Микробиология, 2020, T. 89, № 4, стр. 453-461
Способность бактерий рода Azospirillum к деколоризации синтетических красителей
М. А. Купряшина a, *, Е. Г. Пономарева a, В. Е. Никитина a
a Институт биохимии и физиологии растений и микроорганизмов
Российской академии наук
410049 Саратов, Россия
* E-mail: kupryashina_m@mail.ru
Поступила в редакцию 23.01.2020
После доработки 11.03.2020
Принята к публикации 13.03.2020
Аннотация
Получены приоритетные данные о способности бактерий рода Azospirillum к обесцвечиванию синтетических красителей. В результате скрининга бактерий выявлен штамм A. brasilense SR80 с наиболее высокой эффективностью деколоризации. В отношении ремазола ярко-голубого максимальный процент обесцвечивания составил 50%, малахитового зеленого более 90%. Установлены условия культивирования бактерий, влияющие на эффективность деструкции изучаемых красителей.
Современными темпами индустриализации обусловлены ежегодно растущие объемы производства синтетических красителей, которые находят свое применение в текстильной, косметической, полиграфической, фармацевтической и пищевой промышленности (Liu et al., 2004; Jamee, Siddique, 2019). Вследствие недостаточной эффективности процессов окраски, большой процент красителей попадает в сточные воды предприятий в неизменном виде, что является причиной активного загрязнения окружающей среды данными соединениями (Pearce et al., 2003; Mourid et al., 2017). К сожалению, обычные физико-химические методы обработки промышленных стоков, включающие сорбцию, химическую флокуляцию, фильтрацию или коагуляцию, малоэффективны (Forgacs et al., 2004; Jadhav et al., 2010). В целях минимизации экологических рисков в последние годы активно ведется поиск и разработка новых методов биоредукции синтетических красителей (Rai et al., 2005; Jadhav et al., 2010). Биодеколоризация осуществляется либо путем адсорбции на микробной биомассе, либо ферментативной деструкцией (Forgacs et al., 2004; Agarry et al., 2011; Asgher et al., 2014). До 60% от производимых красителей это азокрасители, в связи с этим наибольший пласт работ, посвящен изучению деколоризации именно этой группы (Guo et al., 2014). Исследований по биодеградации трифенилметановых и антрахиноновых красителей значительно меньше, однако они представляют серьезную опасность для окружающей среды и здоровья человека, так как многие из них обладают канцерогенными, мутагенными и даже тератогенными свойствами (Bhatt et al., 2000; Srivastava et al., 2004; Shedbalkar et al., 2011; Gopinathan et al., 2015).
В последнее десятилетие появились факты и доказательства участия ферментов фенолоксидазного комплекса грибов и бактерий в деградации красителей (Kariminiaae-Hamedaani et al., 2007; Lewańczuk et al., 2015; Munir et al., 2015; Shaheen et al., 2017). Учитывая обнаруженную ранее способность почвенных ассоциативных микроорганизмов рода Azospirillum к продукции фенолокисляющих ферментов (Никитина и соавт., 2010; Купряшина и соавт., 2012; Петров и соавт., 2014), была предпринята данная работа.
Целью настоящей работы явилось исследование способности бактерий рода Azospirillum к деколоризации малахитового зеленого и ремазола ярко-голубого.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Организмы и условия их культивирования. В работе использовали штаммы бактерий рода Azospirillum: A. brasilense Sp245, Sp107, Sp7, SR80, A. lipoferum Sp59b и A. thiophilum Bv-S из коллекции ризосферных микроорганизмов ИБФРМ РАН (http://collection.ibppm.ru). Культивирование бактерий проводили в колбах Эрленмейера (250 мл) на жидкой малатно-солевой среде следующего состава (г/л): KH2PO4 – 0.1; K2HPO4 – 0.4; NaCl – 0.1; Na2MoO4 · 7H2O – 0.002, MgSO4 · 7H2O – 0.2; FeSO4 · 7H2O – 0.02; яблочная кислота – 5.0; NaOH – 1.7; NH4Cl – 1.0; CaCl2 – 0.02; pH 6.8. Среду стерилизовали в течение 30 мин при 121°C. Посевным материалом служила 12-часовая культура, выращенная на среде того же состава. Бактерии для исследования культивировали в термостате при температуре 30°C.
В условиях эксперимента культивирование проводилось при внесении красителей в конечной концентрации 1, 0.1, 0.05 и 0.01 мМ.
Определение эффективности деградации красителей. Способность азоспирилл к деколоризации исследовали в отношении малахитового зеленого (“Вектон”, Россия) и ремазола ярко-голубого (“Sigma-Aldrich”, США). Бактериальную культуру осаждали центрифугированием, а супернатант использовали для анализа.
Степень обесцвечивания анализировали спектрофотометрически на приборе Specord 250 (“Analytik Jena, Германия”) при длине волны 600 и 595 нм для малахитового зеленого и ремазола ярко-голубого соответственно. Степень разрушения красителя выражали в процентах и рассчитывали по формуле:
где Анач – начальное поглощение, Акон – конечное поглощение красителя после культивирования (Nidadavolu et al., 2013; Joshi and Mhatre, 2015).
Статистическая обработка результатов. Все эксперименты проводились минимум в трех повторностях в трех независимых экспериментах. При оценке полученных результатов пользовались методом расчета стандартного отклонения среднего арифметического с использованием программы Microsoft Office Excel 2010; данные имеют соответствующие доверительные интервалы при уровне доверительной вероятности 0.95.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование способности бактерий рода Azospirillum к деколоризации синтетических красителей. В эксперимент были взяты 7 штаммов бактерий рода Azospirillum: A. brasilense Sp245, Sp107, Sp7, SR80, A. lipoferum Sp59b и A. thiophilum Bv-S, с высоким уровнем продукции фенолокисляющих ферментов (Купряшина и соавт., 2015). Культивирование бактерий проводилось в присутствии в среде ремазола ярко-голубого и малахитового зеленого в конечной концентрации 1, 0.1, 0.05 и 0.01 мМ. В водном растворе малахитовый зеленый обесцвечивается при рН 11.6–13.6 из-за присоединения гидроксила с образованием трифенилкарбинола (Теренин, 2013). Для того чтобы исключить влияние pH среды на обесцвечивание красителя на всех этапах исследования проводилось измерение pH опытных растворов, и их диапазон pH составил от 6.8 до 8.
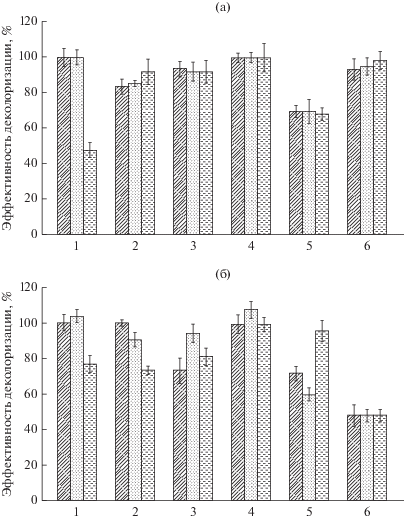
Все взятые в эксперимент штаммы оказались способны в той или иной степени деколоризировать модельные соединения красителей (рис. 1, 2). Однако внесение красителей в среду культивирования в конечной концентрации 1 мМ оказывало ингибирующее действие на рост всех исследуемых штаммов. Малахитовый зеленый уже в концентрации 0.1 мМ снижал рост и развитие бактерий, что обусловлено токсическим действием данного соединения. Известно, что реакционноспособные группы сульфоновой кислоты (SO3H) на ароматических кольцах синтетических красителей значительно ингибируют рост микроорганизмов (Gopinathan et al., 2010). Как видно из рис. 1, штаммы A. brasilense Sp245, Sp107, Sp7, SR80 оказались способны к обесцвечиванию малахитового зеленого в концентрации от 0.01 до 0.1 мМ. При этом отмечалось снижение эффективности деколоризации красителя с увеличением концентрации вносимого вещества, что объясняется либо возрастанием концентрации красящего вещества по отношению к обесцвечивающим агентам, либо блокированием активных центров окислительных ферментов, участвующих в деструкции молекулы красителя (Jadhav et al., 2008; Saratale et al., 2009). Для A. thiophilum Bv-S, A. lipoferum 59b установлено снижение роста при культивировании в присутствии малахитового зеленого даже в концентрации 0.01 мМ, поэтому данные штаммы обесцвечивали краситель не выше 30%. Максимальная степень деградации малахитового зеленого отмечалась для штамма A. brasilense SR80, и составила 80% (рис. 1а).
Рис. 1.
Деколоризация малахитового зеленого (а) и ремазола ярко-голубого (б) ( – 0.1 мМ;
– 0.1 мМ;  – 0.05 мМ;
– 0.05 мМ;  – 0.01 мМ) азоспириллами: 1 – A. thiophilum; 2 – A. brasilense Sp107; 3 – A. brasilense Sp7; 4 – A. brasilense Sp245; 5 – A. lipoferum Sp59b; 6 – A. brasilense SR80.
– 0.01 мМ) азоспириллами: 1 – A. thiophilum; 2 – A. brasilense Sp107; 3 – A. brasilense Sp7; 4 – A. brasilense Sp245; 5 – A. lipoferum Sp59b; 6 – A. brasilense SR80.

Рис. 2.
УФ-видимые спектры образцов, содержащих ремазол ярко-голубой (а) и малахитовый зеленый (б) до и после культивирования в присутствии азоспирилл: 1 – краситель; 2 – A. brasilense Sp245; 3 – A. brasilense SR80.

Наиболее эффективное обесцвечивание ремазола ярко-голубого осуществлялось в концентрациях 0.1 и 0.05 мМ (рис. 2). Для большинства штаммов деколоризация красителя в концентрации 0.05 мМ была максимальна. Наибольшая способность к обесцвечиванию ремазола ярко-голубого отмечалась для штаммов A. brasilense Sp7 и SR80, превышающая 65%. Минимальная потеря цвета красителя в данной концентрации наблюдалась у A. lipoferum 59b, не превышающая 21%. Штаммы A. brasilense Sp107 и Sp245 обесцвечивали ремазол примерно в равной степени, причем независимо от концентрации. По-видимому, присутствие красителя в среде выращивания в концентрации от 0.1 и 0.05 мМ не оказывало угнетающего воздействия на рост бактерий. Возможно, это можно объяснить тем, что данные концентрации являлись менее токсичными для бактерии и не вызывали активации механизмов резистентности.
Образцы, содержащие 0.05 мМ ремазол ярко-голубой и 0.01 мМ малахитовый зеленый, после 48 ч культивирования со штаммами A. brasilense Sp245 и SR80 были проанализированы методом УФ-видимой спектроскопии на приборе Specord 250 (“Analytik Jena”, Германия) в диапазоне длин волн от 200 до 1000 нм. Было детектировано снижение основного максимума поглощения ремазола ярко-голубого (рис. 3), однако полученные данные выявили, что обесцвечивание красителя вероятнее всего не связано с деструкцией молекулы красителя, а скорее опосредовано адсорбцией ремазола микробными клетками. В случае адсорбции пики поглощения ультрафиолетового и видимого излучения уменьшаются примерно пропорционально друг другу. Однако по данным литературы при биодеградации красителя основной пик в видимой области поглощения полностью исчезает, и появляется новый пик в ультрафиолетовой области (Asad et al., 2007). Стоит отметить, УФ-видимая спектроскопия образцов, содержащих 0.01 мМ малахитовый зеленый, до и после культивирования в присутствии азоспирилл показала снижение основного максимума поглощения красителя при 550–650 нм, при этом другие пики в видимом диапазоне не появлялись, но возникали в УФ области при 220–260 нм (рис. 4). Эта абсорбция, скорее всего, объясняется образованием метаболитов деструкции молекулы красителя.
Рис. 3.
Зависимости деколоризации малахитового зеленого (а) и ремазола ярко-голубого (б) от
времени культивирования ( – 24 ч;
– 24 ч;  – 48 ч;
– 48 ч;  – 144 ч;
– 144 ч;  – 192 ч) азоспирилл: 1 – A. thiophilum; 2 – A. brasilense Sp107; 3 – A. brasilense Sp7; 4 – A. brasilense Sp245; 5 – A. lipoferum Sp59b; 6 – A. brasilense SR80.
– 192 ч) азоспирилл: 1 – A. thiophilum; 2 – A. brasilense Sp107; 3 – A. brasilense Sp7; 4 – A. brasilense Sp245; 5 – A. lipoferum Sp59b; 6 – A. brasilense SR80.

Рис. 4.
Влияние источников азота и углерода на эффективность биодеградации малахитового зеленого штаммом A. brasilense SR80 (а) и A. brasilense Sp245 (б): 1 – малат натрия; 2 – глюкоза; 3 – фруктоза; 4 – хлорид аммония; 5 – нитрат калия; 6 – дрожжевой экстракт.
Влияние состава среды и условий культивирования азоспирилл на обесцвечивание малахитового зеленого и ремазола ярко-голубого. Была показана эффективность лигнинолитических ферментов грибов в биодеградации малахитового зеленого и ремазола ярко-голубого (Palmieri et al., 2005; Shedbalkar et al., 2011; Sumandono et al., 2015). Предполагается, что в энзимологии бактериальной деградации синтетических красителей ведущую роль играют ферменты, аналогичные грибным лигнинолитикам (Kalyani et al., 2008, 2012; Du et al., 2011). Известно, что состав среды и условия культивирования оказывают большое влияние на метаболизм микроорганизмов и, соответственно, на активность ферментов (Pollegioni et al., 2015).
Нами оценено влияние на процесс деколоризации красителей таких параметров, как время и температура культивирования. В условиях эксперимента культивирование проводилось в течение 2–10 сут при внесении красителей в конечной концентрации 0.05 мМ (ремазол ярко-голубой) и 0.01 мМ (малахитовый зеленый), в температурном диапазоне от 25 до 45°С с шагом в 5°С. Степень обесцвечивания оценивали как описано ранее.
Для всех взятых в эксперимент штаммов было характерно увеличение уровня деколоризации красителей с течением времени (рис. 3). Обесцвечивание малахитового зеленого начиналось уже через 18 ч культивирования штаммов A. brasilense Sp245, Sp107, Sp7, SR80. На 8 сут выращивания штаммы A. brasilense Sp107 и A. brasilense SR 80 обесцвечивали среду на 90%, в то время как для A. thiophilum Bv-S и A. lipoferum 59b и через 8 сут культивирования обесцвечивание составило всего 30%. При изучении влияния времени культивирования на деколоризацию ремазола было установлено, что максимум обесцвечивания у большинства штаммов наблюдался на 6 сут, среди них самые высокие показатели, более 77%, отмечены у A. brasilense Sp245 и SR80. Минимальную эффективность в обесцвечивании ремазола показал штамм A. lipoferum Sp59b, достигнувший своего максимума в 30% на 4 сут культивирования.
Нами обнаружено статистически значимое влияние температуры культивирования на эффективность биодеколоризации синтетических красителей азоспириллами (диапазон от 20–50°С с шагом в 5°С). Максимальный процент деградации малахитового зеленого от 50 до 80% (для разных штаммов) отмечался при культивировании при 30–35°С. Стоит отметить, что в эксперимент были взяты эндофитные и эпифитные представители рода, т.к. мы предполагали, что их физиологическая активность будет различаться: обычно энзиматические системы эпифитов более толерантны к изменению температур. Однако, как представители эпифитов, так и эндофитов по-разному реагировали на изменение температуры. Обнаружено, что исследуемые штаммы обесцвечивали ремазол ярко-голубой, также как и малахитовый зеленый, наиболее эффективно при температуре 35°С. При повышении температуры культивирования деградация обоих красителей снижалась. Культивирование бактерий при 20°С, также приводило к снижению биодеградации, что связано с угнетением метаболической активности азоспирилл при температурах ниже оптимальных для активного наращивания биомассы. Полученные результаты согласуются с данными, представленными в литературе для других микроорганизмов. Так, рядом исследователей отмечается возрастание скорости обесцвечивания синтетических красителей при приближении температуры культивирования к оптимальной для роста бактерий с последующим понижением активности обесцвечивания при дальнейшем повышении температуры. Предполагается, что подобный эффект может быть связан либо с потерей жизнеспособности клетками микроорганизмов, либо с денатурацией окисляющих краситель ферментов (Chang et al., 2001; Saratale et al., 2009).
Известно, что для ферментов фенолоксидазного комплекса, как бактерий, так и грибов, характерно увеличение активности ферментов при культивировании на бедной по азоту и углероду среде, при этом присутствие в среде культивирования сложных органических соединений, например, дрожжевого экстракта, несмотря на увеличение биомассы, существенно снижает активность фенолоксидаз (Ахмедова, 1996; Ahammed, Prema, 2002). На следующем этапе работы, мы исследовали влияние источников азота и углерода в среде культивирования на эффективность обесцвечивания азоспириллами малахитового зеленого и ремазола ярко-голубого. В качестве объектов были выбраны штаммы A. brasilense SR80, проявляющий наибольший деструктивный потенциал в отношении красителей, и A. brasilense Sp245, как типичный представитель рода. В условиях эксперимента культивирование бактерий проводилось при внесении малахитового зеленого и ремазола ярко-голубого в конечной концентрации 0.01 и 0.05 мМ соответственно. В качестве источников углерода в среду культивирования вносили малат натрия, глюкозу или фруктозу в концентрации 5, 10, 25 г/л, а в качестве источников азота – хлорид аммония, нитрат калия и дрожжевой экстракт в концентрации 1, 2, 5 г/л. Изменение эффективности биодеградации выражали в процентах от контроля (биодеградация при выращивании на стандартной малатно-солевой среде) (рис. 4).
Эффективность биодеградации малахитового зеленого A. brasilense SR80 снижалась при использовании в качестве источника углерода глюкозы примерно на 20% и фруктозы на 10%, при этом концентрация сахаров не оказывала влияния на процесс обесцвечивания. На среде с малатом натрия деградирующий потенциал бактерии был максимальным, но в тоже время увеличение концентрации до 15 г/л приводило к снижению эффективности биодеградации малахитового зеленого в два раза. Для штамма A. brasilense Sp245 отмечалось снижение эффективности деколоризации красителя при внесении в среду культивирования дрожжевого экстракта. Ранее нами было показано, что выращивание A. brasilense Sp245 на среде с дрожжевым экстрактом приводит к снижению активности ферментов фенолоксидазного комплекса (Купряшина и соавт., 2012). Также уменьшение степени обесцвечивания малахитового зеленого вызывало присутствие нитрата калия, что интересно, так как нитрат калия является специфическим ингибитором активности фенолоксидаз, в частности, лакказ Aureobasidium pullulans (Hui, Khachatourians, 1995). Однако качественное и количественное изменение источников азота и углерода в составе среды выращивания не оказывало значимых эффектов на обесцвечивание ремазола ярко-голубого.
Анализ эффективности обесцвечивания синтетических красителей бесклеточными экстрактами. Основываясь на нашем предположении об участии фенолоксидаз в деколоризации синтетических красителей, мы решили проанализировать способность бесклеточных экстрактов A. brasilense Sp245, Sp107, Sp7, SR80, A. lipoferum Sp59b и A. thiophilum Bv-S к обесцвечиванию малахитового зеленого и ремазола ярко-голубого. Бактерии выращивали на малатно-солевой среде в течение 48 ч, далее клетки осаждали центрифугированием, а в супернатант вносили красители в конечной концентрации 1, 0.1, 0.05 мМ. Эффективность деколоризации оценивали спектрофотометрически (как описано ранее).
Эффективность обесцвечивания ремазола ярко-голубого бесклеточными экстрактами всех взятых в эксперимент штаммов была низкой и не превышала порог в 5% даже с увеличением времени инкубации. Однако для малахитового зеленого мы отмечали иную тенденцию. Уже спустя 1 ч инкубации, степень обесцвечивания малахитового зеленого составляла 80% для штаммов A. brasilense Sp245, Sp107, Sp7 и SR80. Увеличив концентрацию красителя до 1 мМ, мы обнаружили, что малахитовый зеленый через 5 ч инкубации обесцвечивается полностью (рис. 5). Отметим, что данная концентрация была токсичной для бактерии, и при выращивании азоспирилл в присутствии 1 мМ малахитового зеленого в среде культивирования степень его деградации составила 0%.
Рис. 5.
Деградация малахитового зеленого через 5 мин (а) и 5 ч (б) инкубации с бесклеточными экстрактами: 1 – A. brasilense Sp7; 2 – A. brasilense Sp 245; 3 – A. brasilense Sp107; 4 – A. brasilense SR80; 5 – A. lipoferum 59b; 6 – A. tiophillum; К – контроль (краситель в среде культивирования).
Таким образом, на примере нескольких штаммов обнаружена способность азоспирилл к обесцвечиванию ремазола ярко-голубого и малахитового зеленого. В ходе проведенного скрининга выявлен штамм A. brasilense SR80 с высокой эффективностью деколоризации исследуемых красителей. Максимальный процент обесцвечивания ремазола ярко-голубого составил около 50%, малахитового зеленого более 90%. Установлено, что присутствие высоких концентраций красителей в среде культивирования вызывает угнетение роста микроорганизмов. Однако способность некоторых штаммов переносить повышенные концентрации красителей делает их использование перспективным в биоремедиации. Изучено влияние условий культивирования бактерий на эффективность обесцвечивания. Установлена деколоризация высоких концентраций малахитового зеленого (1 мМ) с использованием бесклеточных экстрактов азоспирилл. Вероятнее всего, обесцвечивание азоспириллами среды, содержащей ремазол ярко-голубой, идет за счет сорбции красителя бактериальными клетками. Косвенно данный факт, наряду с данными УФ-видимой спектроскопии, подтверждает отсутствие обесцвечивания растворов красителя бесклеточными экстрактами азоспирилл, обладающими Mn-пероксидазной, лакказной и лигнин-пероксидазной активностями (Купряшина и соавт., 2015). Полученные результаты являются значимыми как в фундаментальном, так и прикладном аспектах и могут быть использованы при разработке новых технологий для минимизации экологических рисков от загрязнений синтетическими красителями.
Список литературы
Ахмедова З.Р. Лигнинолитические ферменты базидиальных грибов. Лигнин-пероксидазы гриба Pleurotus ostreatus УзБИ–ZAX 108. I. Оптимизация ферментообразования и получение препаратов лигниназ // Биохимия. 1996. Т. 61. С. 1375–1384.
Купряшина М.А., Петров С.В., Пономарева Е.Г., Никитина В.Е. Лигнинолитическая активность бактерий родов Azospirillum and Niveispirillum // Микробиология. 2015. Т. 84. С. 691–696.
Kupryashina M.A., Petrov S.V., Ponomareva E.G., Nikitina V.E. Ligninolytic activity of bacteria of the genera Azospirillum and Niveispirillum // Microbiology (Moscow). 2015. V. 84. P. 791–795.
Купряшина М.А., Селиванов Н.Ю., Никитина В.Е. Выделение и очистка Mn-пероксидазы Azospirillum brasilense Sp245 // Прикл. биохимия и микробиология. 2012. Т. 48. С. 23–26.
Kupryashina M.A., Selivanov N.Yu., Nikitina V.E. Isolation and purification of Mn-peroxidase from Azospirillum brasilense Sp245 // Appl. Biochem. Microbiol. 2012. V. 48. P. 17–20.
Никитина В.Е., Ветчинкина Е.П., Пономарева Е.Г., Гоголева Ю.В. Фенолоксидазная активность бактерий рода Azospirillum // Микробиология. 2010. Т. 79. С. 344–351.
Nikitina V.E., Vetchinkina E.P., Ponomareva E.G., Gogoleva Yu.V. Phenol oxidase activity in bacteria of the genus Azospirillum // Microbiology (Moscow). 2010. V. 79. P. 327–333.
Петров С.В., Купряшина М.А., Глинская Е.В., Никитина В.Е. Лигнин-пероксидаза фенолоксидазного комплекса ассоциативных бактерий Azospirillum brasilense // Вестн. Оренбургского гос. ун-та. 2014. № 13(174). С. 88–91.
Теренин А.Н. Фотохимия красителей и родственных органических соединений. М.: Рипол Классик, 2013. 364 с.
Agarry S.E., Ayobami O. Evaluation of microbial systems for biotreatment of textile waste effluents in Nigeria: biodecolourization and biodegradation of textile dye // J. Appl. Sci. Environ. Manag. 2011. V. 15. P. 79–86.
Ahammed S., Prema P. Influence of media nutrients on synthesis of lignin peroxidase from Aspergillus sp. // Appl. Biochem. Biotechnol. 2002. V. 102–103. P. 327–336.
Asad S., Amoozegar M.A., Pourbabaee A.A., Sarbolouki M.N., Dastgheib S.M. Decolorization of textile azo dyes by newly isolated halophilic and halotolerant bacteria // Bioresour. Technol. 2007. V. 98. 2082–2088.
Asgher M., Yasmeen Q., Iqbal H.M.N. Development of novel enzymatic bioremediation process for textile industry effluents through response surface methodology // Ecol. Eng. 2014. V. 63. P. 1–11.
Bhatt M., Patel M., Rawal B., Novotny C., Molitoris H., Sasek V. Biological decolorization of the synthetic dye RB-BR in contaminated soil // World J. Microbiol. Biotechnol. 2000. V. 16. P. 195–198.
Chang J.S., Chou Y.P., Chen S.Y. Decolorization of azo dyes with immobilized Pseudomonas luteola // Process Biochem. 2001. V. 36. P. 757–763.
Du L., Wang S., Li G., Wang B., Jia X.M., Zhao Y.H., Chen Y.L. Biodegradation of malachite green by Pseudomonas sp. strain DY1 under aerobic condition: characteristics, degradation products, enzyme analysis and phytotoxicity // Chen. Ecotoxicol. 2011. V. 20. P. 438–446.
Forgacs E., Cserhati T., Oros G. Removal of synthetic dyes from wastewaters: a review // Environ. Int. 2004. V. 30. P. 953–971.
Gopinathan R., Kanhere J., Banerjee J. Effect of malachite green toxicity on non target soil organisms // Chemosphere. 2015. V. 120. P. 637–644.
Guo M., Jia R, Yang X. Decolorization of the azo dye acid red 18 by crude manganese peroxidase: Effect of system parameters and kinetic study // Biocatal. Biotransform. 2014. V. 32. P. 276–284.
Hui Y.H., Khachatourians G.G. Food Biotechnology: Microorganisms. N.Y.: Wiley-VCH, 1995. 596 p.
Jadhav J.P., Kalyani D.C., Telke A.A., Phugare S.S., Govindwar S.P. Evaluation of the efficacy of a bacterial consortium for the removal of color, reduction of heavy metals, and toxicity from textile dye effluent // Bioresour. Technol. 2010. V. 101. P. 165–173.
Jamee R., Siddique R. Biodegradation of synthetic dyes of textile effluent by microorganisms: an environmentally and economically sustainable approach // Eur. J Microbiol. Immunol. 2019. V. 9. P. 114–118.
Joshi P.A., Mhatre K.J. Microbial efficiency to degrade carbol fuchsin and malachite green dyes // Adv. Appl. Sci. Res. 2015. V. 6. P. 85–88.
Kalyani D.C., Telke A.A., Dhanve R.S., Jadhav J.P. Ecofriendly biodegradation and detoxification of reactive red 2 textile dye by newly isolated Pseudomonas sp. SUK1 // J. Hazard. Mater. 2008. V. 163. P. 735–742.
Kalyani D.C., Telke A.A., Surwase S.N., Jadhav S.B., Lee J.-K., Jadhav J.P. Effectual decolorization and detoxification of triphenylmethane dye malachite green (MG) by Pseudomonas aeruginosa NCIM 2074 and its enzyme system // Clean. Techn. Environ. Policy. 2012. V. 14. P. 989–1001.
Kariminiaae-Hamedaani H., Sakurai A., Sakakibara M. Decolorization of synthetic dyes by a new manganese peroxidase-producing white rot fungus // Dyes and Pigments. 2007. V. 72. P. 157–162.
Lewańczuk M., Bryjak J. Continuous decolorization of acid blue 62 solution in an enzyme membrane reactor // Appl. Biochem. Biotechnol. 2015 V. 177. P. 237–252.
Liu W., Chao Y., Yang X., Bao H., Qian S. Biodecolorization of azo, anthraquinonic and triphenylmethane dyes by white-rot fungi and a laccase-secreting engineered strain // Ind. Microbiol. Biotechnol. 2004. V. 31. P. 127–132.
Mourid E., Lakraimi1 M., Khattabi E. El., Benaziz L., Berraho M. Removal of remazol brilliant blue R from aqueous solution by adsorption using a calcined layered double hydroxide [Zn2-Al-CO3] // J. Mater. Environ. Sci. 2017. V. 8. P. 921–930.
Munir N., Asgher M., Tahir I.M., Riaz M., Bilal M., Shah S.M.A. Utilization of agro-wastes for production of ligninolytic enzymes in liquid state fermentation by Phanerochaete chrysosporium IBL-03 // Int. J. Chem. Biochem. Sci. 2015. V. 7. P. 9–14.
Nidadavolu S.B., Gudikandula K., Pabba S.K., Maringanti Ch.S. Decolorization of triphenyl methane dyes by Fomitopsis feei // Natural Science. 2013. V. 5. P. 30–35.
Palmieri G., Cennamo G., Sannia G. Remazol Brilliant Blue R decolourisation by the fungus Pleurotus ostreatus and its oxidative enzymatic system // Enz. Microbial. Technol. 2005. V. 36. P. 17–24.
Pearce C.I., Lloyd J.R., Guthrie J.T. The removal of color from textile wastewater using whole bacterial cells: a review // Dyes Pigments. 2003. V. 58. P. 179–196.
Pollegioni L., Tonin F., Rosini E. Lignin-degrading enzymes // FEBS J. 2015. V. 282. P. 1190–1213.
Rai H.S., Bhattacharya M.S., Singh J., Bansal T.K., Vats P., Banerjee U.C. Removal of dyes from the effluent of textile and dyestuff manufacturing industry: a review of emergin techniques with reference to biological treatment // Crit. Rev. Environ. Sci. Technol. 2005. V. 35. P. 219–238.
Saratale R.G., Saratale G.D., Chang J.S., Govindwar S.P. Ecofriendly decolorization and degradation of reactive green 19A using Micrococcus glutamicus NCIM-2168 // Bioresour. Technol. 2009. V. 110. P. 3897–3901.
Shaheen A., Asgher M., Hussain F., Bhatti N. Immobilized lignin peroxidase from Ganoderma lucidum IBL-05 with improved dye decolorization and cytotoxicity reduction properties // Int. J. Biol. Macromol. 2017. V. 103. P. 57–64.
Shedbalkar U., Jadhav J. Detoxification of malachite green and textile industrial effluent by Penicillium ochrochloron // Biotechnol. Bioproc. Engin. 2011. V. 16. P. 196–204.
Srivastava S., Sinha R., Roya D. Toxicological effects of malachite green // Aquat. Toxicol. 2004. V. 66. P. 319–329.
Sumandono T., Saragiha H., Watanabeb T., Amirta R. Decolorization of remazol brilliant blue R by new isolated white rot fungus collected from tropical rain forest in East Kalimantan and its ligninolytic enzymes activity // Proc. Environ. Sci. 2015. V. 28. P. 45–51.
Дополнительные материалы отсутствуют.


