Микробиология, 2020, T. 89, № 4, стр. 474-487
Динамика биологических процессов при компостировании анаэробно обработанного осадка сточных вод
В. В. Миронов a, *, Е. А. Бочкова a, А. В. Ганнесен a, А. В. Вантеева a, Ю. И. Русскова a, А. Н. Ножевникова a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: 7390530@gmail.com
Поступила в редакцию 18.03.2020
После доработки 26.03.2020
Принята к публикации 30.03.2020
Аннотация
Проведено исследование микробиологических процессов при контролируемом термофильном компостировании обезвоженных анаэробно обработанных в метантенке осадков сточных вод (АнО-СВ) Люберецких очистных сооружений Москвы. Прослежена динамика изменения химических форм азота под воздействием микроорганизмов цикла азота (аммонификаторов, нитрификаторов, денитрификаторов, азотфиксаторов) при смене температурных режимов на последовательных стадиях компостирования, которое длилось 98 сут. В активный период компостирования на 6–10-е сут наблюдали значительную эмиссию аммиака (553–861 мг м–3) и оксида азота (67–86 мг м–3), многократно превышавшую нормативные показатели для выбросов в атмосферу. Микробиологическими методами было определено общее микробное число аэробных гетеротрофных микроорганизмов в компостируемой массе, а также количество КОЕ азотфиксаторов, присутствие и активность культивируемых нитрификаторов и денитрификаторов. На основе данных ПЦР в реальном времени и NGS профилирования по 16S рРНК изучено таксономическое разнообразие микроорганизмов, участвующих в компостировании (бактерий, грибов, архей), и выявлены закономерности сукцессии сообщества микроорганизмов в ходе процесса. Лабораторные эксперименты показали имеющийся потенциал к дальнейшему разложению органических веществ сброженного осадка, возможно, недоступных микроорганизмам в анаэробных условиях, но поддающихся деградации аэробной микробиотой с получением продукта, стимулирующего рост растений и содержащего азот в формах общего 2.3%, аммонийного 890 мг кг–1 и нитратного 3750 мг кг–1.
В настоящее время большое значение имеют исследования и применение методов биодеградации твердых органических отходов, включая органическую фракцию твердых коммунальных отходов (ТКО), направленные на интенсификацию процесса разложения и повышение его безопасности для окружающей среды, а также на получение удобрений. Захоронение ТКО, включая осадки сточных вод (ОСВ) экологически небезопасно. На крупных современных станциях очистки сточных вод Москвы и некоторых других городов проводится стабилизация ОСВ путем их анаэробной обработки в метантенках при температуре 52–53°С. При этом уничтожаются патогены, и из легко разлагаемых органических веществ (ОВ) образуется биогаз, состоящий, в основном, из метана и углекислоты. Сброженная биомасса осадков после обезвоживания на центрифугах (декантерах) является анаэробно сброженным ОСВ (АнОСВ), и эти отходы размещаются на полигонах ТКО или используются при рекультивации отработанных карьеров, а также, частично, в качестве субстрата для приготовления биопочв для озеленения городов и в лесопосадках. Ежегодно в Москве на очистных сооружениях образуются миллионы тонн осадков (Пахненко, 2015). Следует отметить, что в России только в нескольких городах на станциях очистки сточных вод имеются метантенки. В основном сырые осадки сточных вод вывозятся на полигоны ТКО. Из-за неполноты биоразложения органических веществ в анаэробных условиях АнОСВ, даже сброженные в метантенках, характеризуются высоким остаточным содержанием вредных и дурно пахнущих органических веществ, что требует дальнейшей обработки АнОСВ (Meissl, Smidt, 2007). Наиболее эффективным методом получения биопочвы из АнОСВ является промышленное компостирование в камерных установках в смеси с углеродосодержащими отходами, такими как древесная щепа после санитарной обрезки деревьев и кустарников, а также листовой опад, отходы производства бумаги и картона. Компостирование является экзотермическим процессом микробного окисления, в котором органический субстрат подвергается биодеградации сложной популяцией микроорганизмов в условиях оптимальной влажности и наличия кислорода. В компостировании участвует множество микроорганизмов: идентифицировано более 2000 известных видов бактерий, не менее 100 видов грибов, а также археи, при этом большинство микроорганизмов в микробном сообществе компоста представлено некультивируемыми видами (De Gannes et al., 2013; Sánchez et al., 2017; Ножевникова и соавт., 2019). На разных температурных стадиях процесса компостирования (мезофильная, термофильная, остывание и созревание) активны представители различных микробных групп (Pepe et al., 2013). Большинство исследований направлено на выявление активных аэробных микроорганизмов при компостировании в целях оптимизации и управления процессом биодеградации органических веществ.
При компостировании происходит трансформация азота посредством следующих микробных процессов цикла азота, а именно: аммонификации, ассимиляции (или иммобилизации), нитрификации и денитрификации (Meng et al., 2016). Потери азота при компостировании происходят при образовании летучего аммиака и оксидов азота (Caceres et al., 2018). В то же время, аммиак может быть преобразован в азотсодержащие иммобилизованные в компосте соединения (Sasaki et al., 2004; Vazquez et al., 2018). Ассимиляция аммиака бактериями является одним из ключевых процессов трансформации азота. Однако этот процесс применительно к компостированию АнОСВ недостаточно исследован.
Снижение содержания NH3 в атмосфере компоста до нетоксичных для микроорганизмов уровней может способствовать нитрификации (Mena et al., 2003; Wang et al., 2015). Ключевую роль в ней играют нитрифицирующие бактерии и археи, активность которых обнаружена при компостировании в условиях интенсивной аэрации (Kowalchuk et al., 1999; Oishi et al., 2012; Zeng et al., 2013). Исследованиями Banegas и соавт. (2007) показана сравнительная зависимость скорости минерализации ОВ различных осадков сточных вод от объема в смеси древесных опилок, но дальнейших микробиологических исследований работа не получила.
Таким образом, целью данной работы явилось комплексное исследование динамики изменения при термофильном компостировании биологических, физико-химических и агрономических свойств смеси анаэробно обработанного осадка сточных вод и древесной щепы, а также изучение активности, состава и изменения во времени микробного сообщества, участвующего в процессе компостирования.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Субстратом для компостирования служили обезвоженные и предварительно анаэробно обработанные в термофильном метантенке АнОСВ на Люберецких очистных сооружениях Москвы. Перед компостированием АнОСВ смешивали с древесной щепой (5–10 мм) лиственных пород в соотношении 2 : 1.35 по массе для достижения оптимального для компостирования значения C/N 25 (Castaldi et al., 2009). Влажность поддерживали на уровне 55–60%.
Процесс компостирования проводили в течение 98 сут, в том числе первые 28 сут активной фазы процесса (Castaldi et al., 2009), в лабораторных условиях с использованием двухкамерного биореактора аэробной твердофазной биодеградации органических отходов (рис. 1) рабочим объемом 50 дм3. Компостную смесь аэрировали с интенсивностью 0.04 л воздуха мин–1 кг–1 сухого беззольного вещества за счет создаваемого компрессором разряжения и притока атмосферного воздуха через ограждения внутрь камеры, что моделировало естественную аэрацию компостных буртов (Ivankin et al., 2014). Измерение газового состава атмосферы субстрата производили при помощи газоанализатора ОКА-92МТ (“Информаналитика”, Россия). Ежесуточно анализировали состав отходящих газов на газовом хроматографе Кристалл 5000.2 (“Хроматэк”, Россия) по показателям содержания СО2 и О2. Пробы для хроматографии отбирали вручную.
Рис. 1.
Принципиальная схема лабораторного биореактора аэробной твердофазной биодеградации органических отходов: 1 – камера компостирования; 2 – компостная смесь; 3, 4 – сенсоры температуры; 5 – измеритель-регулятор температуры; 6 – газоанализатор; 7 – компрессор; 8 – сенсоры газов; 9 – нагревательный элемент.
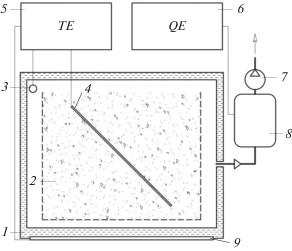
Температура воздуха в камере поддерживалась автоматически на уровне текущего значения ±0.2°С температуры компостируемого материала при помощи нагревательного элемента и измерителя-регулятора ИВТМ-7/2С (“Эксис”, Россия).
Мониторинг температурного и газового режимов, а также отбор проб для микробиологических исследований производили каждые 7-е сут в течение активной фазы процесса (всего 5 проб). Пробы для исследования физико-химических и агрономических свойств отбирали, начиная с первого дня эксперимента, и далее на 7, 14, 21, 28, 56 и 98 сут. Для всех образцов проб по общепринятым и модифицированным методикам были измерены следующие параметры: pH; влажность термогравиметрическим методом на анализаторе влажности ЭВЛАС-2М (“Сибагроприбор”, Россия); содержание общего органического углерода (С, %) термогравиметрическим методом с использованием муфельной печи ПМ-16М-1200 (“МТ-Эталон”, Россия) (Navarro et al., 1993); общего азота (белкового и аммонийного) по Кьельдалю (N, %) в сухом веществе с использованием автоматического титратора Easy Plus (“Mettler Toledo”, Швейцария); водорастворимых аммонийного (N-NH4) и нитратного (N-NO3) азота (Banegas et al., 2007; Castaldi et al., 2009); индекс прорастания (ИП, %) (Cesaro et al., 2015); рассчитано отношение С/N. Для определения водорастворимых веществ, рН и индекса прорастания использовали 10 г образца, ресуспендированного в 300 мл дистиллированной воды (Zorpas, Loizidou, 2008). Измерения рН проводили на лабораторном анализаторе АНИОН 4150 (“Ифраспак-Аналит”, Россия). Концентрацию N-NH4 и N-NO3 азота определяли с использованием спектрофотометра Hach Lange DR 5000 (Германия): аммоний с реактивом Несслера, нитратный азот – методом, основанном на восстановлении кадмия, согласно инструкции по работе спектрофотометра Hach Lange DR 5000. Влияние компоста на рост растений оценивали по прорастанию семян и длине корней редьки посевной (Raphanus sativus) на основании подсчета индекса прорастания (ИП, %) (Cesaro et al., 2015).
Выявление основных микробных групп, вовлеченных в цикл азота и принимающих участие в процессах компостирования на разных температурных стадиях, проводили путем посева образца компостируемой массы на питательные среды. Образцы биомассы массой 1 г ресуспендировали в 10 мл стерильной водопроводной воды со стеклянными бусинами, встряхивали на Bio Vortex V1 (“Biosan”, Латвия) в течение 30 с, разводили в 10 раз и производили посев на стерильные элективные питательные среды с дальнейшей инкубацией в течение 5 сут при температурах 30 и 55°С. Азотфиксаторы выращивали на среде Эшби следующего состава (г/л дистиллированной воды): сахароза – 20; К2НРО4 – 0.2; MgSO4 ∙ 7Н2О – 0.2; NaCl – 0.2; K2SO4 – 0.1; СаСО3 – 5.0. На 1 л среды дополнительно вносили 1 мл раствора микроэлементов по Фeдорову следующего состава (г/л дистиллированной воды): H3BO3 – 5.0; NH4Cl – 5.0; Na2MoO4 ∙ 2H2O – 5.0; ZnSO4 ∙ 7H2O – 0.2; KI – 0.5; NaBr – 0.5; Al2(SO4)3 ∙ 18H2O – 0.3. Нитрификаторы выращивали на средах Виноградского для I и II стадий нитрификации соответственно. Состав среды для I стадии (г/л водопроводной воды): (NH4)2SO4 – 2.0; K2HPO4 – 1.0; MgSO4 ∙ 7H2O – 0.5; NaCl – 2.0; FeSO4 ∙ 7H2O – 0.05; CaCO3 – 5.0. Состав среды для II фазы (г/л водопроводной воды): NaNO2 – 1.0, K2HPO4 – 0.5; MgSO4 ∙ 7H2O – 0.5; NaCl – 0.5; FeSO4 ∙ 7H2O – 0.4; Na2CO3 – 1.0. К обеим средам добавляли в расчете 1 мл на 1 л среды раствор микроэлементов по Пфеннигу следующего состава (мг/л дистиллированной воды): ЭДТА – 500; FeSO4 ∙ 7H2O – 200; ZnSO4 ∙ 7H2O – 10; MnCl2 ∙ 4H2O – 3; H3BO3 – 30; CoCl2 ∙ 2H2O – 20; CuCl2 ∙ 2H2O – 1; NiCl2 ∙ 6H2O – 2; Na2MoO4 ∙ ∙ 2H2O – 3; pH 6). Денитрификаторы выращивали на среде Гильтая следующего состава (г/л дистиллированной воды): цитрат натрия трехзамещенный – 5.0; KNO3 – 2.0; аспарагин – 1.0; KH2PO4 – 2.0; MgSO4 ∙ ∙ 7H2O – 2.0; CaCl2 ∙ 6H2O – 0.2; FeCl3 ∙ 6H2O – 0.001; pH 7.0. Рост гетеротрофных микроорганизмов и азотфиксаторов оценивали путем подсчета колоний на агаризованной среде, описывали морфологическое разнообразие колоний и проводили микроскопирование при помощи светового микроскопа Zeiss Lab.A1 (“Carl Zeiss”, Германия), с цифровой камерой AxioCamHR. Для нитрификаторов, культивируемых в жидкой среде, оценку роста и активности проводили спектрофотометрически по изменению концентрации субстратов и образованию продуктов согласно методикам, описанным выше. Активность денитрификаторов, также культивированных в жидкой среде, определяли по образованию газообразных продуктов (N2, N2O) на газовом хроматографе Кристалл 5000.2 (“Хроматек”, Россия). В качестве сорбента для определения N2 использовали цеолит NaX 60/80 меш, а для определения N2O – Porapak Q 80/100 меш. Длина стальной колонки составляла 3 м, внутренний диаметр – 2 мм, температура колонки – 60°С, температура испарителя – 200°С, ДТП – 200°С, расход газа-носителя (аргона) – 25 мл мин–1.
Подсчет общего микробного числа (ОМЧ) гетеротрофных аэробных микроорганизмов (ГАМ) производили методом высева десятикратных разведений (до 1012 раз) суспензии компостируемой массы по 50 мкл каждого разведения в трех повторностях на богатую агаризованную питательную среду – обогащенную клостридиальную среду следующего состава (г/л): дрожжевой экстракт – 13; пептон – 10; NaCl – 5; ацетат натрия – 3; глюкоза – 5; крахмал – 1; гидрохлорид цистеина – 0.5; вода дистиллированная; pH 7.0. Чашки со средой инкубировали при 30°С (мезофильные условия) или 55°С (термофильные условия) в течение 5 сут, после чего производили визуальный подсчет колоний на поверхности среды и соответствующий пересчет на 1 г компостируемой массы.
Флуоресцентная гибридизация in situ. Фиксацию и подготовку образцов для флуоресцентной гибридизации in situ (FISH) проводили согласно методике, описанной ранее (Ножевникова и соавт., 2012). Для гибридизации использовали меченый флуоресцентным красителем Су3 олигонуклеотидный зонд Nsm156 (5'- TAT TAG CAC ATC TTT CGA T-3'), специфичный по отношению к видам рода Nitrosomonas (Mobarry et al., 1996). Процедура гибридизации проводилась при температуре 46°С по стандартной схеме (Amann et al., 1990). Содержание формамида в гибридизационном буфере составляло 5%. Синтез зонда осуществлялся компанией “Синтол” (Россия). Визуализацию образцов проводили с использованием микроскопа Zeiss Lab.A1 (“Carl Zeiss”, Германия) cо светофильтром Zeiss 20 для Cy3-меченых зондов-.
Подсчет микроорганизмов с помощью ПЦР в реальном времени (qPCR). Для выделения ДНК из компоста использовали набор DNeasy PowerSoil Kit (“Qiagen”, Германия). ПЦР в режиме реального времени проводили в ПЦР буфере-Б (“Синтол”, Россия) в присутствии интеркалирующего красителя SYBR Green I и пассивного референсного красителя ROX (“Синтол”, Россия) с использованием Системы ПЦР обнаружения реального времени CFX96 TouchTM (“Bio-Rad”, США). Для количественного определения содержания архей, бактерий и грибов в исследуемых образцах использовали следующие праймерные системы для гена 16S рРНК или внутреннего транскрибируемого спейсера (internal transcribed spacer, ITS) в случае грибов: Arch 967F/Arch-1060R для архей (Bengtson et al., 2012), Eub338F/Eub518R для бактерий (Fierer et al., 2005), FR1/FF390 для грибов (Prevost-Boure et al., 2011). Детекцию для каждого образца осуществляли в двукратной повторности. Для подсчета количества филотипов в анализируемых образцах сравнивали сигнал, полученный в образце, со стандартной кривой. Для построения стандартных кривых применяли серию последовательных разведений стандартного образца, в качестве которого использовали предварительно очищенный с помощью набора WizardSV Gel and PCR Clean-Up System (“Promega”, США) и клонированный в pGEM-T вектор (“Promega”, США) целевой ПЦР-фрагмент. Количество целевых филотипов в анализируемых образцах рассчитывали на 1 мкг компоста.
Профиль сообщества микроорганизмов компоста по 16S рРНК. Для выделения тотальной ДНК использовали PowerSoil DNA Isolation Kit (“MoBio”, США). Процедуру проводили по протоколу, рекомендованному производителем. ДНК хранили при –20°С. Очищенный образец ДНК использовали в качестве матрицы для полимеразной цепной реакции (ПЦР) с парой универсальных праймеров для V3–V4 участков гена 16S рРНК: 319F (5'-ACTCCTACGGGAGGCAGCAG-3') и 806R (5'-GGACTACHVGGGTWTCTAAT-3'). Праймеры были дополнены идентифицирующими олигонуклеотидными последовательностями для секвенирования MiSeq (“Illumina”, США). Подготовка проб и собственно секвенирование производили согласно рекомендациям производителя. Для контроля качества прочтений использовали UPARSE (Edgar, 2013). Далее прочтения были сгруппированы по операционным таксономическим единицам (OTUs) по уровню сходства 97% с помощью USEARCH (Edgar, 2010). Таксономическое положение репрезентативной последовательности для каждого OTU было определено с использованием “RDP classifier” (Wang et al., 2007).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические параметры компостируемой массы АнОСВ
Динамика изменения температуры авторазогрева в первые 28 сут компостирования (активная фаза), повторяла классическую зависимость (Ножевникова и соавт., 2019), а именно, наблюдали три стадии процесса – мезофильную, термофильную и стадию остывания (рис. 2). Далее, в течение 60 сут, субстрат окончательно стабилизировался без авторазогрева при температуре окружающей среды (стадия созревания).
Рис. 2.
Температурный и газовый профили при компостировании АнОСВ (активная фаза): 1 – динамика изменения температуры субстрата; 2 – концентрация кислорода в атмосфере субстрата; 3 – концентрация диоксида углерода.
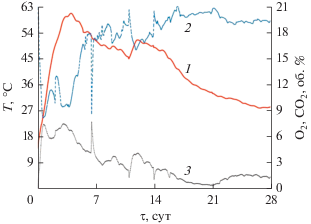
В начале первых суток компостирование проходило в мезофильном режиме, за 48 ч компостирования температура возрастала с 14.1 до 42.4°С. В этот период проходил активный гидролиз легкоразлагаемых субстратов мезофильными микроорганизмами (в том числе микроорганизмами из осадков сточных вод), что вызывало значительное поглощение кислорода в камере компостирования (концентрация снизилась с 21.0 до 11.4 об. % О2, рис. 2) с выделением диоксида углерода (5.8 об. % СО2, рис. 2) и воды. Активное разложение органических веществ вызвало повышение температуры компостируемой массы и создало условия для развития термофильных микроорганизмов.
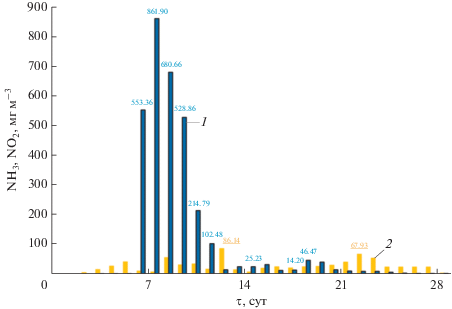
Термофильный режим в компостируемом материале устанавливался на 3-и сут, температура повышалась до максимальной 60.6°С на 4-е сут компостирования, содержание О2 снижалось до 10.2 об. %, а СО2 увеличивалось до 6.8 об. % (рис. 2). Схожий термофильный режим при компостировании АнОСВ с опилками в открытых буртах описан в работе Banegas и соавт. (2007). Высокая температура была обусловлена значительным снижением (на 2.7%) содержанием углерода в субстрате в этот период за счет активной аэробной деградации: с 37.3 до 34.6 ± 0.4% в сухом веществе (с.в.) (рис. 3). Вследствие процессов самоуплотнения субстрата, пористость его нижних слоев уменьшалась, что приводило к формированию анаэробных микрозон и, вероятно, обусловило прохождение одновременно нитрификации и денитрификации (Chowdhury et al., 2014). Нитраты, образовавшиеся на поверхности частиц компостируемого субстрата, посредством массопереноса перемещались внутрь частиц, где в анаэробных условиях восстанавливались до оксидов и молекулярного азота. Возможно, по этой причине содержание нитратного азота к 14-м сут значительно не изменилось, а атмосфера компоста содержала до 86.14 мг м–3 оксидов азота (по NO2, рис. 4). Низкие концентрации нитратного азота на начальной стадии компостирования были отмечены и другими авторами (Banegas et al., 2007; Castaldi et al., 2009).
Мезофильные денитрификаторы, обнаруженные на всех стадиях процесса, в периоды с 7 по 14 сут и с 21 по 28 сут росли наиболее активно, что обусловило денитрификацию и появление оксидов азота в атмосфере компоста на 21–23 сут в количестве 50–70 мг NO2 м–3 (рис. 4). Наши наблюдения согласуются с результатами исследований, в которых показано, что вследствие сопротивления массопереноса концентрация растворенного кислорода начинает уменьшаться на глубине 0.3–0.4 мм от поверхности частицы субстрата, таким образом, до 75% объема каждой частицы находится в анаэробных условиях, что замедляет процессы аэробной биодеградации (Wang et al., 2015).
В то же время, исчерпание доступных субстратов, видимо, начинало лимитировать активность термофильных микроорганизмов, что вызывало снижение скорости разложения органических веществ, о чем свидетельствует повышение концентрации О2 до 19.4 об. % и уменьшение концентрации СО2 до 1.9 об. % и, как следствие, охлаждение субстрата до 44.9°С на 11-е сут.
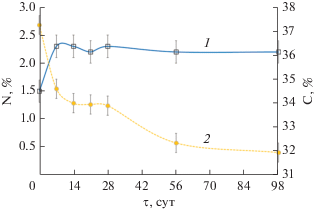
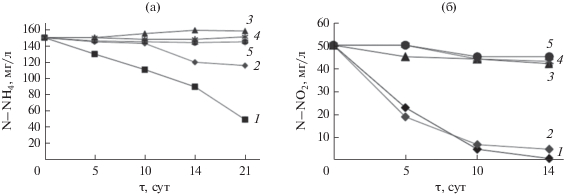
С 6-х по 11-е сут наблюдали интенсивное образование аммиака, вызванное, вероятно, активной аммонификацией белков погибшей биомассы микроорганизмов сброженного осадка. Интенсифицировала выход NH3 также высокая скорость потребления биологически доступного углерода и его низкое исходное содержание в древесной щепе в начальный период компостирования. Это привело к нехватке углерода в субстрате для ассимиляции его микробиотой и, как следствие, к минерализации азота в форме NH3 в условиях высокой температуры авторазогрева (рис. 2 и 4). Аммонификация, потеря влаги, повышение температуры и рН являются причинами выбросов NH3 (Rihani et al., 2010). В то же время, наблюдали увеличение процентного содержания общего азота в этот период с 1.5 ± 0.2% с. в. до 2.3 ± 0.2% с.в. на 7-е сут (рис. 3), т.е. на 53%, что было связано с потерей массы органического вещества в результате деградации. В сравнении с азотом, минерализация углерода идет значительно интенсивней, поэтому концентрация азота в относительных единицах возрастает при уменьшении его абсолютного значения за счет потерь (Banegas et al., 2007; Rihani et al., 2010).
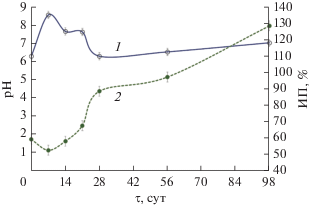
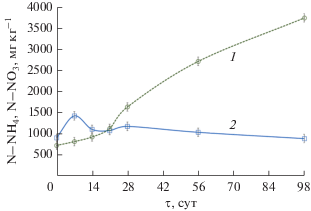
Уровень рН в период с 6-х по 11-е сут увеличивался до 8.54 (рис. 5), вероятно, вследствие увеличения содержания аммонийного азота в субстрате c 910 до 1430 мг N-NH4 кг–1 (рис. 6). Концентрация аммиака в атмосфере субстрата на 7-е сут достигала наибольшего значения 861.9 мг NH3 м–3 и далее на 10 сут компостирования снизилась до 102.48 мг NH3 м–3 (рис. 4). Значительная эмиссия аммиака в течение активной фазы компостирования АнОСВ согласуется с результатами других исследователей (Rincón et al., 2019). Дальнейшее его снижение до нетоксичной для микроорганизмов концентрации способствовало началу нитрификации (Mena et al., 2003; Wang et al., 2015). Так, содержание нитратного азота на 21-е сут увеличилось с первоначальных 730 до 1130 мг N-NO3 кг–1. В то же время, содержание общего азота осталось на прежнем уровне N 2.3% с.в., видимо, за счет приращения белкового азота биомассы термофильных микроорганизмов.
После замедления биодеградации и снижения температуры до 44.9°С на 11-е сут следовало повторное ускорение реакций разложения ОВ, приведшее к снижению уровня О2 до 17.2 об. %, выделению диоксида углерода СО2 (3.5 об. %) и повторному росту температуры до 50.4°С на 13-е сут. Далее температура плавно снижалась (фаза остывания) до 42.9°С при снижении потребления О2 и выделения СО2 на 17-е сут (рис. 2), что привело к началу восстановления популяции мезофильных микроорганизмов.
В период остывания субстрата концентрация аммиака сохранялась на уровне 15–25 мг NH3 м–3. Процессы нитрификации и ассимиляции азота конкурировали за аммиак, и оба процесса снижали его эмиссию.
На 28-е сут компостирования температура понизилась до 28.4°С при содержании О2 и СО2, соответственно, 19.4 и 1.4 об. %. Снижение температуры компостируемой массы до разницы +10°С к температуре окружающей среды свидетельствовало о завершении активной фазы компостирования и начале стадии созревания, которая обычно длится до 6 месяцев, в зависимости от принятой технологии, с получением полностью стабильного продукта – компоста (Meissl, Smidt, 2007).
После стадии активного разложения компостирование субстрата продолжалось до наступления 98 сут с момента начала процесса. Компостирование проводили в мезофильных условиях при температуре, равной температуре окружающей среды 22–25°С. Изменение концентрации кислорода и эмиссия исследуемых газов в этот период были видимо ниже уровня детекции приборов.
Содержание общего органического углерода за 98 сут компостирования уменьшалось с 37.25 ± 0.4 до 31.95 ± 0.4% с. в., что согласуется с ранее полученными данными (Banegas et al., 2007), а соотношение C/N снижалось до 15, что является показателем готовности компоста и соответствует предыдущим данным (Castaldi et al., 2009).
В результате улетучивания аммиака и его окисления до нитратов уровень рН снижался до 6–7 на 21–28 сут (рис. 5). Ранее было показано, что снижение уровня рН способствовало росту грибов и расщеплению лигнина и целлюлозы (Hachicha et al., 2009). Содержание аммонийного азота снизилось до 890 мг кг–1, а нитратного, наоборот, возрастало до 3750 мг кг–1 (рис. 6). Компостирование уменьшило количество аммония, но увеличивало количество нитратов за счет ускорения процессов нитрификации. Этот эффект наблюдали и другие исследователи (Banegas et al., 2007). Итоговое соотношение N-NH4/N-NO3 в компосте составляло 0.24, что также являлось показателем его готовности (Castaldi et al., 2009). Также, на стадии созревания (98 сут) уровень pH компостной массы составлял около 7, что предполагало образование в компосте гуминовых веществ, которые действовали как буферы.
В течение срока компостирования действие субстрата на тестовое растение менялось от ингибирующего его рост до стимулирующего (рис. 5), причем 28 сут компостирования АнОСВ достаточно для потери субстратом фитотоксичности.
Микробиологические исследования компостируемой массы АнОСВ
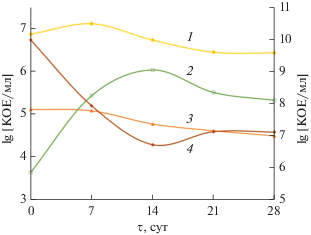
Динамика изменения ОМЧ. В нашей работе показано, что динамика изменения ОМЧ гетеротрофных аэробных микроорганизмов (ГАМ) зависела от изменения температуры в компостируемой массе. В начале процесса компостирования количество гетеротрофных аэробов было наибольшим и достигало 9.4 × 109 КОЕ см−3 (lg[ОМЧ] = = 9.97) (рис. 7). После того как на 4-е сут температура превысила 60°С, ОМЧ ГАМ снижалось на два порядка – до 8.4 × 107 КОЕ см−3 на 7-е сут (lg[ОМЧ] = 7.92). Высокая температура привела к инактивации (переходу в покоящиеся формы, частичной гибели) мезофильной микробиоты. С 7 по 14 сут ОМЧ ГАМ снижалось до 5.2 × 106 КОЕ см–3 (lg[ОМЧ] = 6.71) на 14-е сут.
Рис. 7.
Изменение состава групп микробного сообщества при компостировании АнОСВ (1–3 – по данным qPCR; 4 – исследования ОМЧ ГАМ методом культивирования): 1 – бактерии; 2 – грибы; 3 – археи; 4 – гетеротрофные копиотрофы.
Активность нитрификаторов. Активность культивируемых нитрифицирующих микроорганизмов первой и второй стадий нитрификации была отмечена лишь на начальной стадии процесса. При периодическом культивировании на среде Виноградского в мезофильных условиях стабильное снижение концентрации аммония в среде было отмечено для проб на нулевые и седьмые сутки (рис. 8). В то же время по данным FISH присутствие активных нитрификаторов первой стадии отмечалось не только в первые 7 сут компостирования, но и в последних проанализированных пробах (28 сут) и составляло от 5.5 × 104 кл. г–1 компостной массы в начале процесса и до 7.5 × 104 кл. г–1 компостной массы в финальной точке. Полученные данные коррелируют с ранее опубликованными сведениями о максимальной активности аэробных аммоний-окисляющих бактерий на стадии созревания компоста (Kowalchuk et al., 1999; Oishi et al., 2012; Zeng et al., 2013). К тому моменту, когда компостируемый материал достиг температуры 55°С, представители этой группы, по-видимому, перешли в состояние покоя. Период инкубации при периодическом культивировании, вероятно, был недостаточно длительным, чтобы способность к окислению аммония восстановилась на прежнем уровне.
Рис. 8.
Окисление аммония (а) и нитрита (б) нитрифицирующими бактериями при периодическом культивировании в пробах, отобранных на разных стадиях компостирования: 1 – первые сутки; 2 – 7 сут; 3 – 14 сут; 4 – 21 сут; 5 – 28 сут.
Активность азотфиксаторов. Мезофильные азотфиксаторы в сообществе микроорганизмов компостируемого материала присутствовали в течение всего процесса компостирования, хотя оптимальная температура для их жизнедеятельности устанавливались в первые 2 сут и после 14 сут компостирования. Количество КОЕ культивируемых мезофильных азотфиксаторов на всем протяжении компостирования оставалось на уровне 1.0 × 105–1.5 × 105 КОЕ см–3, что говорит о способности данной группы микроорганизмов переживать неблагоприятные для них условия термофильной стадии компостирования.
Термофильные азотфиксаторы были обнаружены с начала опыта и по 14-е сут компостирования, КОЕ культивируемых термофильных азотфиксаторов составило 1.0 × 103 КОЕ см–3, что на два порядка ниже, чем число мезофильных азотфиксаторов. В фазе остывания (21 и 28 сут) наблюдали некоторое восстановление ОМЧ ГАМ в близких значениях для этих точек – в среднем до 1.3 × 107 КОЕ см–3 (lg[ОМЧ] = 7.11).
Молекулярно-генетическое исследование таксономического разнообразия микробиоты компостируемой массы АнОСВ
Общие показатели биоразнообразия. О числе представителей определенной группы в образце компостируемого материала можно косвенно судить, основываясь на количества копий гена, образующихся в ходе ПЦР, последовательность которого соответствует конкретному домену (археи, бактерии, эукариоты).
В данной работе мы исследовали также разнообразие грибов как представителей домена эукариот. Результаты ПЦР в реальном времени проиллюстрированы на рис. 9. Подсчет численности микробного сообщества компоста методом ПЦР в реальном времени в этом случае не соответствовал результатам подсчета ОМЧ, так как на богатой питательной среде образуются колонии только культивируемых гетеротрофных копиотрофов, способных сформировать колонию за 5 сут, в то время как метод ПЦР в реальном времени выявляет все группы микроорганизмов, в том числе некультивируемые. В то же время данным методом невозможно различать живые и мертвые клетки, таким образом, в подсчет также частично попадала биомасса погибших микроорганизмов метаногенного сообщества АнОСВ, генетический материал которой частично сохранился на момент отбора пробы.
Рис. 9.
Соотношение копий ITS представителей различных таксономических групп грибов при компостировании АнОСВ в пробах, отобранных в первые сутки (до и после добавления древесной щепы), 7, 14, 21 и 28 сут.
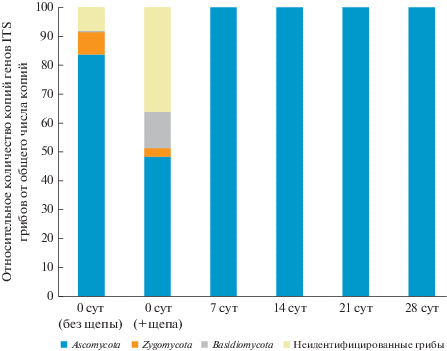
По показателю количества копий гена 16S рРНК и ITS грибов, максимальную общую численность микроорганизмов сообщества компоста наблюдали на 7-е сут (1.34 × 107 копий гена мкг–1), что можно связать с наиболее активным размн-ожением и скоростью метаболизма аэробных те-рмофильных микроорганизмов. Начиная с 21-х сут, численность микроорганизмов, включая грибы, стабилизировалась и оставалась примерно на одном уровне до 28-е сут (3.16 × 106 и 2.94 × 106 копий гена мкг–1 соответственно). Это происходило в связи с расходом легкодоступного субстрата и переходом к утилизации трудноусваиваемых веществ, что привело к инактивации клеток микроорганизмов.
Разнообразие грибов в компостируемой массе АнОСВ. Среди грибов сообщества много неопознанных родов из разных таксонов (Sordariomycetes, Microascaceae). В материале со щепой перед началом компостирования наблюдали большое разнообразие родов грибов – 13 представителей из отделов Ascomycota, Zygomycota и Basidiomycota с долей от 1 до 8%, при этом отсутствовал определенный доминирующий род. На 14 и 28 сут в сообществе доминировал род Pseudogymnoascus (46 и 30% соответственно). Отдел Ascomycota сильно превалировал над другими отделами, начиная с 7-х сут компостирования (рис. 9), что также показано в работах Zhang и соавт. (2016) и Galitskaya и соавт. (2017). Грибное сообщество анализировали при помощи подсчета копий ITS. В грибном сообществе первое время наблюдали активный рост и увеличение числа ITS: за 7 сут число копий ITS возросло с 4.40 × 103 до 2.70 × 105 копий ITS мкг–1. Дальнейшие количественные изменения числа копий ITS имели менее резкий характер. На 14-е сут наблюдали наибольшее число ITS грибов по сравнению с другими стадиями процесса (1.07 × × 106 копий ITS грибов мкг–1), что составляло 16.4% от общего числа микроорганизмов. На 21-е сут количество копий ITS грибов уменьшалось на порядок и составило 3.20 × 105 копий ITS мкг–1. К 28 сут значительных изменений в числе копий ITS грибов не было обнаружено, порядок значения оставался неизменным.
Разнообразие архей в компостируемой массе АнОСВ. Количество копий гена 16S рРНК архей в ходе компостирования уменьшалось примерно на порядок, по сравнению с их числом в субстрате до компостирования; возрастания числа представителей филума не происходило. Археи, видимо, не оказывали значительного влияния на процесс компостирования, и, вероятно, сохранялись за счет образования покоящихся форм, в которых переживали неблагоприятные условия. Осадок сточных вод был предварительно анаэробно сброжен, что привело к развитию анаэробных архей, однако в условиях аэробного процесса их жизнедеятельность ингибировалась.
Разнообразие бактерий в компостируемой массе АнОСВ. В ходе анализа результатов было обнаружено, что бактерии преобладали на всех стадиях компостирования (рис. 10). Доля их последовательностей составляла 82–98% всех последовательностей генов эукариот и прокариот микробиоты компостируемого материала. Так как число копий генов бактерий преобладает в смеси, именно бактериальное сообщество определяет динамику изменения численности сообщества микроорганизмов в целом.
Рис. 10.
Соотношение генов 16S рРНК представителей различных таксономических групп бактерий при компостировании АнОСВ в пробах, отобранных в первые сутки (до и после добавления древесной щепы), 7-е, 14-е, 21-е и 28-е сут.
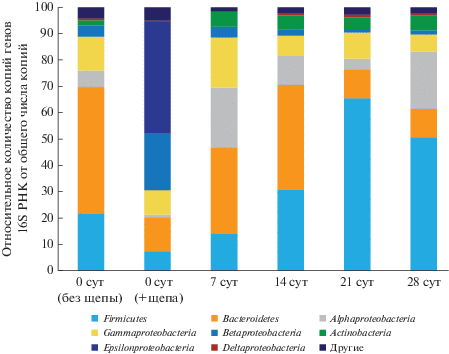
Результаты NGS профилирования иллюстрируют смену бактериальных сообществ при компостировании. Так, число представителей филума Firmicutes за 21 сут компостирования выросло с 8 до 65% от общего числа бактерий. Данная группа преобладала в бактериальном сообществе компоста на поздних стадиях процесса (14–28 сут). Максимальное число Bacteroidetes наблюдали до начала компостирования (47%) и на 14-е сут компостирования (40%). До начала компостирования в образце с добавлением щепы к АнОСВ обнаружилось большое количество бактерий группы ε-Proteobacteria (42%). При этом данная группа практически полностью отсутствовала в АнОСВ до добавления щепы, а также на всех стадиях компостирования: их доля составляла менее 0.01%. Это свидетельствует о том, что представители данной группы были привнесены с древесной щепой, но погибли после начала компостирования. Бактерии-представители γ-Proteobacteria присутствовали на всех стадиях процесса, наибольшую их долю наблюдали на 7-е сут (19%), после чего следовало уменьшение их количества до 6%. Значительную долю филума β-Proteobacteria наблюдали в начальной точке после добавления щепы, при этом не обнаружили корреляции между собственно АнОСВ и смесью АнОСВ и щепы. Представители групп Bacteroidetes и Proteobacteria доминировали на ранних стадиях компостирования, а также в АнОСВ до начала аэробного процесса. Обилие представителей филумов Bacteroidetes, Proteobacteria и Firmicutes в компостируемом субстрате отмечалось ранее в работе Antunes и соавт. (2016). Динамика соотношения трех данных филумов согласуется с результатами работы Zhang и соавт. (2016): численность Firmicutes за период компостирования (11 дней) увеличилась с 8 до 81%, в то время как количество Bacteroidetes и Proteobacteria уменьшилось с 70 до 2 и 17% соответственно. Доля бактерий филума Actinobacteria варьировала в течение всего периода компостирования в пределах 4–6% от общего числа бактерий. Невысокие показатели численности филума были показаны в экспериментах Galitskaya и соавт. (2017), где относительное количество актинобактерий составляло 0.37–5.7%.
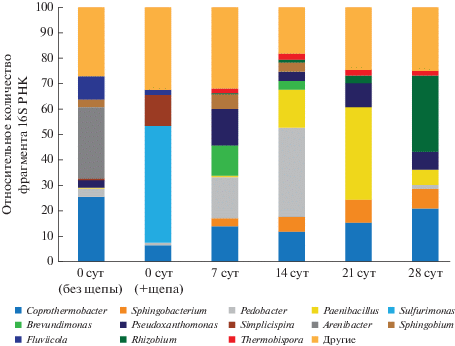
Важно отметить, что в сообществе компостируемой массы почти отсутствовали представители рода Bacillus – максимальная доля составила 1.5% на 21-е сут. Исследования микробиоты компоста из осадка сточных вод в работе Galitskaya и соавт. (2017) показал похожий результат. Однако в ряде других работ по компостированию отмечено доминирование данного рода (Zhang et al., 2016; Weglarz al., 2018). Кроме того, наблюдали большее разнообразие таксонов бактерий на каждой стадии и отсутствие значительного преобладания конкретного рода по ходу созревания компоста – доля доминирующих родов на каждой стадии компостирования варьировала в интервале 10–38%. Интересно, что начальный субстрат до компостирования без добавления щепы значительно отличался по микробному составу от того же субстрата после смешения со щепой. Привнесенные со щепой микроорганизмы являются причиной подобного несоответствия. В обоих типах субстрата присутствовал только род Coprothermobacter, выделенный ранее из компоста с высоким содержанием белков и анаэробно сброженного осадка сточных вод (Etchebehere et al., 1998). Coprothermobacter – один из немногих анаэробных термофильных протеолитических родов бактерий. Представители рода эффективно расщепляют белки до водорода и ацетата, проводят аммонификацию на значительном уровне и при лимитировании субстрата, и при различной концентрации аммония в среде (0–6 г/л), что указано в работе Gagliano и соавт. (2015). Согласно результатам настоящего исследования, в смеси АнОСВ с древесной щепой и в АнОСВ без щепы доля гена 16S рРНК рода Coprothermobacter была равна 6 и 21% соответственно. Более того, протеолитический род Coprothermobacter присутствует в значительном количестве и на остальных стадиях компостирования (12.0–14.5% от общего числа микроорганизмов, рис. 11). Расщепляя белки, Coprothermobacter участвовал в активной эмиссии аммиака на 6–10 сут. Вместе с Coprothermobacter в субстрате без щепы преобладали роды Arenibacter (23%) и Fluviicola (7%), но они не обнаруживались в значимом количестве в субстрате с добавлением щепы. Аналогично, роды Sulfurimonas (38%) и Simplicispira (10%) обнаружены в большом количестве в АнОСВ со щепой и не являлись доминирующими в субстрате без щепы. Таким образом, микробиота компостной массы слагается в равной степени из микробиоты исходного субстрата и из микробиоты наполнителя, в данном случае – древесной щепы. При этом, микробиота наполнителя, судя по всему, может играть важную роль в запуске тех или иных процессов в компостируемой массе. На 7–21 сут процесса обнаружены микроорганизмы, способные расщеплять целлюлозу, – Paenibacillus (максимальное количество на 21 сут, 27% генов 16S рРНК). Представители данного рода обладают способностью утилизировать различные биополимеры (Kumar et al., 2012), некоторые члены способны к азотфиксации (Seldin et al., 1998). Также небольшую долю от общего количества генов составили копии гена представителей рода Thermobispora (2%), который обнаружился в период с 7 по 21 сут включительно, сохраняя свою первоначальную долю в сообществе. На 21-е сут был обнаружен род Rhizobium (2%), способный к азотфиксации, доля которого возрастала до 20% на 28 сут, что, вероятно может свидетельствовать о возрастании уровня метаболизма азота при созревании компоста. Роды Fluviicola, Parapedobacter, Petrimonas, Chryseobacterium, Devosia, Cohnella были ранее обнаружены в сточных водах (Kampfer et al., 2003; Yang et al., 2014) и различных компостирующихся субстратах (Grabowski et al., 2005). Devosia, согласно ранее проведенным исследованиям, может служить маркером термофильного компостирования осадка сточных вод (Awasthi et al., 2017). Были обнаружены бактерии, потенциально способные к утилизации ароматических соединений (Sphingobium, Flavobacterium), однако их доля невелика: максимальное количество копий их гена обнаружили на 7-е сут – 5.4 и 6.2% соответственно.
Рис. 11.
Соотношение генов 16S рРНК доминирующих родов бактерий при компостировании АнОСВ в пробах, отобранных в первые сутки (до и после добавления древесной щепы), 7, 14, 21 и 28 сут.
Таким образом, анаэробно обработанный осадок сточных вод после частичного обезвоживания целесообразно компостировать с древесной щепой для окончательной стабилизации органических веществ в целях предотвращения негативного влияния на окружающую среду. Исходя из полученных данных о процессе компостирования АнОСВ и выявлении термофильных и мезофильных микроорганизмов на разных стадиях процесса, можно сделать вывод, что динамика изменения форм азота обусловлена функционированием сложных трофических связей микробиологического сообщества, приводящим к выходу азота из биополимеров. Активная биодеградация длится до 28 сут с эмиссией азотосодержащих веществ – аммиака до 862 мг м–3 и оксида азота до 86 мг м–3. Самоуплотнение субстрата и низкая концентрация кислорода в его атмосфере (до 8.0 об. %), вследствие потребления микроорганизмами, привели к возникновению частично анаэробных участков и активности обнаруженных мезофильных денитрификаторов с выделением продуктов денитрификации – оксидов азота. Азотфиксаторы начинают присутствовать в значимом количестве на стадии остывания компоста.
Причиной эмиссии значительных количеств аммиака может быть высокая скорость разложения белков погибшей в аэробных условиях биомассы микроорганизмов сброженного осадка при низкой первоначальной биологической доступности углерода древесной щепы (в основном за счет разложения гемицеллюлозы), а также высокая (более 60°С) температура авторазогрева. Так, высокая скорость потребления биологически доступного углерода и его низкое исходное содержание в древесной щепе в начальный период компостирования привела к нехватке С для ассимиляции микробиотой и, как следствие, минерализации азота в форме NH3.
Биотехнологической задачей может быть стимулирование процессов нитрификации и ассимиляции азота, которые, конкурируя за аммиак, минимизируют его эмиссию. В то же время, отгонка избытка аммиака при компостировании и последующее его улавливание на водных скруберах, может, с одной стороны, снизить его концентрацию в субстрате до нетоксичного для микроорганизмов уровня и стимулировать процессы нитрификации и ассимиляции, а с другой – обусловить получение аммиачной воды (гидрата аммиака), применяемой в качестве сырья при производстве минеральных удобрений.
Список литературы
Ножевникова А.Н., Литти Ю.В., Некрасова В.К., Куличевская И.С., Григорьева Н.В., Куликов Н.И., Зубов М.Г. Анаэробное окисление аммония (анаммокс) в биопленках иммобилизованного активного ила при очистке сточных вод с низкой концентрацией загрязнений // Микробиология. 2012. Т. 81. С. 28–28.
Nozhevnikova A.N. Litti Y.V., Nekrasova V.K., Kulichevskaya I.S., Grigoryeva N.V., Kulikov N.I., Zubov M.G. Anaerobic ammonium oxidation (anammox) in immobilized activated sludge biofilms during the treatment of weak wastewater // Microbiology (Moscow). 2012. V. 81. P. 25–34.
Ножевникова А.Н., Миронов В.В., Бочкова Е.А., Литти Ю.В., Русскова Ю.И. Состав микробного сообщества на разных стадиях компостирования, перспектива получения компоста из муниципальных органических отходов // Прикл. биохимия и микробиология. 2019. Т. 55. С. 211–221.
Nozhevnikova A.N., Mironov V.V., Botchkova E.A., Litti Y.V., Russkova Y.I. Composition of a microbial community at different stages of composting and the prospects for compost production from municipal organic waste // Appl. Biochem. Microbiol. 2019. V. 55. P. 199–208.
Пахненко Е.П. Осадки сточных вод и другие нетрадиционные органические удобрения. 3-е изд. М.: БИНОМ. Лаборатория знаний, 2015. 314 с.
Amann R.I., Binder B.J., Olson R.J., Chisholm S.W., Devereux R., Stahl D.A. Combination of 16S rRNA-targeted oligonucleotide probes with flow cytometry for analyzing mixed microbial populations // Appl. Environ. Microbiol. 1990. V. 56. P. 1919–1925.
Antunes L.P. Martins L.F., Pereira R.V., Thomas A.M., Barbosa D., Lemos L.N., Silva G.M., Moura L.M., Epamino G.W., Digiampietri L.A., Lombardi K.C., Ramos P.L., Quaggio R.B., de Oliveira J.C., Pascon R.C., Cruz J.B., da Silva A.M., Setubal J.C. Microbial community structure and dynamics in thermophilic composting viewed through metagenomics and metatranscriptomics // Sci Rep. 2016. V. 6. Art. 38915.
Awasthi M.K., Zhang Z., Wang Q., Shen F., Li R., Li D.-S., Ren X., Wang M., Chen H., Zhao J. New insight with the effects of biochar amendment on bacterial diversity as indicators of biomarkers support the thermophilic phase during sewage sludge composting // Bioresour. Technol. 2017. V. 238. P. 589–601.
Banegas V., Moreno J.L., Moreno J.I., Garcia C., Leon G., Hernandez T. Composting anaerobic and aerobic sewage sludges using two proportions of sawdust // Waste Manag. 2007. V. 27. P. 1317–1327.
Bengtson P., Sterngren A.E., Rousk J., Archaeal abundance across a pH gradient in an arable soil and its relationship to bacterial and fungal growth rates // Appl. Environ. Microbiol. 2012. V. 78. P. 5906–5911.
Caceres R., Malińska K., Marfa O. Nitrification within composting: a review // Waste Manag. 2018. V. 72. P. 119–137.
Castaldi P., Garau G., Deiana P., Melis P. Evolution of carbon compounds during municipal solid waste composting: suitability of chemical and biochemical parameters in defining the stability and maturity of the end product // Dynamic Soil, Dynamic Plant. 2009. P. 17–31.
Cesaro A., Belgiorno V., Guida M. Compost from organic solid waste: Quality assessment and European regulations for its sustainable use // Resour. Conservat. Recycl. 2015. V. 94. P. 72–79.
Chowdhury M.A., de Neergaard A., Jensen L.S. Potential of aeration flow rate and biochar addition to reduce greenhouse gas and ammonia emissions during manure composting // Chemosphere. 2014. V. 97. P. 16–25.
De Gannes V., Eudoxie G., Hickey W.J. Prokaryotic successions and diversity in composts as revealed by 454-pyrosequencing // Bioresour. Technol. 2013. V. 133. P. 573–580.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461.
Edgar R.C. UPARSE: highly accurate OTU sequences from microbial amplicon reads // Nature Methods. 2013. V. 10. P. 996–998.
Etchebehere C., Pavan M.E., Zorzopulos J., Soubes M., Muxi L. Coprothermobacter platensis sp. nov., a new anaerobic proteolytic thermophilic bacterium isolated from an anaerobic mesophilic sludge // Int. J. Syst. Bacteriol. 1998. V. 48. P. 1297–1304.
Fierer N., Jackson J.A., Vilgalys R., Jackson R.B. Assessment of soil microbial community structure by use of taxon-specific quantitative PCR assays // Appl. Environ. Microbiol. 2005. V. 71. P. 4117–4120.
Gagliano M.C., Braguglia C.M., Petruccioli M., Rossetti S. Ecology and biotechnological potential of the thermophilic fermentative Coprothermobacter spp. // FEMS Microbiol. Ecol. 2015. V. 91. fiv018.
Galitskaya P., Biktasheva L., Saveliev A., Grigoryeva T., Boulygina E., Selivanovskaya S. Fungal and bacterial successions in the process of co-composting of organic wastes as revealed by 454 pyrosequencing // PLoS One. 2017. V. 12. Article e0186051.
Grabowski A., Tindall B.J., Bardin V., Blanchet D., Jeanthon C. Petrimonas sulfuriphila gen. nov., sp. nov., a mesophilic fermentative bacterium isolated from a biodegraded oil reservoir // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 1113–1121.
Hachicha S., Sellami F., Cegarra J., Hachicha R., Drira N., Medhioub K., Ammar E. Biological activity during co-composting of sludge issued from the OMW evaporation ponds with poultry manure – physico-chemical characterization of the processed organic matter // J. Hazard. Mat. 2009. V. 162. P. 402–409.
Ivankin A., Pandya U., Saraf M. Intensification of aerobic processing of the organic wastes into compost // Composting for Sustainable Agriculture. Sustainable Development and Biodiversity / Ed. Maheshwari D. Springer, Cham. 2014. V. 3. P. 23–42.
Kampfer P., Dreyer U., Neef A., Dott W., Busse H.-J. Chryseobacterium defluvii sp. nov., isolated from wastewater // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 93–97.
Kowalchuk G.A., Naoumenko Z.S., Derikx P.J., Felske A., Stephen J.R., Arkhipchenko I.A. Molecular analysis of ammonia-oxidizing bacteria of the β-subdivision of the class Proteobacteria in compost and composted materials // A-ppl. Environ. Microbiol. 1999. V. 65. P. 396–403.
Kumar D., Ashfaque M., Muthukumar M., Singh M., Garg N. Production and characterization of carboxymethyl cellulase from Paenibacillus polymyxa using mango peel as substrate // J. Environ. Biol. 2012. V. 33. P. 81–84.
Meissl K., Smidt E. High quality composts by means of cocomposting of residues from anaerobic digestion // Compost Science & Utilization. 2007. V. 15. P. 78–83.
Mena E., Garrido A., Hernández T., García C. Bioremediation of sewage sludge by composting // Commun. Soil Sci. Plant. 2003. V. 34. P. 957–971.
Meng L., Li W., Zhang S., Wu C., Wang K. Effects of sucrose amendment on ammonia assimilation during sewage sludge composting // Bioresour. Technol. 2016. V. 210. P. 160–166.
Mobarry B.K., Wagner M., Urbain V., Rittmann B.E., Stah D.A. Phylogenetic probes for analyzing abundance and spatial organization of nitrifying bacteria // Appl. Environ. Microbiol. 1996. V. 62. P. 2156–2162.
Navarro A.F., Cegarra J., Roig A., Garcia D. Relationships between organic matter and carbon contents of organic wastes // Bioresour. Technol. 1993. V. 44. P. 203–207.
Oishi R., Tada C., Asano R., Yamamoto N., Suyama Y., Nakai Y. Growth of ammonia-oxidizing archaea and bacteria in cattle manure compost under various temperatures and ammonia concentrations // Microb. Ecol. 2012. V. 63. P. 787–793.
Pepe O., Ventorino V., Blaiotta G. Dynamic of functional microbial groups during mesophilic composting of agro-industrial wastes and free-living (N2)-fixing bacteria application // Waste Manag. 2013. V. 33. P. 1616–1625.
Rihani M., Malamis D., Bihaoui B., Etahiri S., Loizidou M., Assobhei O. In-vessel treatment of urban primary sludge by aerobic composting // Bioresour. Technol. 2010. V. 101. P. 5988–5995.
Rincón C.A., De Guardia A., Couvert A., Soutrel I., Guezel S., Le Serrec C. Odor generation patterns during different operational composting stages of anaerobically digested sewage sludge // Waste Manag. 2019. V. 95. P. 661–673.
Sánchez Ó.J., Ospina D.A., Montoya S. Compost supplementation with nutrients and microorganisms in composting process // Waste Manag. 2017. V. 69. P. 136–153.
Sasaki H., Maruyama G., Suzuki H., Nonaka J., Sato M., Sasaki T., Ohta M., Nakai Y. Distribution of ammonia assimilating bacteria in the composting process Compost // Sci. Util. 2004. V. 12. P. 108–113.
Seldin L., Rosado A.S., Da Cruz D.W. Nobrega A., van Elsas G.D. Comparisson of Paenibacillus azotofixans strains isolated from rhizoplane, rhizosphere and non-root-associated soil from maize planted in two different Brazilian soils // Appl. Environ. Microbiol. 1998. V. 64. P. 3860–3868.
Vázquez M.A., de la Varga D., Plana R., Soto M. Nitrogen losses and chemical parameters during co-composting of solid wastes and liquid pig manure // Environ. Technol. 2018. V. 39. P. 2017–2029.
Wang K., Li W., Li X., Ren N. Spatial nitrifications of microbial processes during composting of swine, cow and chicken manure // Sci. Rep. 2015. V. 5. Article 14932.
Wang Q., Garrity G.M., Tiedje J.M., Cole J.R. Naive Bayesian classifier for rapid assignment of rRNA sequences into the new bacterial taxonomy // Appl. Environ. Microbiol. 2007. V. 73. P. 5261–5267.
Weglarz T.C., Holsen L.K., Ribbons R.R., Hall D.J. Microbial diversity and nitrogen-metabolizing gene abundance in backyard food waste composting systems // J. Appl. Microbiol. 2018. V. 125. P. 1066–1075.
Yang H.-X., Wang X., Liu X.-W., Zhang J., Yang G.-Q., Lau K.W.K., Li S.-P., Jiang J.-D. Fluviicola hefeinensis sp. nov., isolated from the wastewater of a chemical factory // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 700–704.
Zeng Y., De Guardia A., Ziebal C., De Macedo F.J., Dabert P. Impact of biodegradation of organic matters on ammonia oxidation in compost // Bioresour. Technol. 2013. V. 136. P. 49–57.
Zhang L.L., Zhang H.Q., Wang Z.H., Chen G.J., Wang L.S. Dynamic changes of the dominant functioning microbial community in the compost of a 90 m3 aerobic solid state fermentor revealed by integrated meta-omics // Bioresour. Technol. 2016. V. 203. P. 1–10.
Zorpas A.A., Loizidou M. Sawdust and natural zeolite as a bulking agent for improving quality of a composting product from anaerobically stabilized sewage sludge // Bioresour. Technol. 2008. V. 99. P. 7545–7552.
Дополнительные материалы отсутствуют.