Микробиология, 2020, T. 89, № 4, стр. 432-443
Образование и свойства клеток-персистеров бактерий – обитателей кожи человека, Staphylococcus capitis и Staphylococcus epidermidis
Ю. А. Николаев a, *, Т. А. Панкратов a, А. В. Ганнесен a, Т. В. Колганова b, Н. Е. Сузина c, Е. В. Демкина a, Г. И. Эль-Регистан a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
c Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, ФИЦ
“Пущинский научный центр биологических исследований РАН”
142290 Пущино, Россия
* E-mail: nikolaevya@mail.ru
Поступила в редакцию 01.03.2020
После доработки 09.03.2020
Принята к публикации 24.03.2020
Аннотация
Персистеры (П) – это выживающие, но не размножающиеся в присутствии летальных доз антибиотиков (АБ) клетки малочисленной (0.001–1.0%) субпопуляции, образующейся в микробной культуре в результате фенотипического перехода, индуцированного стрессорными воздействиями или стохастически. Развиваясь в свежей среде, П восстанавливают структуру родительской популяции, что рассматривается как причина: а) рецидивирующих инфекций; б) неэффективности антибиотикотерапии; в) возникновения антибиотикорезистентности, чему посвящено множество оригинальных статей и обзоров. У бактерий-контаминантов кожи человека образование и свойства П не изучены, что определило цель настоящей работы. В популяциях стационарных культур бактерий Staphylococcus capitis Р205-1 (UNIQEM, Россия), чувствительного к полимиксину, сульфацилу Na, ко-тримоксазолу и Staphylococcus epidermidis 14990 АТСС, резистентного к этим антибиотикам, определяли частоту встречаемости (количество) П двумя способами: 1) традиционным – при внесении летальных доз АБ, и 2) с применением лизирующего раствора (ЛР), что обусловливало гибель ординарных вегетативных клеток и селектировало устойчивые к АБ и ЛР клетки-персистеры (соответственно, ПАБ и ПЛР). Впервые показано, что для определения численности П у штаммов с множественной АБ-резистентностью применим способ использования лизирующего раствора (на примере штамма S. epidermidis). Обнаружено, что в отличие от большинства коллекционных бактерий, у стафилококков – обитателей кожи человека, доля П в стационарных культурах весьма высока и составляет у S. epidermidis ПЛР ∼10%, у S. capitis – ПАБ ∼10%. Выявлена гетерогенность стандартно полученных ПАБ по их устойчивости к лизирующему раствору: у S. capitis доля ПЛР составила около 1% от численности ПАБ; при этом ПЛР были устойчивы к действию АБ. Обнаруженные различия в численности ПЛР у исследуемых штаммов (10% у S. epidermidis и менее 1.0% у S. capitis) коррелируют с их АБ-резистентностью. Показано, что при длительной инкубации (4 мес.) в стандартных условиях цикл развития стафилококков завершался образованием покоящихся форм (ПФ), численность которых составляла для обоих штаммов около 0.1% от численности жизнеспособных клеток в стационарных культурах. ПФ стафилококков обладали всеми необходимыми характеристиками покоящихся клеток: образованием в цикле развития культур; сохранением жизнеспособности в неростовых условиях; отсутствием экспериментально определяемого метаболизма (отсутствие дыхания); специфической ультраструктурной организацией; высокой терморезистентностью (в 200–600 раз больше, чем вегетативных клеток при действии температуры – 90°С, 15 мин). Обнаруженная корреляция между численностью ПЛР в культурах стафилококков и долей высокотермоустойчивых ПФ подтверждает ранее высказанную авторами статьи гипотезу о персистерах как предшественниках ПФ.
Значение совокупности бактерий, ассоциированных с телом человека и формирующих его микробиом, в поддержании здоровья, или, напротив, как причины хронических инфекций, общеизвестно, и исследование его состава и функциональной активности является одной из актуальных задач микробиологии и бактериологии (The Human Microbiome Project Consortium, 2012; Sherwood et al., 2013). Важной составляющей частью микробиома человека является кожная микрофлора (Grice et al., 2009). Микроорганизмы, входящие в состав микробиоты кожи человека, играют важную роль в функционировании организма человека, его социальных реакциях, работе иммунной и ряда других систем. Однако основное внимание в исследованиях последних лет было сосредоточено в основном на микробиоме кишечника, микробиом кожи менее изучен. При этом, будучи подверженными воздействию стрессоров различной природы, включая антибиотики (АБ) и антисептики, бактериальные обитатели кожи (как оппортунистические патогены, так и комменсалы), могут быть источником возникновения и распространения антибиотикорезистентных (АБР) клонов бактерий, что является основной проблемой медицинской микробиологии настоящего времени (Post-conference report, 2015).
Антибиотикорезистентность, обусловленная наличием в клетках генетических детерминант устойчивости к действию АБ, позволяет клеткам размножаться в их присутствии и распространяется путем горизонтального переноса этих детерминант. Согласно современной концепции важным путем возникновения и распространения АБР является образование в микробной популяции малочисленной (0.01–1%) субпопуляции клеток-персистеров (П), обладающих множественной лекарственной толерантностью, т.е. выживающих, но не размножающихся в присутствии антибиотиков (Bigger, 1944; Levin-Reisman et al., 2017; Lewis, Shan, 2017). Персистеры образуются вне зависимости от присутствия антибиотика или другого стрессора как эволюционно выработанная конститутивная форма выживания популяции (Van den Berg et al., 2017). Различают два типа П: образующиеся в результате фенотипического перехода в растущей культуре (П II), численностью до 0.01%, и образующиеся в стационарной культуре (П I), численностью до 1% (Lewis, 2010; Balaban et al., 2004, 2019). Генетические и физиологические механизмы формирования П детально исследованы (Maisonneuve, Gerdes, 2014; Gollan et al., 2019). Основным детерминирующим свойством П обоих типов является их фенотипически обусловленная способность выживать в присутствии летальных доз антибиотиков (АБ) и ревертировать к пролиферации в свежей среде с образованием популяции, подобной родительской, из преимущественно чувствительных к АБ клеток и малочисленной (∼1%) субпопуляции П (Balaban et al., 2019; Gollan et al., 2019). Спонтанно образующиеся генетические мутации устойчивости к АБ, возникшие в П, передаются при их реверсии к росту клеткам новой популяции, в количестве тем большем, чем больше П, что и определило “возникновение П как дорогу к АБР” (Lewin-Reisman, 2017). Поэтому клинически значимые бактерии со множественной АБР являются потенциальными кандидатами в высоперсистерные штаммы.
Другим важным свойством П, к сожалению, малоизученным и отмеченным в нескольких работах (Lewis, 2010; Biel et al., 2014), является их устойчивость к автолизу. Это свойство П было оригинально использовано для разработки “нового протокола” их обнаружения и селекции под действием лизирующего раствора (“Sigma”, Miniprep kit) (Canas-Duarte et al., 2014).
Отметим, что кардинальным конститутивным свойством любой изогенной популяции является ее гетерогенность (Leygeber et al., 2019; Popp, Mascher, 2019), которая сохраняется и на уровне субпопуляций, например, при образовании бациллярных эндоспор и их прорастании (Popp, Mascher, 2019). Гетерогенность П была отмечена в отношении степени их толерантности к действию различных АБ, а также скорости потери ими колониеобразующей способности при хранении в среде с антибиотиком как селектирующим агентом (Демкина и соавт., 2015; van der Berg et al., 2017; Balaban et al., 2019). Снижение КОЕ в популяции бактерий после внесения АБ описывается двухфазной кривой отмирания: быстрого отмирания ординарных клеток на первом этапе, а затем медленного – клеток П, что формирует так называемое плато П (Kaldalu et al., 2016). Мы полагаем, что потеря персистерами колониеобразующей способности при их дальнейшем хранении в той же среде с АБ происходит вследствие их перехода в жизнеспособные, но не культивируемые клетки, что было показано для Mycobacterium thuberculosis (Salina et al., 2019). При хранении бактериальных культур в стандартных условиях (без воздействия селектирующих агентов) клетки субпопуляции персистеров будут переходить из пролиферативно покоящегося состояния, т.е. ареста деления при сохранении определенной низкой метаболической активности, в метаболически покоящееся анабиотическое состояние, свойственное покоящимся формам (ПФ). Гипотеза, рассматривающая П как предшественников покоящихся форм (ПФ), предназначенных для выживания популяций неспорообразующих бактерий, то есть сохранения вида в неростовых условиях, была предложена нами ранее при исследований П бактерий Escherichia coli К12 и Pseudomonas aeruginosa РАО-1 (Лойко и соавт., 2015; Мулюкин и соавт., 2015).
Хотя образованию и свойствам П посвящена огромная литература, основная масса исследований выполнена на коллекционных штаммах E. coli К12, P. aeruginosa РАО-1 и Staphilococcus aureus 209-Р. Бактерии, контаминирующие кожу человека, в этом отношении не изучены.
В связи с вышеизложенным, целью работы было исследовать феноменологию образования персистеров у представителей кожной микробиоты человека Staphilococcus capitis Р205-1 и S. epidermidis 14990, определить сравнительную толерантность П к антибиотикам различных классов и литическим воздействиям и получить доказательства образования из персистеров покоящихся форм стафилококков как морфотипа, предназначенного для длительного выживания популяции в неростовых условиях.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования – бактерии Staphilococcus capitis Р205-1 UNIQEM (ИНМИ ФИЦ Биотехнологии РАН, Россия) и S. epidermidis 14990 АТСС, изолированные с кожи человека.
Условия культивирования. Бактерии культивировали в жидкой среде RCM следующего состава (г/л): дрожжевой экстракт – 13; пептон – 10; глюкоза – 5; натрия хлорид – 5; аммония ацетат – 1; цистеина гидрохлорид – 0.2. Культуры выращивали в конических колбах объемом 250 мл с 50 мл питательной среды на шейкере Biosan PSU-20i (Латвия), 150 об./мин при температуре 33°С. Инкубацию культур при определении численности П проводили в пробирках типа Эппендорф (2 мл) с 500 мкл стационарной культуры на термошейкере TS-100 (“Biosan”), 750 об./мин, при температуре 33°С.
Численность жизнеспособных клеток определяли микрометодом (Thomas et al., 2015), учитывая число КОЕ в 5 мкл 10-кратных разведений бактериальной культуры, инокулированных на поверхность агаризованной среды RCM (агар 15 г/л) в 5–10-кратных повторах каждого разведения.
Численность персистеров в стационарных культурах исследуемых бактерий определяли двумя методами: используя А) стандартный протокол, основанный на действии антибиотиков (Kaldalu et al., 2016), и Б) протокол, основанный на действии лизирующего раствора (Canas-Duarte et al., 2014). А. В опытах с использованием антибиотиков брали 500 мкл аликвоты культуры стационарной фазы роста (ОП590 = 2.0, “Specord Jenway”, Германия) переносили в пробирку типа Эппендоф объемом 2 мл и добавляли: 1) 1 мкл раствора полимиксина (6 мкг/мл); 2) 12.5 мкл раствора сульфацетамида натрия (125 мг/мл); 3) 1 мкл раствора ко-тримоксазола (сульфаметоксазол 40 мг/мл + триметоприм 8 мг/мл). Б. В опытах с лизирующим раствором в 500 мкл аликвоты стационарной культуры (в пробирках Эппендорф объемом 2 мл) вносили 50 мкл лизирующего раствора, содержащего додецилсульфат натрия (0.01% в конечном объеме) и лизоцим 50 мкл (50 мг/мл, 20000 ед./г, “Applichem”). В контрольных вариантах биоциды не добавляли. Культуры опытных и контрольных вариантов (0.5 мл) инкубировали в течение 8 ч на термошейкере TS-100 (“Biosan”) при 33°С в пластиковых пробирках объемом 2 мл.
Кривые отмирания строили по показателям численности КОЕ/мл в отбираемых пробах при 5–10 повторностях и отборе проб из 3-х параллельных пробирок. Критерием наличия П служило плато постоянной численности КОЕ в течение не менее 3 ч на кривых отмирания (Kaldalu et al., 2016). Долю П рассчитывали как отношение КОЕ/мл на плато к концентрации КОЕ в исходной культурe до внесения антибиотика.
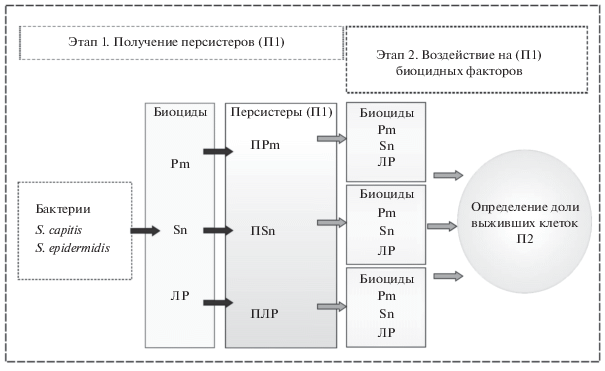
Устойчивость персистеров к перекрестному действию селектирующих биоцидных факторов проводили по следующей схеме (рис. 1). На первом этапе получали П1 в стационарных культурах бактерий, используя в качестве селектирующего агента антибиотики (ПАБ) или лизирующий раствор (ПЛР), как описано выше. На втором этапе персистеры (П1) в культурах, вышедших на плато по численности КОЕ после действия АБ или ЛР, дважды отмывали центрифугированием (10 000 g, 15 мин) в физиологическом растворе от применявшегося биоцида. Осажденные клетки ресуспендировали в таком же объеме бесклеточной культуральной жидкости стационарных (30 ч роста) контрольных культур (супернатант после центрифугирования при 10 000 g, 15 мин, центрифугирование повторяли дважды) и вносили другой биоцидный фактор. Через 4 ч инкубации определяли численность выживших персистеров (КОЕ/мл), обозначая их как П2.
Рис. 1.
Схема опыта по исследованию перекрестной устойчивости клеток-персистеров (П) S. capitis и S. epidermidis к действию различных биоцидных агентов. Pm – полимиксин; Sn – сульфацетамид натрия; ЛР – лизирующий раствор. П1 – персистеры, полученные на этапе 1; П2 – персистеры, полученные на этапе 2 после воздействия биоцидных факторов на П1.
Покоящиеся формы стафилококков (ПФ) получали в культурах, развивавшихся в жидкой среде RCM в указанных выше условиях в течение 7 сут и затем хранящихся в течение 4 мес. при комнатной температуре в отсутствие света в стационарных условиях.
Терморезистентность покоящихся и вегетативных клеток бактерий определяли как долю выживших клеток (КОЕ/мл) после прогревания аликвот (500 мкл) бактериальных культур при температуре 90°С в течение 15, 30, 45 мин в пластиковых пробирках типа Эппендорф на термошейкере TS-100 (“Biosan”). Число КОЕ определяли, как описано выше.
Метаболическую активность вегетативных клеток и ПФ оценивали по дыханию культур, которое определяли по интенсивности выделения СО2 в герметично закрытых флаконах (V = 50 мл), содержащих 1 мл культуры без (эндогенное дыхание) и после (стимулированное дыхание) внесения глюкозы (10 г/л). Концентрацию СО2 определяли на газовом хроматографе Кристалл 5000 (“Хроматэк”, Россия).
Цитоморфологические особенности ПФ изучали при микроскопировании в фазовом контрасте и просмотре тонких срезов клеток в электронном микроскопе. Для электронно-микроскопических исследований осажденные ПФ (4 мес. хранения) фиксировали в 1.5% растворе глютарового альдегида в 0.05 М какодилатном буфере (рН 7.2) при 4°С в течение 1 ч, трижды отмывали в том же буфере и дополнительно фиксировали в 1% растворе OsO4 в 0.05 М какодилатном буфере (рН 7.2) в течение 3 ч при 20°С. После обезвоживания материал заключали в эпоксидную смолу Epon 812. Ультратонкие срезы контрастировали в течение 30 мин в 3% растворе уранилацетата в 70% этаноле и докрашивали цитратом свинца по Рейнольдсу при 20°С в течение 4–5 мин. Срезы просматривали в электронном микроскопе JEM-110B (“Jeol”, Япония) при ускоряющем напряжении 80 кВ.
Статистическая обработка. Повторность измерений в экспериментах трехкратная при постановке 3 независимых серий экспериментов. Представленные результаты отражают усредненные величины. Статистический анализ проводили с использованием пакета документов программы Microsoft Exel XP, принимая критерий вероятности Р < 0.05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Протокол селекции персистеров с помощью антибиотиков. Традиционный протокол определения количества (доли) персистеров (П) в бактериальных культурах основан на их способности выживать (сохранять жизнеспособные клетки, КОЕ), но не размножаться в присутствии летальных доз антибиотиков (АБ) в отличие от ординарных вегетативных клеток, после гибели которых в популяции остаются жизнеспособными только П, количество которых соответствует числу КОЕ (Balaban et al., 2004, 2019). Классические кривые отмирания, детерминирующие наличие в бактериальной популяции П при внесении в нее бактерицидных доз АБ, включают первоначальный участок быстрого снижения численности КОЕ за счет гибели ординарных вегетативных клеток с образованием плато, характеризующего численность П, с последующим медленным снижением числа КОЕ за счет гибели П (первая версия) или приобретения ими свойств жизнеспособных некультивируемых клеток (вторая версия). На кривой гибели клеток популяции (кривой отмирания) образующееся плато (рис. 2) численности КОЕ соответствует количеству образовавшихся в культуре П. В стационарной культуре оно включает персистеры II типа (П II), образовавшиеся в растущей культуре, и персистеры I типа (П I), формирующиеся в стационарной культуре, при этом в общем пуле персистеров численность П I на 1–3 порядка превышает численность П II (Balaban et al., 2019). Для коллекционных культур бактерий численность П в стационарной фазе, как правило, составляет до 1%.
Рис. 2.
Определение численности клеток П1 бактерий S. capitis (а) и S. epidermidis (б) после внесения биоцидов в культуры стадии стационарного роста в момент времени 26 ч (а) или 24 ч (б). 1 – контроль (без внесения биоцидов); 2 – сульфацетамид натрия; 3 – полимиксин; 4 – бисептол (а) или ципрофлоксацин (б); 5 – лизирующий раствор. Стрелками (а) обозначен момент повторного внесения биоцидов в перекрестном опыте (см. рис. 3).
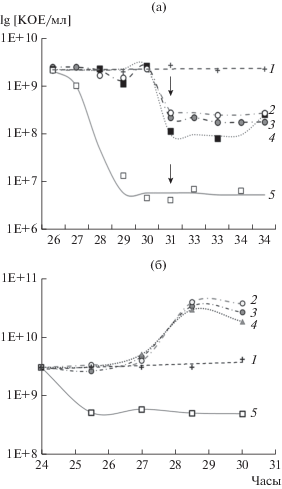
В наших экспериментах объектам исследования были изоляты с кожи человека S. capitis Р205-1 и S. epidermidis 14990, генетически устойчивые к ципрофлоксацину и ампициллину, а штамм 14990 – также к полимиксину (Pm), сульфацетамиду натрия (Sn) и ко-тримоксазолу (Kt). Отметим, что генетически антибиотикорезистентные (АБР) штаммы также обладают способностью к образованию П как универсальному фенотипу выживания любой микробной популяции при повреждающих воздействиях. Для определения численности П летальные дозы (10 МИК) Pm, Sn и Kt вносили в стационарные культуры обоих штаммов (рис. 2а, 2б). После добавления АБ для обоих штаммов был отмечен 3-часовой период отсутствия видимой реакции их культур на действие токсикантов, после которого ход событий в культурах разных штаммов резко различался.
В культурах S. capitis отмечалось быстрое падение численности КОЕ под действием всех трех антибиотиков (со скоростью 1.8 lg КОЕ/(мл ч)) за счет отмирания вегетативных ординарных клеток, после чего образовавшееся на кривой отмирания плато (4 ч наблюдений) отражало высокую численность АБ-толерантных П (около 10%) (рис. 2а). Отмеченная замедленная реакция бактериальных клеток S. capitis на биоцидное действие АБ, ранее не отмечавшаяся, равно как и высокая численность выявленных АБ-толерантных П, по-видимому, связаны с происхождением штамма как представителя микробиоты кожи человека, регулярно контактировавшего с антисептиками и антибиотиками, что привело к селекции штаммов с высокой долей П, аналогично тому, как это описано для E. coli (Van den Bergh et al., 2016).
В культурах S. epidermidis с множественной АБР внесение АБ вызвало неожиданный ответ: после 3-часового периода отсутствия реакции на внесение АБ был отмечен “вторичный рост” культур на достоверно высокую величину (∼ в 10 раз) (рис. 2б). Этот феномен отмечен впервые. Следует обратить внимание на: 1) одинаковую реакцию стационарной популяции на внесение трех АБ с различающимися механизмами действия, которые объединяет одно − стрессорная природа их действия на бактериальную клетку; 2) антибиотики вносили в культуру, развивающуюся в нормальных для нее условиях в нелимитированной среде и перешедшую в стационарную фазу роста, очевидно, вследствие накопления критической концентрации плотностных ауторегуляторов системы QS или иных, например, представленных фенольными липидами (Бухарин и соавт., 2005). Поэтому вторичный рост, наблюдаемый в той же среде, возможен только для субпопуляции с более высокой устойчивостью (нечувствительностью) к критической концентрации ауторегуляторов. Из этого следует, что наблюдаемый эффект относится к категории проявлений популяционной гетерогенности бактерий, скорее фено-, чем генотипической, т.к. о генетических детерминантах устойчивости к аутоиндукторам QS не известно, а фенотипическая гетерогенность в QS-системах достаточно хорошо изучена (Bettenworth et al., 2019). 3) Высоко QS-устойчивый фенотип, по-видимому, всегда формируется как минорная субпопуляция, вне зависимости от наличия или отсутствия детерминант АБР, т.е. как фенотип, всегда присутствующий в бактериальной популяции. Неясно, почему эта субпопуляция оказалась чувствительной к действию АБ, несмотря на наличие в клетках детерминант резистентности к этим АБ. Эти детерминанты имеют клетки всей популяции, но только клетки высоко QS-устойчивые восприняли внесение АБ как стрессорный сигнал, при этом не к гибели, а к росту.
Другое объяснение обнаруженного феномена состоит в том, что стрессорный сигнал АБ воспринимают клетки П, которые теоретические могут отличаться специфической QS-устойчивостью, так как участие QS систем в образовании П известно (Van den Bergh et al., 2017; Xu et al., 2017). Наличие “вторичного роста” S. epidermidis не противоречит высказанным предположениям. Последовавший после внесения АБ трехчасовой период относительной стабильности численности КОЕ можно объяснить постепенным возрастанием в культуре клеток QS-устойчивого фенотипа с конечным увеличением их численности в 10 раз. Идентичный характер кривых роста культур S. epidermidis при внесении разных АБ свидетельствует об одинаковой стрессовой реакции и АБ-устойчивости этой субпопуляции, что соответствует характеристикам фенотипа персистеров. Образование субпопуляции П S. epidermidis показано ниже. Исследования в этом направлении представляют большой интерес не только для фундаментальной микробиологии, но также биомедицины и планируются авторами настоящей работы.
Сам факт высокой АБ устойчивости исследуемых штаммов стафилококков: 1) АБ-резистентности S. epidermidis и 2) высокой частоты образования фенотипически АБ-толерантных П S. capitis, по-видимому, связан с их происхождением как членов микробиома кожи человека, постоянно подвергающейся стрессорным воздействиям (антисептикам, антибиотикам, перепадам температуры), индуцирующим образование П (van den Berg et al., 2017; Gollan et al., 2019).
Получение персистеров с помощью лизирующих агентов. Селектирующее персистеры действие лизирующего раствора было основано на выявленной ранее устойчивости П к лизирующему раствору (Canas-Duarte et al., 2014), начиналось для обоих штаммов сразу после его внесения в стационарную культуру, в отличие от действия АБ, и продолжалось 1.5 ч для S. epidermidis (рис. 2б) и 2.5 ч для S. capitis (рис. 2а), что негативно коррелирует с численностью лизирующихся ординарных клеток и, следовательно, численностью выявленных П, которая составляла 7.8–10% у S. epidermidis и 0.5% у S. capitis.
Общий вывод из этой части исследования состоит в том, что наблюдается прямая корреляция между АБ-резистентностью штамма и частотой образования П. Эти результаты подтверждают современную концепцию связи возникновения АБ-резистентности с образованием П (Levin-Reisman et al., 2017), где большее число выживающих при АБ атаке П обеспечивает большую численность клеток с АБР мутациями в популяции, развившейся из этих П в свежей среде. В недавнем исследовании (Windels et al., 2019) было показано, что скорость появления устойчивости к АБ была выше у мутантов с высокой частотой образования П, чем у мутантов с низкой частотой образования персистеров. Таким образом, развитие АБ-резистентности в высокоперсистерных популяциях зависит как от более высокой вероятности выживания клеток-П, так и от более высокой частоты АБР мутаций в П. Второй вывод состоит в констатации большей устойчивости клеток-П стафилококков, чем ординарных клеток, к литическим агентам, в данном случае – лизирующему раствору, что было ранее показано для штаммов E. coli (Cannas-Duarte et al., 2014) и подтверждает ранее отмеченную более высокую устойчивость клеток П к естественно развивающемуся в стареющих популяциях автолизу (Lewis et al., 2010; Biel et al., 2014). При этом возникает вопрос о сравнительной устойчивости П к действию АБ и литическим агентам, что проверено в следующем блоке экспериментов.
Перекрестное действие селектирующих персистеры агентов. В опытах клетки П, сохранившие при биоцидных воздействиях АБ или лизирующего раствора способность к образованию колоний, назовем их П1, осаждали центрифугированием и ресуспендировали в КЖ стационарных культур того же физиологического возраста контрольных вариантов (показано стрелкой на рис. 2а). Добавленный к обозначению символ (Pm, Sn или ЛР) обозначает способ селекции П1 – с применением полимиксина, сульфацетамида Na или лизирующего раствора соответственно. Эти ресуспендированные субпопуляции персистеров, П1, подвергались вторичному биоцидному воздействию, как показано на рис. 1. Оставшиеся жизнеспособными клетки назовем П2.
Для штамма S. capitis было зафиксировано падение численности жизнеспособных П2 при добавлении лизирующего раствора к П1Pm (рис. 3б) и П1Sn (рис. 3в) до численности (доли) П, полученных действием лизирующего раствора (П1ЛР) (рис. 2а). При этом перекрестное действие самих АБ не влияло на численность жизнеспособных П2Pm (рис. 3б) и П2Sn (рис. 3в), равно как и действие обоих АБ на П1ЛР (рис. 3а). В стационарных культурах контрольных вариантов число жизнеспособных клеток не изменялось на всем протяжении экспериментов, что характерно для культур стафилококков и было отмечено выше.
Рис. 3.
Определение численности клеток П2 бактерий S. capitis при внесении биоцидов в перекрестных опытах: (а) в суспензию ПЛР, полученных при воздействии лизирующего раствора; (б) сульфацила натрия; (в) полимиксина. 1 – контроль; 2 – полимиксин; 3 – сульфацил натрия; 4 – лизирующий раствор.
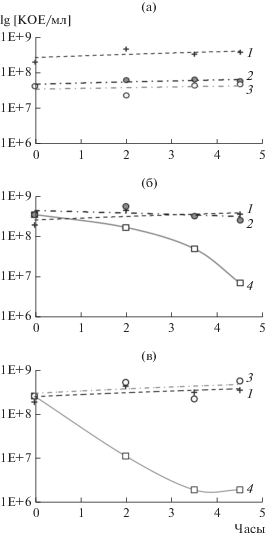
В опытах со штаммом S. epidermidis перекрестное действие селектирующих факторов было определено для клеток П1ЛР, полученных под влиянием лизирующего раствора, как показано стрелкой на рис. 2б. Действие антибиотиков Pm и Sn на П1ЛР не влияло на их численность, аналогично S. capitis. При этом внесение лизирующего раствора в суспензии клеток П1Pm и П1Sn достоверно (на 2 порядка) снижало численность КОЕ, аналогично показанному для штамма S. capitis, и отражало количество П в культуре АБР штамма стафиллоккоков (данные не приводятся). Таким образом, для определения доли П у АБР штаммов бактерий надежным является способ, основанный на применении лизирующего раствора.
Персистеры как клетки-предшественники покоящихся форм бактерий. Еще раз вернемся к определениям персистеров как клеток, фенотипически отличающихся от основной массы ординарных клеток, так как эти определения отражают эволюцию наших представлений о субпопуляции П, всегда присутствующей в фенотипически гетерогенных популяциях (культурах) бактерий. В первоначальном определении (Bigger, 1944) акцент был сделан на выживании П в присутствии летальных доз АБ, что обусловливало реверсию инфекций. В определении Льюиса (Lewis, 2010), благодаря которому был реанимирован интерес к этому популяционному явлению, акцент сделан на дормантном (спящем) состоянии клеток-П, чем, во многом, обусловлена толерантность П к действию АБ. В определении Наталии Балабан (Balaban et al., 2004, 2019) акцент сделан на том, что П являются не просто дормантными клетками с тлеющим метаболизмом, но образуются в результате цитодифференцировки. Но цитодифференцировка известна как процесс, сопряженный с образованием покоящихся форм (ПФ), выживающих не только в присутствии повреждающих воздействий химических или биологических токсикантов, но и при летальных для вегетативных клеток воздействиях физических факторов, например, термической обработке (Бухарин и соавт., 2005). Поэтому терморезистентность является одной из детерминирующих характеристик ПФ.
В наших предыдущих работах была выдвинута гипотеза, рассматривающая П как предшественники ПФ, в которых совершились генно-молекулярные процессы цитодифференцировки, но не завершились физико-химические процессы приобретения клеткой состояния метаболической инертности – анабиоза (Мулюкин и соавт., 2015; Лойко и соавт., 2015). Образование ПФ как малочисленной субпопуляции клеток, предназначенных для выживания и сохранения вида в неростовых условиях, имеет место в любой микробной популяции (Бухарин и соавт., 2005). В популяциях бактерий с внесенными в них АБ падение численности П объясняется как частичной потерей ими жизнеспособности, так и переходом в жизнеспособное некультивируемое состояние, (Salina et al., 2019), где жизнеспособные некультивируемые клетки были получены в культурах Mycobacterium tuberculosis, развивающихся в лимитированной по К+ среде при внесении в стационарные культуры рифампицина.
В условиях отсутствия давления биоцидных стрессоров персистеры, присутствующие в норме в стационарной бактериальной культуре, переходят в обратимое метаболически неактивное состояние, приобретая все характеристики покоящихся анабиотических/покоящихся форм (ПФ).
В настоящей работе было изучено образование ПФ в культурах стафилококков, естественно стареющих в стандартных условиях без воздействия посторонних стрессорных факторов.
Через 4 мес. хранения популяции обоих штаммов состояли из рефрактерных (фазово-контрастная микроскопия) клеток кокковидной формы различных размеров: 1.2 × 1.8 и 0.8 × 1.2 мкм (рис. 5). Полученные в длительно хранящихся культурах клетки обладали всеми признаками покоящихся форм (ПФ), сформулированными для специализированных ПФ − эндоспор (Sudo, Dworkin, 1973). Эти клетки стафилококков, образующиеся в циклах развития их культур, сохраняли жизнеспособность при длительном хранении (4 мес.) в условиях, не благоприятствующих росту: для штамма S. capitis численность ПФ составляла ~ 5 × 106 КОЕ/мл; для S. epidermidis ~ 5.7 × 106 КОЕ/мл.
Рис. 4.
Термоустойчивость (сохранение способности к образованию КОЕ, КОЕ/мл) бактерий S. capitis (а) и S. epidermidis (б) после прогрева в течение 15, 30 и 45 мин при 90°С. 1 – клетки фазы экспоненциального роста; 2 – ПФ. Над столбиками приведены значения выживаемости клеток в процентах от числа клеток до прогревания (100%). Оси ординат представлены в логарифмическом масштабе.
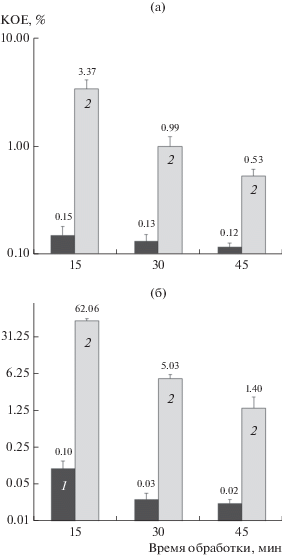
Рис. 5.
Микрофотографии ПФ S. capitis, хранившихся 4 мес.: общий вид, фазовый контраст (б), электронные микрофотографии ПФ первого морфотипа (в, г) и ПФ второго морфотипа (д, е); контроль, вегетативные клетки (а). ЦПМ – цитоплазматическая мембрана; Н – нуклеоид; КС – клеточная стенка, Ц – цитоплазма. Масштабная метка, (б) 10 мкм, (а, в−е) 0.5 мкм
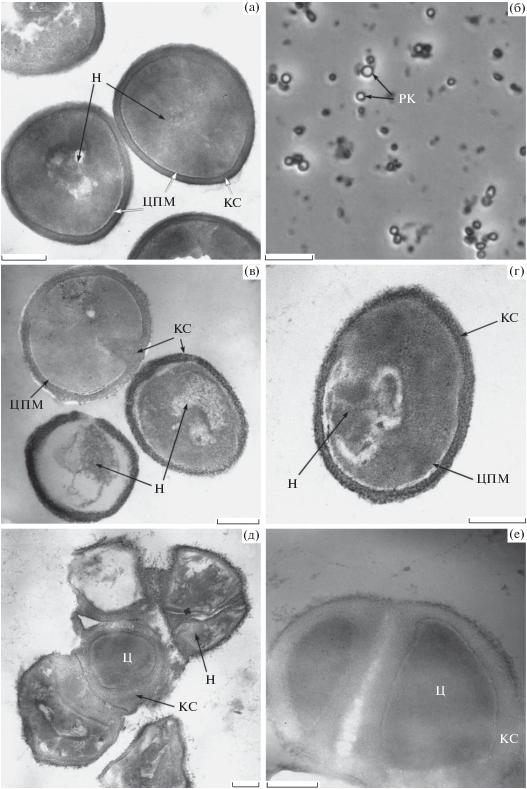
Полученные в 4-мес. культурах покоящиеся клетки не проявляли метаболической активности: по результатам хроматографического определения СО2 у них отсутствовало как эндогенное, так и стимулированное глюкозой дыхание (данные не приводятся).
Еще одним важным качеством, свидетельствующим о переживающих клетках стафилококков как покоящихся анабиотических формах, была их повышенная устойчивость к повреждающим воздействиям; они обладали высокой термоустойчивостью, на 2 порядка большей, чем вегетативные клетки (рис. 4а, 4б).
Наконец, длительно хранящиеся покоящиеся формы стафилококков имели существенное отличие от вегетативных клеток в ультраструктурной организации клеток. При микроскопировании в фазовом контрасте (рис. 5б) ПФ стафилококков характеризовались рефрактерностью, свойственной для бактериальных эндоспор и цистоподобных ПФ неспорообразующих бактерий, что объясняется обезвоживанием протопласта покоящихся клеток при развитии их анабиотического состояния (Эль-Регистан и соавт., 2006). Отмечена гетерогенность покоящихся (4 мес.) популяций стафилококков по размерам клеток.
Электронно-микроскопически в 4-мес. популяциях стафилококков выявляются два морфотипа ПФ (рис. 5). I морфотип – одиночные клетки с компактизованным нуклеоидом (Н) и утолщенной клеточной стенкой (КС) (рис. 5в, 5г), примерно в 2 раза более толстой, чем у вегетативных клеток (рис. 5а), структура которой гетерогенна и состоит из электронно-плотных гранул. II морфотип – толстостенные клетки с плотной гомогенной цитоплазмой, имеющей низкую электронную плотность (рис. 5д, 5е). Внутриклеточные структуры и нуклеоид не различимы. Клеточная стенка также имеет гомогенную структуру (рис. 5е) и еще более низкую электронную плотность. Как правило, такой морфотип имеют ПФ не разошедшихся после деления клеток (рис. 5д, 5е), часто – собранные в агломераты (рис. 5д).
Таким образом, выживающие в неблагоприятных для роста условиях клетки S. capitis и S. epidermidis: а) образующиеся в циклах развития их культур, б) длительно сохраняющие жизнеспособность (способность к колониеобразованию), в) обладающие особенностями ультраструктурной организации, г) термоустойчивостью и д) экспериментально не выявляемой метаболической активностью, можно отнести к покоящимся анабиотическим формам бактерий, предназначенным для сохранения вида. Отметим, что численность длительно выживающих ПФ стафилококков коррелирует с а) численностью П, выявляемых с помощью ЛР в их стационарных культурах и б) терморезистентностью ПФ, и составляет для S. capitis: ПЛР = 6.52 × 106 КОЕ/мл; ПФ (4 мес.) = 5.04 × 106 КОЕ/мл; для. S. epidermidis: ПЛР = 5.02 × 108 КОЕ/мл; ПФ (4 мес.) = = 5.72 × 106 КОЕ/мл. Это подтверждает сформулированную ранее гипотезу, рассматривающую П как предшественники ПФ. Если П являются морфотипом обратимо пролиферативно покоящихся (дорматных) клеток, предназначенных для выживания популяции при действии на нее стрессоров биологической и химической природы (включая антибиотики и ионы тяжелых металлов), и рассматриваются как базовый фенотип персистенции (условно) патогенных бактерий в организме человека (van der Berg, 2017), то ПФ следует рассматривать как морфотип обратимо метаболически покоящихся клеток, образующихся из П, длительно выживающих в неростовых условиях в природных экосистемах и обеспечивающих как сохранение, так и распространение вида как у сапротрофных, так и патогенных бактерий.
Список литературы
Бухарин О.В., Гинцбург А.Л., Романова Ю.Н., Эль-Регистан Г.И. Механизмы выживания бактерий. М.: Медицина, 2005. 367 с.
Демкина Е.В., Лойко Н.Г., Мулюкин А.Л., Смирнова Т.А., Гапонов А.М., Писарев В.М., Тутельян А.В., Николаев Ю.А., Эль-Регистан Г.И. Влияние факторов врожденного иммунитета на развитие антибиотикотолерантности и выживание бактериальных популяций, подвергаемых антибиотической атаке // Микробиология. 2015. Т. 84. С. 660–672.
Demkina E.V., Loiko N.G., Mulyukin A.L., Nikolaev Y.A., El’-Registan G.I., Smirnova T.A., Gaponov A.M., Pisarev V.M., Tutel’yan A.V. Effect of inherent immunity factors on development of antibiotic tolerance and survival of bacterial potulations under antibiotic attack // Microbiology (Moscow). 2015. V. 84. P. 764–774.
Лойко Н.Г., Козлова А.Н., Николаев Ю.А., Гапонов А.М, Тутельян А.В., Эль-Регистан Г.И. Влияние стресса на образование антибиотикотолерантных клеток Escherichia coli // Микробиология. 2015. Т. 84. С. 595–609.
Loiko N.G., Kozlova A.N., Nikolaev Y.A., El’-Registan G.I., Gaponov A.M., Tutel’yan A.V. Effect of stress on emergence of antibiotic-tolerant Escherichia coli cells // Microbiology (Moscow). 2015. V. 84. P. 595–609.
Мулюкин А.Л., Козлова А.Н., Сорокин В.В., Сузина Н.Е., Чердынцева Т.А., Котова И.Б., Гапонов А.М., Тутельян А.В., Эль-Регистан Г.И. Формы выживания Pseudomonas aeruginosa при антибиотической обработке // Микробиология. 2015. Т. 84. С. 645–659.
Mulyukin A.L., Kozlova A.N., Sorokin V.V., El’-Registan G.I., Suzina N.E., Cherdyntseva T.A., Kotova I.B., Gaponov A.M., Tutel’yan A.V. Surviving forms of antibiotic treated Pseudomonas aeruginosa // Microbiology (Moscow). 2015. V. 84. P. 751–763.
Эль-Регистан Г.И., Мулюкин А.Л., Николаев Ю.А., Сузина Н.Е., Гальченко В.Ф., Дуда В.И. Адаптогенные функции внеклеточных ауторегуляторов микроорганизмов // Микробиология. 2006. Т. 75. С. 446–458.
El-Registan G.I., Mulyukin A.L., Nikolaev Yu.A., Galchenko V.F., Suzina N.E., Duda V.I. Adaptogenic functions of extracellular autoregulators of microorganisms // Microbiology (Moscow). 2006. V. 75. C. 380–389.
Balaban N., Merrin I., Chait R., Kowalik L., Leibler S. Bacterial persistence as a phenotypic switch // Science. 2004. V. 305. P. 1622–1625.
Balaban N.Q., Helaine S., Lewis K., Ackermann M., Aldridge B., Andersson D.I., Brynildsen M.P., Bumann D., Camilli A., Collins J.J., Dehio C., Fortune S., Ghigo J.M., Hardt W.D., Harms A., Heinemann M., Hung D.T., Jenal U., Levin B.R., Michiels J., Storz G., Tan M.W., Tenson T., Van Melderen L., Zinkernagel A. Definitions and guidelines for research on antibiotic persistence // Nat. Rev. Microbiol. 2019. V. 17. P. 441–448.
Bettenworth V., Steinfeld B., Duin H., Petersen K., Streit W.R., Bischofs I., Becker A. Phenotypic heterogeneity in bacterial quorum sensing systems // J. Mol. Biol. 2019. V. 431. P. 4530–4546.
Biel F.M., Allen F.A., Häse C.C Autolysis in Vibrio tubiashii and Vibrio coralliilyticus // Can. J. Microbiol. 2014. V. 60. P. 57–63.
Bigger J. Treatment of staphylococcal infections with penicillin by intermittent sterilization // The Lancet. 1944. V. 244. P. 497–500.
Canas-Duarte S.J., Restrepo S., Pedraza J.M. Novel protocol for persister cells isolation // PLoS One. 2014. V. 9. Iss. 2. e88660.
Gollan B., Grabe G., Michaux C., Helaine S. Bacterial persisters and infection: past, present, and progressing // An-nu. Rev. Microbiol. 2019. V. 73. P. 359–385.
Grice E.A., Kong H.H., Conlan S., Deming C.B., Davis J., Young A.C., Bouffard G.G., Blakesley R.W., Murray P.R., Green E.D., Turner M.L., Segre J.A. NISC Comparative Sequencing Program // Science. 2009. V. 324. P. 1190–1192.
Kaldalu N., Joers A., Ingelman H., Tenson T. A general method for measuring persister levels in Escherichia coli cultures // Bacterial Persistence. Methods and Protocols / Eds. Michiels J., Fauvart M. Humana Press, 2016. P. 29–42.
Levin-Reisman I., Ronin I., Gefen O., Braniss I., Shoresh N., Balaban N.Q. Antibiotic tolerance facilitates the evolution of resistance // Science. 2017. V. 355. P. 826–830.
Lewis K. Persister cells // Annu. Rev. Microbiol. 2010. V. 64. P. 357–372.
Lewis K., Shan Y. Why tolerance invites resistance // Science. 2017. V. 355. P. 796.
Leygeber M., Lindemann D., Sachs C.C., Kaganovitch E., Wiechert W., Nöh K., Kohlheyer D. Analyzing microbial population heterogeneity – expanding the toolbox of microfluidic single-cell cultivations // J. Mol. Biol. 2019. V. 431. P. 4569–4588.
Maisonneuve E., Gerdes K. Molecular mechanisms underlying bacterial persisters // Cell. 2014. V. 157. P. 539–548.
Popp P.F., Mascher T. Coordinated cell death in isogenic bacterial populations: sacrificing some for the benefit of many? // J. Mol. Biol. 2019. V. 431. P. 4656–4669.
Post-conference report “A world without antibiotics. Conclusions from Uppsala Health Summit”. 2–3 June 2015. http://apps.who.int/medicinedocs/documents/s22152en/ s22152en.pdf.
Salina E.G., Grigorov A.S., Bychenko O.S., Skvortsova Y.V., Mamedov I.Z., Azhikina T.L., Kaprelyants A.S. Resuscitation of dormant “non-culturable” Mycobacterium tuberculosis is characterized by immediate transcriptional burst // Front. Cell Infect. Microbiol. 2019. V. 9. Art. 272. https://doi.org/10.3389/fcimb.2019.00272
Sherwood L., Willey J., Woolverton C. NIH News. Prescott’s Microbiology (9th ed.). N.Y.: McGraw Hill, 2013. P. 713–721.
Sudo S.Z., Dworkin M. Comparative biology of procaryotic resting cells // Adv. Microbiol. Physiol. 1973. V. 9. P. 153–224.
The Human Microbiome Project Consortium. Structure, function and diversity of the healthy human microbiome // Nature. 2012. V. 486. № 7402. P. 207–214.
Thomas P., Sekhar A.C., Upreti R., Mujawar M.M., Pasha S.S. Optimization of single plate-serial dilution spotting (SP-SDS) with sample anchoring as an assured method for bacterial and yeast CFU enumeration and single colony isolation from diverse samples // Biotechnol. Rep. (Amst.). 2015. V. 8. P. 45–55.
Van den Bergh B., Fauvart M., Michiels J. Formation, physiology, ecology, evolution and clinical importance of bacterial persisters // FEMS Microbiol. Rev. 2017. V. 41. P. 219–251.
Van den Bergh B., Michiels J.E., Michiels J. Experimental evolution of Escherichia coli persister levels using cyclic antibiotic treatments // Bacterial Persistence. Methods and Protocols / Eds. Michiels J., Fauvart M. Humana Press, 2016. P. 131–146.
Wilmaerts D., Windels E.M., Verstraeten N., Michiels J. General mechanisms leading to persister formation and awakening // Trends Genet. 2019. V. 35. P. 401–411.
Windels E.M., Michiels J.E., Van den Bergh B., Fauvart M., Michiels J. Antibiotics: combatting tolerance to stop resistance // mBio. 2019. V. 10. e02095-19. https://doi.org/10.1128/mBio.02095-19
Xu T., Wang X.-Y., Cui P., Zhang Y.-M., Zhang W.-H., Zhang Y. The Agr quorum sensing system represses persister formation through regulation of phenol soluble modulins in Staphylococcus aureus // Front. Microbiol. 2017. V. 8. Art. 2189. https://doi.org/10.3389/fmicb.2017.02189
Дополнительные материалы отсутствуют.


