Микробиология, 2020, T. 89, № 4, стр. 493-497
Осаждение меди в нерастворимые оксалаты термофильными Aspergillus spp., выделенными из горящих отходов добычи угля
Л. О. Соколянская a, М. В. Иванов a, О. П. Иккерт a, А. Е. Калинина a, В. А. Евсеев a, Л. Б. Глухова a, О. В. Карначук a, *
a Томский государственный университет, кафедра физиологии растений и биотехнологии
634050 Томск, Россия
* E-mail: olga.karnachuk@green.tsu.ru
Поступила в редакцию 17.03.2020
После доработки 20.03.2020
Принята к публикации 23.03.2020
Аннотация
Микромицеты способны осаждать металлы в виде нерастворимых оксалатов, участвуя в выведении металлов из круговорота и образовании вторичных минералов. Мицелиальные грибы рода Aspergillus являются модельными организмами для изучения осаждения металлов, которое имеет практическое значение для биовыщелачивания и биоремедиации. До сих пор все известные процессы биоминерализации под действием микромицетов были описаны на примере мезофильных организмов. Термофильные эукариоты могут иметь преимущество при создании биотехнологий. В этом исследовании мы сообщаем о выделении термофильных/термотолерантных Aspergillus spp. из горящих отходов добычи угля в Кузбассе и образовании ими нерастворимого оксалата меди, мулуита. Образование внеклеточных везикул, обогащенных медью, может представлять сайты нуклеации для образования кристаллов мулуита.
Исследования последних лет показали, что микромицеты способны осаждать металлы в виде нерастворимых соединений, прежде всего оксалатов (Gadd et al., 2012). Геохимическими последствиями подобных процессов является выведение металлов из круговорота и образование вторичных минералов. С точки зрения практического использования, геоактивные микромицеты находят применение в биотехнологиях обогащения металлов/металлоидов и биоремедиации. Особое внимание привлекают редкоземельные элементы. Показано, что Aspergillus niger способен осаждать и накапливать лантан (Kang et al., 2019). Модельными организмами, как для исследования биогеохимических реакций, так и разработки биотехнологий, являются микромицеты рода Aspergillus, в частности, A. niger (Ceci et al., 2015; Yang et al., 2020). Для этой группы мицелиальных грибов характерно активное образование щавелевой кислоты (H2C2O4), которая обладает высокой хелатирующей способностью по отношению к металлам и переводит их в нерастворимые соединения (Gadd et al., 2014).
До сих пор все известные процессы биоминерализации под действием микромицетов были описаны на примере мезофильных организмов. Аналогично прокариотам, термофильные эукариоты могут иметь преимущество при создании биотехнологий. Термофилы составляют значительно меньшую часть всех известных культивируемых микромицетов, по сравнению с бактериями и археями (Morgenstern et al., 2012). До настоящего времени основными источниками получения культур термофильных микромицетов являются отходы сельского хозяйства, содержащие остатки растений и компост. Одной из малоизученных экосистем являются горящие отвалы угольных шахт – горельники, где термофильные/термотолерантные грибы могут колонизировать высокотемпературные биотопы. Феномен подземного горения угольных пластов широко распространен, и известны примеры в Китае, России, Индии, Германии, США и Австралии (Stracher et al., 2004). В местах, где горячие газы от сгорания угля выходят на поверхность, формируются экосистемы с повышенной температурой (>50°C). Горельники угольных месторождений потенциально могут быть населены микромицетами, чьи требования к содержанию воды в экосистеме ниже по сравнению с прокариотами. В литературе известны единичные сообщения о присутствии термофильных грибов в отходах добычи угля (Evans, 1971). Биоминерализация эукариотами может вносить вклад в образование вторичных минералов в горельниках. Ранее, при исследовании сообщества прокариот в горящих отходах добычи угля, мы обнаружили присутствие оксалата меди, мулуита (Kadnikov et al., 2018). Биогенный мулуит образовывали устойчивые к меди и условиям с низким рН мезофильные микромицеты из рода Penucillium, выделенные из отходов добычи полиметаллов (Glukhova et al., 2018).
Целью настоящего исследования было выделение термофильных/термотолерантных микромицетов, устойчивых к меди, из горящих отходов добычи угля и изучение их возможности связывать Cu в нерастворимые соединения.
Объектом исследования были культуры микромицетов, выделенные из горящих отвалов угля на месторождении Бунгурский Северный (пос. Листвяги, Кемеровская область). Пробы грунта были отобраны на склонах отвалов с выходами подземного горения в виде фумарол, оконтуренных кристаллами серы. Температура в местах выхода составляла от 50 до 90°С. Пробы отбирали в июле и ноябре 2018 и октябре 2019 года. Посевы микромицетов проводили как на агаризованную среду, так и с использованием специализированных “ловушек” для мицелия. В качестве питательной среды использовали твердую среду Чапека с мальтозой, а также среду, предложенную Тсуджияма и соавт. (Tsujiyamа et al., 2013). Последующие выделения чистой культуры проводили на жидкой среде. Для подавления роста бактерий в среду вносили хлорамфеникол в концентрации 200 мг/л. Посевы инкубировали при температурах 50, 55 и 60°С.
Для определения филогенетического положения использовали молекулярные маркеры: последовательности генов 18S рРНК и межспейсерного региона (ITS), а также рекомендованные для Aspergillus белковые маркеры: BenA (β-тубулин), CaM (калмодулин) и RPB2 (большая субъединица РНК-полимеразы). ДНК из мицелия выделяли набором MO BIO PowerSoil DNA Kit (“MO BIO Laboratories”). Праймеры и условия амплификации маркерных последовательностей описаны ранее (Glukhova et al., 2018), также как и детали сканирующей электронной микроскопии, совмещенной с элементным анализом (SEM-EDS) и дифракционный анализ (XRD) (Ikkert et al., 2013).
Элементный анализ проб горельников на месторождении Бунгурский Северный показал присутствие в них железа и меди. Содержание последней достигало 2 ат. %) в образцах RBS-1, RBS-2 и RBS-3. Дифракционный анализ не подтвердил присутствие оксалата меди, мулуита. Основные кристаллические фазы были представлены алюмосиликатами, также присутствовал характерный для горящих отходов угля гипс. Из проб горельников были получены 10 изолятов микромицетов, наиболее активный рост которых наблюдали при температуре 50°С. Определение последовательности ITS показало, что все изоляты относились к порядку Eurotiales. Ближайшими родственниками термотолерантных грибов были Aspergillus fumigatus и Aspergillus neollipticus, сходство последовательностей с которыми составляло 100% у большинства выделенных штаммов. Микромицеты, растущие при температуре 50°С, родственные A. fumigatus впервые выделены из горящих отходов добычи угля. Хорошо известно, что последовательность ITS является высококонсервативной у Aspergillus и не позволяет дифференцировать виды (Samson et al., 2014; Chen et al., 2017). Дополнительное определение последовательностей белковых маркеров CaM, BenA и RPB2, рекомендованных для филогенетического анализа рода Aspergillus, показало, что некоторые из изолятов могут представлять новые виды.
Три штамма, обозначенные RBS-31, RBS-32 и RBS-33 и способные к росту в присутствие 11 г Cu/л, были выбраны для дальнейших экспериментов по осаждению меди. Штаммы Aspergillus sp. RBS-31 и Aspergillus sp. RBS-32 по классификации предложенной Cooney и Emerson (Cooney, Emerson, 1964) и используемой в современных исследованиях (De Oliveira et al., 2015), относятся к термофилам, так как их максимальная температура для роста составляла 50°С, а минимальная была выше 20°С. Оптимум для штамма RBS-31 составлял 45°С, а для штамма RBS-32 – 37°С. Изолят RBS-33 относился к термотолерантным организмам с оптимумом 26°С, но был способен к росту в широком диапазоне температур от 5 до 55°С.
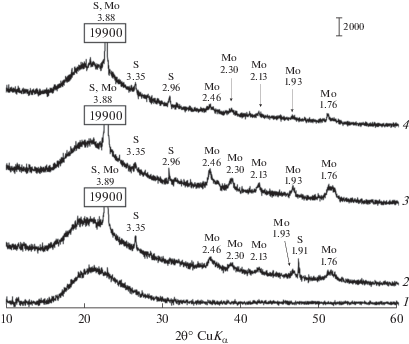
Эксперименты по выращиванию изолятов Aspergillus в присутствие 11 г Cu/л (в виде CuSO4 · 5H2O), проводили на среде Чапека с мальтозой при температуре 50°С и рН 2.5 (рН доводили 0.1 н раствором H2SO4). Ранее мы продемонстрировали образование мулуита мезофильными Penicillium, происходящее в условиях с низким рН (Glukhova et al., 2018). Высокая концентрация протонов является характерной особенностью не только отходов сульфидных месторождений, но и добычи угля, где активно окисляется сульфид железа, пирит. Дифрактограммы мицелия всех трех штаммов после культивирования в течение 35 сут показали присутствие выраженных диагностических пиков оксалата меди, мулуита (CuC2O4 · H2O) (рис. 1). Кристаллическая фаза в химическом контроле без микромицетов не была обнаружена, что свидетельствует о биогенном происхождении мулуита в экспериментальных образцах.
Рис. 1.
Дифрактограммы твердых фаз из мицелия трех штаммов термофильных/термотолерантных Aspergillus spp.: 1 – химический контроль без инокулята; 2 – Aspergillius sp. RBS-31; 3 – Aspergillius sp. RBS-32; 4 – Aspergillius sp. RBS-33. Mo – мулуит, CuC2O4 · H2O.
Электронно-микроскопический анализ мицелия показал, что все три штамма образуют внеклеточные везикулы, обогащенные медью, содержание которой достигало 46.9 ат. % (рис. 2). Ранее мы продемонстрировали механизм детоксикации меди путем образования внеклеточных везикул для мезофильных Penicillium spp., обитающих в кислых шахтных дренажах (Glukhova et al., 2018). Высокая концентрация таких металлов, как железо и медь характерна не только для мест добычи сульфидных руд, но для угольных месторождений. Определение молекулярных и атомных весов элементов везикул (SEM-EDS) в наших экспериментах показали, что обнаруженные внеклеточные везикулы значительно обогащены медью, и соотношение атомного веса элементов в них не соответствует таковому в молекуле мулуита. Связанные с мицелием везикулы могут служить сайтами нуклеации для дальнейшего образовании кристаллов мулуита. Для Aspergillus хорошо известен механизм детоксификации меди, связанный с выведением ее избытка АТФазой Р-типа AfCrpA (Antsotegi-Uskola et al., 2020). Для A. fumigatus с помощью флуоресцентной метки была показана связь AfCrpA с внутриклеточными везикулами, напоминающими вакуолярные компоненты. Авторы предполагают, что синтезированный de novo CrpA перемещается от комплекса Гольджи к мембранам клеток в условиях повышенной концентрации меди. Экзоцитоз везикул может быть логичным завершением детоксификации меди из вакуолярных структур.
Рис. 2.
Микрофотографии мицелия и внеклеточных везикул, сканирующий электронный микроскоп, напыление золотом (а) и элементный анализ в везикулах Aspergillus spp. RBS-32 (б). Значения показаны для везикулы, обозначенной знаком “+”. В таблице показан атомный процент элементов.

Таким образом, мы впервые показали, что термофильные/термотолерантные Aspergillus spp. присутствуют в горящих отходах добычи угля и могут связывать медь в виде малорастворимого кристаллического мулуита. Очевидно, что мулуит является минорным компонентом в отходах добычи угля вследствие невысокого содержания меди, поэтому мы не смогли зафиксировать его присутствие в горельниках на месторождении Бунгурский Северный. Мулуит был ранее обнаружен нами в одной из девяти исследованных проб горельников угля на месторождении Чаган-Узун на Алтае, проанализированных методом дифракционного анализа (Glukhova et al., 2018).
Список литературы
Antsotegi-Uskola M., Markina-Iñarrairaegui A., Ugalde U. New insights into copper homeostasis in filamentous fungi // Int. Microb. 2020. V. 23. P. 65–73.
Evans H.C. Thermophilous fungi of coal spoil tips: II. Occurrence, distribution and temperature relationships // Trans. Brit. Mycol. Soc. 1971. V. 57. P. 255–266.
Ceci A., Kierans M., Hillier S., Persiani A.M., Gadd G.M. Fungal bioweathering of mimetite and a general geomycological model for lead apatite mineral biotransformations // Appl. Environ. Microbiol. 2015. V. 81. P. 4955–4964.
Chen A.J., Hubka V., Frisvad J.C., Visagie C.M., Houbraken J., Meijer M., Varga J., Demirel R., Jurjević Ž., Kubátová A., Sk-lenář F., Zhou Y.G., Samson R.A. Polyphasic taxonomy of Aspergillus section Aspergillus (formerly Eurotium), and its occurrence in indoor environments and food // Stud. Mycol. 2017. V. 88. P. 37–135.
Cooney D.G., Emerson R. Thermophilic fungi: An account of their biology, activities, and classification // Thermophilic Fungi. An Account of Their Biology, Activities, and Classification. XII / Eds. Freeman W.H. & Comp. San Francisco u. London, 1964. Sh. 36. https://doi.org/10.1002/jobm.19660060212
De Oliveira T.B., Gomes E., Rodrigues A. Thermophilic fungi in the new age of fungal taxonomy // Extremophiles. 2015. V. 19. P. 31–37.
Glukhova L.B., Frank Y.A., Danilova E.V. Avakyan M.R., Tuovinen O.H., Karnachuk O.V. Isolation, characterization, and metal response of novel, acid tolerant Penicillium spp. from extremely metal-rich waters at a mining site in Transbaikal (Siberia, Russia) // Microb. Ecol. 2018. V. 76. P. 911–924.
Gadd G.M., Rhee Y.J., Stephenson K., Wei Z. Geomycology: metals, actinides and biominerals // Environ. Microbiol. Rep. 2012. V. 4. P. 270–296.
Gadd G.M., Bahri-Esfahani J., Li Q.W., Rhee Y.J., Wei Z., Fomina M., Liang X.J. Oxalate production by fungi: significance in geomycology, biodeterioration and bioremediation // Fungal. Biol. Rev. 2014. V. 28. P. 36–55.
Ikkert O.P., Gerasimchuk A.L., Bukhtiyarova P.A., Tuovinen O.H., Karnachuk O.V. Characterization of precipitates formed by H2S-producing, Cu-resistant firmicute isolates of Tissierella from human gut and Desulfosporosinus from mine waste // Antonie van Leeuwenhoek. 2013. V. 103. P. 1221–1234.
Kadnikov V.V., Mardanov A.V., Ivasenko D.A., Antsiferov D.V., Beletsky A.V., Karnachuk O.V., Ravin N.V. Lignite coal burning seam in the remote Altai Mountains harbors a hydrogen-driven thermophilic microbial community// Sci. Rep. 2018. V. 8. Article 6730.
Kang X., Csetenyi L., Gadd GM. Biotransformation of lanthanum by Aspergillus niger // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 981–993.
Morgenstern I., Powlowski J., Ishmael N., Darmond C., Marqueteau S., Moisan M.C., Quenneville G., Tsang A. A molecular phylogeny of thermophilic fungi // Fungal Biol. 2012. V. 116. P. 489–502.
Samson R.A., Visagie C.M., Houbraken J., Hong S.B., Hubka V., Klaassen C.H., Perrone G., Seifert K.A., Susca A., Tanney J.B., Varga J., Kocsubé S., Szigeti G., Yaguchi T., Frisvad J.C. Phylogeny, identification and nomenclature of the genus Aspergillus // Stud. Mycol. 2014. V. 78. P. 141–173.
Stracher G. B., Taylor T.P. Coal fires burning out of control around the world: thermodynamic recipe for environmental catastrophe // Int. J. Coal Geol. 2004. V. 59. P. 7–17.
Tsujiyama S., Muraoka T., Takada N. Biodegradation of 2,4-dichlorophenol by shiitake mushroom (Lentinula edodes) using vanillin as an activator // Biotechnol. Lett. 2013. V. 35. P. 1079–1083.
Дополнительные материалы отсутствуют.


