Микробиология, 2020, T. 89, № 5, стр. 522-534
Масс-спектрометрический анализ кислых экзоолигосахаридов клубеньковых бактерий Rhizobium leguminosarum bv. viciae VF39
А. Ш. Канапина a, *, В. В. Марченков b, А. К. Сурин c, Т. В. Ивашина a
a ФИЦ ПНЦБИ РАН Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина
Российской академии наук
142290 Пущино, Россия
b ФГБУ Институт белка Российской академии наук
142290 Пущино, Россия
c ФГБУ Институт биоорганической химии им. академиков М.М. Шемякина и Ю.А. Овчинникова
Российской академии наук
142290 Пущино, Россия
* E-mail: doc.asya63@rambler.ru
Поступила в редакцию 13.03.2020
После доработки 29.04.2020
Принята к публикации 30.04.2020
Аннотация
С использованием методов масс-спектрометрии и HCD-фрагментации ионов определены структуры низкомолекулярных экзоолигосахаридов, продуцируемых симбиотическими азотфиксирующими бактериями Rhizobium leguminosarum bv. viciae VF39. Показано, что экзоолигосахариды являются мономерами, димерами и тримерами повторяющегося октасахаридного звена кислого высокомолекулярного экзополисахарида. Мажорная фракция представлена мономерами октасахарида с двумя остатками глюкуроновой кислоты на восстанавливающем конце. В культуральной жидкости обнаружены также гептасахариды, соответствующие октасахаридному звену, лишенному остатков GlcA-с или Glc-b в главной цепи. Выявлена гетерогенность экзоолигосахаридов по содержанию О‑ацетильных и гидроксибутаноильных заместителей.
Формирование симбиоза является многоэтапным процессом координированного взаимодействия клубеньковых бактерий и бобовых растений, в ходе которого происходит обмен молекулярными сигналами между партнерами, приводящий к дифференциальной экспрессии генов у обоих симбионтов. Результатом такого взаимодействия является образование азотфиксирующего клубенька, который можно рассматривать как новый специализированный орган растений. Одним из важнейших факторов формирования симбиоза является синтез бактериями семейства Rhizobiaceae экзополисахаридов (ЭПС).
Как и у многих микроорганизмов, экзополисахариды ризобий участвуют в защите бактерий от абиотических стрессов, образовании биопленок и подавлении защитных систем растения-хозяина (Marczak et al., 2017). Мутации, блокирующие синтез ЭПС у клубеньковых бактерий, нарушают и образование азотфиксирующих (Fix+) клубеньков недетерминированного типа в симбиозе с такими бобовыми растениями, как Medicago, Trifolium, Vicia, Pisum, Astragalus (Leigh et al., 1987; Rolfe et al., 1996; Cheng, Walker, 1998). В частности, установлено, что у Exo–-мутантов нарушены ранние этапы формирования симбиоза, а именно, инициация и элонгация инфекционных нитей. На более поздних стадиях симбиоза ЭПС защищает микросимбионт от бактерицидного действия NCR (nodule-specific cysteine-rich) пептидов растительного происхождения (Arnold et al., 2018). Последние исследования свидетельствуют о том, что экзополисахариды необходимы и при установлении симбиозов детерминированных типов с Lotus, Phaseolus, Glycine. Так, показано, при инокуляции Lotus corniculatus и L. japonicus мутантным по синтезу ЭПС штаммом Mezorhizobium loti наблюдается блок не только на стадии развития инфекционных нитей, но и на стадии освобождения бактерий из инфекционных нитей в клетки растений (Kelly et al., 2013).
Клубеньковые бактерии продуцируют две формы ЭПС, отличающиеся степенью полимеризации повторяющихся звеньев: высокомолекулярные ЭПС и низкомолекулярные экзоолигосахариды (ЭОС) (Djordjevic et al., 1987; Gonzalez et al., 1998; Staehelin et al., 2006). У штаммов Sinorhizobium meliloti – симбионтов люцерны – ЭОС представляют собой мономеры, димеры и тримеры повторяющегося октасахаридного звена сукциногликана (ЭПСI) (Wang et al., 1999). Низкомолекулярная фракция экзополисахарида штамма Rhizobium sp. GRH2 состоит из димеров повторяющегося октасахаридного звена кислого ЭПС (Lopez-Lara et al., 1993). У Rhizobium sp. NGR234 ЭОС представлены мономерами ЭПС, содержащими девять моносахаридных остатков, и их октасахаридными производными (Staehelin et al., 2006).
Роль ЭОС в симбиозе не выяснена. Известно, что добавление определенных фракций ЭОС при инокуляции растений штаммами ризобий, у которых блокирован синтез ЭПС, восстанавливает способность этих бактерий образовывать азотфиксирующие клубеньки (Djordjevic et al., 1987; Urzainqui et al., 1992; Gonzalez et al., 1996). Эти данные позволили предположить, что ЭОС наряду с липохитоолигосахаридами (Nod-факторами) могут выполнять функцию сигнальных молекул при органогенезе азотфиксирующих клубеньков. У S. meliloti биологически активными являются тримеры повторяющегося звена ЭПСI (Wang et al., 1999). Выявлена корреляция между структурой ЭОС и специфичностью взаимодействия микросимбионта с растениями-хозяевами (Simsek et al., 2007). При этом существенным фактором является наличие и количество в составе ЭОС S. meliloti неуглеводных заместителей, в частности, сукцинильной группы (Simsek et al., 2013). Следует, однако, отметить, что для отдельных пар микро- и макросимбионтов отсутствие ЭОС лишь снижает эффективность симбиоза, и достаточным условием для его установления является наличие модифицированного высокомолекулярного ЭПС (Mendis et al., 2016).
Ранее нами было показано, что клубеньковые бактерии Rhizobium leguminosarum bv. viciae VF39 синтезируют кислый высокомолекулярный гетерополисахарид, необходимый для азотфиксирующего симбиоза с Pisum sativum, Vicia faba и V. sativa (Ivashina et al., 1994). Повторяющееся звено ЭПС является разветвленным октасахаридом, содержащим 5 остатков D-глюкозы, 2 остатка D-глюкуроновой кислоты и остаток D-галактозы (рис. 1). Октасахарид модифицирован двумя остатками ацеталя пировиноградной кислоты (Pyr), О-ацетильными (Ac) и гидроксибутаноильной группами (Hb) (http://csdb.glycoscience.ru/, CSDB ID 25288, Ivashina et al., 2010). Сходные по структуре ЭПС синтезируются и близкородственными штаммами R. leguminosarum (Ivashina, Ksenzenko, 2012).
Рис. 1.
Структура повторяющегося звена кислого экзополисахарида, синтезируемого штаммом R. leguminosarum bv. viciae VF39.
Структуры ЭОС у штаммов Rhizobium leguminosarum различных биоваров к настоящему времени не определены и механизмы их функционирования в симбиозе не изучены. В связи с этим, целью работы было определение структурных особенностей низкомолекулярных форм кислых полисахаридов у симбиотических азотфиксирующих бактерий R. leguminosarum bv. viciae VF39.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы и условия их культивирования. Объектами исследования являлись штамм Rhizobium leguminosarum bv. viciae VF39RifR (далее Rlv VF39) (Ivashina et al., 1994) и его производные с мутациями в генах глюкуронозил-(β-1,4)-глюкозилтрансферазы PssE (Ivashina et al., 2010) и глюкансинтазы NdvB (данная работа). Для трансформации и выделения плазмидной ДНК использовали штамм Escherichia coli DH5α (“Novagen”, США). Конъюгативный перенос плазмиды в клетки Rlv VF39 осуществляли из штамма E. coli S17-1 (Simon et al., 1983). Для стандартного культивирования ризобий использовали среду TY (Beringer, 1974). Для выделения полисахаридов штаммы выращивали в синтетической среде BMM (Ivashina et al., 2010), содержащей D-маннит в концентрации 5 г/л. Бактерии E. coli культивировали в среде LB (Sambrook et al., 1989). Концентрации антибиотиков в селективных средах для E. coli и Rhizobium составляли, соответственно, (мкг/мл): тетрациклина – 10 и 5, канамицина – 20 и 60, рифампицина – 25.
Конструирование штамма с мутацией в гене ndvB осуществляли путем замещения аллеля гена дикого типа на его мутантный аллель в результате гомологичной рекомбинации. Для введения мутации в ген ndvB, кодирующий глюкансинтазу, сконструирована плазмида pEX∆ndvB-Km. Фрагмент ДНК длиной 6748 п.н., содержащий ОРС ndvB с окаймляющими последовательностями геномной ДНК, амплифицировали с использованием праймеров ndvB_f (AAGAATTCAACCAGCACGCCAAATG) и ndvB_r (TTGGTACCCCCACCTTCCGCA) и клонировали в векторе pEX18Tc (Hoang et al., 1998) по сайтам EcoRI и KpnI. В результате была получена плазмида pEXndvB. Для введения делеции длиной 1296 п.н. в ген ndvB плазмиду pEXndvB гидролизовали эндонуклеазой рестрикции XhoI, два сайта которой расположены в кодирующей последовательности гена, и лигировали в условиях образования кольцевых молекул. Для маркирования делеции и последующей селекции мутантов в XhoI-сайт вводили KmR-кассету из плазмиды pUC4K (“Pharmacia LKB”, Швеция). Конъюгативный перенос плазмиды pEX∆ndvB-Km в клетки штамма Rlv VF39 осуществляли из штамма E. coli S17-1 с отбором RifRTcSKmRSucR-клонов. Наличие мутации подтверждали методом ПЦР с использованием праймеров ndvB_f и nd-vB_r.
Выделение полисахаридов. Культуру бактерий, выращенную в среде TY до ранней стационарной фазы, вносили в 50 мл среды BMM до начальной оптической плотности 0.1. Бактерии выращивали в течение 4 сут при 28°С в колбах объемом 750 мл на роторной качалке (200 об./мин). Клетки дважды осаждали центрифугированием при 8000 об./мин (“Beckman J2-21”, США) в течение 30 мин при 4°С. Высокомолекулярные формы экзополисахарида осаждали из надосадочной жидкости добавлением 3-х объемов 96% этанола с последующим центрифугированием при 13 000 об./мин в течение 1 ч при 4°С. Супернатант, содержащий экзоолигосахариды, концентрировали на роторном испарителе. ЭОС осаждали добавлением 10 объемов охлажденного 96% этанола с последующим центрифугированием при 19 000 об./мин в течение 1 ч при 4°С (“Beckman J2-21”) и хранили при –20°С.
Концентрацию сахаров определяли антроновым методом (Loewus, 1952). Для построения калибровочных кривых использовали растворы D-глюкозы в диапазоне концентраций 20–200 мкг/мл.
Ионообменную хроматографию низкомолекулярных олигосахаридов выполняли на ВЭЖ хроматографе ProStar (“Varian”, США). Образец ЭОС (2.4 мг в 20 мМ трис-HCl буфере, pH 8.0) наносили на колонку MonoQ 5/50 GL (“GE Healthcare”, Швеция). Для удаления не связавшихся нейтральных сахаридов колонку промывали этим же буфером. Кислые ЭОС элюировали линейным градиентом NaCl (0–0.35 М) в 20 мМ трис-HCl буфере, pH 8.0. Скорость потока составляла 0.6 мл/мин. Начиная с 3-ей минуты, собирали 72 фракции по 0.4 мл и анализировали на присутствие углеводов антроновым методом. Фракции, образующие один пик, объединяли. Олигосахариды осаждали 10 объемами охлажденного 96% этанола, растворяли в 500 мкл 0.1 M NH4ОAc буфера, pH 6.9 и фракционировали с помощью гель-филь-трации.
Гель-фильтрацию ЭОС проводили на колонке Superdex Peptide 10/300 GL (“GE Healthcare”, Швеция) с использованием хроматографа ProStar (“Varian”, США). В качестве элюента использовали 0.1 M NH4ОAc, pH 6.9. Скорость потока составляла 0.6 мл/мин. Начиная с 12-й минуты, собирали 30 фракций по 500 мкл. Фракции из одного хроматографического пика объединяли, ЭОС осаждали 10 объемами 96% этанола и лиофилизировали.
Масс-спектрометрический анализ экзоолигосахаридов выполняли в режиме регистрации отрицательных ионов на приборе Orbitrap ELITE (“Thermo Scientific,” Германия), снабженном источником ионизации нанораспылением (NSI). ЭОС растворяли в смеси 30% ацетонитрил, 0.1% муравьиная кислота и 10 мМ NH4HCO3. Ввод образца ЭОС (50–200 пмоль/мкл) выполняли с помощью боросиликатного эмиттера (“Thermo Scientific”, США). Напряжение на входном конусе во время ионизации образцов варьировали в диапазоне 0.9–1.3 кВ. Температура прогреваемого капилляра составляла 200°С. Панорамное сканирование для регистрации ионов выполнялось в диапазоне m/z 500–4000. Для получения MS/MS спектров использовали режим HCD (диссоциация, активированная соударением в высокоэнергетической камере) с диапазоном сканирования ионизированных фрагментов с m/z 100–2000. Нормализованная энергия столкновений HCD составляла 25–50%. Все измерения выполняли при разрешении не ниже 200 000. Масс-спектры регистрировали и обрабатывали с использованием стандартного программного обеспечения от производителя (“Xcalibur 2.2”). При расчете молекулярных масс ионов ЭОС и их фрагментов использовали следующие значения: D-глюкоза (Glc) – 180.06 Да, D-галактоза (Gal) – 180.06 Дa, D-глюкуроновая кислота (GlcA) – 194.04 Да, пирувил (Pyr) – 72.02 Да, О-ацетил (Ac) – 43.02 Да, гидроксибутаноил (Hb) – 87.04 Да. В зависимости от типа рассматриваемого масс-спектра, панорамный спектр или спектр фрагментации, мы использовали массы углеводов с учетом потери одной или двух молекул воды.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Фракционирование экзоолигосахаридов. Для анализа секретируемых в культуральную среду полисахаридов бактерии Rlv VF39 выращивали в синтетической среде BMM. Анализ культуральной жидкости на присутствие полисахаридов после осаждения и удаления высокомолекулярного ЭПС выявил наличие низкомолекулярных полисахаридов, концентрация которых была сопоставима с концентрацией высокомолекулярного ЭПС (соответственно, 598 ± 86 и 586 ± 26 мкг/мл). Суммарный препарат экзоолигосахаридов был разделен с помощью анионообменной хроматографии на колонке MonoQ 5/50GL. В результате показано, что только 70% ЭОС связывалось с носителем. Возможно, как и в случае других штаммов ризобий, не связавшиеся ЭОС представляют собой нейтральные полисахариды или β-глюканы (Breedveld, Miller, 1994).
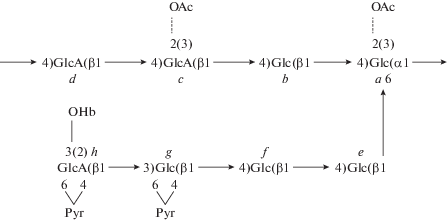
Известно, что помимо нейтральных глюканов штаммы S. meliloti, R. leguminosarum bv. viciae и R. leguminosarum bv. trifolii синтезируют глицерофосфорилированные β-1,2-глюканы (Zevenhuizen et al., 1990; Breedveld, Miller, 1994; Mendis et al., 2016). Сравнительный хроматографический анализ экзоолигосахаридов, продуцируемых штаммом дикого типа и его мутантами c полностью блокированным синтезом кислого ЭПС (pssE) и глюканов (ndvB) (рис. 2), позволил заключить, что наблюдаемые на хроматограмме ЭОС штамма Rlv VF39 являются формами кислого ЭПС c разной степенью полимерности (рис. 2а).
Рис. 2.
Ионообменная хроматография экзоолигосахаридов штамма Rlv VF39 (а) и его производных с мутациями в генах pssE (б) и ndvB (в) на колонке MonoQ 5/50 GL. (◻) – профиль элюции ЭОС по данным антронового теста.
( ) – фракции ЭОС, формирующие пики М1–М4, объединяли и фракционировали с помощью гель-фильтрации.
) – фракции ЭОС, формирующие пики М1–М4, объединяли и фракционировали с помощью гель-фильтрации.
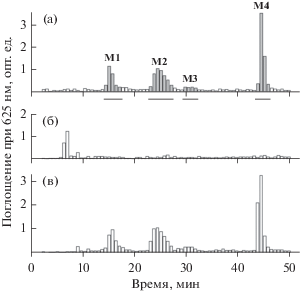
В профиле элюции ЭОС штамма Rlv VF39 можно выделить 4 основных пика: М1–М4 (рис. 2а). ЭОС из отдельных пиков М1–М4 были дополнительно фракционированы с помощью гель-фильтрации (рис. 3). При этом была выявлена относительная однородность исследуемых олигосахаридов: большая часть ЭОС из пиков М1 и М2 формировали на гель-хроматограммах мажорные пики S1 и S2, максимумы которых приходились соответственно на 22.5 и 18.5 минуты элюции (рис. 3а, 3б). Наибольшее количество ЭОС из пика М3 элюировалось между 16 и 18 минутами (пик S3, рис. 3в). ЭОС из пика М4 элюировались практически в свободном объеме колонки, что свидетельствовало об их большой молекулярной массе (пик S4, рис. 3г). Высокая степень полимерности ЭОС из пика S4 подтверждена фракционированием на колонке Superdex 200 10/300 GL (данные не представлены). Основываясь на результатах ионообменного фракционирования и масс-спектрометрического анализа ЭОС, полученных при гидролизе высокомолекулярного ЭПС штамма Rlv VF39 гликозилгидролазой PssW (неопубликованные данные), мы предположили, что олигосахариды из пиков S1, S2 и S3 являются, соответственно, мономерами, димерами и тримерами повторяющегося октасахаридного звена кислого ЭПС (рис. 3). Это предположение подтверждено результатами масс-спектрометрического анализа. ЭОС из пика S4 в силу их высокой полимерности были исключены из хода дальнейших исследований.
Рис. 3.
Гель-фильтрация кислых экзоолигосахаридов из пиков М1 (а), М2 (б), М3 (в) и М4 (г)
на колонке Superdex Peptide 10/300 GL. (◻) – профиль элюции ЭОС по данным антронового
теста. ( ) – фракции ЭОС, формирующие пики S1, S2 и S3, объединяли и анализировали методом
масс-спектрометрии.
) – фракции ЭОС, формирующие пики S1, S2 и S3, объединяли и анализировали методом
масс-спектрометрии.
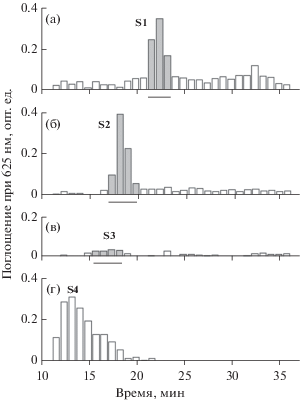
Масс-спектрометрический анализ экзоолигосахаридов пика S1. На масс-спектре олигосахаридов из пика S1 выявлены три серии двухзарядных отрицательных ионов (рис. 4). Установлено, что серия ионов с m/z 731.19, 752.20, 773.20, 774.21, 795.21 и 816.22 соответствует дегидратированным ионам октасахаридного звена (М8) высокомолекулярного ЭПС, содержащего два остатка пировиноградной кислоты, и отличающихся степенью ацетилирования и наличием Hb-группы (табл. 1). Кроме того, идентифицированы ионы гидратированной формы октасахарида (${\text{M}}_{{\text{8}}}^{{\text{h}}}$) с соответствующими модификациями, а также ионы их Na+ и K+ аддуктов. Группу мажорных ионов составляют ионы октасахаридов с одной ацетильной группой (M8Ас), с ацетильной и гидроксибутаноильной группами (M8АсHb), а также ионы октасахарида (M8). Ионы октасахаридов M8Ас2, M8Hb и M8Ас2Hb присутствовали в значительно меньших количествах (табл. 1).
Рис. 4.
Фрагмент NSI масс-спектра экзоолигосахаридов из хроматографического пика S1. Обозначены двухзарядные отрицательные ионы октасахарида М8 и его модифицированных производных, а также ионы гидратированных форм гептасахаридов $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ и $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}.$ M – олигосахарид, содержащий две Pyr группы; h и ⚫ – гидратированные формы и Na+ аддукты соответственно. аM7 и bM7 – гептасахариды, лишенные остатков глюкуроновой кислоты (GlcA-c, ∆ 158.02 Да) и глюкозы (Glc-b, ∆144.04 Да) соответственно.
Таблица 1.
Двухзарядные отрицательные ионы октасахарида и его модифицированных вариантов
| Формула | m/z | Mw | Интенсивность*, % | ||||
|---|---|---|---|---|---|---|---|
| [M – 2H]2– | [Mh – 2H]2– | [M – 3H + Na]2– | [Mh – 3H + Na]2– | [M – 3H + K]2– | |||
| M8 | 731.19 | 740.20 | 742.18 | 751.19 | 750.16 | 1464.38 | 75 |
| M8Ac | 752.20 | 761.20 | 763.19 | 772.19 | 771.17 | 1506.40 | 100 |
| M8Ac2 | 773.20 | 782.21 | 784.19 | 793.20 | 792.17 | 1548.40 | 25 |
| M8Hb | 774.21 | – | 785.20 | 794.21 | 793.18 | 1550.42 | 15 |
| M8AcHb | 795.21 | 804.22 | 806.20 | 815.21 | 814.19 | 1592.42 | 78 |
| M8Ac2Hb | 816.22 | – | 827.21 | 836.22 | 835.18 | 1634.44 | 8 |
Две другие серии ионов с m/z 652.18, 673.18, 695.20, 716.20 и 659.17, 680.17, 701.18, 702.19, 723.19, 744.20 представлены двухзарядными ионами гептасахаридов $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 652.18) и $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 659.17). У гептасахаридов из четырех гексоз главной цепи октасахаридного звена ЭПС отсутствуют либо остаток GlcA-с ($^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$), либо остаток Glc-b ($^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$). На это указывают значения ∆158.02 Да (GlcA) и ∆144.04 Да (Glc) между ионами с m/z 652.18 и m/z 659.17 соответствующих гептасахаридов и ионом октасахарида М8 (m/z 731.19). Из двух гептасахаридов мажорным является $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}.$ Ионы гептасахарида $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ с двумя Ac группами ($^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ас2 и $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ас2Hb) обнаруживаются в следовых количествах, а $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac2 и $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac2Hb отсутствуют (табл. 2).
Таблица 2.
Двухзарядные отрицательные ионы гептасахаридов и их модифицированных вариантов
| Формула | m/z | Mw | Интенсивность*, % | ||
|---|---|---|---|---|---|
| [M – 2H]2– | [M – 3H + Na]2– | ||||
| –GlcA | $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 652.18 | – | 1306.36 | 6.2 |
| $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac | 673.18 | – | 1348.37 | 1.5 | |
| $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Hb | 695.20 | – | 1392.40 | 0.1 | |
| $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$AcHb | 716.20 | – | 1434.41 | 0.4 | |
| –Glc | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 659.17 | 670.16 | 1320.34 | 18 |
| $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac | 680.17 | 691.16 | 1362.35 | 6 | |
| $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac2 | 701.18 | 712.17 | 1404.36 | 0.03 | |
| $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Hb | 702.19 | 713.18 | 1406.38 | 23 | |
| $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$AcHb | 723.19 | – | 1448.39 | 6.3 | |
| $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Ac2Hb | 744.20 | – | 1490.40 | Следы | |
Примечание. Обозначения как в табл. 1.
Результаты HCD фрагментации подтвердили наши предположения относительно состава ЭОС из пика S1 и позволили получить дополнительные сведения об их структуре. Так, фрагментация двухзарядного отрицательного иона октасахарида М8 (m/z 731.19) приводила к отщеплению одного или двух остатков GlcA, в результате чего на спектре появлялись пики ионов $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 1305.36) и $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 1129.33) (рис. 5а). В главной цепи этих олигосахаридов помимо остатка Glc-a с присоединенной боковой цепью сохранялся второй остаток Glc-b (рис. 1). Отщепление остатка Glc-b зафиксировано при фрагментации двухзарядного гидратированного иона октасахарида (${\text{M}}_{{\text{8}}}^{{\text{h}}},$ m/z 740.19) (рис. 5б). В доминирующей на спектре серии однозарядных ионов идентифицирован пик иона пентасахарида (${\text{M}}_{{\text{5}}}^{{\text{h}}}$) c m/z 967.28, у которого помимо двух остатков GlcA отсутствует и остаток Glc-b.
Рис. 5.
Спектры HCD фрагментации двухзарядных отрицательных ионов октасахарида М8 c m/z 731.19 (a) и его гидратированной формы ${\text{M}}_{{\text{8}}}^{{\text{h}}}$ c m/z 740.20 (б); в – схема фрагментации октасахарида. R – боковая цепь (Glc3GalPyr2). * – ионы, наблюдаемые на спектре; ( ) – ионы, образующиеся в случае расположения остатка Glc на противоположном восстанавливающем
конце октасахарида.
) – ионы, образующиеся в случае расположения остатка Glc на противоположном восстанавливающем
конце октасахарида.
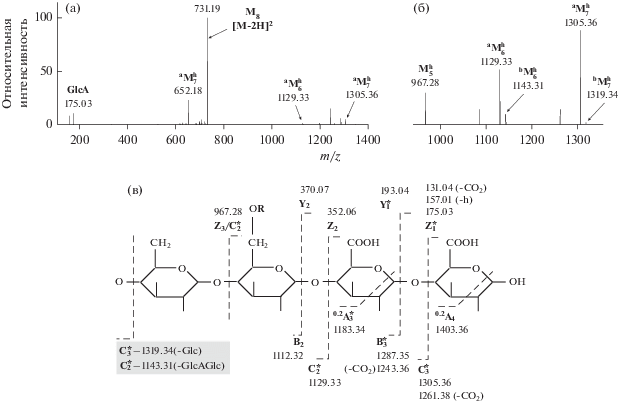
Необходимо отметить, что на этом же спектре зафиксированы пики ионов с m/z 1319.34 ($^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$) и 1143.31 ($^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$). Известно, что в достаточно мягких условиях фрагментации первыми разрываются гликозидные связи, прилежащие к восстанавливающему концу олигосахарида. Таким образом, обнаружение ионов с m/z 1319.34 и 1143.31 допускает существование мономеров, у которых на восстанавливающемконце расположен остаток глюкозы. Однако интенсивность ионов $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ и $^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$ в несколько раз меньше интенсивности ионов $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 1305.36) и $^{{\text{a}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$ (m/z 1129.33). Этот факт, наряду с данными по фрагментации М8 (m/z 731.19), позволяет говорить, что основной формой мономера является октасахарид, у которого на восстанавливающем конце расположен фрагмент GlcA-GlcA. На основании данных расшифровки HCD спектров (табл. 3) предложена схема фрагментации октасахарида с использованием принятых номенклатурных обозначений (рис. 5в) (Domon, Costello, 1988).
Таблица 3.
HCD фрагментация двухзарядного отрицательного иона октасахарида М8 (m/z 731.19)
| m/z | z | Формула фрагмента |
Масса | Обозначение |
|---|---|---|---|---|
| 113.02 | (1–) | GlcA–h-CO2 | 114.02 | ${\text{*dZ}}_{{\text{1}}}^{{ - {\text{h}}}}$ |
| 157.01 | (1–) | GlcA–h | 158.01 | ${\text{Z}}_{{\text{1}}}^{{ - {\text{h}}}}$ |
| 175.03 | (1–) | GlcA | 176.03 | Z1 |
| 615.16 | (2–) | М8-(GalPyr) | 1232.32 | Y6α |
| 643.17 | (2–) | aМ7 | 1288.34 | ${\text{C}}_{{\text{3}}}^{{ - {\text{h}}}}$ |
| 652.18 | (2–) | $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ = М8-GlcA | 1306.36 | C3 |
| 659.17 | (2–) | bM7 = М8-Glc | 1320.34 | С3 |
| 700.19 | (2–) | ${\text{M}}_{{\text{8}}}^{{ - {\text{h}}}}$-CO2 | 1402.38 | d[M−h-2H]2− |
| 709.19 | (2–) | М8-CO2 | 1420.38 | d[M-2H]2− |
| 722.18 | (2–) | ${\text{M}}_{{\text{8}}}^{{ - {\text{h}}}}$ | 1446.37 | [M−h-2H]2− |
| 731.19 | (2–) | М8 | 1464.38 | [M-2H]2− |
| 967.28 | (1–) | M5h | 968.28 | Z3/C2 |
| 1129.33 | (1–) | $^{{\text{a}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$ | 1130.33 | С2 |
| 1143.31 | (1–) | bM6 | 1144.31 | С2 |
| 1183.34 | (1–) | aM7-CO2–C2H3O | 1184.34 | d0.2A3 |
| 1199.37 | (1–) | aM7-2CO2 | 1200.37 | 2dB3 |
| 1243.36 | (1–) | aM7-CO2 | 1244.36 | dB3 |
| 1261.38 | (1–) | $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$-CO2 | 1262.38 | dС3 |
| 1287.35 | (1–) | aМ7 | 1288.35 | B3 |
| 1305.36 | (1–) | $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 1305.36 | С3 |
| 1319.34 | (1–) | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 1320.34 | С3 |
Результаты фрагментации двухзарядных отрицательных ионов гептасахаридов $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 659.17) (рис. 6а) и $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Hb (m/z 702.19) подтвердили наличие в составе главной цепи гептасахарида $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ двух остатков GlcA и отсутствие остатка Glc-b (данные не представлены). Об этом свидетельствует разница в 176.03 Да (GlcA) между зафиксированными на HCD спектре ионом исходного гептасахарида и продуктами его фрагментации: гекса- ($^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$) и пентасахаридами (${\text{M}}_{{\text{5}}}^{{\text{h}}}$). Схема фрагментации и структурная формула $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}},$ а также данные расшифровки HCD спектра данного олигосахарида представлены, соответственно, на рис. 6б и в табл. 4.
Рис. 6.
а – Спектр HCD фрагментации двухзарядного отрицательного иона гептасахарида $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 659.17). Обозначены ионы гекса- ($^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$) и пентасахаридов (${\text{M}}_{{\text{5}}}^{{\text{h}}}$), лишенные одного и двух остатков GlcA соответственно. б – Схема фрагментации гептасахарида bM7. R – боковая цепь (Glc3GalPyr2). * – ионы, наблюдаемые на спектре.
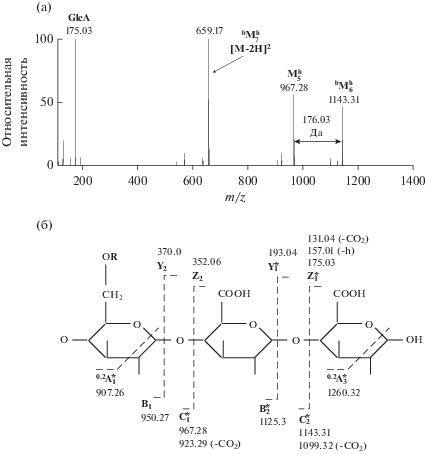
Таблица 4.
HCD фрагментация двухзарядного отрицательного иона гептасахарида $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 659.17)
| m/z | z | Формула фрагмента | Масса | Обозначение |
|---|---|---|---|---|
| 131.04 | (1–) | GlcA-CO2 | 132.04 | dZ1 |
| 157.01 | (1–) | GlcA–h | 158.01 | ${\text{Z}}_{{\text{1}}}^{{ - {\text{h}}}}$ |
| 175.03 | (1–) | GlcA | 176.03 | Z1 |
| 193.04 | (1–) | GlcA | 194.04 | Y1 |
| 543.14 | (2–) | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$-GalPyr | 1088.28 | Y6α |
| 571.15 | (2–) | $^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$ | 1144.30 | C2 |
| 629.16 | (2–) | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 1260.32 | 0.2A3 |
| 637.17 | (2–) | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$-СО2 | 1276.34 | dC2 |
| 659.17 | (2–) | $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ | 1320.34 | [M – 2H]2– |
| 907.26 | (1–) | ${\text{M}}_{{\text{5}}}^{{\text{h}}}$-С2O2H4 | 908.26 | 0.2A1 |
| 923.29 | (1–) | ${\text{M}}_{{\text{5}}}^{{\text{h}}}$-СО2 | 924.29 | dC1 |
| 967.28 | (1–) | ${\text{M}}_{{\text{5}}}^{{\text{h}}}$ | 968.28 | C1 |
| 1099.32 | (1–) | $^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$-СО2 | 1100.32 | dC2 |
| 1125.30 | (1–) | bM6 | 1126.30 | B2 |
| 1143.31 | (1–) | $^{{\text{b}}}{\text{M}}_{{\text{6}}}^{{\text{h}}}$ | 1144.31 | C2 |
Анализ спектра HCD фрагментации иона гептасахарида $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ (m/z 652.18) (данные не представлены) подтвердил наличие остатка Glc-b и отсутствие остатка GlcA-с в его составе, что объясняет отсутствие на масс-спектре $^{{\text{a}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$ с двумя Ас группами. Результаты фрагментации ионов с m/z 702.19 и 752.20, предварительно идентифицированных как ионы $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}$Hb и M8Ас, подтвердили наличие Hb и Ac групп в составе этих олигосахаридов. Необходимо отметить, что используемый в ходе HCD фрагментации энергетический режим приводил к дроблению лишь главной цепи олигосахаридов, практически не затрагивая боковой цепи. Исключение составило отщепление терминального фрагмента Gal-Pyr боковой цепи, наблюдаемое при фрагментации и M8 и $^{{\text{b}}}{\text{M}}_{{\text{7}}}^{{\text{h}}}.$
Анализ экзоолигосахаридов пика S2. Установлено, что ЭОС из пика S2 являются димерными формами октасахарида (рис. 7а). Подобно описанным выше мономерам, каждое звено димера содержало две Pyr группы. Число других неуглеводных заместителей варьировало (табл. 5). Сравнивая интенсивности сигналов, соответствующих ионам D, DAc, DAc2, DAc3, и DAc4 (табл. 5) и учитывая суперпозиции изотопных распределений ионов в разной степени модифицированных форм димеров (рис. 7б и 7в), мы обнаружили, что на спектре доминировали формы с высоким содержанием модифицирующих групп, а формы D и DAc попадали в разряд минорных. Результаты фрагментации ионов димерных форм ЭОС подтвердили наличие характерных для ЭПС неуглеводных заместителей. Показано, что мажорным является димер, на восстанавливающем конце которого расположен остаток Glc: интенсивность иона фрагмента GlcA-Glc в несколько раз превышала интенсивность иона фрагмента GlcA-GlcA (данные не представлены).
Рис. 7.
(а) Фрагмент NSI масс-спектра экзоолигосахаридов хроматографического пика S2. Представлена область двухзарядных отрицательных ионов (m/z 1460–1680); (б и в) примеры изотопного распределения ионов DAc и суперпозиции изотопных распределений ионов димеров с различным содержанием Ac и Hb групп. D – димер октасахарида, содержащий 4 Pyr-группы.
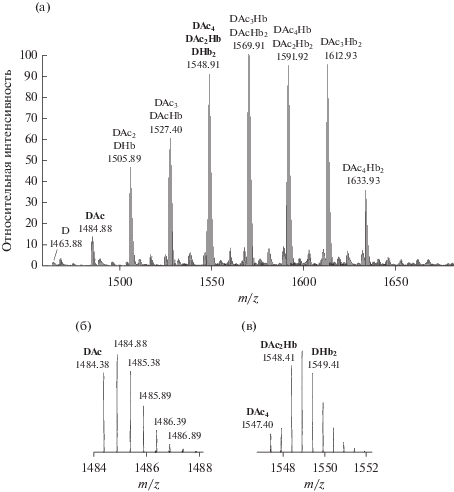
Таблица 5.
Данные NSI масс-спектра двухзарядных отрицательных ионов ЭОС из хроматографического пика S2
| Формула | m/z | Mw | Интенсивность моноизотопного пика*, % |
|---|---|---|---|
| D | 1463.38 | 2928.76 | 1.9 |
| DAc | 1484.38 | 2970.76 | 15.3 |
| DAc2 | 1505.39 | 3012.78 | 47.3 |
| DHb** | 1506.39 | 3014.78 | 3.3 |
| DAc3 | 1526.39 | 3054.80 | 57.5 |
| DAcHb** | 1527.40 | 3056.80 | 23.3 |
| DAc4 | 1547.40 | 3096.80 | 22 |
| DAc2Hb** | 1548.41 | 3098.82 | 82.2 |
| DHb2** | 1549.41 | 3100.82 | 4.1 |
| DAc3Hb | 1569.41 | 3140.82 | 100 |
| DAcHb2** | 1570.42 | 3142.84 | 35.6 |
| DAc4Hb | 1590.42 | 3182.84 | 38.4 |
| DAc2Hb2** | 1591.42 | 3184.84 | 79.5 |
| DAc3Hb2 | 1612.43 | 3226.86 | 97.3 |
| DAc4Hb2 | 1633.44 | 3268.88 | 35.6 |
Анализ экзоолигосахаридов пиков S3. Определить структуру ЭОС из пика S3 не удалось в силу их недостаточного количества. Однако мы полагаем, что эти ЭОС являются тримерами повторяющегося октасахаридного звена кислого ЭПС. Данное предположение основывается на совпадении времени элюции олигосахаридов из пика S3 со временем элюции тримеров октасахарида, полученных в результате гидролиза высокомолекулярного ЭПС гликозилгидролазой PssW, и тримеров октасахарида, продуцируемых штаммом Rlv VF39 с мутацией в гене полисахаридлиазы PlyB. В обоих случаях степень полимеризации и структура выделенных ЭОС были подтверждены масс-спектрометрическим анализом (данные не приведены).
Таким образом, полученные в настоящей работе результаты свидетельствуют о том, что выделенные из культуральной жидкости кислые ЭОС представлены моно-, ди- и тримерами повторяющегося октасахаридного звена высокомолекулярного ЭПС штамма Rlv VF39. В культуральной жидкости обнаружены также гептасахариды, соответствующие по структуре октасахариду без остатков GlcA-с или Glc-b в главной цепи. Известно, что одним из механизмов образования ЭОС у ризобий является гидролиз ЭПС специфическими гидролазами (York, Walker, 1998a; Finnie et al., 1998; Staehelin et al., 2006). Возможно, что и в случае изучаемого штамма ЭОС возникают в результате деполимеризации ЭПС гидролитическими ферментами, гены которых идентифицированы как в геноме исследуемого штамма, так и в геномах других штаммов ризобий (Ivashina, Ksenzenko, 2012).
Сравнительный анализ интенсивностей сигналов ионов мономеров и димеров (табл. 1 и 5) выявил следующую закономерность: среди мономеров на спектре доминировали ионы неацетилированного октасахарида и октасахарида с одной ацетильной группой. Напротив, среди димеров и тримеров преобладали формы с высоким содержанием О-ацетильных групп. Нестехиометрическое ацетилирование повторяющихся звеньев ЭПС описано в ряде работ (O’Neill et al., 1991; Muszyński et al., 2016). Более того, продемонстрировано влияние неуглеводных заместителей в составе полисахаридов на их гидролиз. Так, например, мутация в гене exoZ, блокирующая ацетилирование сукциногликана, приводила к повышенной продукции его низкомолекулярных форм (York, Walker, 1998b). Показано также, что предпочтительным субстратом для глюкуронанлиазы S. meliloti M5N1CS является деацетилированный глюкуронан. При этом гидролиз полисахарида с промежуточной степенью ацетилирования происходил на неацетилированных последовательностях, а близкое расположение к сайту гидролиза двух O‑ацетилированных остатков ингибировало этот процесс (Da Costa et al., 2003). Результаты нашего исследования указывают на то, что in vivo до мономерных форм ЭОС также расщепляются наименее ацетилированные участки высокомолекулярного ЭПС штамма Rlv VF39. Следовательно, установленная in vitro корреляция между степенью ацетилирования ЭПС и его устойчивостью к действию гликозилгидролаз реализуется и in vivo. Этот факт является еще одним косвенным доказательством в пользу высказываемого в литературе предположения о том, что избирательное ацетилирование/деацетилирование бактериальных полисахаридов может влиять на различные процессы, протекающие с их участием (Sutherland, 2001; Vuong et al., 2004; Downie, 2010).
Полученные данные о структурах экзоолигосахаридов у штамма Rlv VF39 открывают перспективы для дальнейшего изучения механизмов их функционирования в симбиозе в качестве сигнальных молекул. В пользу сигнальной функции ЭОС, по крайней мере, для некоторых пар симбионтов свидетельствуют данные о взаимодействии октасахаридного мономера кислого ЭПС, синтезируемого штаммом Mesorhizobium loti R7A, с LyzM рецепторной киназой Epr3, локализованной на клеточной поверхности эпидермальных клеток корня Lotus japonicus. Интересно отметить, что инфицирование мутантным штаммом M. loti R7AexoU, синтезирующим пентасахарид со сниженным отрицательным зарядом вместо октасахарида, приводит к негативному ответу растения (Kawaharada et al., 2015; Muszyński et al., 2016). Можно предположить, что наличие кислого остатка (GlcA) на восстанавливающем конце мономерной формы ЭПС штамма Rlv VF39 и, возможно, ацетильных групп в определенном положении октасахарида определяет специфическое связывание с рецепторными комплексами растительных клеток, контролирующими успешное развитие инфекционного процесса при симбиозе.
Список литературы
Arnold M.F.F., Penterman J., Shabab M., Chen E.J., Walker G.C. Important late stage symbiotic role of the Sinorhizobium meliloti exopolysaccharide succinoglycan // J. Bacteriol. 2018. V. 200. e00665-17.
Beringer J.E. R factor transfer in Rhizobium leguminosarum // J. Gen. Microbiol. 1974. V. 84. P. 188–198.
Breedveld M., Miller K.J. Cyclic β-glucans of members of the family Rhizobiaceae // Microbiol. Rev. 1994. V. 58. P. 145–161.
Cheng H.P., Walker G.C. Succinoglycan is required for initiation and elongation of infection threads during nodulation of alfalfa by Rhizobium meliloti // J. Bacteriol. 1998. V. 180. P. 5183–5191.
Da Costa A., Michaud P., Heyraud A., Colin-Morel P., Courtois B., Courtois J. Acetyl substitution of glucuronan influences glucuronan cleavage by GlyA from Sinorhizobium meliloti M5N1CS (NCIMB 40472) // Carbohyd. Polym. 2003. V. 51. P. 223–228.
Djordjevic S.P., Chen H., Batley M., Redmond J.W., Rolfe B.G. Nitrogen fixation ability of Rhizobium sp. stain NGR234 and Rhizobium trifolii is restored by the addition of homologous exopolysaccharides // J. Bacteriol. 1987. V. 169. P. 53–60.
Domon B., Costello C.E. A systematic nomenclature for carbohydrate fragmentations in FAB-MS/MS spectra of glycoconjugates // Glycoconjugate J. 1988. V. 5. P. 397–409.
Downie J.A. The roles of extracellular proteins, polysaccharides and signals in the interactions of rhizobia with legume roots // FEMS Microbiol. Rev. 2010. V. 34. P. 150–170.
Finnie C., Zorreguieta A., Hartley N.M., Downie J.A. Characterization of Rhizobium leguminosarum exopolysaccharide glycanases that are secreted via a type I exporter and have a novel heptapeptide repeat motif // J. Bacteriol. 1998. V. 180. P. 1691–1699.
Gonzalez J.E., Semino C.E., Wang L.X., Castellano-Torres L. Biosynthetic control of molecular weight in the polymerization of the octasaccharide subunits of succinoglycan, a symbiotically important exopolysaccharide of Rhizobium meliloti // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 13477–13482.
Gonzalez J.E., York G.M., Walker G.C. Rhizobium meliloti exopolysaccharides: synthesis and symbiotic function // Gene. 1996. V. 179. P. 141–146.
Hoang T.T., Karkhoff-Schweizer R.R., Kutchma A.J., Schweizer H.P. A broad-host-range Flp-FRT recombination system for site-specific excision of chromosomally-located DNA sequences: application for isolation of unmarked Pseudomonas aeruginosa mutants // Gene. 1998. V. 212. P. 77–86.
Ivashina T.V., Fedorova E.E., Ashina N.P., Kalinchuk N.A., Druzhinina T.N., Shashkov A.S., Shibaev V.N., Ksenzenko V.N. Mutation in the pssM gene encoding ketal pyruvate transferase leads to disruption of Rhizobium leguminosarum bv. viciae – Pisum sativum symbiosis // J. Appl. Microbiol. 2010. V. 109. P. 731–742.
Ivashina T.V., Khmelnitsky M.I., Shlyapnikov M.G., Kanapin A.A., Ksenzenko V.N. The pssA gene from Rhizobium leguminosarum bv. viciae VF39: cloning, sequence and the possible role in polysaccharide production and nodule formation // Gene. 1994. V. 150. P. 111–116.
Ivashina T.V., Ksenzenko V.N. Exopolysaccharide biosynthesis in Rhizobium leguminosarum: from genes to functions // The Complex World of Polysaccharides / Ed. Karunarat-ne D.N. Rijeka, Croatia: In Tech, 2012. P. 99–126.
Kawaharada Y., Kelly S., Nielsen M.W., Hjuler C.T., Gysel K., Muszyński A., Carlson R.W., Thygesen M.B., Sandal N., Asmussen M.H., Vinther M., Andersen S.U., Krusell L., Thirup S., Jensen K.J., Ronson C.W., Blaise M., Radutoiu S., Stougaard J. Receptor-mediated exopolysaccharide perception controls bacterial infection // Nature. 2015. V. 523. P. 308–312.
Kelly S.J., Muszyński A., Kawaharada Y., Hubber A.M., Sullivan J.T., Sandal N., Carlson R.W., Stougaard J., Ronson C.W. Conditional requirement for exopolysaccharide in the Mesorhizobium–Lotus symbiosis // Mol. Plant. Microbe Interact. 2013. V. 26. P. 319–329.
Leigh J.A., Reed J.W., Hanks J.F., Hirsch A.M., Walker G.C. Rhizobium meliloti mutants that fail to succinylate their calcofluor binding exopolysaccharide are defective in nodule invasion // Cell. 1987. V. 51. P. 579–587.
Loewus F.A. Improvement in anthrone method for determination of carbohydrates // Anal. Chem. 1952. V. 24. P. 219.
Lopez-Lara I.M., Orgambide G., Dazzo F.B., Olivares J., Toro N. Characterization and symbiotic importance of acidic extracellular polysaccharides of Rhizobium sp. strain GRH2 isolated from Acacia nodules // J. Bacteriol. 1993. V. 175. P. 2826–2832.
Marczak M., Mazur A., Koper P., Žebracki K., Skorupska A. Synthesis of rhizobial exopolysaccharides and their importance for symbiosis with legume plants // Genes. 2017. V. 8. P. 360.
Mendis H.C., Madzima T.F., Queiroux C., Jones K.M. Function of succinoglycan polysaccharide in Sinorhizobium meliloti host plant invasion depends on succinylation, not molecular weight // mBio. 2016. V. 7. e00606-16.
Muszyński A., Heiss C., Hjuler C.T., Sullivan J.T., Kelly S.T., Thygesen M.B., Stougaard J., Azadi P., Carlson R.W., Clive W., Ronson C.W. Structures of exopolysaccharides involved in receptor-mediated perception of Mesorhizobium loti by Lotus japonicas // J. Biol. Chem. 2016. V. 291. P. 20946–20961.
O’Neill M.A., Darvill A.G., Albersheim P. The degree of esterification and points of substitution by O-acetyl and O-(3-hydroxybutanoyl) groups in the acidic extracellular polysaccharides secreted by Rhizobium leguminosarum biovars viciae, trifolii, and phaseoli are not related to host range // J. Biol. Chem. 1991. V. 266. P. 9549–9555.
Rolfe B.G., Carlson R.W., Ridge R.W., Dazzo F.B., Mateos P.F., Pankhurst C.E. Defective infection and nodulation of clovers by exopolysaccharide mutants of Rhizobium leguminosarum bv. trifolii // Aust. J. Plant Physiol. 1996. V. 23. P. 285–303.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: a Laboratory Manual. N.Y.: Cold Spring Harbor Lab. Press, 1989. 1626 p.
Simon R., Priefer U., Pühler A. A broad host range mobilization system for in vivo genetic engineering: transposon mutagenesis in gram-negative bacteria // Bio/Technology. 1983. V. 1. P. 784–791.
Simsek S., Ojanen-Reuhs T., Stephens S.B., Reuhs B.L. Strain-ecotype specificity in Sinorhizobium meliloti–Medicago truncatula symbiosis is correlated to succinoglycan oligosaccharide structure // J. Bacteriol. 2007. V. 189. P. 7733–7740.
Simsek S., Wood K., Reuhs B.L. Structural analysis of succinoglycan oligosaccharides from Sinorhizobium meliloti strains with different host compatibility phenotypes // J. Bacteriol. 2013. V. 195. P. 2032–2038.
Staehelin C., Forsberg L.S., Haeze W.D., Gao M.Y., Carlson R.W., Xie Z.-P., Pellock B.J., Jones K.M., Walker G.C., Streit W.R., Broughton W.J. Exo-oligosaccharides of Rhizobium sp. strain NGR234 are required for symbiosis with various legumes // J. Bacteriol. 2006. V. 188. P. 6168–6178.
Sutherland I.W. Biofilm exopolysaccharides: a strong and sticky framework // Microbiology (SGM). 2001. V. 147. P. 3–9.
Vuong C., Kocianova S., Voyich J.M., Yao Y., Fischer E.R., DeLeo F.R., Otto M. A crucial role for exopolysaccharide modification in bacterial biofilm formation, immune evasion, and virulence // J. Biol. Chem. 2004. V. 279. P. 54881–54886.
Urzainqui A., Walker G.C. Exogenous suppression of the symbiotic deficiencies of Rhizobium melilotiexo mutants // J. Bacteriol. 1992. V. 174. P. 3403–3406.
Wang L.-X., Wang Y., Pellock B.J., Walker G.C. Structural characterization of the symbiotically important low-molecular-weight succinoglycan of Sinorhizobium meliloti // J. Bacteriol. 1999. V. 181. P. 6788–6796.
York G.M., Walker G.C. The Rhizobium meliloti ExoK and ExsH glycanases specifically depolymerize nascent succinoglycan chains // Proc. Natl. Acad. Sci. USA. 1998a. V. 95. P. 4912–4917.
York G.M., Walker G.C. The succinyl and acetyl modifications of succinoglycan influence susceptibility of succinoglycan to cleavage by the Rhizobium meliloti glycanases ExoK and ExsH // J. Bacteriol. 1998b. V. 180. P. 4184–4191.
Zevenhuizen L.P.T.M., van Veldhuizen A., Fokkens R.H. Re-examination of cellular cyclic β-1,2-glucans of Rhizobiaceae: distribution of ring sizes and degrees of glycerol-1-phosphate substitution // Antonie Leeuwenhoek. 1990. V. 57. P. 173–178.
Дополнительные материалы отсутствуют.


