Микробиология, 2020, T. 89, № 5, стр. 566-580
Характеристика новых хитин-деградирующих штаммов Laceyella spp. из Новоафонской пещеры (Абхазия), продуцирующих термостабильные хитиназы
Л. Ю. Кузьмина a, О. Я. Червяцова b, Т. Р. Ясаков a, В. Р. Сафина a, Н. Ф. Галимзянова a, А. И. Мелентьев a, Г. Э. Актуганов a, *
a Уфимский Институт биологии – обособленное структурное подразделение ФГБНУ Уфимского федерального исследовательского центра Российской Академии наук
450054 Уфа, Россия
b Государственный природный биосферный заповедник “Шульган-Таш”
453585 Республика Башкортостан, д. Иргизлы, Россия
* E-mail: gleakt@anrb.ru
Поступила в редакцию 27.04.2020
После доработки 08.05.2020
Принята к публикации 11.05.2020
Аннотация
Из грунта Новоафонской пещеры (Абхазия) выделено 9 хитин-деградирующих изолятов умеренно термофильных бактерий, с оптимумом роста и максимальной скоростью деструкции хитина при 50–55°С. Из семи изолятов, формирующих воздушный мицелий, отобрано четыре наиболее активных культуры с уровнем продукции хитиназ 0.11–0.28 ед./мл (при 48°С). На основе оценки культурально-морфологических и физиолого-биохимических признаков, а также c помощью анализа гена 16S рРНК отобранные изоляты были отнесены к виду Laceyella sp. и образовывали единый кластер на филогенетическом древе с видами L. sacchari, L. sediminis и L. tengchongensis при уровне идентичности 96.43–97.21%. Локализация термоактиномицетов в пещере была приурочена к зонам экскурсионного маршрута и к району затопления паводковыми водами. Штаммы Laceyella spp. NAC-16-5 A-4 и NAC-16-5 A-5 деградировали коллоидный хитин (5 г/л) на 85–100% после 96 ч глубинного культивирования (48°С). Синтез хитинолитических ферментов имеет индуцибельный характер у всех отобранных штаммов, достигая максимальных значений в присутствии крабового хитина. Ферментный комплекс Laceyella sp. NAC-16-5 A-4 проявляет активность в диапазоне рН 4–10.5 с двумя оптимумами при рН 5.5 и 7. Неочищенные хитиназы всех отобранных штаммов показывали максимальную активность при 60–70°С с одинаковыми значениями температурного оптимума (65°С), однако наиболее стабильными при 70°С являлись ферментные комплексы штаммов NAC-16-5 A-2 и NAC-16-5 A-4.
Изучение особенностей функционирования микробных сообществ пещерных экосистем имеет существенное значение для выявления взаимосвязей их филогенетического и функционального разнообразия с факторами внешней среды и понимания их роли в геохимических процессах (Хижняк и соавт., 2003; Кондратьева и соавт., 2016; De Mandal et al., 2017). Ограниченность в источниках питательных веществ и энергии создает внутри пещер особую олиготрофную среду, где первичная продукция органического вещества осуществляется хемолитоавтотрофными бактериями, которые, в свою очередь, поддерживают рост различных групп хемоорганотрофных микроорганизмов. Органическое вещество может также привноситься в пещерные экосистемы извне, за счет водных источников, животных (беспозвоночные, рукокрылые), постоянно или временно обитающих в подземных полостях (троглофилы, троглобионты, троглоксены и др.), а также деятельности человека (Howarth, 2003).
Однако роль пещерных сообществ микроорганизмов в биодеградации аллохтонной органики остается малоизученной. Представители пещерной микробиоты могут представлять интерес как потенциальные продуценты новых биоактивных соединений или ферментов деградации трудноразлагаемых природных полимеров (Tomova et al., 2013; Ghosh et al., 2017). Некоторую часть пещерной органики может составлять хитин, как основной структурный компонент экзоскелета многих беспозвоночных обитателей пещер. Присутствие хитина в пещерах обусловлено также развитием микроскопических грибов на аллохтонных органических субстратах, в том числе антропогенного происхождения (Кузьмина и соавт., 2012; Куманяев и соавт., 2014), а также накоплением продуктов жизнедеятельности летучих мышей, в пищевом рационе которых преобладают насекомые (Whiteker et al., 2004).
Известно, что в наземных экосистемах среди наиболее активных бактериальных деструкторов хитина преобладают, как правило, актинобактерии, бациллы и некоторые представители гамма-протеобактерий (Swiontek Brzezinska et al., 2014). Однако состав, разнообразие и распространение бактериальных или грибных деструкторов хитина в микробных сообществах пещер остаются пока малоизученными.
В процессе исследования микробиоты Новоафонской пещеры (Абхазия), одной из наиболее известных крупных экскурсионных пещер Северного Кавказа, нами были выделены умеренно термофильные хитин-деградирующие изоляты, позднее отнесенные к представителям термоактиномицетов рода Laceyella. По морфологическому строению и экологически эта группа сходна с актинобактериями, однако в филогенетическом отношении и по способности формировать эндоспоры она входит в отряд Bacillales (Goodfellow, Jones, 2009). До настоящего времени не сообщалось о присутствии термоактиномицетов в естественных подземных полостях, что обусловлено особенностями микроклимата пещер и олиготрофной средой обитания. Среди представителей Thermoactinomycetaceae встречаются как термофильные, так и мезофильные виды, в биотехнологическом аспекте эти бактерии представляют интерес как источник термостабильных ферментов и новых антимикробных соединений. К настоящему времени хитиназы были охарактеризованы только у двух известных видов термоактиномицетов (Yoon et al., 1998; Shibasaki et al., 2014).
Целью данной работы являлась характеристика новых хитинолитических изолятов термоактиномицетов рода Laceyella, впервые обнаруженных в грунтах Новоафонской пещеры, и оценка термостабильных свойств секретируемых ими хитиназ.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
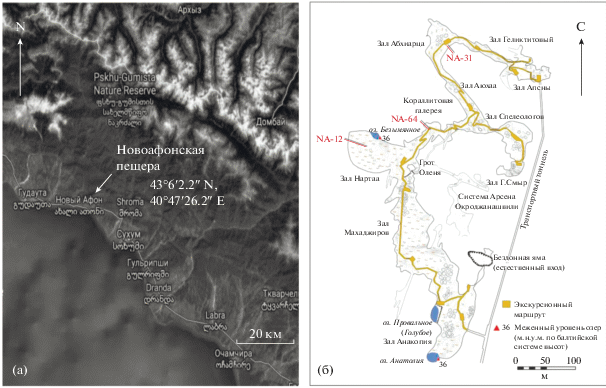
В работе исследовали хитинолитические штаммы термоактиномицетов, выделенные в 2016 г. из грунта Новоафонской пещеры (Абхазия, 43°6′2.2′′ N, 40°47′26.2′′ E, рис. 1а). Образцы грунта, а также гипсовые натечные образования на стенах полости отбирали стерильно в различных частях пещеры (рис. 1б). Полевую влажность образцов определяли весовым методом, высушивая их до постоянного веса при 105°С. Температуру и влажность воздуха в зонах отбора измеряли с помощью аспирационного психрометра МВ-4-М. Образцы суспендировали по 10 г (в расчете на влажный вес) в 100 мл стерильной водопроводной воды и оставляли на 30 мин в колбах Эрленмейера при комнатной температуре и постоянном перемешивании (150 об./мин). Приготовленную суспензию высевали методом серийных разведений на мясопептонный агар (МПА) и инкубировали при 50°С в течение 48 ч. Выросшие отдельные колонии отсевали уколом или штрихом на агаризованную среду следующего состава (г/л): KH2PO4 – 1.0; K2HPO4 3H2O – 0.5; (NH4)2HPO4 – 0.5; MgSO4 ∙ ∙ 7H2O – 0.2; CaCl2 – 0.1; пептон – 3; дрожжевой экстракт – 3; кукурузный экстракт – 1; коллоидный хитин – 5; агар – 16; рН среды 6.5–6.7. Отсеянные изоляты также инкубировали в течение 48–72 ч при 50°С. Наличие хитинолитической активности оценивали по образованию вокруг колоний ореолов просветления в агаре вследствие гидролиза коллоидного хитина. Активные изоляты повторно пересевали методом разведений на среду того же состава, а также на овсяный агар для получения чистой культуры и использовали в дальнейшей работе. Чистые культуры поддерживали ежеквартальными пассажами на овсяном агаре, либо на среде вышеописанного состава с использованием в качестве источника углерода коллоидного хитина или картофельного крахмала. Исходные изоляты хранили в скошенном овсяном агаре при 5°С, а также в ампулах в лиофильно высушенном состоянии.
Рис. 1.
Географическое положение (а) и схематический план (б) Новоафонской пещеры. Зоны, обозначенные на плане как NA-12, NA-31 и NA-64, соответствуют точкам отбора образцов грунта в залах Наарта, Абхиарца и Кораллитовой галерее, из которых были выделены хитинолитические штаммы термоактиномицетов.
Для учета численности групп бактерий, различающихся по способу питания, приготовленные суспензии образцов грунта высевали разведением на селективные среды. Рост хемоорганогетеротрофных бактерий оценивали на ГМФ-агаре, актинобактерий – на крахмало-аммиачном агаре и микроскопических грибов – на среде Чапека (Звягинцев, 1991). Культивирование микроорганизмов на плотных средах проводили при 28°С в течение 7 и 14 сут для бактерий и для микроскопических грибов соответственно.
Макро- и микроморфологические характеристики хитинолитических изолятов термоактиномицетов изучали в соответствии с основными признаками этой группы, представленными в руководстве Берджи (Goodfellow, Jones, 2009). Для выявления особенностей развития спорулирующих структур и локализации спор с помощью световой микроскопии проводили выращивание чистых культур на предметном стекле согласно рекомендациям (Определитель бактерий Берджи, 1997). Микроскопические исследования культур термоактиномицетов в прижизненном состоянии и после окрашивания по Граму проводили с помощью световой микроскопии на микроскопе “Leica DM1000” с цифровой фотокамерой “Leica DFC290” (“Leica Microsystems”, Германия) при увеличениях от ×400 до ×1000. Физиолого-биохимические свойства изолятов, в том числе их способность к образованию кислоты/газа из глюкозы, сахарозы, маннита и трегалозы, образованию ацетилметилкарбинола, гидролизу крахмала, эскулина и арбутина, использованию цитрата и др. определяли согласно описанным ранее методам (Герхардт и соавт., 1984).
Филогенетическое положение новых хитинолитических изолятов оценивали с помощью анализа фрагментов гена 16S рРНК (1244–1320 п.о.). В качестве матрицы для ПЦР использовали геномную ДНК бактериальных культур, выделенную методом фенольной экстракции, с последующей многократной очисткой смесью фенол–хлороформ–изоамиловый спирт (25 : 24 : 1). Амплификацию целевого продукта осуществляли с использованием бактериальных праймеров 27F 5'-AGAGTTTGATC(A/C)TGGCTCAG-3' и 1492R 5'-АСGG(C/T)TACCTTGTTACGACTT-3'. ПЦР проводили в 25 мкл смеси, состоящей из 10× буфера для Taq-полимеразы, 0.25 мМ дНTФ, 1.5 мМ MgCl2, 0.4 мкМ каждого праймера, 5 ед. акт. Taq-полимеразы (все реактивы – “Синтол”, Россия) и 10 нг геномной ДНК при следующих условиях: 95°С – 5 мин, далее 30 с при 94°С, 30 с при 55°С и 1 мин 20 с при 72°С – 30 циклов, 5 мин при 72°С в амплификаторе My Cycler (“Bio-Rad Laboratories”, США). ПЦР-продукты разделяли электрофорезом в горизонтальном агарозном геле (0.8%) в буфере TBE × 0.5 при комнатной температуре, напряжении 5–15 В/см в течение 40 мин. Агарозный гель окрашивали раствором бромистого этидия 0.5 мкг/мл в течение 5–10 мин и фотографировали в УФ-свете с помощью системы гель-документирования BioDocAnalyze (“Bio-Rad Laboratories”, США). Для определения размеров фрагментов использовали маркеры молекулярных масс 100+ bp DNA Ladder и 1 kb DNA Ladder (“Евроген”, Россия). Очистку ПЦР-продуктов и последующую секвенирующую ПЦР проводили с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit (“Applied Biosystems”, США) согласно инструкциям производителя.
Анализ гомологии частичной последовательности гена 16S рРНК трех представителей хитинолитических термоактиномицетов и поиск гомологичных последовательностей осуществляли с использованием баз данных Ribosomal Database Project (RDP) (Cole et al., 2014) и GenBank соответственно (Benson et al., 2013). Множественное выравнивание и филогенетический анализ полученных нуклеотидных последовательностей гена 16S рРНК проводили с помощью программы MEGA7 (Kumar et al., 2016). Филогенетические дерева строили методом “Neighbor-Joining” (Saitou, Nei, 1987), при этом показатель “bootstrap”-анализа соответствовал не менее чем 1000 альтернативным деревьям (Felsenstein, 1985). Эволюционные расстояния рассчитывали методом Maximum Composite Likelihood (Tamura et al., 2004). Частичные последовательности генов 16S рРНК штаммов NAC-16-5 A-4, NAC-16-5 A-5 и NAC-16-5 A-6 были депонированы в международную базу данных GenBank под номерами MN480778, MN480780 и MN480781 соответственно (https://www.ncbi.nlm.nih.gov/nuccore/MN480778.1/;/ MN480780;/MN480781).
Для количественной оценки продукции хитинолитических ферментов новыми штаммами термоактиномицетов, анализа динамики их роста и активности, отобранные культуры выращивали в жидкой среде описанного выше состава. Культивирование проводили в течение 96 ч на шейкере-инкубаторе Innova 40R (“New Brunswick”, США) при 48°С и 220 об./мин.
Хитинолитическую и хитозанолитическую активность исследуемых изолятов измеряли с помощью ранее описанных методов (Hëlisto et al., 2001). Интенсивность накопления биомассы в жидкой культуре термоактиномицетов оценивали спектрофотометрически по показателям оптической плотности культуры при 600 нм. Степень биодеградации хитина изолятами термофильных бактерий оценивали по динамике увеличения диаметра зон гидролиза коллоидного хитина вокруг растущих колоний на агаровой среде в течение 7 сут культивирования при 37 и 45°С.
Кроме того, степень деструкции хитина несколькими отобранными штаммами термоактиномицетов оценивали по сухому весу остаточного нерастворимого субстрата после 4 сут их глубинного культивирования при 48°С и 220 об./мин. Негидролизованный хитин собирали фильтрацией на воронке Бюхнера под вакуумом с использованием бумажных фильтров “Синяя лента”. Биомассу из культуральной среды предварительно удаляли тем же методом с помощью фильтров “Белая лента”. Собранный хитин промывали дистиллированной водой и высушивали при 105°С до постоянного веса. Степень ферментативной деструкции коллоидного хитина определяли тем же способом, после 6 ч инкубации (50°С) 1%-ной суспензии данного полимера с супернатантами культуральной среды трех штаммов термоактиномицетов. Количественно уровень деструкции субстрата (destruction degree) рассчитывали по формуле DD = [(C0–C1)/C1] × 100 (%), где С0 – начальная концентрация хитина в культуральной среде или реакционной смеси (мг/мл), С1 – остаточная концентрация хитина в среде после завершения культивирования, либо инкубации в присутствии ферментных препаратов (мг/мл).
Коллоидный хитин готовили из крабового хитина (ООО “Биопрогресс”, Россия) по модифицированной методике Rodriguez-Kabana et al. (1983). В работе использовали также хитозан с Mw ~500 кДа и степенью деацетилирования (СД) ~85%, любезно предоставленный лабораторией инженерии биополимеров Института биоинженерии ФИЦ “Фундаментальные основы биотехнологии” РАН.
Температурный и рН-оптимумы хитиназ ферментных комплексов новых штаммов термоактиномицетов определяли при стандартных условиях анализа, инкубируя их с субстратом в диапазоне температур 35–75°С и значений рН 3.5–10.5. В качестве буферных систем использовали 0.2 М фосфатно-цитратный буфер (рН 3.5–7.5), 0.2 М натрий-фосфатный буфер (рН 7–8), 0.1 М трис-HCl буфер (рН 7.5–9) и 0.1 М карбонатный буфер (рН 9.2–10.5). Термостабильность ферментов в супернатанте культуральной среды оценивали по их остаточной активности после 15, 30, 45 и 60 мин инкубации при 65, 70 и 80°С. Кинетику сорбции хитиназ из супернатанта культуральной среды термоактиномицетов изучали в течение 60 мин инкубации ферментных препаратов с 0.5%-ной суспензией коллоидного хитина на холоду при постоянном перемешивании. В конце этапов инкубации образцы реакционной смеси центрифугировали (5 мин, 6708 g); степень сорбции рассчитывали по уровню остаточной активности в надосадочной жидкости.
Эксперименты по оценке численности термоактиномицетов и других групп микроорганизмов в образцах грунтов и минеральных отложениях, а также количественный анализ хитинолитической активности на чашках и в жидкой культуре проводили в трехкратной повторности, в качестве ошибки среднего представляли стандартное отклонение.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследуемые в работе штаммы термоактиномицетов были выделены в рамках общей микробиологической оценки качественного и количественного состава культивируемой микробиоты (включая санитарно-показательные группы микроорганизмов) в грунтах и минеральных отложениях Новоафонской пещеры. Было исследовано двенадцать проб грунта и натечных образований со стен и пола, отобранных на всем протяжении пещеры, в области рекреационного воздействия и вне зоны посещения (рис. 1б, табл. 1). Термоактиномицеты обнаруживались только в трех точках, соответствующих грунтам Зала Нартаа (у кромки озера Безымянное), Кораллитовой галереи и Зала Абхиарца (рис. 1б). Эти части пещеры, за исключением зоны отбора в Зале Наарта, характеризовались значительным антропогенным загрязнением, связанным с экскурсионным маршрутом, присутствием аллохтонной органики и зоной действия промывных вод при очистке трапов. Содержание термоактиномицетов в исследованных образцах было невысоким (от 0.6 до 2 × 102 КОЕ/г) по сравнению с численностью мезофильных хемоорганогетеротрофов и актинобактерий (табл. 1). В отличие от термоактиномицетов, умеренно термофильные бактерии, не имеющие мицелиальной морфологии, обнаруживались в большинстве проб грунта и ряда натечных образований стен пещеры, однако в такой же незначительной численности (0.2–3.5 × 102 КОЕ/г; табл. 1). Наличие культивируемых умеренно термофильных бактерий в грунтах Новоафонской пещеры может быть обусловлено довольно значительными средними температурами нейтрального слоя почвы в данном регионе (~13–14°С). Так, в составе микробиоты грунтов пещер Южного Урала со средними температурами нейтрального слоя около 5–6°С, умеренно термофильные микроорганизмы не обнаруживались (неопубликованные данные). Термоактиномицеты в Новоафонской пещере, по всей видимости, являются типичными представителями аллохтонной микробиоты, заносимой с дневной поверхности посетителями (с почвой и/или органическими остатками) туристического маршрута, либо с водотоками. Известно, что представителей этого семейства обнаруживают преимущественно в субстратах растительного происхождения, способных к самопроизвольному разогреву (Goodfellow, Jones, 2009). Интересным фактом является то, что пробы грунта, в которых обнаруживали термоактиномицеты, характеризовались наиболее высоким содержанием микромицетов (2.81 × 103–4.96 × 105 КОЕ/г), которые могут рассматриваться как объективный показатель антропогенного загрязнения пещерной экосистемы (табл. 1). В то же время, представители колиформных бактерий (БГКП) не выявлялись ни в одном из образцов грунта и минеральных образований.
Таблица 1.
Численность (lg КОЕ/г) различных групп культивируемых форм термофильных и мезофильных бактерий, а также микромицетов в образцах грунта и скальных поверхностей, отобранных в различных зонах Новоафонской пещеры
| Номер образца | Точка отбора/тип образца | Термофильные, 50°С | Мезофильные, 28°С | |||
|---|---|---|---|---|---|---|
| бактерии, не формирующие мицелий | термоактиномицеты | хемоорганогетеротрофы | актинобактерии | микромицеты | ||
| Грунт | ||||||
| NA-18 | Смотровая площадка за эстакадой Зала Махаджиров | 2.54 ± 0.06 | 0 | НД | 5.95 ± 0.08 | 3.51 ± 0.07 |
| NA-16 | Юго-восточный тупик между Залами Махаджиров и Нартаа | 1.12 ± 0.05 | 0 | 5.67 ± 0.69 | 5.79 ± 0.68 | 2.58 ± 0.52 |
| NA-12 | Зал Нартаа, у озера | 2.27 ± 0.18 | 1.75 ± 0.43 | НД | 4.96 ± 0.39 | 3.45 ± 0.10 |
| Кораллитовая галерея (грунт): | ||||||
| NA-71 | Левая стена/глиняный склон | 0 | 0 | НД | 4.93 ± 0.10 | 1.15 ± 0.14 |
| NA-64 | Центр галереи | 2.09 ± 0.07 | 2.00 ± 0.27 | 6.86 ± 0.18 | НД | 4.36 ± 0.14 |
| NA-31 | Зал Абхиарца | НД | 2.30 ± 0.71 | НД | 6.06 ± 0.04 | 5.69 ± 0.17 |
| Минеральные натечные образования | ||||||
| NA-44 | Зал Анакопия, северо-западная стена | 1.42 ± 0.16 | 0 | 5.89 ± 0.21 | 4.63 ± 0.10 | 3.46 ± 0.22 |
| NA-3 | Юго-восточное ответвление между Залами Махаджиров и Нартаа, правая стена | 1.63 ± 0.87 | 0 | 5.42 ± 0.18 | 5.30 ± 0.15 | 3.94 ± 0.29 |
| NA-35 | Грот “Оленя”, под камнем “Олененок” | 0 | 0 | 5.60 ± 0.27 | 5.61 ± 0.26 | 1.53 ± 0.52 |
| NA-1 NA-60 |
Кораллитовая галерея Левая стена Центр галереи |
0 0 |
0 0 |
5.68 ± 0.16 5.39 ± 0.18 |
4.35 ± 0.32 4.19 ± 0.30 |
2.80 ± 0.20 2.73 ± 0.30 |
| NA-2 | Зал Гелектитовый | 1.66 ± 0.37 | 0 | 5.25 ± 0.88 | 4.75 ± 0.17 | 1.63 ± 0.36 |
Среди трех десятков микробных изолятов из проб грунта Кораллитовой галереи, развивающихся на МПА при 50°С, девять активно гидролизовали коллоидный хитин в агаре (рис. 2); из них семь культур характеризовались мицелиальной морфологией по данным микроскопии. Отобранные хитин-деградирующие изоляты не развивались в диапазоне температур 28–30°С, большинство из них слабо росли при 37°С. Максимальная динамика развития колоний и деструкции хитина в агаризованной среде у всех изолятов наблюдалась при 45–50°С, положительно коррелируя с абсолютными показателями их роста и ферментативной активности (табл. 2). Наиболее высокие интенсивность роста и степень деструкции хитина в агаризованной среде были отмечены у изолятов А2, А4, А5 и А6 (табл. 2). Эти же культуры характеризовались высоким уровнем спорообразования при 45–50°С по сравнению с остальными изолятами.
Рис. 2.
Гидролиз коллоидного хитина в агаризованной среде изолятами термоактиномицетов при различных методах посева: а – изолят А5, рассев разведением, 3 сут, 50°С; б – различающиеся по активности изоляты А3 и А4, посев уколом, 4 сут, 45°С; в–г – изолят А6, вид сверху (в) и со дна чашки (г), посев штрихом, 3 сут, 48°С.
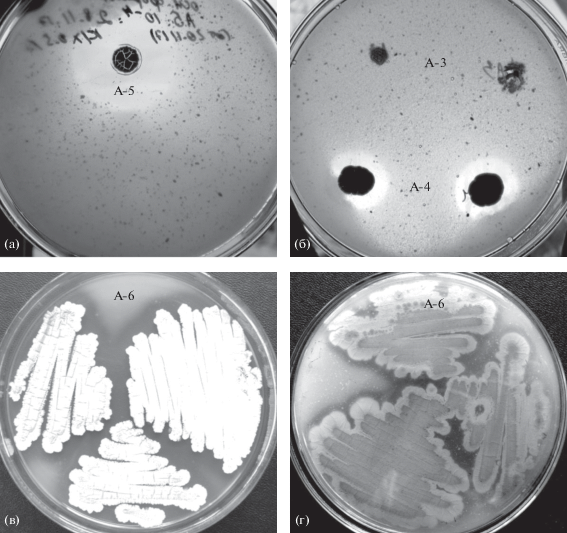
Таблица 2.
Средняя суточная динамика радиального роста колоний и гидролиза коллоидного хитина (мм/сут) термофильными изолятами из Новоафонской пещеры после 7 сут культивирования на агаризованной среде при различных температурах
| Номер изолята* |
37○С | 45○С | 50○С | |||
|---|---|---|---|---|---|---|
| скорость роста, мм/сут | гидролиз хитина, мм/сут | скорость роста, мм/сут | гидролиз хитина, мм/сут | скорость роста, мм/сут | гидролиз хитина, мм/сут | |
| А2 | 1.65 ± 0.07 | 4.93 ± 0.10 | 7.5 ± 0.35 | 6.5 ± 0.10 | 7.93 ± 0.35 | 10.9 ± 0.38 |
| А3 | 1.25 ± 0.35 | 2.64 ± 0.10 | 2.25 ± 0.35 | 3.64 ± 0.10 | 5.4 ± 0.35 | 6.2 ± 1.73 |
| А4 | 2.11 ± 0.05 | 4.54 ± 0.25 | 9.75 ± 0.35 | 6.14 ± 0.20 | 9.89 ± 0.35 | 10.4 ± 0.67 |
| А5 | 2.05 ± 0.07 | 4.5 ± 0.10 | 8.5 ± 0.71 | 6.86 ± 0.20 | 8.75 ± 0.35 | 8.7 ± 0.68 |
| А6 | 2.11 ± 0.15 | 4.64 ± 0.35 | 9.5 ± 0.71 | 6.57 ± 0.20 | 10.15 ± 0.71 | 13.3 ± 0.15 |
| А11 | 0 | 0 | 0.93 ± 0.10 | 1.64 ± 0.30 | 2.25 ± 0.25 | 3.5 ± 0.50 |
| А12 | 0 | 0 | 2.18 ± 0.05 | 2.64 ± 0.51 | 4.15 ± 0.35 | 5.1 ± 0.56 |
| Б1 | 2.25 ± 0.07 | 2.50 ± 0.14 | 2.7 ± 0.14 | 3.50 ± 0.14 | 4.67 ± 0.71 | 6.1 ± 2.0 |
| Б2 | 1.25 ± 0.35 | 1.21 ± 0.10 | 1.45 ± 0.21 | 2.68 ± 0.15 | 2.31 ± 0.28 | 4.4 ± 0.94 |
Предварительная оценка уровня секреции хитиназ и хитозан-деградирующих ферментов термофильными изолятами в глубинной культуре (48○С, 220 об./мин) совпадала со значениями их относительной хитинолитической активности на агаризованной среде (табл. 3). Изоляты, показавшие максимальную продуктивность и обозначенные как IB-NAc-16-5A4, IB-NAc-16-5A5 и IB-NAc-16-5A6, были изучены по фенотипическим характеристикам и филогенетическому положению.
Таблица 3.
Продукция хитино- и хитозанолитических ферментов термофильными изолятами Новоафонской пещеры при глубинном культивировании (48°С, 220 мин–1)
| Номер изолята |
Хитиназная активность в КЖ, ед/мл | Хитозаназная активность в КЖ, ед/мл | ||
|---|---|---|---|---|
| 48 ч | 72 ч | 48 ч | 72 ч | |
| А2 | 0.105 ± 0.009 | 0.062 ± 0.007 | 0.455 ± 0.037 | 0.123 ± 0.011 |
| А3 | 0.032 ± 0.002 | 0.030 ± 0.004 | 0.035 ± 0.004 | 0.033 ± 0.002 |
| А4 | 0.268 ± 0.018 | 0.280 ± 0.017 | 0.668 ± 0.053 | 0.647 ± 0.059 |
| А5 | 0.229 ± 0.017 | 0.234 ± 0.016 | 0.351 ± 0.032 | 0.627 ± 0.055 |
| А6 | 0.133 ± 0.014 | 0.132 ± 0.014 | 0.612 ± 0.041 | 0.580 ± 0.041 |
| А11 | 0.043 ± 0.004 | 0.040 ± 0.003 | 0.045 ± 0.005 | 0.051 ± 0.006 |
| А12 | 0.031 ± 0.003 | 0.028 ± 0.003 | 0.034 ± 0.004 | 0.031 ± 0.004 |
| Б1 | 0.027 ± 0.003 | 0.028 ± 0.003 | 0.031 ± 0.003 | 0.033 ± 0.004 |
| Б2 | 0.024 ± 0.002 | 0.026 ± 0.003 | 0.027 ± 0.003 | 0.030 ± 0.003 |
При рассеве разведением на овсяном или крахмалсодержащем агаре бактерии формировали сходные по морфологии округлые, не врастающие в агар колонии диаметром 5–12 мм, с неровным краем и плоским профилем, матовой поверхностью и сухой консистенцией (рис. 3а). Микроскопия 1–2-суточных культур показала наличие у них мицелиальной морфологии, с хорошо развитым субстратным и воздушным мицелием. Цвет воздушного мицелия варьировал от белого до светло-кремового; субстратный мицелий имел более темное, оранжево-коричневое, окрашивание. Накопления внеклеточных пигментов в среде культивирования не наблюдалось. Исследуемые изоляты при росте на агаре формировали слабоветвящиеся гифы размером в поперечнике 0.7–1.2 мкм с обильным количеством круглых спор диаметром 0.8–1.5 мкм, располагающихся одиночно на коротких спорофорах по бокам гиф (рис. 3б, 3в). На стадии 24-ч культуры все изоляты давали положительное окрашивание по Граму и каталозоположительную реакцию. Исследуемые культуры активно росли в присутствии глюкозы (без образования ацетилметилкарбинола), сахарозы, маннита и трегалозы с образованием органических кислот, не утилизировали цитрат, ацетат и пропионат, не гидролизовали эскулин и арбутин. Наряду с хитином, все штаммы активно гидролизовали крахмал и казеин (табл. 4).
Рис. 3.
а – Фотография колонии изолята IB-NAc-16-5A5 после 3-х сут культивирования на среде с коллоидным хитином; б–в – световая микроскопия интактного мицелия термофильных изолятов IB-NAc-16-5A4 (б) и IB-NAc-16-5A6 (в), развивающегося в тонком слое овсяного агара при 50°С (36 ч). Стрелками показаны спорофоры с эндоспорами, развивающиеся латерально на гифах.

Таблица 4.
Некоторые фенотипические свойства термоактиномицетов, выделенных из грунта Новоафонской пещеры (Кораллитовая галерея), и типовых видов, родственных Laceyella sacchari
| Характеристика | Изоляты | DSM 43356* | YIM 10002** | RHA1*** | ||
|---|---|---|---|---|---|---|
| IB-NAc-16-5A4 | IB-NAc-16-5A5 | IB-NAc-16-5A6 | ||||
| Воздушный мицелий | Светло-кремовый | Белый | Светло-кремовый | Белый | От белого до желто-белого | Белый |
| Форма спор | Круглая | Круглая | Круглая | Круглая | Круглая | Круглая |
| Диаметр спор, мкм | 0.8–1.5 | 0.6–0.8 | 1–1.5 | ≤1 | 0.7–0.8 | 0.7–0.82 |
| Спорофоры/расположение на гифах | Короткие/ латеральное | Короткие/ латеральное | Короткие/ латеральное | До 3 мкм/ латеральное | Короткие/ латеральное | Короткие/ латеральное |
| Образование растворимого пигмента | − | − | − | Желто-коричневый | − | − |
| Температурный диапазон/оптимум роста, ○С | 37–65/45–55 | 37–60/45–50 | 37–65/45–55 | 35–65/48–55 | 28–65/55 | 28–65/55 |
| рН оптимум роста | 6–7.5 | 6–7.5 | 6–7.5 | НД | 6–8 | 7 |
| Каталаза | + | + | + | НД | НД | НД |
| Кислота (газ) из: D-глюкозы Сахарозы D-маннита Трегалозы |
+ (−) + (−) + (−) + (−) |
+ (−) + (−) + (−) + (−) |
+ (−) + (−) + (−) + (−) |
+ − + |
НД НД + + |
НД НД − + |
| Образование
ацетилметилкарбинола при росте в среде Кларка |
− | − | − | − | НД | НД |
| Утилизация: Цитрата Пропионата |
− − |
− − |
− − |
НД НД |
НД НД |
НД НД |
| Гидролиз: Крахмала Хитина Казеина Арбутина Эскулина |
+ + + − − |
+ + + − − |
+ + + − − |
+ ± + ± ± |
− НД + НД НД |
+ НД + НД НД |
Филогенетическое положение термофильных хитинолитических изолятов с мицелиальной морфологией оценивали на основе данных сравнительного анализа частичной последовательности гена 16S рРНК и близких ему последовательностей типовых представителей семейства Thermoactinomycetaceae. Уровень идентичности между ними находился в диапазоне 88.84–97.21%. Отобранные изоляты показывали наибольшую близость к типовым штаммам Laceyella sediminis RHA1, L. tengchongensis YIM 10002 и L. sacchari DSM 43356, образуя с ним единый кластер на филогенетическом древе (рис. 4), с различными уровнями идентичности (табл. 5). Хотя в филогенетическом отношении по гену 16S рРНК перечисленные виды практически идентичны, по данным ДНК–ДНК гибридизации и ряду хемотаксономических характеристик они показывали некоторые отличия, что используется для видовой дифференциации данной группы (Chen et al., 2012). Поскольку фенотипические особенности изолятов NAC-16-5 A-4, NAC-16-5 A-5 и NAC-16-5 A-6 были изучены недостаточно, все они были обозначены как вид Laceyella sp. Идентичен перечисленным штаммам по результатам анализа гена 16S рРНК был менее активный изолят NAC-16-5 A-2. Штаммы А-4, А‑5 и А-6 были депонированы во Всероссийскую коллекцию микроорганизмов (ВКМ РАН) под номерами В-3458, В-3459 и В-3460 соответственно. Следует отметить, что два ближайших к L. sacchari новых вида, L. sediminis RHA1 и L. tengchongensis YIM 10002, существенно отличались по источникам выделения от типового вида L. sacchari, который обнаруживается, как правило, в растительных субстратах, таких как сахарный тростник, багасса, отходы переработки сахарных производств и др. (Goodfellow, Jones, 2009). Если L. sediminis был выделен из донных отложений горячего источника (55°С), то L. tengchongensis – из вулканической почвы близ подножия вулкана (Chen et al., 2012; Zhang et al., 2010). Однако в последние годы появилось немало работ, описывающих изоляты родов Thermoactinomyces и Laceyella из горячих и теплых геотермальных источников (Panosyan et al., 2019). По всей видимости, горячие источники могут быть такой же обычной средой обитания для L. sacchari (Kaur et al., 2014). Тем не менее, до настоящего времени не упоминалось об обнаружении культивируемых представителей Laceyella sp. в грунтах пещер. Выделенные нами из разных зон Новоафонской пещеры штаммы Laceyella sp., вероятно, относятся к одному виду, несмотря на наличие незначительных фенотипических вариаций. Между “новоафонскими” штаммами и филогенетически близкими к ним видами L. sediminis RHA1 и L. tengchongensis YIM 10002 имеется принципиальное различие в температурном диапазоне роста; в отличие от этих видов, выделенные нами штаммы не могли развиваться при 28–35°С (Chen et al., 2012) и по данному признаку были более близки к виду L. sacchari. Среди других отмеченных перекрестных различий в физиологических свойствах исследуемых штаммов с видами L. sediminis и L. tengchongensis были способность к гидролизу крахмала и утилизация D-маннита (табл. 4). До настоящего времени не сообщалось о способности L. sacchari и вышеупомянутых родственных видов к активной деструкции хитина, что позволяет рассматривать новоафонские изоляты Laceyella spp. как обособленную группу. Тем не менее, корректная дифференциация новых штаммов требует более детальной характеристики ряда их физиологических, хемотаксономических и генетических свойств, что предполагается осуществить в дальнейших исследованиях.
Рис. 4.
Филогенетическое древо на основе сравнительного анализа частичных последовательностей генов 16S рРНК штаммов NAC-16-5 A-4 (MN480778), NAC-16-5 A-5 (MN480780) и NAC-16-5 A-6 (MN480781), а также близких им последовательностей типовых видов бактерий семейства Thermoactinomycetaceae. Цифрами указана достоверность ветвления, рассчитанная с помощью “bootstrap”-анализа (значимыми признаются величины больше 50). Масштаб отражает эволюционное расстояние, соответствующее 5 нуклеотидным заменам на каждые 1000 нуклеотидов. В скобках указаны номера, под которыми последовательности депонированы в базе данных GenBank.
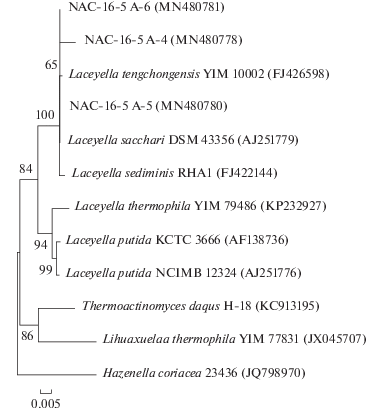
Таблица 5.
Уровни идентичности нуклеотидных последовательностей 16S рДНК хитин-деградирующих изолятов термоактиномицетов Новоафонской пещеры с ближайшими родственными видами рода Laceyella
| Номер изолята | Уровень идентичности с типовыми штаммами по последовательности гена 16S рРНК, % | Количество нуклеотидов | ||
|---|---|---|---|---|
| Laceyellasacchari DSM 43356 | Laceyella tengchongensis YIM 10002 |
Laceyella sediminis RHA1 |
||
| IB-NAc-16-5A4 | 97.21 | 97.13 | 96.97 | 1255 |
| IB-NAc-16-5A5 | 96.43 | 96.58 | 96.43 | 1319 |
| IB-NAc-16-5A6 | 96.74 | 96.89 | 96.74 | 1320 |
Максимальную степень конверсии коллоидного хитина после 96 ч глубинного культивирования показывали штаммы Laceyella spp. NAC-16-5 A-4 и NAC-16-5 A-5 при 50–55°С, что совпадало с данными динамики накопления хитинолитических ферментов в культуральной среде (рис. 5а, 5б). Ферментные комплексы обоих этих штаммов также осуществляли наиболее глубокую деполимеризацию субстрата в течение 4 ч инкубации, с максимумами при 60–70 и 50–60°С соответственно (табл. 6). Полученные результаты свидетельствуют о термофильных свойствах хитиназ новых штаммов Laceyella spp., в особенности, NAC-16-5 A-4.
Рис. 5.
Степень конверсии 0.5 мас. % коллоидного хитина (после 96 ч) в растворимые продукты (а) и динамика секреции хитиназ (б) штаммами Laceyella spp. NAC-16-5 A-2 (1), NAC-16-5 A-4 (2), NAC-16-5 A-5 (3) и NAC-16-5 A-6 (4) при глубинном культивировании (220 об. мин–1, 48°С). На рис. (а) не указан доверительный интервал для шт. 2, поскольку во всех образцах наблюдался полный гидролиз (100%) субстрата.
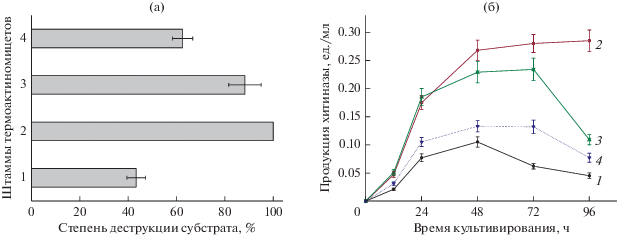
Таблица 6.
Степень деполимеризации коллоидного хитина (5 мг/мл) ферментными комплексами (КЖ) штаммов Laceyella spp. при различных температурах
| Номер изолята | Степень конверсии коллоидного хитина после 4 ч инкубации с ферментными препаратами (1 : 10), % | |||
|---|---|---|---|---|
| 50○С | 60○С | 70○С | 80○С | |
| IB-NAc-16-5A2 | 14.8 ± 1.7 | 25.6 ± 3.3 | 23.4 ± 3.4 | 5.2 ± 1.3 |
| IB-NAc-16-5A4 | 51 ± 5 | 94.4 ± 4.8 | 100 | 18 ± 2.3 |
| IB-NAc-16-5A5 | 74.4 ± 7.7 | 56.2 ± 5.1 | 44 ± 4.3 | 10.6 ± 1.3 |
| IB-NAc-16-5A6 | 47.6 ± 5.6 | 36.8 ± 4.3 | 25.8 ± 3.6 | 9.2 ± 1.5 |
Как известно, из-за высокой активности и стабильности при высоких температурах гидролитические ферменты, в особенности, протеазы, амилазы и липазы, продуцируемые различными видами семейства Thermoactinomycetaceae, представляют интерес для потенциального биотехнологического применения (Goodfellow, Jones, 2009; Panosyan et al., 2019). Основные аспекты использования термостабильных хитиназ связаны с разработкой эффективных процессов ферментативной трансформации и компостирования панцирь-содержащих отходов переработки морских ракообразных и моллюсков, а также получением биоактивных олигомеров хитина и хитозана (Krolicka et al., 2018). Хитиназы термоактиномицетов остаются слабоизученными и в настоящее время охарактеризованы только у штаммов Thermoactinomyces vulgaris KFB-C100 и L. putida JAM FM3001 (Yoon et al., 1998; Shibasaki et al., 2014).
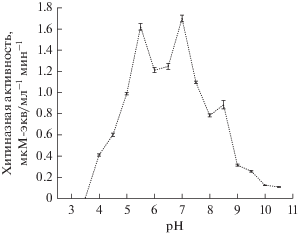
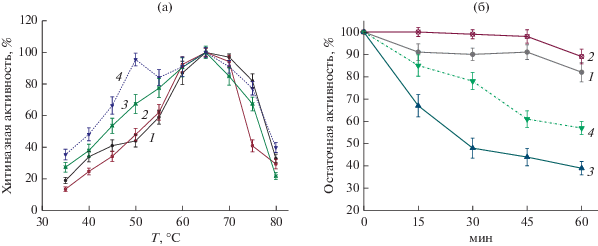
Синтез хитиназ новыми штаммами Laceyella spp. имел индуцибельный характер и в наибольшей степени осуществлялся в присутствии крабового хитина, переведенного в коллоидную форму (табл. 7). Следует отметить, что существенно более низкий уровень индукции хитиназ (в 4–7 раз) у исследуемых бактерий в присутствии хитина креветок может быть обусловлен более низким качеством данного субстрата, меньшим содержанием собственно хитина, возможным присутствием ингибирующих соединений, поскольку в работе использовали неочищенные от белков, пигмента и солей кальция измельченные панцири креветок. Данный фактор может быть также причиной невысокого уровня индукции хитинолитических ферментов в присутствии субстратов грибного происхождения (табл. 7). Анализ кинетики аффинной сорбции хитиназ из внеклеточных комплексов трех штаммов Laceyella spp. на коллоидном хитине показал различную степень (от 65 до 80%) их связывания субстратом (рис. 6). Присутствие в ферментном комплексе термоактиномицетов хитиназ, содержащих в своей структуре хитин-связывающие модули, демонстрирует их потенциал в деградации трудноразлагаемых нерастворимых форм хитина. Согласно предварительным данным, неочищенная хитиназа штамма Laceyella sp. NAC-16-5 A-4 проявляла наиболее высокую активность при рН 5.5 и 7, и 65°С (рис. 7, 8а). Наличие двух пиков в рН-профиле ферментного комплекса может свидетельствовать о синтезе Laceyella sp. NAC-16-5 A-4 хитиназ, существенно различающихся по рН-оптимуму. Хитиназы всех исследованных штаммов Laceyella spp. характеризовались сходным температурным оптимумом (65°С) и максимально активно гидролизовали субстрат в интервале 60–70°С (рис. 8а), что близко оптимуму исследованного штамма L. putida JAM FM3001 (Shibasaki et al., 2014). Исключение составлял хитиназный комплекс штамма NAC-16-5 A-6, показывающий максимальную активность при 50 и 65–70°С (рис. 8а). Все ферментные комплексы были стабильны при 65°С, однако при 70°С и рН 6 значительную термостабильность проявляли только хитиназы штаммов NAC-16-5 A-4 и NAC-16-5 A-2 (рис. 8б). Полученные результаты свидетельствуют о некоторых различиях в свойствах хитинолитических ферментов новых изолятов, что может отражаться в особенностях биодеградации ими хитиновых субстратов. Для выяснения механизмов ферментативной деструкции хитина бактериями рода Laceyella необходима очистка и подробное изучение свойств, а также субстратной специфичности ключевых хитиназ наиболее активных штаммов. Синтез термостабильных хитиназ пещерными изолятами Laceyella spp. и относительно высокая продуктивность (до 0.58 ед./мл) штамма NAC-16-5 A-4 позволяют рассматривать их в качестве альтернативы, либо дополнительного источника ранее описанным хитиназам других групп термофильных и термотолерантных микроорганизмов для потенциального биотехнологического применения.
Таблица 7.
Синтез внеклеточных хитиназ наиболее активными штаммами Laceyella spp. в присутствии различных источников углерода при глубинном культивировании (220 мин–1, 48○С, 48 ч)
| Источник углерода, 0.5% масс. | Продукция хитиназ штаммами Laceyella spp., ед/мл | ||
|---|---|---|---|
| IB-NAc-16-5A4 | IB-NAc-16-5A5 | IB-NAc-16-5A6 | |
| Хитин из панциря краба (нативный) | 0.141 ± 0.011 | 0.108 ± 0.009 | 0.074 ± 0.008 |
| Хитин из панциря краба (коллоидный) | 0.268 ± 0.018 | 0.229 ± 0.017 | 0.133 ± 0.014 |
| Хитин из панциря креветок (неочищенный) | 0.057 ± 0.006 | 0.032 ± 0.003 | 0.035 ± 0.004 |
| Хитин из пчелиного подмора | 0.144 ± 0.018 | 0.124 ± 0.018 | 0.062 ± 0.007 |
| Биомасса плодовых тел гриба Lentinus edodes | 0.056 ± 0.006 | 0.041 ± 0.004 | 0.048 ± 0.005 |
| Мицелий Fusarium culmorum | 0.032 ± 0.003 | 0.020 ± 0.003 | 0.027 ± 0.003 |
| Крахмал картофельный | 0.026 ± 0.005 | 0.025 ± 0.004 | 0.031 ± 0.004 |
| Целлюлоза порошковая | 0 | 0 | 0 |
| D-глюкоза | 0 | 0 | 0 |
| N-ацетил-D-глюкозамин | 0.024 ± 0.005 | 0.029 ± 0.003 | 0.017 ± 0.003 |
Рис. 6.
Кинетика адсорбции на коллоидном хитине (0.52 мас. %) хитиназ из ферментных комплексов штаммов Laceyella spp. NAC-16-5 A-4 (1), NAC-16-5 A-5 (2) и NAC-16-5 A-6 (3).
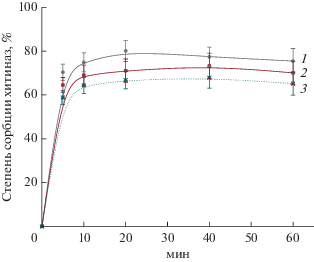
Рис. 8.
Температурный оптимум (а) и термостабильность при 70°С (б) хитинолитических комплексов штаммов Laceyella spp. NAC-16-5 A-2 (1), NAC-16-5 A-4 (2), NAC-16-5 A-5 (3) и NAC-16-5 A-6 (4).
Таким образом, впервые в грунтах пещерной экосистемы обнаружены представители термоактиномицетов, отнесенные к виду Laceyella sp. и способные активно деградировать хитин. Ограниченная локализация этих бактерий, связанная с местами значительного антропогенного загрязнения и близостью экскурсионного маршрута, косвенно указывает на их аллохтонное происхождение. Присутствие термоактиномицетов в грунтах отдаленной зоны экскурсионного маршрута, но расположенной в полосе затопления озера зала Нартаа, может быть также обусловлено их заносом в периоды паводков. Интересно, что в увлажняемом глинистом грунте этой части пещеры постоянно обнаруживаются многочисленные колонии жука Jeannelius gloriosus Ljovushkin, 1965 (сем. Carabidae). Эти колонии приурочены к скоплениям олигохет (Капралов, 2016) и, очевидно, также являются потенциальным источником хитин-содержащей органики, способствующей развитию хитинолитической микробиоты. Хитин-деградирующие бактерии составляют до 30% от количества термофильных изолятов; большинство из них сходны по макро- и микроморфологическим характеристикам и, по всей видимости, могут быть отнесены к термоактиномицетам на основе данных идентификации четырех наиболее активных штаммов Laceyella spp. Новые штаммы Laceyella spp. представляют интерес как перспективный источник термостабильных хитиназ для биоконверсии хитин-содержащего сырья. Более подробное изучение физиолого-биохимических, хемотаксономических и генотипических особенностей новых изолятов с целью их видовой дифференциации, а также характеристика хитинолитических ферментов будут завершены в дальнейших исследованиях.
При проведении исследований использовали оборудование ЦКП “Агидель” УФИЦ РАН.
Список литературы
Герхардт Ф. Методы общей бактериологии. М.: Мир, 1984. Т. 3. 264 с.
Капралов С.А. К фауне Новоафонской пещеры // Биоспелеологические исследования в России и сопредельных государствах: Материалы II Всероссийской молодежной конференции / ИПЭЭ РАН им. А.Н. Северцова (Москва, 1–2 декабря 2016 г.). – Ярославль: Филигрань, 2017. 119 с.
Кондратьева Л.М., Полевская О.С., Литвиненко З.Н., Голубева Е.М., Коновалова Н.С. Роль микробного сообщества в формировании натечного образования “Лунное молоко” в карстовой пещере Снежная (Абхазия) // Микробиология. 2016. Т. 85С. 598–608.
Kondratyeva L.M., Polevskaya O.S., Litvinenko Z.N., Golubeva E.M., Konovalova N.S. Role of the microbial community in formation of speleothem (moonmilk) in the Snezhnaya carst cave (Abkhazia) // Microbiology (Moscow). 2016. V. 85. P. 629–637.
Кузьмина Л.Ю., Галимзянова Н.Ф., Абдуллин Ш.Р., Рябова А.С. Микробиота пещеры Киндерлинская (Республика Башкортостан) // Микробиология. 2012. Т. 81. С. 273–281.
Kuzmina L.Y., Galimzianova N.F., Abdullin S.R., Ryabova A.S. Microbiota of the Kinderlinskaya cave (South Urals, Russia) // Microbiology (Moscow). 2012. V. 81. P. 251–258.
Куманяев А.С. Казикова М.А., Лунева К.Ю., Макаренко М.А., Попкова А.В., Стукалова П.Н., Мазина С.Е. Микромицеты карстовой пещерной системы Снежная–Меженного–Иллюзия // Успехи медицинской микологии. 2014. Т. 12. С. 115–116.
Методы почвенной микробиологии и биохимии. Под ред.Звягинцева Д.Г.. М.: Изд-во МГУ, 1991. 302 с.
Определитель бактерий Берджи // Под ред. Хоулта Дж., Крига Н., СнитаП., Дж. Стейнли, Уилльямса C. 9-е изд. Т. 2. М.: Мир, 1997. 368 с.
Хижняк С.В., Таушева И.В., Березикова А.А., Нестеренко Е.В., Рогозин Д.Ю. Психрофильные и психротолерантные гетеротрофные микроорганизмы карстовых полостей Средней Сибири // Экология. 2003. № 4. С. 261–266.
Benson D.A., Cavanaugh M., Clark K., Karsch-Mizrachi I., Lipman D.J., Ostell J.S., Sayers E.W. GenBank // Nucleic Acids Res. 2013. V. 45 (D1). Database issue. P. D37–D42. https://doi.org/10.1093/nar/gks1195
Chen J.-J., Lin L.-B., Zhang L.-L., Zhang J., Tang S.-K., Wei Y.-L., Li W.-J. Laceyella sediminis sp. nov., a thermophilic bacterium isolated from a hot spring // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 38–42. https://doi.org/10.1099/ijs.0.028282-0
Cole J. R., Wang Q., Fish J. A., Chai B., McGarrell D.M., Sun Y., Brown C.T., Porras-Alfaro A., Kuske C.R., Tiedje J.M. Ribosomal database project: data and tools for high throughput rRNA analysis // Nucleic Acids Res. 2014. V. 42. Database issue. P. D633–D642. https://doi.org/10.1093/nar/gkt1244
De Mandal S., Chatterjee R., Kumar N.S. Dominant bacterial phyla in caves and their predicted functional roles in C and N cycle // BMC Microbiology. 2017. V. 17. Article 90. P. 1–9. https://doi.org/10.1186/s12866-017-1002-x
Felsenstein J. Confidence limits on phylogenies: An approach using the bootstrap // Evolution. 1985. V. 39. P. 783–791.
Ghosh S., Kuisiene N., Cheeptham N. The cave microbiome as a source for drug discovery: Reality or pipe dream? // Biochem. Pharmacol. 2017. V. 15. V. 134. P. 18–34. https://doi.org/10.1016/j.bcp.2016.11.018
Goodfellow M., Jones A.L. Family IX. Thermoactinomycetaceae Matsuo, Katsuta, Matsuda, Shizuri, Yokota and Kasai 2006, 2840VP // Bergey’s manual of systematic bacteriology, 2nd edn. V. 3. The Firmicutes. Dordrecht, Heidelberg, London, New York Springer, 2009. P. 434–453.
Hëlisto P., Aktuganov G., Galimzianova N., Melentjev A., Korpela T. Lytic enzyme complex of an antagonistic Ba-cillus sp. X-b: Isolation and purification of components // J. Chromatogr. B Biomed Sci. Appl. 2001. V. 758. P. 197–205.
Howarth F. Ecology of cave arthropods // Ann. Rev. Entomol. 2003. V. 28. P. 365–389. https://doi.org/10.1146/annurev.en.28.010183.002053
Kaur N., Arora A., Kumar N., Mayilra S. Genome sequencing and annotation of Laceyella sacchari strain GS 1-1, isolated from hot spring, Chumathang, Leh, India // Genom. Data. 2014. V. 2. P. 18–19. https://doi.org/10.1016/j.gdata.2013.10.007
Krolicka M., Hinz S.W.A., Koetsier M.J., Joosten R., Eggink G., van den Broek L.A.M., Boeriu C.G. Chitinase Chi1 from Myceliophthora thermophila C1, a thermostable enzyme for chitin and chitosan depolymerization // J. Agric. Food Chem. 2018. V. 66. P. 1658–1669. https://doi.org/10.1021/acs.jafc.7b04032
Kumar S., Stecher G., Tamura K. MEGA7: Molecular evolutionary genetics analysis version 7.0 for bigger datasets // Mol. Biol. Evol. 2016. V. 3. P. 1870–1874. https://doi.org/10.1093/molbev/msw054
Panosyan H. Thermoactinomycetes isolated from geothermal springs in Armenia capable of producing extracellular hydrolases // Environ. Sustain. 2019. V. 2. P. 219–226. https://doi.org/10.1007/s42398-019-00066-0
Rodriguez-Kabana R., Godoy G., Morgan-Jones G., Shelby R. The determination of soil chitinase activity: conditions for assay and ecological studies // Plant Soil. 1983. V. 75. P. 95–106. https://doi.org/10.1007/BF02178617
Saitou N., Nei M. The neighbor-joining method: A new method for reconstructing phylogenetic trees // Mol. Biol. Evol. 1987. V. 4. P. 406–425.
Shibasaki H., Uchimura K., Miura T., Kobayashi T., Usami R., Horikoshi K. Highly thermostable and surfactant-activated chitinase from a subseafloor bacterium, Laceyella putida // Appl. Microbiol. Biotechnol. 2014. V. 98. P. 7845–7853. https://doi.org/10.1007/s00253-014-5692-9
Swiontek Brzezinska M., Jankiewicz U., Burkowska A., Walczak M. Chitinolytic microorganisms and their possible application in environmental protection // Curr. Microbiol. 2014. V. 68. P. 71–81. https://doi.org/10.1007/s00284-013-0440-4
Tamura K., Nei M., Kumar S. Prospects for inferring very large phylogenies by using the neighbor-joining method // Proc. Natl. Acad. Sci. USA. 2004. V. 101. P. 11030–11035.
Tomova I., Lazarkevich I., Tomova A., Kambourova M., Vasileva-Tonkova E. Diversity and biosynthetic potential of culturable aerobic heterotrophic bacteria isolated from Magura Cave, Bulgaria // Int. J. Speleol. 2013. V. 42. P. 65–76. https://doi.org/10.5038/1827-806X.42.1.8
Whitaker Jr. J.O., Dannelly H.K., Prentice D.A. Chitinase in insectivorous bats // Geomicrobiol. J. 2014. V. 31. P. 116–127. https://doi.org/10.1080/01490451.2013.815292
Yoon H.-G., Kim H.-Y., Lim Y.-H., Cho H.Y. Cloning and expression of a chitinase gene from Thermoactinomyces vulgaris KFB-C100 // J. Microbiol. Biotechnol. 1998. V. 8. P. 560–567.
Yoon J.H., Kim I.G., Shin Y.K., Park Y.H. Proposal of the genus Thermoactinomyces sensu stricto and three new genera, Laceyella, Thermoflavimicrobium and Seinonella, on the basis of phenotypic, phylogenetic and chemotaxonomic analyses // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 395–400.
Дополнительные материалы отсутствуют.