Микробиология, 2020, T. 89, № 5, стр. 556-565
Молекулярный анализ состава микробного сообщества, формирующегося при непрерывном культивировании Methylococcus sp. Concept-8 на природном газе
И. Ю. Ошкин a, С. Э. Белова a, Н. С. Хохлачев b, В. А. Семенова b, О. П. Червякова b, Д. В. Чернушкин c, Е. Н. Тихонова a, А. В. Марданов d, Н. В. Равин d, В. О. Попов e, Н. В. Пименов a, С. Н. Дедыш a, *
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
b ООО “Газпром ВНИИГАЗ”
142717 Московская обл., Развилка, Россия
c ООО “НПО Биосинтез”
127018 Москва, Россия
d Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
e Институт биохимии им. А.Н. Баха, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
* E-mail: dedysh@mail.ru
Поступила в редакцию 20.05.2020
После доработки 22.05.2020
Принята к публикации 29.05.2020
Аннотация
Проведен мониторинг состава микробного сообщества, формирующегося в процессе длительного (более 2 мес.) непрерывного культивирования облигатного метанотрофа Methylococcus sp. Concept-8 на природном газе в ферментере объемом 50 л при 42°С и pH 5.6. Процесс стабильного роста с высокой оптической плотностью культуры (средняя OD540 = 13.5), удельной скоростью роста 0.2 ч–1 и выходом биомассы 4.0–4.5 г/л в пересчете на сухое вещество, продолжался в течение 50 дней. В последующий период нестабильного режима имело место резкое снижение оптической плотности до OD540 = 4. В составе культуральной жидкости были выявлены формиат, ацетат, а также ряд неидентифицированных кислот, являющихся продуктами окисления гомологов метана. Микроскопический анализ показал, что доля клеток сопутствующих микроорганизмов в культуре была максимальна (10–15% общего числа клеток) в период стабильного роста и снижалась до 4.5% в период падения оптической плотности. С помощью молекулярного профилирования состава сообщества по генам 16S рРНК в числе основных сопутствующих микроорганизмов были идентифицированы представители родов Cohnella, Brevibacillus, Azospirillim, Thermomonas, Cupriavidus и Paenibacillus, отвечающие за утилизацию метаболитов и продуктов лизиса клеток метанотрофа. Основным отличием состава сообщества в фазе нестабильного роста было резкое снижение относительной доли бактерий рода Brevibacillus, предположительно ответственных за окисление ацетата. Изоляты, полученные с помощью культуральных подходов, лишь частично покрывали разнообразие сообщества, выявленное с помощью молекулярного анализа. Выделение культур родов Brevibacillus и Cupriavidus, представляющих функционально важные компоненты сообщества, открывает возможности для направленного формирования искусственных ассоциаций со штаммом Concept-8, отличающихся высокими продукционными характеристиками и стабильностью роста.
Метанотрофные бактерии – это группа прокариот, структурно и функционально специализированных на использовании метана в качестве источника углерода и энергии (Hanson, Hanson, 1996; Гальченко, 2001; Trotsenko, Murrell, 2008; Khmelenina et al., 2018). Эта функциональная специфика метанотрофов лежит в основе их использования в биотехнологии получения кормового белка на основе метана (Григорян, Горская, 1970; Hamer, Harrison, 1980; Лалов, 1991; Strong et al., 2015). В промышленном производстве кормового белка Гаприна, реализованном в СССР в середине 1980-х годов, в качестве штамма-продуцента был использован облигатный метанотроф Methylococcus capsulatus ВСБ-874. При длительном непрерывном культивировании этой бактерии на природном газе в условиях незащищенной ферментации происходило спонтанное формирование смешанной культуры, состоящей из клеток штамма-продуцента и сопутствующих микроорганизмов. При стабильных технологических показателях процесса культура состояла на 85–95% из клеток метанотрофа и на 5–15% из клеток сопутствующих микроорганизмов (Буторова, 1991). Идентификация последних с помощью морфолого-биохимических критериев, применяемых в систематике микроорганизмов в то время, позволила отнести их к родам Flavobacterium, Frateuria, Paracoccus, Bacillus, Sporosarcina и Clostridium. Однако из-за отсутствия молекулярных методов идентификации точное установление таксономической принадлежности бактерий, развивающихся в составе промышленной ассоциации Methylococcus capsulatus ВСБ-874, было невозможным.
Функциональная роль микроорганизмов-спутников в поддержании стабильного роста метанотрофных бактерий хорошо известна и заключается в утилизации продуктов их метаболизма и лизиса клеток (Linton, Drozd, 1982; Буторова, 1991; Bothe et al., 2002; Stock et al., 2013). Другая возможная функция спутников состоит в снабжении метанотрофов факторами роста (Iguchi et al., 2011). Как было показано в модельных экспериментах по созданию искусственных ассоциаций Methylomonas methanica NCIMB 11130T, активность окисления метана такими ассоциациями возрастала при увеличении разнообразия гетеротрофных спутников (Ho et al., 2014). Роль ассоциированных микроорганизмов особенно велика при культивировании метанотрофов на природном газе, содержащем гомологи метана. При их соокислении образуется ряд метаболитов, таких как ацетат и пропионат, удаление которых из культуральной жидкости осуществляют спутники-гетеротрофы. Так, в экспериментах по производству белка одноклеточных в Дании было обнаружено, что при незащищенном культивировании Mc. capsulatus (Bath) на природном газе этот метанотроф образует устойчивую ассоциацию с Brevibacillus agri, Ralstonia sp. и Aneurinibacillus sp., ответственными за утилизацию ацетата и пропионата (Bothe et al., 2002). Однако известны также и случаи ингибирующего влияния бактерий-спутников на рост метанотрофов (Stock et al., 2013). Таким образом, контроль и направленное формирование состава ассоциированных с метанотрофом-продуцентом бактерий имеют важнейшее значение для обеспечения стабильности процесса производства белка на природном газе.
Использованный в настоящем исследовании Methylococcus sp. Concept-8 является производной длительного хранения и селекции промышленной культуры Mc. capsulatus ВСБ-874, которую поддерживали на протяжении последних десятилетий в ООО “Газпром ВНИИГАЗ”. Для культуры характерны высокие скорости роста и высокий выход биомассы на метане, что позволяет рассматривать ее в качестве перспективного штамма-продуцента. Определение полной последовательности генома этого метанотрофа позволило произвести исчерпывающий анализ генов, кодирующих основные пути метаболизма С1 соединений (Ошкин и соавт., 2020). Штамм Concept-8 культивировали на природном газе в ферментере в течение более 2-х месяцев, в результате чего сформировалась устойчивая ассоциация бактерий.
Цель настоящей работы заключалась в анализе компонентного состава сообщества, сформировавшегося в результате непрерывного культивирования Methylococcus sp. Concept-8 на природном газе, и идентификации функционально важных бактерий-спутников.
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Режим культивирования штамма Concept-8 и отбор проб для анализа. Незащищенное культивирование проводили на аппарате УФ-50.018 (производство ООО “Эй ПИ Биосистемы”, Россия), оснащенном перемешивающим устройством с четырьмя турбинными мешалками, двойной рубашкой, датчиком кислотности среды и датчиком растворенного кислорода Mettler Toledo InPro 6850i (“Mettler Toledo”, Швейцария). Общий объем ферментера составляет 50 л, рабочий объем среды – 30 л. Культура штамма Concept-8, содержащая 10% спутников, была использована в качестве инокулята.
Состав среды включал следующие компоненты (г л–1): K2SO4, 0.146; MgSO4 ∙ 7H2O, 0.105; H3PO4 (75%), 0.31 мл/л и 1 мл раствора микроэлементов следующего состава (мг/л): ZnSO4 ∙ 7H2O, 0.1; MnSO4 ∙ 4H2O, 0.03; CuSO4 ∙ 5H2O, 0.1; FeSO4 ∙ 7H2O, 2.0; CoSO4 ∙ 2H2O, 0.2; H3BO3, 0.03; Na2MoO4, 0.03. Для поддержания рН титрование осуществляли 0.8% раствором NH4OH. Культивирование проводили на природном газе при постоянной температуре 42°С, pH 5.6 и в отсутствии избыточного давления при средней скорости протока 0.2 h–1. В состав природного газа входили следующие основные компоненты (об. %): метан, 96.00; этан, 2.04 и пропан, 0.62. Аэрирование осуществляли газо-воздушной смесью при заданном расходе в соотношении метан : воздух = 25 : 75%. Оптическую плотность (OD540) клеточной суспензии измеряли каждый час на спектрофотометре КФК-3 (“ЗОМЗ”, Россия). Контроль pH и концентрации растворенного кислорода осуществляли автоматически.
Отбор проб клеточной культуры для анализа в объеме 10 мл проводили в 3-кратной повторности во временных точках, соответствующих 32, 39, 47, 56 и 62 сут с начала культивирования. Суспензии клеток использовали для микроскопического анализа и для выделения культур бактерий-спутников. Далее клетки осаждали центрифугированием при 10000 g в течение 10 мин. В супернатанте определяли содержание органических соединений, а клетки использовали для выделения ДНК и проведения молекулярного анализа состава микробного сообщества.
Анализ культуры с помощью фазово-контрастной и электронной микроскопии. Мониторинг состояния культуры осуществляли с использованием фазово-контрастной микроскопии и микроскопа Zeiss Axioplan 2 (“Carl Zeiss”, Германия). Долю бактерий-спутников оценивали путем учета общего числа клеток и числа клеток, морфологически отличных от Methylococcus sp. Concept-8, в 10 полях зрения.
Образцы клеток, отобранные для электронной микроскопии, фиксировали раствором 2.5% глутарового альдегида в какодилатном буфере (0.05 М раствор какодилата натрия, рН 7.0–7.5) и выдерживали в течение 1 сут при 4°С; затем трижды промывали тем же буферным раствором в течение 5 мин и фиксировали в растворе OsO4 (1% OsO4 + 0.7% раствор рутениевого красного в какодилатном буфере) 1.5 ч при 4°С. После фиксации образцы заключали в 2% агар-агар и последовательно выдерживали в 3% растворе уранилацетата в 30% этиловом спирте в течение 4 ч, далее в 70% этаноле в течение 12 ч при 4°С. Материал обезвоживали в 96% этиловом спирте (2 раза по 15 мин), затем в абсолютном ацетоне (3 раза по 10 мин). Образцы пропитывали смолой ЭПОН-812 (Ероху Embedding Medium Эпон® 812, “Sigma-Aldrich”, США) выдерживая в смеси смола : ацетон в соотношении 1 : 1 (1 ч), затем в смеси смола : ацетон в соотношении 2 : 1 (1 ч). Полученный материал заливали в капсулы со смолой и проводили полимеризацию при температуре 37°С в течение 1 сут, затем при 60°С в течение 1 сут.
Ультратонкие срезы получали на микротоме LKB-III (“LKB”, Швеция) и контрастировали в водном растворе 3% уранилацетата (30 мин), затем в водном растворе 4% цитрата свинца (30 мин). Полученные препараты анализировали с помощью электронного микроскопа JEM 100CXII (“Jeol”, Япония) при ускоряющем напряжении 80 кВ и рабочем увеличении 5000–50 000. Фотодокументирование материалов проводили с помощью цифровой системы вывода оптических изображений Morada G2.
Получение репрезентативных изолятов и их идентификация. Для выделения чистых культур гетеротрофных спутников использовали две агаризованные среды: LB (Luria-Bertani, “Difco”), разбавленную в 5 раз, и R2A Agar (“Difco”), разбавленную в 2 раза. После рассева образцов клеточной суспензии из ферментера на эти среды чашки с посевами инкубировали в термостате при 30°С в течение 3–5 сут. Формирующиеся на среде колонии анализировали с использованием фазово-контрастной микроскопии и отсевали на чашки с аналогичной средой. Идентификацию полученных изолятов проводили путем анализа последовательностей генов 16S рРНК. ПЦР-амплификацию генов 16S рРНК проводили на термоциклере PE GeneAmp PCR System 9700 (“Perkin-Elmer Applied Biosystems”, США) с использованием универсальных для бактерий праймеров 9f и 1492r (Weisburg et al., 1991).
Аналитическое определение органических соединений. Идентификацию и определение концентрации возможных метаболитов в культуральной жидкости проводили с использованием высокоэффективной жидкостной хроматографии на приборе ВЖХ Стайер (“Аквилон”, Россия) с ультрафиолетовым детектором.
Молекулярный анализ состава метанотрофного сообщества. Выделение тотальной ДНК из образцов осажденных клеток проводили с помощью набора DNeasy Power Soil Kit (“Qiagen”). Состав сообщества прокариот определяли на основании анализа последовательностей вариабельного региона V3–V4 гена 16S рРНК, амплифицированного с помощью ПЦР с использованием праймеров PRK341F (5'-CCTACGGGRBGCASCAG-3') и PRK806R (5'-GGACTACYVGGGTATCTAAT-3'). Полученные ПЦР фрагменты использовали для приготовления библиотеки для секвенирования с помощью наборов Nextera XT DNA Library Prep Kit (“Illumina”, США) по протоколам производителя. Полученные библиотеки секвенировали на MiSeq (“Illumina”) с использованием наборов MiSeq Reagent Kit V3 (в формате парных чтений 2 × 300 нт); пересекающиеся чтения объединяли с помощью программы FLASH v 1.2.11 (Magoč, Salzberg, 2011). Полученные последовательности кластеризовали в оперативные таксономические единицы (ОТЕ) на видовом уровне идентичности (97% сходства). Таксономическую идентификацию ОТЕ проводили с помощью классификатора SINA по базе последовательностей рРНК SILVA с параметрами по умолчанию (Pruesse et al., 2012). Также для таксономической идентификации ОТЕ проводили поиск ближайших последовательностей генов 16S рРНК в GenBank с помощью BLASTN.
РЕЗУЛЬТАТЫ
Непрерывное культивирование штамма Concept-8. До начала эксперимента чистую культуру штамма Concept-8 растили в ферментере в незащищенных (нестерильных) условиях с целью максимального приближения к промышленным условиям получения белка из метанотрофных бактерий. Сформированную в результате такого культивирования ассоциацию микроорганизмов использовали для инокуляции ферментера в данном эксперименте (начальная OD540 = 2.5). Контролируемый рост культуры поддерживали в течение 68 сут (рис. 1). Фаза стабильного роста с высокой оптической плотностью (средняя OD540 = 13.5) была достигнута спустя 2 нед. после начала культивирования. Средняя скорость роста культуры в этой фазе составляла 0.2 ч–1, выход биомассы в пересчете на сухое вещество был в диапазоне 4.0–4.5 г/л. В период нестабильного режима имело место резкое снижение оптической плотности до OD540 = 4 с последующим восстановлением до прежних показателей. Максимальная зарегистрированная оптическая плотность составила OD540 = = 18.5. Отбор проб для анализа был произведен как в период условно “стабильного”, так и “нестабильного” режимов (точки отбора помечены стрелками на рис. 1).
Рис. 1.
Динамика роста Methylococcus sp. Concept-8 при непрерывном культивировании в ферментере на природном газе (черная кривая) и доля клеток сопутствующих бактерий в составе метанотрофного сообщества по данным микроскопического анализа (синяя кривая, пунктир). Красными стрелками указаны точки отбора проб для анализа.
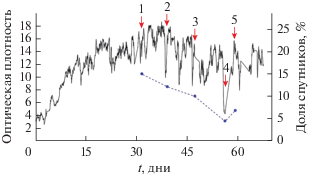
Микроскопический анализ культуры. Исследование культуры из ферментера с помощью фазово-контрастной микроскопии показало, что она состоит из одиночных и двойных кокковидных клеток Methylococcus sp. Concept-8, а также морфологически отличных от метанотрофа клеток бактерий-спутников. Последние были представлены крупными толстыми и мелкими тонкими палочками, овоидами и короткими спириллами. Доля клеток сопутствующих микроорганизмов была максимальной в период стабильного роста и составляла 10–15% общего числа клеток в культуре. В период нестабильного роста доля спутников снижалась до 4.5%, а затем возрастала до 7% (рис. 1).
Анализ ультратонкого строения клеток с помощью электронной микроскопии выявил существенное различие культур, отобранных в стадии стабильного роста и стадии падения оптической плотности (рис. 2). В стадии оптимального роста культура состояла преимущественно из молодых клеток, содержащих многочисленные плотно упакованные внутрицитоплазматические мембраны (ВЦМ). Многочисленные мелкие рибосомы заполняли большую часть клетки (рис. 2а). В клетках, отобранных в фазе снижения роста, наблюдались нарушения клеточной стенки и увеличение переплазматического пространства. Клетки содержали большое количество гранул запасных веществ (рис. 2б). Число рибосом и ВЦМ в клетках снижалось, причем упаковка ВЦМ была более диффузной, чем в молодых клетках. Эти изменения свидетельствуют о существенном падении метаболической активности клеток метанотрофа в фазе нестабильного роста.
Рис. 2.
Ультратонкие срезы клеток Methylococcus sp. Concept-8 в фазе стабильного роста (а) и в фазе снижения оптической плотности (б). Маркер длины: а – 1 мкм; б – 0.5 мкм. Черными стрелками обозначены внутрицитоплазматические мембраны; белыми стрелками – гранулы запасных веществ.
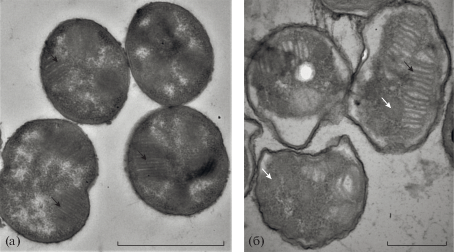
Анализ препаратов с помощью электронной микроскопии не выявил присутствия фаговых частиц ни в фазе стабильного роста, ни в период падения оптической плотности культуры.
Содержание метаболитов в культуральной жидкости. Использование высокоэффективной жидкостной хроматографии позволило выявить наличие в составе культуральной жидкости штамма Concept-8 формиата, ацетата, а также четырех кислот, которых не удалось идентифицировать. Концентрация формиата варьировала от 0 до 0.7 мМ, достигая максимального значения в период падения оптической плотности культуры. Диапазон зарегистрированных концентраций ацетата составил 0–0.6 мМ, причем их максимальные значения (0.4–0.6 мМ) были отмечены в периоды стабильного роста. В периоды падения плотности культуры концентрация ацетата в культуральной жидкости снижалась до 0–0.1 мМ. Неидентифицированные кислоты присутствовали в образцах в следовых количествах, причем их разнообразие было максимальным в фазе стабильного роста.
Молекулярный анализ состава метанотрофного сообщества. В общей сложности, из исследованных образцов клеточного материала было получено 216522 частичных последовательности генов 16S рРНК со средней длиной ~440 нт. На каждый из пяти проанализированных образцов, представленных тремя повторностями, приходилось около 40000 прочтений. Общее бактериальное разнообразие в исследованном сообществе было представлено 18-ю ОТЕ видового уровня (табл. 1). Наиболее многочисленная ОТЕ соответствовала последовательности гена 16S рРНК штамма-продуцента Methylococcus sp. Concept-8. В составе основных компонентов сообщества были идентифицированы представители родов Cohnella, Brevibacillus, Azospirillim, Thermomonas, Paenibacillus и Cupriavidus. В числе минорных компонентов сообщества были выявлены бактерии родов Pigmentiphaga, Burkholderia, Ochrobactrum, Clostridium, Acidovorax, Caulobacter, Methyloversatilis и Chryseobacterium (табл. 1).
Таблица 1.
Репрезентативные ОТЕ, полученные в результате молекулярного анализа метанотрофного сообщества из ферментера
| ОТЕ | Ближайший родственник | Номер депонирования гена 16S рРНК | Процент сходства | Ближайший доступный геном | Число оперонов рРНК |
|---|---|---|---|---|---|
| ОТЕ1 | Methylococcus capsulatus Bath | AE017282.2 | 97.0 | AE017282.2, Methylococcus capsulatus Bath | 2 |
| ОТЕ2 | Brevibacillus sp. KSL51201-067 | GQ497292.1 | 98.5 | NC_012491.1, Brevibacillus brevis NBRC 100599 | 15 |
| ОТЕ3 | Cohnella sp. CAU | MH892071.1 | 96.8 | NZ_CP033433.1, Cohnella candidum | 9 |
| ОТЕ4 | Cohnella candidum 18JY8-7 | CP033433.1 | 96.8 | NZ_CP033433.1, Cohnella candidum | 9 |
| ОТЕ5 | Azospirillum lipoferum NRB228 | MK543121.1 | 98.6 | NC_016622.1, Azospirillum lipoferum 4B | 9 |
| ОТЕ6 | Paenibacillus sp. DXL2 | MH396718.1 | 98.7 | NC_014622.2, Paenibacillus polymyxa | 5 |
| ОТЕ7 | Cupriavidus gilardii R28 | MH997470.1 | 98.7 | NZ_CP010516.1, Cupriavidus gilardii CR3 | 3 |
| ОТЕ8 | Pigmentiphaga sp. RA2 | MT113087.1 | 97.6 | NZ_SGXC00000000.1, Pigmentiphaga kullae strain | 1 |
| ОТЕ9 | Thermomonas sp. DH-29 | MG016495.1 | 98.7 | NZ_FQUK00000000.1, Thermomonas hydrothermalis | 1 |
| ОТЕ10 | Clostridium sp. PPf35E10 | AY548785.1 | 98.9 | NZ_CP011803.1, Clostridium carboxidivorans P7 | 7 |
| ОТЕ11 | Acidovorax sp. AIA_XES_446 | MN704227.1 | 98.7 | NC_015138.1, Acidovorax avenae subsp. avenae ATCC 19860 | 1 |
| ОТЕ12 | Paenibacillus ehimensis HD | MT186159.1 | 98.9 | GCA_004000785.1, Paenibacillus ehimensis NBRC 15659 | 1 |
| ОТЕ13 | Burkholderia sp. XW25 | MN908292.1 | 99.2 | NZ_CP012981.1, Burkholderia cepacia ATCC 25416 | 5 |
| ОТЕ14 | Ochrobactrum intermedium LB1 | MT320017.1 | 98.9 | NZ_ACQA01000001.1, Ochrobactrum intermedium LMG 3301 | 4 |
| ОТЕ15 | Clostridium aciditolerans KVV2 | MK898831.1 | 98.6 | NZ_CP011803.1, Clostridium carboxidivorans P7 | 7 |
| ОТЕ16 | Chryseobacterium bernardetii H4638 | CP033931.1 | 98.7 | NZ_CP033931.1, Chryseobacterium bernardetii H4638 | 6 |
| ОТЕ17 | Caulobacter sp. CC84 | MN955579.1 | 98.4 | NZ_CP034122.1, Caulobacter vibrioides CB2A | 2 |
| ОТЕ18 | Methyloversatilis sp. PL20 | KF206392 | 98.7 | GCA_000374245.1, Methyloversatilis discipulorum RZ94 | 2 |
Соотношение числа прочтений, полученных для каждого из основных компонентов метанотрофного сообщества в различные фазы роста, представлено на рис. 3а. Доля последовательностей штамма-продуцента варьировала в диапазоне 22–51%, что существенно противоречило величинам, полученным при прямом подсчете клеток с помощью микроскопии. Объяснение этому противоречию было найдено путем сравнительного анализа числа оперонов рРНК в геномах основных компонентов сообщества (табл. 1). Этот анализ выявил значительное различие числа оперонов рРНК в геноме штамма-продуцента (2 копии в геноме Methylococcus sp. Concept-8; Ошкин и соавт., 2020) и таковых в геномах основных бактерий-спутников (до 15 копий в геноме Brevibacillus brevis NBRC 100599). Как результат, доля штамма-продуцента в сообществе оказалась существенно занижена. Корректировка компонентного состава сообщества с учетом числа копий оперонов рРНК в геномах соответствующих бактерий дала результаты, значительно лучше согласующиеся с данными микроскопического анализа (рис. 3б).
Рис. 3.
Состав бактериального сообщества, формирующегося при непрерывном культивировании Methylococcus sp. Concept-8 на природном газе, определенный с помощью высокопроизводительного секвенирования ПЦР-амплифицированных фрагментов гена 16S рРНК. а – Исходное соотношение числа прочтений, полученных для разных таксонов бактерий; б – пересчет числа прочтений с учетом поправки на число копий гена 16S рРНК в геномах штамма-продуцента и ассоциированных с ним бактерий. Определения выполнены в 3-кратной повторности в каждой из пяти (1–5) точек отбора проб, показанных на рис. 1.
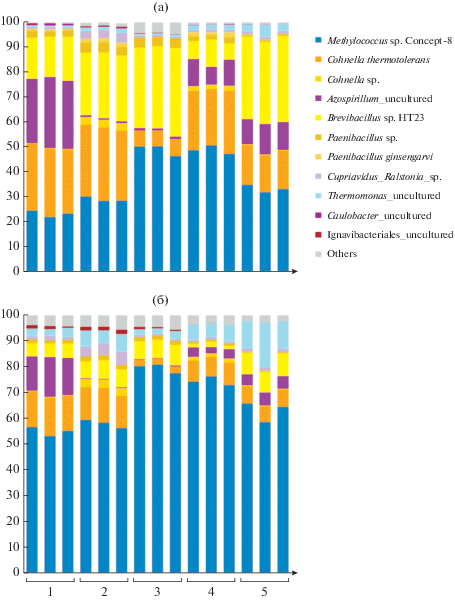
Основным отличием состава сообщества в фазе нестабильного роста (точка 4) было резкое снижение относительной доли бактерий рода Brevibacillus (рис. 3б). В точке 3, предшествующей падению оптической плотности, аналогичное снижение относительной доли было зарегистрировано для спутников родов Cohnella и Thermomonas. Для представителей родов Azospirillum и Cupriavidus наблюдались вспышки развития в отдельные периоды времени. Бактерии рода Paenibacillus постоянно присутствовали в составе сообщества в качестве минорного компонента.
Выделение и идентификация спутников. Работа по отбору морфологически различающихся колоний, сформировавшихся на средах R2A 1 : 2 и LB 1 : 5, их микроскопическому анализу, очистке и идентификации имела результатом получение 13 изолятов аэробных гетеротрофных бактерий (табл. 2). Четыре из них принадлежали к филуму Firmicutes и обнаруживали высокое сходство генов 16S рРНК (98.8–100%) с представителями рода Brevibacillus. Вторая группа из четырех изолятов представляла роды Cupriavidus и Ralstonia класса Betaproteobacteria. Изоляты третьей группы относились к классу Alphaproteobacteria, родам Ochrobactrum и Brevundimonas. Еще один изолят относился к роду Chryseobacterium филума Bacteroidetes. В целом, полученная коллекция изолятов представляла около четверти филотипов, выявленных в составе сообщества с помощью молекулярного анализа (табл. 1).
Таблица 2.
Филогенетическая принадлежность выделенных в чистую культуру бактерий, ассоциированных с Methylococcus sp. Concept-8
| Номер штамма | Филогенетическая группа | Ближайший представитель | Номер в Генбанке | % сходства |
|---|---|---|---|---|
| S1 | Alphaproteobacteria, Rhizobiales | Ochrobactrumintermedium C13 | KT808883.1 | 99.52 |
| S6, S7 | Ochrobactrum intermedium C13 | KT808883.1 | 99.72 | |
| S8 | Brevundimonas mediterranea N7 | MF156545.1 | 100 | |
| S5, S10 | Betaproteobacteria, Burkholderiales | Cupriavidus sp. S-6, Ralstonia sp. MSB2004 | HE660045.1 AY275491.1 | 99.79 99.79 |
| S17 | Cupriavidusgilardii CR3 | CP010516.1 | 99.49 | |
| S19 | Cupriavidus gilardii CR3 | CP010516.1 | 98.72 | |
| S2 | Bacteroidetes, Flavobacteriales | Chryseobacterium bernardetii H4638 | CP033931.1 | 99.57 |
| S3 | Firmicutes, Bacillales | Brevibacillus brevis DZBY05 | KM191283.1 | 100 |
| S11 | Brevibacillus brevis DZBY10 | KM191287.1 | 99.78 | |
| S12 | Brevibacillus brevis DZBY10 | KM191287.1 | 100 | |
| S15 | Brevibacillus fluminis CJ71 | NR_116293.1 | 98.82 |
ОБСУЖДЕНИЕ
В настоящей работе нами был использован комплекс комплементарных методов для мониторинга состава микробного сообщества, развивающегося в процессе длительного культивирования Methylococcus sp. Concept-8 на природном газе. Присутствие в последнем гомологов метана имеет своим следствием накопление продуктов их окисления в культуральной среде. Первые экспериментальные данные о способности Methylococcus capsulatus (Bath) окислять этан были опубликованы в оригинальном описании этого метанотрофа (Foster, Davis, 1966). Это свойство обусловлено способностью ключевого фермента метанотрофов, метанмонооксигеназы (ММО), окислять не только метан, но ряд легких алканов (Murrell, Smith, 2010). Особенно широкой субстратной специфичностью обладает растворимая ММО (Smith, Dalton, 2004), которая присутствует у всех представителей рода Methylococcus, включая штамм Concept-8 (Ошкин и соавт., 2020). Продукты окисления этана и пропана, этанол и пропанол, далее последовательно окисляются другими ферментами цепи окисления С1-соединений, что приводит к накоплению органических кислот в биореакторе (Leadbetter, Forster, 1958; Linton, Drozd, 1982), которые ингибируют рост метанотрофов. Другой возможной причиной накопления органических метаболитов в среде, таких как формиат, ацетат и лактат, является рост в условиях недостатка кислорода (Kalyuzhnaya et al., 2013), причем количество формиата обычно превышает количество ацетата. Как ацетат, так и формиат были обнаружены в составе культуральной среды в нашем эксперименте. Примечательно, что пик концентрации формиата (0.7 мМ) приходился на период нестабильного роста.
Формирование сообщества бактерий, ассоциированных с Methylococcus sp. Concept-8, происходило в условиях повышенной температуры (42°С), слабокислой реакции среды (рН 5.6) и доступности продуктов метаболизма метанотрофных клеток. Как показала настоящая работа, корректная оценка компонентного состава сообщества требует совокупного применения микроскопических и молекулярных методов анализа. На результаты последних значительное влияние может оказывать различие в копийности рибосомальных оперонов в геномах микроорганизмов-компонентов сообществ. Особенно значительные искажения показателей относительного обилия могут иметь место в случае присутствия в составе сообщества представителей Firmicutes, имеющих множественные копии оперонов рРНК. Представители этой группы бактерий, такие как Brevibacillus, Cohnella и Paenibacillus, являются постоянными и, по всей видимости, функционально важными компонентами ассоциации, формирующейся при росте штамма Concept-8 на природном газе. Доля Brevibacillus была одной из самых высоких в фазе стабильного роста и существенно снижалась при ухудшении ростовых характеристик сообщества. Ранее было показано, что в сообществе, образованном Mc. capsulatus (Bath), представитель рода Brevibacillus использовал ацетат и аминокислоты, попадающие в среду в результате лизиса клеток (Bothe et al., 2002). Более того, именно этот компонент сообщества наиболее эффективно снижал концентрацию общего углерода в культуральной среде. Очевидно, что бактерии рода Brevibacillus способны образовывать тесную ассоциацию с метанотрофами рода Methylococcus и, следовательно, играют важную роль в поддержании активного роста ассоциации.
Представители рода Cohnella также присутствовали в сообществе в течение всего периода культивирования. Последовательности генов 16S рРНК, полученные при анализе клеточного материала из ферментера, обнаруживали наибольшее сходство с Cohnella thermotolerans (95.06%). Это грамположительные термотолерантные бактерии семейства Paenibacillaceae, растущие в диапазоне 25–55°С, которые были впервые выделены в ходе микробиологического контроля качества образцов крахмала промышленного производства (Kämpfer et al., 2006). Их роль в сообществе остается неясной, так как они растут на разнообразных сахарах и не используют органические кислоты. Вероятно, они участвуют в утилизации продуктов лизиса клеток метанотрофа.
Численность бактерий рода Azospirillum была высока в 2 из 4 точек стабильного режима, а также при нестабильном режиме. Последовательность гена 16S рРНК, выявленная в данном исследовании, обнаруживала наибольшее сходство (98.64%) с Azospirillum lipoferum и Azospirillum oryzae. Представители Azospirillum способны использовать целый ряд субстратов, таких как ацетат, лактат, малат, фумарат и сукцинат (Hartmann, Zimmer, 1994). Некоторые представители рода, например, Azospirillum thiophilum и Azospirillum palustre, используют метанол и формиат (Orlova et al., 2016; Tikhonova et al., 2019). Ранее было показано, что при росте на метане метанотроф Methylobacter tundripaludum выделяет в культуральную жидкость метанол (Krause et al., 2017). Если это также справедливо для Methylococcus sp. Concept-8, представители Azospirillum могут его использовать в качестве субстрата для роста.
Бактерии рода Thermomonas, наиболее близкие к Thermomonas hydrothermalis, были обнаружены при всех режимах культивирования. T. hydrothermalis был впервые выделен из горячего источника в Португалии и использует ограниченный спектр ростовых субстратов, в числе которых ацетат и ряд аминокислот (Alves et al., 2003).
Культуральный метод позволил выделить представителей различных филогенетических групп, таких как Firmicutes, Alphaproteobacteria, Betaproteobacteria и Bacteroidetes, которые были выявлены также с помощью молекулярного анализа. Полученные изоляты лишь на четверть покрывали разнообразие сообщества, выявленное с помощью молекулярного анализа, что демонстрирует плохую применимость культуральных методов для оценки состава промышленно значимых сообществ микроорганизмов. Наиболее важным результатом применения культурального метода, однако, является выделение нескольких функционально важных компонентов сообщества, таких как бактерии родов Brevibacillus и Cupriavidus в чистых культурах. Изучение метаболических характеристик и геномного потенциала этих изолятов явится фундаментальной основой для направленного формирования искусственных ассоциаций со штаммом Concept-8, отличающихся высокими продукционными характеристиками и стабильностью роста.
Список литературы
Буторова И.А. Микробное сообщество на природном газе и возможности его регуляции. Автореф. дис. … канд. биол. наук. Л., 1991. 20 с.
Гальченко В.Ф. Метанотрофные бактерии. М.: ГЕОС, 2001. 500 с.
Григорян А.Н., Горская Л. Использование природного газа для микробиологического синтеза. М.: ОНТИ Микробиопром, 1970. 90 с.
Лалов В.В. Анализ и синтез энерготехнологических систем производства кормового белка из природного газа. Автореф. дис. … докт. биол. наук. М., 1991.
Ошкин И.Ю., Хмеленина В.Н., Бут С.Ю., Мирошников К.К., Белова С.Э., Хохлачев Н.С., Чернушкин Д.В., Белецкий А.В., Марданов А.В., Равин Н.В., Попов В.О., Дедыш С.Н., Пименов Н.В. Анализ полной последовательности генома нового представителя рода Methylococcus, штамма Concept-8 // Микробиология. 2020. Т. 89. № 3. С. 324–333.
Oshkin I.Yu., Khmelenina V.N., But S.Yu., Miroshnikov K.K., Belova S.E., Khokhlachev N.S., Chernushkin D.V., Beletsky A.V., Mardanov A.V., Ravin N.V., Popov V.O., Dedysh S.N., Pimenov N.V. Analysis of the complete genome sequence of strain Concept-8, a novel representative of the genus Methylococcus // Microbiology (Moscow). 2020. V. 89. P. 309–317.
Alves M.P., Rainey F.A., Nobre M.F., da Costa M.S. Thermomonas hydrothermalis sp. nov., a new slightly thermophilic γ-proteobacterium isolated from a hot spring in Central Portugal // Syst. Appl. Microbiol. 2003. V. 26. P. 70–75.
Bothe H., Møller Jensen K., Mergel A., Larsen J., Jørgensen C., Bothe H., Jørgensen L. Heterotrophic bacteria growing in association with Methylococcus capsulatus (Bath) in a single cell protein production process // Appl. Microbiol. Biotechnol. 2002. V. 59. P. 33–39.
Hamer G., Harrison D.E.F. Single cell protein: the technology, economics and future potential // Hydrocarbons in biotechnology / Eds. Harrison D.E.F., Higgins I.J., London W.R. London: Heyden Institute of Petroleum, 1980. P. 59–73.
Hanson R., Hanson T. Methanotrophic bacteria // Microbiol. Rev. 1996. V. 60. P. 439–471.
Hartmann A., Zimmer W. Physiology of Azospirillum // Azospirillum-Grass Association / Eds: Okon Y. Boca Raton: CRC, 1994. P. 15–39.
Ho A., de Roy K., Thas O., de Neve J., Hoefman S., Vandamme P., Heylen K., Boon N. The more, the merrier: Heterotroph richness stimulates methanotrophic activity // ISME J. 2014. V. 8. P. 1945–1948.
Iguchi H., Yurimoto H., Sakai Y. Stimulation of methanotrophic growth in cocultures by cobalamin excreted by rhizobia // Appl. Environ. Microbiol. 2011. V. 77. P. 8509–8515.
Kalyuzhnaya M.G., Yang S., Rozova O. N., Smalley N.E., Clubb J., Lamb A., Gowda G.A.N., Raftery D., Fu Y., Bringel F., Vuilleumier S., Beck D.A.C., Trotsenko Y.A., Khmelenina V.N., Lidstrom M.E. Highly efficient methane biocatalysis revealed in a methanotrophic bacterium // Nat. Commun. 2013. V. 4. P. 1–7. Article 2785.
Kämpfer P., Rosselló-Mora R., Falsen E., Busse H.-J., Tindall B.J. Cohnella thermotolerans gen. nov., sp. nov., and classification of ’Paenibacillus hongkongensis' as Cohnella hongkongensis sp. nov // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 781–786.
Khmelenina V.N., Murrell J.C., Smith V.J., Trotsenko Y.A. Physiology and biochemistry of the aerobic methanotrophs // Aerobic Utilization of Hydrocarbons, Oils and Lipids. Handbook of Hydrocarbon and Lipid Microbiology / Eds. Rojo F. Cham: Springer, 2018. P. 1–25.
Leadbetter E.R., Forster J.W. Studies on some methane-utilizing bacteria // Arch. Microbiol. 1958. V. 30. P. 91–118.
Linton J.D., Drozd J.W. Microbial interactions and communities in biotechnology // Microbial interactions and communities / Eds. Bull A.T., Slater J.H. London: Academic Press, 1982. V. 1. P. 357–406.
Magoč T., Salzberg S.L. FLASH: fast length adjustment of short reads to improve genome assemblies // Bioinformatics. 2011. V. 27. P. 2957–2963.
Orlova M.V., Tarlachkov S.V., Dubinina G.A., Belousova E.V., Tutukina M.N., Grabovich M.Y. Genomic insights into metabolic versatility of a lithotrophic sulfur-oxidizing diazotrophic Alphaproteobacterium Azospirillum thiophilum // FEMS Microbiol. Ecol. 2016. V. 92. P. fiw199.
Pruesse E., Peplies J., Glöckner F.O. SINA: Accurate high-throughput multiple sequence alignment of ribosomal RNA genes // Bioinformatics. 2012. V. 28. P. 1823–1829.
Smith T.J., Dalton H. Biocatalysis by methane monooxygenase and its implications for the petroleum industry // Petroleum Biotechnology: Developments and Perspectives Studies in Surface Science and Catalysis / Eds. Q.-R.R. Vazquez-Duhalt R. Elsevier, 2004. P. 177–192.
Stock M., Hoefman S., Kerckhof F.M., Boon N., De Vos P., De Baets B., Heylen K., Waegeman W. Exploration and prediction of interactions between methanotrophs and heterotrophs // Res. Microbiol. 2013. V. 164. P. 1045–1054.
Strong P.J., Xie S., Clarke W.P. Methane as a resource: Can the methanotrophs add value? // Environ. Sci. Technol. 2015. V. 49. P. 4001–4018.
Tikhonova E.N., Grouzdev D.S., Kravchenko I.K. Azospirillum palustre sp. nov., a methylotrophic nitrogen-fixing species isolated from raised bog // Int. J. Syst. Evol. Microbiol. 2019. V. 69. P. 2787–2793.
Trotsenko Y.A., Murrell J.C. Metabolic aspects of aerobic obligate methanotrophy // Adv. Appl. Microbiol. 2008. V. 63. P. 183–229.
Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study // J. Bacteriol. 1991. V. 173. P. 697–703.
Дополнительные материалы отсутствуют.


