Микробиология, 2020, T. 89, № 5, стр. 547-555
Сульфатредукция в подземных горизонтах затопленной угольной шахты в Кузбассе
И. А. Панова a, И. И. Русанов b, В. В. Кадников c, Е. А. Латыголец a, М. Р. Авакян a, М. В. Иванов a, В. С. Зюсман a, А. А. Ковалева a, Н. В. Равин c, Н. В. Пименов b, О. В. Карначук a, *
a Лаборатория биохимии и молекулярной биологии, Томский государственный университет
634050 Томск, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
c Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: olga.karnachuk@green.tsu.ru
Поступила в редакцию 14.05.2020
После доработки 22.05.2020
Принята к публикации 29.05.2020
Аннотация
Диссимиляционная сульфатредукция (ДСР) является важным микробным процессом в подземных водоносных горизонтах, однако ее геохимические последствия в этой экосистеме остаются малоизученными. Отсутствие данных по скорости процесса в условиях in situ не позволяет количественно оценивать резервуары серы. Настоящее исследование посвящено изучению микробной сульфатредукции в подземных водоносных горизонтах, ассоциированных с шахтой “Северная” по добыче угля в Кузбассе. Пробы воды отбирали из артезианской скважины, вскрывающей подземные горизонты затопленной шахты. На протяжении более чем десяти лет исследований температура воды колебалась в узких пределах (10–13°С), была восстановленной (–112…–174 мВ) и содержала до 6 мг/л H2S. Анализ микробного сообщества воды путем высокопроизводительного секвенирования гена 16S рРНК показал доминирование сероокисляющих бактерий Sulfurovum, Sulfuricurvum, Sulfurospirillum и Thiothrix. Филотипы, для которых известна способность к ДСР, не обнаружены. Измерение интенсивности сульфатредукции с ${\text{Na}}_{{\text{2}}}^{{{\text{35}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}},$ продемонстрировало относительно активный процесс, поставляющий при разгрузке скважины до 178 г восстановленной серы ежегодно. Путем варьирования условий культивирования в биореакторе выделены в чистую культуру два организма: психрофильный и ацидофильный Desulfomicrobium sp. DI и умеренно термофильный Desulfotomaculum LL1, представляющие минорные компоненты сообщества. Эти представители “редкой биосферы” могут быть ответственны за образование восстановленных соединений серы, используемых разнообразным и многочисленным сероокисляющим сообществом.
Диссимиляционная сульфатредукция является важным микробным процессом в подземных водоносных горизонтах (Orcutt et al., 2013; Momper et al., 2017; Bell et al., 2018). Несмотря на активное изучение сульфатредуцирующих прокариот (СРП) подземной биосферы (Moser et al., 2005; Chivian et al., 2008; Magnabosco et al., 2014; Karnachuk et al., 2019), их геохимическая активность остается малоизученной. Отдельные исследования, обсуждающие биогеохимию сульфатредукции, основаны на молекулярных данных (Anantharaman et al., 2016), в то время как интенсивности процессов in situ остаются неизученными. Нахождение функциональных маркеров диссимиляционной сульфатредукции и даже измерение их транскрипционной активности не позволяет количественно оценить резервуары форм серы. Оценка глобальных скоростей сульфатредукции в наземных глубинных водоносных горизонтах, аналогичная проведенной для морей (Bowles et al., 2014), пока остается невозможной.
В большинстве случаев подземные экосистемы характеризуются олиготрофными условиями, что определяет низкие скорости роста обитающих в них прокариот. Однако водоносные горизонты, ассоциированные с осадочными породами (нефтяными или угольными пластами), могут содержать достаточное количество органических соединений для поддержания активного роста гетеротрофов. Значительную долю в составе микробного сообщества могут составлять не только микроорганизмы, использующие углеводороды, лигнит или неметаморфизированные остатки растений, но и способные развиваться на низкомолекулярных органических кислотах. В связи с поиском источников углерода для подземной биосферы было получено экспериментальное подтверждение образования ацетата, формиата и оксалата в процессе метаморфизма лигнита (Glombitza et al., 2009).
Наши исследования посвящены изучению микробной сульфатредукции в подземных водоносных горизонтах, ассоциированных с шахтой по добыче угля в Кузбассе. Шахта “Северная”, находящаяся в черте города Кемерово на месте открытия каменного угля в Кузбассе в 18-ом веке, была заложена в 1934 году. В 1998 году шахта была закрыта классическим методом “мокрой” ликвидации с прекращением водоотлива и затоплением. Для контроля уровня грунтовых вод и предотвращения затопления жилых построек возле поля шахты была пробурена скважина, глубина которой по разным источникам составляет от 260 до 400 м. Скважина находится в естественном понижении рельефа на берегу реки Томь, куда и происходит разгрузка подземных вод. Подземная вода поступает из скважины под напором с дебетом 166–170 м3/ч. Место разгрузки содержит заметные обрастания Thiothrix, которые используют сероводород, содержащийся в подземной воде (Кадников и соавт., 2019). Анализ микробного сообщества воды путем высокопроизводительного секвенирования гена 16S рРНК показал доминирование сероокисляющих бактерий Thiovirga, Thiothrix, Sulfurovum и Sulfuricurvum (Кадников и соавт., 2019). При этом мы не обнаружили филотипов, для которых известна способность к диссимиляционной сульфатредукции, и вопрос происхождения сероводорода, поддерживающего разнообразное микробное сообщество в воде и местах разгрузки, оставался открытым.
В этом исследовании для определения происхождения H2S в воде скважины мы измерили скорость сульфатредукции с использованием радиоактивномеченного сульфата, а также культивировали сульфатредукторов, представляющих минорные компоненты сообщества, путем обогащения в биореакторе.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб, измерение физико-химических характеристик. Отбор проб воды из скважины, обозначенной Ku-5, и микробных обрастаний проводили в период с 2006 по 2020 годы. Даты отбора проб указаны в таблице к рис. 1. Пробы воды отбирали в месте излива скважины за исключением проб, отобранных в январе 2015 года, когда доступ был затруднен из-за снежного покрова, и воду отбирали из ручья на расстоянии около 10 м ниже по течению от скважины. Пробы микробных обрастаний отбирали с металлической обсадки скважины в месте излива. Микробные маты для культивирования сульфидогенов были отобраны 24.07.2015. Для определения состава микробного сообщества дополнительно отбирали пробы 15.01.2017 и 12.02.2020. Измерение скорости сульфатредукции проводили в пробах, полученных 12.02.2020. Микробные маты для культивирования отбирали в стерильные пластиковые пробирки и хранили в холодильнике до помещения в биореактор.
Рис. 1.
Скважина Ku-5 и микробные обрастания. В таблице представлены даты отбора проб и их физико-химические характеристики.

Физико-химические параметры воды, pH, температуру и окислительно-восстановительный потенциал, измеряли рН-метром HI18314F (“Hanna Instruments”, Германия). Определение содержания H2S проводили спектрофотометрическим методом с парафенилендиамином (Cline, 1969) в пробах, фиксированных 10% ацетатом цинка. Элементный состав воды определяли масс-спектрометрией с индуктивно связанной плазмой как описано ранее (Карначук и соавт., 2015).
Измерение скорости сульфатредукции. Для измерения скорости сульфатредукции в условиях приближенных к in situ пробы воды разливали в пенициллиновые флаконы объемом 30 мл и закрывали резиновой пробкой без доступа воздуха. Аликвоты (200 мкл) ${\text{Na}}_{{\text{2}}}^{{{\text{35}}}}{\text{S}}{{{\text{O}}}_{{\text{4}}}}$ (4 мкКи, “PerkinElmer”, США) вносили в пенициллиновые флаконы шприцем через резиновую пробку. Все измерения скорости сульфатредукции проводили в трех повторностях. Инкубировали флаконы в течение 24, 48 и 72 ч при температуре 12°С, после чего фиксировали 1 мл 1N раствора KOH. В лаборатории проводили разделение восстановленных форм серы кислотной перегонкой (кислоторастворимые сульфиды) и восстановлением CrCl2 (элементная, пиритная и органическая сера) как описано ранее (Карначук и соавт., 2006).
Выделение чистых культур сульфидогенов и изучение их физиологии. Образцы микробных обрастаний помещали в настольный биореактор Biostat B plus (“Sartorius Stedim Biotech GmbH”, Gottingen, Германия) с рабочим объемом 5 л, перемешиванием со скоростью 100 rpm, контролем рН и температуры. Использовали среду Видделя-Бака (Widdel, Bak, 1992), содержащую (в г/л): Na2SO4 – 4; KH2PO4 – 0.2; NH4Cl – 0.25; NaCl – 1; MgCl2 · · 6H2O – 0.4; KCl – 0.5; CaCl2 – 0.113; 2 мл раствора витаминов, 1 мл раствора микроэлементов, по 1 мл раствора Na2SeO3 и Na2WO4. Лактат (18 мM) использовали в качестве донора электронов и Na2S · 9H2O – в качестве восстановителя. Ультрачистый азот (99.9%) продували со скоростью 25 мл мин–1. Температуру в биореакторе изменяли в пределах от 17 до 50°С; рН поддерживали 7.5 в течение всего периода культивирования. В определенные моменты времени отбирали пробы из биореактора для измерения концентрации H2S, белка, а также наблюдения морфологии клеток под фазово-контрастным микроскопом. Вследствие продувки биореактора азотом, концентрацию H2S использовали только как показатель ответа культуры на изменения температуры.
Выделение ДНК, секвенирование и филогенетический анализ. Образец воды (объемом 20 л) пропускали через фильтры с диаметром пор 0.22 мкм. Фильтры гомогенизировали, растирая с жидким азотом, препарат метагеномной ДНК выделяли с помощью Power Soil DNA Isolation Kit (“MO BIO Laboratories Inc.”, Carlsbad, США). ДНК из мата выделяли тем же набором реактивов.
Состав сообщества прокариот определяли на основании анализа последовательностей вариабельного региона V3–V4 гена 16S рРНК, амплифицированного с помощью ПЦР с использованием праймеров PRK341F (5'-CCTACGGGRBGCASCAG-3') и PRK806R (5'-GGACTACYVGGGTATCTAAT-3'). Полученные ПЦР фрагменты использовали для приготовления библиотеки для секвенирования с помощью наборов Nextera XT DNA Library Prep Kit (“Illumina”, США) по протоколам производителя. Полученные библиотеки секвенировали на MiSeq (“Illumina”) с использованием наборов MiSeq Reagent Kit V3 (в формате парных чтений 2 × 300 нт). Полученные пересекающиеся чтения объединяли с помощью программы FLASH v 1.2.11 (Magoč, Salzberg, 2011). В результате было получено 17186 последовательностей фрагментов генов 16S рРНК для образца воды и 18259 последовательностей – для микробного мата. Каждый из этих наборов последовательностей кластеризовали в оперативные таксономические единицы (ОТЕ) на уровне 97% идентичности и удаляли химеры с помощью программы Usearch (Edgar, 2010). Таксономическую идентификацию ОТЕ проводили с помощью классификатора SINA по базе последовательностей рРНК SILVA с параметрами по умолчанию (Pruesse et al., 2012).
Для определения филогенетического положения изолятов амплифицировали ген 16S рРНК с праймерами 27F-1492R. Выделение ДНК и условия амплификации аналогичны описанным ранее (Frank et al., 2016). Номера доступа последовательностей генов 16S рРНК в GenBank NCBI MT500787.
РЕЗУЛЬТАТЫ
Физико-химические характеристики воды скважины Ku-5 и скорость сульфатредукции. Измерения физико-химического состава воды скважины, обозначенной Ku-5, проводили, начиная с 2006 года. За весь период исследований температура вытекающей из шахты воды изменялась незначительно от 9.8 до 13.8°С и не зависела от сезона (рис. 1). Нейтральная реакция среды на протяжении всего периода исследований оставалась фактически неизменной. Измеренные в 2017 г. значения рН (8.7) и температуры (8.7°С) связаны с тем, что отбор проб в январе проводили не на выходе скважины, а ниже по ручью, куда дренируются воды из находящегося в верховьях жилого сектора. Вода на протяжении всего периода исследований была восстановленной (окислительно-восстановительный потенциал изменялся от –112 до –174 мВ) и имела выраженный запах сероводорода. Концентрация H2S, измеренная в июле 2017 г. составляла 5.4 мг/л. Место излива скважины и вся долина ручья покрыты интенсивными микробными обрастаниями, формирующими нити белого цвета (рис. 1).
Средняя скорость сульфатредукции, измеренная в пробах воды в феврале 2020 г., составляла 88.8 нг Sвосст/л сут–1. Только 25% всей восстановленной серы находилась в форме сероводорода (кислоторастворимая сера, КРС). Большая часть метки находилась в форме серы, восстанавливаемой CrCl3 (ХВС), которая может включать пирит (FeS2), элементную и органическую серу. В экспериментах с радиоактивно-меченным сульфатом было исследовано влияние времени инкубации проб в условиях, приближенных к in situ. Варианты инкубации в течение 1, 2 и 3-х сут показали, что наибольшая интенсивность составляла 119.7 нг Sвосст/л сут–1 и была зафиксирована, когда пробы выдерживали в течение 3 сут. Эта величина, вероятно, наиболее приближена к реальной интенсивности процесса в подземной воде, так как при более короткой инкубации изменение физико-химических условий могло снизить активность клеток.
Состав микробного сообщества. Одновременно с измерением скорости сульфатредукции в воде был определен состав микробного сообщества. Бактерии доминировали как в воде, так и пробе микробных обрастаний (табл. 1). В микробном обрастании археи отсутствовали. Основу бактериального сообщества составляли сероокисляющие Sulfurovum, Sulfuricurvum, Sulfurospirillum и Thiothrix. В микробном мате присутствовало значительное количество цианобактерий (10.50%). Из групп прокариот с известной способностью к сульфатредукции в воде были обнаружены дельта-протеобактерии порядков Desulfobacterales и Desulfovibrionales, их доли в сообществе составляли 0.12 и 0.01% соответственно. Эти же две группы были обнаружены и в микробном мате, где их суммарная доля составляла лишь 0.02%. Надо отметить, что большая часть обнаруженных представителей Deltaproteobacteria относились к классам Myxococcales и Bdellovibrionales, для которых способность к сульфатредукции не известна.
Таблица 1.
Состав микробного сообщества воды скважины Ku-5 и микробных обрастаний, формирующихся на изливе скважины, определенный из проб, отобранных в феврале 2020 г.
| Филогенетическая группа | Доля последовательностей генов 16S рРНК, % | |
|---|---|---|
| вода | микробный мат | |
| Euryarchaeota (Methanomassiliicoccales) | 2.65 | – |
| Woesearchaeota | 10.08 | – |
| Bacteroidetes | – | 12.69 |
| Chloroflexi | 4.32 | 1.34 |
| Cyanobacteria | – | 10.50 |
| Epsilonproteobacteria (Sulfurovum) | 40.12 | 23.39 |
| Epsilonproteobacteria (Sulfuricurvum) | 16.89 | 3.22 |
| Epsilonproteobacteria (Sulfurospirillum) | – | 1.00 |
| Patescibacteria | 1.37 | 3.66 |
| Gammaproteobacteria (Halothiobacillaceae) | 14.37 | 3.67 |
| Gammaproteobacteria (Crenothrix) | 0.56 | 6.04 |
| Gammaproteobacteria (Thiothrix) | 6.75 | 14.18 |
| Прочие | 2.88 | 20.31 |
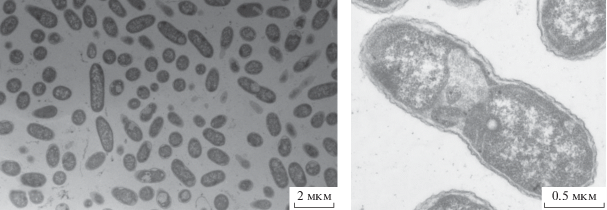
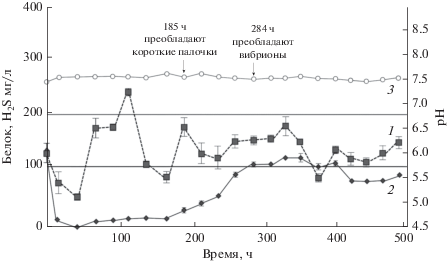
Выделение чистых культур сульфатредуцирующих бактерий и изучение их физиологии. Для выделения чистых культур сульфатредуцирующих бактерий (СРБ) использовали культивирование в биореакторе. Культивирование в таких условиях позволяет изменять различные параметры, включая температуру и донор электронов, и создавать оптимальные условиях для развития сульфидогенов, представляющих минорные компоненты сообщества. Концентрацию сероводорода в среде рассматривали в качестве свидетельства протекания сульфатредукции. Первоначально в качестве единственного донора электронов использовали лактат (18 мM). Температура воды скважины Ku-5 незначительно колебалась около 12.5°С. Для моделирования условий близких к in situ, поддерживали температуру 17°С – наиболее низкую температуру, достигаемую циркулированием водопроводной воды в кожухе колбы биореактора. Изменение биомассы и концентрация сероводорода в биореакторе в первые 500 ч культивирования показаны на рис. 2. Наблюдение морфотипов в пробах из биореактора показало доминирование подвижных палочек, совпавшее с повышением концентрации H2S в среде через 185 ч от начала культивирования. В этой точке были отобраны пробы, из которых в дальнейшем был выделен чистый сульфидогенный изолят, представленный подвижными палочками, размером около 1 мкм в диаметре и 1.5–2 мкм в длину и обозначенный штамм DI (рис. 3). Для дополнительной очистки культуры были проведены серии разведений и получены колонии на твердой среде WB с лактатом в качестве единственного донора электронов.
Рис. 2.
Изменение биомассы (1), концентрации сероводорода (2) и рН (3) в биореакторе в первые 500 ч культивирования. Вертикальные линии показывают стандартное отклонение, рассчитанное из трех повторностей.
Филогенетический анализ последовательности гена 16S рРНК штамма DI показал, что он относится к роду Desulfomicrobium (рис. 4). Ближайшими родственниками являются несколько видов: D. norvegicum со сходством последовательностей гена 16S рРНК 99.79%, D. baculatum (99.65%), D. apsheronum (99.65%) и D. macestii (99.58%). Штамм являлся умеренным психрофилом, рос в пределах от 4 до 28°С с оптимумом при 15°С, сохраняя стабильный, активный рост при 4°С. Инкубация DI при температуре 37°С приводила к потере клетками подвижности и их лизису в течение 12 ч. Одновременно штамм DI проявил свойства умеренного ацидофила и рос в пределах значений рН от 4 до 6.5 с оптимумом при pH 5. Максимальная концентрация NaCl в среде, позволяющая рост, составляла 1.2%, при концентрации 1.5% NaCl рост отсутствовал. Оптимальное содержание NaCl в среде составляло 0–1%. Desulfomicrobium sp. DI мог использовать в качестве донора электрона для сульфатредукции: лактат, сукцинат, глицерол, этанол, фруктозу, глюкозу, маннозу и сахарозу. Наиболее активно восстановление сульфата происходило при росте на лактате, глицероле и фруктозе. Рост отсутствовал при выращивании на цитрате, бутирате, фумарате, пропионате, формиате. Штамм не использовал аминокислоты глицин, аланин и цистеин.
Рис. 4.
Дерево, показывающее филогенетическое положение изолятов DI и LL1 на основе анализа последовательностей гена 16S рРНК, определенное методом Maximum Likelihood. Бутстрепы рассчитаны из 500 итераций.
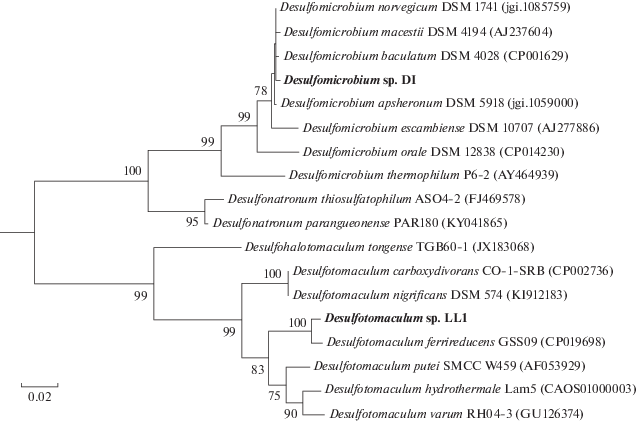
Начиная с 1456 ч температуру в биореакторе постепенно повышая до 50°С, которая была установлена в точке 2030 ч от начала культивирования. В точке 2109 ч в биореакторе доминировали споровые палочки, и концентрация сероводорода в среде составляла 400 мг/л. Из этой пробы была выделена чистая культура спорообразующего сульфидогена, обозначенная как штамм LL1. Дополнительную очистку культуры проводили путем прогревания при 90°С в течение 30 мин с последующей серией разведений. Филогенетический анализ последовательности гена 16S рРНК показал, что штамм относится к роду Desulfotomaculum (рис. 4). Ближайшим родственником является недавно описанный Desulfotomaculum ferrireducens (Yang et al., 2016) со сходством последовательностей гена 16S рРНК 98.93%. Штамм является умеренным термофилом и растет в пределах от 28 до 55°С, с оптимумом при 50°С. Учитывая установленный порог сходства гена 16S рРНК для разграничения видов 98.7% (Chun et al., 2018), возможно, штамм LL1 является новым штаммом D. ferrireducens.
ОБСУЖДЕНИЕ
Измеренная скорость сульфатредукции в воде Ku-5, 119.7 нг Sвосст/л сут–1, составляет относительно небольшую величину по сравнению со скоростями известными для водной толщи поверхностных водоемов с анаэробной зоной, например, меромиктических озер. Однако, учитывая дебит скважины 166–170 м3/ч, количество восстановленной серы, поступающее с водой из скважины, составляет 475–488 мг Sвосст в сутки. Таким образом, в расчете на сероводород при разгрузке скважины поток восстановленной серы может достигать 173–178 г S в год. Это количество превышает скорость сульфатредукции, измеренную в подземных горизонтах, ассоциированных с пластами лигнита в Германии, составлявшую 8.4 мM (768 мг/л) сульфида в год (Detmers et al., 2001). Измеренная исследователями максимальная концентрация сульфата достигала 1.34 мM (129 мг/л), что значительно превышает концентрации в скважине Ku-5. Вероятно, низкая концентрация сульфата (5.5 мг/л), обнаруженная в воде в момент измерения скорости сульфатредукции в Ku-5, связана с его активным потреблением бактериями.
Стоит отметить тот факт, что основной формой восстановленной серы, обнаруживаемой при краткосрочной инкубации проб по измерению сульфатредукции, была фракция ХВС, содержащая элементную и органическую серу и пирит, а не сероводород (КРС). Концентрация железа, измеренная в период изучения скважины, была невысокой и колебалась от 0.27 до 0.67 мг/л. Поэтому маловероятно, что в воде образуются заметные количества пирита. Можно предположить, что доминирующее в воде сообщество сероокислящих прокариот быстро окисляет сероводород до серы и, вероятно, далее до сульфата. Этот факт свидетельствует об активном круговороте серы в воде и подземных горизонтах. По-видимому, сероокисляющие организмы, прежде всего Thiothrix, образующие многочисленные скопления на изливе скважины, играют роль своеобразного фильтра.
Остается открытым вопрос об акцепторе электрона, используемым сероокисляющими микроорганизмами. Возможными вариантами является проникновение кислорода и существование аэробных “микрозон” в системе вода–порода, аналогично известным анаэробным микрозонам в аэробных местообитаниях. Некоторые представители Thiothrix могут использовать альтернативный акцептор – нитрат. Концентрация ${\text{NO}}_{3}^{ - }$, измеренная в январе 2017 года, составляла 6.7 мг/л. Хотя, учитывая тот факт, что вода была отобрана в ручье, а не на устье скважины, возможным источником нитрата были хозяйственные стоки. Нельзя исключить возможность фильтрации хозяйственных стоков в подземные водоносные горизонты затопленной шахты.
Обогащение в биореакторе путем смены условий культивирования позволило выделить два изолята СРБ – умеренного психрофила и ацидофила (Desulfomicrobium sp. DI) и умеренного термофила (Desulfotomaculum sp. LL1). Присутствие психрофильных форм не вызывает удивления, так как круглогодичная температура воды, изливающейся из шахты, колеблется в пределах 11.7–13.8°С. Предпочтение умеренно кислых условий штаммом DI может быть связано с окислением пирита, содержащегося в угле. Эти процессы приводят к формированию зон с повышенной концентрацией протонов, аналогично известному для месторождений сульфидов металлов феномену кислых шахтных дренажных вод (Kaksonen et al., 2008). Desulfomicrobium могут играть важную роль в биотопах, ассоциированных с угольными пластами; известно, что они составляли один из основных компонентов (10.9%) бактериального сообщества, разлагающего лигнин (Wang et al., 2013).
Присутствие термофильного спорообразующего Desulfotomaculum можно объяснить тем фактом, что при затоплении шахт подземные водоносные горизонты формируют гидравлически связанный водоносный комплекс. Поэтому микроорганизмы более глубоких горизонтов с повышенной температурой могут попадать в воду скважины. Известной аналогией является нахождение спорообразующих термофильных Desulfotomaculum в морских осадках, источником которых считают подводные гидротермы и углеводородные сипы (O’Sullivan et al., 2015). Авторы выдвигают гипотезу о том, что находящиеся на дне океана гидротермальные источники являются своеобразным “банком”, из которого споры могут поступать в отдаленные регионы и давать вегетативные клетки при попадании в подходящие условия.
Очевидно, что оба СРП, выделенные путем накопления в биореакторе, представляют “редкую биосферу” в биотопе, так как ни один из этих филотипов не удалось обнаружить методом высокопроизводительного секвенирования гена 16S рРНК. Выделенный Desulfomicrobium sp. DI, несмотря на значительное сходство маркерного гена, может представлять новый вид, так как его физиологические характеристики заметно отличаются от близкородственных видов Desulfomicrobium. До сих пор не известно ни одного психрофильного представителя этого рода, также как не известна способность к утилизации сахаров представителями Desulfomicrobium. К настоящему времени доступны геномы близких родственников штамма DI – D. baculatum, D. norvegicum, D. apsheronum. Проведенный нами анализ сходства нуклеотидного состава геномов (ANI) и аминокислотного состава геномов (AAI) (табл. 2 ) подтвердил, что организмы представляют разные виды, и ANI не превышает установленного порога для различных видов 95–96% (Chun et al., 2018). Очевидно, ген 16S не позволяет разграничивать виды рода Desulfomicrobium.
Таблица 2.
Сходство геномных последовательностей видов Desulfomicrobium близкородственных Desulfomicrobium sp. DI
| ANI | |||
| D. norvegicum | D. apsheronum | D. baculatum | |
| D. norvegicum | 100 | 93.90 | 86.85 |
| D. apsheronum | 93.90 | 100 | 86.44 |
| D. baculatum | 86.85 | 86.44 | 100 |
| AAI | |||
| D. norvegicum | D. apsheronum | D. baculatum | |
| D. norvegicum | 100 | 94.50 | 88.33 |
| D. apsheronum | 94.51 | 100 | 87.71 |
| D. baculatum | 88.33 | 87.71 | 100 |
Список литературы
Кадников В.В., Марданов А.В., Белецкий А.В., Анциферов Д.В., Ковалева А.А., Карначук О.В., Равин Н.В. Сероокисляющие бактерии доминируют в воде затопленной угольной шахты в Кузбассе // Микробиология. 2019. Т. 88. С. 123–126.
Kadnikov V.V., Mardanov A.V., Beletsky A.V., Ravin N.V., Antsiferov D.V., Kovalyova A.A., Karnachuk O.V. Sulfur-oxidizing bacteria dominate in the water from a flooded coal mine shaft in Kuzbass // Microbiology (Moscow). 2019. V. 88. P. 120–123.
Карначук О.В., Курганская И.А., Авакян М.Р., Франк Ю.А., Иккерт О.П., Филенко Р.А., Данилова Э.В., Пименов Н.В. Ацидофильный Desulfosporosinus из окисленных отходов добычи металлов в Забайкальском крае // Микробиология. 2015. Т. 84. С. 595–605.
Karnachuk O.V., Kurganskaya I.A., Avakyan M.R., Frank Y.A., Ikkert O.P., Filenko R.A., Danilova E.V., Pimenov N.V. An acidophilic Desulfosporosinus isolated from the oxidized mining wastes in the Transbaikal area // Microbiology (Moscow). 2015. V. 84. P. 677–686.
Карначук О.В., Пименов Н.В., Юсупов С.К., Франк Ю.А. Пухакка Я.А., Иванов М.В. Распределение, разнообразие и активность сульфатредуцирующих бактерий в водной толще озера Гёк-Гёль, Азербайджан // Микробиология. 2006. Т. 75. С. 101–109.
Karnachuk O.V., Frank Yu.A., Pimenov N.V., Yusupov S.K., Ivanov M.V., Puhakka Ya.A. Distribution, diversity, and activity of sulfate-reducing bacteria in the water column in Gek-Gel lake, Azerbaijan // Microbiology (Moscow). 2006. V. 75. P. 82–89.
Anantharaman K., Brown C.T., Hug L.A., Sharon I., Castelle C.J., Probst A.J., Thomas B.C., Singh A., Wilkins M.J., Karaoz U., Brodie E.L., Williams K.H., Hubbard S.S., Banfield J.F. Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system // Nat. Commun. 2016. V. 7. Art. 13219.
Bell E., Lamminmäki T., Alneberg J., Andersson A.F., Qian C., Xiong W., Hettich R.L., Balmer L., Frutschi M., Sommer G., Bernier-Latmani R. Biogeochemical cycling by a low-diversity microbial community in deep groundwater // Front. Microbiol. 2018. V. 9. Art. 2129. https://doi.org/10.3389/fmicb.2018.02129
Bowles M.W., Mogollon J.M., Kasten S., Zabel M., Hinrichs K.-U. Global rates of marine sulfate reduction and implications for sub-sea-floor metabolic activities // Science. 2014. V. 344. P. 889–891.
Chivian D., Brodie E.L., Alm E.J., Culley D.E., Dehal P.S., DeSantis T.Z. Gihring T.M., Lapidus A., Lin L.H., Lowry S.R., Moser D.P., Richardson P.M., Southam G., Wanger G., Pratt L.M., Andersen G.L., Hazen T.C., Brockman F.J., Arkin A.P., Onstott T.C. Environmental genomics revealed single-species ecosystem deep within Earth // Science. 2008. V. 322. P. 275–278.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D. R., da Costa M.S., Rooney A.P., Yi H., Xu X.-W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 461–466.
Cline J.D. Spectrophotometric determination of hydrogen sulfide in natural waters // Limnol. Oceanogr. 1969. V. 14. P. 454–458.
Detmers J., Schulte U., Strauss H., Kuever J. Sulfate reduction at a lignite seam: microbial abundance and activity // Microb. Ecol. 2001. V. 42. P. 238–247.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461.
Frank Y., Banks D., Avakian M., Antsiferov D., Kadychagov P., Karnachuk O. Firmicutes is an important component of microbial communities in water-injected and pristine oil reservoirs, Western Siberia, Russia // Geomicrobiol. J. 2016. V. 33. P. 387–400.
Glombitza C., Mangelsdorf K., Horsfield B. A novel procedure to detect low molecular weight compounds released by alkaline ester cleavage from low maturity coals to assess its feedstock potential for deep microbial life // Org. Geochem. 2009. V. 40. P. 175–183.
Guiqin Yang, Junhui Guo, Li Zhuang, Yong Yuan, Shungui Zhou. Desulfotomaculum ferrireducens sp. nov., a moderately thermophilic sulfate-reducing and dissimilatory Fe(III)-reducing bacterium isolated from compost // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 3022–3028.
Kaksonen A.H., Dopson M., Karnachuk O., Tuovinen O.H., Puhakka J.A. Biological iron oxidation and sulfate reduction in the treatment of acid mine drainage at low temperatures // Psychrophiles: From biodiversity to biotechnology / Eds. Margesin R., Schinner F., Marx J.C., Gerday C. Berlin, Heidelberg: Springer-Verlag, 2008. P. 429–454.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated Candidatus Desulforudis audaxviator from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. V. 13. P. 1947–1959.
Magnabosco C., Tekere M., Lau M.C.Y., Linage B., Kuloyo O., Erasmus M., Cason E., van Heerden E., Borgonie G., Kieft T.L., Olivier J., Onstott T.C. Comparisons of the composition and biogeographic distribution of the bacterial communities occupying South African thermal springs with those inhabiting deep subsurface fracture water // Front. Microbiol. 2014. V. 5. Art. 679. https://doi.org/10.3389/fmicb.2014.00679
Magoč T., Salzberg S.L. FLASH: fast length adjustment of short reads to improve genome assemblies // Bioinformatics. 2011. V. 27. P. 2957–2963.
Mardanov A.V., Panova I.A., Beletsky A.V., Avakyan M.R., Kadnikov V.V., Antsiferov D.V., Banks D., Frank Y.A., Pimenov N.V., Ravin N.V., Karnachuk O.V. Genomic insights into a new acidophilic, copper-resistant Desulfosporosinus isolate from the oxidized tailings area of an abandoned gold mine // FEMS Microbiol. Ecol. 2016. V. 92. P. fiw111.
Momper L., Jungbluth S., Lee M., Amend J.P. Energy and carbon metabolisms in a deep terrestrial subsurface fluid microbial community // ISME J. 2017. V. 11. P. 2319–2333.
Moser D.P., Gihring T.M., Brockman F.J., Fredrickson J.K., Balkwill D.L., Dollhopf M.E., Lollar B.S. Pratt L.M., Boice E., Southam G., Wanger G., Baker B.J., Pfiffner S.M., Lin L.-H., Onstott T.C. Desulfotomaculum and Methanobacterium spp. dominate a 4- to 5-kilometer-deep fault // Appl. Environ. Microbiol. 2005. V. 71. P. 8773–8783.
O’Sullivan L.A., Roussel E.G., Weightman A.J., Webster G., Hubert C.R.J., Bell E, Head I., Sass H., Parkes R.J. Survival of Desulfotomaculum spores from estuarine sediments after serial autoclaving and high-temperature exposure // ISME J. 2015. V. 9. P. 922–933.
Orcutt B.N., LaRowe D.E., Biddle J.F., Colwell F.S., Glazer B.T., Reese B.K., Kirkpatrich J.B., Lapham L.L., Mills H.J., Sylvan J.B., Wankel S.D., Wheat C.G. Microbial activity in the marine deep biosphere: progress and prospects // Front. Microbiol. 2013. V. 4. 189. https://doi.org/10.3389/fmicb.2013.00189
Pruesse E., Peplies J., Glöckner F.O. SINA: accurate high-throughput multiple sequence alignment of ribosomal RNA genes // Bioinformatics. 2012. V. 28. P. 1823–1829.
Wang Y., Liu Q., Yan L., Gao Y., Wang Y., Wang W. A novel lignin degradation bacterial consortium for efficient pulping // Bioresour. Technol. 2013. V. 139. P. 113–119.
Widdel F.F., Bak R. Gram negative mesophilic sulfate reducing bacteria // The Prokaryotes: a Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A. et al. Berlin: Springer, 1992. P. 3352–3378.
Дополнительные материалы отсутствуют.