Микробиология, 2020, T. 89, № 6, стр. 728-736
Скрининг производных N-гексанамида и 2H-1,3-бензодиаксола как модуляторов “кворум сенсинга” у Chromobacterium violaceum
Д. Г. Дерябин a, *, А. А. Галаджиева b, Г. К. Дускаев a
a ФГБНУ Федеральный научный центр биологических систем и агротехнологий
Российской академии наук
460000 Оренбург, Россия
b Институт клеточного и внутриклеточного симбиоза Уральского отделения Российской академии наук – обособленное подразделение ФГБУН “Оренбургский федеральный исследовательский центр Уральского отделения Российской академии наук”
460000 Оренбург, Россия
* E-mail: dgderyabin@yandex.ru
Поступила в редакцию 01.03.2020
После доработки 15.05.2020
Принята к публикации 30.05.2020
Аннотация
Целью исследования был скрининг оригинальной библиотеки химических соединений на предмет поиска среди них эффективных модуляторов системы “кворум сенсинга” у протеобактерий. В состав тестированной библиотеки вошли 19 молекул, содержащих идентичный с естественным автоиндуктором N-гексаноил гомосерин лактоном (С6-АГЛ) неполярный радикал N-гексанамида или полярную гетероциклическую группу 2H-1,3-бензодиоксола. В качестве тест-объекта для оценки их кворум-модулирующей активности использован штамм Chromobacterium violaceum CV026 (NCTC 13278) с нарушенным синтезом естественного автоиндуктора С6-АГЛ, содержащий функциональный гомодимерный рецептор автоиндуктора CviR, после взаимодействия с двумя молекулами С6-АГЛ активирующий транскрипцию ранее молчащих генов, в том числе vioABCDE-оперона, что регистрируется как образование сине-фиолетового пигмента виолацеина. По результатам первичного скрининга агонистическая (виолацеин-индуцирующая) активность обнаружена у 4 соединений, а выполнение второго варианта тестирования в присутствии экзогенно внесенного С6-АГЛ свидетельствовало о наличии антагонистической (виолацеин-ингибирующей) активности у 9 исследованных соединений. Интересно, что наиболее выраженная антагонистическая активность детектирована у молекул, одновременно показавших себя как агонисты С6-АГЛ. При этом их эффективные концентрации, обусловливающие 50% ингибирование кворум-зависимого биосинтеза виолацеина, оказались в 3.2–20.4 раз ниже концентраций, вызывающих его 50% индукцию. Абсолютные концентрации тестированных соединений, необходимые для индукции биосинтеза виолацеина, на несколько порядков превышали требуемую для этого концентрацию естественного автоиндуктора, а выраженность их ингибирующего эффекта была обратно пропорциональна концентрации экзогенно вносимого С6-АГЛ. По результатам проведенного скрининга в качестве наиболее эффективного модулятора системы “кворум сенсинга” идентифицирован N-1,3-бензодиоксол-5-ил-оксогексанамид, особенности биологической активности которого свидетельствуют о целесообразности его дальнейших исследований в системах in silico, in vitro и in vivo.
“Кворум сенсинг” (англ.: quorum sensing, QS) – механизм химической межклеточной коммуникации у бактерий, обеспечивающий их скоординированное функционирование в микробных популяциях, достигших высокой плотности (Bassler, Losick, 2006). В наиболее общем виде этот феномен включает образование и высвобождение внеклеточных малых сигнальных молекул – автоиндукторов, которые после достижения пороговых концентраций в среде культивирования обуславливают глобальные изменения паттернов генной экспрессии в рецептирующих их бактериальных клетках (von Bodman et al., 2008). При этом на фоне выраженных молекулярных различий “кворум сенсинга” у грамотрицательных и грамположительных бактерий, а также значительного разнообразия химической природы автоиндукторов и механизмов их рецепции (Papenfort, Bassler, 2016), наиболее изученной является плотностно-зависимая коммуникация, опосредованная ацилированными лактонами гомосерина – АГЛ (англ.: AHL-mediated QS).
Универсальный принцип организации таких систем, описанных уже у нескольких сотен видов протеобактерий, основан на наличии синтаз, катализирующих превращение предшественника S‑аденозилметионина в молекулы АГЛ, содержащие полярное N-ацилированное гомосерин-лактоновое кольцо и неполярную ацильную цепь, у разных таксонов варьирующую по количеству атомов углерода, наличию замещений и степени сатурированности (Case et al., 2008). Амфифильный характер молекул АГЛ определяет возможность их свободного транспорта из клетки в окружающую среду и из среды в клетку по градиенту концентрации, где они воспринимаются специальными рецепторами, типично представляющими собой белковые гомодимеры с N-концевыми АГЛ-связывающими доменами (Zhang et al., 2002). Результатом рецепции двух молекул АГЛ является изменение конформации белковых гомодимеров, обеспечивающее возможность взаимодействия их C-концевых ДНК-связывающих доменов со специфическими нуклеотидными последовательностями на бактериальной хромосоме с последующей за этим инициацией транскрипции располагающихся рядом генов-мишеней или целых оперонов.
Активируемые данным способом варианты биологической активности неэффективны при реализации одиночными клетками, но ярко проявляются при их скоординированной деятельности в составе бактериальных популяций, что объясняет целесообразность феномена плотностно-зависимой химической коммуникации (Bassler, Losick, 2006). При этом принципиально важным является нахождение под QS контролем таких проявлений коллективного поведения бактерий, как синтез факторов вирулентности и образование биопленок, что определяет оценку АГЛ-опосредованного “кворум сенсинга” как новой перспективной мишени для адресного воздействия на фито- и зоопатогенные протеобактерии (Remy et al., 2018).
Предложенные к настоящему времени стратегии ингибирования “кворум сенсинга” достаточно разнообразны и включают подавление активности АГЛ-синтаз, внеклеточное связывание или ферментативную деградацию молекул автоиндукторов, а также интерференцию других малых молекул с автоиндукторами за взаимодействие с цитоплазматическими белками-рецепторами (Chen et al., 2018). Последний подход оценивается многими экспертами как наиболее перспективный, а его практическая реализация предполагает проведение работ по дизайну, синтезу и биологическому скринингу в значительных по численности библиотеках химических соединений, характеризующихся различной степенью структурного подобия АГЛ (Geske et al., 2008).
Целью настоящего исследования явился скрининг библиотеки производных N-гексанамида и 2H-1,3-бензодиоксола, структурные особенности которых позволяли предполагать возможность конкуренции с автоиндуктором С6-АГЛ за взаимодействие с рецепторным белком CviR в тестах индукции или ингибирования кворум-зависимого биосинтеза пигмента виолацеина у штамма Chromobacterium violaceum CV026 (NCTC 13278).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Бактериальный штамм. В качестве инструмента для скрининга кворум-модулирующей активности использован лабораторный штамм C. violaceum CV026 (NCTC 13278) с цитоплазматическим белком CviR, который в естественных условиях рецептирует автоиндуктор N-гексаноил-L-гомосерин лактон (С6-АГЛ). После связывания двух молекул С6-АГЛ гомодимер CviR переходит из “закрытой” в “открытую” конформацию (Chen et al., 2011), которая распознает на бактериальной ДНК палиндромные последовательности CTGNCCNNNNGGNCAG и активирует в этих сайтах сборку РНК-полимераз с последующей инициацией транскрипции расположенных рядом ранее молчащих генов и оперонов (Stauff, Bassler, 2011). В частности, под подобным контролем находится vioABEDC-оперон, а кодируемые им ферменты формируют каскад биосинтеза сине-фиолетового пигмента виолацеина с максимумом поглощения при 585 нм (Sanchez et al., 2006), интенсивность накопления которого в бактериальной культуре прямо пропорциональна степени активации “кворум сенсинга”.
Важным дополнительным свойством штамма C. violaceum CV026 является инсерция транспозона mini-Tn5 в ген синтазы автоиндуктора, вследствие чего для активации описанного выше механизма кворум-зависимой транскрипции требуется присутствие экзогенно вносимого С6-АГЛ (McClean et al., 1997) или других АГЛ-имитирующих молекул (Blosser, Gray, 2000).
Химические соединения. Представленная для исследования оригинальная библиотека включала ряды химических соединений, воспроизводящих элементы структуры ацилированных лактонов гомосерина, что позволяло предполагать возможность их прямой конкуренции с природным автоиндуктором “кворум сенсинга” за связывание с соответствующим рецепторным белком.
Первый принцип дизайна данной библиотеки заключался в формировании ряда из 10 малых молекул (рис. 1, по вертикали), общим элементом структуры которых являлось наличие неполярного радикала N-гексанамида (брутто-формула C6NO), идентичного таковому в молекуле С6-АГЛ и ковалентно присоединенного к полярным циклическим группировкам различного строения и состава. В свою очередь, вторая группа из 10 малых молекул объединялась наличием общей гетероциклической группы 2H-1,3-бензодиоксола (брутто-формула C7H6O2), ковалентно присоединенной к различающимся по составу и строению линейным или циклическим неполярным радикалам (рис. 1, по горизонтали). На пересечении вертикально и горизонтально расположенных рядов находится молекула N-1,3-бензодиоксол-5-ил-оксогексанамида, объединяющая обе описанные выше структурные особенности. Общая численность библиотеки составила 19 химических соединений, полное наименование которых в соответствии с номенклатурой Международного союза теоретической и прикладной химии (англ.: International Union of Pure and Applied Chemistry; IUPAC) приведено в табл. 1.
Рис. 1.
Структурные формулы химических соединений, исследованных в тесте индукции/ингибирования кворум-зависимого биосинтеза пигмента виолацеина у C. violaceum CV026. По вертикали: (соединения 1–10) производные N‑гексанамида (X); по горизонтали (соединения 11–19) производные 2H-1,3-бензодиоксола (Y). Нумерация соединений аналогична приведенной в таблице ниже. Соединение 20 – естественный автоиндуктор кворум сенсинга у C. violaceum CV026: N-гексаноил-L-гомосерин лактон (С6-АГЛ).
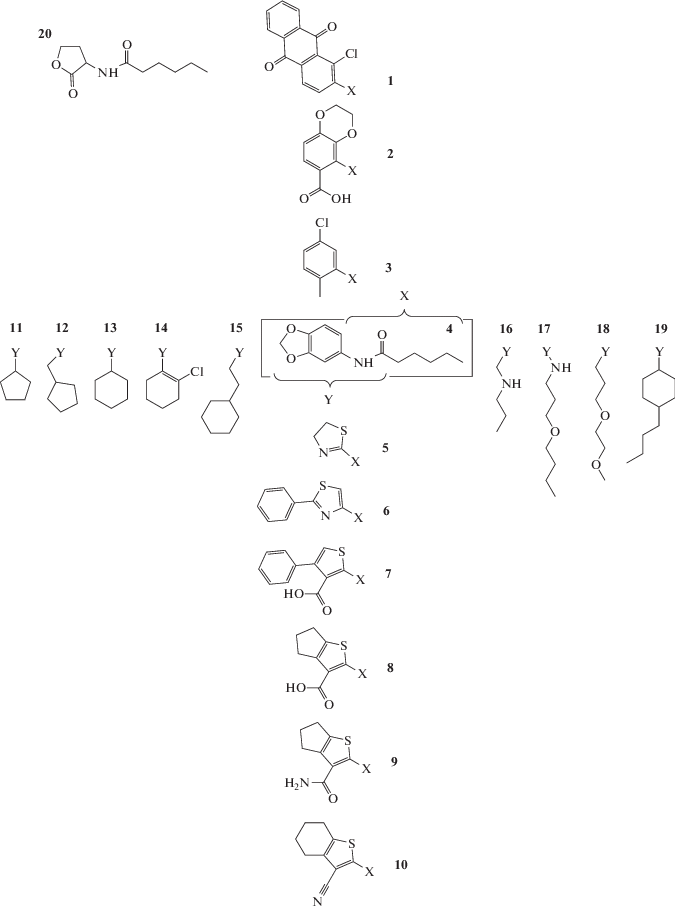
Таблица 1.
Количественная характеристика кворум-модулирующей активности производных N-гексанамида (1–10) и 2H-1,3-бензодиоксола (4, 11–19), оцененной в тесте индукции/ингибирования кворум-зависимого биосинтеза пигмента виолацеина у C. violaceum CV026
| № соединения | Наименование соединения по IUPAC | Характеристики кворум-модулирующей активности, мкМ | |
|---|---|---|---|
| ЕС50индукции | ЕС50ингибирования | ||
| 1 | N-(1-хлор-9,10-диоксо-9,10-дигидро-2-антраценил) гексанамид | – | – |
| 2 | 2-(гексаноиламино)-1,4-бензодиоксан-6-карбоновая кислота | – | – |
| 3 | N-(5-хлор-2-метилфенил) гексанамид | 250.0 | 45.6 |
| 4 | N-(1,3-бензодиоксол-5-ил)-гексанамид | 46.9 | 2.3 |
| 5 | N-(4,5-дигидро-1,3-тиазол-2-ил)-гексанамид | 62.5 | 19.5 |
| 6 | N-(2-фенил-1,3-тиазол-4-ил) гексанамид | – | – |
| 7 | 2-(гексаноиламино)-4-фенил-3-тиофенкарбоновая кислота | – | – |
| 8 | 2-гексаноиламино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбоновая кислота | – | 73.4 |
| 9 | 2-гексаноиламино-5,6- дигидро-4H-циклопента[b]тиофен-3- карбоксамид | – | 81.3 |
| 10 | N-(3-циано-4,5,6,7-тетрагидро-1-бензотиофен-2ил)-гексанамид | – | – |
| 11 | N-(1,3-бензодиоксол-5-ил)-циклопентанкарбоксамид | – | 112.5 |
| 12 | N-(1,3-бензодиоксол-5-ил)-2-циклопентилацетамид | 250.0 | 50.9 |
| 13 | N-(1,3-бензодиоксол-5-ил)-циклогексанкарбоксамид | – | 87.5 |
| 14 | N-(1,3-бензодиоксол-5-ил)-2-хлор-1-циклогексен-1-карбоновой кислоты | – | – |
| 15 | N-(1,3-бензодиоксол-5-ил)-3-циклогексилпропанамид | – | 100.0 |
| 16 | N-(1,3-бензодиоксол-5-ил)-2-пропилглицинамид | – | – |
| 17 | N-(1,3-бензодиоксол-5-ил)-4- (2-метоксиэтокси)-бутанамид | – | – |
| 18 | N-(1,3-бензодиоксол-5-ил)-3-(3-бутоксипропил) мочевина | – | – |
| 19 | N-(1,3-бензодиоксол-5-ил)-4-бутилциклогексанкарбоксамид | – | – |
| 20 | N-гексаноил-L-гомосеринлактон (автоиндуктор “кворум сенсинга” у C. violaceum CV026; положительный контроль) | 0.0005 | – |
Описанная библиотека сформирована путем приобретения коммерчески доступных химических соединений с чистотой не менее 99% по каталогу “Sigma-Aldrich” (США) и заказного синтеза отсутствующих соединений с чистотой не менее 95% в компании “Enamine Ltd” (Украина).
Для контрольной индукции “кворум сенсинга” и проведения исследований по его ингибированию использован химически синтезированный аналог С6-АГЛ с чистотой ≥98% (“Cayman Chemicals”, США).
Метод исследования кворум-модулирующей активности на модели C. violaceum CV026. Скрининг кворум-модулирующей активности тестируемых химических соединений проводили в двух вариантах: 1) без внесения в пробы С6-АГЛ – для выявления соединений с виолацеин-индуцирующей (агонистической по отношению к данному автоиндуктору) активностью; 2) при внесении в пробы С6-АГЛ – для выявления виолацеин-ингибирующей (антагонистической по отношению к автоиндуктору) активности.
Перед проведением тестирования эквимолярные навески исследуемых соединений растворяли в 95% этаноле. Для первой серии экспериментов из полученных спиртовых растворов готовили серии двукратных разведений в LB-бульоне (“Sigma”, США), формируя ряды концентраций исследуемых соединений в диапазоне от 2 до 1000 мкМ. Для второй серии экспериментов аналогичные ряды разведений исследуемых соединений готовили в LB-бульоне с предварительно внесенным в него автоиндуктором С6-АГЛ в конечных концентрациях 1, 10 или 100 нМ. В каждый вариант исследования включали дополнительные пробы LB-бульона, содержащие только С6-АГЛ (положительный контроль, обеспечивающий 100% индукцию виолацеина) или пробы чистого LB-бульона (отрицательный контроль, рост непигментированной культуры). Подготовленные ряды разведений и контрольные пробы переносили в лунки стерильных 96-луночных планшетов в объеме 200 мкл, инокулировали 10 мкл культуры C. violaceum CV026 и культивировали в статическом режиме при 27°C в течение 1 сут. Результаты эксперимента оценивали с использованием микрострипового фотометра STAT FAX 303 VIS+ (“Awareness Technology”, США), последовательно регистрируя оптическую плотность бактериальных культур (при 450 ± 5 нм) и количественное содержание пигмента виолацеина в этанольных экстрактах их биомассы (при 600 ± 5 нм). Значения поглощения отрицательного контроля вычитали.
Проявление QS-модулирующих эффектов исследуемых соединений выражали величинами EC50, которые соответствовали их концентрациям, вызывающим 50% индукцию (EC50инд; 1 вариант экспериментов) или 50% ингибирование (EC50инг; 2 вариант экспериментов) биосинтеза виолацеина относительно положительного контроля.
Статистическая обработка результатов исследования. Все эксперименты выполнены не менее чем в пяти повторностях. Полученные результаты обработаны методами вариационной статистики в программе Excel для Windows 10.
РЕЗУЛЬТАТЫ
Выявление кворум-индуцирующей (агонистической по отношению к С6-АГЛ) активности в тесте индукции биосинтеза пигмента виолацеина у C. violaceum СV026. Тестерный штамм C. violaceum CV026 культивировали в жидкой питательной среде, не содержащей С6-АГЛ, но с внесенными в нее производными N-гексанамида или 2H-1,3-бензодиоксола в диапазоне концентраций от 2 до 1000 мкМ. Регистрация значений оптической плотности (ОП450) выросших бактериальных культур выявила отсутствие стимулирующего или активирующего действия тестируемых соединений на рост использованного лабораторного штамма. Последующая экстракция пигмента из выросшей биомассы 95% этанолом и определение оптической плотности этих экстрактов (ОП600) позволили обнаружить продукцию пигмента виолацеина в присутствии 4 из 19 исследуемых химических соединений (табл. 1).
Подобная агонистическая активность установлена у трех производных N-гексанамида: соединений 3, 4 и 5 (рис. 1). Наименьшая способность к кворум-зависимой индукции биосинтеза виолацеина, характеризуемая величиной ЕС50инд = 250 мкМ, показана у соединения 3 (N-(5-хлор-2-метил-фенил)-гексанамида). Усложнение строения присутствующего в его молекуле полярного шестичленного кольца за счет дополнения антраценовой (соединение 1) или диоксиновой (соединение 2) группировок сопровождалось исчезновением агонистической способности. Соединение 5 (N-(4,5-дигидро-1,3-тиазол-2-ил)-гексанамид) было более активным и индуцировало биосинтез виолацеина на уровне 50% от положительного контроля уже в концентрации 62.5 мкМ. Модификация присутствующего в его молекуле пятичленного тиазолового или сходного по строению тиофенового кольца (у соединений 7–10) полностью отменяла искомый агонистический эффект. Наиболее выраженная агонистическая активность (ЕС50инд = = 46.9 мкМ) была зафиксирована у соединения 4 (N-(1,3-бензодиоксол-5-ил)-гексанамида), однако его концентрация, необходимая для эффективной активации кворум-зависимого биосинтеза виолацеина у C. violaceum CV026, была на четыре порядка выше таковой у естественного автоиндуктора С6-АГЛ, характеризуемого величиной ЕС50инд = = 0.0005 мкм (рис. 2а).
Рис. 2.
Количественные характеристики кворум-модулирующей активности N-(1,3-бензодиоксол-5-ил)-гексанамида (соединения 4): а – сравнение значений EC50инд химического аналога автоиндуктора С6-АГЛ (1) и соединения 4 (2) в тесте индукции биосинтеза пигмента виолацеина у C. violaceum CV026; б – сравнение значений EC50инд (2) и EC50инг (3) соединения 4 в тестах индукции и ингибирования биосинтеза пигмента виолацеина у C. violaceum CV026; в – изменение значений EC50инг соединения 4 в тесте ингибирования биосинтеза пигмента виолацеина у C. violaceum CV026 в присутствии С6-АГЛ в концентрациях 0.001 (3), 0.01 (4) и 0.1 мкМ (5).

Проведение аналогичного скрининга в группе производных 2H-1,3-бензодиоксола позволило подтвердить агонистическую активность соединения 4. При этом замещение в его структуре остатка N-гексанамида на различные по строению и составу циклические (соединения 11, 13–15, 19) или линейные (соединения 16–18) неполярные радикалы в большинстве случаев приводило к утрате искомой активности. На этом фоне единственным исключением являлось соединение 12 (N-(1,3-бензодиоксол-5-ил)-2-циклопентилацетамид), в котором пять атомов углерода были замкнуты в циклопентановое кольцо (рис. 1). Такая модификация, меняющая структуру неполярного радикала, снижала агонистическую активность до ЕС50инд = 250 мкМ, делая ее сопоставимой с таковой у наименее активного соединения 3 из группы производных N-гексанамида (табл. 1).
Выявление кворум-ингибирующей (антагонистической по отношению к С6-АГЛ) активности в тесте ингибирования биосинтеза пигмента виолацеина у C. violaceum СV026. Условием для скрининга кворум-ингибирующей активности исследуемой библиотеки химических соединений была фоновая индукция биосинтеза пигмента виолацеина, обеспечиваемая внесением в культуру C. violaceum CV026 полного химического аналога его естественного автоиндуктора – С6-АГЛ в концентрации 0.001 мкМ. На этом фоне проявлением биологической активности производных N-гексанамида и 2H-1,3-бензодиоксола являлось подавление биосинтеза виолацеина, проявляющееся в росте депигментированных или частично депигментированных культур. Анализ величин оптической плотности полученных из них этанольных экстрактов (ОП600) позволил зафиксировать и количественно охарактеризовать кворум-ингибирующую активность (EC50инг) у девяти из девятнадцати исследуемых химических соединений (табл. 1).
В группе производных N-гексанамида антагонистическая активность была выявлена у соединений 3, 4 и 5, в первом варианте проведения эксперимента продемонстрировавших свою агонистическую активность, а также двух структурно сходных молекул на основе тиофена (рис. 1): соединения 8 (2-гексаноиламино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбоновая кислота) и соединения 9 (2-гексаноиламино-5,6-дигидро-4H-циклопента[b]тиофен-3-карбоксамид). Проведение аналогичного скрининга в группе производных 2H-1,3-бензодиоксола показало наличие искомой активности у соединения 12, ранее также охарактеризованного как индуктор “кворум сенсинга”, и дополнительно – у соединений 11 (N-(1,3-бензодиоксол-5-ил)-циклопентанкарбоксамид), 13 (N-(1,3-бензодиоксол-5-ил)-циклогексанкарбоксамид) и 15 (N-(1,3-бензодиоксол-5-ил)-3-циклогексилпропанамид) с дистальными пяти- или шестичленными углеводородными циклами в неполярном радикале (рис. 1).
Анализ количественных характеристик регистрируемого эффекта позволил сформулировать два принципиальных положения. Во-первых, наиболее выраженная кворум-ингибирующая активность со значениями EC50инг в диапазоне от 2.3 до 50.9 мкМ констатирована у соединений 3, 4, 5 и 12, которые в первом варианте скрининга проявили себя как агонисты автоиндуктора, в то время как вновь выявленные соединения 8, 9, 11, 13 и 15 проявляли свою антагонистическую активность в значительно более высоких концентрациях – в диапазоне от 73.4 до 112.5 мкМ. Во-вторых, сравнение производных N-гексанамида и 2H-1,3-бензодиоксола свидетельствовало о несколько более выраженной кворум-ингибирующей активности первой группы соединений. Наиболее же выраженная кворум-модулирующая активность оказывалась характерной для соединения 4, сочетающего в себе обе названные структурные особенности.
Сравнение эффективных концентраций соединений 3, 4, 5 и 12, обусловливающих развитие кворум-индуцирующего и кворум-ингибирующего эффектов, обнаружило частичное перекрывание данных диапазонов. При этом проявление антагонистического эффекта требовало в 3.2–20.4 раз меньшей концентрации тестируемых соединений, чем для проявления их агонистического действия. В частности, у наиболее активного соединения 4 (N-(1,3-бензодиоксол-5-ил)-гексанамида) величина EC50инг = 2.3 мкМ оказалась более чем на порядок ниже величины ЕС50инд = 46.9 мкМ (рис. 2б).
Еще одним важным наблюдением являлась обратная зависимость выраженности кворум-ингибирующего эффекта производных N-гексанамида и 2H-1,3-бензодиоксола от концентрации экзогенно вносимого химического аналога автоиндуктора С6-АГЛ. При этом, в сравнении с описанной выше серией экспериментов, увеличение концентрации автоиндуктора с 0.001 до 0.01 мкМ требовало примерно десятикратного увеличения действующих концентраций тестируемых соединений, необходимых для 50% подавления биосинтеза виолацеина, а ее дальнейшее повышение до 0.1 мкМ приводило к частичной или полной отмене ингибирующего эффекта. Так значение EC50инг соединения 4, определенное в пробах с внесением 0.01 мкМ С6-АГЛ, возросло до 19.7 мкМ, а увеличение концентрации автоиндуктора до 0.1 мкМ позволяло выявлять только фоновое проявление кворум-ингибирующей активности (рис. 2в).
ОБСУЖДЕНИЕ
Формирование библиотек химических соединений для последующего отбора соединений с различными вариантами биологической активности является современным направлением поиска потенциальных терапевтических агентов, в том числе направленных на подавление “кворум сенсинга” бактериальных патогенов (Ravithej Singh et al., 2018). При этом основными задачами подобных исследований является анализ взаимоотношений “структура–активность” тестируемых соединений, а также отбор наиболее перспективных “кандидатных” молекул с целью их дальнейшего углубленного исследования (Fong et al., 2019). Настоящая работа развивает данное научное направление, ставя своей целью скрининг кворум-модулирующей активности в предварительно сформированной библиотеке производных N‑гексанамида и 2H-1,3-бензодиоксола, воспроизводящих отдельные элементы структуры N-гексаноил-L-гомосеринлактона (С6-АГЛ) – автоиндуктора “кворум сенсинга” у C. violaceum (McClean et al., 1997).
Результаты проведенного скрининга позволили идентифицировать четыре соединения (3, 4, 5 и 12 на рис. 1), развивающие двунаправленную кворум-модулирующую активность: (i) при прямом тестировании на С6-АГЛ-дефицитном штамме C. violaceum CV026 проявляющие свойства агонистов “кворум сенсинга”, (ii) в эксперименте с внесением экзогенного С6-АГЛ демонстрирующие противоположную – антагонистическую активность. При этом наблюдаемые эффекты хорошо согласуются с представлениями о способности конкурентных ингибиторов ацилированных лактонов гомосерина слабо активировать систему “кворум сенсинга”, что первоначально было предсказано по результатам компьютерного моделирования (Anand et al., 2013), а в дальнейшем получило ряд экспериментальных подтверждений (Moore et al., 2015).
Предполагаемым механизмом агонистической активности соединений 3, 4, 5 и 12 является их функционирование в качестве С6-АГЛ-мимикрирующих молекул (Galloway et al., 2012), при связывании с N-концевыми доменами гомодимера CviR трансформирующих его в “открытую” конформацию, способную к взаимодействию с соответствующими специфическими последовательностями ДНК на бактериальной хромосоме (Chen et al., 2011). Однако структурные отличия названных соединений от естественного автоиндуктора обусловливают относительно слабый характер их кворум-индуцирующей активности, на четыре порядка уступающей таковой у С6-АГЛ как следствия сниженной афинности к белку CviR. Эта же модель позволяет объяснить и природу антагонистической активности соединений 3, 4, 5 и 12: одновременное связывание одной подобной молекулы и одной молекулы С6-АГЛ с гомодимером CviR приводит к искажению его “открытой” конформации с утратой способности к взаимодействию со специфическими последовательностями на бактериальной ДНК. Дополнительным аргументом в пользу предложенного механизма кворум-модулирующей активности производных N-гексанамида и 2H-1,3-бензодиоксола является более чем двукратное превышение концентраций соединений, требуемых для индукции “кворум сенсинга”, в сравнении с концентрациями, достаточными для его ингибирования. Об этом же свидетельствует нивелирование анта-гонистического эффекта исследованных соединений в присутствии высоких концентраций С6-АГЛ вследствие конкуренции между ними как молекулами с низкой и высокой афинностью к белку CviR.
Следует отдельно отметить, что описанный в настоящей работе характер биологической активности соединений 3, 4, 5 и 12 не соответствует ни одной из четырех известных классификационнных групп модуляторов “кворум сенсинга” (Welsh, Blackwell, 2016), в связи с чем они должны быть обозначены как представители особой группы “концентрационно-зависимых агонистов/антагонистов”.
Анализ “структура–активность” позволил определить ряд условий, необходимых для проявления обнаруженного двунаправленного кворум-модулирующего эффекта. В первую очередь – это консервативность строения неполярного радикала у соединений 3, 4, 5, полностью идентичного данному участку в молекуле естественного автоиндуктора С6-АГЛ, или его минимальная структурная модификация у соединения 12, сохраняющая стереохимическое соответствие гидрофобному карману на N-концевом домене белка CviR (https://www.uniprot.org/uniprot/D3W065). В свою очередь, структурные ограничения для полярных циклических группировок анализируемых молекул определялись наличием в их составе от 3 до 7 атомов углерода, а также 1 или 2 атомов кислорода, азота или серы.
Еще два производных N-гексанамида (соединения 8, 9) и три производных 2H-1,3-бензодиоксола (соединения 11, 13 и 15) в тесте на C. violaceum CV026 обусловливали только ингибирование кворум-зависимого биосинтеза виолацеина, в соответствии с чем могли быть классифицированы как “истинные антагонисты” (Welsh, Blackwell, 2016). Вероятный механизм их активности также заключался в конкурентном препятствовании формированию правильной “открытой конформации” гомодимера белка CviR, но в сравнении с представителями первой группы соединений (3, 4, 5 и 12) требовал использования более высоких действующих концентраций.
Структурные ограничения для этих молекул были менее жесткими и допускали наличие в их составе различных по структуре неполярных углеводородных радикалов из 5–8 атомов углерода, а также расширенного перечня полярных циклических группировок, включающих производные тиофена. Однако следствием такой модификации было вероятное снижение аффинности к белку CviR, что в контексте поставленной задачи оценивалось как нежелательное явление.
В качестве же наиболее перспективного соединения, выявленного в результате проведенного скрининга, следует назвать N-(1,3-бензодиоксол-5-ил)-гексанамид, который является новым структурно отличным от АГЛ модулятором “кворум сенсинга” и может быть рекомендован для проведения дальнейших углубленных исследований в системах in silico, in vitro и in vivo.
Список литературы
Anand R., Rai N., Thattai M. Interactions among quorum sensing inhibitors // PLoS One. 2013. V. 8. Article e62254.
Bassler B.L., Losick R. Bacterially speaking // Cell. 2006. V. 125. P. 237–246.
Blosser R.S., Gray K.M. Extraction of violacein from Chromobacterium violaceum provides a new quantitative bioassay for N-acyl homoserine lactone autoinducers // Microbiol. Methods. 2000. V. 40. P. 47–55.
Case R.J., Labbate M., Kjelleberg S. AHL-driven quorum-sensing circuits: their frequency and function among the Proteobacteria // ISME J. 2008. V. 2. P. 345–349.
Chen G., Swem L.R., Swem D.L., Stauff D.L., O’Loughlin C.T., Jeffrey P.D., Bassler B.L., Hughson F.M. A strategy for antagonizing quorum sensing // Mol. Cell. 2011. V. 42. P. 199–209.
Chen X., Zhang L., Zhang M., Liu H., Lu P., Lin K. Quorum sensing inhibitors: a patent review (2014–2018) // Expert Opin. Ther. Pat. 2018. V. 28. P. 849–865.
Fong J., Mortensen K.T., Nørskov A., Qvortrup K., Yang L., Tan C.H., Nielsen T.E., Givskov M. Itaconimides as novel quorum sensing inhibitors of Pseudomonas aeruginosa // Front. Cell Infect. Microbiol. 2019. V. 8. P. 443.
Galloway W.R., Hodgkinson J.T, Bowden S., Welch M., Spring D.R. Applications of small molecule activators and inhibitors of quorum sensing in Gram-negative bacteria // Trends Microbiol. 2012. V. 20. P. 449–458.
Geske G.D., O’Neill J.C., Blackwell H.E. Expanding dialogues: from natural autoinducers to non-natural analogues that modulate quorum sensing in Gram-negative bacteria // Chem. Soc. Rev. 2008. V. 37. P. 1432–1447.
McClean K.H., Winson M.K., Fish L., Taylor A. Quorum sensing and Chromobacterium violaceum: exploitation of violacein production and inhibition for the detection of N-acylhomoserine lactones // Microbiology (SGM). 1997. V. 143. P. 3703–3711.
Moore J.D., Rossi F.M., Welsh M.A., Nyffeler K.E., Blackwell H.E. A comparative analysis of synthetic Quorum Sensing modulators in Pseudomonas aeruginosa: new insights into mechanism, active efflux susceptibility, phenotypic response, and next-generation ligand design // J. Am. Chem. Soc. 2015. V. 137. P. 14626–14639.
Papenfort K., Bassler B.L. Quorum sensing signal-response systems in Gram-negative bacteria // Nat. Rev. Microbiol. 2016. V. 14. P. 576–588.
Ravithej Singh L., Tripathi V.C., Raj S., Kumar A., Gupta S., Horam S., Upadhyay A., Kushwaha P., Arockiaraj J., Sashidhara K.V., Pasupuleti M. In-house chemical library repurposing: A case example for Pseudomonas aeruginosa antibiofilm activity and quorum sensing inhibition // Drug Dev. Res. 2018. V. 79. P. 383–390.
Rémy B., Mion S., Plener L., Elias M., Chabrière E., Daudé D. Interference in bacterial Quorum Sensing: a biopharmaceutical perspective // Front. Pharmacol. 2018. V. 9. P. 203.
Sanchez C., Brana A.F., Mendez C., Salas J.A. Reevaluation of the violacein biosynthetic pathway and its relationship to indolocarbazole biosynthesis // Chembiochem. 2006. V. 7. P. 1231–1240.
Stauff D.L., Bassler B.L. Quorum Sensing in Chromobacterium violaceum: DNA recognition and gene regulation by the CviR receptor // J. Bacteriol. 2011. V. 193. P. 3871–3878.
von Bodman S.B., Willey J.M., Diggle S.P. Cell-cell communication in bacteria: united we stand // J. Bacteriol. 2008. V. 190. P. 4377–4391.
Welsh M.A., Blackwell H.E. Chemical probes of quorum sensing: from compound development to biological discovery // FEMS Microbiol. Rev. 2016. V. 40. P. 774–794.
Zhang R.G., Pappas K.M., Brace J.L., Miller P.C., Oulmassov T., Molyneaux J.M., Anderson J.C., Bashkin J.K., Winans S.C., Joachimiak A. Structure of a bacterial quorum-sensing transcription factor complexed with pheromone and DNA // Nature. 2002. V. 417. P. 971–974.
Дополнительные материалы отсутствуют.


