Микробиология, 2020, T. 89, № 6, стр. 688-699
Нитчатые аноксигенные фототрофные бактерии в микробных сообществах содовых озер Кулундинской степи (Алтайский край)
В. М. Горленко a, *, И. А. Брянцева a, О. С. Самылина a, А. А. Ашихмин b, М. А. Синетова c, Н. А. Кострикина a, В. В. Козяева a
a Федеральный исследовательский центр “Фундаментальные основы биотехнологии”
Российской академии наук
119071 Москва, Россия
b Институт фундаментальных проблем биологии Российской академии наук – обособленное подразделение Федерального исследовательского центра “Пущинский научный центр биологических исследований Российской академии наук”
142290 Московская обл., Пущино, Россия
c Федеральное государственное бюджетное учреждение науки Институт физиологии растений
им. К.А. Тимирязева Российской академии наук
127276 Москва, Россия
* E-mail: vgorlenko@mail.ru
Поступила в редакцию 25.04.2020
После доработки 20.05.2020
Принята к публикации 26.05.2020
Аннотация
Содовые озера являются реликтовыми экосистемами, населенными уникальными микроорганизмами, обладающими свойствами двойных экстремофилов – галоалкалофилов и натронофилов. Из проб воды и обрастаний на растениях в прибрежных зонах содовых степных озер Танатар 6 и Горчина 1 (Кулунда, Алтайский край), в период их распреснения, выделены две сходные по морфо-физиологическим свойствам монокультуры нитчатых аноксигенных фототрофных бактерий (НАФБ). В природных условиях НАФБ сосуществовали вместе с аноксигенными пурпурными серобактериями родов Chromatium, Thiocapsa, Ectothiorhodospira, Thiorhodospira, а также с оксигенными фототрофами (алкалофильными цианобактериями, эвгленидами и диатомовыми водорослями). НАФБ формировали нити, окруженные тонким чехлом, клетки содержали антенные структуры – хлоросомы. Оба изолята, наряду с небольшим количеством бактериохлорофилла (Бхл) a, входящего в состав реакционного центра, содержали одновременно антенные Бхл c и Бхл d. В бактериях также обнаружены альфа и бета каротины и их производные. НАФБ хорошо росли в среде, содержащей 500 мг/л Na2S ∙ 9H2O, при общей минерализации 15–30 г/л и рН 8.0−9.5. Идентификация обеих культур по данным состава аминокислот белков комплекса PufLM, показала их принадлежность к филуму Chloroflexi и практически 100% сходство между собой и с алкало-галофильным изолятом “Candidatus Viridilinea mediisalina” Kir15-3F, обнаруженным ранее в содовом озере Киран (Восточная Сибирь, Россия). Можно заключить, что “Cand. Viridilinea mediisalina” является типичным компонентом фототрофных сообществ содовых водоемов Сибири с умеренной соленостью.
Содовые озера как экстремальные местообитания являются объектом изучения на протяжении длительного времени, и интерес к их исследованию не убывает. Это обусловлено спецификой галоалкалофильных микроорганизмов, как особой группы двойных экстремофилов, а также связано с гипотезой, рассматривающей микробные сообщества содовых озер как реликтовый аналог наземной биоты раннего протерозоя (Заварзин, 1993).
До недавнего времени представление об экологии и биоразнообразии фототрофных бактерий филума Chloroflexi (Chloroflexota) базировалось на свойствах термофильных видов Chloroflexi: Chloroflexus aurantiacus, Cfl. aggregans, Cfl. islandicus, Rhoseiflexus castenholzii, которые изучены в чистых культурах (Hanada, 2014; Gaisin et al., 2017). Недавно список термофильных видов пополнился двумя новыми таксонами “Cand. Chloroanaerofilum corporosum” и “Cand. Roseilinea gracile”, которые определены в результате метагеномного анализа микробных матов щелочно-кремнистых горячих источников в Йеллоустонском национальном парке (Tank et al., 2017).
Информация о мезофильных нитчатых аноксигенных фототрофных бактериях (НАФБ) в основном получена при исследовании природных образцов или обогащенных монокультур бактерий (Дубинина, Горленко, 1975; Горленко, Пивоварова, 1977; Klappenbach, Pierson, 2004; Gorlenko et al., 2014; Gaisin et al., 2019а, 2019b; Burganskaya et al., 2019). Исключение составляет Oscillochloris trichoides штамм Dg 6, физиология и другие свойства которого исследованы в чистой культуре (Keppen et al., 2000).
Мезофильные Chloroflexi были обнаружены в составе микробных матов низкотемпературных участков холодных и термальных источников. Из сульфидсодержащих источников получены культуры НАФБ и идентифицированы как два пресноводных вида рода Oscillochloris: Oscillochloris trichoides и “Cand. Oscillochloris fontis” (Горленко, Коротков 1979; Gaisin et al., 2019b). НАФБ идентифицированы также в бентосных сообществах морских лагун и фототрофных сообществах, сформированных в континентальных водоемах различной степени минерализации (Pierson et al., 1994; Компанцева и соавт., 2005; Grouzdev et al., 2019; Бурганская и соавт., 2019). В гиперсоленых лагунах морского происхождения обнаружена экстремально галофильная НАФБ, названная “Cand. Chlorothrix halophila” (Klappenbach, Pierson, 2004). Из содовых озер Восточной Сибири и Монголии с минерализацией от 5 до 28 г/л выделены несколько генетически близких между собой монокультур НАФБ, описанных как новый род и вид “Cand. Chloroploca asiatica” (Gorlenko et al., 2014). Бактерии этого вида следует рассматривать, как алкало- и галотолеранты. Умеренно галофильная и алкалофильная НАФБ была выделена из микробных матов мелководного содового озера Киран с минерализацией 35 г/л, рН 9.3 (Burganskaya et al., 2018). Эта бактерия описана как новый род и новый вид “Cand. Viridilinea mediisalina” и является единственным представителем галоалкалофильных НАФБ (Gaisin et al., 2019a).
В настоящей работе установлено, что бактерии филогенетически близкие к “Cand. Viridilinea mediisalina” появляются в составе фототрофных сообществ гиперсоленых содовых озер Кулундинской степи (Западная Сибирь) при их распреснении.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования
Объектами исследования служили фототрофные сообщества из двух озер: Танатар 6 (51°37′08′′ N 79°48′53′′ E) и Горчина 1 (51°40′19′′ N 79°54′20′′ E). Озера расположены в Михайловском районе Алтайского края рядом с пос. Малиновое озеро (рис. 1). По химическому типу рассолов являются содовыми и имеют стабильные щелочные значения рН за счет высокой карбонатной щелочности (Samylina et al., 2019). Озера бессточные, окружены сосновыми борами. Общая соленость в момент отбора образцов составляла 13 и 30 г/л и рН 10.1 и 10.6 в Танатаре 6 и Горчине 1 соответственно. Соленость и значения рН измеряли с помощью полевого потенциометра-кондуктометра “WTW” (Германия). Уровень воды был высоким: литоральная зона полностью затоплена, граница роста степных трав оказалась также в воде (рис. 2а, 2е).
Рис. 1.
Карта-схема расположения озер, из которых были выделены НАФБ: МО – пос. Малиновое озеро; М – оз. Малиновое; Т1–Т6 – озера Танатары 1, 2, 3, 4, 5 и 6 соответственно; Г1–Г4 – озера Горчины 1, 2, 3 и 4 соответственно.
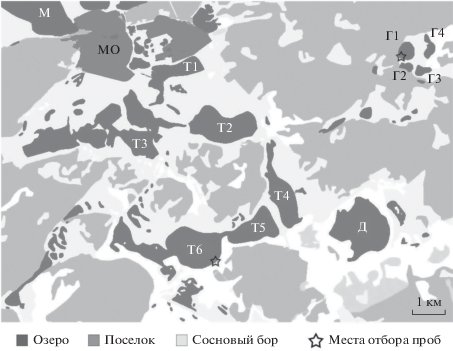
Рис. 2.
Состав фототрофных сообществ, исследованных в озерах Танатар 6 (а–д) и Горчина 1 (е–к) в июле 2018 г.: а, е – высокий уровень воды в озерах; б–д – образец Tr 6; ж–к – образец Gr 1-1. Цифрами обозначены: 1 – нити НАФБ; цианобактерии (2 – cf. Cyanobacterium cedrorum, 3 – Nodularia harveyana, 4 – cf. Nostoc punctiforme, 5 – cf. Nostoc paludosum, 6 – Nodosilinea sp., 7 – Spirulina major, 8 – Halomicronema sp., 9 – акинеты Anabaenopsis sp., 10 – Chroococcus turgidus, 11 – Arthrospira maxima, 12 – Geitlerinema sp.); пурпурные бактерии (13 – Thiocapsa sp., 14 – Chromatium sp.); диатомовые водоросли (15 – Anomoeoneis sphaerophora, 16 – Nitzschia cf. communis); эвглениды (17 – Euglena sp.). Масштаб линейки – 5 мкм.

Пробы для выделения НАФБ были отобраны 28–29 июля 2018 г. В воде озера Танатар 6 наблюдали цветение одноклеточной зеленой водоросли Picocystis salinarum, поэтому заметного развития биопленок на дне не происходило. В качестве образца отобрано эпифитное циано-бактериальное обрастание (образец Tr 6). В прибрежной зоне озера Горчина 1 происходило обильное развитие планктонного сообщества, которое в виде мелких комочков пассивно осаждалось на дно, где к моменту отбора проб образовался слой фототрофной биомассы толщиной 20–25 см. Для микроскопического исследования были отобраны образцы воды с цветением (Gr 1-1) и осевшей из планктона биомассы (Gr 1-2).
Морфологическое разнообразие микроорганизмов в природных образцах изучали в нативных препаратах под световым микроскопом Jenaval с фотоустановкой Zeiss Bundle Canon PS G9 (Германия). Фотографии сообществ делали с использованием программного обеспечения AxioVision Rel. 4.7. Идентификацию цианобактерий в образцах производили на основании морфологических критериев по определителям (Komárek, Anagnostidis, 1998, 2005; Komárek, 2013), а также с учетом данных, полученных в предыдущих исследованиях (Самылина и соавт., 2015; Namsaraev et al., 2018; Samylina et al., 2019).
Метод получения монокультур НАФБ
Образцы отбирали в пластиковые флаконы объемом 50 мл. Пробы гомогенизировали и использовали в качестве инокулята. Посев проводили в пробирки объемом 20 мл в среду с полужидким агаром (0.5%) с десятикратными разведениями. Состав среды (мг/л): KH2PO4 – 400, NH4Cl – 400, MgCl2 · 6H2O – 200, KCl – 300, NaCl – 15 000, CaCl2 · 2H2O – 50, NaHCO3 – 3000; Na2S · · 9H2O – 500, дрожжевой экстракт – 50, ацетат натрия – 250, раствор микроэлементов – 1 мл и раствор витаминов по Пфеннигу – 1 мл. pH среды доводили до значения 9.0–9.5. Пробирки с засеянной средой инкубировали при 28°С в люминостате с лампами дневного света при освещенности 2000 люкс. Выросшие в столбиках агара отдельные колонии из последних разведений извлекали пастеровской пипеткой и повторно пересевали с разведениями в агаризованную среду. Процедуру пересевов отдельно выросших колоний повторяли до получения обогащенной монокультуры НАФБ, свободной от присутствия других видов фототрофов.
Морфология и тонкое строение
Морфологию клеток монокультур НАФБ изучали в фазовом контрасте с помощью микроскопа Olympus BX 41 (Япония). Для получения ультратонких срезов клетки собирали центрифугированием в течение 3 мин при 16 000 g и фиксировали, используя 2.5% глутаральдегид в буфере PBS (0.1 М фосфатно-натриевый буфер, содержащий 0.85% NaCl, pH 7.2), при 4°C. После трехкратной промывки в буфере PBS образец был постфиксирован в 1% OsO4 в течение 1 ч, затем последовательно обезвожен с повышением концентрации этанола и 100% ацетона и погружен в эпоксидную смолу Epon (Sigma, США). Срезы контрастировали обработкой сначала уранилацетатом, а затем цитратом свинца и просматривали под электронным микроскопом Libra-120 (Carl Zeiss, Германия) или Jeol JEM-100C (Япония) (Gaisin et al., 2019a, 2019b; Bryantseva et al., 2019).
Анализ состава пигментов
Для анализа качественного и количественного состава пигментов выделенных монокультур НАФБ использовали клетки, выросшие на жидких средах (Ashikhmin et al., 2014). Спектры поглощения мембранной фракции, полученной после обработки ультразвуком клеточной суспензии в 10 мМ трис-HCl-буфере (рН 8.0), а также экстракты смеси ацетон–метанол (7 : 2, об./об.) и петролейного эфира анализировали с использованием спектрофотометра Cary 50 (Varian, Австралия) в диапазоне длин волн 360–960 нм. Пигменты клеток были проанализированы с помощью высокоэффективной жидкостной хроматография (ВЭЖХ), используя колонку Agilent Zorbax SB-C18 (4.6 × 250 мм) (Agilent, США). Аппарат для ВЭЖХ (Shimadzu, Япония) состоял из насоса LC-10ADVP с модулем FCV-10ALVP, детектором с диодной матрицей SPD-M20A и термостатом CTO-20AC. Колонка была сбалансирована смесью ацетонитрил/вода/этилацетат (69.3 : 7.7 : 23%, об./об.). Смесь пропускали через колонку в течение первых 3 мин, а затем данная смесь была линейно замещена этилацетатом (37 мин). После этого чистый этилацетат пропускали через колонку в течение дополнительных 3 мин. Скорость подачи всего растворителя составляла 1.0 мл/мин. Анализ был выполнен при постоянной температуре 22°С. Концентрация пигментов была рассчитана с помощью программы LC-solution (Shimadzu, Япония).
Идентифицикация выделенных НАФБ
ДНК бактерий выделяли с помощью набора PowerMax Soil DNA Isolation Kit (MO BIO Laboratories, Inc., США), согласно инструкции производителя. Фрагменты участка оперона pufLM амплифицировали и секвенировали с использованием праймерных систем, специфичных для НАФБ (Achenbach et al., 2001; Калашников и соавт., 2014). Продукты амплификации очищали с использованием набора Wizard SV Gel and PCR Clean-Up System (Promega, США), согласно инструкции производителя. Секвенирование продуктов амплификации проводили по методу Сэнгера на автоматическом секвенаторе DNA Analyzer 3730 (Applied Biosystems, США) с использованием набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit, согласно инструкции производителя. Из полученных последовательностей оперона pufLM были транслированы in silico аминокислотные последовательности белков PufL (240 а.o) и PufM (163 а.o), которые затем были независимо выравнены с использованием сервиса MUSCLE (Madeira et al., 2019) и конкатенированы. Полученные конкатенаты (403 а.o) были использованы для построения филогенетического дерева в программе MEGA 7.0 (Sudhir et al., 2016) с применением алгоритма Maximum Likelihood. Бутстрэп поддержка ветвей была рассчитана при анализе 1000 альтернативных деревьев. Последовательности генов pufLM культур Gr 1-1 и Tr 6 депонированы в базу данных GenBank под номерами MT364253 и MT364254 соответственно.
РЕЗУЛЬТАТЫ
Условия формирования фототрофных сообществ в исследованных озерах
Соленость рапы исследованных озер обычно соответствовала статусу гиперсоленых водоемов (Самылина и соавт., 2015; Namsaraev et al., 2018; Samylina et al., 2019). Однако, в 2018 г. в результате дождей произошло сильное их распреснение, и в период полевых работ (28–29 июля) общая соленость составила 13 г/л для Танатара 6 и 30 г/л для Горчины 1, что привело к обильному развитию разнообразных прокариотных и эукариотных фототрофных микроорганизмов в планктоне и перифитоне.
Характеристика фототрофных микроорганизмов в пробах, отобранных из озер Танатар 6 и Горчина 1
Образец Tr 6 из оз. Танатар 6 представлял собой эпифитное циано-бактериальное сообщество (перифитон), в котором доминировали гетероцистные цианобактерии cf. Nostoc paludosum, cf. Nostoc punctiforme и Nodularia harveyana, нитчатые негетероцистные цианобактерии Nodosilinea sp. и Spirulina major, одноклеточные цианобактерии cf. Cyanobacterium cedrorum, пурпурные бактерии рода Thiocapsa и нитчатые микроорганизмы желто-зеленого цвета (предположительно НАФБ) (рис. 2б–2д).
В образце планктонного сообщества Gr 1-1 из оз. Горчина 1 выявлены различные фототрофные микроорганизмы (рис. 2ж–2к): среди эукариот эвглениды (Euglena sp.) и диатомовые водоросли (Anomoeoneis sphaerophora и Nitzschia cf. communis); среди прокариот цианобактерии (нитчатые негетероцистные Nodosilinea sp., Geitlerinema sp., Spirulina major, Arthrospira maxima, многочисленные акинеты и гетероцисты Anabaenopsis sp. и в небольшом количестве одноклеточные Chroococcus turgidus и Cyanobacterium cf. stanieri), пурпурные бактерии (Chromatium sp.) и предполагаемые НАФБ. Состав доминирующих фототрофов в образце Gr 1-2 (осевшая на дно биомасса планктона) был другим. Водоросли были представлены нитчатыми хлорофитами Ctenocladus circinnatus. Цианобактерии – нитчатыми негетероцистными Nodosilinea sp. и Geitlerinema sp., акинетами гетероцистных Anabaenopsis sp. и единичными клетками Cyanobacterium cf. stanieri. Среди пурпурных бактерий помимо Chromatium sp. обнаружены колонии Ectothiorhodospira sp. Однако, нитей, похожих на НАФБ, обнаружено не было.
Таким образом, в образцах Tr 6 и Gr 1-1 среди цианобактерий и других фототрофов присутствовали нитчатые микроорганизмы, окрашенные в желто-зеленый цвет, морфологически сходные с НАФБ (рис. 2б, 2д, 2ж, 2к). В дальнейшем, эти бактерии были выделены в монокультуры, и была подтверждена их принадлежность к филуму Chloroflexi.
Морфология выделенных культур НАФБ
На первых этапах очистки на использованной среде совместно с НАФБ вырастали пурпурные бактерии родов Chromatium, Thiocapsa, Ectothiorhodospira, Thiorhodospira. После ряда пересевов из отдельных колоний были получены монокультуры НАФБ.
Выделенные культуры НАФБ Tr 6 (оз. Танатар 6) и Gr 1-1 (оз. Горчина 1) имели сходную морфологию (рис. 3, 4). Цвет клеточной суспензии и выросших в агаре колоний – грязно-зеленый. Цилиндрические клетки формировали неразветвленные нити (трихомы) неопределенной длины, окруженные тонким прозрачным чехлом. Толщина трихомов 1.1–1.8 мкм. Нити обеих культур были способны к движению с помощью скольжения. Цвет нитей в проходящем свете – желто-зеленый. В местах поперечных клеточных перегородок при микрокопировании с фазовым контрастом выявлялись блестящие зоны, сформированные газовыми везикулами. В составе клеток часто встречались светлые округлые включения, предположительно полигидроксиалканатов.
Рис. 3.
Морфология и ультратонкое строение НАФБ Tr 6: а–в – электронный микроскоп, ультратонкие срезы (масштаб линейки 0.5 мкм); г – световой микроскоп фазовый контраст (масштаб линейки 5 мкм). Обозначения: кп – клеточная перегородка; ч – чехол; хл – хлоросомы, пга – полигидроксиалканоаты; пф – полифосфаты.
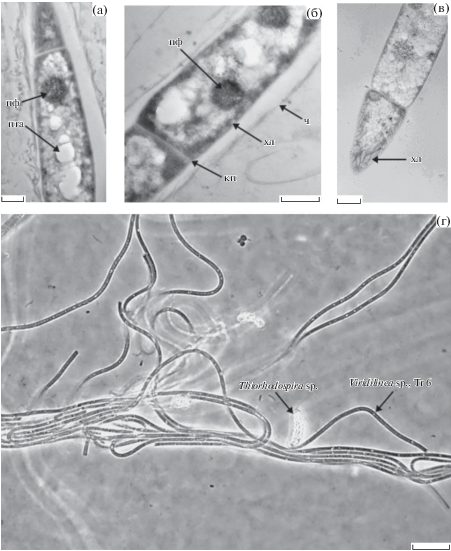
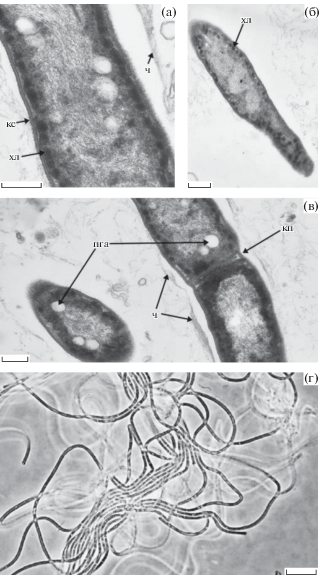
Рис. 4.
Морфология и ультратонкое строение НАФБ Gr 1-1: а–в – электронный микроскоп, ультратонкие срезы (масштаб линейки 0.5 мкм); г – световой микроскоп, фазовый контраст (масштаб линейки 0.5 мкм). Обозначения: кс – клеточная стенка; кп – клеточная перегородка; ч – чехол; хл – хлоросомы, пга – полигидроксиалканоаты.
Тонкое строение
Оба изолята имели сходный тип строения, выявленный на ультратонких срезах (рис. 3, 4). Нити – трихомы состояли из цилиндрических клеток размером 1.2–1.8 × 3.5–5.0 мкм (Tr) и 1.0–1.5 × 2.5–4.5 мкм (Gr 1-1) и были окружены тонким чехлом с размытыми очертаниями. Разделение клеток сопровождалось образованием поперечных клеточных перегородок. В месте деления перетяжек не наблюдалось. Клеточная стенка состояла из нескольких слоев, однако внешней мембраны, характерной для грамотрицательных бактерий не обнаружено. За цитоплазматической мембраной располагались хлоросомы – светособирающие антенные структуры, характерные для большинства известных фототрофных Chloroflexi. В клетках присутствовали оптически светлые включения, предположительно полигидроксиалканатов. Кроме того, обнаружены темные включения зерен полифосфатов.
Пигменты
На рис. 5 и 6 приведены данные по поглощению света фракцией мембран клеток культур Tr 6 и Gr 1-1, а также клеточных экстрактов в петролейном эфире и ацетон-метаноле (7 : 2, об./об.). Спектральный анализ мембранной фракции, ре-суспендированной в Трис-HCl буфере, выявил присутствие максимумов, характерных для Бхл c или d (742 и 743 нм), а также нечетко выраженные максимумы каротиноидных пигментов в области 499–520 нм. В ацетон-метанольной смеси спектры поглощения экстрактов мембран культур Tr 6 и Gr 1-1 имели основные максимумы Бхл при 664 и 656 нм, а в петролейном эфире – при 660 и 652 нм, соответственно (рис. 5а, 6а). Результаты ВЭЖХ анализа экстрагированных пигментов из клеток (рис. 5б, 6б, табл. 1) показали присутствие у монокультуры Tr 6 тринадцати форм Бхл c и семи форм Бхл d, а у монокультуры Gr 1-1 – четырех форм Бхл c и семи форм Бхл d. Кроме Бхл c и d, также был обнаружен Бхл a, входящий в состав реакционного центра у всех хлорофилл содержащих Chloroflexi. Он присутствует в клетках в небольшом количестве (0.9–1.2 мол. %). Соотношение Бхл a, Бхл c и Бхл d было не одинаковым для исследованных культур НАФБ. Для Tr 6 оно составляло 1.2 : 64.5 : 34.3 мол. %; для Gr 1-1 соотношение Бхл а : Бхл c : Бхл d – 0.9 : 35.8 : 63.3 мол. %. Следует отметить присутствие значительного количества каротиноидов, которые также относятся к категории антенных пигментов. Общее количество каротиноидов у новых культур НАФБ было 10.8–15.8 мол. % от суммы пигментов (Бхл + Кар). β-Каротин и γ-каротин являлись преобладающими каротиноидами (табл. 1). В небольших количествах обнаружен ликопин и его производные, которые образуются в цепи биосинтеза β- и γ-каротинов.
Рис. 5.
Спектры поглощения (а) и ВЭЖХ экстрагированных пигментов (б) из клеток НАФБ Tr 6. Идентификация пиков: 1, 2, 4, 6, 9, 14, 19 – Бхл d; 3, 5, 7, 8, 10–12, 15–18, 20, 21 – Бхл c; 13 – Бхл a; 22 – γ-каротин; 23 – производное ликопина; 24 – β-каротин.
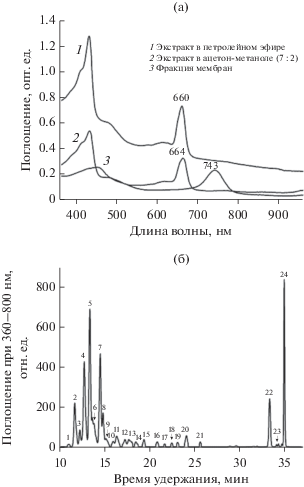
Рис. 6.
Спектры поглощения (а) и ВЭЖХ экстрагированных пигментов (б) из клеток НАФБ Gr 1-1. Идентификация пиков: 1−3, 6, 9, 10, 12 – Бхл d; 4, 5, 7, 8 – Бхл c; 11 – Бхл a; 13 – ликопин; 14 – γ-каротин; 15 – производное ликопина; 16 – β-каротин.
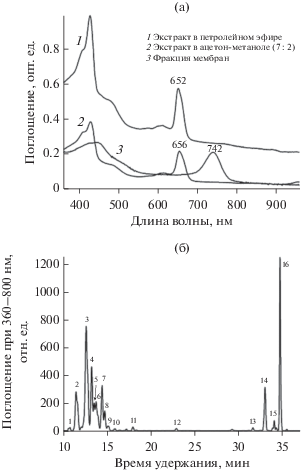
Рис. 7.
Филогенетическое положение выделенных культур АНФБ Tr 6 и Gr 1-1 на основании анализа аминокислотной последовательности PufLM (403 аминокислотных оснований). Алгоритм—Maximum Likelihood. Достоверность ветвления установлена на основании построения 1000 альтернативных деревьев.
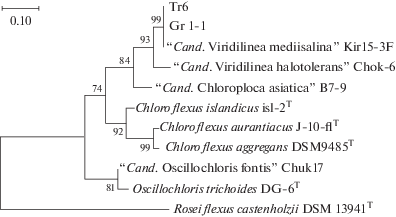
Таблица 1.
Сравнительная характеристика культур НАФБ рода “Cand. Viridilinea”
| Характеристики | “Cand. Viridilinea mediisalina” | “Cand. Viridilinea halotolerant” | ||
|---|---|---|---|---|
| Tr 6 | Gr 1-1 | Kir15-3F | ||
| Местообитание | Микробный мат, щелочное содовое озеро, минерализация 13 г/л, рН 10.1 | Микробный мат, содовое озеро, минерализация 30 г/л, рН 10.6 | Микробный мат, содовое озеро, минерализация 35 г/л, рН 9.2 | Микробный мат, сульфидный источник, минерализация 22 г/л, рН 7 |
| Размер клеток, мкм | 1.2–1.8 × 3.5–5.0 | 1.0–1.5 × 2.5–4.5 | 1.5 × 4.0–6.0 | 1.2–1.8 × 3.0–4.0 |
| Трихом | Неразветвленный неопределенной длины | Неразветвленный неопределенной длины | Неразветвленный неопределенной длины | Неразветвленный неопределенной длины |
| Чехол | + | + | + | + |
| Подвижность | + | + | + | + |
| Газовые везикулы | + | + | + | + |
| Хлоросомы | + | + | + | + |
| Цвет клеточной суспензии | Зеленый или грязно-зеленый | Зеленый или грязно-зеленый | Зеленый | Желто-зеленый или зеленый |
| Спектр поглощения пигментов in vivo, нм | (430–440), 455, 743 | (428), 443, 742 | 450, (515), 615, (674), 745, (805), 860 | 457, (520), 748 |
| Спектр поглощения пигментов ацетон-метанолового экстракта (7 : 2, об./об.), нм | (415–420), 433, (480–490), 616, 664 | (415–420), 430, (480–490), 615, 656 | 430, (463), (485), 615, 656, 775 | 436, 502, 618, 667 |
| Бхл, мол. % | а 1.2, c 64.5, d 34.3 | а 0.9, c 35.8, d 63.3 | а 0.6, c 47.6, d 51.8 | а 0.2, c 95.2, d 4.6 |
| Каротиноиды, мол. % | γ-Каротин 32.9, β-каротин 65.9, производные ликопина 1.2 |
γ-Каротин 26.3, β-Каротин 68.0, ликопин 1.8, производ. ликопина 4.0 |
γ-Каротин 49.1, β-Каротин 46.8, ликопин 4.1 |
γ-Каротин 48.1, β-Каротин 47.4, производные ликопина 4.5 |
| Бхл : каротиноиды, мол. % | 89.2 : 10.8 | 84.2 : 15.8 | 85 : 15 | 94.7 : 5.3 |
| Оптимум рН | 8.0–9.5 | 8.0–9.5 | 8.0–9.0 | 7.5–8.5 |
| Оптимум температуры, °С | 25–35 | 25–35 | 31–42 | 31−42 |
| Оптимум NaCl, % | 1.5–2.5 | 1.5–2.5 | 2.0–2.5 | 0.5−1 |
| Фототрофия | + | + | + | + |
| Рост в темноте | – | – | – | – |
| Аэробный рост | – | – | – | – |
| Запасные вещества | ПГА, ПФ | ПГА, ПФ | ПГА, ПФ | ПГА, ПФ |
| Г+Ц в ДНК, мол. % | но | но | 58.01 | 60.4 |
Физиологические особенности
Монокультуры Tr 6 и Gr 1-1 являлись алкалофильными, солеустойчивыми, мезофильными анаэробными фототрофными бактериями. Хороший рост происходил на среде с сульфидом 0.3–0.7 г/л и бикарбонатом, содержащей 15–25 г/л NaCl при рН 8.0–9.5 и температуре 25–35°C. Добавление в среду комплекса витаминов положительно влияло на рост выделенных культур НАФБ. Образование глобул элементной серы в процессе роста на среде с сульфидом не наблюдали. Рост бактерий не происходил в темноте в анаэробных или аэробных условиях.
Таксономическое положение
Монокультуры НАФБ Tr 6 и Gr 1-1 были идентифицированы с использованием специфических праймеров на последовательность оперона pufLM, входящих в состав РЦ ФС II (рис. 7). Филогенетический анализ показал, что последовательности белков PufLM, принадлежащие монокультурам Tr 6 и Gr 1-1, формировали ветвь внутри порядка Chloroflexales филума Chloroflexi (рис. 7). Наиболее близким к ним была последовательность PufLM культуры “Cand. Viridilinea mediisalina” Kir15-3F (сходство 100%). Таким образом, полученные данные показали высокий уровень сходства новых культур между собой и с культурой Kir15-3F типового вида “Cand. Viridilinea mediisalina”.
Филогенетическое положение выделенных культур НАФБ Tr 6 и Gr 1-1 на основании анализа аминокислотной последовательности PufLM (403 аминокислотных оснований). Алгоритм – Maximum Likelihood. Достоверность ветвления установлена на основании построения 1000 альтернативных деревьев.
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Содовые озера Кулундинской степи очень изменчивы по своим гидрохимическим параметрам (Самылина и соавт., 2015; Namsaraev et al., 2018; Samylina et al., 2019), причем помимо сезонной изменчивости, ярко выражена и межгодовая. Среди всех изученных озер Горчина 1 является самым контрастным по солености: в период наблюдений с 2005 по 2018 гг. содержание солей изменялось в диапазоне от 400 до 30 г/л. В Танатаре 6 в тот же период – от 250 до 13 г/л. Условно, можно выделить периоды (фазы) экстремальной (300–400 г/л), высокой (60–200 г/л) и относительно низкой (13–60 г/л) общей солености, которые длятся по несколько лет. До 2018 г. исследуемые озера находились поочередно в фазах высокой и экстремально высокой солености, а в 2018 г. перешли в фазу относительно низкой солености (30 г/л для Горчины 1 и 13 г/л для Танатара 6), т.е. оказались в состоянии максимального распреснения за весь период наблюдений. Это сказалось на разнообразии фототрофных микроорганизмов в озерах. Так, в предыдущие годы при соленостях от 60 г/л и выше в исследуемых озерах доминировали галоалкалофильные и натронофильные нитчатые (Geitlerinema sp. и Nodosilinea sp.) и одноклеточные (Euhalothece sp.) цианобактерии, а также пурпурные серные бактерии Ecthothiorhodospira sp. В 2018 г. в составе фототрофных сообществ массово появились гетероцистные цианобактерии, которые ранее не встречались (Anabaenopsis sp., cf. Nostoc paludosum, cf. Nostoc punctiforme), а помимо цианобактерий и пурпурных серых бактерий впервые выявлено массовое развитие НАФБ филума Chloroflexi.
Ранее отмечалось присутствие НАФБ в бентосном сообществе степного соленого щелочного озера Хилганта с минерализацией около 40 г/л и рН выше 9.5 (Компанцева и соавт., 2005). Видовая принадлежность этого микроорганизма не была установлена. Единственный галоалкалофильный вид “Cand. Viridilinea mediisalina” обнаружен в составе микробного мата сапропелевого содового озера Киран (Восточная Сибирь) с минерализацией 35 г/л, в котором отмечалось обильное цветение планктонной цианобактерии Arthrospira sp. (Gaisin et al., 2019a). Другой вид “Cand. Viridilinea halotolerans” изолирован из микробного мата соленого Чокракского источника (Крым) с рН близким к нейтральному значению (Grouzdev et al., 2019).
В исследованных степных Кулундинских озерах формирование альгобактериального мата не происходило. НАФБ вместе с другими фототрофами, представленными преимущественно галоалкалофилами, развивались в местах скопления и деструкции оседающего планктона, сопровождающегося выделением сероводорода. Впервые установлено присутствие НАФБ в перифитоне, в обрастаниях на поверхности затопленных растений. Присутствие как оксигенных, так и аноксигенных фототрофов в отобранных пробах указывало на наличие в них как аэробных, так и анаэробных микрозон.
Данные по нуклеотидам и белкам комплекса PufLM корректны для определения до вида фототрофных бактерий, имеющих реакционный центр 2-ого типа (РЦ II) (Imhoff et al., 2018). К таким фототрофам относятся пурпурные бактерии, аэробные бактериохлорофилл a содержащие аноксигенные фототрофные бактерии, представитель филума Gematimonas и НАФБ. Идентификация двух выделенных нами культур НАФБ по данным состава аминокислот комплекса PufLM, показала их принадлежность к филуму Chloroflexi и 100% сходство между собой и с алкало-галофильным изолятом “Cand. Viridilinea mediisalina” Kir15-3F, обнаруженным ранее в содовом озере Киран. Интересно, что Kir15-3F, являясь сульфидофилом, не имеет фермент сульфид: хинон оксидоредуктазу, участвующую в первичном этапе окисления сульфида (Gaisin et al., 2019a). Дальнейшее исследование физиологии двух новых монокультур, выделенных из озер Кулундийской степи, может дать ответ является ли этот признак характерным для данного вида.
Интересной особенностью НАФБ рода “Cand. Viridilinea” является наличие nif-генов, определяющих способность к азотфиксации. Ранее было показано, что соленость рапы является основным фактором, влияющим на состав и диазотрофный потенциал фототрофных сообществ содовых озер Кулундинской степи (Namsaraev et al., 2018; Samylina et al., 2019). В 2018 г. произошло сильное распреснение исследованных содовых озер (13–30 г/л) и наряду с увеличением разнообразия гетероцистных цианобактерий в составе фототрофных сообществ массово развились НАФБ рода “Cand. Viridilinea”. Можно предположить, что представители этого рода вместе с пурпурными бактериями и цианобактериями участвуют в фиксации атмосферного азота в низкоминерализованных содовых степных озерах.
Таким образом, показано что вид “Cand. Viridilinea mediisalina” распространен в фототрофных сообществах географически удаленных степных содовых озер Сибири и может играть важную экологическую роль.
Список литературы
Бурганская Е.И., Груздев Д.С., Круткина М.С., Горленко В.М. Бактериальные сообщества микробных матов супралиторали Белого моря и литорали отделившихся от моря озер // Микробиология. 2019. Т. 88. № 5. С. 568–582. https://doi.org/10.1134/S0026365619050033
Burganskaya E.I., Grouzdev D.S., Krutkina M.S., Gorlenko V.M. Bacterial communities of microbial mats of the white sea supralittoral and of the littoral of the lakes separated from the sea // Microbiology (Mikrobiologiya). 2019. V. 88. № 5. P. 600–612. https://doi.org/10.1134/S0026261719050035
Горленко В.М., Коротков С.А. Морфологические и физиологические особенности новой нитчатой скользящей зеленой бактерии Oscillochloris trichoides nov. comb. // Изв. АН СССР Сер. Биол. 1979. Т. 6. С. 848–856.
Gorlenko V.M., Korotkov S.A. Morphological and physiological features of the new filamentous gliding green bacterium Oscillochloris trichoides nov. comb. // Izv. Akad. Nauk SSSR Ser. Biol. 1979. № 6. P. 848–857.
Горленко В.М., Пивоварова Т.А. О принадлежности сине-зеленой водоросли Oscillatoria coerulescens Gicklhorn, 1921 к новому роду хлоробактерий Oscillochloris nov. gen. // Изв. АН СССР Сер. Биол. 1977. № 3. С. 396–409.
Gorlenko, V.M., Pivovarova, T.A. On the belonging of bluegreen alga Oscillatoria coerulescens Gicklhorn, 1921 to a new genus of chlorobacteria Oscillochloris nov. gen. // Izv. Akad. Nauk SSSR Ser. Biol. 1977. № 3. P. 396–409.
Дубинина Г.А., Горленко В.М. Новые нитчатые фотосинтезирующие зеленые бактерии с газовыми вакуолями // Микробиология. 1975. Т. 44. № 3. С. 511–518.
Dubinina G.A., Gorlenko V.M. New filamentous photosynthetic green bacteria containing gas vacuoles // Mikrobiologiya. 1975. V. 44. № 3. P. 452–458.
Компанцева Е.И., Сорокин Д.Ю., Горленко В.М., Намсараев Б.Б. Фототрофное сообщество соленого щелочного озера Хилганта (Юго-Восточное Забайкалье) // Микробиология. 2005. Т. 74. № 3. С. 410–419.
Kompantseva E.I., Sorokin D.Yu., Gorlenko V.M., Namsaraev B.B. The phototrophic community found in Lake Khilganta (an alkaline saline lake located in the Southeastern Transbaikal region) // Microbiology. 2005. V. 74. № 3. P. 352–361.
Самылина О.С., Сапожников Ф.В., Гайнанова О.Ю., Рябова А.В., Никитин М.А., Сорокин Д.Ю. Альго-бактериальные сообщества содовых озер Кулундинской степи (Алтайский край, Россия) // Микробиология. 2015. Т. 84. № 1. С. 107–119. https://doi.org/10.7868/S0026365614060172
Samylina O.S., Sapozhnikov F.V., Gainanova O.Yu., Ryabova A.V., Nikitin M.A., Sorokin D.Yu. Algo–bacterial communities of the Kulunda Steppe (Altai region, Russia) soda lakes // Microbiology. 2014. V. 83. № 6. P. 849–860. https://doi.org/10.1134/S0026261714060162
Заварзин Г.А. Эпиконтинентальные содовые водоемы как предполагаемые реликтовые биотопы формирования наземной биоты // Микробиология. 1993. Т. 62. С. 789–800.
Zavarzin G.A. Epicontinental soda lakes as probable relict biotopes of terrestrial biota formation // Microbiology (Moscow). 1993. V. 62. P. 473–479.
Achenbach L.A., Carey J., Madigan M.T. Photosynthetic and phylogenetic primers for detection of anoxygenic phototrophs in natural environments // Appl. Environ. Microbiol. 2001. V. 67. P. 2922–2926. https://doi.org/10.1128/AEM.67.7.2922-2926.2001
Ashikhmin A., Makhneva Z., Moskalenko A. The LH2 complexes are assembled in the cells of purple sulfur bacterium Ectothiorhodospira haloalkaliphila with inhibition of carotenoid biosynthesis // Photosynth. Res. 2014. V. 119. P. 291–303.
Bryantseva I.A., Tarasov A.L., Kostrikina N.A., Gaisin V.A., Grouzdev D.S., Gorlenko V.M. Prosthecochloris marina sp. nov., a new green sulfur bacterium from the coastal zone of the South China Sea // Arch. Microbiol. 2019. V. 201. P. 1399–1404. https://doi.org/10.1007/s00203-019-01707-y
Burganskaya E.I., Bryantseva I.A., Gaisin V.A., Grouzdev D.S., Rysina M.S., Barkhutova D.D., Baslerov R.V., Gorlenko V.M., Kuznetsov B.B. Benthic phototrophic community from Kiran soda lake, south‑eastern Siberia // Extremophiles. 2018. V. 22. № 2. P. 211–220. https://doi.org/10.1007/s00792-017-0989-0
Burganskaya E.I., Bryantseva I.A., Krutkina M.S., Grouzdev D.S., Gorlenko V.M. Bacterial communities of the microbial mats of Chokrak sulfide springs // Arch. Microbiol. 2019. V. 201. № 6. P. 795–805. https://doi.org/10.1007/s00203-019-01648-6
Gaisin V.A., Burganskaya E.I., Grouzdev D.S., Ashikhmin A.A., Kostrikina N.A., Bryantseva I.A., Koziaeva V.V., Gorlenko V.M. ‘Candidatus Viridilinea mediisalina’, a novel phototrophic Chloroflexi bacterium from a Siberian soda lake // FEMS Microbiology Letters. 2019a. V. 366. № 5. pii: fnz043. https://doi.org/10.1093/femsle/fnz043
Gaisin V.A., Burganskaya E.I., Grouzdev D.S., Osipova N.S., Ashikhmin A.A., Sinetova M.A., Krutkina M.S., Bryantseva I.A., Sukhacheva M.V., Kochetkova T.V., Koziaeva V.V., Kalashnikov A.M., Gorlenko V.M. ‘Candidatus Oscillochloris fontis’: a novel mesophilic phototrophic Chloroflexota bacterium belonging to the ubiquitous Oscillochloris genus // FEMS Microbiology Letters. 2019b. V. 366. № 8. pii: fnz097. https://doi.org/10.1093/femsle/fnz097
Gaisin V.A., Kalashnikov A.M., Grouzdev D.S., Sukhacheva M.V., Kuznetsov B.B., Gorlenko V.M. Chloroflexus islandicus sp. nov., a thermophilic filamentous anoxygenic phototrophic bacterium from a geyser // Int. J. Syst. Evol. Microbiol. 2017. V. 67. № 5. P. 1381–1386. https://doi.org/10.1099/ijsem.0.001820
Gorlenko V.M., Bryantseva I.A., Kalashnikov A.M., Gaisin V.A., Sukhacheva M.V., Gruzdev D.S., Kuznetsov B.B. Candidatus ‘Chloroploca asiatica’ gen. nov., sp. nov., a new mesophilic filamentous anoxygenic phototrophic bacterium // Microbiology. 2014. V. 83. № 6. P. 838–848. https://doi.org/10.1134/S0026261714060083
Grouzdev D.S., Burganskaya E.I., Krutkina M.S., Sukhacheva M.V., Gorlenko V.M. Genome sequence of “Candidatus Viridilinea halotolerans” Chok-6, isolated from a saline sulfide-rich spring // Microbiol. Resour. Announc. 2019. V. 8. № 4. e01614-18. https://doi.org/10.1128/MRA.01614-18
Hanada S. The phylum Chloroflexi, the family Chloroflexaceae, and the related phototrophic families Oscillochloridaceae and Roseiflexaceae // The Prokaryotes – Other Major Lineages of Bacteria and the Archaea / Eds. Falkow S., Rosenberg E., Schleifer K.-H., Stackebrandt E.Berlin Heidelberg: Springer-Verlag. 2014. P. 515–532.
Imhoff J.F., Rahn T., Künzel S., Neulinger S.C. Photosynthesis is widely distributed among Proteobacteria as demonstrated by the phylogeny of PufLM reaction center proteins // Front. Microbiol. 2018. https://doi.org/10.3389/fmicb.2017.02679
Keppen O.I., Tourova T.P., Kuznetsov B.B., Ivanovsky R.N., Gorlenko V.M. Proposal of Oscillochloridaceae fam. nov. on the basis of a phylogenetic analysis of the filamentous anoxygenic phototrophic bacteria, and emended description of Oscillochloris and Oscillochloris trichoides in comparison with further new isolates // Int. J. Syst. Evol. Microbiol. 2000. V. 50. № 4. P. 1529–1537.
Klappenbach J.A., Pierson B.K. Phylogenetic and physiological characterization of a filamentous anoxygenic photoautotrophic bacterium “Candidatus Chlorothrix halophila” gen. nov., sp. nov., recovered from hypersaline microbial mats // Arch. Microbiol. 2004. V. 181. P. 17–25.
Komárek J., Anagnostidis K. Cyanoprokaryota 1. Chroococcales. Jena-Stuttgart-Lübeck-Ulm: Gustav Fischer, 1998.
Komárek J., Anagnostidis K. Susswasserflora von Mitteleuropa. 19/2. Cyanoprokaryota. 2. Teil: Oscillatoriales / Eds. Büdel B., Gärtner G., Krienitz L., Schagerl M. Heidelberg: Elsevier, 2005. 759 p.
Komárek J. Cyanoprokaryota. 3. Heterocytous Genera. Berlin, Heidelberg: Springer Spektrum, 2013.
Madeira F., Park Y.M., Lee J. et al. The EMBL-EBI search and sequence analysis tools APIs in 2019 // Nucleic Acids Research. 2019. Jul; 47(W1): W636−W641. https://doi.org/10.1093/nar/gkz268
Namsaraev Z., Samylina O., Sukhacheva M., Borisenko G., Sorokin D., Tourova T. Effect of salinity on diazotrophic activity and microbial composition of phototrophic communities from Bitter-1 soda lake (Kulunda Steppe, Russia) // Extremophiles. 2018. V. 22. P. 651–663. https://doi.org/10.1007/s00792-018-1026-7
Pierson B.K., Valdez D., Larsen M., Morgan E., Mack E.E. Chloroflexus-like organisms from marine and hypersaline environments: distribution and diversity // Photosynth. Res. 1994. V. 41. № 1. P. 35–52.
Samylina O.S., Namsaraev Z.B., Grouzdev D.S., Slobodova N.V., Zelenev V.V., Borisenko G.V., Sorokin D.Y. The patterns of nitrogen fixation in haloalkaliphilic phototrophic communities of Kulunda Steppe soda lakes (Altai, Russia) // FEMS Microbiol Ecol. 2019. V. 95. № 11. pii: fiz174. https://doi.org/10.1093/femsec/fiz174
Sudhir Kumar, Glen Stecher, Koichiro Tamura. MEGA7: molecular evolutionary genetics analysis version 7.0 for bigger datasets // Molecular Biology and Evolution 33.7 (2016): 1870–1874
Tank M., Thiel V., Ward D.M., Bryant D.A. A panoply of phototrophs: An overview of the thermophilic chlorophototrophs of the microbial mats of alkaline siliceous hot springs in Yellowstone National Park, WY, USA // Modern Topics in the Phototrophic Prokaryotes / Ed. Hallenbeck P. Cham: Springer, 2017. P. 87–137. https://doi.org/10.1007/978-3-319-46261-5_3
Дополнительные материалы отсутствуют.


