Микробиология, 2020, T. 89, № 6, стр. 658-674
Прокариотные сообщества засоленных почв Приэльтонья в почвенной катене вдоль реки Хары
А. И. Кузнецова a, *, Е. А. Иванова b, О. С. Самылина a, Ф. Г. Курбанова c, Д. С. Груздев d, Т. А. Канапацкий a, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
117312 Москва, Россия
b Почвенный институт им. В.В. Докучаева
119017 Москва, Россия
c МГУ им. М.В. Ломоносова, факультет почвоведения
119991 Москва, Россия
d Центр Биоинженерии, ФИЦ Биотехнологии РАН
117312 Москва, Россия
* E-mail: kuznetsovasci@gmail.com
Поступила в редакцию 07.06.2020
После доработки 12.07.2020
Принята к публикации 17.07.2020
Аннотация
На примере почвенной катены вдоль реки Хары, впадающей в гиперсоленое озеро Эльтон, изучена таксономическая структура прокариотных микробных комплексов засоленных почв Приэльтонья, а также дана их сравнительная характеристика. Методом пиросеквенирования в почвенных образцах выявлено 11 бактериальных и 2 архейные филы. Сравнительный анализ структуры микробных сообществ выявил различия между пойменными солончаками и светло-каштановыми почвами на склоне и вершине речной террасы. Описаны закономерности распространения шести доминирующих фил (Euryarchaeota, Thaumarchaeota, Proteobacteria, Firmicutes, Bacteroidetes, Actinobacteria). Для образцов из пойменных почв установлена зависимость между распространением представителей фил Euryarchaeota, Thaumarchaeota, Firmicutes, Actinobacteria и Proteobacteria и степенью засоления, а также рН почвенной вытяжки. В образцах светло-каштановых почв обнаружено преобладание фил Actinobacteria и Firmicutes. Методом клонирования гена 16S рРНК выявлено большое разнообразие представителей рода Streptomyces (Actinobacteria). Многие выделенные клоны стрептомицетов были гомологичны известным продуцентам антибиотиков, что говорит перспективности почв Приэльтонья для дальнейшего биотехнологического скрининга.
Изучение микробного разнообразия почвенных сообществ засушливых и засоленных местообитаний вызывает особый интерес в связи с проблемами глобального изменения климата, а также в связи с оценкой биотехнологической ценности данных местообитаний. Глобальное изменение климата и возрастающая антропогенная нагрузка приводят к опустыниванию и увеличению доли засоленных почв в природных экосистемах по всему миру (Rengasamy, 2006). В настоящее время актуальным является изучение смены микробных сообществ в условиях аридного климата, а также выявление изменений в составе микробиомов, их экологических функциях и механизмах адаптации к изменению режимов засоления, ощелачивания, растительного покрова и других характеристик почв засушливых местообитаний. В дальнейшем такие данные могут быть использованы для изучения влияния глобальных климатических процессов на природные микробные экосистемы. К настоящему моменту известны единичные комплексные филогенетические исследования прокариотных микробных сообществ засоленных почв на территории Китая (Xie et a., 2017), США (Hollister et al., 2010), Пакистана (Mukhtar et al., 2017). Саудовской Аравии (Bibi et al., 2018) и Мексики (Navarro-Noya et al., 2015).
Район Приэльтонье – это уникальный природный объект, расположенный в Юго-Восточной части Восточно-Европейской равнины в Прикаспийской низменности (Волгоградская область, Россия). Озеро Эльтон является самым соленым озером в Европе и одним из самых больших гиперсоленых озер в мире. Его площадь составляет 155 км2, а соленость варьирует от 300 до 613 г/л (Argaman et al., 2012). Озеро расположено во впадине между крупными соляными куполами, развившимися вследствие процессов солянокупольной тектоники на севере Прикаспийской низменности. Оно находится на 15 м ниже уровня моря, тогда как самая высокая точка Приэльтонья, гора Улаган, располагается на 68 м выше уровня моря. В Эльтон впадают семь минерализованных рек: Хара, Ланцуг, Солянка, Чернавка, Большая и Малая Сморогда, Карантинка. Все реки, помимо М. Сморогды, являются мезогалинными (Kanapatskiy et al., 2018).
Почвенный покров Приэльтонья сформирован в условиях резко континентального засушливого климата с жарким летом (средняя температура июля 25°C) и умеренно холодной зимой (средняя температура января –11°C) и количеством осадков около 300 мм в год. Почвы данного района представлены типичными солончаками, солянкупольными структурами и солончаками автоморфными солончаковатыми со светло-каштановой солонцеватой солончаковатой почвой, при этом процент участия сопутствующей почвы составляет около 10–25% (Шишов, Панкова , 2006).
В районе Приэльтонья выражена постгидроморфная эволюция почв, когда от уреза воды озера к водораздельным участкам происходит рассолонцевание, рассоление и остепнение почв (Андреева и соавт., 2010). Таким образом, этот район представляет уникальную возможность проследить влияние естественной смены почв на изменение состава почвенных микробных сообществ.
Микробиологические исследования, проводимые в Приэльтонье, как правило, были посвящены водным экосистемам (Kanapatskiy et al., 2018). Единственным на данный момент исследованием микробного разнообразия почв этого района является работа Зеновой и соавт. (2016), в которой было установлено, что по мере удаления от озера и смены почв вдоль реки Хары увеличивается численность и разнообразие родов актиномицетов (Zenova et al., 2016). Таким образом, микробное разнообразие почв Приэльтонья до настоящего времени практически не изучено.
Целью данной работы стало описание филогенетического разнообразия прокариотных микробных сообществ почв, расположенных вдоль реки Хары (район Приэльтонья).
ОБЪЕКТЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования и отбор образцов
Объектами исследования стали почвы, расположенные вдоль реки Хары, впадающей в озеро Эльтон с севера (рис. 1а–1б, табл. 1). В августе 2013 г. было отобрано пять образцов по направлению от уреза воды к вершине речной террасы: H1, H2, H3, H4 и Н5 (рис. 1в–1д). Площадь станций для отбора почв составила 100 × 100 см для каждой точки пробоотбора. Почвенные пробы для молекулярных анализов были отобраны из верхнего слоя почвы на глубине 10 см от почвенной поверхности. Если почвенные образцы были покрыты соляной коркой, то отбор почв производился после удаления корки с поверхности. Все почвенные образцы были отобраны в стерильные емкости с хладагентами и перевезены в лабораторию, где хранились при температуре –20°C до выделения ДНК.
Рис. 1.
Район исследований и расположение станций отбора образцов: (а) географическое положение оз. Эльтон, (б) схема оз. Эльтон и впадающих в него рек (красной стрелкой отмечен район работ); (в–г) расположение почвенных разрезов (П1, П5, П9) и станций отбора почвенных образцов (H1-H5) (Yandex-карты); (д) схема катены реки Хары и расположенных вдоль нее станций Н1−Н5 (стрелка указывает направление течения реки).
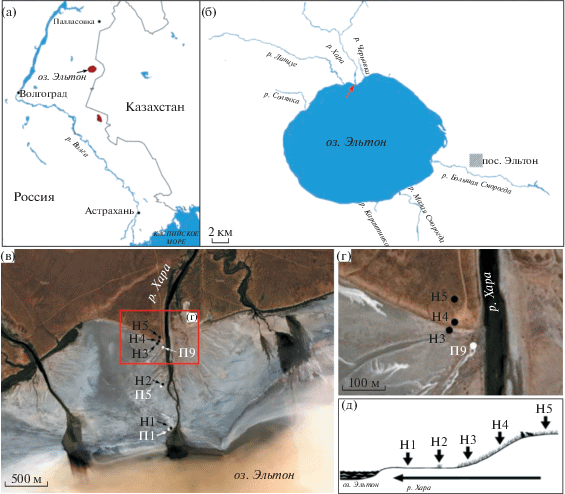
Таблица 1.
Характеристика почв Приэльтонья
| Образец | П1 = Н1 | П5 = Н2 | П9 | Н3 | Н4 | Н5 |
|---|---|---|---|---|---|---|
| Расположение в катене | Пойма у уреза воды | Пойма | Подножие склона | Склон | Вершина склона | |
| Соляная корка | Есть | Есть | Есть (с включением песка) | Отсутствует | Отсутствует | |
| Растительность | Отсутствует | Начало разрастаний солянковой растительности | Солянковая растительность | Полынно-солянковая растительность | Разнотравье на вершине склона | |
| Содержание солей (TDS, г/л) | 4.5 | 1.2 | 6.6 | Измерения не проводились | ||
| Кислотность почвы, рН | 6.3 | 7.8 | 6.4 | |||
Поскольку пойменные почвы подвержены наибольшему изменению за счет процессов осушения и затопления, то для их описания были заложены почвенные разрезы П1, П5 и П9 (подробное описание приведено в Приложении), соответствующие точкам Н1, Н2 и Н3, и определены физико-химические свойства верхних горизонтов почв (рис. 1). Для определения типов почв П1, П5 и П9 была использована как Международная классификация WRB (IUSS Working Group WRB, 2014), так и Классификация почв России 2008 (Полевой определитель…, 2008). Характеристика более стабильных почв, соответствующих точкам Н4 и Н5 приведена по литературным данным (Почвы Приэльтонья (Аверьянов, Сохина, неопубл.)).
Для исследования солевого состава верхнего 10 см горизонта почв был проведен анализ водной вытяжки (1 : 5), где были определены значения рН и TDS (Total Dissolved Solids) для образцов П1, П5 и П9. Измерения проводилось на стационарных приборах “Эксперт-pH” и “Mettler Toledo Seveneasy” соответственно.
Выделение, амплификация и пиросеквенирование ДНК из почв
ДНК экстрагировали из 0.2 г почвы при помощи PowerSoil DNA Isolation Kit (Mobio Laboratories, Solana Beach, CA, USA). Гомогенизацию образцов проводили на приборе Precellys 24 (Bertin Technologies, France). Степень очистки и качество выделенной ДНК тестировали при помощи электрофореза в 0.5× TAE буфере на 1% агарозном геле.
При конструировании и секвенировании ампликонных библиотек очищенный препарат ДНК (по 10–15 нг) использовался в качестве матрицы в реакции ПЦР (температурный профиль: 95°С – 30 с, 50°С – 30 с, 72°С – 30 с; всего 30 циклов) с добавлением полимеразы Encyclo (“Евроген”, Россия) и универсальных праймеров к вариабельному участку V4 гена 16S рРНК – F515 (GTGCCAGCMGCCGCGGTAA) и R806 (GGACTA CVSGGGTATCTAAT) (Bates et al., 2010). Кроме того, в праймеры вводили олигонуклеотидные идентификаторы для каждой пробы (20 идентификаторов) и служебные последовательности, необходимые для пиросеквенирования по протоколу фирмы “Roche” (Швейцария). Подготовку проб и секвенирование выполняли на приборе GS Junior (“Roche”, Швейцария) согласно рекомендациям производителя.
Обработка данных пиросеквенрования
Необработанные последовательности (raw sequences) были проанализированы с помощью QIIME ver. 1.9.0 (www.qiime.org). Для снижения ошибок мультиплексные считывания были сначала отфильтрованы по качеству и сгруппированы в соответствии со штрих-кодовыми последовательностями. Последовательности менее 200 пар оснований и уровнем качества ниже 25, а также те, которые содержали некорректные идентификаторы (barcodes), праймеры, неоднозначные символы или гомополимерную длину, равную или превышающую 8 пар оснований, были исключены из дальнейшего анализа. Последовательности, не принадлежащие прокариотам, а также химерные последовательности и синглетоны были также удалены из исследуемого массива данных.
Дальнейшие шаги включали объединение последовательностей в операционные таксономические единицы (ОТЕ) с 97%-ным порогом сходства с использованием алгоритма uclust с выбором репрезентативных последовательностей по алгоритму “most_abundant”. Выравнивание нуклеотидных последовательностей производили согласно алгоритму PyNast, далее осуществляли построение матрицы генетических расстояний. Для проведения всех вышеперечисленных оценок проводили процедуру нормализации числа последовательностей в выборке по минимальному образцу. Классификацию последовательностей осуществляли с использованием банка данных RDP (Ribosomal Database Project), доступного на сайте http://rdp.cme.msu.edu/. Сравнительный анализ микробных сообществ почвенных образцов и таксономическую идентификацию нуклеотидных последовательностей проводили с использованием программного пакета QIIME 1.9.0. Все последовательности были депонированы на сервере NCBI Sequencing Read Archive (SRA) (http:// trace.ncbi.nlm.nih.gov/Traces/sra/) с присвоением идентификатора (BioProject ID) PRJNA315964.
Для сравнения микробных сообществ были проведены оценки альфа- и бета-разнообразия. Анализ альфа-разнообразия включал в себя вычисление индексов: Шеннона (H = – ∑pi ln pi, где pi – доля i-го вида в сообществе), филогенетического разнообразия (индекса Фейта, определяемого как сумма длин ветвей филогенетического древа, соединяющих все виды в сообществе) и Чао1 (Chao1 = Sobs + a/b, где Sobs – число обнаруженных ОТЕ, a – число ОТЕ, содержащих 1 сиквенс, b – число ОТЕ, содержащих 2 сиквенса). Для оценки бета-разнообразия для расчета “расстояния” между любыми парами прокариотных сообществ использовали метрику “взвешенного” (weighted) UniFrac (Lozupone et al., 2011). Результаты представлены в виде кластерного анализа с бутстрэп-поддержкой для подтверждения точности ветвления. Все оценки были измерены для нормализованных данных (нормализация проводилась до наименьшего числа последовательностей, присутствующих в анализируемом массиве данных). Анализ зависимости между таксономическим разнообразием и химическими свойствами почв для образцов Н1, Н2 и Н3 был сделан на основе линейной корреляции Пирсона в программном пакете StatPlus.
Амплификация, клонирование и секвенирование генов 16S рРНК стрептомицетов
Анализ разнообразия стрептомицетов проводили в образце почвы Н4. Тотальная ДНК была экстрагирована из образца, согласно раннее описанной процедуре (Boulygina et al., 2001). Препарат тотальной ДНК использовали для ПЦР со стрептомицетно-специфичными 16S pPHK праймерами StrepB (ACAAGCCCTGGAAACGGGGT) и StrepF (ACGTGTGCAGCCCAAGACA) (Rintala et al., 2001). Препарат тотальной ДНК использовали для ПЦР со стрептомицетно-специфичными 16S pPHK праймерами StrepB (ACAAGCCCTGGAAACGGGGT) и StrepF (ACGTGTGCAGCCCAAGACA) (Rintala et al., 2001). Температурный профиль ПЦР состоял из следующих циклов: 98°C – 5 мин, 95°C – 40 с – 30 циклов, 58°C – 40 с, 72°C – 2 мин, 72°C – 10 мин. Реакция проводилась согласно раннее описанному протоколу для данных праймеров (Rintala et al., 2001). Полученные ПЦР фрагменты были очищены при помощи электрофореза в 0.7% агарозном геле с использованием Wizard SV Gel and PCR Clean-Up System (Promega, USA) и далее клонированы при помощи pGEM-T Easy Vector System I (Promega, USA). Вектор pGEM-T, лигированный с ПЦР фрагментами, был использован для трансформации Escherichia coli DH10B методом электропорации. Определение нуклеотидных последовательностей клоновых вставок было проведено с праймера StrepB секвенированием по методу Сэнгера с использованием набора реактивов BigDye Terminator v3.1 Cycle Sequencing Kit в ABI3730 DNA Analyzer (Applied Biosystems, USA).
Из библиотеки ПЦР фрагментов 16S рРНК было получено 96 клонов стрептомицетов. Полученные последовательности были отредактированы в программном пакете BioEdit (Hall et al., 1999) и проверены на химеры с помощью сервиса Bellerophon (Huber et al. 2014). Первичный сравнительный анализ полученных последовательностей проводили с помощью on-line сервиса NCBI BLAST (http://www.ncbi.nlm.nih.gov/blast). После отделения коротких, неспецифичных и химерных сиквенсов осталось 63 клона стрептомицетов, которые были использованы в дальнейшем анализе. Длина полученных последовательностей составила >600 пар оснований. Филогенетические реконструкции проводили с использованием MEGA 5.0 (Tamura et al., 2011). Последовательности клонирования были депонированы в GenBank под номерами присоединения KU951599- KU951661.
РЕЗУЛЬТАТЫ
Характеристика почв в районе исследований
Показано, что при движении вдоль реки Хары от озера к склону происходила смена почв в следующем порядке (рис. 1, табл 1): 1) образцы (П1, Н1) (46°39′52′′ N, 46°39′52′′ Е), солончаки сульфидные (Полевой определитель…, 2008) или Fluvic Solonchak Clayic Evapocrustic Sulfidic (Классификация WRB IUSS, 2014) 2) образцы (П5, Н2) (49°12′13′′ N, 46°39′46′′ E), солончаки сульфидно-глеевые (Полевой определитель…, 2008) или Fluvic Gleyic Solonchak Clayic Evapocrustic Sulfidic (Классификация WRB IUSS, 2014); 3) образцы (П9, Н3) (49°12′26′′ N, 46°39′47′′ E) солончаки глеевые (Полевой определитель…, 2008) или Fluvic Gleyic Solonchak Clayic Evapocrustic (Классификация WRB IUSS, 2014); 4) образцы Н4 (49°12′28′′ N, 46°39′45′′ E) и Н5 (49°12′30′′ N, 46°39′45′′ E) светло-каштановые почвы (Полевой определитель…, 2008) или Gleyic Kastanozem (Классификация WRB IUSS, 2014).
В почвенном разрезе П1, который был заложен в пойме в 100 м от уреза воды озера, сформировался солончак сульфидный. Вся поверхность почвы была покрыта солевой коркой белесого цвета, образующей сплошной покров. Растительность отсутствовала. Ниже залегал сырой, черный, бесструктурный с редкими включениями растительных остатков и запахом сероводорода горизонт, из которого был отобран образцы образец Н1. Почвенный разрез П5 (солончак сульфидно-глеевый) располагался в 100 м выше по течению реки от разреза П1. Поверхность этого участка также была покрыта сплошной солевой коркой. Высшая растительность над разрезом отсутствовала, однако, для этой части катены было характерно появление местами солянковой растительности. Под солевой коркой залегал горизонт, представленный мокрым, рыхлым, черно-серым, заиленным суглинком с остатками полуразложившейся растительности. Из этого горизонта был отобран образец Н2. Почвенный разрез П9 был заложен у подножия склона в 200 м от места впадения реки Хары в озеро Эльтон и представлял собой солончак глеевый. Солевая корка с включениями песчанистого материала образовывала сплошной покров белесого цвета. Нижележащий рыхлый бесструктурный горизонт, из которого был отобран образец Н3, по гранулометрическому составу был представлен средним суглинком и характеризовался неоднородной окраской: на фоне сизовато-белесой почвенной массы встречались черные и ржавые пятна. Для этой части катены была характерна разреженная солянковая растительность. Полные описания почвенных профилей П1, П5 и П9 приведены в сопроводительных материалах к статье (рис. S1–S3 ). Образцы Н4 и Н5 были отобраны со склона и вершины речной террасы, соответственно, где почвы были светло-каштановыми с хлоридным или хлоридно-сульфатным засолением (Почвы Приэльтонья (Аверьянов, Сохина, неопубл.)). Для почв этих точек было характерно снижение степени увлажнения и улучшение дренажных свойств. Солевые корки отсутствовали, а солянковая растительность сменялась на полынно-солянковую на склоне и разнотравье на вершине склона.
Характеристика разнообразия микробных сообществ почв по результатам пиросеквенирования гена 16S рРНК
В результате исследования было получено 8558 прокариотных последовательностей гена 16S рРНК. Для каждого образца почвы количество последовательностей изменялось от 1454 до 2214. Количество филотипов (ОТЕ) в образцах варьировало от 117 до 276. Базируясь на полученных данных, была рассчитана оценка покрытия (С) для каждого образца, которая колебалась в пределах от 89.1 до 98.2%. Такое значение оценки покрытия указывает на то, что величина выборки была достаточной для покрытия почвенного микробного разнообразия (табл. 2). Показатель Chao 1 имел значения от 120.918 до 294.14.
Таблица 2.
Основные показатели биоразнообразия для почвенных образцов, отобранных в катене реки Хары
| Номер образца | Индекс Фейта | Количество ОТЕ | Chao 1 | С, % | Индекс Шеннона |
|---|---|---|---|---|---|
| H1 | 13.763 | 117 | 120.918 | 96.3 | 4.460 |
| H2 | 22.053 | 234 | 241.198 | 89.1 | 6.626 |
| H3 | 13.696 | 131 | 148.491 | 96.2 | 4.891 |
| H4 | 22.764 | 276 | 294.140 | 89.7 | 7.068 |
| H5 | 13.353 | 141 | 169.920 | 98.2 | 4.738 |
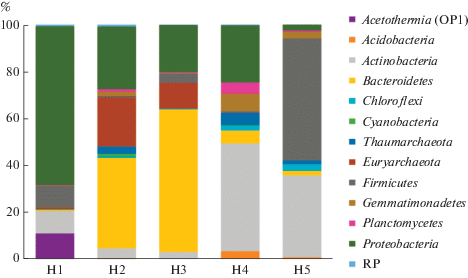
В общей сложности в почвенных образцах было выделено 11 бактериальных и 2 архейные филы (рис. 2). Филогенетический анализ показал, что в прокариотных сообществах почвенных образцов вдоль катены реки Хары археи были представлены филами Euryarchaeota (6.3%) и Thaumarchaeota (1.9%), а бактерии – филами Proteobacteria (27.8%), Bacteroidetes (21.0%), Actinobacteria (19.2%), Firmicutes (13.2%), Gemmatimonadetes (2.4%), Acidobacteria (0.9%), Candidate phylum Acetothermia (OP1) (2.2%), Chloroflexi (1.2%), Planctomycetes (1.3%), Verrucomicrobia (0.5%), Cyanobacteria (0.3%). Tакже в образцах почв присутствовали неидентифицированные бактерии (N/A) 1.4% и редкие филы (RP) 0.2%.
Рис. 2.
Таксономическая структура микробиомов почв вдоль реки Хары на уровне прокариотных фил для каждого образца. (RP (“Rare Phyla”) включают в себя филы, которые составляли менее 1% от общего числа прокариотных сиквенсов).
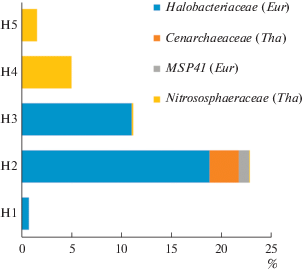
Основываясь на полученных данных мы дали подробное описание двух архейных (Euryarchaeota и Thaumarchaeota) и четырех бактериальных фил (Proteobacteria, Firmicutes, Bacteroidetes, Actinobacteria), суммарная доля которых в исследованных образцах почв составляла около 89.5.
В образце солончака сульфидного (Н1), отобранного у кромки озера под соляной коркой, археи составляли 0.8% от всех прокариот и были представлены филумом Euryarchaeota, главным образом семейством Halobacteriaceae (риc. 2, 3). В этом образце преобладали представители филума Proteobacteria (66.9%) (рис. 4). Среди них доминировали представители семейства Sphingomonadaceae (3.3%), Enterobacteriaceae (56.8%), Pseudomonadaceae (29.1%). Также были обнаружены представители филума Firmicutes, среди которых доминировали представители семейств Planococcaceae (0.39%) и Gemellaceae (0.44%) (рис. 6). Доля филума Actinobacteria составляла 9.39% от общего бактериального разнообразия и была представлена в основном семействами Corynebacteriaceae (3.3%) и Micrococcaseae (1.6%) (рис. 7).
Рис. 4.
Таксономическая структура представителей филума Proteobacteria в образцах почв вдоль реки Хары на уровне семейств.
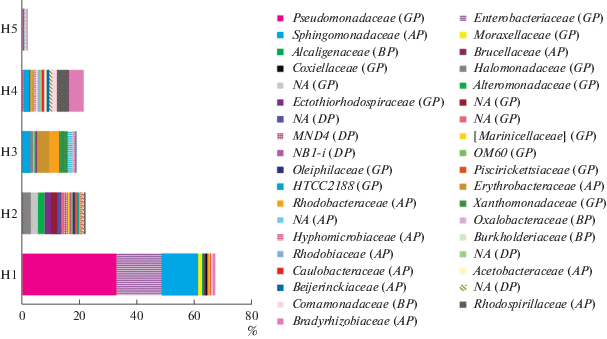
Рис. 5.
Таксономическая структура представителей филума Bacteroidetes в образцах почв вдоль реки Хары на уровне семейств.
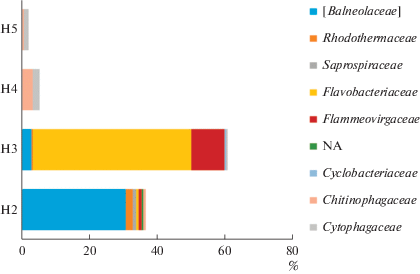
Рис. 6.
Таксономическая структура представителей филума Firmicutes в образцах почв вдоль реки Хары на уровне семейств.
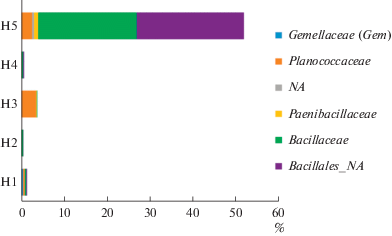
Рис. 7.
Таксономическая структура представителей филума Actinobacteria в образцах почв вдоль реки Хары на уровне семейств.
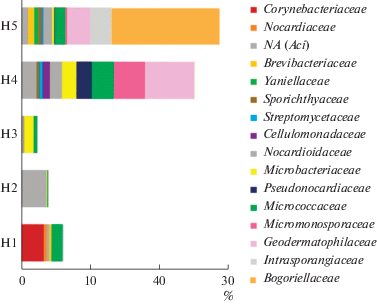
В образце солончака сульфидно-глеевого (Н2), отобранном в зоне первых разрастаний солянковой растительности, появились в значительном количестве археи, доля которых среди прокариот была максимальной и достигала 23%. Археи были представлены филами Euryarchaeota (19.9%) (семейства Halobacteriaceae (18.8%) и MSP41 (1.1%)) и Thaumarchaeota (2.7%) (семейство Cenarhaeaceae) (риc. 3). Доля филума Proteobacteria, напротив, значительно снизилась и составила 25.5% от общего микробного разнообразия. Этот филум был представлен семействами MND4 (1.1%), Alteromonadaceae (2.3%), Ectothiorhodospiraceae (2.2%), Piscirickettsiaceae (0.9%), Halomonadaceae (2.9%) (рис. 4). Кроме того, доминировали также представители филума Bacteroidetes (36.8%) и, в первую очередь семейство Balneolaceae (30%) (рис. 5). Доля представителей филума Firmicutes снизилась до 0.58%. Они были представлены, главным образом, бактериями семейства Bacillaceae (0.4%), а также неидентифицированными до уровня семейства представителями порядка Bacillales (0.1%) (рис. 6). Доля филотипов Actinobacteria в данном образце снизилась в два раза по сравнению с образцом Н1, и составила 4.1%. Актинобактерии были представлены в основном неидентифицированными до уровня семейства представителями порядка Acidimicrobiales (3.7%), а также семействами Micrococcaceae (0.1%) и Microbacteriaceae (0.1%) (рис. 7, 9).
Рис. 8.
Коровый и акцессорный компоненты прокаритоных комплексов почв реки Хары (на уровне филотипов).
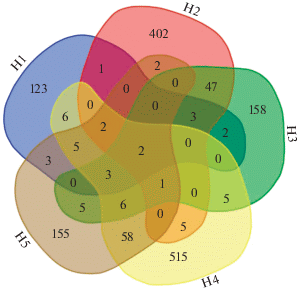
Рис. 9.
Структура микробиомов почв вдоль реки Хары на уровне семейств. Кластерный анализ выполнен на основании попарных дистанций, вычисленных с помощью алгоритма Брея-Кертиса. Приведены только те семейства, доля которых была более 1% хотя бы в одном из образцов. Дендрограмма построена на основании матрицы попарных дистанций между исследуемыми образцами, рассчитанной по методу “взвешенного” UniFraс, цифрами обозначена достоверность кластeризации (бутстреп-поддержка кластеров).
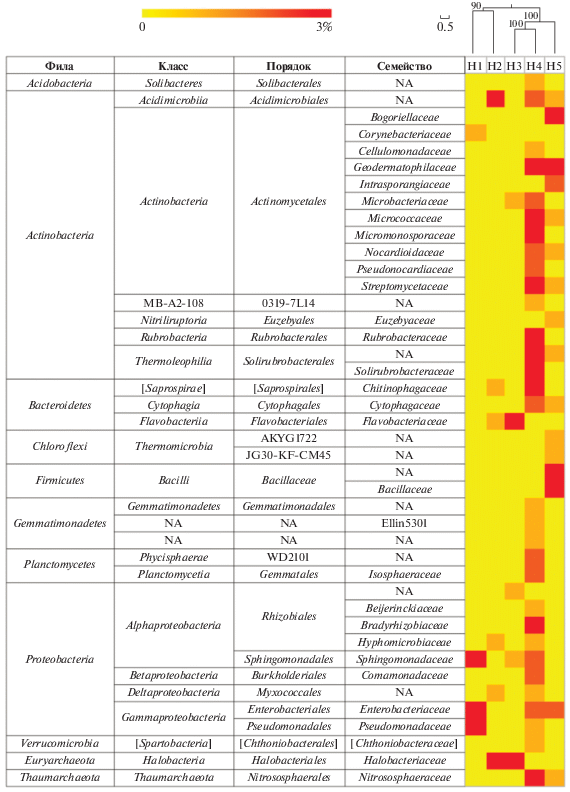
В образце солончака глеевого (Н3), отобранном у подножья склона, доля архей составляла 11.14% от всех прокариот, обнаруженных в данном образце. В данном образце произошла смена филогенетического разнообразиея архей. Так, доля филума Euryarchaeota составляла 11.04%, а филума Thaumarchaeota – 0.1%. При этом филум Thaumarchaeota был представлен семейством Nitrososphaeraceae (риc. 3). Доля филума Proteobacteria снизилась до 20.13% и была представлена семействами Sphingomonadaceae (1.4%), Rhodobacteriaceae (1.8%), Halomonadaceae (0.2%), Enterobacteriaceae (0.01%), Xantomonadaceae (2.9%) (рис. 4). Доля Bacteroidetes возрастала в образце Н3 в два раза по сравнению с образцом Н2 и составляла 60.46% (рис. 5). Данный филум был представлен семействами Flammeovirgaceae (9.7%), Cytophagaceae (0.28%) и Flavobacteriaceae (46.5%). Филум Firmicutes (3.9%) был представлен семействами Bacilliaceae (0.1%), Paenibacillaceae (0.1%), Planococcaceae (3.4%) (рис. 6). Доля Actinobacteria в данном образце была минимальной среди всех исследованных образцов и составляла 2.96%, при этом преобладали представители семейств Micrococcaceae (0.5%) и Microbacteriaceae (1.3%) (рис. 7).
В образце светло-каштановой почвы с хлоридным или хлоридно-сульфатным засолением (Н4), отобранном на склоне речной террасы под полынно-солянковой растительностью, археи, доля которых составляла 5.0% от всех прокариотов, были представлены только филумом Thaumarchaeota и семейством Nitrososphaeraceae (рис. 3). Доля филума Proteobacteria в данном образце возрастала по сравнению с образцом Н3 и достигала 23.8%. Филогенетическое разнообразие протеобактерий в данном образце значительно возрастало и было представлено следующими семействами: Beijerinkiaceae (1.0%), Bradiorhizobiaceae (5.1%), Hyphomicrobiaceae (1.0%), Sphingomonadaceae (2.1%), Comamonadaceae (2.2%), Enterobacteriaceae (2.1%), Pseudomonadaceae (1.1%), Rhodobacteriaceae (0.6%) (рис. 4). Доля филума Bacteroidetes резко снизилась до 5.4%, и данный филум был представлен семействами Chitinophagaceae (3.1%), Cytophagaceae (2.0%) (рис. 5). Доля филума Firmicutes составляла 0.69% и была представлена семействами Bacilliaceae (0.34%) и Planococcaceae (0.1%) а также неидентифицированными до уровня семейства бактериями порядка Bacillales (0.25%), (рис. 6). Доля Actinobacteria в образце Н4 была максимальной среди всех исследованных образцов и составляла 44.73%. В данном образце также существенно возрасла доля и разнообразие порядка Actinomycetales (рис. 7, 9, S7 ): наряду с типичными для других образцов семействами Micrococcaceae (3.2%) и Microbacteriaceae (4.1%), были выявлены семейства Geodermatophilaceae (6.2%), Streptomycetaceae (0.4%), Nocardioidaceae (2%), Pseudonocardiaceae (2%), Micromonosporaceae (4%), Cellulomonadaceae (1%). Также в данном образце в доминанты выходили актинобактерии сем. Rubrobacteraceae (5.7%) и пор. Solirubobacteriales (9.1%) (сем. Solirubrobacteriaceae и Conexibacteraceae) (рис. 7, 9).
В образце светло-каштановой почвы с хлоридным или хлоридно-сульфатным засолением (Н5), отобранном на вершине речной террасы под разнотравной полынно-солянковой растительностью археи, как и в образце Н4, были представлены только филумом Thaumarchaeota (1.6%) и семейством Nitrososphaeraceae (рис. 3). Доля филума Proteobacteria резко снизилась и составила 2.64%. Протеобактерии были представлены семействами Enterobacteriaceae (0.2%), Rhodobiaceae (0.2%), Comamonadaceae (0.4%), доля остальных семейств протеобактерий не превышала 0.1% (рис. 4). Доля филума Bacteroidetes в данном образце составляла 1.6%, бактероидеты были представлены семействами Chitinophagaceae (0.3%), Cytophagaceae (1.3%) (рис. 5). Доля филума Firmicutes (51.74%), напротив, резко возрoсла и достигла максимального значения по сравнению со всеми исследованными образцами. Фирмикуты были представлены семействами Baceilliaceae (22.9%), Paenibacelaceae (1.0%), Planococcaceae (2.5%), а также неидентифицированными представителями пор. Bacillales (24.9%) (рис. 6). Доля Actinobacteria несколько снизилась (до 34.56%) по сравнению с образцом Н4. По своему таксономическому разнообразию актинобактерии в данном образце были сходны с образцом Н4, но в образце Н5 появились семейства Brevibacteriaceae (1.0%), Yaniellaceae (0.6%) (рис. 7).
Таким образом, по мере удаления от озера прослеживается смена почв и связанная с этим смена микробных сообществ. Если в пойменных образцах почв доминировали такие архейные филы как Euryarchaeota и Thaumarchaeota и бактериальные филы Proteobacteria и Bacteroidetes, то при смене почв на склоне и вершине речной террасы полностью исчезли представители филума Euryarchaeota, снизилась доля Proteobacteria и Bacteroidetes и возрасла численность филума Firmicutes.
Экологическая характеристика микробных сообществ почв вдоль реки Хары
Выявление стабильных и уникальных микробных таксонов в исследуемых образцах почвы проводилось посредством изучения “корового” микробиома (Shade, Handelsman, 2012). Данный анализ показывает, что количество филотипов для исследованных образцов составило 1509 (рис. 8). Наибольшей долей общих ОТЕ отличались образцы почв H2 и H3 (47 филотипов) и H4 и H5 (58 филотипов). В коровом микробиоме присутствовали филотипы, относящиеся к актинобактериям семейства Microbacteriaceae и бактериям рода Bacillus. При этом доля общих ОТЕ, присутствующих во всех образцах изучаемой почвенной катены, не превышала 1%. Таким образом, микробное сообщество каждой исследуемой почвы являлось уникальным.
Кластерный анализ показал, насколько почвенные микробные сообщества отличаются друг от друга (рис. 9). Установлено, что микробиомы почв, отобранных под номерами Н1 и Н2 отличаются от остальных исследуемых образцов. Образцы Н3, Н4 и Н5 формируют отдельный кластер, причем, образцы Н3 и Н4 расположены ближе друг к другу, нежели образец Н5. Такие различия могут быть связаны с почвенными условиями в местах отбора проб. Величины бутстрэп-поддержки свидетельствуют как о высокой степени достоверности (90% и более) выявленных кластеров, так и об уникальности исследуемых биотопов.
Наименьшим уровнем биоразнообразия отличались образцы H1 и H3. В образце H1 количество филотипов достигало 117, а в образце H3 – 131 ОТЕ (табл. 2). Наибольшим видовым богатством обладали образец Н2, отобранный в первых разрастаниях солянковой растительности, и образец Н4, взятый на склоне под луговой растительностью (рис. S5 ). Количество филотипов в данных образцах составляло 216 и 249 соответственно.
Такая разница может объясняться тем, что в образцах H1 и Н3 содержание солей было выше, чем образце Н2 (4.5, 6.6 и 1.2 г/л соответственно). Высокое содержание солей в образце Н3, отобранном у подножья речной террасы, может являться следствием как аккумуляции солей в результате разлива озера, так и накоплением солей в результате их смыва с вершины террасы в ходе эрозионных процессов на склоне. Проведенный анализ разнообразия доминирующих в сообществе прокариотных фил выявил наибольшее разнообразие протеобактерий и бактероидет в образцах H2 и H4 (рис. S4 ); актинобактерий – главным образом в образце H4 и несколько меньше в H5. В образцах H1 и H5 отмечалось наибольшее разнообразие фирмикут, при этом в почве H5 отмечалось сравнительное увеличение доли близкородственных филотипов.
В дополнение к популяционным исследованиям мы провели анализ зависимости между таксономическим разнообразием и химическими свойствами почв для образцов Н1, Н2 и Н3. В ходе исследования была выявлена статистически значимая отрицательная корреляция между соленостью для Euryarchaeota (–0.81) и Actinobacteria (–0.99), а также положительная корреляция с соленостью у Firmicutes (0.88). В отношении кислотности среды зависимость была обратной: была выявлена положительная корреляция для Actinobacteria (0.91), Euryarchaeota (0.97) и Thaumarchaeota (0.93), и отрицательная (–0.99) для Firmicutes (рис. S6 ).
Известно, что бактерии филы Euryarchaeota относятся к галотолерантам и галофилам, и могут существовать при концентрации солей, близкой к выпадению в осадок NaCl (Mwirichia et al., 2010). При этом, есть исследования, демонстрирующие преимущественное выделение данной группы прокариот из содовых озер со знaчениями рН, достигающими значения в десять единиц. Последнее указывает на то, что для данной группы более существенным является наличие катионов, а частности, ионов Na+ (присутствующих в почвенном поглощающем комплексе солончаков), нежели концентрация солей (León-Lorenzana, 2017). Кроме того, многочисленные исследования подтверждают тот факт, что уровень засоления почв и кислотность среды являются основными направляющими факторами для формирования специфических микробных сообществ с доминированием представителей филумов Actinobacteria, Firmicutes (Звягинцев, Зенова, 2007; Zhang et al., 2019), а также данные показатели влияют на распрострaнение некоторых видов филума Thaumarchaeota (Navarro-Noya et al., 2015).
Таким образом, показаны не только таксономические различия между исследованными образцами, но и выявлены некоторые закономерности по распределению доминирующих фил в зависимости от уровней солености и кислотности водных вытяжек пойменных почв.
Филогенетическая характеристика представителей семейства Streptomycetaceae в светло-каштановой почве на склоне речной террасы
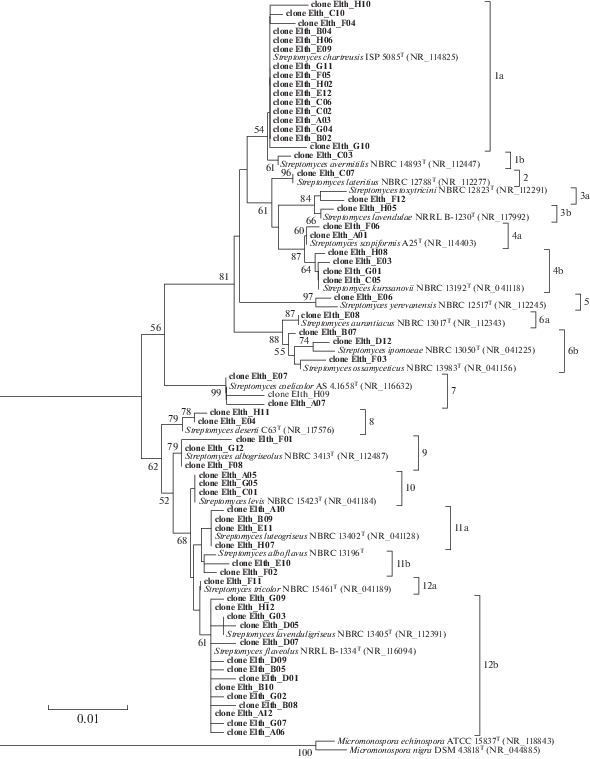
Представители филума Actinobacteria были обнаружены во всех исследованных почвенных образцах, отобранных вдоль реки Хары, но количественно преобладали в образцах светло-каштановых почв с хлоридным или хлоридно-сульфатным засолением Н4 и Н5 (рис. 2). Согласно молекулярным данным, доля представителей семейства Streptomycetaceae в этих образцах достигала 3.5 и 1% соответственно (здесь приведены доли каждого семейства в % от количества последовательностей доминирующего порядка актинобактерий в образцах Н4 и Н5 – Actinomycetales, составляющего 52.5 и 80% соответственно) (рис. S7 ). Таким образом, в целом, согласно полученным данным, в исследуемой почвенной катене доля бактерий данного семейства составляла 0.1%. Столь заниженные результаты могут быть объяснены методическими особенностями исследования данной группы микроорганизмов. В частности, известно, что метагеномные исследования могут не выявлять полное филогенетическое разнообразие актинобактерий в почвах (Schwientek et al., 2011). Одной из причин является использование универсальных праймеров, которые могут проявлять недостаточное сродство к ДНК с высоким содержанием ГЦ-пар, что типично для актинобактерий, в частности, для стрептомицетов. Вместе с тем разнообразие мицелиальных актинобактерий (в частности представителей семейства Streptomycetaceae) является важнейшей особенностью сообществ светло-каштановых почв (Н4 и Н5). Так, по результатам пиросеквенирования гена 16S рРНК в образцах Н4 и Н5 выявлено всего 5 и 4 ОТЕ, принадлежащих семейству Streptomicetaceae, соответственно. Все они принадлежали роду Streptomyces. Поэтому методом клонирования фрагментов гена 16S рРНК с использованием праймерных пар, специфичных к стрептомицетам, мы провели более полную оценку разнообразия представителей рода Streptomyces. Для исследования был выбран образец Н4 с наибольшей их долей среди всех исследованных образцов (рис. 7). В результате анализа получено 63 клона, которые были разделены на 18 кластеров в соответствии с ближайшими типовыми штаммами различных видов рода Streptomyces (рис. 10). Среди клонов преобладали последовательности, близкие к Streptomyces chartreusis ISP 5085T (группа 1а) и Streptomyces flaveolus NRRL B-1334T (группа 12b). Часть последовательностей принадлежит стрептомицетам, выделенным из различных почв, включая засушливые (группы 1а, 3b, 8).
Рис. 10.
Филогенетическое дерево, построенное на основе сравнительного анализа последовательностей генов 16S рРНК клонов стрептомицетов, полученных из почвенного образца Н4 (выделены жирным шрифтом), и последовательностей ближайших культивируемых представителей. Дерево построено с использованием алгоритма neighbor-joining. Шкала указывает на эволюционную дистанцию, соответствующую 1 замене на 100 нуклеотидов. Последовательности видов рода Micromonospora были использованы в качестве корня дерева. Цифры показывают точность ветвей, определенную по методу bootstrap analysis 1000 замен (показаны значения превышающие 50).
ОБСУЖДЕНИЕ
Уникальное геоморфологическое строение района Приэльтонья позволяет произвести анализ микробных сообществ различных почв в рамках одного природного объекта. Почвы района дифференцированы по высотным ярусам приозерных террас и образуют закономерную смену (катену) зональных и азональных почв. В направлении от вершины склона до кромки озера наблюдается замена кальция натрием в почвенном поглощающем комплексе, что свидетельствует о наличии процесса осолонцевания. Соровые солончаки, опоясывающие озеро, сменяются на луговые солончаки, расположенные на вершине приозерных террас (Почвы Приэльтонья… (Аверьянов, Сохина, неопубл.)). В данном исследовании была охарактеризована смена прокариотных микробных сообществ почв Приэльтонья по катене вдоль реки Хары.
На промежутке от озера до вершины речной террасы сменялись как типы почв, так и растительность, значения солености и pH. Микробные сообщества каждой почвы оказались уникальными по своему составу. Для пойменных почв установлено, что представители филума Proteobacteria в большей степени были представлены в почвах с повышенной соленостью, варьирующей от 1.2 до 6.6 г/л, и слабощелочной реакцией среды (рН варьирует от 6.3 до 7.8). Представители филумов Thaumarchaeota, Firmicutes и Actinobacteria были приурочены к светло-каштановым почвам, расположенным на речной террасе .Такие закономерности широко известны в современной литературе и наблюдались и в почвах других местообитаний. Так, аналогичная нашему исследованию зависимость представителей филума Actinobacteria от уровня щелочности почв была установлена при анализе образцов, отобранных в Северной и Южной Америках (Lauber et al., 2009), в почвах вдоль гиперсоленого озера Эбинур (Китай) (Zhao et al., 2018), а также в различных типах почв, расположенных на территории России и Монголии (Звягинцев, Зенова, 2007). В засоленных почвах у озера Ла Сал Дель Рэй (США) доминирующими таксонами были представители филумов Proteobacteria, Bacteroidetes и Firmicutes (Hollister et al, 2010), что также коррелирует с нашими исследованиями. Филотипы рода Bacillus (Firmicutes) относятся к спорообразующим, и, тем самым, легко переживают небагоприятные условия, такие, как повышенная концентрация солей в почве, иссушение, инсоляция, и т.д. (van Djil, Hecker, 2013). Также известно, что данные бактерии участвуют на первых этапах разложения органического материала, формируемого, к примеру, из биомассы микроорганизмов, отмирающих в результате неблагоприятных условий окружающей среды (Hu et al., 2015).
Величина индекса Фейта показывает, что наибольшим биоразнообразием обладали образцы почв, отобранные в первых разрастаниях солянковой растительности и на склоне речной террасы. В данных образцах доминировали представители фил Proteobacteria и Bacteroidetes. Представители филума Actinobacteria были приурочены, в основном, к образцам светло-каштановой почвы на склоне и на вершине речной террасы, где также были отмечены значительные разрастания полынно-солянковой растительности. Молекулярные исследования бактерий симбионтов галофильной солянки (Salsola stocksii), отобранной в соляной выработке Кева (Пакистан), установили доминирование в почвах, ассоциированных с корневой системой растений, представителей фил Proteobacteria и Actinobacteria. Также были выделены представители фил Firmicutes, Acidobacteria, Bacteroidetes, Planctomycetes, Euryarchaeota и других (Mukhtar et al., 2017). Аналогичные данные по микробному разнообразию почв под солянковой растительностью были получены на примере прибрежных почв, отобранных в городе Джедда (Саудовская Аравия) (Bibi et al., 2018). Таким образом, полученные нами данные по микробному разнообразию почв, отобранных под солянковой растительностью в районе Приэльтонья, соответствуют данным, показанным для солянковой растительности в других точках земного шара.
Основными трендами вдоль почвенной катены было снижение численности представителей фил Proteobacteria и Euryarchaeota от озера к вершине речной террасы. Репрезентативность фил Bacteroidetes, Actinobacteria, Firmicutes и Thaumarchaeota, наоборот, увеличивалась в аналогичном направлении. Более детальный анализ микробных сообществ почв показал различия не только на уровне фил, но и на уровне семейств.
Филум Euryarchaeota был обнаружен только в пойменных образцах почв. Его максимальная доля приходилась на образец солончака сульфидно-глеевого, а минимальная на образец солончака сульфидного. В пойменных образцах филум Euryarchaeota был представлен семействами Halobacteriaceae, которые являются типичными представителями засоленных почв (Xie et al., 2017). Представители филума Thaumarchaeota были обнаружены во всех образцах почв, кроме солончака сульфидного. В образце солончака сульфидно-глеевого данный филум представлен семейством Cenarhaeaceae, представители которого описаны также в засоленно-щелочных почвах осушенного озера Тескоко (Мехико) (Navarro-Noya et al., 2015).
Численность протеобактерий была максимальной в образце солончака сульфидного и постепенно снижалась по мере удаления от озера вдоль почвенной катены. Минимальная численность протеобактерий была выявлена на вершине речной террасы в образце светло-каштановой почвы. В пойменных образцах почв доминировали семейства Sphingomonadaceae, Enterobacteriaceae, Halomonadaceae, среди представителей данных семейств известны солеустойчивые виды (de la Haba et al., 2014; de Vries et al., 2019), а также известно, что они широко распространенны в засоленных почвах (Bilal et al., 1990).
Представители филума Firmicutes были обнаружены во всех исследованных образцах. Их максимальная доля в общем микробном сообществе почв была выявлена в образце светло-каштановой почвы на вершине речной террасы, тогда как минимальное количество – в образце солончака сульфидно-глеевого. Основными семействами, принадлежащими к данному филуму были Baceilliaceae, Paenibacelaceae, Planococcaceae. При изучении отклика почвенных микробных сообществ на внесение солей установлено, что распространение этих семейств положительно коррелирует как с увеличением засоленности почв, так и с появлением растительности (Szoboszlay et al., 2019).
Представители филума Bacteroidetes были обнаружены в четырех из пяти исследованных образцов. Исключением стал образец солончака сульфидного, отобранного у кромки озера. Разнообразие внутри филума на уровне семейств также увеличивалось по мере удаления от озера вдоль почвенной катены. Наименьшая доля представителей данного филума была обнаружена в образце солончака сульфидно-глеевого, а наибольшая в – солончаке глеевом. Кроме того, прослеживалась заметная смена микробных композиций при переходе от солончака глеевого к светло-каштановым почвам. Так, в образце солончака глеевого были обнаружены семейства Flammeovirgaceae, Chitinophagaceae и Flavobacteriaceae, а уже в светло-каштановых почвах преобладали семейства Chitinophagaceae, Cytophagaceae. Исследование влияния засухи на почвы вдоль реки Рейн в Нидерландах показало, что при иссушении почв преобладают семейства Flavobacteriaceae, Chitinophagaceae, Cytophagaceae (Meinser et al., 2018), что соответствует засушливым условиям светло-каштановых почв Приэльтонья. Аналогичные закономерности были обнаружены в почвах вдоль озера О’Коннор в Западной Австралии (Rath et al., 2019).
Представители филума Actinobacteria были обнаружены во всех исследованных образцах. Наименьшая численность актинобактерий была выявлена в образце солончака глеевого, а наибольшая в образцах светло-каштановой почвы. В пойменных образцах филогенетическое разнообразие актинобактерий было невысоким. В основном, доминировали семейства Corynebacteriaceae, Micrococcaseae, Microbacteriaceae. Однако уже в образце светло-каштановой почвы на склоне речной террасы помимо указанных семейств было выявлено значительное разнообразие мицелиальных и немицелиальных представителей филума Actinobacteria. На примере озера Акколь (Казахстан) показано, что таксономическое разнообразие на менее засоленных участках несколько выше, чем на более засоленных. При переходе от солончака лугового к каштановой почве с появлением степной растительности происходит закономерная смена в составе микробного сообщества, в котором начинают доминировать типичные почвенные представители филы Actinobacteria (Першина и соавт., 2012).
Закономерности смены микробных сообществ в почвенной катене вдоль реки Хары соответствуют описанным в литературе. Доминирование Gammaproteobacteria, Actinobacteria, Firmicutes, Alphaproteobacteria, Bacteroidetes и Betaproteobacteria было установлено в почвах у соленого озера Эбинур (Китай) (Zhao et al., 2018). В почвах, прилегающих к озеру Кархан (самому большому соленому озеру Китая) была выявлена закономерность изменения микробных сообществ в зависимости от градиента солености, и показано, что влияние засоления на микробные сообщества выше в засоленных почвах, чем в засоленных водах или озерных осадках (Xie et al., 2017).
Исследование микробных сообществ засоленных почв также перспективно с точки зрения поиска и целенаправленного выделения новых продуцентов антибиотиков, ферментов, биопластика, биотоплива и т.п. Особый интерес представляют актиномицеты рода Streptomyces, которые, помимо антибиотиков, являются продуцентами веществ с противовирусными, противопухолевыми, противогрибковыми и другими свойствами (Newman et al., 2007). Для того, чтобы использовать почвы для целенаправленного поиска стрептомицетов – продуцентов биологически активных веществ необходимо дать характеристику стрептомицетных комплексов тех или иных почв, как с использованием классических культуральных методов, так и праймерных пар, специфичных к стрептомицетам.
Ранее для исследованных нами почв была определена численность и структура актиномицетных комплексов, описанная традиционными методами посева на плотные питательные среды (Zenova et al., 2016). Было установлено, что во всех образцах в катене вдоль реки Хары доминировали культивируемые представители родов Streptomyces и Micromonospora. Численность мицелиальных бактерий, установленная культуральными методами, варьировала в пределах от 1 × 103 до 1 × 104 КОЕ/г почвы. В результате нашего исследования в образце светло-каштановой почвы было выявлено значительное разнообразие стрептомицетов. Часть из выявленных клонов оказалась гомологична уже известным продуцентам антибиотиков. Например, наиболее многочисленная группа клонов 1а гомологична Streptomyces chartreusis, выделеному из почв Африки (Leach et al., 1953) и описанному как продуцент противоопухолевого антибиотика чартреусина. Группы 1b и 6b гомологичны продуцентам авермектина и осамицина S. avermitilis и S. оssamyceticus, соответственно (коллекция NBRC https://www.nite.go.jp/). Таким образом, основываясь на сопоставлении различных методов описания стрептомицетных комплексов почв Приэльтонья можно заключить, что светло-каштановые почвы потенциально перспективны для дальнейшего биотехнологического скрининга.
Таким образом, на примере почвенной катены вдоль реки Хары показана закономерность смены почв вдоль экологического градиента, а также смена почвенных микробных сообществ. Выявлены некоторые закономерности в изменении микробного биоразнообразия при переходе от одной почвы к другой, а также установлена зависимость композиций микробных комплексов от уровня солености, pH, растительности и рельефа.
Популяционный анализ почвенных микробных сообществ Приэльтонья позволил установить сходства и различия между исследованными образцами, а выявление аксессорных компонентов, ассоциированных с конкретным местообитанием, может быть перспективно с точки зрения биоиндикации определенных экологических условий: засоления/рассоления, анаэробиоза, влажности, и т.д. Кроме того, показано, что светлокаштановые почвы у реки Хары имеют потенциал для выделения стрептомицетов, которые в дальнейшем могут быть использованы для изучения в целях биотехнологии.
Список литературы
Аверьянов О.А., Сохина Э.Н. Почвы Приэльтонья. Рабочие материалы регионального центра по изучению и сохранению биоразнообразия. Всероссийский НИИ агролесомелиорации. (неопубликовано).
Андреева О.В., Куст Г.С., Сухой П.Ю. Краткосрочная динамика почвенного покрова по данным космической съемки – индикатор климатических изменений (на примере Приэльтонья) // Роль почв в биосфере. Труды Института экологического почвоведения МГУ. Вып. 10. Функционирование почв. Почвоведение и климат Земли. Почвенная биота. Экологическое образование. М.: МАКС ПРЕСС, 2010. С. 85–109.
Звягинцев Д.Г., Зенова Г.М. Актиномицеты засоленных и щелочных почв. Изд-во Книжный дом Университет, 2007. 109 с.
Звягинцев Д.Г., Зенова Г.М., Манучарова Н.А. Экстремофильные и экстремотолерантные актиномицеты в наземных экосистемах. М.: Университетская книга, 2011. 136 с.
Першина Е.В., Тамазян Г.С., Дольник А.С., Пинаев А.Г., Сергалиев Н.Х., Андронов Е.Е. Изучение структуры микробного сообщества засоленных почв с использованием высокопроизводительного секвенирования // Экологическая генетика. 2012. Т. 10. № 2. С. 32–40.
Полевой определитель почв России. М.: Почв. ин-т им. В.В. Докучаева, 2008. 182 с.
Шишов JI.JI., Панкова Е.И. Засоленные почвы России. М.: ИКЦ “Академкнига”, 2006. 854 с.
Argaman E., Keesstra S.D., Zeiligue A. Monitoring the impact of surface albedo on a saline lake in SW Russia // Land Degradation and Development. 2012. V. 23. № 4. P. 398–408.
Bates S.T., Berg-Lyons D., Caporaso J.G., Walters W.A., Knight R., Fierer N. Examining the global distribution of dominant archaeal populations in soil // The ISME J. 2011. V. 5. № 5. P. 908–917.
Bibi F., Strobel G.A., Naseer M.I., Yasir M., Khalaf Al-Ghamdi A.A., Azhar E.I. Microbial flora associated with the halophyte–salsola imbricate and its biotechnical potential // Frontiers in Microbiology. 2018. № 9. Article 65.
Bilal R. G., Mahmood R.K., Malik K.A. Nitrogenase activity and nitrogen-fixing bacteria associated with the roots of Atriplex spp. growing in saline sodic soils of Pakistan // Biology and Fertility of Soils. 1990. V 9. № 4. P. 315–320.
Boulygina E.S., Kuznetsov B.B., Marusina A.I., Tourova T.P., Kravchenko I.K., Bykova S.A., Kolganova T.V., Galchenko V.F. A study of nucleotide sequences of NifH genes of some methanotrophic bacteria // Microbiology. 2002. V. 71. № 4. P. 425–432.
de la Haba R.R., Arahal D.R., Sánchez-Porro C., Ventosa A. The family Halomonadaceae // The Prokaryotes / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg. Springer, 2014.
de Vries H.J., Beyer F., Jarzembowska M. et al. Isolation and characterization of Sphingomonadaceae from fouled membranes // npj Biofilms Microbiomes. 2019. V. 5. № 6.
Hall T.A. BioEdit: a user-friendly biologicalsequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acids Symp. 1999. V. 41. P. 95–98.
Hollister E.B., Engledow A.S.,Hammett A.J.M, Provin T.L., Wilkinson H.H., Gentry T.J. Shifts in microbial community structure along an ecological gradient of hypersaline soils and sediments // ISME J. 2010. V. 4. № 6. P. 829–838.
Huber T.G.F., Hugenholtz P. Bellerophon: A program to detect chimeric sequences in multiple sequence alignments // Bioinformatics. 2004. V. 20. № 14. P. 2317–2319.
Hu P., Hollister E., Somenahally A., Hons F., Gentry T. Soil bacterial and fungal communities respond differently to various isothiocyanates added for biofumigation // Frontiers in Microbiology. 2015. V. 5. P. 729.
IUSS Working Group WRB. World Reference Base for Soil Resources 2014: International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. FAO, Rome, 2014. 181 p.
Kanapatskiy T.A., Samylina O.S., Plotnikov A.O., Selivanova E.A., Khlopko Yu.A., Kuznetsova A.I., Rusanov I.I., Zakharova E.E., Pimenov N.V. Microbial processes of organic matter production and decomposition in saline rivers of the lake Elton area (Volgograd oblast, Russia) // Microbiology. V. 87. № 1. P. 66–78.
Lauber C.L., Hamady M., Knight R., Fierer N. Pyrosequencing-based assessment of soil pH as a predictor of soil bacterial community structure at the continental scale // 2009. Applied and Environmental Microbiology. V. 75. № 15. P. 5111–5120.
Leach B.E., Calhoun K.M., Johnson L.E., Teeters Ch.M., Jackson W.G. Chartreusin, a new antibiotic produced by Streptomyces chartreusis, a new species // J. American Chemical Society. 1953. V. 75. № 16. P. 4011–4012.
León-Lorenzana A.D., Delgado-Balbuena L., Domínguez-Mendoza C.A., Navarro-Noya Y.E., Luna-Guido M., Dendooven L. soil salinity controls relative abundance of specific bacterial groups involved in the decomposition of maize plant residues // Front. Ecol. Evol. 2018. V. 6.
Lozupone C., Lladser M., Knights D., Stombaugh J., Knight R. UniFrac: an effective distance metric for microbial community comparison // ISME J. 2011. V. 5. P. 169–172.
Meisner A., Jacquiod S., Snoek B.L., ten Hooven F.C., Wim H., van der Putten W.N. Drought legacy effects on the composition of soil fungal and prokaryote communities // Frontiers in Microbiology. 2018. V. 9. P. 1–12.
Mukhtar S., Ishaq A., Hassan S., Mehnaz S., Mirza M.S., Malik K.A. Comparison of microbial communities associated with halophyte (Salsola stocksii) and Non-Halophyte (Triticum aestivum) using culture-independent approaches // Polish J. Microbiology. 2017. V. 66. № 3. P. 353–364.
Mwirichia R., Cousin S., Muigai A.W., Boga H.I., Stackebrandt E. Archaeal diversity in the haloalkaline lake elmenteita in Kenya. Curr Microbiol. 2010. V. 60. P. 47–52.
Navarro-Noya Y.E., Valenzuela-Encinas C., Sandoval-Yuriar A., Jiménez-Bueno N.G., Marsch R., Dendooven L. Archaeal communities in a heterogeneous hypersaline-alkaline soil // Archaea. 2015. V. 2015. P. 1–11.
Newman D.J., Cragg G.M. Natural products as sources of new drugs over the last 25 years // J. Natural Products. 2007. V. 70. № 3. P. 461–477.
Rath K.M., Fierer N., Murphy D.V., Rousk J. Linking bacterial community composition to soil salinity along environmental gradients // ISME J. 2019. V. 13. № 3. P. 836–846.
Rengasamy P. World salinization with emphasis on Australia // Journal of Experimental Botany. 2006. V. 57. № 5. P. 1017–1023.
Rintala H., Nevalainen A., Rönkä E., Suutari M. PCR primers targeting the 16S rRNA gene for the specific detection of streptomycetes // Molecular and Cellular Probes. 2001. V. 15. № 6. P. 337–347.
Shade A., Handelsman J. Beyond the Venn diagram: the hunt for a core microbiome // Environmental Microbiology. 2012. V. 14. № 1. P. 4–12.
Schwientek P., Szczepanowski R., Rückert C., Stoye J., Pühler A. Sequencing of high G + C microbial genomes using the ultrafast pyrosequencing technology // J. Biotechnology. 2011. V. 155. № 1. P. 68–77.
Szoboszlay M., Näther A., Liu B., Carrillo A., Castellanos T., Smalla K., Jia Z., Tebbe C.C. Contrasting microbial community responses to salinization and straw amendment in a semiarid bare soil and its wheat rhizosphere // Scientific Reports. 2019. V. 9. № 1. P. 1–11.
Tamura K., Peterson D., Peterson N., Stecher G., Nei M., Kumar S. MEGA5: molecular evolutionary genetics analysis using maximum likelihood, evolutionary distance, and maximum parsimony methods // Mol. Biol. Evol. 2011. V. 28. P. 2731–2739.
van Dijl J. M., Hecker M. Bacillus subtilis: from soil bacterium to super-secreting cell factory // Microbial Cell Factories. 2013. V. 12. № 3.
Xie K., Deng Y., Zhang S., Zhang W., Liu J., Xie Y., Zhang X., Huang H. Prokaryotic community distribution along an ecological gradient of salinity in surface and subsurface saline soils // Scientific Reports. 2017. V. 7. № 1.
Zenova G.M., Dubrova M.S., Kuznetsova A.I., Gracheva T.A., Manucharova N.A., Zvyagintsev D.G. Ecological and taxonomic features of actinomycetal complexes in soils of the lake Elton basin // Eurasian Soil Science. 2016. V. 49. № 2. P. 213–216.
Zhao S., Liu J.J., Banerjee S., Zhou N., Zhao Z.Y., Zhang K., Tian Ch.Y. Soil pH is equally important as salinity in shaping bacterial communities in saline soils under halophytic vegetation // Sci. Rep. 2018. V. 8. № 4550. P. 1–11.
Zhang K., Shi Y., Cui X., Yue P., Li K., Liu X., Tripathi B.M., Chu H. Salinity is a key determinant for soil microbial communities in a desert ecosystem // mSystems. 2019. V. 4. № 1.
Дополнительные материалы
- скачать ESM.docx
- Дополнительные материалы. Рис. S1.-Рис. S7.