Микробиология, 2020, T. 89, № 6, стр. 748-752
Использование микробных обрастаний для выделения спорообразующих прокариот из подземной биосферы
А. П. Лукина a, М. Р. Авакян a, Э. В. Данилова b, О. В. Карначук a, *
a Кафедра физиологии растений и биотехнологии, Томский государственный университет
634050 Томск, Россия
b Лаборатория микробиологии, Институт общей и экспериментальной биологии СО РАН
670047 Улан-Удэ, Россия
* E-mail: olga.karnachuk@green.tsu.ru
Поступила в редакцию 27.04.2020
После доработки 22.05.2020
Принята к публикации 29.05.2020
Аннотация
Подземная биосфера является богатым источником новых прокариот. В 2019 г. был описан новый род Thermoanaerosсeptrum, филогенетически удаленный от таксономически описанных представителей Firmicutes. Экология этой группы остается неизученной, так как единственный известный представитель, T. fracticalcis, получает энергию, используя фумарат, источник которого в подземных водах не очевиден. Бактерия не способна использовать ни одну из окисленных форм серы (сульфат, сульфит, тиосульфат, элементная сера) в качестве акцептора электронов для дыхания, хотя в геноме присутствуют белки, необходимые для осуществления диссимиляционного восстановления сульфата. Изучение экологии T. fracticalcis затрудняет тот факт, что организм является минорным компонентом сообщества. Целью настоящего исследования было использование микробных обрастаний на изливе глубинной термальной скважины для получения спорообразующих сульфидогенов. Полученная чистая культура Thermoanaerosсeptrum sp. BuN1 восстанавливает сульфаты и характеризуется сахаролитической активностью, а также ростом в широком диапазоне рН от 3.5 до 9. Штамм BuN1 является умеренным термофилом с оптимумом 50°С и растет в интервале от 37 до 60°С.
Резервуар углерода в подземных горизонтах по разным оценкам достигает 14–135 Пг (1 Пг = 1015 г), что составляет 2–19% всей биомассы Земли (M-cMahon, Parnell, 2014). Наши знания о подземных микроорганизмах в большей части основаны на последовательностях гена 16S рРНК и, в меньшей степени, геномах, собранных из метагеномной информации (metagenome-assembled genomes – MAGs) и полученных из единичных клеток (single amplified genomes – SAGs). Соотношение культивируемых прокариот и числа известных по молекулярным данным минимально для подземных местообитаний (Anantharaman et al., 2018). Причинами этого являются трудности с отбором проб, незагрязненных организмами с поверхности, и сложность культивирования медленнорастущих подземных форм (Karnachuk et al., 2019). Своеобразными “окнами” в подземную биосферу являются артезианские скважины, термальные источники, связанные с разломами, и глубокие шахты для добычи минералов. Отбор проб из артезианских скважин, где вода поступает под давлением из глубинных пластов, помогает избежать загрязнения поверхностными организмами.
Подземные водоносные горизонты в большинстве случаев характеризуются олиготрофными условиями, к которым прокариоты приспосабливаются замедленным метаболизмом. В местах излива глубинных скважин на поверхность могут формироваться своеобразные термальные биотопы, где дефицитные по органическому веществу, но богатые минеральными соединениями высокотемпературные воды получают доступ к свету и кислороду. Здесь формируются высокопродуктивные сообщества, в которых органика образуется за счет фотосинтеза и/или хемосинтеза, основанного на окислении восстановленных соединений серы, приносимых из глубинных пластов. Микробные маты на изливе термальных скважин могут служить своеобразными накопителями глубинных организмов, прежде всего, спорообразующих. Одной из причин, не позволяющих культивировать глубинные прокариоты непосредственно из воды скважин, является их низкое содержание в пробах воды. Особенное значение это имеет в случае выделения минорных компонентов сообщества. Накопление клеток, или, что более вероятно, спор в микробных матах позволяет получить сконцентрированный инокулят для постановки первичных накопительных культур. Маты фактически являются природной “ловушкой” для некоторых микроорганизмов.
В 2019 г. из подземных горизонтов Большого Артезианского Бассейна в США была выделена и описана бактерия, Thermoanaerosсeptrum fracticalcis, представляющая новый род, филогенетически удаленный от таксономически описанных представителей Firmicutes (Hamilton-Brehm et al., 2019). Организм представляет минорный компонент микробного сообщества и использует узкий круг органических субстратов для гетеротрофного роста. Возможная роль бактерии в сообществе остается непонятной, так как единственным субстратом, который позволял рутинное культивирование, является фумарат, чье присутствие в подземных водах не очевидно. Авторы предполагают, что T. fracticalcis может использовать криптические продукты метаболизма других организмов, что и объясняет его незначительное содержание в сообществе. В геноме T. fracticalcis обнаружена бисульфитредуктаза, dsrAB, предполагающая способность к сульфатному дыханию. Однако авторы не смогли экспериментально подтвердить использование сульфата, равно как и других соединений серы с промежуточной степенью окисления, в качестве акцепторов электронов.
В этом исследовании мы использовали микробные обрастания, формирующиеся на выходе глубинных вод из артезианской термальной скважины в Тункинском районе Республики Бурятия для получения культур сульфатредуцирующих спорообразующих прокариот. Скважина Р-1 была пробурена в 1953–1954 гг. до глубины 834 м. Вода используется для бальнеологических целей. Скважина изливается непосредственно в небольшой термальный бассейн. Обсадная труба скважины покрыта массивными микробными обрастаниями черного цвета.
Пробы воды и микробных обрастаний отбирали 05.08.2016 г. из воды скважины и матов в местах стока термальной воды у основания обсадной трубы. Физико-химические параметры воды, pH, температуру и окислительно-восстановительный потенциал, измеряли рН-метром HI183141 (“Hanna Instruments”). Пробы воды фиксировали ацетатом цинка для определения содержания H2S, которое проводили в лаборатории спектрофотометрическим методом с парафенилендиамином (Cline, 1969). Элементный состав воды определяли масс-спектрометрией с индуктивно связанной плазмой как описано ранее (Mardanov et al., 2016). Для получения культур сульфидогенов использовали пресноводную среду Видделя-Бака (WB) с добавлением растворов микроэлементов, витаминов, раствора селената-вольфрамата, сульфида натрия в качестве восстановителя (Widdel, Bak, 1992) и элементного железа (Карначук и соавт., 2006). В качестве доноров электронов использовали 7.5 мМ формиат, 9 мМ ацетат, 7.3 мМ лактат, 13.5 мМ пропионат и 5 мМ глюкозу. В пенициллиновые флаконы со средой помещали небольшое количество матов (на кончике скальпеля), после чего инкубировали флаконы при температуре 50°С. В экспериментах по восстановлению сульфата использовали высокочистый безводный Na2SO4 (“Sigma-Aldrich”), исключающий присутствие недоокисленных соединений серы. Для определения филогенетического положения изолята амплифицировали ген 16S рРНК с праймерами 27F-1492R. Выделение ДНК и условия амплификации были аналогичны описанным ранее (Frank et al., 2016).
Температура воды скважины Р-1 в момент отбора проб составляла 39.7°C, рН 8.06. Вода была сильно восстановлена (Eh = –386 mV) и содержала следы сероводорода (0.93 мг/л) (табл. 1). Активные сульфидогенные накопительные культуры, содержащие спорообразующие клетки, были получены на среде с глюкозой. Для их выделения в чистую культуру проводили пастеризацию накопительной культуры при температуре 95°С в течение 15 мин с последующими сериями разведений. Дальнейшее выделение отдельных колоний на твердой среде позволило получить бинарную культуру спорообразующих бактерий. Два палочковидных спорообразующих морфотипа разделили путем снижения рН среды до 3.17 с последующей серией разведений. Выделенную морфологически однородную культуру сульфидогенов обозначили штамм BuN1.
Таблица 1.
Физико-химические параметры воды скважины Р-1
| Параметры и единицы измерения | Значения |
|---|---|
| рН | 8.06 |
| Температура, °C | 39.7 |
| Eh, mV | –386 |
| Содержание в воде, мг/л: | |
| Na | 311 |
| Mg | 4.46 |
| Ca | 22.4 |
| Si | 18.3 |
| K | 2.80 |
| Sr | 0.31 |
| B | <0.01 |
| Li | 0.006 |
| Fe | 0.27 |
| Ba | 0.063 |
| Se | 0.005 |
| P | 0.020 |
| Rb | <0.0028 |
| Mn | 0.065 |
| Al | 0.018 |
| Ge | 0.00039 |
| Zn | 0.012 |
| Cr | 0.011 |
| As | <0.002 |
| ${\text{SO}}_{4}^{{2 - }}$ | <10 |
| H2S | 0.93 |
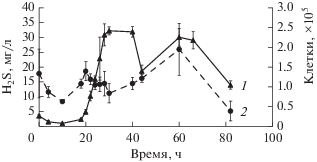
Анализ последовательности гена 16S рРНК показал, что штамм BuN1 относится к описанному недавно роду Thermoanaerosсeptrum, представляющему удаленную ветвь внутри фирмикут (рис. 1). Сходство последовательностей гена 16S рРНК с единственным известным видом, T. fracticalcis, составляло 97.6%. Однако штамм BuN1 существенно отличался от T. fracticalcis прежде всего способностью к восстановлению сульфата. Наряду с сульфатом штамм восстанавливал сульфит и тиосульфат, но не элементную серу, нитрат или фумарат. T. fracticalcis не использует сахара (Hamilton-Brehm et al., 2019), в то время как на глюкозе, фруктозе и сахарозе наблюдали наиболее активный рост BuN1. Неожиданно, максимальный рост штамм демонстрировал на среде с сахарозой, рост на фруктозе и глюкозе был слабее. Скорость роста на сахарозе составляла 0.22 ч–1, время удвоения 3.2 ч. При достаточно высокой для анаэроба скорости роста штамм не накапливал значительной биомассы, численность клеток достигала 2.5 × 105 клеток/мл в конце экспоненциальной фазы (рис. 2). Содержание сероводорода увеличивалось с ростом клеток и составляло 25 мг/л после 60 ч культивирования. Максимальное содержание сероводорода, зафиксированное при культивировании, составляло 72 мг/л среды.
Рис. 1.
Дерево, показывающее филогенетическое положение штамма BuN1, построено на основе анализа последовательностей гена 16S рРНК с использованием программы FastTree (Price et al., 2009). Последовательности выровнены в онлайн сервисе SINA ACT (https://www.arb-silva.de/aligner/).

Рис. 2.
Рост Thermoanaerosсeptrum sp. BuN1 на сахарозе, представленный как количество клеток, (1) и изменение концентрации H2S (2) в среде. Вертикальные линии показывают стандартное отклонение.
Штамм BuN1 не использует традиционные для сульфатредукторов доноры электронов – лактат и этанол, но хорошо растет на пирувате. Формиат и пропионат не поддерживали рост, как и фумарат, являющийся единственным субстратом, позволяющим рутинно выращивать T. fracticalcis (Hamilton-Brehm et al., 2019). Глюкоза и пируват также поддерживали рост BuN1 в отсутствие сульфата. Thermoanaerosсeptrum sp. BuN1 рос в узких пределах температуры от 37 до 55°С с оптимумом при 50°С. При этом штамм характеризовался широким диапазоном рН для роста от 2.8 до 9, с оптимумом 7.2. Максимальная концентрация NaCl в среде для роста составляла 0.5%.
Сходство последовательностей гена 16S рРНК штамма BuN1 и T. fracticalcis DRI-13, составляет менее 98.7% – порога, разграничивающего виды (Chun et al., 2018). Учитывая значительные различия в физиологии, очевидно, что штамм BuN1 является новым видом рода Thermoanaerosсeptrum. Способность использовать сахара и восстанавливать соединения серы проясняет возможную роль этой группы в подземных горизонтах, как деструкторов микробной биомассы, образуемой хемолитотрофами. Подобный метаболизм соответствует обнаруженной Хамилтон-Брем и соавт. незначительной доли Thermoanaerosсeptrum в сообществе подземных горизонтов (Hamilton-Brehm et al., 2019). Происхождение Thermoanaerosсeptrum sp. BuN1 из подземной биосферы не вызывает сомнения, учитывая тот факт, что все известные из базы данных GenBank родственники являются представителями глубинных горизонтов, включая некультивируемую бактерию, обнаруженную в глубинных подземных водах, связанных с аккреционной призмой в Японии (Baito et al., 2015), и сообщество сульфидогенов из подземных термальных вод в Дании (Kjeldsen et al., 2007). Вызывает интерес тот факт, что при относительно активном росте на сахарозе BuN1 образовывал относительно небольшое количество сероводорода, что предполагает дополнительный источник энергии. Возможно, происходит одновременное сбраживание сахаров и использование промежуточных метаболитов в качестве донора электронов для сульфатредукции, как и предположили Хамилтон-Брем и соавт., обозначив их “криптическими” субстратами (Hamilton-Brehm et al., 2019). Определение геномной последовательности Thermoanaerosceptrum sp. BuN1 в совокупности с физиологическими экспериментами позволит понять метаболизм, а также изучить происхождение генов dsr в этом роде фирмикут. Возможно, что последовательность нуклеотидов какого-то из белков, связанных с сульфатредукцией, была нарушена у T. fracticalcis вставкой в хромосому бактериофага или другого мобильного элемента.
Список литературы
Карначук О.В., Пименов Н.В., Юсупов С.К., Франк Ю.А., Пухакка Я.А., Иванов М.В. Распределение, разнообразие и активность сульфатредуцирующих бактерий в водной толще озера Гёк-Гёль, Азербайджан // Микробиология. 2006. Т. 75. С. 101–109.
Karnachuk O.V., Pimenov N.V., Yusupov S.K., Frank Y.A., Puhakka Y.A., Ivanov M.V. Distribution, diversity, and activity of sulfate-reducing bacteria in the water column in Gek-Gel Lake, Azerbaijan // Microbiology (Moscow). 2006. V. 75. P. 82–89.
Anantharaman K., Brown C.T., Hug L.A., Sharon I., Castelle C.J., Probst A.J., Thomas B.C., Singh A., Wilkins M.J., Karaoz U., Brodie E.L., Williams K.H., Hubbard S.S., Banfield J.F. Thousands of microbial genomes shed light on interconnected biogeochemical processes in an aquifer system // Nat. Commun. 2016. V. 7. 13219. https://doi.org/10.1038/ncomms13219
Baito K., Imai S., Matsushita M., Otani M., Sato Y., Kimura H. Biogas production using anaerobic groundwater containing a subterranean microbial community associated with the accretionary prism // Microb. Biotechnol. 2015. V. 8. P. 837–845.
Cline J.D. Spectrophotometric determination of hydrogen sulfide in natural waters // Limnol. Oceanogr. 1969. V. 14. P. 454–458.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi H., Xu X.-W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 461–466.
Frank Y., Banks D., Avakian M., Antsiferov D., Kadychagov P., Karnachuk O. Firmicutes is an important component of microbial communities in water-injected and pristine oil reservoirs, Western Siberia, Russia // Geomicrobiol. J. 2016. V. 33. P. 387–400.
Hamilton-Brehm S.D., Stewart L.E., Zavarin M., Caldwell M., Lawson P.A., Onstott T.C., Grzymski J., Neveux I., Lollar B.S., Russell C.E., Moser D.P. Thermoanaerosceptrum fracticalcis gen. nov. sp. nov., a novel fumarate-fermenting microorganism from a deep fractured carbonate aquifer of the US Great Basin // Front. Microbiol. 2019. V. 10. P. 2224.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated Candidatus Desulforudis audaxviator from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. V. 13. P. 1947–1959.
Kjeldsen K.U., Kjellerup B.V., Egli K., Frølund B., Nielsen P.H., Ingvorsen K. Phylogenetic and functional diversity of bacteria in biofilms from metal surfaces of an alkaline district heating system // FEMS Microbiol. Ecol. 2007. V. 61. P. 384–397.
Mardanov A.V., Panova I.A., Beletsky A.V., Avakyan M.R., Kadnikov V.V., Antsiferov D.V., Banks D., Frank Y.A., Pimenov N.V., Ravin N.V., Karnachuk O.V. Genomic insights into a new acidophilic, copper-resistant Desulfosporosinus isolate from the oxidized tailings area of an abandoned gold mine // FEMS Microbiol. Ecol. 2016. V. 92. Art. fiw111.
McMahon S., Parnell J. Weighing the deep continental biosphere // FEMS Microbiol. Ecol. 2014. V. 87. P. 113–120.
Price M.N., Dehal P.S., Arkin A.P. FastTree: Computing Large Minimum-Evolution Trees with Profiles instead of a Distance Matrix // Mol. Biol. Evol. 2009. V. 26. P. 1641–1650.
Widdel F.F., Bak R. Gram negative mesophilic sulfate reducing bacteria // The Prokaryotes: A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A. et al. Berlin: Springer, 1992. P. 3352–3378.
Дополнительные материалы отсутствуют.


