Микробиология, 2020, T. 89, № 6, стр. 631-645
Биокоррозия синтетических пластмасс: механизмы деградации и способы защиты
В. К. Плакунов a, А. В. Ганнесен a, С. В. Мартьянов a, М. В. Журина a, *
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: mzhurik@mail.ru
Поступила в редакцию 17.06.2020
После доработки 22.06.2020
Принята к публикации 29.07.2020
Аннотация
Проанализированы механизмы воздействия микроорганизмов на синтетические пластмассы. Основное внимание уделено наиболее распространенным полимерам, для которых существует крупнотоннажное производство. Рассмотрено участие микробных ферментов в биодеградации пластмасс и роль мультивидовых микробных биопленок в биокоррозии. Обсуждаются главные приемы защиты синтетических пластмасс от микробных повреждений.
ВВЕДЕНИЕ
Постоянно растущее промышленное производство синтетических полимерных материалов (пластмасс) приводит к масштабному (постепенно переходящему в катастрофическое) загрязнению окружающей среды их отходами. Актуальность рассмотрения проблем, связанных с биокоррозией синтетических полимеров, диктуется отсутствием в настоящее время русскоязычных обзорных работ, доступных широкому кругу отечественных специалистов.
Из-за широкого распространения пластмасс в технике и домашнем хозяйстве невозможно организовать универсальную систему сбора и утилизации их отходов. В результате возникли две, казалось бы, разнонаправленные, но фактически тесно связанные задачи: во-первых, продление срока службы используемых технических полимерных изделий путем предупреждения их коррозии, в том числе микробной биокоррозии, и, во-вторых, ускорение биоразложения отходов, накапливающихся после завершения срока службы этих изделий.
Первая задача решается путем введения в состав полимера стабилизирующих и биоцидных добавок, вторая – путем введения добавок ускоряющих разрушение пластмасс под действием физико-химических факторов среды и делающих их доступными для утилизации микроорганизмами.
Хотя основной целью данного обзора является первая проблема (которую мы рассмотрим в основном на примере широко распространенных пластмасс), необходимо кратко остановиться на способах увеличения доступности синтетических пластмасс для разложения микроорганизмами. Оговоримся, что рассмотрение отдельной очень важной и масштабной проблемы получения т.н. “биопластмасс” на основе биологических полимеров (например, крахмала, целлюлозы, хитина, альгината, полиоксиалканоатов и др.) или мономеров (например, молочной кислоты – источника полилактида) в нашу задачу не входит, поскольку подробно обсуждается в недавно опубликованных обзорах (Roohi et al., 2017; Iram et al., 2019) и монографии (Ciardelli et al., 2019).
Повышение разлагаемости и биодоступности пластмасс может быть достигнуто двумя основными способами. Первый, прямо не связанный с воздействием микроорганизмов, состоит в использовании физико-химических приемов (нагреванием пластмасс при повышенных температурах, облучением ультрафиолетом, введением добавок, повышающих чувствительность к окислительному воздействию атмосферного кислорода и др. (E-uropean Bioplastics, 2015; Mierzwa-Hersztek et al., 2019). В этом случае в полимерных цепях пластмасс возникают неоднородности и разрывы, которые делают их более доступными для последующего разложения микроорганизмами. Второй путь состоит во внедрении в структуру пластмассы биоразлагаемых добавок (крахмала, целлюлозы) и других доступных для прямого воздействия микроорганизмов субстратов. В последние годы возникло крупнотоннажное производство таких субстратов, называемых “полностью разлагаемыми добавками к пластмассам” (“totally degradable plastic additive”, TDPA), которые существенно ускоряют микробную биокоррозию (Agamuthu, Faizura, 2005).
Однако при использовании таких добавок возникают две проблемы. Во-первых, для гомогенного смешивания столь разнородных субстратов, как растительные продукты и синтетические (как правило, гидрофобные) плаcтмассы, необходимо введение т.н. “совместителей” или “компатибилизаторов” (“сompatibilizers”), которые обычно представляют собой блок привитых сополимеров, но могут также быть химически модифицированными полимерами (Ajji, 2014; Markovic, Visakh, 2017). Так, например, полиэтилен с привитым малеиновым ангидридом (MAPE) обеспечивает хорошие результаты с точки зрения улучшения совместимости с другими наполнителями (Герасин и соавт., 2005; Robledo-Ortíz et al., 2020). Во-вторых, введение этих добавок отрицательно сказывается на прочности пластмасс и времени их жизни при воздействии неблагоприятных физико-химических условий среды. Кроме того, микробная утилизация органических добавок приводит к формированию мелких (и даже наноразмерных) фрагментов пластмасс т.н. “микропластиков”, которые встречаются повсеместно в водоемах и почве. Они могут адсорбировать другие загрязняющие вещества и, накапливаясь в почвенных и водных беспозвоночных организмах, приводить к их повреждениям, а главное – попадать с пищей в организмы животных и человека, вызывая токсические эффекты. Экологические проблемы, вызываемые микропластиками, и способы борьбы с их образованием являются предметом многочисленных исследований (см. обзоры: Padervand et al., 2020; Yuan et al., 2020; Bashir et al., 2020) и будут кратко рассмотрены нами в последующих разделах обзора.
Кроме того, в пластмассы могу вводиться другие вещества, определенным образом влияющие на их свойства, в том числе и на чувствительность к воздействию микроорганизмов: сшивающие агенты, наполнители и другие компоненты. Многочисленные технологические и экологические проблемы, возникающие при производстве и применении описанных материалов, подробно освещены в специальной литературе, к которой мы и отсылаем читателей, интересующихся деталями указанных проблем (Adamcová et al., 2019; Ciardelli et al., 2019).
ПРОЦЕССЫ И МЕХАНИЗМЫ БИОЛОГИЧЕСКОГО РАЗЛОЖЕНИЯ СИНТЕТИЧЕСКИХ ПЛАСТМАСС
Главные этапы разложения пластмасс. Основными биологическими объектами, способными осуществлять биокоррозию пластмасс, являются микроорганизмы. Поэтому при дальнейшем изложении имеющихся в литературе сведений именно их роли в природных и промышленных условиях будет уделено основное внимание. В понятие биодеградации пластмасс входит изменение таких их свойств, как форма поверхности, и молекулярная масса, пределы прочности, химическая структура. Биоразлагаемость определяется как химическим составом пластмасс, так и условиями их применения и хранения отходов. В естественных условиях (в почвах и водоемах) пластмассы разлагаются преимущественно под влиянием аэробных микроорганизмов с образованием СО2, Н2О и метаболитов (олигомеров, димеров, мономеров и продуктов их превращений). В глубоких отложениях и на свалках определяющую роль играют анаэробные микроорганизмы, разлагающие пластмассы до СН4, Н2О и метаболитов. Образующиеся промежуточные продукты могут включаться в биомассу микроорганизмов или накапливаться в окружающей среде. И, наконец, в компостах могут осуществляться оба типа процессов разложения пластмасс (Fesseha, Abebe, 2019).
Принято подразделять микробную деградацию полимеров на четыре основных этапа: биодетериорацию (biodeterioration), биофрагментацию, ассимиляцию и минерализацию (Sharma, 2018). Под термином биодетериорация обычно понимают первичное воздействие микроорганизмов на полимер, не приводящее к существенному нарушению его структуры, но изменяющее свойства полимера таким образом, что облегчается последующая его модификация под влиянием факторов внешней среды, а также биофрагментация под действием ферментов микроорганизмов. Между первым и вторым этапами биокоррозии полимеров не всегда можно провести четкие границы. Подробно последствия воздействия процесса биодетериорации на экологическое состояние окружающей среды рассмотрены в монографии (Biodeterioration Research 3, 1990) и последующих статьях (например, Stroganov et al., 2008). Третий этап – ассимиляция (включение фрагментов-метаболитов в биомассу микроорганизма) может практически отсутствовать или протекать лишь частично. И, наконец, полное разложение полимера может приводить к его минерализации с образованием вышеупомянутых продуктов. В данном обзоре мы подробнее остановимся только на втором этапе, а именно, на ферментативной биокоррозии синтетических полимеров преимущественно на примере полиолефинов (полиэтиленов и сходных по структуре полимеров), поскольку этот вид синтетических пластмасс является не только широко распространенным, но и наиболее долговечным из-за устойчивости к воздействию микробиоты как природных, так и технологических систем.
Ферменты, участвующие в биокоррозии синтетических пластмасс. К деполимеризации синтетических пластмасс может приводить воздействие физико-химических факторов: фотоокислительных (например, ультрафиолета), термических, механохимических (например, воздействие озона или катализ тяжелыми металлами, приводящие к возникновению свободных радикалов) и других. Однако наряду с этими процессами значительную роль играет участие микроорганизмов в разрушении синтетических пластиков (Devi et al., 2015; Sheel, Pant, 2018).
Очевидно, что в связи с практической нерастворимостью пластмасс в водных системах, решающую роль в процессах их биоразложения играют ферменты микроорганизмов, выделяемые в окружающую среду или расположенные на поверхности микробной клетки.
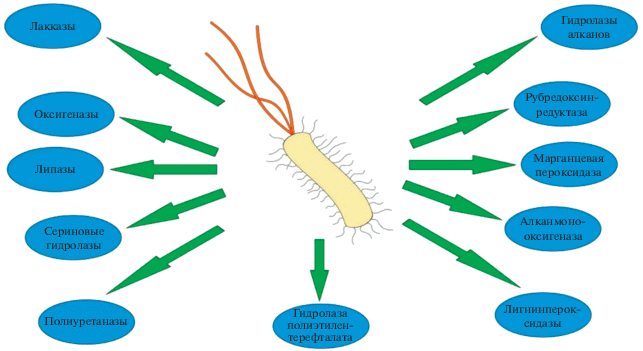
Во многих случаях природа ферментов, играющих ключевую роль в биодеградации синтетических пластмасс под действием конкретных микроорганизмов, остается неизвестной. Однако участие некоторых классов ферментов в этих процессах можно считать убедительно доказанным (Sharma, 2018). Выборочные данные приведены на рис. 1.
Одними из наиболее изученных ферментов, принимающих участие в биокоррозии пластмасс, являются лакказы (EC 1.10.3.2), содержащие в активном центре атомы меди, связанные с аминокислотами. Их синтезируют прокариоты, грибы и растения. Эти ферменты обладают широкой субстратной специфичностью, но одна из основных их функций связана с круговоротом лигнина и формированием гумуса в почве. Они находят широкое применение в биотехнологии при переработке отходов, в том числе содержащих синтетические пластмассы (Sheel, Pant, 2018; Ceci et al., 2019). Другим ферментом, участвующим в деградации синтетических пластмасс, в частности, высокомолекулярного полиэтилена (РЕ), является марганецпероксидаза (ЕС 1.11.1.13). Этот содержащий гем фермент также участвует в деградации лигнина, но способен осуществлять и биокоррозию облученного ультрафиолетом РЕ (Mukherjee, Kundu, 2014), а также полиамида нейлона. Еще одной активной в биокоррозии полимеров оксидоредуктазой, относящейся к классу “лигниназ”, является лигнинпероксидаза (ЕС 1.11.1.14) (Vignali et al., 2018).
Ключевую роль в деструкции синтетических полимеров – производных олефинов, играют алкангидроксилазные многокомпонентные системы, включающие монооксигеназы, специфичные для алканов с разной длиной углеродной цепи. Эти ферменты могут содержать в активном центре цитохромы Р450 (CYP52, CYP153, CYP116B5) или флавины, как, например, AlmA (у термофильных бактерий, LadA), атомы меди (pBMO), а также атомы меди в сочетании с флавинами (диоксигеназы) или негемовое железо (AlkB) и другие кофакторы. Для активности некоторых из них (AlkB) необходимо присутствие белков рубредоксинов или ферментов рубредоксинредуктаз, а для ферментов, содержащих цитохром Р450, требуется ферредоксин и ферредоксинредуктаза (Jeon, Kim, 2015; Турова и соавт., 2016; Moreno, Rojo, 2019). Прямые доказательства участия алкангидроксилаз Rhodococcus ruber в деструкции РЕ, подвергнутого предварительному абиотическому оксо-фрагментированию, получены путем секвенирования РНК с последующим хроматомасс-cпектрометрическим анализом (Gravouil et al., 2017).
Существуют основания полагать участие в процессах биокоррозии и некоторых других ферментов: серингидролаз, микробных липаз и эстераз (рис. 1). Однако их роль и механизмы действия пока изучены недостаточно (Sharma, 2018).
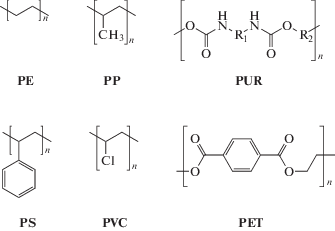
Методы детекции биокоррозии пластмасс. Изучение механизмов деградации синтетических полимеров затруднено крайне низкой скоростью протекания процессов их биокоррозии. Время жизни этих полимеров в природных условиях составляет десятки и сотни лет. Поэтому даже начальные результаты биокоррозии можно обнаружить только после длительного воздействия микроорганизмов, измеряемого несколькими неделями или месяцами. Мы рассмотрим механизмы и методы детекции биокоррозии на примере наиболее распространенных синтетических пластмасс, а именно полиэтилена низкой плотности (low-density polyethylene LDPE), полиэтилена высокой плотности (high density polyethylene, HDPE), полиэтилентерефталата (polyethylene terephthalate, PET), полипропилена (polypropylene, PP), поливинилхлорида (polyvinyl chloride, PVC) и полиуретана (polyurethane, PUR). Они составляют более половины кратковременно используемых пластмасс (например, в виде упаковочного материала), которые в результате дают наибольшее количество отходов (Ragaert et al., 2017) (рис. 2). В цитируемом далее обзоре кратко рассмотрены механизмы, участвующие в биодеградации некоторых из указанных пластмасс и перечислены основные микроорганизмы-возбудители их биокоррозии (Raddadi, Fava, 2019) (рис. 3).
Сделаны попытки оценить разными методами повреждение поверхности полиэтиленов (РЕ) (как правило, модифицированных предварительной обработкой нагреванием или облучением ультрафиолетом). Например, уже в ранних работах удалось показать с помощью сканирующей электронной микроскопии наличие повреждений поверхности LDPE, модифицированного добавлением 7.7% крахмала, при длительной инкубации в присутствии Arthrobacter paraffineus по сравнению со стерильными условиями (Hakkarainen, Albertsson, 2004). Однако для обнаружения хотя бы слабых повреждений поверхности немодифицированных РЕ в лабораторных условиях необходима инкубация с микроорганизмами в течение нескольких недель, а в природных условиях (например, в почве) – даже нескольких месяцев (Sangale et al., 2012; Esmaeili et al., 2013). Нами недавно предложен удобный оптический экспресс-метод количественной оценки повреждения моно- и мультивидовыми сообществами микроорганизмов поверхности немодифицированного РЕ путем измерения светорассеяния, для которого достаточно инкубации в течение всего 5–7 сут. Этот подход может использоваться как для оценки биокоррозии пластмасс, так и для подбора биоцидов, позволяющих защитить пластмассы от биоповреждения (Журина и соавт., 2020а, 2020б).
В качестве простых физико-химических методов оценки биокоррозии применяют измерение потери веса, пределы прочности при растяжении, молекулярную массу, степень кристалличности и поглощения воды (изменение гидрофобности) (Harrison et al., 2018; Kulkarni, Dasari, 2018). При этом замечено, что сообщества микроорганизмов проявляют более высокую деградирующую способность, чем отдельные их представители (подробнее см. предпоследний раздел данного обзора).
Сведения о биодеградации РР очень ограниченны. Показано, что существенное ускорение разложения РР грибами Phanerochaete chrysosporium и Engyodontium album наблюдается после жесткой его предобработки (выдерживание при 100°C или облучение ультрафиолетом в течение 10 дней) (Jeyakumar et al., 2013). Установлено синергидное биокоррозионное воздействие в течение 12 мес. бинарных комбинаций бактерий: B. flexus + + P. azotoformans или B. flexus + B. subtilis на модифицированный РР. При этом показано, что РР, облученный ультрафиолетом, деградирует быстрее, чем термически обработанный пластик (Aravinthan et al., 2015). В одной из немногих работ с немодифицированным РР авторы изучили его биодеградацию в отсутствие дополнительных компонентов, с помощью мезофильной бактерии Stenotrophomonas panacihumi, изолированной из твердых бытовых отходов, и измерили степень разложения РР по количеству образующейся углекислоты и изменению величины молекулярной массы. Они продемонстрировали обратную зависимость между величиной молекулярной массы полимера и степенью его биодеградации (по выделению CO2) после инкубации в течение 90 сут в присутствии изучаемого микроорганизма (Jeon, Kim, 2016). Заслуживает внимания работа, посвященная биодеградации РР в виде частиц микропластика, которые, как мы уже упоминали, представляют серьезную угрозу для природных биоценозов. После 40 сут инкубации потеря веса РР составляла 4% в случае Bacillus sp., и 6.4% в присутствии Rhodococcus sp. Эти данные подтверждены спектроскопическими и электронно-микроскопическими методами (Auta et al., 2018).
Следует отметить, что сама по себе потеря веса полимера не может служить надежным критерием его биодеградации, поскольку состав пластиков, как мы уже упоминали, очень гетерогенен, и часть компонентов может теряться при воздействии факторов внешней среды независимо от присутствия микроорганизмов. Поэтому данный показатель должен обязательно дополняться другими методами тестирования. В частности, показателем деградации полимера может служить измерение его механической или термической стабильности. Однако и в этом случае наличие дополнительных компонентов может сильно влиять на результаты. Так, например, пленки PVC могут содержать до 30% и более дополнительных компонентов, доступных для воздействия микроорганизмов. В этих случаях дополнительным критерием может служить метод дифференциального калориметрического анализа – температура перехода полимера в “стекловидное” состояние. Снижение этой температуры может указывать на микробную деградацию полимера (Lucas et al., 2008). О наличии микробного повреждения полимеров может также свидетельствовать снижение их средней молекулярной массы, определяемой методом гель-фильтрации, которое проявляется на поздних стадиях биодеградации полимера, как, например, в случае биокоррозии PVC (Giacomucci et al., 2020). В некоторых случаях оправдывают себя радиоизотопные методы, хотя они требуют предварительного введения “меченых” атомов в полимер с последующим определением “меченых” продуктов деградации. Очевидно, что этот метод применим только при достаточно глубокой деструкции полимеров в конкретном случае PE (Tian et al., 2016). Некоторые методы пока только проходят апробацию их применимости для измерения биокоррозии синтетических полимеров. Например, определение соотношения стабильных изотопов, т.е. величины δ13C, широко применяемое в биогеохимии, испытано для определения биокоррозии ряда полимеров, в том числе полиолефинов, с обнадеживающими результатами (Berto et al., 2017).
Биодеградация PS пока еще изучена недостаточно. Мономерный стирол может подвергаться микробной деструкции, которая начинается с окисления двойной связи этиленовой боковой цепи, катализируемого стиролмонооксигеназой. Однако сам полимер очень устойчив к биокоррозии: есть сведения, что его листы сохраняются без повреждений в почве более 32 лет (Otake et al., 1995). Как правило, биодеградацию PS изучают на его комплексных сополимерах. Однако проведено исследование воздействия чистой культуры R. ruber и на измельченный индивидуальный PS (Mor, Sivan, 2008). Авторы изучили образование биопленок на поверхности полимера и измерили потерю его веса, составившую 0.5 и 0.8% за 4 и 8 нед. инкубации соответственно. В другой работе обнаружена деградация немодифицированного PS c образованием стирола, толуола, бензола и акролеина под воздействием Pseudomonas sp. (Devi et al., 2016). Существуют исследования, демонстрирующие возможность биодеградации полистирола, измеренной разными методами при длительных инкубациях с чистыми культурами микроорганизмов: Pseudomonas aeruginosa, Bacillus subtilis, Staphylococcus aureus, Streptococcus pyogenes, Aspergillus niger и рядом микробных сообществ. Они обобщены в недавно опубликованном обзоре (Ho et al., 2017).
Особый случай биодеградации PS обнаружен у микроорганизма кишечной микробиоты личинок мучного хрущака (Tenebrio molitor Linnaeus), способных метаболизировать полистирол, прогрызая пластиковую упаковку с образованием 14СО2 при метаболизме меченого 14С-PS (Yang et al., 2015a). Этот процесс подавляется при добавлении в пищу насекомого антибиотиков. Особенно активным ингибитором оказался гентамицин. Из червеобразного отростка личинок изолирован микроорганизм Exiguobacterium sр., способный формировать биопленку на поверхности PS, нарушая его структуру, снижая гидрофобность и вызывая образование полярных С–О-групп. Планктонная культура этой бактерии способна деградировать 7.4% фрагментов PS за 60 сут инкубации (Yang et al., 2015b).
Очень устойчивым к микробному воздействию оказался PVC. Детальный филогенетический анализ микроскопических грибов, заселяющих пленки PVC, помещенные в почву на 10 мес., показал преимущественное присутствие: Phanerochaete chrysosporium, Lentinus tigrinus, Aspergillus niger и A. sydowii. Дальнейшее их раздельное культивирование в течение 7 нед. на средах, содержащих PVC в качестве единственного источника углерода, позволило обнаружить изменение характера поверхности полимера методом сканирующей электронной микроскопии (scanning electrone microscopy, SEM), снижение его молекулярной массы (методом гель-хроматографии), изменение химической структуры полимера методами инфракрасной спектроскопии с Фурье преобразованием (Fourier-transform spectroscopy FTIR) и ядерного магнитного резонанса (nuclear magnetic resonance, NMR), что свидетельствует о потенциальной способности микроскопических грибов к биокоррозии PVC (Ali et al., 2014). Бактерии менее активны как биодеструкторы PVC. Так, разные виды Pseudomonas, способные усваивать мономерный винилхлорид (Danko et al., 2004), не оказывают существенного воздействия на немодифицированный PVC (Wilkes, Aristilde, 2017). Более активными оказались бинарные и мультивидовые сообщества бактерий. Так, совместная культура P. citronellolis и B. flexus после 45 сут инкубации вызывали фрагментацию пленки PVC, сопровождаемую 10% снижением молекулярной массы. Биодеградация отходов PVS сопровождалась изменением химического состава и потерей веса, составившей 19% после 30 сут инкубации (Giacomucci et al., 2019). Аналогичная активация биоразложения PVC получена в анаэробных сообществах, выделенных из морских осадков. Инкубация в течение 7 мес. привела к потере веса, составившей 11.7%, снижению термической стабильности и молекулярной массы полимера (Giacomucci et al., 2020).
Наиболее убедительные данные о способности микроорганизмов к биокоррозии пластмасс и механизмах происходящих изменений дают методы измерения повреждений синтетических пластмасс, включая FTIR, NMR, хроматомасс-спектрометрию (gas chromatography coupled with mass spectroscopy, GC–MS), а также микроскопические методы – SEM и атомную силовую микроскопию (atomic force microscopy, AFM). Отметим, что последние два метода имеют существенные недостатки, которые нужно учитывать при оценке результатов и о которых будет сказано в разделе, посвященном участию мультивидовых сообществ в биокоррозии. Эти методы позволяют обнаружить возникновение под воздействием микроорганизмов ранее не существовавших в составе полимеров функциональных групп (карбонильных, спиртовых и др.), а также изменения в самих полимерных цепях (возникновение непредельных связей, отщепление боковых групп и т.д.). Но и в этих случаях нельзя упускать из вида возможность изменений не основного скелета пластмассы, а присутствующих в ней дополнительных компонентов: компатибилизаторов, пластификаторов, стабилизаторов и др. Более подробное рассмотрение этих методов выходит за рамки данного обзора (см., например, Hakkarainen, Albertsson, 2004; Springer Handbook of Materials Measurement Methods, 2006; Vimala, Mathew, 2016).
Мы рассмотрим более подробно некоторые из последствий воздействия микроорганизмов на конкретном примере биодеградации PET, который представляет собой сополимер терефталевой кислоты и этиленгликоля и довольно чувствителен к микробному воздействию, поэтому для него биохимические превращения изучены наиболее подробно. Он содержит как кристаллические, так и аморфные участки; последние более чувствительны к воздействию ферментов. Хотя РЕТ включает эфирные связи, наличие ароматических групп делает их устойчивыми к гидролизу липазами и эстеразами (Webb et al., 2013).
Значительная часть исследований по биодеградации РЕТ проведена с изолированными ферментами при повышенных температурах для перевода кристаллической формы полимера в аморфную. Показано, что липазы, эстеразы, кутиназы, изолированные из грибов и актиномицетов, гидролизуют аморфный РЕТ и изменяют поверхность пленки, изготовленной из этого полимера. Карбоксилэстеразы из разных видов бацилл также способны частично гидролизовать волокна РЕТ. Наиболее активной оказалась термостабильная грибная кутиназа HiC из Thermomyces insolens. Под ее воздействием (96 ч, 70°С) происходит почти полный гидролиз фибрилл низкокристаллического РЕТ (Ronkvist et al., 2009). Как известно, синтетичекие полимеры состоят из кристаллических (упорядоченных) и аморфных структур. Первые более устойчивы к микробному воздействию. Изучение механизма и кинетики гидролиза РЕТ термофилом Thermobifida fusca показало, что в процессе деструкции этого пластика образуются терефталевая кислота (ТРА), этиленгликоль (EG), моно-(2-гидроксиэтил) терефталат (MNET) и бис-(2-гидроксиэтил) терефталат (BNET) (Barth et al., 2015) (рис. 3).
Рис. 3.
Основные продукты, образующиеся при гидролизе РЕТ Thermobifida fusca (по Barth et al., 2015), (аббревиатуры расшифрованы в тексте).
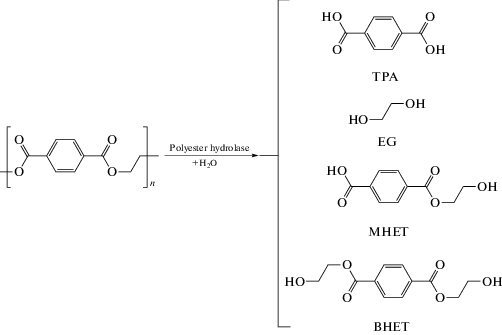
После образования этих продуктов терефталевая кислота через ряд стадий превращается в протокатеховую кислоту, которую диоксигеназа (EC 1.11.13.) каталитически расщепляет между атомами C3 и C4 ароматического кольца с образованием 3‑карбокси-цис,цис-муконовой кислоты. Последняя через стадию образования 3-оксоадипиновой кислоты превращается в сукцинил-КоА и ацетил-КоА, вступающие в цикл трикарбоновых кислот (Yoshida et al., 2016).
Путем анализа библиотеки генов растительного компоста с использованием в качестве субстрата трибутирина получен гомолог грибной кутиназы – LC-кутиназа. Этот фермент по аминокислотному составу оказался высоко гомологичен липазе Thermomonospora curvata (59.7% сходства) и кутиназе Thermobifida fusca (57.4% сходства). Она обнаружила высокую удельную активность в отношении гидролиза РЕТ (12 мг/ч/мг фермента), которая превышает величины известных до сих пор аналогичных ферментов. Поэтому она может послужить удачной моделью для анализа молекулярного механизма гидролиза РЕT, а также представляется перспективной для модификации поверхности и деградации этого полимера (Sulaimanet al., 2012).
Недостаток использования изолированных ферментов для переработки РЕТ связан с тем, что они плохо адсорбируются на гидрофобной поверхности полимера. Поэтому предпринята попытка повысить активность кутиназы из Thermobifda fusca (TfCut2) путем добавления в реакционную смесь катионного детергента, облегчающего взаимодействие фермента с поверхностью субстрата. Этот прием позволил на порядок повысить скорость превращения субстрата и добиться разложения 97% фибрилл низкокристаллического РЕТ за 30 ч инкубации. Данный подход расширяет возможности применения подобных ферментов в биотехнологических процессах утилизации отходов РЕТ (Furukawa et al., 2019).
Основные исследования, проведенные с изолированными ферментами, способными к деградации РЕТ и PUR, обобщены в недавно опубликованных обзорах и статьях (Wei, Zimmermann, 2017; Koshti et al.,2018; Liu et al., 2019).
РОЛЬ МИКРОБНЫХ БИОПЛЕНОК В ДЕГРАДАЦИИ СИНТЕТИЧЕСКИХ ПЛАСТМАСС
Большое количество исследований посвящено микробной деградации различных форм модифицированного и немодифицированного РЕТ и других синтетических пластмасс. В этих случаях первые этапы биокоррозии также осуществляют внеклеточные ферменты, но их контакт с субстратом облегчается тем, что сначала на поверхности РЕТ формируются моно- или мультивидовые сообщества (биопленки). Само по себе формирование биопленок на поверхности синтетических полимеров является только необходимым, но не достаточным условием протекания биокоррозии. Возникает вопрос, насколько сильно зависит от природы синтетической пластмассы в одинаковых внешних условиях состав и разнообразие формирующихся сообществ.
Поскольку синтетические пластмассы принципиально отличаются от природных субстратов, для экологических систем, содержащих отходы пластмасс, был даже предложен специальный термин “пластисфера” (“plastisphere”) (Zettler et al., 2013). С этого момента исследования пластисферы шли по двум направлениям. Они авторы посвящали свои работы изучению биогеографии разнообразия микробных сообществ пластисферы, другие проверяли особенности состава микрофлоры в зависимости от химической природы поверхности пластиков. Так было показано, что состав сообществ пластисферы в Атлантическом и Тихом океанах в большей степени определяется их географическим расположением, чем природой пластмасс (Amaral-Zettler et al., 2015). С другой стороны, проведено сравнение состава зрелых микробных сообществ, формирующихся на девяти различных полимерных пленках: HDPE, LDPE, PP, PS, PUR, PVC, PET, PLA, SAN (стиролакрилонитрил) и стекле при длительной инкубации (15 мес.) в естественной проточной системе с морской водой. Состав сообществ определяли с помощью секвенирования генов 16S и 18S рРНК, сопровождавшегося исследованием биопленок методом SEM (Kirstein et al., 2018). Оказалось, что биопленочные сообщества на поверхности пластиков отличаются по составу от сообщества, формирующегося на поверхности стекла. Сообщества пластисферы имеют общее доминирующее “ядро”, однако выявлено также и 13 дискриминационных таксонов, специфичных для разных полимерных субстратов. К сожалению, в большинстве исследований исключительное внимание уделяется только прокариотической части сообщества и, иногда, микромицетам. Между тем, существенную роль в формировании пластисферного сообщества могут играть фототрофные эукариоты и беспозвоночные животные, даже если они не являются его постоянными компонентами. Практически не уделяется внимания участию сигнальных (например, системы quorum sensing) и антибиопленочных компонентов, образуемых этими и другими спутниками сообщества (Antunes et al., 2019). Вообще эта область пластиферных сообществ до сих пор изучена крайне недостаточно.
Детальный анализ многочисленных, а порою и противоречивых, результатов, полученных разными группами исследователей при изучении пластисферы, не входит в задачу данного обзора, тем более, что они подробно рассмотрены в упомянутой статье (Kirstein et al., 2018). Мы остановимся только на одной из недавно опубликованных работ, в которой детально изучен состав микробных обрастаний, формирующихся на поверхности РЕТ, помещенных в водные системы различного состава в разных климатических районах. Во всех случаях показано доминирование представителей филумов Bacteroidetes, Gammaproteobacteria и Alphaproteobacteria при наличии существенных количественных различий в зависимости от времени инкубации и воздействия биоцидов. Возможность деградации образцов РЕТ предположена на основании обнаружения in silico у представителей родов Pseudomonas и Acidovorax генов, кодирующих ферменты катаболизма промежуточного продукта деградации РЕТ – терефталевой кислоты, а также подтверждена наличием повреждений поверхности пластика при исследовании методом SEM (Турова и соавт., 2020). Авторы полагают, что наблюдаемые повреждения поверхности пластика возникают в местах концентрирования микроорганизмов – активных возбудителей биокоррозии. Однако, как мы уже упоминали ранее, не менее (а может быть и более) правдоподобным выглядит альтернативное объяснение, основанное на том, что усиленный рост микроорганизмов происходит в тех местах, где уже имеются повреждения, вызванные воздействием абиотических факторов окружающей среды, либо присутствуют аморфные участки пластика, более доступные для воздействия микроорганизмов, чем кристаллические. Для выбора между этими возможностями необходимо изучение ранних стадий формирования микробных биопленок и выявление первичных колонизаторов. Как показано нами в недавней работе, повреждение поверхности РЕ определяется не общей массой сформировавшейся биопленки, а количеством содержащихся в ней метаболически активных клеток микроорганизма. Поэтому, например, мутант Chromobacterium violaceum CV026 с нарушенным синтезом матрикса оказывает почти такое же повреждающее действие на поверхность разных типов РЕ, как и штамм дикого типа, нормально формирующий биопленку (Журина и соавт., 2020a). К сожалению, изучению начальных стадий формирования биопленок на поверхности пластиков посвящены лишь единичные работы. Для исследований подобного рода удобнее использовать биопленки, реконструированные из чистых культур микроорганизмов-деструкторов пластмасс. Используя такой подход, нам удалось доказать, что первичным колонизатором разных типов РЕ в случае трехвидовых биопленок, реконструированных из заранее подобранных наиболее активных микроорганизмов-деструкторов (Kocuria rhizophila, Pseudomonas aeruginosa, Chromobacterium violaceum и Yarrowia lipolytica в разных сочетаниях), является аскомицет (Журина и соавт. 2020б).
В начальный период исследования деградации синтетических пластмасс в природных условиях авторы в основном пытались изолировать чистые или хотя бы накопительные культуры микроорганизмов, способных использовать эти ксенобиотики в качестве единственного источника углерода (Mor, Sivan, 2008; Kyaw et al., 2012; Kowalczyk et al., 2016 и др.). Уже в этих работах было замечено, что в бинарных биопленках процессы биокоррозии протекают интенсивнее, поскольку один из участников процесса может осуществлять первичную модификацию полимерной цепи, а другой “подхватывать” образующиеся промежуточные продукты. Возможно также, что первичный колонизатор способствует подключению спутника путем образования биосурфактантов (Mukherjee et al., 2015, 2018; Esmaeili et al., 2013).
В последнее время все большее распространение получает подход, основанный на реконструкции модельных микробных консорциумов из наиболее перспективных микроорганизмов-деструкторов. Во-первых, такой подход позволяет расшифровать механизмы процессов биокоррозии пластмасс, во-вторых, подобрать синергидные комбинации, которые могут оказаться перспективными для применения в процессах биоремедиации природных сред и очистки сточных вод от промышленных отходов, связанных с производством и использованием пластмасс (Jia et al., 2016; Fiore et al., 2017; Журина и соавт., 2020б).
Основные микроорганизмы и пути биодеградации РЕ и других пластмасс приведены в обзорах (Ghosh et al., 2013; Ahmed et al., 2018; Shankar et al., 2019; Montazer et al., 2020).
Особую область использования микроорганизмов для деградации отходов пластмасс представляет борьба с загрязнением окружающей среды микропластиками (о которых мы уже упоминали в данном обзоре). Эта область стала развиваться особенно бурно, когда полностью был осознан вред, приносимый микрочастицами пластмасс как низшим, так и высшим организмам экологических систем (Anbumani, Kakkar, 2018). Недавно обнаружено, что микрочастицы многих пластмасс могут встречаться не только в почве, водоемах и жилых помещениях, но и в атмосфере, в результате чего они способны распространяться на большие расстояния (Mbachu et al., 2020). Возможность воздействия микробных биопленок на частицы микропластиков рассмотрена в недавно опубликованном обзоре (Mincer et al., 2019).
ОСНОВНЫЕ СПОСОБЫ ЗАЩИТЫ СИНТЕТИЧЕСКИХ ПЛАСТМАСС ОТ БИОКОРРОЗИИ
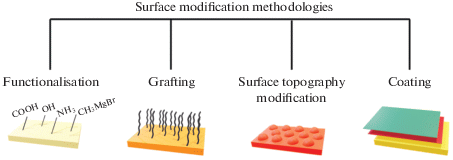
Модификация поверхности пластмасс. Существуют две основные стратегии защиты синтетических пластмасс от микробного обрастания и повреждения: во-первых, антиадгезивная модификация поверхности полимера, препятствующая прикреплению микроорганизмов и формированию ими биопленок; во вторых, введение в состав полимера антимикробных веществ, которые могут, даже не препятствуя прикреплению микроорганизмов к поверхности полимера, подавлять их дальнейший рост и оказывать биостатическое или биоцидное действие. Особенно эффективными являются вещества, которые могут сочетать оба указанных воздействия на микроорганизмы. Методологию модификации поверхности полимеров можно подразделить на четыре основных типа: “функционализацию” (functionalization), “прививку” (grafting), изменение топографии поверхности (surface topography modification) и покрытие (coating) (Çaykara et al., 2020) (рис. 4).
Функционализацию обычно осуществляют физико-химическими способами воздействия на поверхность полимера: обработкой холодной плазмой, окислителями типа озона, радиацией, гидролитическими химическими и ферментативными воздействиями. Как правило, это приводит к повышению гидрофобности и изменению поверхностной энергии полимера, препятствующей адгезии микроорганизмов.
Прививка – это способ ковалентного покрытия поверхности полимера. Возможны два варианта: “grafting to”, когда к поверхности защищаемого полимера присоединяется защитный полимер. Примером может служить хитозан, оказывающий бактериостатический и бактерицидный эффект. При методе “grafting from” к защищаемой поверхности присоединяется мономер, который затем полимеризуется в защитный полимер. Примерами могут быть химически модифицированные производные ванилина, более активные в отношении грамположительных бактерий, чем грамотрицательных. Изменение топографии (шероховатости) поверхности может изменять как ее гидрофильность, так и гидрофобность. Лазерная обработка поверхности (как органических полимеров, так и сплавов металлов) может изменять смачиваемость в десятки раз, придавая поверхности свойства супергидрофильности или супергидрофобности, сопровождающиеся антимикробной активностью, которая усиливается при адсорбции на этой поверхности бактериофагов (Boinovich et al., 2018; Kaminskii et al., 2019; Emelyanenko et al., 2020). Способы антибактериального покрытия поверхности пластмасс непрерывно совершенствуются. Они основаны на связывании с поверхностью пластмасс катионных или анионных полиэлектролитных соединений с образованием тонких пленок. Для этого можно, например, использовать комплекс хитозана и гиалуроновой кислоты (Del Hoyo-Gallego et al., 2016). Другие возможности антимикробной защиты поверхности пластмасс, в том числе посредством использования наноструктур, детально рассмотрены в недавно опубликованной монографии (Engineered Antimicrobial Surfaces, 2020).
Композитные синтетичесике пластмассы. Принципиально новое направление модернизации свойств пластмасс, в том числе придания им антимикробных свойств, заключается в разработке методов получения так называемых “(нано)композитных” полимеров. Этот подход основан на сочетании в одном материале свойств нескольких полимеров с использованием, в частности, уже упомянутых нами компартментализаторов. Ранние работы в этой области обобщены в нескольких монографиях и обзорах (Lipatov, Alekseeva, 2007; Wax Crystal Control Nanocomposites…, 2008; Jones, 2009). Развитие данного направления позволило получить пластмассы с совершенно новыми свойствами, в частности, позволяющими осуществлять направленую “доставку” лекарственных веществ к их мишеням (одна из разновидностей “таргетной терапии”) (Campbell, Smeets, 2019; Ozcelikay, 2019). К настоящему времени композитные материалы получили очень большую популярность в различных областях технологии, в том числе и для защиты пластмасс от биокоррозии (Prasanth et al., 2015; Mohammed, Billah, 2019). Среди многих испытанных в качестве добавок антимикробных соединений хорошо зарекомендовали себя гуанидинсодержащие высокомолекулярные соединения (Меняшев и соавт., 2016). Очевидно, что для предотвращения микробного повреждения пластика, вводимые в него биоциды должны обладать антибиопленочным эффектом, поскольку формирование биопленок является, как мы уже отмечали, необходимым (хотя и не достаточным) условием проявления биокоррозии. Действительно, полученные на основе сополимера метакрилоилгуанидин гидрохлорида с N,N-диаллил-N,N-диметиламмоний хлоридом, иммобилизованным на минерале группы смектитов – монтмориллоните, композитные материалы обнаружили антибиопленочную активность (Герасин и соавт., 2018). Использование слоистых силикатов находит широкое применение для изготовления композитных полимеров, поскольку позволяет получить гомогенные смеси и предотвратить (или замедлить) вымывание биоцидного компонента (Ambrogi et al., 2017). При подборе антибиопленочного агента желательно руководствоваться принципами, сформулированными в недавней дискуссионной работе (Плакунов и соавт., 2019), а также использовать усовершенствованные методы анализа роста биопленок и количества содержащихся в них метаболически активных микроорганизмов (Плакунов и соавт., 2016). Применяя эти подходы, нам удалось показать, что гидрохлоридная соль полигексаметиленгуанидина, сополимер метакрилоильной производной гидрохлорида гуанидина с диаллильной производной диметиламмоний хлорида, а также сополимер метакрилоильного производного гуанидина с полиметакриламидом, введенные в HDPE, не влияют на рост планктонных культур изученных микроорганизмов. При этом они оказывают выраженное антибиопленочное действие на формирование и созревание биопленок как грамположительных, так и грамотрицательных бактерий, а также аскомицета Yarrowia lipolytica (Журина и соавт., 2020b). Таким образом, изученные производные гуанидина оказались перспективными антибиопленочными агентами, пригодными для защиты РЕ от биокоррозии, вызываемой мультивидовыми микробными биопленками.
Список литературы
Герасин В.А., Бахов Ф.Н., Мерекалова Н.Д., Королев Ю.М., Fischer H.R., Антипов Е.М. Структура формирующихся на Na+-монтмориллоните слоев поверхностно-активных веществ и совместимость модифицированной глины с полиолефинами // Высокомолекулярные соединения. Серия А. 2005. Т. 47. С. 1635–1651.
Gerasin V.A., Bakhov F.N., Merekalova N.D., Korolev Yu.M., Fischer H.R., Antipov E.M. Structure of surfactant layers formed on Na+ montmorillonite and compatibility of the modified clay with polyolefins // Polymer Sci. Ser. A. (Moscow). 2005. V. 47. P. 954–967.
Герасин В.А., Менделеев Д.И., Куренков В.В., Меняшев М.Р. Гуанидинсодержащие органоминеральные комплексы как биоцидные добавки для полимерных композитов // Журн. прикл. химии. 2018. Т. 91. С. 1139–1147.
Gerasin V.A., Mendeleev D.I., Kurenkov V.V. Menyashev M.R. Guanidine-containing organomineral complexes as biocide additives to polymeric composites // Russian J. Appl. Chem. 2018. V. 91. P. 1297−1304.
Журина М.В., Ганнесен А.В., Мартьянов С.В., Плакунов В.К. Экспресс-метод определения взаимосвязи биокоррозии полиэтилена биопленками Chromobacterium violaceum с их способностью формировать внеклеточный полимерный матрикс // Микробиология. 2020а. Т. 89. С. 52–58.
Zhurina M.V., Gannesen A.V., Martyanov S.V., Plakunov V.K. Express method for determining the relation between polyethylene biocorrosion by Chromobacterium violaceum biofilms and their ability to form extracellular matrix // Microbiology (Moscow). 2020a. V. 89. P. 44–49.
Журина М.В., Каллистова А.Ю., Панюшкина А.Е., Ганнесен А.В., Мартьянов С.В., Герасин В.А., Сивов Н.А., Тихомиров В.А., Плакунов В.К. Специфика формирования мультивидовых микробных биопленок на поверхности полиэтилена // Микробиология. 2020б. Т. 89. С. 400–409.
Zhurina M.V., Kallistova A.Yu., Panyushkina A.E., Gannesen A.V., Mart’yanov S.V., Gerasin V.A., Sivov N.A., Tikhomirov V.A., Plakunov V.K. Specific features of formation of multispecies microbial biofilms on polyethylene surface // Microbiology (Moscow). 2020b. V. 89. P. 396−404.
Меняшев М.Р., Мартыненко А.И., Попова Н.И., Клещева Н.А., Сивов Н.А. Метакрилатгуанидин и метакрилоилгуанидин гидрохлорид: синтез и полимеризация // Высокомолекулярные соединения. Серия Б. 2016. Т. 58. С. 394–401.
Menyashev M.R., Martynenko A.I., Popova N.I., Kleshcheva N.A., Sivov N.A. Guanidine methacrylate and methacryloyl guanidine hydrochloride: synthesis and polymerization // Polymer Sci. Ser B. 2016. V. 58. P. 556–563.
Турова Т.П., Соколова Д.Ш., Семенова Е.М., Шумкова Е.С., Коршунова А.В., Бабич Т.Л., Полтараус А.Б., Назина Т.Н. Детекция генов деградации н-алканов alkB и ladA у термофильных углеводородокисляющих бактерий родов Aeribacillus и Geobacillus // Микробиология. 2016. Т. 85. С. 676–692.
Tourova T.P., Sokolova D.Sh., Semenova E.M., Shumkova E.S., Korshunova A.V., Babich T.L., Poltaraus A.B., Nazina T.N. Detection of n-alkane biodegradation genes alkB and ladA in thermophilic hydrocarbon-oxidizing bacteria of the genera Aeribacillus and Geobacillus // Microbiology (Moscow). 2016. V. 85. P. 693–707.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484–480.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Плакунов В.К., Журина М.В., Ганнесен А.В., Мартьянов С.В., Николаев Ю.А. Антибиопленочные агенты: неоднозначность терминологии и стратегия поиска // Микробиология. 2019. Т. 88. С. 705–709.
Plakunov V.K., Zhurina M.V., Gannesen A.V., Mart’yanov S.V., Nikolaev Yu.A. Antibiofilm agents: therminological ambiguity and strategy for search // Microbiology (Moscow). 2019. V. 88. P. 747–750.
Турова Т.П., Соколова Д.Ш., Назина Т.Н., Груздев Д.С., Лаптев А.Б. Филогенетическое разнообразие микробных сообществ с поверхности полиэтилентерефталатных материалов при экспозиции в водных средах // Микробиология. 2020. Т. 89. С. 99–110.
Tourova T.P., Sokolova D.Sh., Nazina T.N., Gruzdev D.S., Laptev A.B. Phylogenetic diversity of microbial communities from the surface of polyethylene terephthalate materials exposed to different water environments // Microbiology (Moscow). 2020. V. 89. P. 96–106.
Adamcová D., Zloch J., Brtnický M., Vaverková M.D. Biodegradation/disintegration of selected range of polymers: impact on the compost guality // J. Polymer. Environ. 2019. V. 27. P. 892–899.
Ajji A. Interphase and compatibilization by addition of a compatibilizer // Polymer Blends Handbook / Eds. Utra-cki L.A, Wilkie C.A. Dordrecht: Springer Science + Business Media, 2014. P. 448–501.
Agamuthu P., Faizura P.N. Biodegradability of degradable plastic waste // Waste Manag Res. 2005. V. 23. P. 95–100.
Ahmed T., Shahid M., Azeem F., Rasul I., Shah A.A., Noman M., Hameed A., Manzoor N., Manzoor I., Muhammad S. Biodegradation of plastics: current scenario and future prospects for environmental safety // Environ. Sci. Pollut. Res. Int. 2018. V. 25. P. 7287–7298.
Ali M.I., Ahmed S., Robson G., Javed I., Ali N., Atiq N., Hameed A. Isolation and molecular characterization of polyvinyl chloride (PVC) plastic degrading fungal isolates // J. Basic Microbiol. 2014. V. 54. P. 18–27.
Amaral-Zettler L.A., Zettler E.R., Slikas B., Boyd G.D., Melvin D.W., Morrall C.E., Proskurowski G., Mincer T.J. The biogeography of the plastisphere: implications for policy // Front. Ecol. Environ. 2015. V. 13. P. 541–546.
Ambrogi V., Pietrella D., Nocchetti M., Casagrande S., Moretti V., De Marco S., Ricci M. Montmorillonite–chitosan–c-hlorhexidine composite films with antibiofilm activity and improved cytotoxicity for wound dressing // J. Colloid Interface Sci. 2017. V. 491. P. 265–272.
Anbumani S., Kakkar P. Ecotoxicological effects of microplastics on biota: a review // Environ. Sci. Pollut. Res. Int. 2018. V. 25. P. 14373–14396. https://doi.org/10.1007/s11356-018-1999-x
Antunes J., Leão P., Vasconcelos V. Review: marine biofilms: diversity of communities and of chemical cues // Environ. Microbiol. Rep. 2019. V. 11. P. 287–305.
Aravinthan A., Arkatkar A., Juwarkar A.A., Doble M. Synergistic growth of Bacillus and Pseudomonas and its degradation potential on pretreated polypropylene // Prep. Biochem. Biotechnol. 2016. V. 46. P. 109–115.
Auta H.S., Emenike C.U., Jayanthi B., Fauziah S.H. Growth kinetics and biodeterioration of polypropylene microplastics by Bacillus sp. and Rhodococcus sp. isolated from mangrove sediment // Mar. Pollut. Bull. 2018. V. 127. P. 15–21.
Barth M., Oeser T., Wei R., Then J., Schmidt J., Zimmermann W. Effect of hydrolysis products on the enzymatic degradation of polyethylene terephthalate nanoparticles by a polyester hydrolase from Thermobifida fusca // Biochem. Engin. J. 2015. V. 93. P. 222–228.
Bashir I., Lone F.A., Bhat R.A., Mir S.A., Dar Z.A., Dar S.A. Concerns and threats of contamination on aquatic ecosystems // Bioremediation and Biotechnology / Eds. Hakeem K., Bhat R., Qadri H. Springer Nature Switzerland AG, 2020. P. 1–26.
Berto D., Rampazzo F., Gion C., Noventa S., Ronchi F., Traldi U., Giorgi G., Cicero A.M., Giovanardi O. Preliminary study to characterize plastic polymers using elemental analyser/isotope ratio mass spectrometry (EA/IRMS) // Chemosphere. 2017. V. 176. P. 47–56.
Biodeteriation Research 3. Mycotoxins, Biotoxins, Wood Decay, Air Quality, Cultural Properties, General Biodeterioration, and Degradation / Eds. Llewellyn G.C., O’Rear C.E. Washington: Pan American Biodeterioration Society, 1990. 689 p.
Boinovich L.B., Modin E.B., Aleshkin A.V., Emelyanenko K.A., Zulkarneev E.R., Kiseleva I.A., Vasiliev A.L, Emelyanenko A.M. Effective antibacterial nanotextured surfaces based on extreme wettability and bacteriophage seeding // ACS Appl. Nano. Mater. 2018. V. 1. P. 1348–1359.
Campbell S., Smeets N. Drug delivery: localized and systemic therapeutic strategies with polymer systems // Functional Polymers (Polymers and Polymeric Composites) / Eds. Mazumder M. Abu Jafar, Sheardown H., Al-Ahmed A.. 1st ed. Springer: 2019. P. 3–56.
Çaykara T., Sande M.G., Azoia N., Rodrigues L.R., Silva C.J. Exploring the potential of polyethylene terephthalate in the design of antibacterial surfaces // Med. Microbiol. Immunol. 2020. V. 209. P. 363–372.
Ceci A., Pinzari F., Russo F., Persiani A.M, Gadd G.M. Roles of saprotrophic fungi in biodegradation or transformation of organic and inorganic pollutants in co-contaminated sites // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 53–68.
Ciardelli F., Bronco S., Bertoldo M., Passaglia E. The obtainment of bioplastics // Polymers from Fossil and Renewable Resources. Springer Nature Switzerland AG, 2019. P. 107–132.
Danko A.S., Luo M., Bagwell C.E., Brigmon R.L., Freedman D.L. Involvement of linear plasmids in aerobic biodegradation of vinyl chloride // Appl. Environ. Microbiol. 2004. V. 70. P. 6092–6097.
Del Hoyo-Gallego S., Pérez-Álvarez L., Gómez-Galván F., Lizundia E., Kuritka I., Sedlarik V., Laza J.M., Vila-Vilela J.L. Construction of antibacterial poly(ethylene terephthalate) films via layer by layer assembly of chitosan and hyaluronic acid // Carbohydr. Polym. 2016. V. 143. P. 35–43.
Devi R.S., Kannan V.R., Natarajan K., Nivas D., Kannan K., Chandru S., Antony A.R. The role of microbes in plastic degradation // Environmental Waste Management / Ed. Ram Chandra. Taylor & Francis Group, LLC, 2016. P. 341–370.
Emelyanenko A.M., Kaminskii V.V., Pytskii I.S., Domantovsky A.G., Emelyanenko K.A., Aleshkin A.V., Boinovich L.B. Antibacterial properties of superhydrophilic textured copper in contact with bacterial suspensions // Bull. Exp. Biol. Med. 2020. V. 168. P. 488–491.
Engineered Antimicrobial Surfaces / Eds. Snigdha S., Thomas S., Radhakrishnan E.K., Kalarikkal N. Springer Nature Singapore Pte. Ltd., 2020. 163 p.
Esmaeili A., Pourbabaee A.A., Alikhani H.A., Shabani F., Esmaeili E. Biodegradation of low-density polyethylene (LDPE) by mixed culture of Lysinibacillus xylanilyticus and Aspergillus niger in soil // PLoS One. 2013. V. 8. Art. e71720.
European Bioplastics. 2015. “Oxo-biodegradable” plastics and other plastics with additives for degradation. https://docs.european-bioplastics.org/publications/bp/ EUBP_BP_Additive-mediated_plastics.pdf.
Fesseha H., Abebe F. Degradation of plastic materials using microorganisms: a review // Public Health Open J. 2019. V. 4. P. 57–63.
Fiore G., Matyjaszkiewicz A., Annunziata F., Grierson C., Savery N.J., Marucci L., di Bernardo M. In-silico analysis and implementation of a multicellular feedback control strategy in a synthetic bacterial consortium // ACS Synth. Biol. 2017. V. 6. P. 507–517.
Furukawa M., Kawakami N., Tomizawa A., Miyamoto K. Efficient degradation of poly(ethylene terephthalate) with Thermobifda fusca cutinase exhibiting improved catalytic activity generated using mutagenesis and additive-based approaches // Sci. Rep. 2019. V. 9. Art. 16038. https://doi.org/10.1038/s41598-019-52379-z
Ghosh S.K., Pal S., Ray S. Study of microbes having potentiality for biodegradation of plastics // Environ. Sci. Pollut. Res. 2013. V. 20. P. 4339–4355.
Giacomucci L., Raddadi N., Soccio M., Lotti N., Fava F. Polyvinyl chloride biodegradation by Pseudomonas citronellolis and Bacillus flexus // New Biotechnol. 2019. V. 52. P. 35–41.
Giacomucci L., Raddadi N., Soccio M., Lotti N., Fava F. Biodegradation of polyvinyl chloride plastic films by enriched anaerobic marine consortia // Mar. Environ. Res. 2020. V. 158. Art. 104949.
Gravouil K., Ferru-Clément R., Colas S., Helye R., Kadri L., Bourdeau L., Moumen B., Mercier A., Ferreira T. Transcriptomics and lipidomics of the environmental strain Rhodococcus ruber point out consumption pathways and potential metabolic bottlenecks for polyethylene degradation // Environ. Sci. Technol. 2017. V. 51. P. 5172–5181.
Hakkarainen M., Albertsson A.-C. Environmental degradation of polyethylene // Long Term Properties of Polyolefins. Ed. Albertsson A.C. / Advances in Polymer Science. V. 169. Berlin, Heidelberg: Springer, 2004. P. 177–200.
Harrison J.P., Boardman C., O’Callaghan K., Delort A.M., Song J. Biodegradability standards for carrier bags and plastic films in aquatic environments: a critical review // R. Soc. Open. Sci. 2018. V. 5. Art. 171792.
Ho B.T., Roberts T.K., Lucas S. An overview on biodegradation of polystyrene and modified polystyrene: the microbial approach // Crit. Revs. Biotechnol. 2018. V. 38. P. 308–320.
Jeyakumar D., Chirsteen J., Doble M. Synergistic effects of pretreatment and blending on fungi mediated biodegradation of polypropylenes // Bioresour. Technol. V. 148. P. 78 –85.
Jeon H.J., Kim M.N. Functional analysis of alkane hydroxylase system derived from Pseudomonas aeruginosa E7 for low molecular weight polyethylene biodegradation // Int. Biodeterior. Biodegrad. 2015. V. 103. P. 141–146.
Jeon H.J., Kim M.N. Isolation of mesophilic bacterium for biodegradation of polypropylene // Int. Biodeterior. Biodegrad. 2016. V. 115. P. 244–249.
Jia X., Liu C., Song H., Ding M., Du J., Ma Q., Yuan Y. Design, analysis and application of synthetic microbial consortia // Synth. Syst. Biotechnol. 2016. V. 1. P. 109–117.
Jones A. Choosing antimicrobial additives for plastics // Plastics Additiv. Compound. 2009. V. 11. P. 26–28.
Iram D., Riaz R., Iqbal R.K. Usage of potential microorganisms for degradation of plastics // Open J. Environ. Biol. 2019. OJEB-4-110.
Kaminskii V.V., Aleshkin A.V., Zul’karneev E.R., Zatevalov A.M., Kiseleva I.A., Efimova O.G., Emelyanenko K.A., Emelyanenko A.M., Boinovich L.B. Development of a bacteriophage complex with superhydrophilic and superhydrophobic nanotextured surfaces of metals reventing healthcare-associated infections (HAI) // Bull. Exp. Biol. Med. 2019. V. 167. P. 488–492.
Kirstein I.V., Wichels A., Krohne G., Gerdts G. Mature biofilm communities on synthetic polymers in seawater – specific or general? // Marine Environ. Res. 2018. V. 142. P. 147–154.
Koshti R., Mehta L. Samarth N. Biological recycling of polyethylene terephthalate: a mini-review // J. Polym. Environ. 2018. V. 26. P. 3520–3529.
Kowalczyk A., Chyc M., Ryszka P., Latowski D. Achromobacter xylosoxidans as a new microorganism strain colonizing high-density polyethylene as a key step to its biodegradation // Environ. Sci. Pollut. Res. 2016. V. 23. P. 11349–11356.
Kulkarni A., Dasari H. Current status of methods used in degradation of polymers: a review // MATEC Web of Conferences. 2018. V. 144. № 8. Art. 02023.
Kyaw B.M., Champakalakshmi R., Sakharkar M.K., Lim C.S., Sakharkar K.R. Biodegradation of low density polythene (LDPE) by Pseudomonas species // Indian J. Microbiol. 2012. V. 52. P. 411–419.
Lipatov Y.S., Alekseeva T.T. Phase-separated interpenetrating polymer networks // Adv. Polym. Sci. 2007. V. 208. P. 1–227.
Liu C., Shi C., Zhu S., Wei R., Yin C.C. Structural and functional characterization of polyethylene terephthalate hydrolase from Ideonella sakaiensis // Biochem. Biophys. Res. Commun. 2019. V. 508. P. 289–294.
Lucas N., Bienaime C., Belloy C., Queneudec M., Silvestre F., Nava-Saucedo J.E. Polymer biodegradation: mechanisms and estimation techniques // Chemosphere. 2008. V. 73. P. 429–442.
Markovic.G., Visakh P.M. Polymer blends: state of art // Recent developments in polymer macro, micro and nano blends / Eds. Visakh P.M., Markovic G., Pasquini D. Elsevier Ltd., 2017. P. 1–15.
Mbachu O., Jenkins G., Pratt C., Kaparaju P. A new contaminant superhighway? A review of sources, measurement techniques and fate of atmospheric microplastics // Water Air and Soil Pollution. 2020. V. 231. Art. 85. https://doi.org/10.1007/s11270-020-4459-4
Mierzwa-Hersztek M., Gondek K., Kopeć M. Degradation of polyethylene and biocomponent-derived polymer materials: an overview // J. Polymer. Environ. 2019 V. 27. P. 600–611.
Mincer T.J., Zettler E.R., Amaral-Zettler L.A. Biofilms on plastic debris and their influence on marine nutrient cycling, productivity, and hazardous chemical mobility // Hazardous Chemicals Associated with Plastics in the Marine Environment / Eds. Takada H., Karapanagioti H. The Handbook of Environmental Chemistry, vol 78. Springer International Publishing Switzerland, 2019. P. 221–234.
Montazer Z., Habibi Najafi M.B., Levin D.B. Challenges with verifying microbial degradation of polyethylene // Polymers (Basel). 2020. V. 12. P. 123.
Moreno R., Rojo F. Enzymes for aerobic degradation of alkanes in bacteria // Aerobic utilization of hydrocarbons, oils, and lipids / Ed. F. Rojo. Handbook of Hydrocarbon and Lipid Microbiology. Springer Nature Switzerland AG, 2019. P. 118–142.
Mor R., Sivan A. Biofilm formation and partial biodegradation of polystyrene by the actinomycete Rhodococcus ruber // Biodegradation. 2008. V. 19. P. 851–858.
Mohammed S., Billah R. Composites and nanocomposites // Functional Polymers (Polymers and Polymeric Composites) / Eds. Abu Jafar Mazumder M., Sheardown H., Al-Ahmed A.. 1st ed. Springer, 2019. P. 449–512. https://doi.org/10.1007/978-3-319-95987-0_15
Muhonja C.N., Makonde H., Magoma G., Imbuga M. Biodegradability of polyethylene by bacteria and fungi from dandora dumpsite Nairobi-Kenya // PLoS One. 2018 V. 13. Art. e0198446.
Mukherjee S., Kundu P.P. Alkaline fungal degradation of oxidized polyethylene in black liquor: studies on the effect of lignin peroxidases and manganese peroxidases // J. Appl. Polym. Sci. 2014. V. 131. P. 40738.
Mukherjee S., RoyChaudhuri U., Kundu P.P. Biodegradation of polyethylene waste by simultaneous use of two bacteria: Bacillus licheniformis for production of bio-surfactant and Lysinibacillus fusiformis for biodegradation // RSC Advances. 2015. V. 6. P. 2982–2992.
Mukherjee S., RoyChaudhuri U., Kundu P.P. Biodegradation of polyethylene via complete solubilization by the action of Pseudomonas fluorescens, biosurfactant produced by Bacillus licheniformis and anionic surfactant // J. Chem. Tech. Biotechnol. 2018. V. 93. P. 1300–1311.
Otake Y., Kobayashi T., Asabe H., Murakami N., Ono K. Biodegradation of low-density polyethylene, polystyrene, polyvinyl chloride, and urea formaldehyde resin buried under soil for over 32 years // J. Appl. Polymer Sci. 1995. V. 56. P. 1789–1796.
Ozcelikay G., Esim O., Bakirhan N.K., Savaser A., Ozkan Y., Ozkan S.A. Biocompatible nanopolymers in drug delivery systems and their recent electrochemical applications in drug assays // Handbook of Polymer and Ceramic Nanotechnology / Eds. Hussain C.M., Thomas S. Springer Nature Switzerland AG, 2019. P. 2–20.
Padervand M., Lichtfouse E., Robert D., Wang C. Removal of microplastics from the environment: a review // Environ. Chem. Lett. 2020. V. 18. P. 807–828.
Prasanth R., Owuor P., Shankar R., Joyner J., Kosolwattana S., Jose S.P., Dong P., Thakur V.K, Cho J.H., Shelke M. Eco-friendly polymer-layered silicate nanocomposite – preparation, chemistry, properties, and applications // Eco-friendly Polymer Nanocomposites. Advanced Structured Materials / Eds. Thakur V.K.,Thakur M.K. New Delhi–Heidelberg–New York–Dordrecht–London: Springer, 2015. P. 1–42.
Raddadi N., Fava F. Biodegradation of oil-based plastics in the environment: Existing knowledge and needs of research and innovation // Sci. Total Environ. 2019. V. 679. P. 148–158.
Raddadi N., Soccio M., Lotti N., Fava F. Biodegradation of polyvinyl chloride plastic films by enriched anaerobic marine consortia // Marine Environ. Res. 2020. V. 158. Art. 104949.
Ragaert K., Delva L., Van Geem K. Mechanical and chemical recycling of solid plastic waste // Waste Manag. 2017. V. 69. P. 24–58.
Robledo-Ortíz J.R., González-López M.E., Rodrigue D., Gutiérrez-Ruiz J.F., Prezas-Lara F., Pérez-Fonseca A.A. Improving the compatibility and mechanical properties of natural fibers/green polyethylene biocomposites produced by rotational molding // J. Polymer. Environ. 2020. V. 28. P. 1040–1049.
Ronkvist A.S.M., Xie W., Lu W., Gross R.A. Cutinase-catalyzed hydrolysis of poly(ethylene terephthalate) // Macromolecules. 2009. V. 42. P. 5128–5138.
Roohi, Bano K., Kuddus M., Zaheer M.R., Zia Q., Khan M.F., Ashraf G.M., Gupta A., Aliev G. Microbial enzymatic degradation of biodegradable plastics // Curr. Pharm. Biotechnol. 2017. V. 18. P. 1–12.
Sangale M.K., Shahnawaz M., Ade A.B. A Review on biodegradation of polythene: the microbial approach // J. Bioremed. Biodeg. 2012. V. 3. Art. 164. https://doi.org/10.4172/2155-6199.1000164
Shankar S., Singh S., Mishra A., Sharma M., Bir S. Microbial degradation of polyethylene: recent progress and challenges // Microbial Metabolism of Xenobiotic Compounds / Ed. Arora P.K.. Springer Nature Singapore Pte. Ltd., 2019. P. 245–262.
Sharma S.R. Bioremediation of polythenes and plastics: a microbial approach // Approaches in Bioremediation. Nanotechnology in the Life Sciences / Eds. Prasad R., Aranda E. Springer Nature Switzerland AG, 2018. P. 97–114.
Sheel A., Pant D. Microbial depolymerization // Waste Bioremediation, Energy, Environment, and Sustainability / Eds.Varjani S.J., Gnansounou E., Baskar G., Pant D., Zakaria Z.A. Springer Nature Singapore Pte Ltd., 2018. P. 61–103.
Springer Handbook of Materials Measurement Methods / Eds. Czichos H., Saito T., Smith L. Springer-Verlag Berlin Heidelberg: Springer Science + Business Media, Inc., 2006. 1207 p.
Stroganova V.F., Kukolevaa D.A., Akhmetshin A.S., Stroganov I.V. Biodeterioration of polymers and polymer composite materials // Polymer Science, Ser. D. Glues and Sealing Materials. 2009. V. 2. № 3. P. 164–166.
Sulaiman S., Yamato S., Kanaya E., Kim J.J., Koga Y., Takano K., Kanaya S. Isolation of a novel cutinase homolog with polyethylene terephthalate-degrading activity from leaf-branch compost by using a metagenomic approach // Appl. Environ. Microbiol. 2012. V. 78. P. 1556–1562.
Tian L., Kolvenbach B., Corvini N., Wang S., Tavanaie N., Wang L., Ma Y., Scheu S., Corvini P.F. Mineralization of 14C-labelled polystyrene plastics by Penicillium variabile after ozonation pre-treatment // N. Biotechnol. 2017. V. 38. P.101–105. https://doi.org/10.1016/j.nbt.2016.07.008
Vignali E., Tonin F., Pollegioni L., Rosini E. Characterization and use of a bacterial lignin peroxidase with an improved manganese-oxidative activity // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 10579–10588. https://doi.org/10.1007/s00253-018-9409-3
Vimala P.P., Mathew L. Biodegradation of polyethylene using Bacillus subtilis / Procedia Technology. 2016. V. 24. P. 232–239. https://doi.org/10.1016/j.protcy.2016.05.031
Wax Crystal Control Nanocomposites Stimuli-Responsive Polymers / Eds. Aoshima S., Kanaoka S. Berlin–Heidelberg: Springer-Verlag, 2008. 215 p.
Webb H.K., Arnott J., Crawford R.J., Ivanova E.P. Plastic degradation and its environmental implications with special reference to poly(ethylene terephthalate) // Polymers. 2013. V. 5. P. 1–18.
Wei R., Zimmermann W. Microbial enzymes for the recycling of recalcitrant petroleum-based plastics: how far are we? // Microbial Biotechnol. 2017. V. 10. P. 1308–1322.
Wilkes R.A., Aristilde L. Degradation and metabolism of synthetic plastics and associated products by Pseudomonas sp.: capabilities and challenges // J. Applied. Microbiol. 2017. V. 123. P. 582–593.
Yang Y., Yang J., Wu W.M., Zhao J., Song Y., Gao L., Yang R., Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 1. Chemical and physical characterization and isotopic tests // Environ. Sci. Technol. 2015. V. 49. P. 12080–12086.
Yang Y., Yang J., Wu W.M., Zhao J., Song Y., Gao L., Yang R., Jiang L. Biodegradation and mineralization of polystyrene by plastic-eating mealworms: Part 2. Role of gut microorganisms // Environ. Sci. Technol. 2015. V. 49. P. 12087–12093.
Yoshida S., Hiraga K., Takehana T., Taniguchi I., Yamaji H., Maeda Y., Toyohara K., Miyamoto K., Kimura Y., Oda K. A bacterium that degrades and assimilates poly(ethylene terephthalate) // Science. 2016. V. 353. P. 759–759.
Yuan J., Ma J., Sun Y., Zhou T., Zhao Y., Yu F. Microbial degradation and other environmental aspects of microplastics/plastics // Sci. Total Environ. 2020. V. 715. Art. 136968. https://doi.org/10.1016/j.scitotenv.2020.136968
Zettler E.R., Mincer T.J., Amaral-Zettler L.A. Life in the “plastisphere”: microbial communities on plastic marine debris // Environ. Sci. Technol. 2013. V. 47. P. 7137–7146.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология