Микробиология, 2021, T. 90, № 1, стр. 90-99
Биовыщелачивание медно-цинкового концентрата с высоким содержанием мышьяка
Ю. А. Елкина a, b, В. С. Меламуд b, А. Г. Булаев a, b, *
a Московский государственный университет им. М.В. Ломоносова, Биологический факультет
119192 Москва, Россия
b Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: bulaev.inmi@yandex.ru
Поступила в редакцию 22.01.2020
После доработки 08.07.2020
Принята к публикации 16.07.2020
Аннотация
Целью работы являлось изучение зависимости скорости биовыщелачивания меди и цинка из мы-шьяксодержащего медно-цинкового концентрата, содержащего 16% Cu, 5.3% Zn и 1.36% As, от температуры и присутствия в среде органического источника углерода (дрожжевого экстракта). Основными минералами концентрата были халькопирит (CuFeS2), теннантит (Cu12As4S13), сфалерит (ZnS) и пирит (FeS2). В работе использовалась смешанная культура умеренно-термофильных ацидофильных микроорганизмов, окисляющих серу и двухвалентное железо, состоящая из штаммов Acidithiobacillus caldus MBC-1, Sulfobacillus thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1. Эксперименты проводили в колбах со 100 мл минеральной среды и 2 г концентрата на ротационной качалке в течение 30 сут при температурах от 40 до 60°C. Было показано, что скорость выщелачивания меди зависела и от температуры, и от присутствия дрожжевого экстракта. Так, степень выщелачивания меди возрастала с увеличением температуры, а степень выщелачивания цинка зависела от температуры в меньшей степени. При этом в присутствии органического источника углерода в среде биовыщелачивание и меди, и цинка происходило активно при высоких температурах (55 и 60°C), тогда как в экспериментах со средой без дрожжевого экстракта активность выщелачивания цветных металлов из концентрата при данных температурах была гораздо ниже. В то же время при температурах 40–50°C активность выщелачивания в меньшей степени зависела от присутствия в среде органического источника углерода.
Биогидрометаллургические технологии, широко применяемые в промышленном масштабе для извлечения благородных (золото, серебро) и цветных (медь, никель, цинк, уран) металлов из сульфидных руд и концентратов и основанные на процессах окисления сульфидных минералов ацидофильными железо- и сероокисляющими микроорганизмами, подразделяются на технологии кучного и чанового (реакторного) биовыщелачивания (Johnson, 2014; Булаев и соавт., 2016). Нужно отметить, что из-за относительно высоких затрат реакторное биоокисление обычно применяется для извлечения из концентратов благородных металлов, тогда как переработку концентратов цветных металлов обычно выгоднее осуществлять с помощью пирометаллургических технологий (Булаев и соавт., 2016; World Copper Factbook, 2017; Pietrzyk, Tora, 2018). При этом для извлечения цветных металлов обычно используется кучное биовыщелачивание, которое позволяет рентабельно перерабатывать бедные руды цветных металлов благодаря низкой себестоимости процесса, не требующего сложного аппаратурного оформления (Gentina, Acevedo, 2013; Johnson, 2014; Булаев и соавт., 2016).
Практика применения биогидрометаллургических технологий показывает, что реакторное биовыщелачивание может успешно применяться для извлечения цветных металлов из концентратов, которые не могут быть переработаны пирометаллургическими методами из-за особенностей состава (относительно низкое содержание ценных компонентов, наличие примесей, которые невозможно удалить на этапе обогащения, высокое содержание токсичных элементов) (Булаев и соавт., 2016). Например, было продемонстрировано, что реакторное биовыщелачивание может быть успешно использовано для переработки сульфидных концентратов, содержащих кобальт, никель, медь и цинк (Morin, d’Hugues, 2007; Gericke et al., 2009; Neale et al., 2017).
Одной из причин, которая вынуждает использовать гидрометаллургические технологии (в том числе биовыщелачивание) для переработки руд и концентратов цветных металлов, является высокое содержание мышьяка (Marsden, House, 2006; Neale et al., 2017). Например, золотосодержащие концентраты часто содержат минерал арсенопирит (FeAsS), поэтому при их переработке с помощью пирометаллургических технологий (обжига) возникают проблемы с газовыми выбросами, полная очистка которых от высокотоксичных летучих оксидов мышьяка As2O3 и As4O6, образующихся при обжиге, представляет собой технологическую проблему (Marsden, House, 2006). Поэтому для их переработки повсеместно используются технологии реакторного биоокисления и автоклавного окисления, которые позволяют избегать образования токсичных газовых выбросов (Marsden, House, 2006; Mahmoud et al., 2017). В Финляндии существует предприятие, которое использует реакторное биовыщелачивание для извлечения никеля и кобальта из сульфидного концентрата. Так как концентрат содержит около 1.5% мышьяка, его нельзя направлять на пирометаллургическую переработку, и поэтому для его переработки используется реакторное биовыщелачивание (Neale et al., 2017).
Перспективной областью для применения биогидрометаллургических методов может быть переработка мышьяксодержащих руд и концентратов меди. Наиболее распространeнным минералом меди, обладающим и наибольшим значением для металлургии, является сульфидный минерал халькопирит (CuFeS2). Халькопиритные концентраты, получаемые из сульфидных руд с помощью флотационного обогащения, обладающие достаточно высоким содержанием меди и не содержащие большого количества примесей, могут успешно перерабатываться с помощью пирометаллургических технологий (Watling, 2006; Baba et al., 2012). Однако, из многих медных руд из-за особенностей минерального состава не всегда возможно получить концентраты, полностью отвечающие требованиям для пирометаллургической переработки. Так, проблемой является присутствие в рудах сульфидных минералов меди, содержащих мышьяк, например энаргита (Cu3AsS4) и теннантита (Cu12As4S13) (Filippou et al., 2007; Diaz et al., 2018). В ряде работ было исследовано биовыщелачивание медных руд и концентратов, содержащих мышьяк (Diaz et al., 2018). В частности, в одной из работ исследовали биовыщелачивание концентрата, содержащего энаргит при температурах 35 и 68°C мезофильными и термофильными микроорганизмами соответственно. Было показано, что выщелачивание меди из энаргита зависело от температуры, и при более высокой температуре было выщелочено на порядок больше меди, чем в мезофильных условиях (84 и 8% соответственно) (Munoz et al., 2006).
Разработка технологических подходов для биовыщелачивания разных типов сырья требует понимания закономерностей процессов выщелачивания, которые определяются разными факторами. Сульфидные концентраты содержат всегда целый ряд сульфидных минералов, механизмы биоокисления которых различаются. Кроме того, в процессе биовыщелачивания сульфидных концентратов между минералами происходят электрохимические взаимодействия (Jyothi et al., 1989; Schippers, Sand, 1999; Mahmoud et al., 2017). Биовыщелачивание сульфидных минералов зависит от физико-химических факторов среды, а также от состава микробной культуры, которая осуществляет процесс биовыщелачивания (Кондратьева и соавт., 2015). В промышленных условиях реакторное биовыщелачивание не проводится в асептических условиях, поэтому всегда осуществляются популяциями микроорганизмов, которые формируются в процессе биовыщелачивания и состав которых зависит от условий процесса, а также от минерального состава сырья (Кондратьева и соавт., 2015). Так как процессы биовыщелачивания в промышленных условиях сопровождаются повышением температуры, то доминируют в микробных популяция обычно умеренно-термофильные микроорганизмы, такие как представители родов бактерий Acidithiobacillus (умеренно-термофильный представитель рода – вид A. caldus) и Sulfobacillus и архей Acidiplasma и Ferroplasma семейства Ferroplasmaceae (Rawlings et al., 1999; Okibe et al., 2003; Dopson, Lindstrom, 2004; van Hille et al., 2011; Bulaev et al., 2017). Микроорганизмы, которые присутствуют в популяциях, осуществляющих процессы биовыщелачивания, различаются по своим физиологическим свойствам (оптимальная температура, pH, устойчивость к различным ионам тяжелых металлов), поэтому в разных условиях в популяции могут доминировать разные виды микроорганизмов, то есть в зависимости от условий основной вклад в биовыщелачивание сульфидных концентратов могут вносить разные виды микроорганизмов. Таким образом, перед проведением технологических испытаний требуется предварительно проводить лабораторные исследования закономерностей, которые определяют эффективность биовыщелачивания различных типов сырья.
Целью данной работы было изучение процесса биовыщелачивания полиметаллического медно-цинкового концентрата с высоким содержанием мышьяка смешанной культурой умеренно-термофильных микроорганизмов, представителей групп, доминирующих в технологических процессах, в различных условиях для определения влияния на процесс выщелачивания металлов температуры и присутствия в среде органического источника углерода.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Объектом исследования являлся сульфидный концентрат, содержащий 28% Fe, 16% Cu, 5.3% Zn, 1.36% As, 33.2% сульфидной серы, 2% сульфатной серы и 0.4% элементной серы. Основными минералами концентрата были халькопирит (CuFeS2), теннантит (Cu12As4S13), сфалерит (ZnS) и пирит (FeS2). Концентрат был измельчен до крупности не более 75 мкм.
В работе была использована смешанная культура умеренно-термофильных ацидофильных микроорганизмов, содержащая штаммы Acidithiobacillus caldus MBC-1, Sulfobacillus thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1, выделенные ранее из образцов руд и пульпы реакторов биоокисления (Булаев и соавт., 2012; Muravyov, Bulaev, 2013). Свойства штаммов представлены в табл. 1. Необходимо отметить, что среди исследованных штаммов все способны к окислению серы, но A. caldus MBC-1 является наиболее активным сероокислителем (Елкина и соавт., 2020).
Таблица 1.
Физиологические свойства штаммов, использованных при проведении экспериментов
| Штамм | Донор электронов | Углеродное питание | Температура, °С (оптимум/верхний предел) |
|---|---|---|---|
| Acidithiobacillus caldus MBC-1 | S0 | Автотроф | 45/53 |
| Sulfobacillus thermosulfidooxidans SH-1 | Fe2+, S0 | Миксотроф | 50/60 |
| Acidiplasma sp. MBA-1 | Fe2+, S0 | Гетеротроф | 50–55/63 |
Эксперименты. Для проведения экспериментов была использована жидкая питательная среда, содержащая минеральные соли (г/л): (NH4)2SO4 – 3.0, KCl – 0.2, MgSO4 ⋅ 7H2O – 0.5, K2HPO4 – 0.5. Чтобы установить начальный pH на уровне 1.5, в среду добавляли 1.5 мл/л концентрированной серной кислоты. Для роста двух исследуемых штаммов (S. thermosulfidooxidans SH-1 и Acidiplasma sp. MBA-1) необходимо наличие органического источника углерода, поэтому в среду в одном варианте эксперимента вносили органический источник углерода (0.02% (м./об.) дрожжевого экстракта (ДЭ)).
Опыты проводили в колбах со 100 мл питательной среды и 2 г концентрата на ротационной качалке (200 об./мин) в течение 30 сут. Эксперименты проводили при температурах 40, 45, 50, 55 и 60°C. Штаммы во всех экспериментах инокулировали таким образом, чтобы начальная численность каждого микроорганизма составляла примерно 1 × 107 кл/мл.
Для анализа процесса биовыщелачивания отбирали пробы жидкой фазы на 10, 20 и 30 сутки. Во всех отобранных пробах измеряли pH, окислительно-восстановительный потенциал (Eh), содержание двух- и трехвалентного железа, мышьяка, цинка и меди. Концентрацию ионов железа в среде определяли спектрофотометрически роданидным методом (Резников и соавт., 1970). Содержание мышьяка в среде измеряли с помощью метода атомно-эмиссионной спектроскопии с индуктивно-связанной плазмой. Содержание цинка и меди измеряли на атомно-абсорбционном спектрометре Perkin Elmer 3100 (США). Измерение данных параметров позволяло судить об активности микроорганизмов. Степень выщелачивания цветных металлов из минералов оценивали по концентрации ионов меди и цинка в среде.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Данные, полученные в экспериментах по биовыщелачиванию концентрата в разных условиях, представлены на рис. 1–3. Полученные результаты показывают, что присутствие органического источника углерода влияло на процессы биовыщелачивания при разных температурах.
Рис. 1.
Изменение параметров среды в процессе биовыщелачивания концентрата микроорганизмами на среде, содержащей 0.02% дрожжевого экстракта, при различных температурах: а – pH среды; б – Eh среды; в – концентрация ионов Fe3+ (г/л); г – концентрация ионов Fe2+ (г/л); д – суммарная концентрация ионов железа (г/л); е – концентрация меди (г/л); ж – концентрация цинка (г/л); з – концентрация мышьяка (г/л); 1 – 40°C; 2 – 45°C; 3 – 50°C ; 4 – 55°C; 5 – 60°C; 6 – 60°C (стерильный контроль).
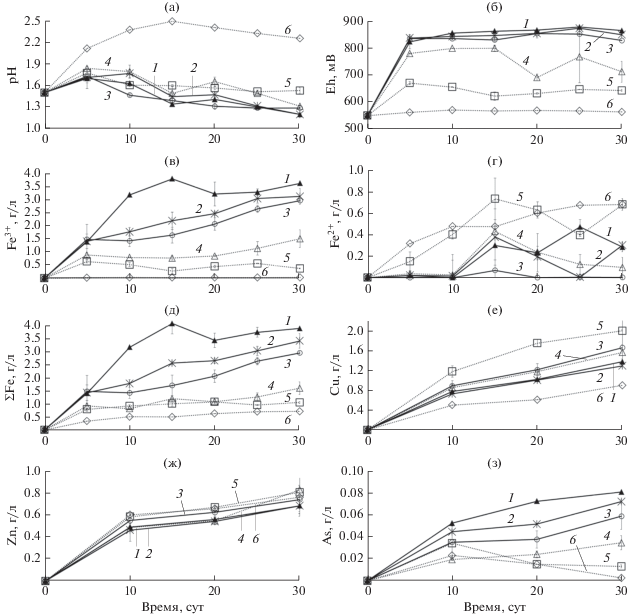
Рис. 2.
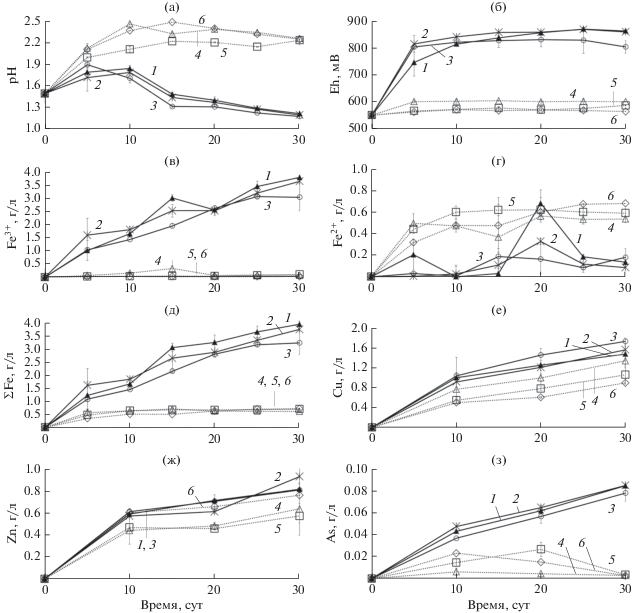
Изменение параметров среды в процессе биовыщелачивания концентрата микроорганизмами на среде без дрожжевого экстракта при различных температурах: а – pH среды; б – Eh среды; в – концентрация ионов Fe3+ (г/л); г – концентрация ионов Fe2+ (г/л); д – суммарная концентрация ионов железа (г/л); е – концентрация меди (г/л); ж – концентрация цинка (г/л); з – концентрация мышьяка (г/л); 1 – 40°C; 2 – 45°C; 3 – 50°C ; 4 – 55°C; 5 – 60°C; 6 – 60°C (стерильный контроль).
При выщелачивании концентрата в присутствии ДЭ во всех условиях, кроме стерильного контроля, сначала происходило увеличение pH (до 1.74–1.85) (рис. 1а). При 60°C pH на 30 сут постепенно снижался до 1.53 (рис. 1а, кривая 5), тогда как при других температурах pH снижался до значений 1.20–1.31 (рис. 1а, кривые 1–4).
Значения Eh среды при температурах 40–50°C уже на 5 сут эксперимента превысили 800 мВ и на протяжении всего эксперимента составляли 824–878 мВ (рис. 1б, кривые 1–3), тогда как при 55°C значение Eh не превысило 800 мВ и на 30 сут снизилось до 713 мВ (рис. 1б, кривая 4). При 60°C значение Eh было относительно низким (622–671 мВ) (рис. 1а, кривая 5). В контрольном варианте эксперимента Eh практически не изменялся в течение 30 сут эксперимента (рис. 1а, кривая 6).
Закономерности изменения концентрации ионов железа Fe3+ и Fe2+ в ходе эксперимента (рис. 1в–1д) соответствовали изменениям Eh в процессе эксперимента, так как в процессе окисления сульфидных минералов Eh определяется, прежде всего, соотношением ионов Fe3+ и Fe2+, которое также отражает активность окисления железа. Наиболее высокими концентрация ионов Fe3+ и суммарная концентрация ионов железа были при температуре 40°C (3.60 и 3.88 г/л соответственно на 30 сутки эксперимента) (рис. 1в и 1д, кривая 1), но при температурах 45 и 50°C к концу эксперимента концентрации ионов железа Fe3+ были ненамного ниже (2.95 и 3.10 г/л соответственно) (рис. 1в и 1д, кривые 2 и 3). При этом концентрация ионов Fe2+ была на порядок ниже, чем ионов Fe3+ (рис. 1г, кривые 1–3). Концентрации ионов Fe3+ при 55 и 60°C были в несколько раз ниже, чем при более низких температурах (1.50 и 0.37 г/л соответственно) (рис. 1в, кривые 4 и 5). В контрольном эксперименте концентрации ионов Fe3+ были следовыми на протяжении всего эксперимента (рис. 1в, кривая 6). При температуре 60°C концентрации ионов Fe2+ были относительно высокими, практически не различались в контрольном эксперименте и в эксперименте с микроорганизмами (0.68 г/л) (рис. 1г, кривые 5 и 6). При 55°C концентрация ионов Fe2+ сначала возрастала до 10 сут до 0.81 г/л, но затем постепенно снижалась до 0.10 г/л к концу эксперимента (рис. 1г, кривая 4). Таким образом, при температурах 40–50°C биоокисление сульфидных минералов, содержащих железо, происходило, очевидно, более активно, чем при более высоких температурах, что может быть вызвано снижением активности микроорганизмов при высоких температурах.
На рис. 1е и 1ж показаны изменения концентраций меди и цинка в среде. Тогда как концентрации ионов цинка при разных температурах практически не различались (на 30 сут эксперимента они достигали 0.68–0.83 г/л) и были достаточно высокими и в стерильном контроле (рис. 1ж, кривые 1–6), концентрация меди различалась в разных вариантах эксперимента достаточно значительно (от 0.90 г/л в стерильном контроле до 2.00 г/л при 60°C (рис. 1е, кривые 1–6).
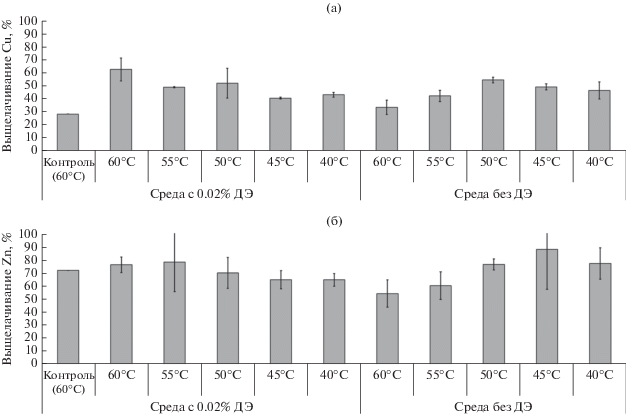
В результате выщелачивания концентрата в течение 30 сут было извлечено в раствор от 64% (при 40 и 45°C) до 78% цинка (при 55°C) (рис. 3). При 60°C в стерильном контроле и в эксперименте с микробной культурой было выщелочено 72 и 76% цинка.
Степень выщелачивания меди в разных условиях заметно различалась и в значительной степени зависела от температуры (рис. 3). Наиболее высокой степень выщелачивания была при 60°C (63%), при этом в стерильном контроле она была ниже, чем в других вариантах эксперимента (28%). При 50 и 55°C степени выщелачивания различались слабо (52 и 49%), также как при 40 и 45°C (43 и 40%).
Таким образом, процесс выщелачивания меди, в отличие от выщелачивания цинка из сфалерита, в значительной степени зависел и от активности микроорганизмов. Это может быть обусловлено тем фактом, что сфалерит относительно легко подвергается выщелачиванию, в том числе биологическому и кислотному, поэтому при относительно высоких температурах процесс выщелачивания цинка мог в меньшей степени быть обусловлен активностью микроорганизмов и в какой-то степени происходить за счет химического выщелачивания при низких pH. При этом минералы меди относительно устойчивы к выщелачиванию, и поэтому выщелачивание меди в большей степени могло зависеть как от температуры, так и от активности микроорганизмов (Jyo-thi et al., 1989; Schippers, Sand, 1999; Mahmoud et al., 2017).
Степень выщелачивания мышьяка зависела от температуры (рис. 1з) и была самой высокой при 40°C (около 30%) (рис. 1з, кривая 1), снижаясь с повышением температуры (при 60°C после 30 сут выщелачивания она составила около 5%) (рис. 1з, кривая 5). Это указывает на то, что при высоких температурах, при которых степень выщелачивания мышьяка была наиболее высокой, выщелачивание меди было обусловлено, главным образом, выщелачиванием халькопирита. Ранее было продемонстрировано, что биовыщелачивание халькопирита в большой степени зависит от температуры и ускоряется при ее повышении (Rodriguez et al., 2003; Liu et al., 2017), тогда как процесс биовыщелачивания теннантита может в меньшей степени зависеть от температуры по сравнению с халькопиритом (Елкина и соавт., 2020).
Таким образом, было показано, что температура, вероятно, оказывала различное влияние на выщелачивание разных сульфидных минералов, содержащихся в концентрате, а наиболее высокая степень выщелачивания меди была достигнута при наиболее высокой температуре.
На рис. 2 и 3 показаны результаты экспериментов по биовыщелачиванию концентрата с использованием среды, не содержащей органического источника углерода (ДЭ), который могут потреблять миксотрофные железоокисляющие микроорганизмы, использованные в данной работы. Нужно отметить, что процесс биовыщелачивания концентрата с использованием среды без ДЭ в значительной степени зависел от температуры и ингибировался при высоких температурах в более значительной степени, чем в экспериментах со средой, содержащей органический источник углерода.
Было показано, что в отличие от экспериментов со средой, содержащей ДЭ, в экспериментах в автотрофных условиях pH снижался только при температурах 40–50°C (до значений около 1.20) (рис. 2а, кривые 1–3), тогда как при температурах 55–60°C (рис. 2а, кривые 4 и 5) и в стерильном контроле он возрастал в ходе выщелачивания до значений около 2.26 (рис. 2а, кривая 6).
Значения Eh среды в автотрофных условиях при температурах 40–50°C на 10 сут эксперимента превысили 800 мВ и на протяжении всего эксперимента составляли 805–872 мВ (рис. 2б, кривые 1–3), также как в экспериментах со средой, содержащей ДЭ (рис. 1б). При 55°C значения Eh в течение всего эксперимента составляли около 600 мВ и, таким образом, были намного ниже, чем в эксперименте со средой с ДЭ (рис. 2б, кривая 4). При 60°C как в контрольном эксперименте, так и эксперименте с микробной культурой значения Eh практически не изменялись за 30 сут эксперимента и составляли 562–586 мВ (рис. 2б, кривые 5 и 6).
Изменения концентрации ионов железа Fe3+ и Fe2+ в ходе эксперимента показаны на рис. 2в–2д. Концентрации ионов Fe3+ и суммарные концентрации ионов железа были наиболее высокими при температурах 40 и 45°C (3.81 и 3.66 г/л Fe3+ и 3.95 и 3.75 г/л суммарного железа на 30 сут эксперимента соответственно) (рис. 2в и 2д, кривые 1 и 2), а при температуре 50°C к концу эксперимента концентрации ионов Fe3+ и суммарная концентрация ионов железа были ненамного ниже (3.05 и 3.23 г/л на 30 сут эксперимента соответственно) (рис. 2в и 2д, кривая 3). Таким образом, концентрации ионов железа при температурах 40–50°C в экспериментах со средой, содержащей ДЭ, и средой без ДЭ отличались в достаточно малой степени (рис. 1в–1д и рис. 2в–2д). Нужно отметить, что при температурах 55–60°C концентрации ионов Fe3+ были очень низкими и фактически не превышали значительно концентрацию ионов трехвалентного железа в контрольном варианте эксперимента (рис. 2в, кривые 4–6). Следовательно, при температурах 40–50°C биоокисление сульфидных минералов, содержащих железо, в эксперименте со средой без ДЭ происходило фактически с той же скоростью, что и в эксперименте со средой, содержащей органический источник углерода. При этом при температурах 55−60°C окисление железа происходило с крайне низкой скоростью, а железо в среде находилось, в основном, в форме ионов Fe2+, что, очевидно, было обусловлено частичным химическим выщелачиванием сульфидных минералов в среде с низким pH (рис. 2г, кривые 4–6).
На рис. 2е и 2ж показаны изменения концентраций меди и цинка в среде в процессе выщелачивания. Концентрации меди в среде при разных температурах различались к концу эксперимента (от 0.90 г/л в стерильном контроле до 1.74 г/л при 50°C) (рис. 2е, кривые 1–6). В экспериментах со средой без ДЭ степень выщелачивания меди была наибольшей при 50°C и составила 54% (рис. 3). Несколько ниже была степень выщелачивания меди при температурах 40 и 45°C (46 и 49% соответственно), а при температурах 55 и 60°C степень выщелачивания меди была еще ниже (42 и 33%). При 60°C степень выщелачивания была ненамного выше, чем в стерильном контроле (28%). Таким образом, зависимость выщелачивания меди от температуры в экспериментах со средой без ДЭ отличалась от таковой, выявленной в экспериментах со средой с ДЭ. Тогда как при наличии в среде ДЭ степень выщелачивания меди возрастала с температурой, в экспериментах со средой без ДЭ степень выщелачивания меди при температурах выше 50°C в значительной степени снижалась. Степень выщелачивания цинка была максимальной при 45°C (88%). При этом при температурах 40–50°C степень выщелачивания была выше, чем в соответствующих экспериментах со средой, содержащей ДЭ. При 55 и 60°C степень выщелачивания была ниже (60 и 54% соответственно), чем при более низких температурах, и несколько ниже, чем в контрольном эксперименте.
Степень выщелачивания мышьяка (рис. 2з) при температурах 40–50°C была практически одинаковой (около 29–31%) (рис. 2з, кривые 1–3), при этом снижаясь с повышением температуры (после 30 сут выщелачивания она составила около 1% при 55 и 60°C) (рис. 2з, кривые 4 и 5). Таким образом, закономерности зависимости для выщелачивания мышьяка от температуры оказались такими же, как и для цветных металлов.
Результаты данной работы показывают, что процесс выщелачивания минералов, входящих в состав сульфидного концентрата, зависел от условий процесса, при этом характер зависимости определялся комбинацией факторов. Так, выщелачивание меди возрастало с увеличением температуры, а выщелачивание цинка зависело от температуры в меньшей степени. При этом в присутствии органического источника углерода в среде биовыщелачивание и меди, и цинка происходило активно при высоких температурах (55 и 60°C), тогда как в экспериментах со средой без ДЭ активность выщелачивания цветных металлов из концентрата при данных температурах была гораздо ниже. В то же время при температурах 40–50°C активность выщелачивания в меньшей степени зависела от присутствия в среде органического источника углерода. Это может быть объяснено особенностями физиологических свойств микроорганизмов смешанной культуры, которая использовалась в экспериментах, и взаимодействиями между ними, которые играют важную роль в процессах биовыщелачивания и в значительной степени определяют их скорость и эффективность (Кондратьева и соавт., 2015). Известно, что в микробных популяциях, осуществляющих окисление сульфидных минералов как в природных местах обитания, так и в условиях промышленных процессов (реакторы и кучи биоовыщелачивания), присутствуют как автотрофные микроорганизмы, так и миксо- и гетеротрофы (Gonzalez-Toril et al., 2003; Druschel et al., 2004; Morin, d’Hugues, 2007; van Hille et al., 2011; Кондратьева и соавт., 2015; Bulaev et al., 2017). Благодаря различиям в углеродном метаболизме между микроорганизмами, окисляющими сульфидные минералы, в микробных популяциях между автотрофами и миксо- и гетеротрофами возникают трофические связи, так как автотрофы, способные расти в отсутствии органического источника углерода, продуцируют в том числе экзометаболиты, которые могут потребляться миксо- и гетеротрофами (Gonzalez-Toril et al., 2003; Nancucheo, Johnson, 2010).
В данной работе в смешанной культуре присутствовали штаммы родов Sulfobacillus и Acidiplasma, которые нуждаются в органическом источнике углерода для роста (Кондратьева и соавт., 2015), а также штамм A. caldus, являющийся автотрофом. Так как данный штамм неактивен при температуре выше 53°C, при высоких температурах активность штаммов, нуждающихся в органическом источнике углерода и способных к окислению сульфидных минералов при высоких температурах, полностью зависела от наличия в среде ДЭ.
Кроме того, было установлено, что выщелачивание разных минералов, входящих в состав концентрата, в разной степени зависело от факторов, влияющих на активность штаммов микроорганизмов, что определяется их строением, электрохимическими свойствами и интермедиатами, которые образуются в процессе окисления (Jyothi et al., 1989; Rodriguez et al., 2003; Liu et al., 2017).
Результаты исследований по биовыщелачиванию сульфидных минералов и концентратов в лабораторных условиях, в том числе в данной работе, могут быть использованы для разработки подходов, позволяющих оптимизировать существующие биогидрометаллургические технологии. В данной работе показано, что разные минералы, входящие в состав исследованного концентрата, наиболее активно окислялись при разных условиях, при этом медь из халькопирита наиболее активно выщелачивалась в условиях, в которых активность культуры зависела от присутствия органического источника углерода (высокая температура), а цинк и мышьяк из сфалерита и теннантита активнее выщелачивались при более низких температурах, при которых не требовалось внесение в среду дополнительных источников углерода. Таким образом, на основании полученных данных можно разработать подходы, которые могут обеспечить максимальное извлечение металлов и обеспечить достаточно высокую активность микроорганизмов. Например, в одной из работ была предложена технологическая схема, предполагающая ведение непрерывного процесса биоокисления упорных золотосодержащих пиритно-арсенопиритных концентратов в переменном температурном режиме (Меламуд и соавт., 1999). Согласно этой схеме, первый этап окисления осуществлялся при температуре 30°C автотрофными мезофильными бактериями A. ferrooxidans, а второй этап – при 42 и 50°C миксотрофными умеренно- термофильными бактериями S. thermosulfidooxidans. При этом скорость окисления сульфидных минералов увеличивалась по сравнению с мезофильными условиями в несколько раз за счет стимуляции роста сульфобацилл, проводящих процесс биоокисления с большей скоростью. Такая технологическая схема может быть использована для проведения процессов окисления сырья, содержащего упорные минералы, для которых может потребоваться высокая температура, так как можно стабилизировать процесс биоокисления концентрата при таких температурах за счет снабжения умеренно-термофильных миксотрофных микроорганизмов источниками органического углерода, выделенными автотрофными микроорганизмами на первой стадии при более низкой температуре.
Результаты данной работы могут служить научной основой для разработок новой биогидрометаллургической технологии, основанной на биовыщелачивании с переменным температурным режимом. Переменный температурный режим может обеспечить постадийную смену доминирующих в процессе микроорганизмов. Первая низкотемпературная стадия обеспечит активный рост автотрофных микроорганизмов и выщелачивание некоторых сульфидных минералов. В свою очередь, рост автотрофных микроорганизмов на первой стадии обеспечит продуцируемыми экзометаболитами активность миксо- и гетеротрофных микроорганизмов на следующих стадиях, что позволит выщелачивать более упорные сульфидные минералы при высокой температуре. Таким образом, полученные результаты могут быть использованы для проведения дальнейших технологических исследований с целью оптимизации биогидрометаллургических технологий.
Список литературы
Булаев А.Г., Першина Е.В., Украинцев И.В. Состояние развития современных биогидрометаллургических технологий и перспективы их использования в России // Цветные металлы. 2016. № 10. С. 29–35.
Булаев А.Г., Пивоварова Т.А., Кузнецов Б.Б., Колганова Т.В., Кондратьева Т.Ф. Скорость окисления сульфидных минералов сообществами ацидофильных хемолитотрофных микроорганизмов из разных мест обитания // Микробиология. 2012. Т. 81. № 4. С. 434–442.
Bulaev A.G., Pivovarova T.A., Kuznetsov B.B., Kolganova T.V., Kondrat’eva T.F. Rates of sulfide mineral oxidation by acidophilic chemolithotrophic microbial communities from various sources // Microbiology. 2012. V. 81. № 4. P. 397–404.
Елкина Ю.А., Мельникова Е.А., Меламуд В.С., Булаевa А.Г. Биовыщелачивание теннантита и энаргита умеренно-термофильными ацидофильными микроорганизмами // Микробиология. 2020. Т. 89. № 4. P. 419–431.
Elkina Yu.A., Melnikova E.A., Melamud V.S., Bulaev A.G. Bioleaching of enargite and tennantite by moderately thermophilic acidophilic microorganisms // Microbilogy. V. 89. № 4. P. 413–424.
Кондратьева Т.Ф., Булаев А.Г., Муравьев М.И. Микроорганизмы в биогеотехнологиях переработки сульфидных руд. М.: Наука, 2015. 212 с.
Меламуд В.С., Пивоварова Т.А., Кондратьева Т.Ф., Каравайко Г.И. Изучение процесса бактериального окисления золотосодержащего пиритно-арсенопиритного концентрата в умеренно термофильных условиях // Прикл. биохимия и микробиология. 1999. Т. 35. № 2. С. 182–189.
Melamud V.S., Pivovarova T.A., Kondrateva T.F., Karavaiko G.I. Study of oxidation by bacteria of a difficult-to-dress gold-containing pyrite-arsenopyrite concentrate under moderately thermophilic conditions // Applied Biochemistry and Microbiology. 1999. V. 35. № 2. P. 161–167.
Резников А.А., Муликовская Е.П., Соколов И.Ю. Методы анализа природных вод. М.: Недра, 1970. 140 с.
Baba A.A., Ayinla K.I., Adekola F.A., Ghosh M.K., Ayanda O.S., Bale R.B., Sheik A.R., Pradhan S.R. A review on novel techniques for chalcopyrite ore processing // International J. Mining Engineering and Mineral Processing. 2012. V. 1(1). P. 1–16.
Bulaev A., Belyi A., Panyushkina A., Solopova N., Pivovarova T. Microbial population of industrial biooxidation reactors // Solid State Phenomena. 2017. V. 262. P. 48–52.
Diaz J.A., Serrano J., Leiva E. Bioleaching of arsenic-bearing copper ores // Minerals. 2018. V. 8. № 5. P. 215.
Dopson M., Lindstrom E.B. Analysis of community composition during moderately thermophilic bioleaching of pyrite, arsenical pyrite, and chalcopyrite // Microb. Ecol. 2004. V. 48. № 1. P. 19–28.
Druschel G.K., Baker B.J., Gihring T.H., Banfield J.F. Acid mine drainage biogeochemistry at Iron Mountain, California // Geochem. Trans. 2004. V. 5. № 2. P. 13–32.
Filippou D., St-Germain P., Grammatikopoulos T. Recovery of metal values from copper – arsenic minerals and other related resources // Miner. Process Extr. Metall. Rev. 2007. V. 28. № 4. P. 247–298.
Gentina J.C., Acevedo F. Application of bioleaching to copper mining in Chile // Electron. J. Biotechnol. 2013. V. 16. № 3. P. 16.
Gericke M., Neale J.W., Van Staden P.J. A Mintek perspective of the past 25 years in minerals bioleaching // J. S. Afr. Inst. Mining and Met. 2009. V. 109. P. 567–585.
Gonzalez-Toril E., Llobet-Brossa E., Casamayor E.O., Amann R., Amils R. Microbial ecology of an extreme acidic environment, the Tinto River // Appl. Environ. Microbiol. 2003. V. 69. P. 4853–4865.
Johnson D.B. Biomining – biotechnologies for extracting and recovering metals from ores and waste materials // Curr. Opin. Biotechnol. 2014. V. 30. P. 24−31.
Jyothi N., Sudha K.N., Natarajan K.A. Electrochemical aspects of selective bioleaching of sphalerite and chalcopyrite from mixed sulphides // Int. J. Miner Process. 1989. V. 27. P. 189–203.
Liu H., Xia J., Nie Z., Liu L., Wang L., Ma C., Zheng L., Zhao Y., Wen W. Comparative study of S, Fe and Cu speciation transformation during chalcopyrite bioleaching by mixed mesophiles and mixed thermophiles // Miner. Eng. 2017. V. 106. P. 22–32.
Mahmoud A., Cezac P., Hoadley A.F.A., Contaminea F., D’Hugues P. A review of sulfide minerals microbially assis-ted leaching in stirredtank reactors // International Biodeterioration & Biodegradation. 2017. V. 119. P. 118–146.
Marsden J.O., House C.I. The Chemistry of Gold Extraction. 2nd ed. Littleton: Society for Mining, Metallurgy, and Exploration, Inc., 2006. 625 p.
Morin D.H.R., d’Hugues P. Bioleaching of a cobalt contai-ning pyrite in stirred reactors: a case study from laboratory scale to industrial application // Biomining / Eds. Rawlings D.E., Johnson B.D. Berlin: Springer, 2007. P. 35–55.
Munoz J.A., Blazquez M.L., Gonzalez F., Ballester A., Acevedo F., Gentina J.C., Gonzalez P. Electrochemical study of enargite bioleaching by mesophilic and thermophilic microorganisms // Hydrometallurgy. 2006. V. 84. P. 175–186.
Muravyov M.I., Bulaev A.G. Two-step oxidation of a refractory gold-bearing sulfidic concentrate and the effect of organic nutrients on its biooxidation // Minerals Engineering. 2013. V. 45. P. 108–114.
Nancucheo I., Johnson D.B. Production of glycolic acid by chemolithotrophic iron- and sulfur-oxidizing bacteria and its role in delineating and sustaining acidophilic sulfide mineral-oxidizing consortia // Appl. Environ. Microbiol. 2010. V. 76. № 2. P. 461–467.
Neale J., Seppala J., Laukka A., van Aswegen P., Barnett S., Gericke M. The MONDO minerals nickel sulfide bioleach project: from test work to early plant operation // Solid State Phenomena. 2017. V. 262. P. 28–32.
Okibe N., Gericke M., Hallberg K.B., Johnson D.B. Enumeration and characterization of acidophilic microorganisms isolated from a pilot plant stirred-tank bioleaching operation // Appl. Environ. Microbiol. 2003. V. 69. № 4. P. 1936–1943.
Pietrzyk S., Tora B. Trends in global copper mining – a review // IOP Conference Series: Materials Science and Engineering. 2018. V. 427. 012002.
Rawlings D.E., Coram N.J., Gardner M.N., Deane S.M. Thiobacillus caldus and Leptospirillum ferrooxidans are widely distributed in continuous flow biooxidation tanks used to treat a variety of metal containing ores and concentrates // Process Metallurgy. Elsevier, 1999. V. 9. P. 777–786.
Rodriguez Y., Ballester B., Blazquez M.L., Gonzalez F., Munoz J.A. New information on the chalcopyrite bioleaching mechanism at low and high temperature // Hydrometallurgy. 2003. V. 71. № 1–2. P. 47–56.
Schippers A., Sand W. Bacterial leaching of metal sulfides proceeds by two indirect mechanisms via thiosulfate or via polysulfides and sulfur // Appl. Environ. Microbiol. 1999. V. 65. № 1. P. 319–321.
van Hille R.P., van Wyk N., Harrison S.T.L. Review of the microbial ecology of BIOX® reactors illustrate the dominance of the genus Ferroplasma in many commercial reactors // Biohydrometallurgy: Biotech Key to Unlock Minerals Resources Value. Changsha: Central South University Press, 2011. P. 1021.
Watling H.R. The bioleaching of sulphide minerals with emphasis on copper sulphides – a review // Hydrometallurgy. 2006. V. 84. № 1–2. P. 81–108.
World Copper Factbook 2017, International Copper Study Group, Lisbon, Portugal.
Дополнительные материалы отсутствуют.