Микробиология, 2021, T. 90, № 1, стр. 122-128
Галактофуранан клеточной стенки актинобактерий рода Paenarthrobacter
Н. В. Потехина a, *, А. С. Шашков b, Е. М. Тульская a, Е. В. Арискина c, Л. В. Дорофеева c, Л. И. Евтушенко c
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119192 Москва, Россия
b Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Россия
c Всероссийская коллекция микроорганизмов, Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, ФИЦ Пущинский научный центр биологических исследований РАН
142290 Московская обл., Пущино, Россия
* E-mail: potekhina56@mail.ru
Поступила в редакцию 19.05.2020
После доработки 17.06.2020
Принята к публикации 25.06.2020
Аннотация
Изучен состав и структура гликополимеров клеточных стенок представителей рода Paenarthrobacter – P. aurescens ВКМ Ac-1105T, P. histidinovorans ВКМ Ac-1978T и P. nicotinovorans ВКМ Ac-1988T, относившихся ранее к роду Arthrobacter. У всех исследованных штаммов выявлен нейтральный полисахарид – (1 → → 6)-связанный β-D-галактофуранан, почти полностью замещенный по гидроксилам при С-2 галактозы остатками 2,3-диацетамидо-2,3-дидезокси-α-глюкопиранозы (α-GlcpNAc3NAc). Кислотные гидролизаты клеточных стенок содержали галактозу, глюкозу, арабинозу, глюкозамин и галактозамин. Исследования проводили химическими и ЯМР-спектроскопическими методами. Структура галактофуранана не была описана ранее для представителей других родов актинобактерий. Полученные данные расширяют представления о химическом строении клеточных стенок микроорганизмов и могут быть востребованы в систематике актинобактерий, в частности, для дифференциации на уровне фенотипа и обоснования описания новых родов в составе семейства Micrococcaceae.
Изучение гликополимеров клеточных стенок микроорганизмов представляет интерес для ряда областей фундаментальной и прикладной науки, в том числе, таксономии микроорганизмов. Хотя система классификации прокариот во все большей мере базируется на данных геномики, сведения о фенотипических характеристиках, в частности, хемотаксономических, отражающих химический состав клеток и клеточных стенок, по-прежнему актуальны (Nouioui et al., 2018; Chun et al., 2018). Основным гликополимером клеточных стенок грамположительных бактерий, как известно, является пептидогликан, характеризующийся высокой степенью структурного разнообразия (Schleifer, Kandler, 1972; Schumann, 2011). Типы (вариации) структур этого полимера являются важнейшими хемотаксономическими признаками таксонов актинобактерий различного ранга (Schumann, 2011; Schumann et al., 2009; Busse, 2016).
Помимо пептидогликана, клеточная стенка грамположительных бактерий обычно содержит гликополимеры иных типов, ковалентно связанные с пептидогликаном, которые часто называют вторичными гликополимерами (“secondary cell wall glycopolymers”) (Kohler et al., 2009; Schade, Weidenmaier, 2016). Последние представлены фосфатсодержащими гликополимерами – тейхоевыми кислотами и поли(гликозилфосфатами), а также бесфосфатными – тейхуроновыми и тейхулозоновыми кислотами или полисахаридами других типов (Kohler et al., 2009; Potekhina et al., 2011; Тульская и соавт., 2011; Schade, Weidenmaier, 2016; Шашков и соавт., 2020а). Показано, что набор и структура вторичных гликополимеров являются специфичными для ряда изученных видов, родов и таксонов актинобактерий более высокого уровня (Takeuchi et al., 1990; Potekhina et al., 2011; Evtushenko, Ariskina, 2015; Magee, Ward, 2015; Goodfellow, 2015; Goodfellow, Jones, 2015; Nouioui et al., 2018; Busse, 2020; Шашков и соавт., 2020а).
Род Paenarthrobacter (семейство Micrococcaceae) включает 6 видов, которые ранее входили в состав рода Arthrobacter (группа “Arthrobacter nicotinovorans”) (Busse, 2016). Род предложен на основе филогенетической обособленности (16S рРНК) вошедших в него видов и их отличий от Arthrobacter sensu stricto и других близких родов по фенотипическим признакам, главным образом, хемотаксономическим (структура пепдидогликана, состав изопреноидных хинонов и полярных липидов) (Busse, 2016). Представители рода Paenarthrobacter имеют пептидогликан A3α типа, вариация А11.17 (L-лизин в тетрапептидной цепочке, межпептидный мостик L-Ala–L-Thr–L-Ala) (Schumann et al., 2011; Busse, 2016). Сведения о вторичных гликополимерах этого рода фрагментарны. Для штаммов двух видов (P. aurescens и P. ureafaciens) показано отсутствие тейхоевых кислот и наличие нейтральных полисахаридов, структуры которых не установлены (Takeuchi, Yokota, 1989).
Целью настоящей работы было изучение структур вторичных гликополимеров клеточных стенок типовых штаммов трех видов рода Paenarthrobacter – P. aurescens (типовой вид рода), P. histidinovorans и P. nicotinovorans.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы для исследований (P. aurescens ВКМ Ac-1105T, P. histidinovorans ВКМ Ac-1978T, P. nicotinovorans ВКМ Ac-1988T и Paenarthrobacter sp. ВКМ Ac-2576) были получены из Всероссийской коллекции микроорганизмов (ВКМ) (www.vkm.ru).
Культуры выращивали аэробно при температуре 28°С до середины фазы логарифмического роста на пептонно-дрожжевой среде (г/л): пептон – 5, дрожжевой экстракт – 3, K2HPO4 – 0.2, глюкоза – 5; pH 7. Клеточные стенки получали методом дифференциального центрифугирования из клеток, разрушенных на ультразвуковом дезинтеграторе UP100H (“Hielscher”, Германия) при 30 кГц, 3–5 × 10 мин в ледяной воде; гликополимеры экстрагировали из клеточных стенок 10% ТХУ при 4°С (Potekhina et al., 2011).
Продукты кислотного гидролиза (2 M HCl, 3 ч, 100°С) препаратов клеточной стенки и гликополимеров идентифицировали методами хроматографии на бумаге и электрофореза с использованием различных систем растворителей и специфических красителей (реактив Ишервуда, нингидрин, AgNO3, анилин-фталат) (Potekhina et al., 2011).
Абсолютную конфигурацию галактозы определяли модифицированным методом с использованием ГЖХ ацетилированных гликозидов с (S)-октан-2-олом как описано ранее (Potekhina et al., 2011).
ЯМР-спектры снимали на спектрометре Avance 600 (“Bruker”, Германия) для растворов препаратов в 99.96% D2O при 30°С. Для отсчета химических сдвигов использовали внутренние стандарты TSP (δH 0.0) и ацетон (δC 31.45) при температуре 313 К. Двумерные ЯМР-эксперименты выполняли с использованием стандартного математического обеспечения фирмы “Bruker” (“Bruker Optik GmbH”, Германия). Время спин-лока в экспериментах 1Н,1Н TOCSY составляло 100 мс. 1Н,13С HMBC эксперименты были оптимизированы для КССВ 8 Гц.
Выделение ДНК, амплификацию, секвенирование и анализ последовательности нуклеотидов гена 16S рРНК штамма ВКМ Ac-2576 проводили как описано ранее (Ryzhmanova et al., 2017).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В кислотных гидролизатах клеточных стенок изученных штаммов (P. aurescens ВКМ Ac-1105T, P. histidinovorans ВКМ Ac-1978T, P. nicotinovorans ВКМ Ac-1988T) и выделенных из них препаратов гликополимеров обнаружены в разных соотношениях галактоза, глюкоза, арабиноза, а также глюкозамин и галактозамин. Фосфорные эфиры глицерина и других полиолов или сахаров обнаружены не были, что указывало на отсутствие тейхоевых кислот и поли(гликозилфосфатов) и наличие бесфосфатных гликополимеров.
Препараты гликополимеров из клеточных стенок всех трех вышеупомянутых штаммов, исследованные методами ЯМР-спектроскопии, показали полную идентичность. Развернутое описание ЯМР-спектрометрического анализа приводится для препарата штамма P. nicotinovorans ВКМ Ac-1988T.
Спектр ЯМР 13С (рис. 1) препарата гликополимера штамма ВКМ Ac-1988T содержал в области резонанса аномерных атомов углерода три сигнала при δC 109.1 м.д. (минор), 107.3 м.д. и 97.3 м.д. В области резонанса атомов углерода, связанных с азотом, имелись два сигнала при δC 53.6 и 53.1 м.д. В сильном поле идентифицированы два сигнала метильных групп N-ацетатов (δC 23.0 и 23.3 м.д.), им соответствовали два сигнала карбонильных атомов углерода при δC 176.1 и 175.4 м.д. Остальные сигналы находились в области δC 88–62 м.д. В области резонанса протонов при аномерных атомах углерода в спектре ЯМР 1Н были видны два интенсивных сигнала при δH 5.10 м.д. (уширенный синглет, 3J < 2 Гц) и δH 5.02 м.д. (дублет, 3J 4 Гц). В сильном поле присутствовал интенсивный синглет при δH 1.98 м.д. Остальные сигналы располагались в области δH 3.5–4.2 м.д.
Рис. 1.
Спектр 13C ЯМР галактофуранана из клеточной стенки P. nicotinovorans ВКМ Ac-1988T. Арабские цифры отнесены к атомам в остатках сахаров, обозначенных заглавными латинскими буквами, как показано в табл. 1.
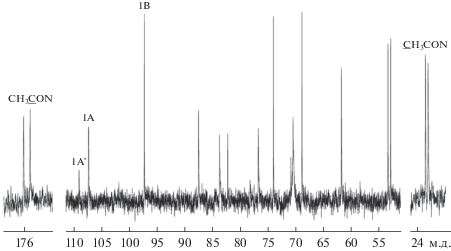
Одномерные спектры были расшифрованы при анализе двумерных гомоядерных 1Н,1Н COSY, TOCSY, ROESY и гетероядерных 1Н,13С HSQC и HMBC спектров. Гомоядерные спектры выявили наличие в полимере остатков β-галактофуранозы (β-Galf, остатки А, А') и 2,3-диацетамидо-2,3-дидезокси-α-глюкопиранозы (α-D-GlcpNAc3NAc, остаток B). Спектр 1Н,1Н ROESY (рис. 2, табл. 1) содержал среди прочих корреляционные пики Н-1(А)/Н-6,6'(А) (5.12/3.90; 3.64) и Н-1(В)/Н-1.2(А) (5.03/5.12;4.20), которые свидетельствовали о (1 → 6)-связи между остатками β-Galf и о замещении последних остатками α-D-GlcpNAc3NAc по гидроксилу у С-2. Отметим, что значительный ядерный эффект Оверхаузера H-1(B)/H-1(A) (5.03/5.12) ожидается в данном дисахаридном фрагменте при одинаковой (D) конфигурации пираноз (Bock, Pedersen, 1983). Отнесение сигналов в спектре ЯМР 13С полимера было выполнено при анализе спектра 1Н,13С HSQC (табл. 1). Слабопольное смещение сигналов С-2 и С-6 остатка А по сравнению с соответствующими сигналами в β-метил-D-галактофуранозиде (Lipkind et al., 1988) подтверждало замещение остатка по гидроксилам при этих атомах. Анализ двумерных спектров выявил принадлежность минорных сигналов незамещенным по С-2 остаткам β-Galf (остатки А'; табл. 1). Спектр 1Н,13С HMBC (рис. 3; табл. 1) подтвердил наличие (1 → 6)-связи между остатками β-Galf (корреляционные пики H-1(A)/C-6(A) (5.12/70.4) и H-6'(A)/C-1(A)) (3.64/107.3) и (1 → 2)-связи между остатками α-D-GlcpNAc3NAc и β-Galf (корреляционные пики H-1(B)/C-2(A) (5.03/87.5) и H-2(A)/C-1(B) (4.20/97.3).
Рис. 2.
Часть спектра 1H,1H ROESY галактофуранана из клеточной стенки P. nicotinovorans ВКМ Ac-1988T. Соответствующие части 1H ЯМР спектра показаны вдоль осей. Арабские цифры отнесены к атомам в остатках сахаров, обозначенных заглавными латинскими буквами, как показано в табл. 1.
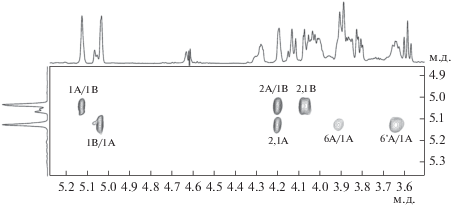
Таблица 1.
Химические сдвиги в спектрax 13C и 1H ЯМР галактофуранана из клеточной стенки P. nicotinovorans ВКМ Ac-1988T
| Остаток | Химические сдвиги 13C (δC ацетон 31.45) и 1H (δH TSP 0.0) |
||||||
|---|---|---|---|---|---|---|---|
| C-1 H-1 |
C-2 H-2 |
C-3 H-3 |
C-4 H-4 |
C-5 H-5 |
C-6 H-6.6' |
||
| $\begin{array}{*{20}{c}} { \to {\kern 1pt} 6){\text{ - D - }}\beta {\text{ - Gal}}f{\text{ - (1}}{\kern 1pt} \to } \\ {\,\,\,\,\,\,\,2)} \end{array}$ | A | 107.3 5.12 |
87.5 4.20 |
76.7 4.28 |
83.7 4.02 |
70.4 4.01 |
70.4 3.90, 3.64 |
| $\begin{array}{*{20}{c}} {\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \uparrow } \\ {\alpha {\text{ - D - Glc}}p{\text{NAc3NAc - (1}}} \end{array}$ | B | 97.3 5.03 |
52.8a 4.06 |
53.3b 4.13 |
68.9 3.58 |
74.0 3.86 |
61.7 3.86, 3.82 |
| $ \to {\kern 1pt} 6){\text{ - D - }}\beta {\text{ - Gal}}f{\text{ - (1}}{\kern 1pt} \to $ | A ' | 109.1 5.06 |
82.3 4.13 |
78.2 4.06 |
84.5 4.00 |
70.8 3.96 |
70.4 3.87, 3.81 |
Рис. 3.
Часть спектра 1Н,13С HMBC галактофуранана из клеточной стенки P. nicotinovorans ВКМ Ac-1988T. Соответствующие части 1H и 13C ЯМР спектров показаны вдоль горизонтальной и вертикальной осей. Арабские цифры перед косой чертой относятся к протонам, а после – к углеродам в остатках, обозначенных заглавными латинскими буквами, как показано в табл. 1.

Таким образом, ЯМР-эксперименты показали, что препарат гликополимера штамма ВКМ Ас-1988T содержит нейтральный полисахарид – галактофуранан, почти полностью (90%) замещенный остатками диаминоглюкозы, со структурой повторяющегося звена:
Идентичность спектров гликополимеров штаммов P. aurescens ВКМ Ac-1105T, P. histidinovorans Ac-1978T и описанного выше ВКМ Ас-1988T указывало на идентичность структур галактофурананов у всех трех организмов.
Ранее аналогичный галактофуранан с диаминоглюкозой в боковой цепи был описан в составе клеточной стенки Arthrobacter sp. ВКМ Ac-2576 (Shashkov et al., 2012). С целью уточнения таксономического положения штамма ВКМ Ac-2576 было проведено сравнительное изучение последовательностей нуклеотидов 16S РНК генов этого штамма и родственных организмов. Было установлено, что ВКМ Ac-2576 также относится к роду Раenarthrobacter. Последовательность нуклеотидов гена 16S РНК генов штамма ВКМ Ac-2576 имеет 100% сходства с депонированной в GenBank последовательностью (BJMD01000050) штамма P. aurescens NBRC 12136T (=P. aurescens ВКМ Ac-1105T).
Таким образом, все исследованные штаммы рода Paenarthrobacter, относящиеся к трем видам – P. aurescens (типовой вид рода), P. histidinovorans и P. nicotinovorans, и штамм Ac-2576, сходный по последовательности нуклеотидов гена 16S РНК с P. aurescens ВКМ Ac-1105T, содержат в качестве вторичного гликополимера клеточной стенки галактофуранан с α-диаминоглюкозой в боковой цепи. Структура этого полимера установлена до настоящего времени только у представителей Paenarthrobacter и не описана у других прокариотных микроорганизмов. При этом, как отмечалось ранее (Takeuchi, Yokota, 1989) и показано нами, штаммы видов Paenarthrobacter (P. aurescens, P. histidinovorans, P. nicotinovorans, P. ureafaciens) не имеют тейхоевых кислот или других фосфатсодержащих полимеров.
Интересно также отметить, что в клеточной стенке других видов Paenarthrobacter (P. ilicis, P. nitroguajacolicus и P. ureafaciens), как и у штаммов, изученных в данной работе, содержится в значительном количестве галактоза (Keddie, Cure, 1978; Takeuchi, Yokota, 1989). Это может указывать как на наличие у них аналогичного галактофуранана, так и другого галактозосодержащего полимера. Дальнейшее исследование представителей этих видов позволит выяснить, характерен ли идентифицированный галактофуранан для всех видов рода или он свойствен лишь части его видов.
Немногочисленные изученные к настоящему времени представители ревизованного рода Arthrobacter (A. globiformis, A. pascens, A. ramosus) (Busse, 2016) и вид Pseudarthrobacter oxydans (ранее A. oxydans), имеющие, как и Paenarthrobacter, пептидогликан A3α, также характеризуются наличием бесфосфатных полисахаридов (структуры которых не установлены) (Naumova et al., 1988; Takeuchi, Yokota, 1989). Исключение составляет A. crystallopoietes, содержащий в клеточной стенке тейхоевые кислоты (Naumova et al., 1988; Takeuchi, Yokota, 1989). Этот вид, однако, весьма удален филогенетически от типового вида рода, A. globiformis и, по данным Busse (2016), может рассматриваться как представитель нового рода.
В отличие от вышеупомянутых Paenarthrobacter и Arthrobacter, исследованные представители родов Glutamicibacter и Paeniglutamicibacter (ранее принадлежавшие к Arthrobacter) имеют пептидогликан A4α типа и содержат в качестве вторичных гликополимеров тейхоевые кислоты и/или поли(гликозилфосфаты) (G. mysorens, G. nicotianae, P. sulfureus, G. uratoxydans, G. protophormiae) (Naumova et al., 1988; Takeuchi, Yokota, 1989; Потехина и соавт., 2012; Шашков и соавт., 2020б).
Таким образом, в результате проведенных исследований получены новые данные о химическом составе клеточных стенок трех видов Paenarthrobacter. У представителей рода обнаружен галактофуранан с α-диаминоглюкозой в боковой цепи, не описанный ранее у других прокариотных организмов. Показано, что этот полимер и набор сахаров кислотных гидролизатов клеточных стенок (галактоза, глюкоза, арабиноза, глюкозамин и галактозамин), а также отсутствие тейхоевых кислот и других фосфатсодержащих полимеров, характерны для трех изученных видов Paenarthrobacter. Полученные результаты могут быть востребованы в систематике прокариот для дифференциации родов актинобактерий на уровне фенотипа.
Список литературы
Потехина Н.В., Шашков А.С., Сенченкова С.Н., Дорофеева Л.И., Евтушенко Л.И. Структура гексасахарид-1-фосфатного полимера Arthrobacter uratoxydans ВКМ Ac-1979T // Биохимия. 2012. Т. 77. С. 1546–1555.
Potekhina N.V., Shashkov A.S., Senchenkova S.N., Dorofeeva L.V., Evtushenko L.I. Structure of hexasaccharide 1‑phosphate polymer from Arthrobacter uratoxydans VKM Ac-1979T cell wall // Biochemistry (Moscow). 2012. V. 77. P. 1294–1302.
Тульская Е.М., Шашков А.С., Стрешинская Г.М., Сенченкова С.Н., Потехина Н.В., Козлова Ю.И., Евтушенко Л.И. Тейхуроновые и тейхулозоновые кислоты актиномицетов // Биохимия. 2011. Т. 76. С. 904–913.
Tul’skaya E.M., Shashkov A.S., Streshinskaya G.M., Senchenkova S.N., Potekhina N.V., Kozlova Yu I., Evtushenko L.I. Teichuronic and teichulosonic acids of Actinomycetes // Biochemistry (Moscow). 2011. V. 76. P. 736–744.
Шашков А.С., Тульская Е.М., Стрешинская Г.М., Дмитренок А.С., Потехина Н.В., Сенченкова С.Н., Пискункова Н.Ф., Дорофеева Л.В., Евтушенко Л.И. Рамноманнаны и тейхуроновая кислота из клеточной стенки Rathayibacter tritici ВКМ Ас-1603Т // Биохимия. 2020а. Т. 85. С. 428–437.
Shashkov A.S., Tul’skaya E.M., Streshinskaya G.M., Dmitrenok A.S., Potekhina N.V., Senchenkova S.N., Piskunkova N.F., Dorofeeva L.V., Evtushenko L.I. Rhamnomannans and teichuronic acid from cell wall of Rathayibacter tritici VKM Ac-1603T // Biochemistry (Moscow). 2020a. V. 85. P. 369–377.
Шашков А.С., Тульская Е.М., Дорофеева Л.В., Евтушенко Л.И., Потехина Н.В. Гликозил-1-фосфатные полимеры и тейхулозоновая кислота из клеточной стенки Glutamicibacter protophormiae ВКМ Ac-2104T // Биохимия. 2020б. Т. 85. С. 736–742.
Shashkov A.S., Tul’skaya E.M., Dorofeeva L.V., Evtushenko L.I., Potekhina N.V. Two glycosyl 1-phosphate polymers and teichulosonic acid from Glutamicibacter protophormiae VKM Ac-2104T cell wall // Biochemistry (Moscow). 2020b. V. 85. P. 629–635.
Bock K., Pedersen C. Carbon 13 nuclear magnetic resonance spectroscopy of monosaccharides // Adv. Carbohydr. Chem. Biochem. 1983. V. 41. P. 27–66.
Busse H.J. Family I. Corynebacteriaceae // Bergey’s Manual of Systematic Bacteriology. 2nd edn. / Eds. Whitman W., Goodfellow M., Kämpfer P., Busse H.-J., Trujillo M., Ludwig W., Suzuki K.-I., Parte A. N.Y.: Springer-Verlag, 2012. V. 5. P. 244–245.
Busse H.J. Review of the taxonomy of the genus Arthrobacter, emendation of the genus Arthrobacter sensu lato, proposal to reclassify selected species of the genus Arthrobacter in the novel genera Glutamicibacter gen. nov., Paeniglutamicibacter gen. nov., Pseudoglutamicibacter gen. nov., Paenarthrobacter gen. nov. and Pseudarthrobacter gen. nov., and emended description of Arthrobacter roseus // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 9–37.
Chun J., Oren A., Ventosa A., Christensen H., Arahal D.R., da Costa M.S., Rooney A.P., Yi H., Xu X.W., De Meyer S., Trujillo M.E. Proposed minimal standards for the use of genome data for the taxonomy of prokaryotes // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 461–466.
Evtushenko L.I., Ariskina E.V. Nocardioidaceae // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–18. https://doi.org/10.1002/9781118960608.fbm00042
Goodfellow M. Nocardiaceae // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–5. https://doi.org/10.1002/9781118960608.fbm00014
Goodfellow M., Jones A.L. Corynebacteriales ord. nov. // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–14. https://doi.org/10.1002/9781118960608.obm00009
Keddie R.M., Cure G.L. Cell wall composition of coryneform bacteria // Special Publications of the Society for General Microbiology I. Coryneform Bacteria / Eds. Bousfield I.J., Callely A.G., London: Academic Press, 1978. P. 47–83.
Kohler T., Xia G., Kulauzovic E., Peschel A. Teichoic acids, lipoteichoic acids, and related cell wall glycopolymers of Gram-positive bacteria // Microbial Glycobiology: Structures, Relevance and Applications / Eds. Moran A., Holst O., Brennan P., von Itzstein M. Amsterdam: Elsevier, 2009. P. 75–91.
Lipkind G.M., Shashkov A.S., Mamyan S.S., Kochetkov N.K. The nuclear Overhauser effect and structural factors determining the conformations of disaccharide glycosides // Carbohydr. Res. 1988. V. 181. P. 1–12.
Magee J.G., Ward A.C. Mycobacterium // Bergey’s Manual of Systematics of Archaea and Bacteria / Ed. Whitman W.B. 2015. P. 1–84. https://doi.org/10.1002/9781118960608.gbm00029
Naumova I.B. The teichoic acids of actinomycetes // Microbiol. Sci. 1988. V. 5. P. 275–279.
Nouioui I., Carro L., Garcia-Lopez M., Meier-Kolthoff J.P., Woyke T., Kyrpides N.C., Pukall R., Klenk H.P., Goodfellow M., Goker M. Genome-based taxonomic classification of the phylum Actinobacteria // Front. Microbiol. 2018. V. 9. Art. 2007. https://doi.org/10.3389/fmicb.2018.02007
Potekhina N.V., Streshinskaya G.M., Tul’skaya E.M., Shashkov A.S. Cell wall teichoic acids in the taxonomy and characterization of Gram-positive bacteria // Taxonomy of Prokaryotes, Methods in Microbiology / Eds. Rainey F.A., Oren A. London: Academic Press, 2011. V. 38. Ch. 6. P. 132–164.
Ryzhmanova Y., Oshurkova V., Troshina O., Abashina T., Ariskina E., Avtukh A., Shcherbakova V. Anoxynatronum buryatiense sp. nov., an anaerobic alkaliphilic bacterium from a low mineralization soda lake in Buryatia, Russia // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 4704–4709.
Schade J., Weidenmaier C. Cell wall glycopolymers of firmicutes and their role as nonprotein adhesins // FEBS Lett. 2016. V. 590. P. 3758–3771.
Schäffer C., Messner P. The structure of secondary cell wall polymers: how Gram-positive bacteria stick their cell walls together // Microbiology (SGM). 2005. V. 151. P. 643–651.
Shashkov A.S., Potekhina N.V., Kachala V.V., Senchenkova S.N., Dorofeeva L.V., Evtushenko L.I. A novel galactofuranan from the cell wall of Arthrobacter sp. VKM Ac-2576 // Carbohydr. Res. 2012. V. 352. P. 215–218.
Schleifer K.H., Kandler O. Peptidoglycan types of bacterial cell walls and their taxonomic implications // Bacteriol. Rev. 1972. V. 36. P. 407–477.
Schumann P. Peptidoglycan structure // Taxonomy of Prokaryotes, Methods in Microbiology / Eds. Rainey F.A., Oren A. London: Academic Press, 2011. Ch. 6. V. 38. P. 101–129.
Schumann P., Kämpfer P., Busse H.J., Evtushenko L.I. Proposed minimal standards for describing new genera and species of the suborder Micrococcineae // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1823–1849.
Takeuchi M., Yokota A. Cell-wall polysaccharides in coryneform bacteria // J. Gen. Appl. Microbiol. 1989. V. 35. P. 233–252.
Takeuchi M., Yokota A., Misaki A. Comparative structures of the cell-wall polysaccharides of four species of the genus Microbacterium // J. Gen. Appl. Microbiol. 1990. V. 36. P. 255–271.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


