Микробиология, 2021, T. 90, № 1, стр. 76-89
Микробный консорциум, осуществляющий удаление фосфатов в циклическом аэробно-анаэробном культивировании
А. В. Пелевина a, *, Ю. Ю. Берестовская a, В. А. Грачёв a, И. К. Дорофеева a, В. В. Сорокин a, А. Г. Дорофеев a, b, А. Ю. Каллистова a, Ю. А. Николаев a, Р. Ю. Котляров c, А. В. Белецкий c, Н. В. Равин c, Н. В. Пименов a, А. В. Марданов c
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b АО “Мосводоканал”
105005 Москва, Россия
c Институт биоинженерии, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: annie.pelevina@yandex.ru
Поступила в редакцию 05.08.2020
После доработки 24.09.2020
Принята к публикации 29.09.2020
Аннотация
Исследованы особенности формирования сообщества фосфат-аккумулирующих микроорганизмов в лабораторном биореакторе последовательно-периодического действия (sequencing batch reactor, SBR), обеспечивающим чередование аэробных и анаэробных условий при периодическом сливе и добавлении среды. Биореактор обеспечивал удаление 50% фосфора из поступающей среды уже через 22 сут с момента запуска. Методами микроскопии и рентгеновского микроанализа показано наличие клеток разной морфологии, которые содержали обогащенные фосфором гранулы. Методом высокопроизводительного секвенирования фрагментов гена 16S рРНК выявлены изменения в составе микробного сообщества активного ила в процессе его культивирования в биореакторе. Показана смена форм бактерий в сообществе, связанная с увеличением относительного вклада представителей порядка Bacteroidetes (до 43% от всех последовательностей гена 16S рРНК), а также представителей классов Alpha- и Betaproteobacteria (до 15 и 27% соответственно). В момент запуска биореактора в посевном материале (активный ил очистных сооружений) доля типичных представителей активного ила фосфат-аккумулирующих микроорганизмов – бактерий рода “Candidatus Accumulibacter” класса Betaproteobacteria была низкой – 0.2% от общего количества последовательностей гена 16S рРНК, и они полностью элиминировались из сообщества в ходе работы биореактора. К моменту максимального удаления фосфора из поступающей среды произошло увеличение доли других представителей этого класса – бактерий родов Dechloromonas и Zoogloea семейства Rhodocyclaceae с (0.7 до 11.1%) и (с 0.09 до 11.5%) соответственно. По-видимому, эффективное удаление фосфатов связано с развитием бактерий семейства Rhodocyclaceae, которые ранее не относили к типичным представителям ФАО.
Микроорганизмы группы фосфат-аккумулирующих организмов (ФАО), способные к внутриклеточному накоплению полифосфатов, осуществляют биологическую очистку сточных вод от фосфора. Они развиваются в активном иле очистных сооружений при обязательной цикличности условий роста: периодической смене отсутствия и наличия акцепторов электронов (в первую очередь кислорода) и, соответственно, присутствия и отсутствия легкодоступных органических веществ (Van Loosdrecht et al., 1997; Mino et al., 1998; Seviour et al., 2003; Wentzel et al., 2008). Периодическая смена условий роста определяет направленность основных метаболических путей ФАО. В анаэробных условиях (без акцепторов электронов) ФАО поглощают органические соединения (главным образом, летучие жирные кислоты (ЛЖК)) и запасают их в форме внутриклеточных полимеров с одновременной деградацией внутриклеточных полифосфатов и выбросом ортофосфата из клеток. В аэробных условиях и (или) при наличии альтернативного акцептора электронов (нитратов или нитритов) ФАО способны расти, поглощать ортофосфаты и синтезировать внутриклеточные полифосфаты, используя для этих процессов энергию от разложения внутриклеточных источников углерода и энергии, накопленных в анаэробных условиях. Таким образом, представители ФАО относятся к микроорганизмам, обладающим циклическим типом метаболизма (Дорофеев и соавт., 2019).
Группа ФАО не является монофилетичной, т.е. способность к аккумуляции фосфатов выявлена у представителей различных филогенетических групп микроорганизмов, как бактерий, так и архей. В настоящее время к истинным ФАО относят представителей кандидатного рода “Ca. Accumulibacter phosphatis” (сем. Rhodocyclacea, Betaproteobacteria) (Hesselmann et al., 1999; Nguyen et al., 2012; Stokholm-Bjerregaard et al., 2017; Zeng et al., 2018; Qiu et al., 2019), которые в качестве субстрата используют летучие жирные кислоты (ацетат, пропионат). В зависимости от используемых акцепторов электронов внутри этого фенотипа выделяют две основные филогенетические группы “Ca. Accumulibacter phosphatis” (тип I и тип II), каждая из которых в свою очередь подразделяется на клады (тип I – на клады от IА до IЕ и тип II на клады от IIA до II I) (Rubio-Rincon et al., 2017). ФАО I используют в качестве акцепторов электронов нитрат и нитрит, а ФАО II – только кислород (Figdore et al., 2018; Dasgupta et al., 2019). К потенциальным представителям ФАО относят широко распространенные в очистных сооружениях аэробные актинобактерии Tetrasphaera (Maszenan et al., 2000; Nielsen et al., 2019), а также ряд других прокариот, роль которых в биологическом удалении фосфора надежно не установлена – Thiothrix caldifontis (Rubio-Rincón et al., 2017), Microlunatus phosphovorus (Nakamura et al., 1995), “Ca. Accumulimonas” (Nguyen et al., 2012), новая группа органотрофных бактерий семейства Comamonadaceae (Ge et al., 2015), Dechloromonas (Ren et al., 2020), Methanosarcina mazei (Paula et al., 2019).
Несмотря на полувековой опыт использования ФАО в процессах очистки сточных вод и огромное количество исследований, посвященных этой группе бактерий, физиология фосфат-аккумулирующих бактерий до сих пор детально не изучена. Основная причина заключается в том, что в связи со сложностью организации и большим разнообразием микробных сообществ активных илов, в которых бактерии тесно связаны слизистым матриксом, выделить представителей ФАО с циклическим типом метаболизма в чистую культуру до сих пор никому не удалось (Дорофеев и соавт., 2019). Источниками информации о ФАО являются метагеномный анализ микробных консорциумов, осуществляющих биологическое удаление фосфатов в крупномасштабных очистных сооружениях, и лабораторных культур фосфат-аккумулирующих организмов. На основании исследования метагенома ила, обогащенного “Ca. Accumulibacter phosphatis”, было установлено, что представители ФАО II имеют полный набор генов фиксации азота и CO2 (Flowers et al., 2013). Исследования экспрессии генов цикла трикарбоновых кислот выявили значительные расхождения в анаэробном и аэробном метаболизме различных популяций “Ca. Accumulibacter phosphatis” (Wexler et al., 2009). Было показано, что представители ФАО имеют как общие пути центрального метаболизма углерода и фосфора, так и специфические, связанные со спектром используемых органических субстратов и акцепторов электронов (Skennerton et al., 2015). На основании протеомного анализа было установлено, что анаэробная деградация гликогена у всех изученных “Ca. Accumulibacter phosphatis” осуществляется по пути Эмбдена–Мейергофа–Парнаса (Wilmes et al., 2008).
Выращивание обогащенных ФАО культур проводят, как правило, в реакторах типа SBR (Sequencing Batch Reactor) (Artan et al., 2005; Liu et al., 2020; Fan et al., 2020), воспроизводящих технологические условия крупномасштабных очистных сооружений. Эта технология имеет ряд недостатков. В частности, для получения в SBR культур с высокой плотностью (несколько граммов в литре) прибегают к удержанию в биореакторе части биомассы, в результате чего развитие культур происходит в виде флоккул, которые имеют такую же сложную многокомпонентную структуру, как активный ил очистных сооружений. Получить микробное сообщество с минимальным количеством компонентов, в котором доминируют ФАО, в таких реакторах практически невозможно. Существенный прогресс в исследовании ФАО авторы видят в развитии и совершенствовании альтернативных способов циклического культивирования, поддерживающих оптимальные условия для роста ФАО в гомогенной культуре и дающих преимущество по сравнению с традиционным SBR-культивированием. В гомогенной культуре проще проводить физиологические исследования и выделять чистые культуры ФАО традиционными микробиологическими методами.
В настоящей работе для минимизации образования флоккул и получения гомогенного микробного сообщества, обогащенного ФАО, был выбран циклический отъемно-доливной способ культивирования с перемешиванием в модифицированном биореакторе SBR-типа, обеспечивающем чередование аэробных и анаэробных условий. Целью исследования было изучение развивающегося в этих условиях фосфат-аккумулирующего микробного консорциума, его описание и изучение видового состава.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Культивирование в биореакторе. Лабораторный биореактор для циклического культивирования микробного сообщества был создан на основе биореактора BIOSTAT B (фирмы “Sartorius”), имеющего рабочий объемом 2 л, снабженного перемешивающим устройством и внешней рубашкой для термостатирования. Схема биореактора для культивирования представлена на рис. 1.
Рис. 1.
Схема установки для отъемно-доливного аэробно/анаэробного выращивания микроорганизмов: 1 – биореактор; 2 – насос подачи среды; 3 – насос отведения культуры; 4 – воздушный компрессор; 5 – источник газообразного азота; 6 – система регулирования подачи газов.
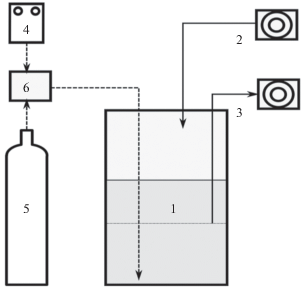
Цикличность культивирования заключалась в чередовании анаэробных условий с присутствием ацетата (легкодоступного источника углерода и энергии) и аэробных условия без ацетата (после его потребления в анаэробный период). Подача свежей среды в биореактор и слив культуры осуществляли с помощью двух перистальтических насосов. Аэробные и анаэробные условия создавали за счет подачи в биореактор воздуха или азота, очищенного от следов кислорода, с использованием системы регулирования подачи газов (ООО “Элточприбор”, Россия). Управление газовыми потоками и перистальтическими насосами осуществляли в автоматическом режиме с использованием универсального логического модуля LOGО (“Siemens”).
Каждый цикл культивирования микробного сообщества в биореакторе длился 6 ч и состоял из нескольких последовательных этапов:
1) создание анаэробных условий продувкой реактора азотом в течение 5 мин со скоростью 5 л/мин (за это время концентрация О2 в культуре падала ниже 0.05 мг О2/л), после чего в биореактор подавали питательную среду в объеме 0.125 л. Общая продолжительность этого этапа составляла 10 мин;
2) анаэробный период, в течение которого культуру перемешивали мешалкой со скоростью 200 об./мин. Продолжительность анаэробного периода составляла 2 ч 50 мин;
3) аэробный период, в течение которого микробное сообщество аэрировали воздухом. Продолжительность аэробного периода – 3 ч.
Через каждые четыре цикла выращивания (24 ч) в конце аэробного периода (за 5 мин до его окончания) прекращали подачу воздуха и 0.5 л культуры сливали из биореактора (остаточный объем культуры в реакторе составлял 1.5 л).
Таким образом, усредненная удельная скорость протока системы составила 0.29 л/сут, что в квазистационарном состоянии соответствует возрасту культуры 3.4 сут (время генерации – 2.4 сут).
Для предотвращения зарастания емкости с питательной средой и подающих ее в реактор шлангов, эти части установки еженедельно промывали стерильной водопроводной водой, нагретой до 95°С.
Посевным материалом (инокулянтом), который вносили в биореактор, служил ил аэротенков Люберецких очистных сооружений (г. Москва).
Питательная среда, подобранная на основании мирового опыта лабораторного выращивания ФАО (Onuki et al., 2002; Welles et al., 2017) имела следующий состав (г/л водопроводной воды): CH3COONa (3H2O) – 0.708; (NH4)2SO4 – 0.046; КH2PO4 – 0.109; дрожжевой экстракт – 0.009; MgSO4 ∙ 7H2O – 0.135. В качестве основного источника углерода и энергии был использован ацетат (Artan et al., 2005; Tchobanoglous et al., 2014).
Аналитические методы. Значение рН среды измеряли с помощью рН-метра-иономера Эксперт-001 (“ООО Эконикс-Эксперт”, Россия). В процессе культивирования в реакторе значение рН находилось в пределах 8.5–8.7.
Температуру культивирования микробного сообщества 18–20°С задавали с помощью термостата Haake® WKL 26 (“Thermo Fisher Scientific”, США).
Количество взвешенного вещества в отобранной из реактора пробе после ее фильтрования и высушивания определяли гравиметрически (ПНДФ 14.1:2:4.254-09).
Концентрацию фосфатов определяли фотометрически с молибдатом аммония как в подающейся в биореактор питательной среде, так и на выходе из биореактора в конце аэробной и анаэробной фаз культивирования (ПНДФ 14.1:2:4.248-07).
Концентрацию растворенного кислорода измеряли электрохимически с использованием кислородомера Oxi 197 (“WTW”, Германия).
Исследование культуры фосфат-аккумулирующих бактерий. Морфологию клеток исследовали на микроскопе Olympus CX41 с фазовым контрастом (“Olympus”, Япония).
Фосфат-аккумулирующие бактерии в составе микробного сообщества определяли по наличию в составе клеток гранул, состоящих из соединений фосфора, о чем судили по результатам рентгеновского микроанализа препаратов.
Количество клеток (% от состава клеток всего сообщества), имеющих в своем составе различные включения, определяли на основании среднего значения, полученного при подсчете клеток в 80 полях зрения.
Электронно-микроскопические исследования тотальных препаратов проводили на микроскопе JEM 100 (“Jeol”, Япония) по методике описанной ранее (Vasilyeva et al., 2006). Для приготовления препаратов клетки фиксировали 2.5% глутаровым альдегидом. Дофиксацию проводили раствором тетраокиси осмия.
Рентгеновский микроанализ препаратов клеток проводили на микроскопе JEM-1400 (“Jeol”, Япония), оснащенного рентгеновским микроанализатором (“Oxford Instruments”, Великобритания), при ускоряющем напряжении 80 кэВ; угол наклона образца – 15°. Получаемые спектры анализировали с применением программы AZtec (“Oxford Instruments”, Великобритания). Эту же программу использовали для элементного картирования образцов. Образцы для рентгеновского микроанализа готовили с использованием медных сеток для электронной микроскопии с нанесенной формваровой пленкой, напыленной углеродом, на которые наносили нативные препараты клеток. Сеточки высушивали и использовали для анализа.
Статистическую обработку проводили с использованием пакета программ Microsoft Office Exel 2007.
Исследуемые образцы. Для исследования состава развивающегося микробного консорциума в лабораторном биреакторе отбирали четыре образца активного ила:
1) Образец активного ила из промышленного биореактора по удалению органического вещества, аммония и фосфора. В биореакторе реализована технология Кейптаунского университета (Burton et al., 2014), основанная на чередовании аэробной и анаэробной зон (в аэротенке карусельного типа). Данный образец использовался для загрузки лабораторного биореактора.
2) Образец активного ила, отобранного из лабораторного биореактора на 8 сут с момента его пуска.
3) Образец активного ила, отобранного из лабораторного биореактора на 15 сут с момента его пуска.
4) Образец активного ила, отобранного из лабораторного биореактора на 22 сут с момента его пуска.
Выделение ДНК для метагеномного анализа, амплификация и секвенирование фрагментов генов 16S рРНК. ДНК из образцов активного ила выделяли с помощью набора DNeasy PowerSoil Kit (“Qiagen”, Германия) по протоколам производителя. Вариабельный V3–V4 регион гена 16S рРНК амплифицировали с использованием универсальных праймеров 341F CCTAYGGGDBGCWSCAG и 806R GGACTACNVGGGTHTCTAAT (Frey et al., 2016). Полученные ПЦР фрагменты использовали для приготовления библиотек для секвенирования с помощью наборов Nextera XT DNA Library Prep Kit (“Illumina”) по протоколам производителя. Мультиплексировали с помощью наборов Nextera XT Index Kit v2. ПЦР фрагменты секвенировали с использованием Illumina MiSeq. Для каждого образца получали не менее 8 тысяч последовательностей фрагментов генов 16S рРНК.
Чтения из всех образцов были объединены вместе, исключены низкокачественные чтения, синглетоны и химеры. Оставшиеся чтения были кластеризованы в ОТЕ с минимальной идентичностью в 97%. Для определения доли ОТЕ в каждом из образцов, на репрезентативные последовательности ОТЕ были наложены исходные чтения (включая низкокачественные и синглетоны) с минимальной идентичностью в 97% на всей длине чтения. Для выполнения всех этих процедур использовался пакет программ usearch (Edgar, 2010). Таксономическую идентификацию микроорганизмов по последовательностям генов 16S рРНК проводили с использованием usearch и базы данных Silva.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
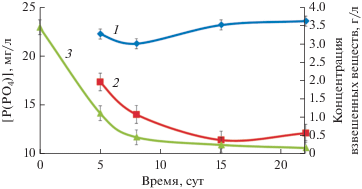
Культивирование ФАО. Разработана методика выращивания ФАО в биореакторе, основанная на периодическом (циклическом) изменении условий культивирования. Содержание взвешенного вещества в биореакторе после его инокуляции активным илом составляло 3.43 г/л, рН 8.5. В течение первых 15 сут происходило уменьшение массы взвеси до 0.2 г/л за счет ее вымывания и незначительное изменение рН до 8.9. За это время снижалось количество грубодисперсной примеси, после чего взвешенное вещество практически полностью было представлено микробной биомассой. С 15 до 22 сут концентрация микробной биомассы, а также значение рН водной фазы реактора держались на постоянном уровне, что свидетельствовало о стабилизации его работы. Одновременно с этим происходило постепенное уменьшение содержания фосфатов в водной фазе реактора. Если на 5 сут культивирования разница между количеством фосфатов в исходной среде и сливной воде биореактора составляла 4.9 мг/л, то к 8 сут эта цифра возрастала в 1.5 раза (до 7.2 мг/л), а к 22 сут она составила 11–12 мг Р-РО4/л, что соответствовало 50% удаления фосфора из поступающей среды (рис. 2).
Рис. 2.
Изменение содержания растворимых фосфатов в биореакторе: 1 – концентрация P-PO4 в среде, поступающей в реактор; 2 – концентрация P-PO4 на выходе из биореактора; 3 – концентрация взвешенных веществ в биореакторе.
Для выяснения природы удаления фосфора, нами было исследовано изменение количества фосфатов в среде в течение одного цикла работы, включающего аэробную и анаэробную фазы. Количественные данные о содержании фосфатов в течение одного цикла культивирования на 8, 15 и 22 сут работы реактора представлены в табл. 1. Необходимо отметить, что в соответствии с биохимическими реакциями, протекающими у ФАО, в анаэробных условиях в отсутствие окислителей и при наличии ацетата происходит выброс фосфатов из клеток. При попадании в аэробные условия клетки ФАО окисляют накопленные углеродные субстраты и при этом поглощают фосфата из среды (Terashgima et al., 2016).
Таблица 1.
Изменение концентрации фосфатов в ходе одного цикла культивирования микробного сообщества на 8, 15 и 22 сут работы биореактора
| Время культивирования, сут | Концентрация P-PO4, мг/л | |||
|---|---|---|---|---|
| начало цикла | конец анаэробной фазы | конец аэробной фазы | Δ, мг/л |
|
| 8 | 14.6 ± 1.18 | 17.0 ± 1.19 | 14.0 ± 1.35 | 3.0 |
| 15 | 12.3 ± 1.18 | 14.7 ± 1.19 | 11.4 ± 1.35 | 3.3 |
| 22 | 13.0 ± 1.18 | 15.3 ± 1.19 | 12.1 ± 1.35 | 3.2 |
Полученные результаты свидетельствовали о том, что в процессе культивирования активного ила очистных сооружений в лабораторной установке развивалось микробное сообщество, включающее физиологически активных представителей ФАО. Также важно, что концентрация фосфатов на выходе из реактора была всегда ниже, чем в поступающей воде.
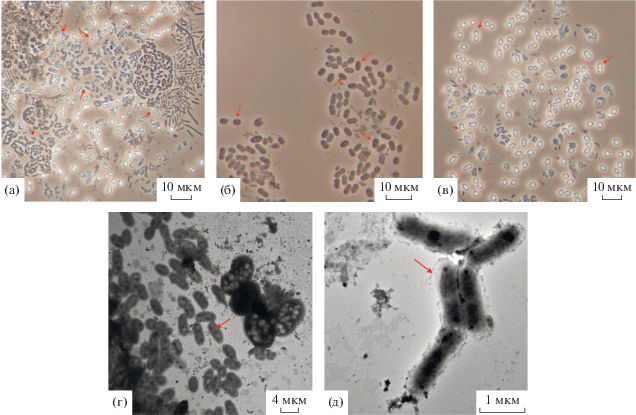
Исследование клеток ФАО методами микроскопии и рентгеновского микроанализа. Микроскопическое исследование микробного сообщества биореактора выявило морфологическое разнообразие бактериальных форм в его составе. Большинство (до 85%) клеток содержало включения (рис. 3). В целом, в сообществе доминировали вытянутые округлые клетки размером (1–1.5) × × (2–3.5) мкм, которые содержали преломляющие свет структуры разного размера, расположенные вдоль клеток (рис. 3а). Крупные палочковидные клетки размером (2–3) × (3–5) мкм содержали мелкие плотные темные включения (рис. 3б). Наряду с палочковидными клетками в сообществе развивались клетки округлой формы размером 2.4 × 3.3 мкм со светящимися круглыми внутриклеточными структурами, которые располагались равномерно по всему объему клетки (рис. 3в). Электронно-микроскопическое исследование подтвердило наличие в микробном сообществе клеток с разными включениями (рис. 3г, 3д).
Рис. 3.
Бактериальное разнообразие в составе микробного сообщества биореактора: а–в – фазовый контраст, ×1000; г – электронная микроскопия, ×800; д – электронная микроскопия, ×1700. Стрелками показаны клетки с включениями.
Для определения химического состава включений нами было сделано картирование микробного сообщества в целом методом рентгеновского микроанализа, а также проведен точечный анализ элементного состава бактериальных клеток. Метод рентгеновского микроанализа позволяет проводить быстрое определение элементного состава микробных объектов, как отдельных клеток, так и их скоплений, что позволяет получить информацию по содержанию интересующего нас фосфора и других элементов в сравнительном количественном соотношении друг к другу. Применение режима картирования программы AZtec дает возможность увидеть наглядную картину распределения элементов в образце.
Картирование позволило установить, что химические элементы, включая фосфор, распределялись внутри представителей сообщества по-разному. Часть элементов содержались внутри клеток, часть сорбировалась в межклеточном пространстве на поверхности клеток сообщества. В палочковидных клетках размером (1–1.5) × (2–3.3) мкм такие химические элементы как углерод, калий, сера и кальций были равномерно распределены в клетках, а фосфор, натрий и магний находились не только внутри клеток, но в межклеточном пространстве (рис. 4). В клетках палочковидной формы размером 0.5 × 2 мкм нами были обнаружены электронно-плотные структуры, которые были идентифицированы как включения фосфора (рис. 5а, 5б). Для подтверждения результатов картирования микробного сообщества в целом, нами был проведен точечный элементный анализ отдельных клеток сообщества. Наиболее характерные для этих клеток спектры показаны на рис. 5в. Процентное содержание химических элементов в точках анализа представлено в табл. 2. Точечный анализ показал, что содержание фосфора в клетках (спектры 51–54) было выше, по сравнению с фоновым количеством этого элемента. Включения фосфора (спектры 51 и 52) в палочковидных клетках содержали в 10 раз больше этого элемента, по сравнению с контролем. Включения в изогнутых клетках (спектр 53) содержали в 8 раз больше этого элемента. Максимальное количество фосфора находилось в кокковидных клетках (спектр 54).
Рис. 4.
Элементный анализ микробного сообщества в целом методом картирования с применением рентгеновского микроанализа. Цветом показано распределение отдельных химических элементов; а – электронная фотография сообщества; б – распределение углерода; в – распределение фосфора; г – распределение натрия; д – распределение калия; е – распределение магния; ж – распределение серы; з – распределение кальция. Стрелками показано накопление химических элементов в межклеточном пространстве.

Рис. 5.
Точечный анализ элементного состава бактериальных клеток фосфат-аккумулирующего сообщества методом картирования с применением рентгеновского микроанализа: (а) – электронная фотография клеток; (б) – распределение фосфора в клетках сообщества; стрелками показаны обогащенные фосфором гранулы. (в) – контроль – фоновое внеклеточное содержание фосфора; содержание химических элементов: в гранулах палочковидных клеток (спектры 51 и 52); в гранулах изогнутых клеток (спектр 53); в кокковидных клетках (спектр 54). Стрелками отмечены пики фосфора.
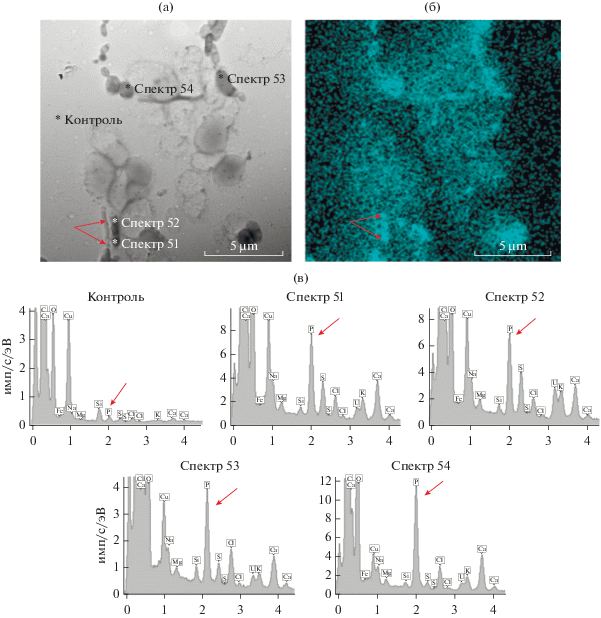
Таблица 2.
Содержание химических элементов в точках анализа, выраженное в процентах от общего содержания элементов
| Номер спектра | Контроль (подложка без клеток) | 51 | 52 | 53 | 54 |
|---|---|---|---|---|---|
| Содержание фосфора, % | 0.15 | 1.63 | 1.59 | 1.31 | 3.16 |
| Отношение концентраций фосфора в исследуемой точке к контролю | 1 | 10.87 | 10.6 | 8.73 | 21.07 |
Таким образом, было показано, что фосфор находился как на поверхности, так и внутри клеток. Распределение этого элемента внутри клеток было разным. Часть бактерий микробного сообщества биореактора содержали фосфорные гранулы и могли быть представителями ФАО.
Изменение таксономического состава микробного консорциума в процессе его культивировния. На начальном этапе работы биореактора в составе микробного сообщества активного ила были обнаружены последовательности представителей доменов бактерий и архей. Доля архей составляла небольшую часть – 1.17% от общего количества последовательностей. Среди них доминировали метаногены порядка Methanosarcinales и представители некультивируемого кандидатного филума Wosearchaeota. Ближайшие гомологи найденных последовательностей генов 16S рРНК были обнаружены в очистных сооружениях, сбраживающих осадки в анаэробных условиях, и метантенках (Kirkegaard et al., 2017).
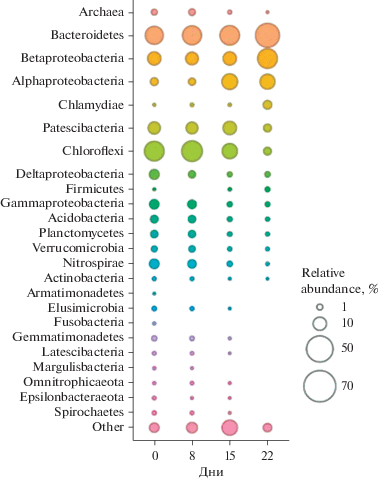
Бактериальные последовательности относились к 19 различным филумам, среди которых доминировали представители филумов Bacteroidetes (22.4%), Proteobacteria (22.3%), Patescibacteria (8.8%), Chloroflexi (27.2%) и Nitrospirae (4.7%). Суммарно их доля от всех последовательностей генов 16S рРНК составляла 85.4%. Филумы Acidobacteria, Planctomycetes, Verrucomicrobia и др. составляли минорную часть микробного сообщества (рис. 6).
Около 4.8% всех последовательностей фрагментов генов 16S рРНК относилось к неизвестным глубоким линиям и не были классифицированы даже на уровне филума.
Большинство идентифицированных филумов ранее обнаруживались в биореакторах по очистке сточных вод (Wu et al., 2019).
По мере культивирования сообщества менялся его состав, и снижалось таксономическое разнообразие. Так доля архей в ходе работы биореактора снизилась до 0.01% (рис. 6). Доля остальных доминирующих в момент загрузки филумов Patescibacteria (8.8%), Chloroflexi (27.2%) и Nitrospirae (4.7%) в ходе работы биореактора значительно снизилась – до 2.66, 2.63 и 0.15% соответственно. Филум Patescibacteria был описан совсем недавно на основании молекулярных данных (Hug et al., 2016; Parks et al., 2018) и в настоящее время не имеет культивируемых представителей. Метаболизм бактерий этого филума был предсказан только на основании метагеномного анализа микробных сообществ. Patescibacteria имеют, как правило, небольшие геномы, при этом многие метаболические пути у них отсутствуют или они неполные. На основании этих данных предполагается, что бактерии этого филума являются либо паразитами, либо симбионтами.
В ходе работы биореактора большинство минорных групп микроорганизмов были элиминированы, среди них представители филумов Fusobacteria, Ca. Margulisbacteria, Ca. Latescibacteria, Spirochaetes, Elusimicrobia, Gemmatimonadetes, Armatimonadetes и Omnitrophica. Доли остальных минорных групп также снижались (рис. 6).
Число обнаруженных ОТЕ сократилось с 445 до 184. На заключительном этапе 61% (10 наиболее многочисленных ОТЕ) всех прочтений составляли ОТЕ, которые на начальном этапе работы биореактора составляли всего 1% сообщества.
Доли двух доминирующих в загрузке филумов Bacteroidetes (22.4%) и Proteobacteria (22.3%) в ходе культивирования в циклически изменяющихся условиях увеличились. Доля Bacteroidetes, которые способны к разложению сложного органического вещества, возросла почти в два раза – до 42.8% (Thomas et al., 2011; Fernández-Gómez et al., 2013; Hahnke et al., 2016). При этом основной рост приходился на виды, относящиеся к порядкам Chitinophagales, Cytophagales и Sphingobacteriales.
В ходе работы биореактора доля протеобактерий возросла с 22.3 до 43.2%, что было связано с увеличением численности представителей двух классов α- и β-Proteobacteria (с 2.7 до 14.8% и с 10.7 до 27.3% соответственно), в то время как доля γ-, δ-, ε-протеобактерий снизилась с 9.5 до 1.4%. Среди альфапротеобактерий в биореакторе существенно возрастала доля микроорганизмов, относящихся к порядку Microvibrionales (с 0.28 до 7.4%), близкие последовательности 16S рРНК к которым были обнаружены ранее в биопленке аноксигенного гибридного реактора по очистке сточных вод от азота и фосфора (последовательность JN391746, идентична на 98% с OTU1), а также доля бактерий рода Gemmobacter с 0.04 до 3.7%, в который входят гетеротрофные бактерии, являющиеся факультативным анаэробами (Rothe et al., 1987).
Бетапротеобактерии, доминирующие в большинстве исследованных микробных сообществ активных илов промышленных очистных сооружений (Yu, Zhang, 2012; Wu et al., 2019), в составе сообщества нашего биореактора были представлены семейством Rhodocyclaceae. Следует отметить, что в ходе развития микробного сообщества существенно изменялось соотношение долей родов внутри этого семейства. В частности, снижалась доля представителей рода Thauera (с 3.6 до 0.1% от общего числа чтений). Известно, что эти микроорганизмы способные разлагать широкий спектр органических кислот и ароматических соединений (Mechichi et al., 2002; Mao et al., 2010). В тоже время, увеличились доли представителей рода Zoogloea (с 0.09 до 11.5%), который встречается в составе большинства микробных сообществ активных илов (Zhang et al., 2012; Wu et al., 2019) и представителей рода Dechloromonas семейства Rhodocyclaceae – с 0.74 до 11.1% от всех последовательностей гена 16S рРНК. Родственные им микроорганизмы были найдены в микробных сообществах различных очистных сооружений, в частности, ближайшие последовательности генов 16S были найдены в аэробном ферментере в Китае (LT841763 – 99%, LT842295 – 99% идентичность) (Dasgupta et al., 2019). В состав семейства Rhodocyclaceae входят фосфат-аккумулирующие организмы, в частности, вид “Ca. Accumulibacter”, который доминирует в большинстве микробных сообществ промышленных сооружений по очистке сточных вод от соединений фосфора (Bond et al., 1995; Mao et al., 2015; Barr et al., 2016; Дорофеев и соавт., 2019). В лабораторном биореакторе в момент загрузки активным илом очистных сооружений бактерии Ca. Accumulibacter ожидаемо идентифицировались и были представлены двумя ОТЕ, доли которых составляли всего 0.01 и 0.2% и имели высокое сходство с последовательностями гена 16S рРНК, выявленных в SBR-реакторе по удалению фосфора (идентичность генов 16S рРНК 96%, HM046420) и биореакторах по очистке сточных вод (99% идентичности с LR637422) (Bond et al., 1995; Mao et al., 2015). Однако в процессе культивирования доля этих организмов снижалась, и к концу работы биореактора они не обнаруживались в составе микробного сообщества. Таким образом, в сконструированном биореакторе в процессе циклического культивирования развивались представители ФAO, которые не были характерны для крупномасштабных очистных сооружений (Artan, Orhon, 2005).
В заключение следует отметить, что использованное нами последовательно-периодическое культивирование позволило получить фосфат-аккумулирующее микробное сообщество, отличающееся от сообщества флоккулированного активного ила промышленного аэротенка, использованного в качестве инокулята, большей гомогенностью и низкой плотностью популяции. Количественные изменения концентрации фосфатов в анаэробный и аэробный периоды и итоговое снижение содержания фосфора в среде указывали на развитие в биореакторе бактерий, которые отвечают за удаление фосфора аналогично процессам биологического удалении фосфора активным илом в очистных сооружениях. Обычно содержание фосфора в сточных водах составляет 4–8 мг/л (Qasim, Zhu, 2017) и снижается до концентрации менее 1 мг/л. При этом концентрация активного ила в промышленных реакторах как правило находится в пределах 2–4 г/л. В наших экспериментах при концентрации биомассы на порядок меньше (0.2 г/л), чем в промышленных очистных сооружениях, удаление фосфора достигало 12 мг/л, что на порядок выше по удельным показателям удаления фосфора на единицу биомассы активного ила. Полученные результаты позволяют сделать вывод об эффективности использования последовательно-периодического способа культивирования активного ила очистных сооружений, в процессе которого в лабораторном биореакторе развивалось микробное сообщество с высоким содержанием фосфат-аккумулирующих бактерий.
Микроскопические методы исследования показали накопление фосфора в виде гранул в клетках разной морфологии, что свидетельствовало о развитии разных представителей группы ФАО в микробном сообществе. Молекулярно-биологические методы не только подтвердили наличие фосфат-аккумулирующих бактерий в составе сообщества, но и позволили проследить динамику развития сообщества ФАО в целом и определить доминирующих представителей этой группы микроорганизмов. Интересно отметить, что в активном иле очистных сооружений, который использовали как инокулянт, были идентифицированы известные бактерии семейства Rhodocycla-ceae – “Ca. Accumulibacter”, которые считаются типичными для очистных сооружений. Они были представлены двумя ОТЕ, близкими к последовательностям гена 16S рРНК, ранее обнаруженным в SBR-реакторе по удалению фосфора (идентичность генов 16S рРНК 96%, HM046420) и биореакторах по очистке сточных вод (99% идентичности с LR637422) (Bond et al., 1995; Mao et al., 2015; Barr et al., 2016; Welles et al., 2017; Дорофеев и cоавт., 2019). Однако в процессе работы лабораторного биреактора доля этих организмов снижалась. В момент наиболее эффективного удаления фосфора микробным сообществом бактерии “Candidatus Accumulibacter phosphatis” не были идентифицированы в его составе. Доминирующими группами в этот момент были представители семейства Rhodocyclaceae, относящиеся к родам Dechloromonas и Zoogloea, доля последовательностей гена 16S рРНК которых увеличилась за время работы реактора максимально по сравнению с долей последовательностей других бактерий.
Бактерии рода Zoogloea часто встречаются в активных илах очистных сооружений (Barr et al., 2016; Wu et al., 2019). В ряде работ сообщалось о совместном накоплении представителей родов Zoogloea и Dechloromonas в биореакторах по удалению фосфора в денитрифицирующих условиях (denitrifying phosphorus removal) (Bond et al., 1995). Были высказаны предположения о том, что бактерии рода Zoogloea могут быть потенциальными ФАО (Shao et al., 2009). Так у единственного вида Zoogloea ramigera были обнаружены внутриклеточные гранул волютина (Roinestad, Yall, 1970). Микроорганизмы, родственные бактериям рода Dechloromonas, были найдены в микробных сообществах различных очистных сооружений, в частности, ближайшие к этому роду последовательности генов 16S были идентифицированы в аэробном ферментере в Китае (LT841763 – 99%, LT842295 – 99% идентичность) (Bond et al., 1995; Mao et al., 2015; Welles et al., 2017; Dasgupta et al., 2019).
Таким образом, режим работы лабораторного биореактора с циклическим последовательно-периодическим способом культивирования микробного сообщества активного ила очистных сооружений оказался неблагоприятным для развития типичных для очистных сооружений Candidatus “Accumulibacter phosphatis” семейства Rhodocycla-ceae и давал преимущество для роста других представителей этой физиологической группы. В составе сообщества были идентифицированы представили двух других родов этого семейства – родов Dechloromonas и Zoogloea, которые эффективно удаляли фосфор из среды.
Список литературы
Дорофеев А.Г., Николаев Ю.А., Марданов А.В., Пименов Н.В. Циклический метаболизм как способ существования микроорганизмов // Микробиология. 2019. Т. 88. С. 401–416.
Dorofeev A.G., Nikolaev Y.A., Pimenov N.V., Mardanov A.V. Cyclic metabolism as a mode of microbial existence // Microbiology (Moscow). 2019. V. 88. P. 402–415.
Artan N., Orhon D. Mechanism and design of sequencing batch reactors for nutrient removal // London: IWA Publishing, 2005. 116 p.
Barr J.J., Dutilh B.E., Skennerton C.T., Fukushima T., Has-tie M.L., Gorman J.J., Tyson G.W., Bond P.L. Metagenomic and metaproteomic analyses of Accumulibacter phosphatis enriched floccular and granular biofilm // Environ. Microbiol. 2016. V. 18. P. 273–287.
Bond P.L., Hugenholtz P., Keller J., Blackall L.L. Bacterial community structures of phosphate-removing and nonphosphate-removing activated sludges from sequencing batch reactors // Appl. Environ. Microbiol. 1995. V. 61. P. 1910–1916.
Burton F.L., Stensel H.D., Tchobanoglous G. Wastewater engineering: treatment and reuse / 5th ed. revised by G. Tchobanoglous, F.L. Burton, H.D. Stensel. Metcalf and Eddy, New York–London: McGraw Hill, 2014. P. 2044.
Dasgupta S., De Clippeleir H., Goel R. Short operational differences support granulation in a lab scale reactor in comparison to another conventional activated sludge reactor // Bioresource Technol. 2019. V. 271. P. 417–426.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461.
Fan Z., Zeng W., Wang B., Guo Y., Meng Q., Peng Y. Transcriptional responses of “Candidatus Accumulibacter” clades to environmental dynamics in enhanced biological phosphorus removal // Bioresource Technol. 2020. V. 306. P. 123108.
Fernández-Gómez B., Richter M., Schüler M., Pinhassi J., Acinas S.G., González J.M. Ecology of marine Bacteroidetes: a comparative genomics approach // ISME. 2013. V. 7. P. 1026–1037.
Figdore B.A., Stensel H.D., Winkler M.K.H. Comparison of different aerobic granular sludge types for activated sludge nitrification bioaugmentation potential // Bioresource Technol. 2018. V. 251. P. 2189–2196.
Flowers J.J., He S., Malfatti S., del Rio T.G., Tringe S.G., Hugenholtz P., McMahon K.D. Comparative genomics of two “Candidatus Accumulibacter” clades performing biological phosphorus removal // ISME J. 2013. V. 7. P. 2301–2314.
Frey B., Rime T., Phillips M., Stierli B., Hajdas I., Widmer F., Hartmann M. Microbial diversity in European alpine permafrost and active layers // FEMS Microbiol. Ecol. 2016. V. 92. fiw018. https://doi.org/10.1093/femsec/fiw018
Hahnke R.L., Meier-Kolthoff J.P., García-López M., Mukherjee S., Huntemann M., Ivanova N.N., Woyke T., Kyrpides N.C., Klenk H.P., Göker M. Genome-based taxonomic classification of Bacteroidetes // Front. Microbiol. 2016. V. 20. P. 2003.
Hesselmann R.P.X., Werlen C., Hahn D., van der Meer J.R., Zehnder A.J.B. Enrichment, phylogenetic analysis and detection of a bacterium that performs enhanced biological phosphate removal in activated sludge // Syst. Appl. Microbiol. 1999. V. 22. P. 454–465.
Hug L.A., Baker B.J., Anantharaman K., Brown C.T., Probst A.J., Castelle C. A new view of the tree of life // Nat. Microbiol. 2016. V. 1. P. 16048.
Kirkegaard R.H., McIlroy S.J., Kristensen J.M. The impact of immigration on microbial community composition in full-scale anaerobic digesters // Sci. Rep. 2017. V. 7. P. 9343.
Liu S., Daigger G. T., Liu B., Zhao W., Liu J. Enhanced performance of simultaneous carbon, nitrogen and phosphorus removal from municipal wastewater in an anaerobic-aerobic-anoxic sequencing batch reactor (AOA-SBR) system by alternating the cycle times // Bioresource Technol. 2020. V. 301. P. 122750.
Mao Y., Graham D.W., Tamaki H., Zhang T. Dominant and novel clades of Candidatus “Accumulibacter phosphatis” in 18 globally distributed full-scale wastewater treatment plants // Sci. Rep. 2015. V. 5. P. 11857.
Mao Y., Zhang X., Xia X., Zhong H., Zhao L. Versatile aromatic compound-degrading capacity and microdiversity of Thauera strains isolated from a coking wastewater treatment bioreactor // J. Ind. Microbiol. Biotechnol. 2010. V. 37. P. 927–934.
Maszenan A.M., Seviour R.J., Patel B.K.C., Schumann P., Burghardt J., Tokiwa Y., Stratton H.M. Three isolates of novel polyphosphate-accumulating Gram-positive cocci, obtained from activated sludge, belong to a new genus, Tetrasphaera gen. nov., and description of two new species, Tetrasphaera japonica sp. nov. and Tetrasphaera australiensis sp. nov. // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 593–603.
Mechichi T., Stackebrandt E., Gad’on N., Fuchs G. Phylogenetic and metabolic diversity of bacteria degrading aromatic compounds under denitrifying conditions, and description of Thauera phenylacetica sp. nov., Thauera aminoaromatica sp. nov., and Azoarcus buckelii sp. nov. // Arch. Microbiol. 2002. V. 178. P. 26–35.
Mino T., Van Loosdrecht M.C.V., Heijnen J.J. Microbiology and biochemistry of the enhanced biological phosphate removal process // Wat. Res. 1998. V. 32. P. 3193–3207.
Nakamura K., Hiraishi A., Yoshimi Y., Kawaharasaki M., Masuda K., Kamagata Y. Microlunatus phosphovorus gen. nov., sp. nov., a new gram-positive polyphosphate-accumulating bacterium isolated from activated sludge // Int. J. Syst. Bacteriol. 1995. V. 45. P. 17–22.
Nguyen H.T., Nielsen J.L., Nielsen P.H. “Candidatus Halomonas phosphatis”, a novel polyphosphate-accumulating organism in full-scale enhanced biological phosphorus removal plants // Environ. Microbiol. 2012. V. 14. P. 2826–2837.
Nielsen P.H., McIlroy S.J., Albertsen M., Nierychlo M. Re-evaluating the microbiology of the enhanced biological phosphorus removal process // Curr. Opin. Biotechnol. 2019. V. 57. P. 111–118.
Onuki M., Satoh H., Mino T. Analysis of microbial community that performs enhanced biological phosphorus removal in activated sludge fed with acetate // Water Sci. Technol. 2002. V. 46. P. 145–153.
Parks D.H., Chuvochina M., Waite D.W., Rinke C., Skarshewksi A., Chaumeil P.A. A standardized bacterial taxonomy based on genome phylogeny substantially revises the tree of life // Nat. Biotechnol. 2018. V. 36. P. 996–1004.
Paula F.S., Chin J.P., Schnürer A., Müller B., Manesiotis P., Waters N., McGrath J.W. The potential for polyphosphate metabolism in Archaea and anaerobic polyphosphate formation in Methanosarcina mazei // Sci. Rep. 2019. V. 9. P. 1–12.
Qasim S.R., Zhu G. Wastewater Treatment and Reuse, Theory and Design Examples. V. 1. Principles and Basic Treatment. CRC Press, 2017.
Qiu G., Zuniga-Montanez R., Law Y., Thi S.S., Nguyen T.Q.N., Eganathan K., Liu X., Nielsen P.H., Williams R.B.H., Wuertz S. Polyphosphate-accumulating organisms in full-scale tropical wastewater treatment plants use diverse carbon sources // Water Res. 2019. V. 149. P. 496–510.
Ren S., Li X., Yin X., Luo C., Liu F. Characteristics of intracellular polyphosphate granules and phosphorus-absorption of a marine polyphosphate-accumulating bacterium, Halomonas sp. YSR-3 // J. Oceanol. Limnol. 2020. V. 38. P. 195–203.
Roinestad F.A., Yall I. Volutin granules in Zoogloea ramigera // Appl. Microbiol. 1970. V. 19. P. 973–979.
Rothe B., Fischer A., Hirsch P., Sittig M., Stackebrandt E. The phylogenetic position of the budding bacteria Blastobacter aggregatus and Gemmobacter aquatilis gen. nov., sp. nov. // Arch. Microbiol. 1987. V. 147. P. 92–99.
Rubio-Rincon F.J., Lopez-Vazquez C.M., Welles L., van Loosdrecht M.C.M., Brdjanovic D. Cooperation between Candidatus Competibacter and Candidatus Accumulibacter clade I, in denitrification and phosphate removal processes // Water Res. 2017. V. 120. P. 156–164.
Rubio-Rincón F.J., Welles L., Lopez-Vazquez C.M., Nierychlo M., Abbas B., Geleijnse M., Nielsen P.H., van Loosdrecht M.C.M., Brdjanovic D. Long-term effects of sulphide on the enhanced biological removal of phosphorus: The symbiotic role of Thiothrix caldifontis // Water Res. 2017. V. 116. P. 53–64.
Seviour R.J., Mino T., Onuki M. The microbiology of biological phosphorus removal in activated sludge systems // FEMS Microbiol. Rev. 2003. V. 27. P. 99–127.
Shao Y., Chung B.S., Lee S.S., Park W., Lee S.S., Jeon C.O. Zoogloea caeni sp. nov., a floc-forming bacterium isolated from activated sludge // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 526–530.
Skennerton C.T., Barr J.J., Slater F.R., Bond P.L., Tyson G.W. Expanding our view of genomic diversity in Candidatus Accumulibacter clades // Environ. Microbiol. 2015. V. 17. P. 1574–1585.
Stokholm-Bjerregaard M., McIlroy S.J., Nierychlo M., Karst S.M., Albertsen M., Nielsen P.H. A critical assessment of the microorganisms proposed to be important to enhanced biological phosphorus removal in full-scale wastewater treatment systems // Front. Microbiol. 2017. V. 8. P. 718.
Terashima M., Yama A., Sato M., Yumoto I., Kamagata Y., Kato S. Culture-dependent and -independent identification of polyphosphate-accumulating Dechloromonas spp. predominating in a full-scale oxidation ditch wastewater treatment plant // Microbes Environ. 2016. V. 31. P. 449–455.
Thomas F., Hehemann J.-H., Rebuffet E., Czjzek M., Michel G. Environmental and gut Bacteroidetes: the food connection // Front. Microbiol. 2011. V. 2. P. 93.
Van Loosdrecht M.C.M., Hooijmans C.M., Brdjanovic D., Heijnen J.J. Biological phosphorus removal processes // Appl. Microbiol. Biotechnol. 1997. V. 48. P. 289–296.
Vasilyeva L.V. Omelchenko M.V., Berestovskaya Y.Y., Lysenko A.M., Abraham W.R., Dedysh S.N., Zavarzin G.A. Asticcacaulis benevestitus sp. nov., a psychrotolerant, dimorphic, prosthecate bacterium from tundra wetland soil // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 2083–2088.
Welles L., Abbas B., Sorokin D.Y., Lopez-Vazquez C.M., Hooijmans C.M., van Loosdrecht M., Brdjanovic D. Metabolic response of “Candidatus Accumulibacter phosphatis” clade II C to changes in influent P/C ratio // Front. Microbiol. 2017. V. 7. P. 2121.
Wentzel M.C., Comeau Y., Ekama G.A., van Loosdrecht M.C.M., Brdjanovic D. Enhanced biological nutrient removal // Biological Wastewater Treatment. Principles, Modelling and Design / Eds. Henze M., van Loosdrecht M.C.M., Ekama G.A., Brdjanovic D. London: IWA Pub., 2008. P. 155–220.
Wexler M., Richardson D.J., Bond P.L. Radiolabelled proteomics to determine differential functioning of Accumulibacter during the anaerobic and aerobic phases of a bioreactor operating for enhanced biological phosphorus removal // Environ. Microbiol. 2009. V. 11. P. 3029–3044.
Wilmes P., Andersson A.F., Lefsrud M.G., Wexler M., Shah M., Zhang B., Hettich R.L., Bond P.L., VerBerkmoes N.C., Banfield J.F. Community proteogenomics highlights microbial strain-variant protein expression within activated sludge performing enhanced biological phosphorus removal // ISME J. 2008. V. 2. P. 853–864.
Wu L., Ning D., Zhang B., Li Y., Zhang P., Shan X., Ling F. Global diversity and biogeography of bacterial communities in wastewater treatment plants // Nat. Microbiol. 2019. V. 4. P. 1183–1195.
Yu K., Zhang T. Metagenomic and metatranscriptomic analysis of microbial community structure and gene expression of activated sludge // PLoS One. 2012. V. 7. e38183.
Zeng W., Zhang L., Fan P., Guo J., Peng Y. Community structures and population dynamics of “Candidatus Accumulibacter” in activated sludges of wastewater treatment plants using ppk1 as phylogenetic marker // J. Environ. Sci. 2018. V. 67. P. 237–248.
Zhang T., Shao M.-F., Ye L. 454 pyrosequencing reveals bacterial diversity of activated sludge from 14 sewage treatment plants // ISME J. 2012. V. 6. P. 1137–1147.
Дополнительные материалы отсутствуют.