Микробиология, 2021, T. 90, № 1, стр. 64-75
Снижение эффективности формирования биопленок и их устойчивости к окислительному стрессу и высушиванию у ahpC мутанта Azospirillum Brasilense
А. В. Шелудько a, *, Д. И. Мокеев a, С. С. Евстигнеева a, Ю. А. Филипьечева a, А. М. Буров a, Л. П. Петрова a, Е. И. Кацы a, **
a Институт биохимии и физиологии растений и микроорганизмов
Российской академии наук
410049 Саратов, Россия
* E-mail: shel71@yandex.ru
** E-mail: ei_katsy@mail.ru
Поступила в редакцию 21.02.2020
После доработки 14.07.2020
Принята к публикации 10.08.2020
Аннотация
Azospirillum brasilense формируют биопленки на разнообразных поверхностях. Ранее было показано, что инактивация гена ahpC алкилгидропероксидредуктазы у мутанта SK586 штамма A. brasilense Sp245 привела к повышению чувствительности к пероксидам и к изменениям в жгутиковании, подвижности и свойствах клеточной поверхности. В данной работе установлено, что штамм Sp245 в условиях лимита по азоту переходит преимущественно к биопленочному существованию, тогда как для ahpC мутанта SK586 такая тенденция не характерна. Инактивация гена ahpC негативно влияет на жизнеспособность клеток SK586 в составе биопленок, что наиболее заметно при дефиците азота. При отсутствии существенных морфологических различий цистоподобных форм Sp245 и SK586 устойчивые к высушиванию покоящиеся формы мутанта из безазотистой среды были более чувствительны к перекиси водорода, чем покоящиеся формы Sp245. В биопленках штамма Sp245 устойчивые к высушиванию жизнеспособные формы обнаруживались и после 9 мес. хранения, а в биопленках мутанта SK586 такие бактерии сохраняли жизнеспособность менее месяца. При адаптации к корневой системе растений увеличивалось количество клеточных форм азоспирилл, устойчивых к высушиванию, по сравнению с числом таких клеток из зрелых биопленок на абиотических поверхностях. В отличие от Sp245 ahpC, мутант SK586 не оказывал позитивного влияния на развитие корневой системы и рост надземной части 10-дневных растений – возможно, из-за сниженной способности к колонизации корней проростков пшеницы, инкубируемых в жидкой среде. По-видимому, алкилгидропероксидредуктаза существенна для более успешного противостояния азоспирилл разнообразным стрессам и для проявления стимулирующей рост растений активности этих бактерий.
Альфапротеобактерии Azospirillum brasilense, обитающие в фитосфере и используемые в качестве биоудобрений, оказывают существенное положительное влияние на рост растений и их устойчивость к неблагоприятным абиотическим и биотическим факторам (Bashan, de-Bashan, 2010; Fibach-Paldi et al., 2012; Fukami et al., 2018). Растения воспринимают не только патогенные, но и полезные бактерии как потенциальную угрозу и защищаются от них, в частности, с помощью продукции перекиси водорода и других активных форм кислорода (АФК) (Васильева и соавт., 2007). Полагают, что устойчивость бактерий к окислительному стрессу способствует успешной колонизации ими растений (Fukami et al., 2018). Защите клеток азоспирилл от эндогенных и экзогенных АФК помогают такие ферменты, как супероксиддисмутаза, каталаза и алкилгидропероксидредуктаза (Tarrand et al., 1978; Nur et al., 1982; Clara, Knowles, 1984; Wasim et al., 2009).
Определенное значение для успешного формирования и функционирования растительно-микробной ассоциации и противостояния бактерий и растений различным абиотическим стрессам может иметь способность азоспирилл формировать биопленки на корнях растения-хозяина (Шелудько и соавт., 2010; Fibach-Paldi et al., 2012; Bogino et al., 2013). В биопленках бактерии заключены в матрикс, являющийся резервуаром воды, ферментов и питательных веществ и играющий структурную и защитную роль (Flemming, Wingender, 2010). Матрикс биопленок медленно высыхает, чем предохраняет микроорганизмы от изменений водного потенциала. Исследованы состав, структура и функции основных биополимеров матрикса биопленок азоспирилл, обеспечивающих фиксацию зрелых биопленок на твердой поверхности и выполняющих каркасную функцию, способствующих созданию в биопленках условий для фиксации азота (Ramírez-Mata et al., 2016; Wang et al., 2017; Шелудько и соавт., 2018). Охарактеризован морфологический и функциональный полиморфизм клеточных форм в биопленках азоспирилл (Wang et al., 2017; Шелудько и соавт., 2020). Так, наличие покоящихся форм в биопленочной популяции повышает устойчивость к таким негативным воздействиям, как высушивание и окислительный стресс (Шелудько и соавт., 2020). Однако сведения о физиолого-биохимических механизмах защиты клеток от данного типа воздействий имеют лишь предварительный характер (Шелудько и соавт., 2020). Анализ систем защиты от окислительного и других стрессов интересен также и для осмысления роли этих систем в адаптации азоспирилл к существованию как в динамичной почвенной среде, так и в ассоциации с растениями (Fukami et al., 2018).
Объектами нашего исследования стали активно исследуемый штамм A. brasilense Sp245, способный проникать внутрь корней и заселять межклетники проводящей системы и корневые волоски пшеницы (Baldani et al., 1983; Schloter et al., 1998), и полученный нами ранее мутант SK586 (Sheludko et al., 1998), у которого одиночная вставка искусственного транспозона Omegon-Km находится в каталитической субъединице C алкилгидропероксидредуктазы (AhpC) – одного из ферментов защиты от АФК (Poole, Ellis, 1996; Wasim et al., 2009). Ранее было показано, что инактивация AhpC у мутанта SK586 привела к множественным фенотипическим изменениям, включая жгутикование и подвижность бактерий, морфологию колоний и свойства клеточной поверхности, способность клеток к агрегации (Scheludko et al., 1998; Wasim et al., 2009).
На наш взгляд, биопленки ahpC мутанта SK586 могли стать интересным объектом для анализа возможного вклада алкилгидропероксидредуктазы в адаптацию биопленочной популяции азоспирилл к окислительному и другим стрессам. К примеру, известно, что у ряда бактерий в условиях теплового шока AhpC выполняет функции шаперона и предотвращает агрегацию белков (Lee et al., 2016; Kamariah et al., 2018).
Целью данной работы явилось исследование формирования биопленок культурами штамма A. brasilense Sp245 и его инсерционного ahpC мутанта SK586, характеристика устойчивости биопленок к неблагоприятным внешним факторам. В наши задачи входил анализ влияния состава среды культивирования на формирование биопленок штаммов Sp245 и SK586, сравнение устойчивости биопленочных популяций к окислительному стрессу и высушиванию, анализ колонизации этими бактериями корней проростков пшеницы и способности стимулировать рост растений-партнеров.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы бактерий и питательные среды. В работе использовали штамм A. brasilense Sp245 [IBPPM 219], выделенный в Бразилии из корней пшеницы (Triticum sp.) (Baldani et al., 1983), и его дефектный по жгутикованию и подвижности Omegon-Km мутант SK586 (Scheludko et al., 1998), содержащий вставку искусственного транспозона Omegon-Km (KmR) в гене ahpC каталитической субъединицы С алкилгидропероксидредуктазы (Wasim et al., 2009).
Бактерии культивировали при 30°C на малатно-солевой среде (МСС) (Döbereiner, Day, 1976) с NH4Cl (1 г/л) или без него и на среде Luria–Bertani (LB) (Sambrook et al., 1989). Плотные и полужидкие среды содержали 1.8 и 0.3% Бакто агара соответственно. Мутант SK586 культивировали в присутствии 50 мкг/мл канамицина (Km).
Анализ формирования и микроструктуры биопленок. Ночные (24 ч; стационарная фаза роста) культуры азоспирилл, выращенные с аэрацией в жидкой МСС с NH4Cl, отмывали 50 мМ фосфатным буфером (ФБ) (pH 7.0) и суспендировали до ОП590 = 0.05–0.10 (l = 0.5 см) в свежей МСС с хлоридом аммония или без него. Вносили по 2 мл или по 0.2 мл полученных суспензий соответственно в стеклянные пробирки и ячейки полистирольных планшетов с 96-ю плоскодонными лунками и инкубировали 6 сут при 30°С в стационарных условиях. За это время стабилизировалось относительное количество биомассы в биопленках азоспирилл и завершалось их формирование (зрелые биопленки, относительное количество биомассы в которых не изменяется при увеличении сроков культивирования в исследованном временном диапазоне от 6 до 11 сут) (Шелудько и соавт., 2015). Относительное количество биомассы в зрелых биопленках оценивали посредством окраски биопленок кристаллическим фиолетовым (O’Toole, Kolter, 1998), как подробно описано в работе Шелудько и соавт. (2020). Фазово-контрастную микроскопию биопленок и планктонных клеток выполняли на приборе Leica DM6000 B (“Leica Microsystems”, Германия).
Приготовление ультратонких срезов. Биопленки осторожно промывали и смывали 50 мМ ФБ (pH 7.0). Смывы, содержащие фрагменты био-пленок, или 24-ч планктонные культуры из жидкой МСС с азотом, выросшие в условиях аэрации, осаждали центрифугированием. Полученные образцы биопленочных и планктонных клеток поэтапно фиксировали (растворами 2.5% глутарового альдегида и 1% OsO4 в 0.1 М какодилатном буфере (pH 7.2)) и обезвоживали, как описано ранее (Шелудько и соавт., 2020). Обезвоженный материал заключали в эпоксидную смолу Epon 812. Срезы получали на ультратоме, переносили на сеточки и при необходимости негативно окрашивали 3% раствором уранилацетата в 70% спирте. Ультратонкие срезы просматривали в просвечивающем электронном микроскопе Libra 120 (“Carl Zeiss”, Германия) при ускоряющем напряжении 120 кВ.
Анализ влияния перекиси водорода на жизнеспособность азоспирилл выполняли, как описано Шелудько и соавт. (2020). Зрелые биопленки или 24-ч планктонные культуры, выращенные с аэрацией, инкубировали 18 ч в 50 мМ ФБ (pH 7.0), содержащем 0, 0.0001, 0.0005, 0.001, 0.01, 0.1 или 1% H2O2. Пробирки с биопленками предварительно осторожно промывали этим же буфером, а после его удаления вносили 2.5 мл раствора H2O2 соответствующей концентрации. В случае планктонных бактерий 2 мл жидких культур, разведенных до ОП590 = 0.3–0.4 (l = 0.5 см), осаждали и ресуспендировали в 2.5 мл раствора H2O2. (Суспензии азоспирилл с ОП590 = 0.3–0.4 содержат (5.5 ± 0.5) × 109 жизнеспособных бактерий в 1 мл). Через 18 ч удаляли раствор H2O2 из пробирок с биопленками, а планктонные клетки осаждали центрифугированием. В пробирки с биопленками или осадком планктонных клеток вносили по 2.5 мл безазотистой МСС, содержащей 0.3% агара. Через 24–48 ч инкубации фиксировали наличие роста под поверхностью полужидкой среды. Отсутствие роста свидетельствовало о гибели бактерий.
Определение численности жизнеспособных клеток в биопленках и их устойчивости к высушиванию. Зрелые биопленки осторожно промывали 50 мМ ФБ (pH 7.0). Определяли количество колониеобразующих единиц (КОЕ) в промытых нативных (не подвергавшиxся каким-либо воздействиям) и сухих биопленках. В последнем случае промытые биопленки сушили при 30°С и хранили при 37°С. Для определения КОЕ в пробирки с биопленками вносили по 2 мл 50 мМ ФБ (pH 7.0), инкубировали 1 ч и смывали биомассу. Биомассу ресуспендировали в 50 мМ ФБ (pH 7.0) и 1 мин диспергировали на встряхивателе Vortex (при световой микроскопии этих суспензий сразу после их получения агрегатов клеток не наблюдали). Из полученной суспензии готовили серию десятикратных разведений и высевали из них по 100 мкл на плотную МСС с азотом. Результаты с учетом разведения пересчитывали на 1 мл смыва. В качестве контроля использовали пробирки, в которых 6 сут инкубировали стерильную питательную среду. Результаты повторного проверочного окрашивания поверхности стекла опытных пробирок после смывания из них биопленок не отличались от контрольных значений и не превышали 0.04 ед. ОП590 (l = 0.5 см), что свидетельствовало о полноте смывания биомассы биопленок.
Для определения продолжительности сохранения жизнеспособности покоящимися формами пробирки с сухими биопленками, хранившиеся более 7 сут, через 10 дней, а затем каждые 20 дней заполняли безазотистой полужидкой МСС (с 0.3% агара) и инкубировали для прорастания цистоподобных форм азоспирилл (Шелудько и соавт., 2020). Через 24–48 ч инкубации жизнеспособные микроаэрофильные клетки азоспирилл делятся и, перемещаясь в агаре, формируют видимую глазом полосу под поверхностью безазотистой среды. Если формирования такой полосы не наблюдалось в течение 7 сут, полужидкую среду из пробирок переносили на плотные питательные среды. Отсутствие роста и в этом случае расценивали как гибель популяции.
Анализ способности бактерий к колонизации корней проростков пшеницы проводили в соответствии с процедурой, ранее использованной Шелудько и соавт. (2010) в работе с мутантами азоспирилл по жгутикованию и подвижности. Семена мягкой яровой пшеницы сорта Саратовская 29, полученные из ВНИИ сельского хозяйства Юго-Востока (Саратов, Россия), стерилизовали, проращивали в течение 3-х сут и инокулировали, выдерживая проростки с покачиванием (25 об./мин) в суспензии бактерий (ОП590 = 0.5 (l = 0.5 см)) в 50 мМ ФБ (pH 7.0) (Шелудько и соавт., 2010). Инокулированные проростки пшеницы однократно промывали стерильным ФБ и помещали над слоем жидкости в пробирки, содержащие 10 мл среды для растений следующего состава (г/л): KH2PO4 – 4; CaCl2 – 1.25; H3BO3 – 0.0016; CuSO4 ∙ ∙ 5H2O – 0.00025; MgSO4 – 0.09; Na2MoO4 ∙ 2H2O – 0.0025; KJ – 0.008; ZnSO4 – 0.015; FeSO4 ∙ 7H2O – 0.028; этилендиаминтетрауксусной кислоты динатриевая соль – 0.037 (рН 6.0). Инокулированные растения выращивали еще 7 дней при 22°С и естественном освещении. Распределение бактерий и образование биопленок на поверхности корней исследовали с использованием микроскопа Leica DM6000 B (“Leica Microsystems”, Германия). Из навесок стерильно отмытых корней 10-дневных проростков готовили гомогенат, в котором определяли количество КОЕ посредством высевов серийных десятикратных разведений на плотную МСС. Нулевое и первое разведение центрифугировали, удаляли надосадочную жидкость, сушили при 30°С и хранили при 37°С. В этих образцах выявляли устойчивые к высушиванию клетки как описано выше. Количество бактерий, высеваемых с корней, пересчитывали на одно растение. Контролировали наличие посторонней микрофлоры в гомогенатах корней. Образцы, в высевах с которых встречались колонии с нехарактерной для азоспирилл морфологией, отбрасывали.
Статистическая обработка результатов. Выполняли не менее трех независимых экспериментов как минимум в двух повторностях. Статистическую обработку данных проводили с использованием t-критерия Стьюдента (доверительные интервалы даны для 95% уровня значимости) и однофакторного дисперсионного анализа (ANOVA) (при уровне значимости p ≤ 0.05). Для статистической обработки использовали пакет программ Microsoft Office Excel 2010.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Характеристика зрелых биопленок азоспирилл. Как показано в табл. 1 (столбцы б), исключение из МСС источника связанного азота приводит к снижению количества биомассы в зрелых биопленках ahpC мутанта SK586, сформированных на гидрофильной поверхности, а в биопленках штамма Sp245 оно остается неизменным. Оптическая плотность планктонных культур этих штаммов, выросших параллельно с биопленками в безазотистой МСС, уступает плотности культур со среды с азотом (табл. 1, столбцы а). Отношение показателя, характеризующего количество клеток в планктонных культурах (ОП590 планктонных культур), к показателю, характеризующему относительную биомассу биопленок (ОП590 кристаллического фиолетового, десорбированного из биопленок), под МСС с/без NH4Cl для бактерий Sp245 и SK586 составило, соответственно, 0.5/0.2 и 0.5/0.7 (табл. 1, столбцы а, б). Таким образом, в условиях лимита по азоту контактирующие с гидрофильной поверхностью клетки штамма Sp245 переходили преимущественно к биопленочному существованию; а в случае мутанта SK586 этого предпочтения не наблюдалось.
Таблица 1.
Рост планктонных культур (а), биомасса (б) и количество КОЕ (в) в зрелых биопленках A. brasilense, сформированных в стеклянных пробирках под жидкой МСС
| Штамм | (а) ОП590 (l = 0.5 см) планктонных культур |
(б) ОП590 (l = 0.5 см) кристаллического фиолетового, десорбированного после окрашивания биопленок |
(в) * Количество КОЕ × 1010 в 1 мл суспензии смытой биомассы биопленки |
|||
|---|---|---|---|---|---|---|
| +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | |
| Sp245 | 0.33 ± 0.03 В | 0.14 ± 0.03 А | 0.73 ± 0.04 Б | 0.73 ± 0.12 Б | 1.9 ± 0.3 г | 1.1 ± 0.1 в |
| SK586 | 0.36 ± 0.02 В | 0.26 ± 0.02 Б | 0.69 ± 0.05 Б | 0.40 ± 0.05 А | 0.9 ± 0.1 б | 0.6 ± 0.2 а |
Примечание. Результаты однофакторного дисперсионного анализа (ANOVA) в колонках (а) или (б) представлены заглавными буквами; разными буквами обозначены статистически значимые различия между средними. В колонках (а), (б) и (в) показаны результаты ANOVA, проведенного с последовательным сравнением средних в столбце и строке; разными буквами обозначены статистически значимые различия. А, А или а – средние значения с наименьшей величиной. * Биомассу биопленки смывали 2 мл 50 мМ ФБ (pH 7.0).
Зрелые биопленки штамма Sp245 содержали примерно в 1.8–2.1 раза больше жизнеспособных бактерий, по сравнению с биопленками мутанта SK586 (табл. 1, столбцы в), независимо от наличия источника связанного азота в МСС. В суспензиях биомассы биопленок штамма Sp245, смытых с поверхности стекла, число КОЕ варьировало в пределах порядка 1010, а в случае биопленок штамма SK586 – 109. Более низкое количество КОЕ соответствовало сниженному количеству биомассы в биопленках мутанта на стекле под безазотистой МСС (табл. 1, столбцы б, в). Однако на такой же поверхности в МСС с NH4Cl относительное количество биомассы в биопленках SK586 не уступало показателям Sp245, но различия в количестве КОЕ в биопленках сохранялось.
Сформированные под жидкой средой LB биопленки штаммов Sp245 и SK586 содержали примерно одинаковое количество биомассы на гидрофильной и гидрофобной поверхности (рис. 1). На стекле под МСС с NH4Cl показатели биомассы Sp245 и SK586 не отличались от значений, характерных для биопленок, сформированных под LB. По сравнению с Sp245, мутант SK586 формировал менее выраженные биопленки на гидрофильной поверхности под безазотистой МСС и на полистироле под МСС с/без NH4Cl (рис. 1). Стоит отметить, что через 7 сут культивирования рН окружающих биопленки сред LB и МСС с/без NH4Cl увеличивался с 7.0 до (8.3 ± 0.1) и (9.3 ± 0.1) соответственно. Не исключено, что инактивация гена ahpC привела к повышению чувствительности мутанта к изменениям pH среды, что могло сказаться и на жизнеспособности клеток в составе биопленок (табл. 1, столбцы в).
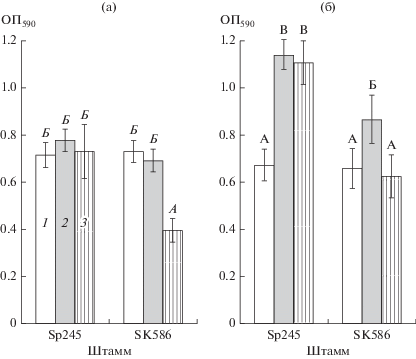
Рис. 1.
Влияние состава среды на биомассу зрелых биопленок A. brasilense, сформированных на стекле (а) и полистироле (б) под жидкой средой LB (1), MСС + NH4Cl (2) или MСС без NH4Cl (3). Обозначения: ОП590 (l = 0.5 см) – оптическая плотность раствора кристаллического фиолетового, десорбированного после окрашивания биопленок. Однофакторный дисперсионный анализ (ANOVA) данных на панелях (а) и (б) последовательно проводили, сравнивая влияние состава среды на показатели каждого штамма, затем сопоставляя показатели Sp245 и SK586 на каждой из сред; разными заглавными буквами обозначены статистически значимые различия; А и А – средние значения с наименьшей величиной.
Устойчивость биопленок к окислительному стрессу. Мы оценили влияние перекиси водорода в качестве агента окислительного стресса на жизнеспособность бактерий из планктонных культур в стационарной фазе роста или из зрелых биопленок. В отсутствие источников углерода и азота (в 50 мМ ФБ; pH 7.0) планктонные культуры Sp245 сохраняли жизнеспособность в присутствии 0.001% H2O2, а культуры SK586 – в присутствии 0.0005% H2O2. МИК перекиси водорода для родительского и мутантного штаммов различались в 10 раз (табл. 2, столбец а). Эти данные согласуются с результатами проведенного ранее сравнения устойчивости к алкилпероксидам и H2O2 планктонных культур Sp245 и SK586, активно росших в минимальной и богатой средах (Wasim et al., 2009).
Таблица 2.
Устойчивость к окислительному стрессу 24-ч планктонных культур (а) и зрелых биопленок A. brasilense (б и в), сформированных в стеклянных пробирках под жидкой МСС
| Штамм | * Наличие бактериального роста под толщей полужидкой среды после инкубации в растворе H2O2 | |||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| (а) Планктонные культуры из |
(б) Нативные биопленки из МСС |
(в) ** Сухие биопленки из МСС |
||||||||||||||
| МСС + NH4Cl | +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | ||||||||||||
| H2O2, % | ||||||||||||||||
| 0.0005 | 0.001 | 0.01 | 0.001 | 0.01 | 0.1 | 0.001 | 0.01 | 0.1 | 0.001 | 0.01 | 0.1 | 0.0001 | 0.001 | 0.01 | 0.1 | |
| Sp245 | + | + | – | + | + | – | + | + | – | + | – | – | + | + | – | – |
| SK586 | + | – | – | + | + | – | + | – | – | + | – | – | + | – | – | – |
Примечание. В случае планктонных культур (а) и биопленок (б, в) результаты воспроизведены в 7 и 5 независимых экспериментах соответственно. * Планктонные культуры или биопленки после 18 ч инкубации с H2O2 48 ч культивировали в МСС с 0.3% агара без источника связанного азота. Планктонные культуры (а) и нативные биопленки (б) содержали не менее 109 КОЕ в 1 мл суспензии (см. Материалы и методы исследования и табл. 1); количество КОЕ в сухих биопленках (в) приведено в табл. 3. ** Биопленки (б) высушили и хранили 7 сут при 37°C.
В нативных зрелых биопленках устойчивость азоспирилл к окислительному стрессу возрастала. МИК 0.1% H2O2 для особей из биопленок Sp245 не зависела от наличия азота в среде (табл. 2, столбцы б). В МСС с NH4Cl устойчивость к перекиси водорода клеток из биопленок мутанта SK586 не отличалась от показателей Sp245, но в МСС без азота МИК перекиси водорода для SK586 снижалась на порядок (табл. 2, столбцы б). Таким образом, предполагаемый вклад AhpC в адаптацию азоспирилл к воздействию внешних факторов окислительного стресса наиболее заметен не только при дефиците источника углерода (Wasim et al., 2009), но и в условиях дефицита азота (данная работа).
Влияние окислительного стресса на жизнеспособность устойчивых к высушиванию покоящихся форм биопленок. Выживанию биопленочных популяций азоспирилл в условиях окислительного стресса способствует формирование покоящихся форм (Шелудько и соавт., 2020). Для получения покоящихся форм биопленки были высушены при 30°C и заложены на хранение при 37°C (оптимальная температура для культивирования A. brasilense (Tarrand et al. 1978)). Через 7 сут хранения максимальная численность 103 КОЕ сохранялась в биопленках Sp245. В случае мутанта SK586 количество КОЕ составляло 102 (табл. 3). В биопленках Sp245 жизнеспособные формы сохранялись после 9 мес. хранения сухих образцов. Устойчивые к высушиванию формы из биопленок SK586 сохраняли жизнеспособность менее месяца (табл. 3).
Таблица 3.
Влияние продолжительности хранения при 37°C на жизнеспособность A. brasilense в сухих зрелых биопленках
| Штамм | (а) * КОЕ в 1 мл суспензии смытой биомассы сухих биопленок, хранившихся 7 сут |
(б) ** Наличие бактериального роста под поверхностью полужидкой среды при культивировании сухих биопленок из МСС |
||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| +NH4Cl | –NH4Cl | +NH4Cl | –NH4Cl | |||||||||
| Хранение сухих биопленок при 37°C, сут | ||||||||||||
| 7 | 17 | 37 | 127 | 277 | 7 | 17 | 37 | 127 | 277 | |||
| Sp245 | (2.4 ± 0.4) × 103 | (5.7 ± 0.7) × 103 | + | + | + | + | + | + | + | + | + | + |
| SK586 | (1.3 ± 0.04) × 102 | (1.6 ± 0.1) × 102 | + | + | – | – | – | + | + | – | – | – |
Покоящиеся формы Sp245 в сухих биопленках сохраняли жизнеспособность после инкубации с 0.001% H2O2, а МИК H2O2 составляла для них 0.01%, как и для планктонных культур (табл. 2, столбец в). В биопленках из МСС с азотом покоящиеся формы SK586 имели сходную с Sp245 устойчивость к перекиси водорода (табл. 2, столбец в), превышавшую устойчивость планктонных клеток мутанта. Для покоящихся форм мутанта из безазотистой МСС МИК перекиси водорода снижалась до 0.001%. Таким образом, по сравнению со штаммом Sp245, при культивировании в МСС без азота покоящиеся формы и биопленки мутанта SK586 были более чувствительными к негативному воздействию H2O2.
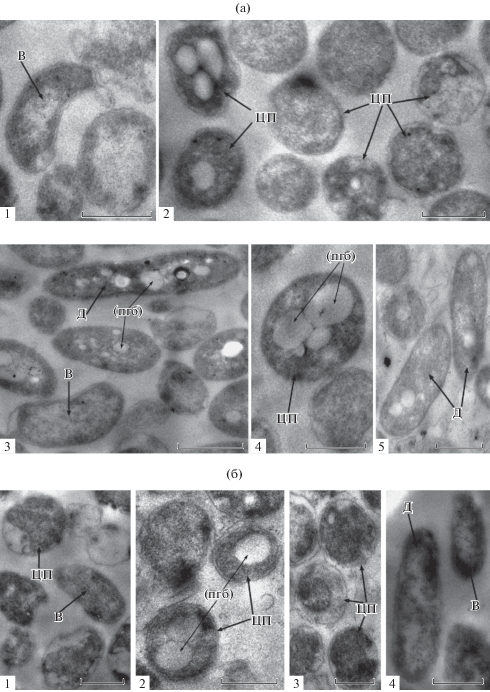
Ультраструктура клеток в составе биопленок. Анализ ультраструктуры планктонных клеток штаммов Sp245 и SK586 из 24-ч жидких культур, выросших при перемешивании в МСС с азотом, показал, что вегетативные клетки (В-клетки) являются вибрионами с минимальным количеством включений, которые, как сообщается, могут являться гранулами полигидроксибутирата (ПГБ) (Berg et al., 1980). Тонкий слой капсулы тесно связан с липополисахаридом наружной мембраны клеток. Также встречаются клетки, лишенные выраженной капсулы. В популяции планктонных клеток азоспирилл присутствуют делящиеся особи и длинные клетки (Дл-клетки).
Сравнение ультратонких срезов биопленок Sp245 и SK586 показало, что для обоих штаммов характерен выраженный полиморфизм размера и формы клеток, независимо от наличия связанного азота в среде культивирования (рис. 2). На срезах биопленок обнаруживались В-клетки, Дл-клетки и клетки яйцевидной формы (рис. 2) средних и больших размеров – цистоподобные формы (ЦП-формы), которые описаны в старых культурах азоспирилл, в частности, в среде без источника связанного азота (Berg et al., 1980). Часть Дл-клеток покрыта выраженным внешним слоем (рис. 2). В биопленках были также выявлены лизированные клетки. Наличие бактерий с признаками разрушения частично объясняло отсутствие зависимости между количествами биомассы биопленок и КОЕ; необходимо также учитывать, что и матрикс биопленок вносит вклад в общее количество биомассы. Кристаллический фиолетовый, использованный нами для определения относительного количества биомассы в биопленках, окрашивает как живые и мертвые клетки, так и внеклеточный матрикс (O’Toole, Kolter, 1998; Плакунов и соавт., 2016; Шелудько и соавт., 2018).
Рис. 2.
Просвечивающая электронная микроскопия ультратонких срезов клеток A. brasilense Sp245 (а) и SK586 (б) из фрагментов зрелых биопленок, сформированных под жидкой МСС с NH4Cl (1, 3, 4) или без связанного азота (2, 5). Масштабная линейка соответствует 1 мкм. В – “В-клетки”, Д – “Дл-клетки”, ЦП – “ЦП-формы”, (пгб) – полигидроксибутират.
Определение численности бактерий, адсорбирующихся и формирующих биопленки на корнях проростков пшеницы. Начальные этапы колонизации азоспириллами корневой системы растений зависят от способности бактерий перемещаться по направлению к корням растения. Данное обстоятельство обусловило выбор способа инокуляции (с покачиванием инкубационных сосудов), обеспечивающих штамму дикого типа и его мутанту с дефектами в подвижности равные шансы на контакт с поверхностью корня (Шелудько и соавт., 2010). Количество клеток A. brasilense, прикрепившихся к корням, стабилизировалось в течение 3 ч инкубации суспензии бактерий с трехсуточными проростками пшеницы. Количество адсорбировавшихся клеток Sp245 и SK586 варьировало в пределах порядка 107 и составляло, соответственно, (2.0 ± 0.2) × 107 и (1.2 ± 0.1) × × 107 КОЕ/растение.
Уже через 24–48 ч после инокуляции растений клетки штаммов Sp245 и SK586 обнаруживались на корнях в виде агрегатов наряду с равномерно распределенными особями. На шестые–седьмые сутки агрегаты клеток этих штаммов, образующие биопленку, формировали скопления на поверхности корней проростков (рис. 3). Биопленки располагались не равномерно по всему корню, а, преимущественно, в зонах всасывания и верхушки корня. Бактериальные скопления наблюдались у мест соединения корневых волосков с поверхностью корня, на кончике корневого волоска; встречались и корневые волоски, заселенные бактериями вдоль всей поверхности. Численность бактерий SK586, обитавших в корневой системе проростков пшеницы, после 7 сут инкубации на порядок уступала численности бактерий Sp245 (табл. 4, столбец а). При микроскопии степень выраженности биопленок на поверхности корня в случае двух штаммов согласовалась с численностью бактерий, заселивших корневую систему к 7 сут культивирования: см., например, в табл. 4 (столбец в) процент корневых волосков с шапочками из бактерий (рис. 3). Отметим, что при выращивании растений в полужидком агаре другим авторам не удалось выявить изменений в способности ahpC мутанта SK586 колонизировать поверхность корней проростков пшеницы (Wasim et al., 2009). Вероятно, в микроаэрофильных условиях, являющихся оптимальными для азоспирилл (Elmas et al., 2019), клетки мутанта SK586 легче адаптируются к существованию в корневой системе растений (Wasim et al., 2009).
Рис. 3.
Просвечивающая световая микроскопия корней 10-дневных проростков пшеницы через 7 дней после инокуляции культурами A. brasilense Sp245 (а) и SK586 (б). Масштабная линейка соответствует 10 мкм.
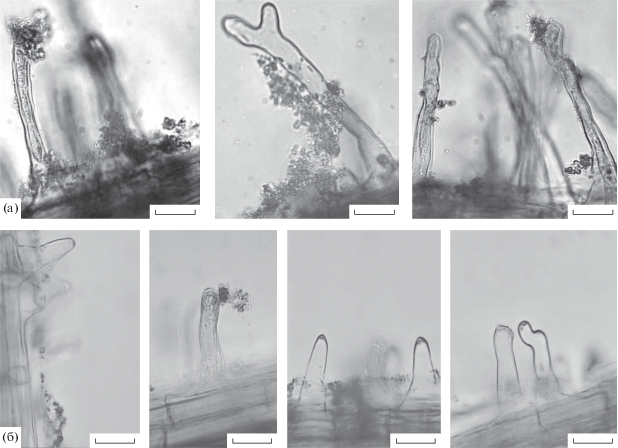
Таблица 4.
Характеристики 10-суточных проростков пшеницы через 7 сут после инокуляции бактериями A. brasilense*
| Штамм | Проросток после 7-ми дней культивирования с бактериями | ||||||
|---|---|---|---|---|---|---|---|
| (а) КОЕ × 107, высеваемые из корневой системы |
(б) КОЕ × 105, высеваемые из сухих корней, хранившихся 7 сут |
(в) Корневые волоски с шапочками из бактерий, % |
(г) Корневая система |
(д) Длина побега, мм |
|||
| деформи-рованные корневые волоски, % | разветвленные корни, % | длина корня, мм | |||||
| К** | 0 | 0 | 0 | 16.3 ± 1.6 а | 39.0 ± 2.5 А | 30.6 ± 1.9 А | 119.7 ± 4.7 А |
| Sp245 | 1.0 ± 0.1 | 1.5 ± 0.2 | 49.6 ± 3.9 б | 39.3 ± 2.3 в | 56.8 ± 3.3 Б | 27.9 ± 1.7 А | 138.5 ± 4.0 Б |
| SK586 | 0.1 ± 0.04 | 0.5 ± 0.06 | 38.6 ± 4.5 а | 27.4 ± 4.9 б | 33.6 ± 5.5 А | 28.5 ± 6.4 А | 111.2 ± 18.4 А |
Примечание. Приведены результаты 5 независимых экспериментов, в каждом из которых использовали не менее 10 растений. Однофакторный дисперсионный анализ (ANOVA) в колонках (в), (г) или (д) проводили, сравнивая средние в столбце. Разными буквами обозначены статистически значимые различия. А, А, а или а – средние значения с наименьшей величиной. * Для инокуляции использовали 3-х суточные проростки, которые 3 ч инкубировали в суспензии клеток штаммов Sp245 и SK586. Число бактерий, адсорбировавшихся на корнях, составило (2.0 ± 0.2) × 107 и (1.2 ± 0.1) × 107 КОЕ, соответственно штамму. ** Контроль – стерильные растения.
Исследована численность устойчивых к высушиванию клеток Sp245 и SK586, заселивших корни проростков. Для получения покоящихся форм гомогенаты инокулированных корней были высушены при 30°C и заложены на хранение при 37°C. Образцы корней, инокулированных Sp245, без высушивания содержали 107 КОЕ, через 7 сут хранения сухих образцов количество КОЕ снижалось до 105 (табл. 4, столбец а, б). В случае мутанта SK586 количество КОЕ без высушивания образцов составляло 106, а в сухих пробах – 104 (табл. 4, столбец а, б).
Для биопленок, сформированных на абиотической поверхности под МСС, наблюдалась более выраженная тенденция снижения численности клеток в сухих образцах. Так, в сырых биопленках Sp245/SK586 содержалось 1010/109 КОЕ, а сухие биопленки этих штаммов содержали 103/102 КОЕ (табл. 1 и 3). Вероятно, у азоспирилл, адаптировавшихся к корневой системе растений, формируется больше клеточных форм, устойчивых к высушиванию (или в этих условиях потенциал устойчивости клеток к данному виду стресса возрастает), по сравнению с бактериями из биопленок, сформировавшихся в абиотических условиях – на стекле под МСС.
Инокуляция штаммами Sp245 и SK586 по-разному сказывалась на морфометрических показателях проростков пшеницы (табл. 4, столбцы г, д). Инокуляция штаммом Sp245 стимулировала развитие корневой системы проростков и положительно влияла на длину надземной части (табл. 4, столбцы г, е). В случае растений, инокулированных SK586, подобные эффекты отсутствовали, что можно объяснить как низкой численностью бактерий, обитающих на корнях растений, так и повышенной чувствительностью клеток мутанта к окислительному стрессу, вызванной инактивацией гена ahpC.
Таким образом, у ahpC мутанта бактерии A. brasilense Sp245 снижена эффективность формирования биопленок в условиях лимита по азоту и при колонизации корней проростков пшеницы, а клетки мутанта в составе биопленок с абиотической и биотической поверхностей обладали сниженной жизнеспособностью. При отсутствии существенных морфологических различий ЦП-клеток Sp245 и SK586 численность устойчивых к высушиванию покоящихся форм мутанта уступала таковой у родительского штамма. Устойчивые к высушиванию формы в биопленках Sp245 сохраняли жизнеспособность после 9 мес. хранения сухих образцов, а в биопленках SK586 жизнеспособность таких форм сохранялась менее месяца. По-видимому, отсутствие AhpC у мутанта SK586 усиливало влияние стресса, обусловленного высушиванием биопленок. Возможно, в процессе прорастания сухих покоящихся форм активность AhpC позволяла бактериям, сталкивающимся со стрессорными факторами, преодолевать их негативное влияние. Мутантный штамм, адаптировавшийся в корневой системе проростков пшеницы, формировал меньше, чем Sp245, клеточных форм, устойчивых к высушиванию. Однако в популяциях обоих штаммов в условиях in planta формировалось больше устойчивых к высушиванию клеток, чем в биопленках на абиотической поверхности (под жидкой МСМ на стекле).
Инокуляция проростков пшеницы культурой штамма A. brasilense Sp245 стимулировала развитие корневой системы проростков и положительно влияла на длину надземной части; но в случае растений, инокулированных мутантом SK586, подобные эффекты отсутствовали. Возможно, AhpC способствует более успешной адаптации азоспирилл к существованию в ассоциации с растениями и проявлению стимулирующей рост растений активности этих бактерий. Следует отметить, что AhpC отвечает за удаление не только H2O2, но и других органических пероксидов (Wasim et al., 2009), а также может защищать белки при тепловом шоке (Lee et al., 2016; Kamariah et al., 2018) и, возможно, при других стрессах.
Азоспириллы способны формировать биопленки как самостоятельно, так и совместно с другими микроорганизмами, например, с бактериями, осуществляющими очистку сточных вод (Gómez-Villalba et al., 2006). В составе мультивидовых биопленок члены сообщества могут оказывать взаимные как защитные, так и антагонистические воздействия (Ножевникова и соавт., 2015). Очевидно, азоспириллы в таких пленках будут сталкиваться с конкуренцией за ростовые факторы и с изменением рН, а влияние на их популяцию окислительного стресса, обусловленного эндогенным H2O2 и/или другими органическими пероксидами, может усиливаться. В данной работе выявлено, что инактивация гена ahpC сопровождалась снижением устойчивости биопленочной популяции азоспирилл не только к окислительному стрессу, но и к недостатку ростовых факторов, изменению рН среды и высушиванию, и влияла на свойства покоящихся форм. По-видимому, алкилгидропероксидредуктаза может участвовать в обеспечении адаптивных ответов A. brasilense на широкий круг стрессов, что, возможно, способствует более успешному приспособлению биопленочной популяции азоспирилл к изменениям окружающей среды, существованию в ассоциации с растениями и в составе мультивидовых сообществ (Bashan, de-Bashan, 2010; Bogino et al., 2013).
Список литературы
Васильева Г.Г., Глянько А.К., Миронова Н.В., Путилина Т.Е., Лузова Г.Б. Активные формы кислорода в проростках гороха при взаимодействии с симбиотическими и патогенными микроорганизмами // Прикл. биохимия и микробиология. 2007. Т. 43. С. 240–245.
Vasil’eva G.G., Glyan’ko A.G., Mironova N.V., Putilina T.E., Luzova G.B. Active oxygen species in pea seedlings during the interactions with symbiotic and pathogenic microorganisms // Appl. Biochem. Microbiol. 2007. V. 43. P. 217–221.
Ножевникова А.Н., Бочкова Е.А., Плакунов В.К. Мультивидовые биопленки в экологии, медицине и биотехнологии // Микробиология. 2015. Т. 84. С. 623–644.
Nozhevnikova A.N., Botchkova E.A., Plakunov V.K. Multi-species biofilms in ecology, medicine, and biotechnology // Microbiology (Moscow). 2015. V. 84. P. 731–750.
Плакунов В.К., Мартьянов С.В., Тетенева Н.А., Журина М.В. Универсальный метод количественной характеристики роста и метаболической активности микробных биопленок в статических моделях // Микробиология. 2016. Т. 85. С. 484–489.
Plakunov V.K., Mart’yanov S.V., Teteneva N.A., Zhurina M.V. A universal method for quantitative characterization of growth and metabolic activity of microbial biofilms in static models // Microbiology (Moscow). 2016. V. 85. P. 509–513.
Шелудько А.В., Широков А.А., Соколова М. К., Соколов О. И., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Колонизация корней пшеницы бактериями Azospirillum brasilense с различной подвижностью // Микробиология. 2010. Т. 79. С. 696–704.
Shelud’ko A.V., Shirokov A.A., Sokolova M.K., Sokolov O.I., Petrova L.P., Matora L.Yu., Katsy E.I. Wheat root colonization by Azospirillum brasilense strains with different motility // Microbiology (Moscow). 2010. V. 79. P. 688–695.
Шелудько А.В., Филипьечева Ю.А., Шумилова Е.М., Хлебцов Б.Н., Буров А.М., Петрова Л.П., Кацы Е.И. Изменения в формировании биопленок у flhB1 мутанта бактерии Azospirillum brasilense Sp245, лишенного жгутиков // Микробиология. 2015. Т. 84. С. 175–183.
Shelud’ko A.V., Filip’echeva Y.A., Shumilova E.M., K-hlebtsov B.N., Burov A.M., Petrova L.P., Katsy E.I. Changes in biofilm formation in the nonflagellated flhB1 mutant of Azospirillum brasilense Sp245 // Microbiology (Moscow). 2015. V. 84. P. 144–151.
Шелудько А.В., Филипьечева Ю.А., Телешева Е.М., Буров А.М., Евстигнеева С.С., Бурыгин Г.Л., Петрова Л.П. Характеристика углеводсодержащих компонентов биопленок Azospirillum brasilense Sp245 // Микробиология. 2018. Т. 87. С. 483–494.
Shelud’ko A.V., Filip’echeva Y.A., Telesheva E.M., Burov A.M., Evstigneeva S.S., Burygin G.L., Petrova L.P. Characterization of carbohydrate-containing components of Azospirillum brasilense Sp245 biofilms // Microbiology (Moscow). 2018. V. 87. P. 610–620.
Шелудько А.В., Мокеев Д.И., Евстигнеева С.С., Филипьечева Ю.А., Буров А.М., Петрова Л.П., Пономарева Е.Г., Кацы Е.И. Анализ ультраструктуры клеток в составе биопленок бактерий Azospirillum brasilense // Микробиология. 2020. Т. 89. С. 59–73.
Shelud’ko A.V., Mokeev D.I., Evstigneeva S.S., Filip’echeva Yu.A., Burov A.M., Petrova L.P., Ponomareva E.G., Katsy E.I. Cell ultrastructure in biofilms of Azospirillum brasilense // Microbiology (Moscow). 2020. V. 89. P. 50–63.
Baldani V.L.D., Baldani J.I., Döbereiner J. Effects of Azospirillum inoculation on root infection and nitrogen incorporation in wheat // Can. J. Microbiol. 1983. V. 29. P. 924–929.
Bashan Y., de-Bashan L.E. How the plant growth-promoting bacterium Azospirillum promotes plant growth – a critical assessment // Adv. Agron. 2010. V. 108. P. 77–136.
Berg R.H., Tyler M.E., Novick N.J., Vasil V., Vasil I.K. Biology of Azospirillum–sugarcane association: enhancement of nitrogenase activity // Appl. Environ. Microbiol. 1980. V. 39. P. 642–649.
Bogino P.C., Oliva M.M., Sorroche F.G., Giordano W. The role of bacterial biofilms and surface components in plant-bacterial associations // Int. J. Mol. Sci. 2013. V. 14. P. 15838–15859.
Clara R.W., Knowles R. Superoxide dismutase, catalase, and peroxidase in ammonium-grown and nitrogen-fixing Azospirillum brasilense // Can. J. Microbiol. 1984. V. 30. P. 1222–1228.
Döbereiner J., Day J.M. Associative symbiosis in tropical grass: Characterization of microorganisms and dinitrogen fixing sites // Symp. on Nitrogen Fixation / Eds. Newton W.E., Nijmans C.J. Pullman: Washington State University Press, 1976. P. 518–538.
Elmas M., Alexiades V., O’Neal L., Alexandre G. Modeling aerotaxis band formation in Azospirillum brasilense // BMC Microbiol. 2019. V. 19. P. 101.
Fibach-Paldi S., Burdman S., Okon Y. Key physiological properties contributing to rhizosphere adaptation and plant growth promoting abilities of Azospirillum brasilense // FEMS Microbiol. Lett. 2012. V. 326. P. 99–108.
Flemming H.-C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. 2010. V. 8. P. 623–633.
Fukami J., Cerezini P., Hungria M. Azospirillum: benefits that go far beyond biological nitrogen fixation // AMB Expr. 2018. V. 8. P. 73–85.
Gómez-Villalba B., Calvo C., Vilchez R., González-López J., Rodelas B. TGGE analysis of the diversity of ammonia-oxidizing and denitrifying bacteria in submerged filter biofilms for the treatment of urban wastewater // Appl. Microbiol. Biotechnol. 2006. V. 72. P. 393–400.
Kamariah N., Eisenhaber B., Eisenhaber F., Grüber G. Molecular mechanism of the Escherichia coli AhpC in the function of a chaperone under heat-shock conditions // Sci. Rep. 2018. V. 8. P. 14151.
Lee J.T., Lee S.S., Mondal S., Tripathi B.N., Kim S., Lee K.W., Hong S.H., Bai H.-W., Cho J.-Y., Chung B.Y. Enhancement of the chaperone activity of alkyl hydroperoxide reductase C from Pseudomonas aeruginosa PAO1 resulting from a point-specific mutation confers heat tolerance in Escherichia coli // Mol. Cells. 2016. V. 39. P. 594–602.
Nur I., Okon Y., Henis Y. Effect of dissolved oxygen tension on production of carotenoids, poly-β-hydroxybutyrate, succinate oxidase and superoxide dismutase by Azospirillum brasilense grown in continuous culture // J. Gen. Microbiol. 1982. V. 128. P. 2937–2943.
O’Toole G.A., Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis // Mol. Microbiol. 1998. V. 28. P. 449–461.
Poole L.B., Ellis H.R. Flavin-dependent alkyl hydroxyperoxide reductase from Salmonella typhymurium. 1. Purification and enzymatic activities of over expressed AhpF and AhpC proteins // Biochemistry. 1996. V. 35. P. 56–64.
Ramírez-Mata A., López-Lara L.I., Xiqui-Vázquez L., Jijón-Moreno S., Romero-Osorio A., Baca B.E. The cyclic-di-GMP diguanylate cyclase CdgA has a role in biofilm formation and exopolysaccharide production in Azospirillum brasilense // Res. Microbiol. 2016. V. 167. P. 190–201.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual, 2nd edn. N.Y.: Cold Spring Harbor Laboratory Press, 1989.
Scheludko A.V., Katsy E.I., Ostudin N.A., Gringaus O.K., Panasenko V.I. Novel classes of Azospirillum brasilense mutants with defects in the assembly and functioning of polar and lateral flagella // Мол. генетика, микробиология и вирусология. 1998. № 4. С. 33–37.
Schloter M., Hartmann A. Endophytic and surface colonization of wheat roots (Triticum aestivum) by different Azospirillum brasilense strains studied with strain-specific monoclonal antibodies // Symbiosis. 1998. V. 25. P. 159–179.
Tarrand J.J., Krieg N.R., Döbereiner J. A taxonomic study of the Spirillum lipoferum group with description of a new genus, Azospirillum gen. nov. and two species, Azospirillum lipoferum (Beijerinck) comb. nov. and Azospirillum braslense sp. nov. // Can. J. Microbiol. 1978. V. 24. P. 967–980.
Wang D., Xu A., Elmerich C., Ma L.Z. Biofilm formation enables free-living nitrogen-fixing rhizobacteria to fix nitrogen under aerobic conditions // ISME J. 2017. V. 11. P. 1602–1613.
Wasim M., Bible A.N., Xie Z., Alexandre G. Alkyl hydroperoxide reductase has a role in oxidative stress resistance and in modulating changes in cell-surface properties in Azospirillum brasilense Sp245 // Microbiology (SGM). 2009. V. 155. P. 1192–1202.
Дополнительные материалы отсутствуют.


