Микробиология, 2021, T. 90, № 2, стр. 166-178
Трансформация микробных комплексов в компонентах почвенных конструкций разного генезиса (почва, торф, песок) при процессах замораживания–оттаивания
А. М. Глушакова a, b, Л. В. Лысак a, А. В. Качалкин a, c, А. Е. Иванова a, d, А. Б. Умарова a, И. А. Абрамян a, З. С. Ежелев a, И. А. Максимова a, *
a МГУ им. М.В. Ломоносова
119234 Москва, Россия
b НИИ вакцин и сывороток им. И.И. Мечникова
105064 Москва, Россия
c Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
d Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
* E-mail: maximova.irina@gmail.com
Поступила в редакцию 04.08.2020
После доработки 16.09.2020
Принята к публикации 21.10.2020
Аннотация
В модельном эксперименте исследована трансформация микробных комплексов культивируемых форм сапротрофных бактерий и дрожжевых грибов при процессах замораживания–оттаивания в компонентах специализированных почвенных конструкций, которые используются для решения задач городского озеленения и выращивания травянистых растений. Численность сапротрофных бактерий и дрожжевых грибов зависела как от типа субстрата, так и от изменений температуры при процессах замораживания–оттаивания. Был зафиксирован достоверный рост численности дрожжей на стадии охлаждения торфа и почвы (Апах) до 0 и –5°C и на последующей стадии оттаивания до 0°С. В Апах и торфе максимальная численность дрожжей составила 5.1 lg (КОЕ/г). В отличие от численности дрожжевых грибов, показатель численности сапротрофных бактерий в Апах и торфе характеризовался резким снижением, когда температура субстрата принимала отрицательные значения, и была максимальной при температуре 19–22 и 10°C. В Апах максимальная численность бактерий составила 7.5 lg (КОЕ/г), в торфе – 8.0 lg (КОЕ/г). В песке численность как сапротрофных бактерий, так и дрожжевых грибов не зависела от температуры и составила 5.0 lg (КОЕ/г) для бактерий и 3.4 lg (КОЕ/г) для дрожжевых грибов на всех этапах в циклах замораживания–оттаивания. Всего из разных компонентов почвенных конструкций было выделено 15 видов сапротрофных бактерий и 29 видов дрожжевых грибов. При максимальной температуре охлаждения в циклах до –5°С из Апах и из торфа удалось выделить три вида бактерий, обладающих как психрофильными свойствами (Flavobacterium рsychrophilum), так и способных к образованию устойчивых к различным неблагоприятным воздействиям эндоспор (Bacillus subtilis, B. megaterium). Среди дрожжевых грибов, выделенных из Апах и торфа при отрицательной температуре и также обладающих психрофильными свойствами, были виды Candida sake, Rhodotorula glutinis, Rh. mucilaginosa, Solicoccozyma terricola. В песке при отрицательных температурах обнаружены бактерии, обладающие психрофильными свойствами, Flavobacterium рsychrophilum и Pseudomonas fluorescens, и два вида бацилл – Bacillus subtilis, B. megaterium. Только один вид дрожжевых грибов, Debaryomyces hansenii, способный переживать стрессовые условия в виде аскоспор, был выделен из песка при −5°C. Изучение в модельном эксперименте влияния краткосрочных перепадов температуры на динамику численности и разнообразия сообществ одноклеточных микроорганизмов в компонентах специализированных почвенных конструкций показало, что они способны “переносить” непродолжительные стрессовые перепады температуры, характерные для весенне-осеннего периода, восстанавливая численность исходных популяций после прекращения негативного воздействия. Это также говорит в пользу способности почвенных конструкций к саморазвитию в процессе функционирования, а не быстрой деградации.
Все процессы замораживания–оттаивания являются обычными для почв, формирующихся в зоне умеренного климата. Такие сезоннопромерзающие почвы занимают значительные территории и подвержены негативным изменениям структурной организации. Постепенно процессы замораживания–оттаивания в естественных условиях приводят к эрозии и деградации почв (Kværnø, Øygarden, 2006). Чувствительны к этим процессам и теплофизические свойства почв, их изменение сказывается на микробной активности, условиях вегетации растений, водно-физических свойствах почвы (Морина, 2008). Считается, что процессы оттаивания ведут к увеличению скорости минерализации органического вещества почв, что также сказывается на активации микробиоты (Kuhry et al., 2006; Schuur et al., 2008).
Изменения климата, наблюдаемые в настоящее время в умеренном, самом широком по протяженности географическом поясе Северного полушария, свидетельствуют об увеличении частоты промерзания почв и их последующего оттаивания в позднеосенний, зимний и ранневесенний периоды (Оценочный доклад об изменениях климата…., 2008). По мнению климатологов, это связано в первую очередь с устойчивыми трендами увеличения зимних температур и уменьшением высоты и устойчивости снежного покрова (Venäläinen et al., 2001; Гулёв и соавт., 2008; Kim et al., 2012).
Известно, что промерзание и последующее оттаивание почв часто влекут за собой резкое усиление дыхательной активности биоты (Lopes de Gerenyu et al., 2001; Teepe et al., 2001; Kurganova et al., 2004, 2007; Teepe, Ludwig, 2004; Matzner, Borken, 2008; Курганова, Лопес де Гереню, 2015). Повышение температуры влияет на скорость биохимических реакций, ферментативную активность, влечет за собой изменение физических (растворимость газов в воде) и биологических (рост микробных популяций) факторов среды (Степанов и соавт., 1996). Быстрые перепады температур, которые происходят при замерзании и оттаивании почвы, приводят к изменениям активности эмиссии газов, вызывают гибель одних микроорганизмов, приводя к увеличению количества доступных субстратов в почве, и, как следствие, при оттаивании, к росту микробной активности (Yergeau, Kowalchuk, 2008). Следовательно, одной из причин этого считается активация роста одних микроорганизмов на питательных веществах, которые высвобождаются при разрушении неадаптированных клеток других микроорганизмов под воздействием отрицательных температур (Panikov, Dedysh, 2000). Однако есть работы, где приводятся данные об отсутствии явления активации роста микроорганизмов. В работе Копонен и соавт. (2006) было показано, что замораживание и последующее оттаивание почв в бореальной зоне не оказывают заметного влияния на структуру и функционирование микробного сообщества.
До сих пор открытыми и актуальными остаются вопросы, связанные с влиянием сезонных перепадов температуры на численность и разнообразие сообществ почвенных микроорганизмов. Прежде всего, это касается влияния краткосрочных флуктуаций температуры на состав и функциональную активность сообщества микроорганизмов в почвах (Степанов и соавт., 1996; Larsenet al., 2002; Sulkava, Huhta, 2003; Feng et al., 2007).
В связи с этим, нами была предпринята попытка изучить в модельном эксперименте воздействие последовательных циклов замораживания–оттаивания (ЦЗО) на трансформацию микробных комплексов некоторых групп одноклеточных микроорганизмов (культивируемых сапротрофных бактерий и дрожжей) в компонентах специализированных почвенных конструкций. Такие антропогенно-глубокопреобразованные почвы (по классификации М.Н. Строгановой, 1998) в настоящее время представляют большой интерес и являются востребованными в мегаполисах в связи с решением задач озеленения, создания качественных и безопасных условий для жизни и работы людей на урбанизированных территориях. Почвенные конструкции традиционно представляют собой сочетание различных по генезису и свойствам субстратов – гумусового почвенного горизонта, торфа и песка. От правильного и долговременного функционирования таких почвенных конструкций зависит успешность формирования и поддержания в хорошем качестве зеленых участков высоко урбанизированных территорий современных мегаполисов (Умарова и соавт., 2019).
Постоянными и обязательными обитателями всех почвенных субстратов являются микроорганизмы разных таксономических и эколого-трофических групп. Их численность и таксономическое разнообразие косвенно свидетельствуют об интенсивности минерализационных процессов в почвах (Звягинцев и соавт., 2005). Они играют важную роль в круговороте веществ в природе, определяют состояние других компонентов экосистемы, в том числе обеспечивают произрастание различных видов растений (Добровольская, 2002; Добровольская и соавт., 2015). Продолжительность эксплуатационного периода конструкций в мегаполисах зависит от многих параметров. К ним относятся: интенсивность процессов аккумуляции в корнеобитаемом слое конструкций элементов питания и влаги, степень загрязненности окружающих городских почв, численность, разнообразие и соотношение различных функциональных групп микроорганизмов в урбаноземах и в специализированных почвенных конструкциях. Период функционирования конструкций, в свою очередь, отражается на их экономической рентабельности (Курбатова, 2004; Смагин и соавт., 2006; Смагин, 2012).
Цель работы – изучить в модельном эксперименте трансформацию микробных комплексов культивируемых форм сапротрофных бактерий и дрожжевых грибов в различных компонентах специализированных почвенных конструкций (пахотном почвенном горизонте, торфе, песке) в условиях стресса при процессах краткосрочного замораживания–оттаивания.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
В качестве исходных образцов для эксперимента были выбраны: пахотный горизонт конструктозема, торф, песок. Модельный эксперимент проводился по отработанной методике (Вайгель, 2017; Сусленкова и соавт., 2018) на 36 почвенных колонках (стеклянные трубки высотой 10 см и диаметром 15 см). Всего было создано три варианта почвенных колонок по 12 повторностей для каждого варианта:
вариант 1 – горизонт Апах конструктоземов 1950-х гг., который был использован при формировании Почвенного стационара МГУ. На протяжении всех лет территория подвергалась вспашке, поэтому данный горизонт продолжает иметь все морфологические признаки пахотного горизонта: серую окраску, зернисто-комковатую структуру, оптимальную плотность;
вариант 2 – торф низинный, высокой степени разложения (>30%), нейтрализованный мелом (рН 5.5–6.5), производитель ООО “Селигер-торф”;
вариант 3 – песок карьерный (преобладающая фракция – мелкий песок).
Колонки на первом этапе эксперимента заполнялись с определенной задаваемой плотностью, которая соблюдалась по всей высоте почвенных колонок. Дно колонок формировалось из четырех слоев капрона. Затем колонки устанавливались на штативы лабораторные ШЛ-98. На следующем фильтрационном этапе эксперимента каждую из колонок проливали одинаковым объемом воды 1000 мл с установлением постоянной скорости фильтрации. Объем проливаемой воды был рассчитан таким образом, чтобы насытить все поровое пространство субстрата влагой. Для фиксирования скорости потока на нижней границе почвенных колонок осуществляли сбор фильтрата, с регистрацией времени прохождения воды через колонку. Высота водного столба на верхней границе поддерживалась на постоянном уровне и составляла 1 см. После окончания фильтрации и стекания лизиметрических вод, колонки помещали в термостат и замораживали до температуры –5°C. Температуру измеряли на глубине 7 см с помощью технического жидкостного термометра ТТЖ-М с диапазоном измерения –35...–50°С – 160/66 и ценой деления 0.5°C.
Стартовой точкой микробиологического анализа компонентов была температура субстратов до начала моделирования циклов замораживания–оттаивания, соответствующая комнатной температуре (19 и 22°С для первого и второго циклов соответственно). Далее отбор образцов из колонок на микробиологический анализ компонентов проводили на этапах охлаждения до 10, 5, 0°С и при замерзании до −5°С. Следующий отбор образцов производили после оттаивания колонок до 0°С и инкубирования их при нулевой температуре в течение трех суток. Затем колонки вынимали, оставляли при комнатной температуре до достижения стартовых температурных значений субстратов, проливали воду объемом 1000 мл и повторяли цикл. Всего было проведено два последовательных цикла замораживания–оттаивания колонок с компонентами почвенных конструкций. Температуру измеряли в контрольных колонках, из которых образцы не отбирали (табл. 1). Все временные интервалы промерзания–оттаивания для каждого цикла указаны в табл. 1.
Таблица 1.
Продолжительность отдельных этапов во время ЦЗО (Апах, торф, песок)
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 |
|---|---|---|---|---|---|---|---|---|---|---|
| Апах | 19 | 68ч36м | 40ч03м | 72 | 72ч24м | 22 | 65ч41м | 40ч12м | 72 | 430ч53м |
| Торф | 116ч15м | 54ч22м | 81ч12м | 100ч14м | 53ч32м | 549ч35м | ||||
| Песок | 20ч21м | 08ч02м | 06ч15м | 14ч18м | 08ч02м | 200ч587м |
Обозначения: 1 – варианты субстратов, которыми были заполнены почвенные колонки; 2 – стартовая температура субстратов до начала первого цикла замораживания–оттаивания, °С; 3 – время промерзания до –5°С (Апах, торф, песок) на глубине 7 см (первый цикл), часы и минуты; 4 – время оттаивания до 0°С (первый цикл), часы и минуты; 5 – время содержания колонок при 0°С, часы; 6 – время доведения содержимого колонок до комнатной температуры; 7 – стартовая температура субстратов до начала второго цикла замораживания–оттаивания, °С; 8 – время промерзания до –5°С, (Апах, торф, песок) на глубине 7 см (второй цикл), часы и минуты; 9 – время оттаивания до 0°С (второй цикл), часы и минуты; 10 – время поддержания температуры 0°С, часы; 11 – общая продолжительность циклов замораживания–оттаивания, часы и минуты.
Всего было проанализировано 864 образца почвенных компонентов (по 288 образцов каждого субстрата). Общая продолжительность эксперимента составила 28 сут. Каждый образец исследовался в восьми повторностях. Посевы культивировали в течение 7–10 дней.
Выделение и расчет численности (на 1 г абсолютного сухого субстрата) только культивируемых форм бактерий сапротрофного комплекса проводили классическим методом посева на одну среду. Использовали агаризованную глюкозо-пептонно-дрожжевую среду (ГПД) состава (г/л): глюкоза – 1, пептон – 2, дрожжевой экстракт – 1, гидролизат казеина – 1, CaCO3 – 0.5, агар-агар – 20. Эта среда позволяет выделить из почвы до 50 родов блока аэробных и факультативно-анаэробных бактерий (Звягинцев, 1991; Лысак и соавт., 2003). Посевы анализировали с микроскопированием всех выросших колоний. Схожие по макро- и микроморфологии колонии выделяли в чистую культуру для последующей генетической идентификации нуклеотидных последовательностей гена 16S рРНК с использованием программы BLAST (Manucharova et al., 2008). Выделение ДНК из чистых культур бактерий проводили с использованием набора PrepMan Ultra Sample Preparation Reagent в соответствии с рекомендациями производителя. Секвенирование ПЦР-продуктов вариабельных участков V3–V4 гена 16S рРНК проводили по стандартному протоколу MicroSeq 500 16S rDNA Bacterial Identification Kits Protocol (“ThermoFisher”) с использованием стандартных праймеров fD1/rD1 (прямой праймер (fD1): 5'-HAATHYGTGCCAGCAGC-3' и обратный праймер (rD1): 5'-GTCRTCCYDCCTCCTC-3') (Weisburg, 1991). Капиллярный форез проводили на генетическом анализаторе ABI Prism 3130. Для анализа полученных электрофореграмм и последовательностей нуклеотидов применяли программное обеспечение MicroSeq ID v2.0 Software и валидированную библиотеку MicroSeq ID 16S rDNA 500 Library v2.0. Анализ последовательностей гена 16S pРНК проводили в Научно-производственной компании “Синтол” (Москва). Всего было идентифицировано 612 штаммов бактерий.
Численность и таксономическое разнообразие дрожжевых грибов определяли с помощью прямого метода посева на глюкозо-пептонно-дрожжевую среду (ГПДА) состава (г/л): глюкоза – 20, пептон – 10, дрожжевой экстракт – 5, агар – 20) с добавлением хлорамфеникола (500 мг/л) для предотвращения роста бактерий. Видовую идентификацию дрожжевых грибов проводили на основе анализа нуклеотидной последовательности ITS региона рДНК. Выделение рДНК и постановку ПЦР проводили по ранее описанной методике (Глушакова, Качалкин, 2017). Секвенирование рДНК проводили с помощью набора реактивов Big Dye Terminator V3.1 Cycle Sequencing Kit (“Applied Biosystems”, США) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130xl Genetic Analyzer в ЗАО “Евроген” (Москва). Для секвенирования был использован праймер ITS5 (5'-GGA AGT AAA AGT CGT AAC AAG G) (Fell, Blatt, 1999). Идентификацию дрожжей на основании полученных результатов секвенирования проводили, используя данные генбанка NCBI (www.ncbi.nlm.nih.gov) и базы данных MycoID (www.mycobank.org). Всего было проанализировано 128 штаммов дрожжевых грибов.
На основании проведенной идентификации микроорганизмов рассчитывали относительное обилие таксонов. Относительное обилие каждого таксона бактерий и дрожжевых грибов (в %) определяли, рассчитывая среднее содержание (доли) каждого из них от общей численности бактерий (дрожжей) в образце. Относительное обилие в субстрате в заданных условиях вычисляли как среднее по всем проанализированным образцам.
Статистическую обработку полученных результатов проводили, используя пакет STATISTICA 8.0 (StatSoft).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Численность сапротрофных бактерий в Апах и торфе зависела как от типа субстрата, так и от изменений температуры при процессах замораживания–оттаивания (рис. 1).
Рис. 1.
Изменение численности сапротрофных бактерий в компонентах почвенных конструкций при процессах замораживания−оттаивания; показаны средние значения и ошибка среднего. Условные обозначения: 1 – Апах; 2 – торф; 3 – песок.
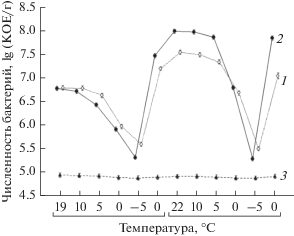
Результаты двухфакторного дисперсионного анализа показали, что численность бактерий достоверно зависит от субстрата (критерий Фишера 3454.02; p < 0.050) и температуры (критерий Фишера 1347.73; p < 0.050). В Апах и торфе наблюдался близкий по значениям диапазон колебаний численности сапротрофных бактерий: в Апах от 5.4 lg (КОЕ/г) до 7.5 lg (КОЕ/г); в торфе – от 5.5 lg (КОЕ/г) до 8.0 lg (КОЕ/г). Численность сапротрофных бактерий в Апах и торфе характеризовалась резким снижением, когда температура субстратов принимала отрицательные значения. Максимальные значения численности наблюдались в стартовой точке и при охлаждении субстратов до 10°С. В песке численность сапротрофных бактерий не зависела от температуры и составляла порядка 5.0 lg (КОЕ/г) на всех этапах циклов замораживания–оттаивания. Из песка в ходе эксперимента выделено четыре вида бактерий: Bacillus subtilis, B. megaterium, Flavobacterium рsychrophilum и Pseudomonas fluorescens. Вероятно, как образование эндоспор бациллами, так и метаболическая пластичность психрофильных видов, Flavobacterium рsychrophilum и Pseudomonas fluorescens, позволяют им, оказавшись в неблагоприятных для роста и развития местообитаниях, таких как песок, сохраняться и не гибнуть в течение длительного периода.
Аналогичная закономерность была получена нами ранее в исследованиях образцов дерново-подзолистой почвы, подвергшихся 3-кратному замораживанию (модельный опыт). Показатели суммарной численности клеток изменялись незначительно, однако существенно уменьшалась доля интактных (живых) клеток. Метод окраски почвенной суспензии красителем LIVE/DEAD L7012 позволил определить численность и охарактеризовать физиологическое состояние бактериальных клеток в образцах почвы. При этом даже после трехкратного замораживания–оттаивания образца около 10% клеток сохраняли неповрежденную клеточную мембрану, что, видимо, связано с защитным действием почвы по отношению к населяющим ее организмам, а также с адаптивными возможностями самих бактерий. Безусловно, адаптационные механизмы зависят от вида микроорганизма, его чувствительности к перепадам температур. Примером такого механизма, который к настоящему времени достаточно хорошо изучен, является изменение активности системы метаболических ферментов или текучести клеточных мембран, ассоциированной со спектром жирных кислот (Лысак, 2010; Андрюков и соавт., 2015).
Численность дрожжевых грибов в Апах и торфе зависела как от типа субстрата, так и от изменений температуры при процессах замораживания–оттаивания (рис. 2).
Рис. 2.
Изменение численности дрожжевых грибов в ЦЗО компонентов почвенных конструкций; показаны средние значения и ошибка среднего. Условные обозначения: 1 – Апах; 2 – торф; 3 – песок.
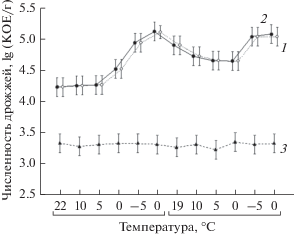
Результаты двухфакторного дисперсионного анализа показали, что численность дрожжевых грибов в Апах и торфе достоверно зависит от субстрата (критерий Фишера 3658.48; p < 0.050) и температуры (критерий Фишера 1016.87; p < 0.050). В Апах и торфе наблюдались синхронные колебания численности дрожжевых грибов в пределах от 4.2 lg (КОЕ/г) до 5.1 lg (КОЕ/г) в циклах замораживания–оттаивания. Рост численности дрожжей был зафиксирован на стадии охлаждения Апах и торфа до 0 и –5°С и на последующей стадии оттаивания до 0°С.
Общая закономерность в динамике численности дрожжевых грибов в исследованных компонентах почвенных конструкций, Апах и торфе, вероятно, связана со схожими чертами в таксономической структуре обоих субстратов и прежде всего присутствием видов дрожжей, штаммы которых часто обладают психрофильными свойствами (Cystofilobasidium infirmominiatum, Rhodotorula glutinis, Rhodosporidiobolus colostri, Candida sake, Solicoccozyma terricola). Рост численности дрожжей при пониженных температурах за счет психрофильных видов, возможно, связан с активацией их роста за счет питательных веществ, которые высвобождаются при разрушении неадаптированных клеток других видов микроорганизмов под воздействием отрицательных температур (Panikov, Dedysh, 2000). В песке численность дрожжевых грибов не зависела от температуры и составила порядка 3.4 lg (КОЕ/г) на всех стадиях в циклах замораживания–оттаивания. Дрожжи в песке были представлены всего двумя видами, аскомицетом Debaryomyces hansenii и базидиомицетом Rhodotorula mucilaginosa. Это эврибионтные дрожжи с широким ассимиляционным спектром. Они регулярно выделяются из самых разных местообитаний (растительные субстраты, пищевые продукты, морская вода, почва и др.) (Vital et al., 2002; Kurtzman et al., 2011). Важной экологической особенностью этих видов дрожжевых грибов является показанная ранее их устойчивость к длительному периоду высушивания и низкой активности воды, чем объясняется высокая доля этих дрожжей в таком антропогенном субстрате, как пыль жилых помещений (Глушакова и соавт., 2004, 2015). Скорее всего, отсутствие зависимости между значениями численности дрожжей D. hansenii и Rh. mucilaginosa в таком бедном субстрате как песок и температурой связано со способностью этих видов длительное время сохраняться в неблагоприятной среде (для D. hansenii в том числе и за счет способности образовывать аскоспоры) в условиях недостатка питательных веществ.
Таксономическая структура комплексов сапротрофных бактерий и дрожжевых грибов. Всего из всех компонентов почвенных конструкций было выделено 15 видов сапротрофных бактерий (табл. 2). Из Апах было выделено 15 видов бактерий, из торфа – 10, из песка – 6.
Таблица 2.
Относительное обилие сапротрофных бактерий, выделенных из компонентов почвенных конструкций в ЦЗО
| Этапы ЦЗО | Arthrobacter globiformis | Aquaspirillum soli | Azospirillum lipoferum | Bacillus megaterium | Bacillus subtilis | Beijerinckia mobilis | Cytophaga sp. | Erwinia sp. | Flavobacterium рsychrophilum | Myxococcus xanthus | Myxococcus sp. | Polyangium cellulosum | Pseudomonas fluorescens | Streptomyces sp. | Xanthomonas campestris | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Апах | 1 | 4.2 | 8.5 | – | 2.2 | 4.0 | 4.1 | – | 14.2 | 26.5 | 14.5 | – | 2.8 | 1.5 | 8.3 | 9.2 |
| 2 | 4.2 | 4.7 | 6.5 | 3.8 | 4.9 | 10.2 | 11.8 | – | 29.6 | 3.1 | 1.3 | 2.7 | 5.4 | 2.6 | 9.2 | |
| 3 | 12.4 | 8.6 | – | 4.5 | 7.5 | – | 4.7 | – | 47.8 | – | – | 3.2 | 6.6 | 4.7 | – | |
| 4 | 2.6 | – | – | 4.5 | 6.8 | – | – | – | 76.4 | – | – | – | 6.8 | 2.9 | – | |
| 5 | – | – | – | 4.8 | 7.2 | – | – | – | 85.7 | – | – | – | 2.3 | – | – | |
| 6 | 3.6 | 5.4 | 16.2 | 2.3 | 2.3 | 11.3 | 9.9 | 3.3 | 22.7 | 6.2 | – | 3.6 | 4.5 | 5.6 | 3.1 | |
| 7 | 4.1 | 9.2 | 7.1 | 3.2 | 4.2 | 5.2 | 12.4 | 8.1 | 33.2 | 0.5 | – | 2.4 | 1.7 | 2.1 | 6.6 | |
| 8 | 8.6 | – | 5.9 | 3.8 | 9.0 | 9.2 | 10.8 | 3.2 | 27.4 | – | – | – | 4.4 | 4.1 | 13.6 | |
| 9 | 5.4 | – | – | 5.4 | 6.2 | – | – | 2.1 | 70.8 | – | – | – | 5.5 | 4.6 | – | |
| 10 | 1.8 | – | – | 3.4 | 8.3 | – | – | 1.2 | 81.6 | – | – | – | 3.7 | – | – | |
| 11 | – | – | – | 1.9 | 22.1 | – | – | – | 73.8 | – | – | – | 2.2 | – | – | |
| 12 | 3.6 | 5.4 | 19.2 | 3.6 | 3.1 | 10.9 | 9.9 | 3.3 | 20.1 | 6.8 | – | 3.6 | 2.5 | 4.9 | 3.1 | |
| Торф | 1 | 14.6 | – | – | 8.1 | 3.9 | – | 13.1 | – | 38.1 | 10.0 | 6.7 | – | 5.5 | – | – |
| 2 | – | – | – | 16.4 | 13.6 | – | – | – | 62.8 | – | – | – | 7.2 | – | – | |
| 3 | – | – | – | 4.8 | 17.1 | – | – | – | 72.4 | – | – | – | 5.7 | – | – | |
| 4 | – | – | – | 6.2 | 6.9 | – | – | – | 82.4 | – | – | – | 4.5 | – | – | |
| 5 | – | – | – | 4.2 | 16.4 | – | – | – | 72.6 | – | – | – | 6.8 | – | – | |
| 6 | 9.2 | – | – | 2.4 | 14.6 | 14.2 | – | – | 40.4 | 11.4 | – | – | 7.8 | – | – | |
| 7 | 16.3 | – | – | 7.4 | 7.7 | 9.1 | – | – | 29.8 | 22.1 | 2.1 | – | 5.5 | – | – | |
| 8 | 10.1 | – | – | 11.4 | 18.1 | 4.4 | – | – | 35.2 | 5.2 | – | – | 15.6 | – | – | |
| 9 | – | – | – | 5.1 | 11.7 | – | – | – | 78.4 | – | – | – | 4.8 | – | – | |
| 10 | – | – | – | 7.1 | 9.2 | – | – | – | 80.1 | – | – | – | 3.6 | – | – | |
| 11 | – | – | – | 3.6 | 8.7 | – | – | – | 85.6 | – | – | – | 2.1 | – | – | |
| 12 | 10.7 | – | – | 4.4 | 9.8 | 15.6 | 23.1 | – | 18.1 | 10.1 | – | – | 8.2 | – | – | |
| Песок | 1 | – | – | – | 17.6 | 26.1 | – | – | – | 34.2 | – | – | – | 22.1 | – | – |
| 2 | – | – | – | 15.8 | 33.3 | – | – | – | 28.6 | – | – | – | 22.3 | – | – | |
| 3 | – | – | – | 18.5 | 21.2 | – | – | – | 44.1 | – | – | – | 16.2 | – | – | |
| 4 | – | – | – | 9.4 | 14.6 | – | – | – | 65.4 | – | – | – | 10.6 | – | – | |
| 5 | – | – | – | 1.5 | 7.2 | – | – | – | 87.2 | – | – | – | 4.1 | – | – | |
| 6 | – | – | – | 15.7 | 30.6 | – | – | – | 27.5 | 4.3 | 1.1 | – | 20.8 | – | – | |
| 7 | – | – | – | 18.6 | 27.8 | – | – | – | 33.1 | 2.1 | – | – | 18.4 | – | – | |
| 8 | – | – | – | 22.8 | 15.5 | – | – | – | 45.2 | – | – | – | 16.5 | – | – | |
| 9 | – | – | – | 14.7 | 17.7 | – | – | – | 55.2 | – | – | – | 12.4 | – | – | |
| 10 | – | – | – | 7.6 | 12.5 | – | – | – | 72.4 | – | – | – | 7.5 | – | – | |
| 11 | – | – | – | 2.2 | 4.2 | – | – | – | 90.2 | – | – | – | 3.4 | – | – | |
| 12 | – | – | – | 27.2 | 31.8 | – | – | – | 15.6 | – | – | – | 25.4 | – | – |
Этапы ЦЗО: 1 – 19°С (стартовая температура субстратов до начала первого цикла замораживания–оттаивания); 2 – 10°С (промерзание в первом цикле замораживания–оттаивания); 3 – 5°С (промерзание в первом цикле замораживания–оттаивания); 4 – 0°С (промерзание в первом цикле замораживания–оттаивания); 5 – –5°С (завершение этапа промерзания в первом цикле замораживания–оттаивания); 6 – 0°С (оттаивание в первом цикле замораживания–оттаивания); 7 – 22°С (завершение первого цикла замораживания–оттаивания и стартовая температура субстратов второго цикла замораживания–оттаивания); 8 – 10°С (промерзание во втором цикле замораживания–оттаивания); 9 – 5°С (промерзание во втором цикле замораживания–оттаивания); 10 – 0°С (промерзание во втором цикле замораживания–оттаивания); 11 – –5°С (завершение этапа промерзания во втором цикле замораживания–оттаивания); 12 – 0°С (оттаивание во втором цикле замораживания–оттаивания).
Относительное обилие некоторых видов бактерий сильно зависело от изменений температуры при процессах замораживания–оттаивания (табл. 2). При максимальной температуре охлаждения в циклах до –5°С из Апах и торфа выделялись три вида бактерий, обладающие как психрофильными свойствами (Flavobacterium рsychrophilum), так и способные к образованию устойчивых к различным неблагоприятным воздействиям эндоспор (Bacillus subtilis, B. megaterium).
Доля вида Bacillus subtilis в Апах при –5°С составила 7.2 и 22.1% в первом и втором циклах соответственно; в торфе – 16.4 и 8.7%. Доля Bacillus megaterium составила в Апах 4.8 и 1.9% соответственно в первом и втором циклах замораживания–оттаивания; в торфе – 4.2 и 3.6%. Доля Flavobacterium рsychrophilum была наибольшей в Апах при –5°С и составила 85.7 и 73.8% в первом и втором циклах соответственно; в торфе – 72.6 и 85.6% (табл. 2). Вид Flavobacterium рsychrophilum регулярно выделяется из почвы и пресных водоемов, особенно активно развивается при пониженных температурах (Намсараев, 2008; Naoyuki, 2008). В исследованиях психрофильных бактерий показано, что холодовой шок так изменяет их физиологию, что они приобретают высокую выживаемость и более высокую скорость роста, синтезируя в ответ на охлаждение белки холодового шока (Феофилова, 2003; Воробьева, 2004). Приспособленность спорообразующих бактерий гидролитического комплекса из рода Bacillus к условиям низких температур ранее была показана в модельном опыте влияния температуры на структуру микробных сообществ верховых торфяников (Головченко и соавт., 2010). Отдельно хотелось отметить выявленное нами достоверное возрастание относительного обилия азотфиксирующих бактерий Azospirillum lipoferum (до 16.2 и 19.2% в первом и втором циклах соответственно) в Апах и Beijerin-ckia mobilis в Апах (до 11.3 и 10.9% соответственно в первом и во втором циклах) и в торфе (до 14.2 и 15.6% соответственно в первом и во втором циклах) на этапе оттаивания до 0°С (табл. 2). Влияние этих бактерий на рост растений огромно и по праву сопоставимо с обработкой некоторых почв азотными удобрениями.
Всего из почвенных субстратов было выделено 29 видов дрожжевых грибов – 9 аскомицетовых (табл. 3) и 20 базидиомицетовых (табл. 4).
Таблица 3.
Относительное обилие аскомицетовых дрожжевых грибов, выделенных из компонентов почвенных конструкций в ЦЗО
| Этапы ЦЗО | Barnettozyma californica | Candida parapsilosis | C. sake | Debaryomyces hansenii | Hanseniaspora uvarum | Metschnikowia pulcherrima | Meyerozyma guilliermondii | Nadsonia starkeyi-henricii | Schwanniomyces capriottii | |
|---|---|---|---|---|---|---|---|---|---|---|
| Апах | 1 | 2.06 | 0.25 | 1.61 | 3.70 | 3.07 | 2.87 | 1.23 | – | 2.38 |
| 2 | 1.77 | 0.43 | 2.14 | 3.14 | 2.24 | 4.26 | 4.29 | – | – | |
| 3 | 2.21 | 0.24 | 2.64 | 4.20 | 2.28 | 4.12 | – | – | – | |
| 4 | – | – | 3.02 | – | 2.66 | 4.16 | – | – | – | |
| 5 | – | – | 6.37 | 6.22 | 2.10 | 3.90 | – | – | – | |
| 6 | 1.13 | 0.98 | 6.37 | 10.24 | 0.58 | 0.16 | – | – | 2.38 | |
| 7 | 2.05 | 0.25 | 1.61 | 1.46 | 2.07 | 2.87 | 1.23 | – | 6.20 | |
| 8 | 3.11 | 0.43 | 2.14 | 3.45 | 2.24 | 4.26 | 3.29 | – | – | |
| 9 | 4.25 | 0.24 | 2.64 | 1.10 | 2.28 | 4.12 | – | – | – | |
| 10 | – | – | 3.02 | – | 3.06 | 4.16 | – | – | – | |
| 11 | 3.78 | 0.07 | 6.45 | 7.11 | – | 0.16 | – | – | 2.56 | |
| 12 | 1.13 | 1.05 | 6.92 | 10.73 | 0.98 | 0.16 | – | – | 2.38 | |
| Торф | 1 | – | – | 12.68 | 4.48 | – | 3.82 | 0.40 | – | 2.22 |
| 2 | 0.23 | – | 15.88 | 2.11 | – | 2.45 | 1.16 | 0.98 | – | |
| 3 | – | 1.29 | 16.05 | 6.18 | 2.13 | 5.15 | – | 2.11 | – | |
| 4 | – | – | 24.89 | – | 2.31 | – | – | 9.45 | – | |
| 5 | – | – | 66.53 | 7.23 | 4.02 | – | – | 1.72 | – | |
| 6 | – | – | 47.79 | 8.23 | 0.54 | – | – | 11.17 | – | |
| 7 | – | – | 12.38 | 6.14 | – | 3.82 | 0.32 | – | 7.11 | |
| 8 | 0.78 | – | 15.11 | – | – | 2.44 | 1.16 | – | – | |
| 9 | – | 1.29 | 16.05 | 4.44 | 2.39 | 5.22 | – | – | – | |
| 10 | – | – | 23.02 | – | 2.14 | – | – | 11.37 | – | |
| 11 | – | – | 66.53 | 6.55 | 4.09 | – | – | 5.86 | – | |
| 12 | – | – | 47.96 | 7.20 | 0.54 | – | – | 13.24 | – | |
| Песок | 1 | – | – | – | 71.87 | – | – | – | – | – |
| 2 | – | – | – | 4.77 | – | – | – | – | – | |
| 3 | – | – | – | 20.00 | – | – | – | – | – | |
| 4 | – | – | – | 54.35 | – | – | – | – | – | |
| 5 | – | – | – | 100 | – | – | – | – | – | |
| 6 | – | – | – | 100 | – | – | – | – | – | |
| 7 | – | – | – | 81.20 | – | – | – | – | – | |
| 8 | – | – | – | 4.57 | – | – | – | – | – | |
| 9 | – | – | – | 24.70 | – | – | – | – | – | |
| 10 | – | – | – | 46.50 | – | – | – | – | – | |
| 11 | – | – | – | 100 | – | – | – | – | – | |
| 12 | – | – | – | 100 | – | – | – | – | – |
Обозначения как в табл. 2.
Таблица 4.
Относительное обилие базидиомицетовых дрожжевых грибов, выделенных из компонентов почвенных конструкций в ЦЗО
| Этапы ЦЗО | Apiotrichum dulcitum | A. laibachii | A. porosum | Cystofilobasidium capitatum | Cys. infirmominiatum | Cys. macerans | Diutina catenulata | Filobasidium magnum | F. wieringae | Goffeauzyma gastrica | Papiliotrema flavescens | Rhodosporidiobolus colostri | Rhodotorula glutinis | Rh. graminis | Rh. mucilaginosa | Saitozyma podzolica | Solicoccozyma aeria | S. terrea | S. terricola | Tausonia pullulans | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Апах | 1 | 1.37 | 1.07 | 2.93 | 13.00 | 0.43 | – | 0.86 | 3.76 | 1.19 | 3.74 | 7.22 | 1.37 | – | 2.57 | 10.78 | 7.36 | 8.49 | 13.48 | 0.33 | 2.89 |
| 2 | 1.68 | 2.05 | 2.94 | 24.2 | 0.57 | 0.78 | 1.15 | 1.78 | 0.91 | 0.17 | 0 | 1.63 | 3.45 | – | 18.11 | 6.01 | 2.44 | 12.14 | 0.39 | 1.33 | |
| 3 | 1.66 | 3.21 | 2.52 | 27.12 | 4.14 | 2.90 | – | 0.12 | 0.22 | 0.87 | 2.19 | 5.11 | 4.89 | 5.53 | 4.48 | 2.74 | 1.84 | 2.22 | 8.22 | 4.33 | |
| 4 | 1.33 | 1.02 | 0.45 | 27.45 | 6.78 | 5.34 | – | – | – | 0.17 | 4.32 | 5.85 | 6.02 | 6.77 | 6.44 | 3.00 | 0.56 | 0.22 | 10.11 | 4.33 | |
| 5 | 1.67 | 0.23 | 0.42 | 26.61 | – | 5.37 | – | – | – | – | 5.33 | – | 12.29 | 3.37 | 6.00 | 2.34 | 1.01 | 0.08 | 16.69 | – | |
| 6 | 0.68 | 0.23 | 1.04 | 10.44 | 10.21 | 10.91 | – | – | – | – | 5.33 | 2.46 | 10.12 | 1.63 | 11.67 | 8.28 | – | 1.48 | 3.68 | – | |
| 7 | 2.11 | 4.17 | 3.02 | 8.11 | – | – | 0.17 | 6.10 | 6.12 | 5.24 | 6.09 | – | – | 2.43 | 6.43 | 6.98 | 7.45 | 8.02 | 2.42 | 7.40 | |
| 8 | 0.88 | 1.14 | 6.15 | 19.45 | 1.55 | 0.78 | 0.28 | – | 4.13 | 1.24 | – | 2.60 | 2.11 | – | 18.03 | 6.78 | 3.12 | 10.45 | 0.39 | 2.00 | |
| 9 | 1.66 | 3.55 | 5.24 | 29.22 | – | – | – | – | 1.45 | 1.18 | 2.20 | 7.00 | 3.2 | 5.15 | 4.44 | 3.15 | 0.12 | 2.55 | 9.05 | 6.21 | |
| 10 | 1.33 | 1.50 | 1.28 | 30.12 | 9.12 | 9.11 | – | – | – | 0.68 | 1.45 | 1.8 | 4.78 | 8.45 | 2.10 | 1.26 | 1.12 | 1.44 | 14.22 | – | |
| 11 | 0.68 | – | 5.26 | 10.56 | 7.50 | 9.12 | – | – | – | – | 6.22 | 3.16 | 8.56 | – | 13.8 | 10.18 | – | 0.14 | 4.69 | – | |
| 12 | 0.68 | 0.23 | 1.22 | 10.44 | 10.21 | 10.91 | – | – | – | – | 5.33 | 2.46 | 10.12 | 1.63 | 11.67 | 7.18 | – | 0.96 | 3.61 | – | |
| Торф | 1 | – | 0.35 | – | – | 4.75 | – | – | – | – | – | 0.92 | 2.48 | – | – | 67.34 | – | – | – | – | 0.53 |
| 2 | – | 0.70 | – | – | 2.66 | – | – | – | – | – | – | 5.18 | – | – | 65.51 | – | – | – | – | 3.14 | |
| 3 | – | 1.12 | – | – | 6.23 | – | – | – | – | – | – | 3.14 | 1.20 | – | 55.4 | – | – | – | – | – | |
| 4 | – | 0.20 | – | – | 41.12 | – | – | – | – | – | – | 6.05 | 5.78 | – | 10.20 | – | – | – | – | – | |
| 5 | – | – | – | – | – | – | – | – | – | – | – | – | 17.83 | – | 2.67 | – | – | – | – | – | |
| 6 | – | – | – | – | 22.05 | – | – | – | – | – | – | – | – | – | 10.22 | – | – | – | – | – | |
| 7 | – | 2.16 | – | – | 4.75 | – | – | – | – | – | 2.80 | 5.25 | – | – | 49.16 | – | – | – | – | 6.08 | |
| 8 | – | 0.92 | – | – | 5.78 | – | – | – | – | – | – | 10.18 | – | – | 58.51 | – | – | – | – | 5.12 | |
| 9 | – | 2.51 | – | – | 8.02 | – | – | – | – | – | – | 3.00 | 1.10 | – | 55.98 | – | – | – | – | – | |
| 10 | – | 0.56 | – | – | 42.14 | – | – | – | – | – | – | 4.23 | 5.50 | – | 11.04 | – | – | – | – | – | |
| 11 | – | – | – | – | – | – | – | – | – | – | – | – | 16.97 | – | – | – | – | – | – | – | |
| 12 | – | – | – | – | 18.51 | – | – | – | – | – | – | – | – | – | 12.55 | – | – | – | – | – | |
| Песок | 1 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 28.10 | – | – | – | – | – |
| 2 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 95.23 | – | – | – | – | – | |
| 3 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 80.00 | – | – | – | – | – | |
| 4 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 45.65 | – | – | – | – | – | |
| 5 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | |
| 6 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | |
| 7 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 18.80 | – | – | – | – | – | |
| 8 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 95.43 | – | – | – | – | – | |
| 9 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 75.30 | – | – | – | – | – | |
| 10 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | 53.50 | – | – | – | – | – | |
| 11 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | |
| 12 | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – | – |
Обозначения как в табл. 2.
Больше всего видов дрожжевых грибов – 28, было выделено из Апах, в торфе было встречено 16 видов дрожжевых грибов, в песке удалось обнаружить только два вида дрожжей. Единственный вид дрожжей, который не был выделен нами из пахотного горизонта и встречен только в торфе – Nadsonia starkeyi-henricii (Cif.) Kurtzman & Robnett, это типичный, но немногочисленный обитатель торфа и влажных заболоченных почв (Kurtzman et al., 2011).
В целом, выделенный из компонентов почвенных конструкций комплекс дрожжевых грибов был представлен типичными педобионтными видами дрожжей (Apiotrichum dulcitum, A. laibachii, A. porosum, Barnettozyma californica, Goffeauzyma gastrica, Saitozyma podzolica, Solicoccozyma terrea, Solicoccozyma terricola) – 44.8%; эпифитами (Hanseniaspora uvarum, Filobasidium magnum, F. wieringae, Metschnikowia pulcherrima, Papiliotrema flavescens, Rhodosporidiobolus colostri) – 34.5%; и эврибионтными и оппортунистическими видами дрожжевых грибов (Candida parapsilosis, Debaryomyces hansenii, Diutina catenulata, Rhodotorula mucilaginosa) – 20.7%.
Относительное обилие некоторых видов дрожжевых грибов, выделенных из компонентов почвенных конструкций, зависело от температуры в циклах замораживания−оттаивания. Так, доля дрожжей Cystofilobasidium infirmominiatum возрастала в Апах при нулевой температуре до 6.8 и 9.1% в первом и втором циклах соответственно и при –5°С до 7.5% во втором цикле, а также в торфе при 0°C до 41.12 и 42.14% в первом и втором циклах соответственно. Этот вид дрожжей широко распространен на самых различных субстратах, но чаще встречается на листьях растений, в умеренной зоне именно в осенний период. Доля вида Rhodo-torula mucilaginosa увеличивалась в Апах до 18% и до 95% в торфе при 10°С. Rh. mucilaginosa является эврибионтным видом, это один из самых широко распространенных видов дрожжей, но чаще всего выделяется как эпифит травянистых и древесных растений, где его относительное обилие может в отдельных образцах достигать 100%. Относительное обилие дрожжей Rhodotorula glutinis возрастало при отрицательной температуре в Апах (до 12.3 и 17.8% в первом и втором циклах соответственно и в торфе (до 8.6 и 17.0% в первом и втором циклах соответственно). Этот вид дрожжевых грибов наиболее типичен для филлосферы, однако часто выделяется и из почвы, в умеренном поясе особенно обилен в осенне-зимний период. Также при –5°С активизировался и рост аскомицетовых дрожжей Candida sake, доля которых выросла до 6% в Апах и до 66.5% в торфе в обоих циклах. В Московском регионе C. sake преимущественно почвенный вид, но также он регулярно встречается на болотных растениях (Чернов и соавт., 2013). Относительное обилие большинства выделенных нами педобионтных дрожжей было очень низким при отрицательных температурах в циклах замораживания–оттаивания. Исключение составили дрожжи Solicoccozyma terricola, относительное обилие которых при отрицательных температурах было 16.7 и 10.2% соответственно, в первом и втором циклах замораживания–оттаивания (типичный обитатель почв умеренной и северной зон).
Комплекс физиологических механизмов позволяет некоторым дрожжевым грибам адаптироваться к низким температурам. Он может включать увеличение в клетках дрожжей концентрации внутриклеточного дисахарида трегалозы и многоатомных спиртов полиолов, нерастворимые мембранные липиды, а также антифризные белки и активные при низких температурах ферменты. В комбинации эти механизмы необходимы для выполнения психротрофной и психрофильной функций (Ткаченко, 2017).
Неоднократно было показано на почвенных и пресноводных бактериях, что краткосрочное замораживание (1–3 сут) замедляет рост и активность микробных сообществ, а рост численности микроорганизмов повышается после 7 и 15-суточного замораживания. Установлено, что чем длительнее замораживание, тем больше времени требуется микроорганизмам после размораживания для адаптации к новым условиям (Upton, 1990; Черобаева и соавт., 2011). В нашей работе была выявлена устойчивая динамика снижения численности (на полтора–два порядка) культивируемых бактерий сапротрофного комплекса от положительных температур вплоть до максимальной отрицательной в эксперименте температуры –5°С. При отрицательной температуре субстратов Апах и торф из них высевались только устойчивые к низким температурам бациллы и психрофильные бактерии Flavobacterium рsychrophilum. В то же время для дрожжевых грибов впервые была показана противоположная закономерность, которая характеризовалась устойчивым ростом численности дрожжевого населения в градиенте от положительных до отрицательной температуры инкубирования субстратов Апах и торф. Показанное явление определенно нуждается в дальнейшем изучении.
Среди выделенных нами из Апах видов дрожжевых грибов и сапротрофных бактерий для более чем 55% известна способность к синтезу одного или более фитогормонов (ИУК, зеатин, ГК3), стимулирующих рост и развитие растений. Среди встреченных нами, к ним относятся бактерии из родов Azotobacter, Pseudomonas, Bacillus, Micrococcus, Streptomyces; виды дрожжей Rhodotorula mucilaginosa, Candida sake, Cystofilobasidium capitatum, Cys. infirmominiatum, Metschnikowia pulcherrima, Solicoccozyma terricola и другие (Shokri, Emtiazi, 2010; Стрелецкий, 2017; Streletskii et al., 2019). Фитогормональная активность микроорганизмов, кроме таксономической приуроченности, во многом имеет и штаммовую зависимость.
Исследованная при процессах замораживания–оттаивания микробиота компонентов специализированных почвенных конструкций отличается высокой численностью и эколого-функциональным разнообразием. Среди выделенных грамотрицательных и грамположительных бактерий и дрожжевых грибов были обнаружены представители разных эколого-трофических групп: гидролитики, копиотрофы, копиотрофы-олиготрофы. Оценка в модельном эксперименте влияния краткосрочных перепадов температуры на динамику численности и разнообразия сообществ одноклеточных микроорганизмов в исследованных компонентах почвенных конструкций показала, что они, вероятно, обладают хорошим адаптивным ферментативным аппаратом, который позволяет им “переносить” стрессовые перепады температуры, характерные для весенне-осеннего периода (Männistö et al., 2009). Это также говорит в пользу способности специализированных почвенных конструкций саморазвиваться в процессе функционирования, что пролонгирует промежуток их активного функционирования в урбоэкосистеме без дополнительного вмешательства и затрат (Просянников, Рыженков, 2009; Смагин, 2012). Среди выделенных нами из исследованных компонентов почвенных конструкций микроорганизмов присутствуют виды, для которых известна способность к стимуляции роста и развития растений за счет продуцирования фитогормонов, прежде всего, ИУК. Для оценки фитогормональной активности выделенных нами штаммов бактерий и дрожжей на всех этапах в циклах замораживания–оттаивания в настоящее время проводятся биохимические исследования.
Список литературы
Андрюков Б.Г., Сомова Л.М., Тимченко Н.Ф. Жирные кислоты как объект исследования температурных адаптационных стратегий микроорганизмов-психрофилов // Здоровье. Медицинская экология. Наука. 2015. № 3(61). С. 43–49.
Вайгель А.Э. Агрофизические свойства почвенных конструкций разного строения и их трансформация в первые годы функционирования в условиях города Москвы. Автореферат дис. … канд. биол. наук. М.: МГУ, 2017. 25 с.
Воробьева Л.И. Стрессоры, стрессы и выживаемость бактерий (обзор) // Прикл. биохимия и микробиология. 2004. Т. 40. С. 261–269.
Vorob’eva L.I. Stressors, stress reactions, and survival of bacteria: a review // Appl. Biochem. Microbiol. 2004. V. 40. P. 217–224.
Глушакова А.М., Желтикова И.Ю., Чернов И.Ю. Группировки дрожжей в домашней пыли и источники ее формирования //Микробиология. 2004. Т. 73. С. 111–117.
Glushakova A.M., Zheltikova T.M., Chernov I.Y. Groups and sources of yeasts in house dust // Microbiology (Moscow). 2004. V. 73. P. 94–98.
Глушакова А.М., Качалкин А.В., Желтикова Т.М., Чернов И.Ю. Устойчивость дрожжей разных экологических групп к длительному сохранению в высушенном состоянии // Микробиология. 2015. Т. 84. С. 379–387.
Glushakova A.M., Kachalkin A.V., Zheltikova T.M., Chernov I.Y. Resistance of various yeast ecological groups to prolonged storage in dry state // Microbiology (Moscow). 2015. V. 84. P. 442–448.
Головченко А.В., Семенова Т.А., Добровольская Т.Г., Богданова О.Ю., Кухаренко О.С. Влияние температуры на структуру микробных сообществ верхового торфяника (модельные опыты) // Вестник Томского гос. пед. ун‑та. 2010. Т. 3. № 93. С. 92–99.
Гулёв С.К., Катцов В.М., Соломина О.Н. Глобальное потепление климата продолжается // Вестник PAH. 2008. Т. 78. С. 20–27.
Gulev S.K., Kattsov V.M., Solomina O.N. Global warming continues // Herald of the Russian Academy of Sciences. 2008. V. 78. P. 44–50.
Добровольская Т.Г. Структура бактериальных сообществ почв. М.: ИКЦ “Академкнига”, 2002. 282 с.
Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. Т. 48. № 9. С. 1087–1096.
Dobrovol’skaya T.G., Zvyagintsev D.G., Chernov I.Y., Golovchenko A.V., Zenova G.M., Lysak L.V., Manucharova N.A., Marfenina O.E., Polyanskaya L.M., Stepanov A.L., Umarov M.M. The role of microorganisms in the ecological functions of soils // Euras. Soil Sci. 2015. V. 48. P. 959–967.
Звягинцев Д.Г. Методы почвенной микробиологии и биохимии. M.: МГУ, 1991. 304 с.
Звягинцев Д.Г., Бабьева И.П., Зенова Г.М. Биология почв. М.: МГУ, 2005. 445 с.
Курбатова А.С. Ландшафтно-экологические основы формирования градостроительных структур. М.: Маджента, 2004. 400 с.
Курганова И.Н., Лопес де Гереню В.О. Вклад абиотических факторов в усиление эмиссии СО2 из почв при процессах замораживания–оттаивания // Почвоведение. 2015. Т. 48. № 9. С. 1145-1152.
Kurganova I.N., Lopes de Gerenyu V.O. Contribution of abiotic factors to CO2 emission from soils in the freeze–thaw cycles // Euras. Soil Sci. 2015. V. 48. P. 1009–1015.
Лысак Л.В., Добровольская Т.Г., Скворцова И.Н. Методы оценки бактериального разнообразия почв и идентификация почвенных бактерий. М.: МаксПресс, 2003. 120 с.
Лысак Л.В. Бактериальные сообщества городских почв. Автореферат дис. … докт. биол. наук. М.: МГУ, 2010. 46 с.
Морина О.М., Холоден Е.Э., Лобанов С.А., Дербенцева А.М. Динамика температур почв при антропогенных нагрузках: учеб. пособие. Владивосток: Изд-во Дальневост. ун-та, 2008. 115 с.
Намсараев Б.Б., Абидуева Е.Ю., Лаврентьева Е.В., Банзаракцаева Т.Г., Бархутова Д.Д., Буянтуева Л.Б. Экология микроорганизмов экстремальных водных сис-тем: учеб. пособие. Улан-Удэ: Изд-во Бурятского гос-университета, 2008. 94 с.
Определитель бактерий Берджи. М.: Мир, 1997. Т. 1, 2. 800 с.
Оценочный доклад об изменениях климата и их последствиях на территории Российской Федерации (техническое резюме). М.: Росгидромет, 2008. 89 с.
Просянников Е.В., Рыженков Д.Д. Почвенные конструкции с заданными свойствами // Агрохимический вестник. 2009. № 3. С. 13–14.
Смагин А.В. Теория и практика конструирования почв. М.: Изд-во Московского университета, 2012. 542 с.
Смагин А.В. Садовникова Н.Б. Создание почвоподобных конструкций // Почвоведение. 2015. Т. 48. С. 1112–1123.
Smagin A.V., Sadovnikova N.B. Creation of soil-like constructions // Eurasian Soil Science. 2015. V. 48. P. 981–990.
Смагин А.В., Азовцева Н.А., Смагина М.В., Степанов А.Л., Мягкова А.Д. Некоторые критерии и методы оценки экологического состояния почв в связи с озеленением городских территорий // Почвоведение. 2006. Т. 39. С. 603–615.
Smagin A.V., Azovtseva N.A., Smagina M.V., Stepanov A.L. Criteria and methods to assess the ecological status of soils in relation to the landscaping of urban territories // Euras. Soil Sci. 2006. V. 39. P. 539–551.
Степанов А.Л., Судницын И.И., Умаров М.М., Галиманге Б. Влияние плотности почв и давления почвенной влаги на эмиссию закиси азота и диоксида углерода // Почвоведение. 1996. Т. 29. С. 1337–1340.
Stepanov A.L., Sudnitsyn I.I., Umarov M.M., Galimange B. The effect of soil bulk density and moisture tension on nitrous oxide and carbon oxide emission // Euras. Soil Sci. 1996. V. 29. P. 1247–1250.
Стрелецкий Р.А. Эколого-таксономические аспекты распространения фитогормональной активности среди дрожжей. Автореферат дис. … канд. биол. наук. М.: МГУ, 2017. 26 с.
Строганова М.Н. Городские почвы: генезис, систематика и экологическое значение (на примере г. Москвы). Докт. дис. в форме науч. докл., 1998. 74 с.
Сусленкова М.М., Умарова А.Б., Бутылкина М.А. Микроструктура почв разного генезиса и ее трансформация в составе конструктоземов в условиях г. Москвы // Почвоведение. 2018. Т. 51. С. 1265–1273.
Suslenkova M.M., Umarova A.B., Butylkina M.A. Microstructure of soils of different geneses and its transformation in constructozems of Moscow // Euras. Soil Sci. 2018. V. 51. P. 1220–1228.
Ткаченко О.Б. Криофильные грибы: способы адаптации к пониженным температурам // Микология и фитопатология. 2017. Т. 51. С. 15–18.
Умарова А.Б., Сусленкова М.М., Бутылкина М.А., Салимгареева О.А., Кокорева А.А., Ежелев З.С., Гасина А.И. Гидросорбционные и микроструктурные характеристики почвенных субстратов разного генезиса и их изменение в составе конструктоземов // Почвоведение. 2019. Т. 52. С. 1346–1355.
Umarova A.B., Suslenkova M.M., Butylkina M.A., Salimgareeva O.A., Kokoreva A.A., Ezhelev Z.S., Gasina A.I. Hydrosorption and microstructural characteristics of soil horizons of different geneses and their change in constructozems // Euras. Soil Sci. 2019. V. 52. P. 1369–1377.
Феофилова Е.П. Торможение жизненной активности как универсальный биохимический механизм адаптации микроорганизмов к стрессовым воздействиям // Прикл. биохимия и микробиология. 2003. Т. 39. С. 5–24.
Чернов И.Ю. Дрожжи в природе. М.: Товарищество научных изданий КМК, 2013. 336 с.
Чернов И.Ю., Глушакова А.М., Качалкин А.В. Аннотированный список видов дрожжей Московского региона // Микология и фитопатология. 2013. Т. 47. С. 103–115.
Черобаева А.С., Степанов А.Л., Кравченко И.К. Отклик аммонийокисляющих бактерий и архей на резкие изменения температуры в почвах разных климатических зон // Проблемы агрохимии и экологии. 2011. № 3. С. 17–24.
Fell J., Blatt G. Separation of strains of the yeasts Xanthophyllomyces dendrorhous and Phaffia rhodozyma based on rDNA IGS and ITS sequence analysis // J. Ind. Microbiol. Biotech. 1999. V. 23. P. 677–681.
Feng X., Nielsen L.L., Simpson M. Responses of soil organic matter and microorganisms to freeze–thaw cycles // Soil Biol. & Biochem. 2007. V. 39. P. 2027–2037.
Kim D.-G., Vargas R., Bond-Lamberty B., Turetsky M.R. Effects of soil rewetting and thawing on soil gas fluxes: a review of current literature and suggestions for future research // Biogeosciences. 2012. V. 9. P. 2459–2483.
Koponen H.T., Jaakkola T., Keinanen-Toivola M.M., Kaipainen S., Tuomainen J., Servomaa K., Martikainen P.J. Microbial communities, biomass, and activities in soils as affected by freeze thaw cycles // Soil Biol. Biochem. 2006. V. 38. P. 1861–1871.
Kuhry P. Turunen J. The postglacial development of boreal and subarctic peatlands // Boreal Peatland Ecosystems / Eds. Wieder R.K., Vitt D.H. N.Y.: Springer, 2006. P. 25–46.
Kurganova I., Teepe R., Loftfield N. Influence of freeze-thaw events on carbon dioxide emission from soil at different moisture and land use // Carbon Balance and Management. 2007. V. 2. P. 1–9.
Kurganova I., Teepe R., Lopes de Gerenyu V., Loftfield N., Flessa H. Effect of contrasting changes in hydrothermic conditions on the N2O emission from forest and tundra soils // Euras. Soil Sci. 2004. V. 40. P. 795–799.
Kurtzman C.P., Fell J.W., Boekhout T., Roberts V. Methods for isolation, phenotypic characterization and maintenance of yeasts // The Yeasts: A Taxonomic Study / Eds. Kurtzman C.P., Fell J.W., Boekout T. Amsterdam: Elsevier Science, 2011. P. 87–110.
Kværnø S., Øygarden L. The influence of freeze–thaw cycles and soil moisture on aggregate stability of three soils in Norway // Catena. 2006. V. 67. P. 175–182.
Larsen K.S., Jonasson S., Michelsen A. Repeated freeze-thaw cycles and their effect on biological processes in two arctic ecosystem types // Appl. Soil Ecol. 2002. V. 21. P. 187–195.
Lopes de Gerenyu V.O., Kurganova I.N., Rozanova L.N., Kudeyarov V.N. Annual emission of carbon dioxide from soils of the Southern Taiga soils of Russia // Euras. Soil Sci. 2001. V. 34. P. 931–944.
Manucharova N.A., Vlasenko A.N., Tourova T.P., Panteleeva A.N., Stepanov A.L., Zenova G.M. Thermophilic chitinolytic microorganisms of brown semidesert soil // Microbiology (Moscow). 2008. V. 77. P. 610–615.
Matzner E., Borken W. Do freezethaw events enhance C and N losses from soils of different ecosystems? A review // Eur. J. Soil Sci. 2008. V. 59. P. 274–284.
Männistö M.K., Tiirola M., Häggblom M.M. Effect of freeze-thaw cycles on bacterial communities of arctic tundra soil // Microb. Ecol. 2009. V. 58. P. 621–631.
Misaka N., Nishizawa T., Yoshimizu M. Quantitative detection of viable Flavobacterium psychrophilum in Chum Salmon Oncorhynchus keta by colony blotting and immunostaining // Fish Pathology. 2008. V. 43. P. 117–123.
Panikov N.S., Dedysh S.N. Cold season CH4 and CO2 emission from boreal peat bogs (West Siberia): Winter fluxes and thaw activation dynamics // Global Biogeochem. Cycles. 2000. V. 14. P. 1071–1080.
Schuur E.A., Abbott B. Climate change: high risk of permafrost thaw // Nature. 2011. V. 480(7375). P. 32–33.
Stirk W. A., Ördög V., Novák O., Rolčík J., Strnad M., Bálint P., van Staden J. Auxin and cytokinin relationships in 24 microalgal strains // J. Phycol. 2013. V. 49. P. 459–467.
Streletskii R.A., Kachalkin A.V., Glushakova A.M., Yurkov A.M., Demin V.V. Yeasts producing zeatin // Peer J. 2019. V. 7. e6474.
Sulkava P., Huhta V. Effects of hard frost and freeze-thaw cycles on decomposer communities and N mineralisation in boreal forest soil // Appl. Soil Ecol. 2003. V. 22. P. 225–239.
Teepe R., Brumme R., Beese F. Nitrous oxide emission from soil during freezing and thawing periods // Soil Biol. Biochem. 2001. V. 33. P. 1269–1275.
Teepe R., Ludwig B. Variability of CO2 and N2O emissions during freeze-thaw cycles: results of model experiments on undisturbed forest soil cores // J. Plant Nutrit. Soil Sci. 2004. V. 167. P. 153–159.
Upton A.C., Nedwell D.B., Wyrr-William D.D. The selection of microbial communities by constant of fluctuating, temperatures // FEMS Microbiol. Ecol. 1990. V. 74. P. 243–252.
Venäläinen A., Tuomenvirta H., Heikinheimo M., Kellomaki S., Peltola H., Strandman H., Vaisanen H. Impact of climate change on soil frost under snow cover in a forested landscape // Climate Research. 2001. V. 17. P. 63–72.
Vital M., Abranches J., Hagler A., Mendonça-Hagler L. Mycocinogenic yeasts isolated from Amazon soils of the Maracá ecological station, Roraima-Brazil // Braz. J. Microbiol. 2002. V. 33. P. 230–235.
Weisburg W.G., Barns S.M., Pelletier D.A., Lane D.J. 16S ribosomal DNA amplification for phylogenetic study // J. Bacteriol. 1991. V. 173. P. 697–703.
Yergeau E., Kowalchuk G.A. Responses of Antarctic soil microbial communities and associated functions to temperature and freeze–thaw cycle frequence // Appl. Environ. Microbiol. 2008. V. 10. P. 2223–2235.
Дополнительные материалы отсутствуют.


