Микробиология, 2021, T. 90, № 2, стр. 243-246
Desulfovibrio из микробиоты детей с расстройством аутистического спектра связывают железо в малорастворимые кристаллические сульфиды
О. П. Иккерт a, М. В. Иванов a, А. Ухова a, В. С. Зюсман a, Л. Б. Глухова a, М. Р. Авакян a, О. В. Карначук a, *
a Кафедра физиологии растений, биотехнологии и биоинформатики,
Томский государственный университет
634050 Томск, Россия
* E-mail: olga.karnachuk@green.tsu.ru
Поступила в редакцию 16.11.2020
После доработки 21.11.2020
Принята к публикации 30.11.2020
Аннотация
Одной из групп бактерий, присутствующих в кишечнике детей с расстройством аутистического спектра (РАС) в повышенном количестве, являются сульфатредуцирующие бактерии (СРБ) рода Desulfovibrio. До настоящего времени, высокая концентрация Desulfovibrio у индивидуумов с РАС была показана только молекулярными методами. Культивируемые формы, выделенные из желудочно-кишечного тракта (ЖКТ) аутистов, до сих пор отсутствовали. Возможным механизмом влияния СРБ является переведение железа в бионедоступные формы сульфидов, вызывая его дефицит в организме. В этом исследовании мы выделили две чистые культуры Desulfovibrio из фекалий детей с диагностированным РАС. В экспериментах Desulfovibrio desulfuricans AY5 образовывал кристаллические сульфиды железа – грейгит и пирит, содержащие железо в бионедоступной форме.
Исследования последних лет свидетельствуют о существовании оси кишечник–мозг и вовлеченности микробиоты желудочно-кишечного тракта (ЖКТ) в этиологию расстройств аутистического спектра (РАС) у детей (обзор см. Bezawada et al., 2020). Последние исследования показали эффективность трансплантации фекальной микробиоты в терапии РАС (Kang et al., 2020). Одной из групп бактерий, повышенную численность которых обнаруживают у детей с РАС, являются сульфатредуцирующие бактерии (СРБ) рода Desulfovibrio (Finegold, 2011; Finegold et al., 2012; De Angelis et al., 2013; Weston et al., 2015; Liu et al., 2019). Более того, была отмечена корреляция между численностью Desulfovibrio и интенсивностью проявлений РАС (Tomova et al., 2015). Современные биоинформатические исследования показали связь численности Desulfovibrio в кишечнике с биополярными нарушениями у детей (Cheng et al., 2020). Однако возможные механизмы, связывающие численность этой группы с патофизиологией, остаются неясными. В качестве гипотез рассматривают токсичное действие образуемого бактериями сероводорода, образование липополисахаридов и возможное участие в воспалительных процессах (Weston et al., 2015). Мы предполагаем, что одним из возможных механизмов влияния СРБ может быть иммобилизация железа в бионедоступные формы. Недостаток железа является одной из известных характеристик пациентов с РАС. Повышенное содержание СРБ, включая Desulfovibrio, может приводить к биоминерализации железа в форме сульфидов в ЖКТ.
Эксперименты, направленные на прояснение возможной связи СРБ с патофизиологией РАС, затруднены отсутствием чистых культур. Нам не известны сообщения о культивируемых формах СРБ, выделенных из фекалий пациентов с РАС. В этом исследовании мы впервые выделили чистые культуры Desulfovibrio из микробиоты кишечника детей с РАС и оценили их способность выводить железо из раствора путем осаждения в малорастворимые сульфиды.
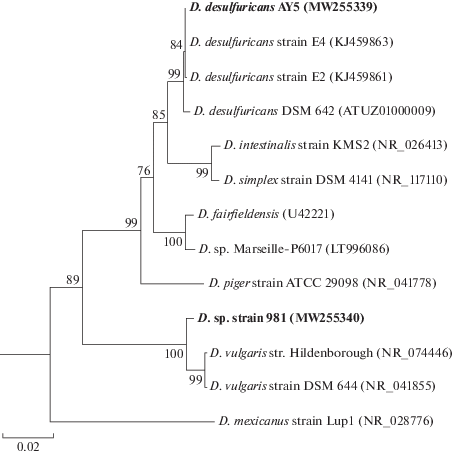
Для получения накопительных культур сульфидогенов были использованы фекалии детей возрастной группы от 7 до 13 лет с диагностированным РАС. При получении накопительных культур сульфидогенов использовали среду Видделя–Бака (WB) с лактатом в качестве донора электронов и добавлением растворов микроэлементов, витаминов, селената-вольфрамата, сульфида натрия в качестве восстановителя (Widdel, Bak, 1992) и модифицированную добавлением элементного железа (Карначук и соавт., 2006; Karnachuk et al., 2019). Инкубацию проводили в анаэробных условиях при температуре 37°С. Накопительные культуры, активно восстанавливающие сульфат, отбирали для получения колоний на агаризованной (1.5%) среде. После выделения колоний окончательную очистку культур проводили методом десятикратных разведений. В результате были выделены два морфологически однородных изолята, обозначенные штамм AY5 и штамм 981. Для определения филогенетического положения изолятов амплифицировали ген 16S рРНК с праймерами 27F-1492R. Выделение ДНК и условия амплификации аналогичны описанным ранее (Frank et al., 2016). Филогенетический анализ последовательности гена 16S рРНК показал, что оба штамма относятся к роду Desulfovibrio (рис. 1). Ближайшим валидно описанным родственником штамма AY5 является типовой штамм Desulfovibrio desulfuricans DSM 642, сходство последовательностей гена 16S рРНК с которым составляло 99.72%. Штамм 981 был близок к другому модельному сульфатредуктору, Desulfovibrio vulgaris, со сходством последовательностей 99.02%.
Рис. 1.
Дерево, показывающее филогенетическое положение штаммов AY5 и 981 на основе анализа последовательностей гена 16S рРНК, определенное методом Neighbor-Joining. Бутстрепы рассчитаны из 1000 итераций. Дерево построено с использованием MEGA X.
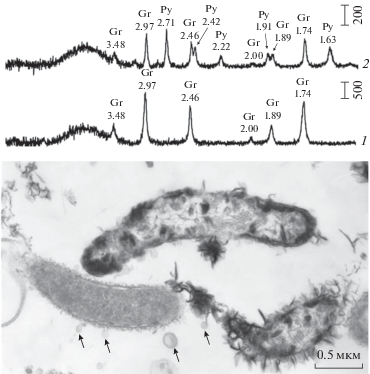
Эксперименты по изучению иммобилизации железа D. desulfiricans AY5 были проведены в периодической культуре в сывороточных бутылях объемом 250 мл с использованием той же среды, что и для выделения чистых культур, и дополнительным внесением двухвалентного железа в концентрации 100 мг/л. Инкубировали пробы в течение 8, 24 и 32 сут при оптимальной температуре роста 37°С, после чего образованный осадок осаждали центрифугированием и проводили дифракционный анализ как описано ранее (Ikkert et al., 2103). В осадке, образованном штаммом AY5, обнаружили кристаллические сульфиды железа, грейгит (Fe3S4) и пирит (FeS2) (рис. 2). Грейгит образовывался уже на 8-е сут, в то время как пирит обнаруживали только после 32 сут культивирования. Обе кристаллические фазы иммобилизуют железо из раствора и с трудом подвержены ре-окислению. Исследование штамма AY5 показало присутствие микровезикул на клеточной стенке, которые могут выполнять роль дополнительных сайтов нуклеации микрокристаллов сульфидов (рис. 2). Дефицит железа является известной характеристикой аутистов (Yanagimoto et al., 2020). Выведение железа из раствора за счет связывания в трудно окисляемые кристаллические формы, хорошо известно для природных экосистем, например, осадков морей. Реакции образования кристаллических сульфидов железа могут происходить и в ЖКТ индивидуумов с РАС, аналогично тому, как это происходит в природе. Кроме того, микрокристаллы грейгита обладают магнитными свойствами и могут влиять на биологические структуры через образование магнитных полей. По последним данным магнитные поля ферромагнитных минералов оказывают влияние на ионные каналы в мембране и вызывают изменение структуры, функций и морфологии клеток (обзор см. Svobodova et al., 2019).
Рис. 2.
Вверху: дифрактограммы осадка из эксперимента по биоминерализации железа штаммом D. desulfuricans AY5. Обозначения: 1 – инкубация в течение 24 сут; 2 – инкубация в течение 32 сут; Gr – грейгит, Fe3S4; Py – пирит, FeS2. Внизу: трансмиссионная электронная микрофотография ультратонких срезов клеток штамма AY5 с электронно-плотными кристаллами (предположительно, сульфида железа) на клеточной стенке и везикулами (показаны стрелками).
Список литературы
Карначук О.В., Пименов Н.В., Юсупов С.К., Франк Ю.А., Пухакка Я.А., Иванов М.В. Распределение, разнообразие и активность сульфатредуцирующих бактерий в водной толще озера Гёк-гёль, Азербайджан // Микробиология. 2006. Т. 75. С. 101–109.
Karnachuk O.V., Pimenov N.V., Yusupov S.K., Frank Y.A., Puhakka J.A., Ivanov M.V. Distribution, diversity, and activity of sulfate-reducing bacteria in the water column in Gek-Gel Lake, Azerbaijan // Microbiology (Moscow). 2006. V. 75. P. 82–89.
Bezawada N., Phang T.H., Hold G.L., Hansen R. Autism spectrum disorder and the gut microbiota in children: a systematic review // Ann. Nutr. Metab. 2020. V. 76. P. 16–29.
Cheng S., Han B., Ding M., Wen Y., Ma M., Zhang L., Qi X., Cheng B., Li P., Kafle O.P., Liang X., Liu L., Du Y., Zhao Y., Zhang F. Identifying psychiatric disorder-associated gut microbiota using microbiota-related gene set enrichment analysis // Brief. Bioinform. 2020. V. 21. P. 1016–1022.
De Angelis M., Piccolo M., Vannini L., Siragusa S., De Giacomo A., Serrazzanetti D.I., Cristofori F., Guerzoni M.E., Gobbetti M., Francavilla R. Fecal microbiota and metabolome of children with autism and pervasive developmental disorder not otherwise specified // PLoS One. 2013. V. 8. e76993.
Finegold S.M. Desulfovibrio species are potentially important in regressive autism // Med. Hypotheses. 2011. V. 77. P. 270–274.
Finegold S.M., Downes J., Summanen P.H. Microbiology of regressive autism // Anaerobe. 2012. V. 18. P. 260–262.
Frank Y., Banks D., Avakian M., Antsiferov D., Kadychagov P., Karnachuk O. Firmicutes is an important component of microbial communities in water-injected and pristine oil reservoirs, Western Siberia, Russia // Geomicrobiol. J. 2016. V. 33. P. 387–400.
Ikkert O.P., Gerasimchuk A.L., Bukhtiyarova P.A., Tuovinen O.H., Karnachuk O.V. Characterization of precipitates formed by H2S-producing, Cu-resistant Firmicute isolates of Tissierella from human gut and Desulfosporosinus from mine waste // Antonie van Leeuwenhoek. 2013. V. 103. P. 1221–1234.
Kang D.-W., Adams J.B., Vargason T., Santiago M., Hahn J., Krajmalnik-Brown R. Distinct fecal and plasma metabolites in children with autism spectrum disorders and their modulation after microbiota transfer therapy // mSphere. 2020. V. 5. e00314-20.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated Candidatus Desulforudis audaxviator from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. V. 13. P. 1947–1959.
Liu F., Li J., Wu F., Zheng H., Peng Q., Zhou H. Altered composition and function of intestinal microbiota in autism spectrum disorders: a systematic review // Transl. Psychiatry. 2019. V. 9. P. 1–43.
Svobodova H., Kosnáč D., Tanila H., Wagner A., Trnka M., Vitovič P., Hlinkova J., Vavrinsky E., Ehrlich H., Polák Š., Kopani M. Iron-oxide minerals in the human tissues // Biometals. 2020. V. 33. P. 1–13.
Tomova A., Husarova V., Lakatosova S., Bakos J., Vlkova B., Babinska K., Ostatnikova D. Gastrointestinal microbiota in children with autism in Slovakia // Physiol. Behav. 2015. V. 138. P. 179–187.
Weston B., Fogal B., Cook D., Dhurjati P. An agent-based modeling framework for evaluating hypotheses on risks for developing autism: Effects of the gut microbial environment // Med. Hypotheses. 2015. V. 84. P. 395–401.
Widdel F.F., Bak R. Gram negative mesophilic sulfate reducing bacteria // The Prokaryotes: A Handbook on the Biology of Bacteria: Ecophysiology, Isolation, Identification, Applications / Eds. Balows A. et al. Berlin: Springer, 1992. P. 3352–3378.
Yanagimoto Y., Ishizaki Y., Kaneko K. Iron deficiency anemia, stunted growth, and developmental delay due to avoidant/restrictive food intake disorder by restricted eating in autism spectrum disorder // Biopsychosoc. Med. 2020. V. 14. P. 1–8. https://doi.org/10.1186/s13030-020-00182-y
Дополнительные материалы отсутствуют.


