Микробиология, 2021, T. 90, № 2, стр. 131-144
О возможности аэробной продукции метана пелагическими микробными сообществами моря Лаптевых
О. С. Самылина a, *, И. И. Русанов a, И. Ю. Тарновецкий a, Е. В. Якушев b, c, А. А. Гринько d, Е. Е. Захарова a, А. Ю. Меркель a, Т. А. Канапацкий a, И. П. Семилетов e, f, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
117312 Москва, Россия
b Институт океанологии им. П.П. Ширшова РАН
117997 Москва, Россия
c Norwegian Institute for Water Research (NIVA)
0349 Осло, Норвегия
d Национальный исследовательский Томский политехнический университет
634050 Томск, Россия
e Тихоокеанский океанологический институт им. В.И. Ильичева
Дальневосточного отделения РАН
690041 Владивосток, Россия
f Высшая школа экономики
111033 Москва, Россия
* E-mail: olga.samylina@gmail.com
Поступила в редакцию 21.10.2020
После доработки 17.11.2020
Принята к публикации 18.11.2020
Аннотация
Проведены исследования таксономического разнообразия и метаболической активности микробных сообществ водной толщи моря Лаптевых над полем метановых газовыделений и вне зоны разгрузки метановых сипов. Содержание растворенного метана в водной толще на обеих станциях имело сопоставимые значения вплоть до глубины расположения пикноклина (25 м). На этой глубине были зафиксированы локальные максимумы содержания метана с наибольшим значением (116 нМ CH4) на станции, удаленной от метанового сипа. Данные секвенирования гена 16S рРНК и измерения активности гидрогенотрофного метаногенеза свидетельствуют об отсутствии в зоне пикноклина и в других исследованных горизонтах водной толщи метаногенеза, обусловленного метаногенными археями. Филогенетическое разнообразие микроорганизмов, выявленное на основании секвенирования гена 16S рРНК, а также радиоизотопное измерение первичной продукции (ПП), активности темновой ассимиляции углекислоты (ТАУ) и скорости окисления метана (МО) указывают на функционирование в пелагиали моря Лаптевых микробного сообщества, способного в олиготрофных условиях арктического бассейна трансформировать широкий спектр органических соединений. Обсуждаются гидрохимические предпосылки и возможные микробные агенты аэробной продукции метана через деметилирование метилфосфоната и разложение диметилсульфониопропионата при использовании растворенного органического вещества, синтезируемого в ходе процессов ПП, ТАУ и МО.
Важной составляющей биогеохимического круговорота углерода в океане является цикл метана. В морские водоемы метан может поступать как из глубоководных гидротермальных источников, грязевых вулканов и холодных метановых сипов, так и синтезироваться in situ в осадках и водной толще.
Хорошо известны и детально исследованы метаногенные археи, которые считаются основными продуцентами метана на нашей планете. Они являются строгими анаэробами и образуют метан, используя в качестве субстрата в основном низкомолекулярные соединения: углекислоту, ацетат, метанол и метиламины. Недавно также была показана возможность образования метана из метокси-групп циклических органических соединений (см. обзор Kurth et al., 2020 и ссылки в нем). Развитие метаногенных архей в морях приурочено главным образом к анаэробным осадкам, а в водной толще – к анаэробным микронишам, образующимся в крупных частицах органической взвеси, кишечном тракте и пеллетах зоопланктона (Bianchi et al., 1992; Ditchfield et al., 2012). Вместе с тем поверхностные кислородсодержащие воды различных регионов Мирового океана часто бывают пересыщены метаном по отношению к атмосфере – явление, которое принято называть “морским метановым парадоксом” (Karl et al., 2008; Bižic et al., 2020). Долгое время объяснение этого феномена сводилось к выявлению в водной толще анаэробных микрониш с развитием метаногенных архей. Однако в настоящее время “метановый парадокс” объясняют метаболической активностью аэробных пелагических микроорганизмов, и чаще всего – разрушением метилфосфоната (MPn) гетеротрофными бактериями в условиях фосфатного голодания (Karl et al., 2008; Sosa et al., 2019), при котором параллельно с высвобождением фосфата происходит восстановление метильной группы до метана. Помимо этого, в последние годы накапливаются данные и о других механизмах аэробной продукции метана, специфика и распространение которых в водах Мирового океана остаются практически неизученными. Так, при доступности фосфора, но в условиях лимитирования по азоту выделение метана может быть связано с аэробным разложением диметилсульфониопропионата (ДМСП) до диметилсульфида (ДМС) или метилмеркаптана (метантиол, MeSH) (Damm et al., 2010) и последующим анаэробным разложением этих продуктов метилотрофными метаногенами (Kurth et al., 2020). Более того, согласно последним исследованиям продуцентами метана в аэробных условиях могут быть разнообразные представители фитопланктона: цианобактерии, кокколитофориды и другие гаптофиты, диатомовые водоросли (см. обзор Bižić et al., 2020 и ссылки в нем). Причем речь в данном случае идет не об изученных ранее метаболических путях (деметилирование MPn или выделение нитрогеназой и гидрогеназами водорода, который служит субстратом для гидрогенотрофного метаногенеза), но о каком-то неизвестном механизме конверсии углекислоты в метан, связанном с основным метаболизмом оксифототрофов.
Шельфовые моря восточной Арктики, в том числе море Лаптевых, известны как мощные источники эмиссии метана в атмосферу (Shakhova et al., 2010; Berchet et al., 2016). В акватории моря Лаптевых было выявлено более 700 районов разгрузки пузырькового метана, интенсивность которой изменяется на 5 порядков (до 176 г CH4/(м2 сут)) и определяется состоянием подводной мерзлоты и стабильностью гидратов (Shakhova et al., 2015). В придонных слоях воды в зонах разгрузки метановых сипов концентрации растворенного метана достигают 300–650 нМ, а в некоторых случаях 5000 нМ (Shakhova et al., 2010; Savvichev et al., 2018). Согласно данным многолетних исследований, транспорт метана из осадков в атмосферу происходит преимущественно посредством пузырькового переноса, в процессе которого происходит частичное растворение и насыщение метаном водной толщи (Shakhova et al., 2010, 2015). Поэтому повышенные концентрации метана в атмосфере и водной толще арктических морей, включая море Лаптевых, обычно связывают с активностью многочисленных метановых сипов. Вместе с тем, филогенетическое разнообразие и метаболический потенциал пелагических микробных сообществ шельфовой зоны моря Лаптевых остаются неизученными.
С целью выявления потенциальных агентов микробной продукции метана в аэробных условиях водной толщи моря Лаптевых в данной работе было проведено сравнительное изучение гидрохимических параметров, а также определение таксономического разнообразия и функциональной активности пелагических микробных сообществ на станциях, расположенных как в поле метановых сипов, так и на удалении от них.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Место исследования и отбор проб воды. Пробы воды и донных осадков были отобраны в ходе 73 рейса НИС “Академик Мстислав Келдыш” в октябре 2018 г. в море Лаптевых. Для исследования были выбраны две сходные по глубине станции: АМК73-6045 (76.7744 N, 125.7620 E), расположенная в зоне разгрузки метанового сипа, и АМК73-6053 (76.7387 N, 128.4512 E), удаленная от зоны пузырьковой разгрузки метана (рис. 1). Отбор проб воды на различных горизонтах осуществляли из 10 л батометров зондирующего комплекса Rosette непосредственно после подъема на палубу. Горизонты для отбора воды определяли на основании данных по температуре и солености. Основные параметры указанных станций приведены в табл. 1.
Рис. 1.
Расположение станций АМК73-6045 (метановый сип) и АМК73-6053 (вне зоны активных газовыделений), исследованных в ходе 73 рейса НИС “Академик Мстислав Келдыш” в октябре 2018 г. в море Лаптевых.
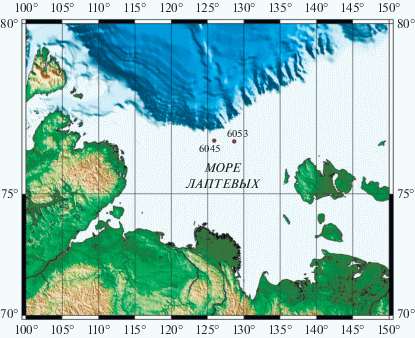
Таблица 1.
Характеристика станций отбора образцов АМК73-6045 и АМК73-6053, исследованных в ходе 73 рейса НИС “Академик Мстислав Келдыш” в октябре 2018 г.
| Глубина, м | Горизонт, м | Т, °С | S, ‰ | O2, мкM | СН4, нM | PO4, мкM | NO3, мкM | NO2, мкM | NH4, мкM | N*, мкM |
|---|---|---|---|---|---|---|---|---|---|---|
| АМК73-6045 (над метановым сипом) | ||||||||||
| 72.7 | 0 | 0.70 | 30.64 | 359.11 | 29.0 | 0.30 | 1.13 | 0.00 | 0.61 | –0.67 |
| 4 | – | – | – | 31.7 | – | – | – | – | – | |
| 10 | 0.71 | 30.61 | 349.81 | 33.0 | 0.69 | 0.47 | 0.04 | 0.31 | –6.67 | |
| 16 | – | – | – | 47.3 | – | – | – | – | – | |
| 25 | 0.66 | 30.65 | 349.26 | 61.6 | 0.41 | 2.18 | 0.09 | 0.32 | –1.29 | |
| 32 | –1.43 | 34.03 | 348.67 | 40.6 | 0.52 | 2.74 | 0.00 | 0.31 | –2.33 | |
| 48 | –1.47 | 34.03 | 346.62 | 40.2 | 0.46 | 0.31 | 0.00 | 0.29 | –3.61 | |
| 65 | –1.48 | 34.03 | 317.81 | 867.9 | 0.74 | 7.70 | 0.04 | 0.27 | –1.08 | |
| 70 | –1.48 | 34.03 | 328.32 | 841.1 | 0.48 | 8.69 | 0.00 | 0.30 | 3.40 | |
| АМК73-6053 (вне зоны активных газовыделений) | ||||||||||
| 67.1 | 0 | 0.42 | 30.05 | 354.00 | 29.9 | 0.33 | 2.03 | 0.04 | 0.06 | –0.30 |
| 8 | 0.69 | 30.40 | 352.01 | 32.1 | 0.33 | 2.70 | 0.09 | 0.09 | 0.28 | |
| 15 | – | – | – | 50.4 | – | – | – | – | – | |
| 20 | 0.25 | 32.46 | 344.95 | 44.6 | 0.41 | 4.16 | 0.09 | 0.04 | 0.44 | |
| 25 | –1.13 | 33.92 | 344.24 | 116.5 | 0.43 | 4.99 | 0.04 | 0.05 | 0.88 | |
| 45 | –1.60 | 34.20 | 308.88 | 25.9 | 0.58 | 8.83 | 0.04 | 0.12 | 2.13 | |
| 65 | –1.60 | 34.20 | 323.33 | 25.9 | 0.59 | 7.14 | 0.09 | 0.07 | 0.52 | |
Определение гидрохимических параметров в воде. Пробы воды для определения гидрохимических параметров отбирали через силиконовые прозрачные шланги, позволявшие при необходимости контролировать отсутствие пузырька воздуха при заполнении склянок. Сразу после отбора проводили фиксацию проб на растворенный кислород и аммонийный азот. Пробы для определения фосфатов и нитратов отбирали в пластиковую посуду объемом 0.5 л без консервации и анализировали в судовой лаборатории.
Растворенный кислород определяли модифицированным методом Винклера с использованием 20–30 мл калиброванных склянок с диаметром пробки 10 мм и объемом промывки при заполнении склянки не менее 300% (Methods…, 1999). Фосфаты определяли по методу Морфи–Райли, нитриты – по методу с “единым” цветным реактивом, нитраты – согласно усовершенствованному методу Морриса и Райли, аммонийный азот – по методу Сэджи–Солорзано с образованием фенол-гипохлоритного комплекса (Methods…, 1999).
Квазиконсервативный индикатор N* рассчитывали по формуле: N* = (N – 16P + 2.90 мкмоль/кг) × × 0.87 (Gruber, Sarmiento, 1997), где N – концентрация нитратов, P – концентрация фосфатов. N* примерно равен нулю, если выдерживается пропорция Редфилда (N : P = 16 : 1), а положительные и отрицательные значения N* отражают отклонения от нее.
Пробы на определение концентрации метана отбирали, без турбулентности, в стеклянные флаконы с фиксатором (KOH) и стандартной газовой фазой (“head-space”), герметично закрывали резиновой пробкой. Содержание метана в пробах определяли по методике фазово-равновесной дегазации на газовом хроматографе Kristall-2000-M (Хроматэк, Йошкар-Ола, Россия) с пламенно-ионизационным детектором. Ошибка метода составляет 6%.
Радиоизотопные эксперименты. Для измерения интенсивности процессов фотосинтеза, микробной ассимиляции углекислоты и автотрофного метаногенеза использовали радиоуглеродный метод с добавлением NaH14CO3, а для микробного окисления метана – с 14CH4.
Воду для измерения активности первичной продукции (ПП) и темновой ассимиляции углекислоты (ТАУ) наливали из батометров в склянки объемом 310 мл с помощью силиконовой трубки, без турбулентности, с двойной промывкой и с изливом половины объема склянки. Все склянки при отборе были затемнены. На каждом горизонте отбора для определения ПП использовали две прозрачные склянки, а для ТАУ две темные, покрытые алюминиевой фольгой. Темные склянки являлись контролем для светлых склянок. Для контроля ТАУ наполняли 1 темный флакон и добавляли в него 1 мл 0.05 н HCl. После отбора, в затемненном помещении во все склянки добавляли по 100 мкл стерильного раствора NaH14CO3 (специфическая активность 2.04 ГБк ммоль–1, 5 мкКи/пробу). Затем снимали общие затемняющие чехлы и для каждой склянки использовали индивидуальный чехол, калиброванный по степени пропускания фотосинтетически активной радиации, соответствующей освещенности на горизонте отбора пробы. Склянки инкубировали в проточном аквариуме на палубе судна от 4 до 6 ч. По завершении экспозиции содержимое флаконов фиксировали 1 мл 0.05 н HCl. Дальнейшую обработку проб для измерения активности ПП и ТАУ проводили по методике, подробно описанной ранее (Savvichev et al., 2020).
Интенсивность гидрогенотрофного метаногенеза измеряли в склянках, отобранных и зафиксированных КОН, аналогично определению скорости ТАУ. После завершения инкубации с меченым бикарбонатом пробы обрабатывали по методике, подробно описанной ранее (Pimenov, Bonch-Osmolovskaya, 2006).
Для определения интенсивности микробного окисления метана (МО) радиоуглеродным методом (14СН4) воду из батометра наливали с помощью силиконового шланга в 30 мл пенициллиновые флаконы с промывкой и изливом и закрывали резиновой пробкой, контролируя отсутствие пузырька воздуха. После введения 14CH4 (1 мкКи на образец, специфическая активность 1.16 ГБк ммоль–1), растворенного в дегазированной дистиллированной воде, пробы инкубировали 2 сут в холодильнике, в условиях, близких к in situ. Для каждой пробы использовали 2 повторности и контроль (пробу, предварительно фиксированную 1 н КОН). После инкубации пробы фиксировали и транспортировали в лабораторию для дальнейшего определения продуктов микробного окисления: углекислоты (СО2), включения в биомассу микроорганизмов (БМ) и в растворенный органический углерод (РОУ). Обработку проб и расчеты интенсивности метанокисления проводили по ранее описанной методике (Русанов и соавт., 1998).
Определение состава микробного сообщества методом высокопроизводительного секвенирования гена 16S рРНК. Для определения филогенетического состава микробных сообществ биомассу из образцов воды объемом 1 л концентрировали на фильтрах Microsart CN-Filter (“Sartorius Stedim Biotech”, Германия) с диаметром пор 0.2 мкм. Фильтры с биомассой хранили в замороженном виде до выделения ДНК в лаборатории.
ДНК выделяли из биомассы с мембранных фильтров с использованием коммерческого набора PowerSoil DNA Isolation Kit (“Qiagen”, Нидерланды). Библиотеки 16S рРНК получали с помощью двух последовательных ПЦР. Обе реакции были проведены с помощью готовой смеси qPCRmix-HS SYBR (“Евроген”, Россия) на амплификаторе StepOnePlus Real-Time PCR System (“Applied Biosystems”, США). В ходе первой реакции амплифицировали V4 участок 16S рРНК с использованием праймеров 515F (5'-GTGBCAGCMGCCGCGGTAA-3') (Hugerth et al., 2014) и Pro-mod-805R (5'-GACTACNVGGGTMTCTAATCC-3') (Меркель и соавт., 2019) с конечной концентрацией 0.25 мкМ. Программа первой реакции была следующей: предварительная денатурация при 95°C 3 мин; 32 цикла (денатурация – 95°C 25 с, отжиг праймеров – 56°C 20 с, элонгация – 72°C 30 с); финальная элонгация – 72°C 20 мин. Полученные ампликоны были использованы в качестве матрицы для второй реакции с уникальными индексными праймерами Illumina (TruSeq). Конечная концентрация индексных праймеров составляла 0.5 мкМ. Программа второй ПЦР была следующей: предварительная денатурация при 95°C 3 мин; 14 циклов (денатурация – 95°C 20 с, отжиг праймеров – 59°C 20 с, элонгация – 72°C 30 с); финальная элонгация – 72°C 20 мин. Полученные библиотеки очищали при помощи набора Cleanup Standard (“Евроген”, Россия), смешивали эквимолярно, загружали на 2%-ный агарозный гель и вырезали необходимый продукт на трансиллюминаторе The Safe Imager Blue-Light (“Invitrogen”, Израиль) с длиной волны 470 нм. ДНК из геля очищали при помощи набора Cleanup Standard (“Евроген”, Россия). Конечную концентрацию пула библиотек измеряли на флуориметре Qubit 2.0 с использованием высокочувствительных реактивов HS Assay Kit (“Life Technologies”, США). Секвенирование проводили на платформе MiSeq (“Illumina”, США) с использованием набора MiSeq Reagent Micro Kit v2 (300 циклов) согласно инструкции производителя. Первичную обработку данных и удаление химерных последовательностей производили, как было описано ранее (Fadrosh et al., 2014). Формирование ОТЕ таблицы и анализ альфа разнообразия проводили по методике, описанной ранее (Пименов и соавт., 2018). Массивы последовательностей были депонированы в архив GenBank под номером биопроекта PRJNA684336.
РЕЗУЛЬТАТЫ
Физико-химическая характеристика станций. Распределение гидрофизических и некоторых гидрохимических параметров в водной толще на станции АМК73-6045, расположенной над метановым сипом, и на удаленной от сипа станции АМК73-6053 показано на рис. 2 и в табл. 1. Пикноклин на станции над метановым сипом (АМК73-6045) располагался на глубине 23–32 м, на удаленной станции (АМК73-6053) зона пикноклина располагалась несколько выше – на глубине 20–25 м. Слои выше и ниже пикноклина были хорошо аэрированы на обеих станциях, содержание кислорода было 340–360 мкМ над пикнолином и 320–340 мкМ под пикноклином (табл. 1). Содержание биогенных элементов (P, N) изменялось по вертикали незначительно. Однако расчет квазиконсервативного индикатора N*, отражающего изменения в пропорции Редфилда, выявил лимитирование по азоту практически по всей глубине водной толщи над метановым сипом (АМК73-6045), в то время как на удаленной станции (АМК73-6053) этот индикатор был больше нуля на всех горизонтах, за исключением верхнего (табл. 1).
Рис. 2.
Распределение температуры (а), солености (б) и метана (в) на станциях АМК73-6045 (сплошная линия) и АМК73-6053 (пунктирная линия).
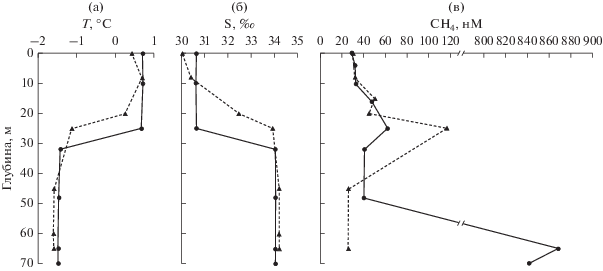
Содержание метана на различных горизонтах обеих станций, как правило, находилось в пределах 25.9–50.4 нM. Однако на глубине 25 м, которая соответствует пикноклину, были зафиксированы локальные максимумы: 61.6 и 116.5 нM на станциях АМК73-6045 (сип) и АМК73-6053 (удаленная станция) соответственно. Содержание метана в придонных горизонтах станции АМК73-6045 (сип) достигало 867.9 нM, в то время как на удаленной станции не превышало средних значений до самого дна (рис. 2).
Первичная продукция (ПП) фитопланктона. Интенсивности ПП, выявленные на исследованных станциях, были низкими (рис. 3а, 3б). На станции АМК73-6045 (сип) суммарные значения ПП изменялись от 2.2 до 18.2 мкг С/(л день), на удаленной станции АМК73-6053 диапазон значений был ниже – от 5.2 до 9.9 мкг С/(л день). При этом интегральные величины ПП на обеих станциях были практически идентичны (табл. 2). На разных горизонтах станции АМК73-6045 (сип) доля включения углерода бикарбоната (С-НСО3) в БМ варьировала от 11 до 76%, а доля С-НСО3, перешедшего в РОУ, – от 24 до 89% от суммарных величин ПП (рис. 3а). На удаленной станции АМК73-6053 наблюдалось более высокое включение углерода в БМ – от 40 до 75% и несколько меньшее включение в РОУ – от 25 до 60% (рис. 3б). В среднем доля включения углерода бикарбоната в РОУ в процессе ПП составила 71.8% на станции АМК73-6045 и 42.7% на станции АМК73-6053 (табл. 2).
Рис. 3.
Микробные процессы, измеренные на станциях AMK73-6045 (метановый сип) и AMK73-6053 (вне зоны активных газовыделений) в 73 рейсе НИС “Академик Мстислав Келдыш”: (а, б) первичная продукция (ПП), (в, г) темновая ассимиляция углекислоты (ТАУ), (д, е) окисление метана (МО). Цветные столбцы отражают долевое соотношение продуктов ПП, ТАУ и МО при микробной трансформации углерода бикарбоната (а–г) или углерода метана (д, е): синие – включение в биомассу (БМ), красные – продукция растворенного органического углерода (РОУ), зеленые – продукция СО2. Графики отражают распределение по горизонтам дискретных величин процессов: (▲) ПП – суммарная (БМ + РОУ) интенсивность первичной продукции; (⚫) ТАУ – суммарная (БМ + РОУ) интенсивность темновой ассимиляции углекислоты; (◼) МО – суммарная (СО2 + БМ + РОУ) интенсивность окисления метана.
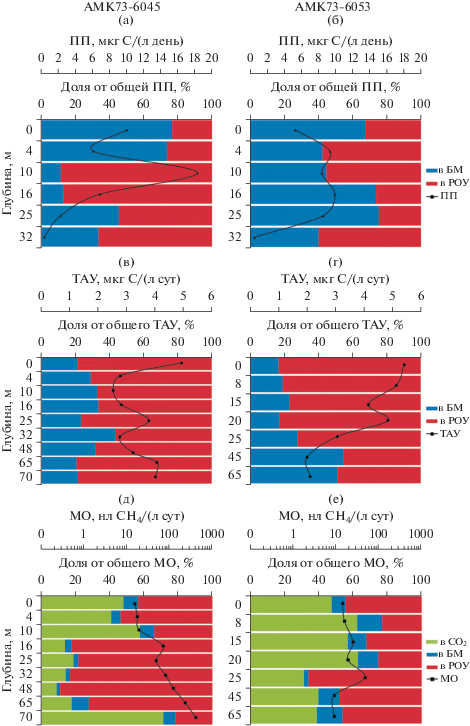
Таблица 2.
Интегральные величины процессов первичной продукции (ПП), темновой ассимиляции углекислоты (ТАУ) и окисления метана (МО) пелагическими микробными сообществами, измеренные на станциях АМК73-6045 (над метановым сипом) и АМК73-6053 (вне зоны активных газовыделений) в ходе 73 рейса НИС “Академик Мстислав Келдыш” в октябре 2018 г.
| Процессы | АМК73-6045 | АМК73-6053 | ||
|---|---|---|---|---|
| ПП, мг С/(м2 день) |
Суммарная ПП | 228.6 | 237.3 | |
| Включение С-НСО3 в БМ | 64.5 (28.2%) | 135.9 (57.3%) | ||
| Включение С-НСО3 в РОУ | 164.1 (71.8%) | 101.4 (42.7%) | ||
| ТАУ, мг С/(м2 сут) |
Суммарная ТАУ | 230.4 | 208.5 | |
| Включение С-НСО3 в БМ | 67.9 (29.5%) | 64.3 (30.8%) | ||
| Включение С-НСО3 в РОУ | 162.5 (70.5%) | 144.2 (69.2%) | ||
| МО, мкг С-СН4/(м2 сут) |
Суммарное МО | 0–32 м* 771.9 |
0–70 м** 4271.7 |
693.4 |
| Включение С-СН4 в СО2 | 164.8 (21%) | 252.3 (5.9%) | 293.0 (42.2%) | |
| Включение С-СН4 в БМ | 29.9 (4%) | 945.2 (22.1%) | 54.7 (7.9%) | |
| Включение С-СН4 в РОУ | 577.2 (75%) | 3074.2 (72.0%) | 345.8 (49.9%) | |
Темновая ассимиляция углекислоты (ТАУ). Измеренные величины ТАУ на обеих станциях оказались достаточно высокими для Арктических морей в позднеосенний период. На станции АМК73-6045 (сип) суммарная интенсивность ТАУ по горизонтам изменялась от 2.5 до 4.9 мкг С/(л сут), при среднем значении 3.4 мкг С/(л сут). Величины большие, чем средние, детектированы на поверхности, в верхней части пикноклина (25 м) и в двух придонных (65 и 70 м) горизонтах (рис. 3в). Доля включения углерода бикарбоната в БМ микроорганизмов на разных горизонтах изменялась от 21 до 43%, а большая часть С-НСО3 переходила в РОУ (57–79% от суммарной величины ТАУ).
На удаленной станции АМК73-6053 профиль распределения интенсивности ТАУ по горизонтам существенно отличался от такового над сипом (рис. 3г): на горизонтах от поверхности до верхней части пикноклина интенсивность ТАУ была выше средней величины, а от нижней части пикноклина до дна детектированы низкие значения. Однако диапазон величин ТАУ (от 2 до 5.4 мкг С/(л сут) и среднее значение ТАУ (3.8 мкг С/(л сут) на удаленной станции АМК73-6053 были сходны с таковыми на станции АМК73-6045 над метановым сипом. Доля включения углерода бикарбоната в БМ на различных горизонтах составила от 17 до 55%, в РОУ – от 45 до 83%.
В среднем доли включения углерода бикарбоната в БМ и РОУ в процессе ТАУ были сходны на обеих станциях и составили около 30% в БМ и 70% в РОУ (табл. 2).
Метаногенез и окисление метана в водной толще. Интенсивность гидрогенотрофного метаногенеза (МГ), измеренная радиоизотопным методом с использованием NaH14СO3, в исследованных образцах была крайне низкой и составила, по расчетам, менее 3 нл СН4/(л сут), что ниже границы чувствительности метода, которая при концентрациях метана до 2 мкл/л позволяет достоверно измерять скорости МГ более 5 нл СН4/(л сут). Полученные данные указывают на отсутствие или незначительность вклада гидрогенотрофного МГ в повышение подповерхностных концентраций метана в исследованных образцах водной толщи.
Процесс микробного окисления метана (МО) протекал по всей глубине водной толщи на обеих станциях, а углерод метана трансформировался в СО2, БМ и РОУ (рис. 3д, 3е). Интенсивность МО на обеих станциях была невысокой (за исключением придонных горизонтов на станции над сипом), что характерно для водной толщи открытой части Арктических морей (Rogener et al., 2020). На удаленной станции (AMK73-6053) диапазон суммарных величин окисления метана изменялся от 9 до 47 нл СН4/(л сут), со средним значением 20 нл СН4/(л сут) (рис. 3е). Значения выше средних выявлены над (15 м) и под (25 м) пикноклином. Минимальные скорости МО выявлены в придонных (45 и 65 м) горизонтах. Оба максимума и минимумы, промежуточный и придонный, полностью соответствовали профилю распределения метана (рис. 2). Доли включения углерода метана в СО2, БМ и РОУ в процессе МО на удаленной станции составили 42.2, 7.9 и 49.9% соответственно (табл. 2).
Иная картина выявлена на станции AMK73-6045 над метановым сипом (рис. 3д). По концентрации растворенного метана всю водную толщу над этой станцией можно условно разделить на две зоны: от поверхности до нижней части пикноклина (0–32 м) и от нижней части пикноклина до дна (рис. 2). Концентрации метана от поверхности до нижней части пикноклина имели даже несколько меньшие величины, чем на удаленной станции. А диапазон общей интенсивности МО изменялся более существенно и равномерно: от 16 на поверхности до 81 нл СН4/(л сут) под пикноклином со средним значением 42 нл СН4/(л сут) (рис. 3д). Также как и на удаленной станции, в пикноклине обнаружено небольшое уменьшение интенсивности МО, а непосредственно над зоной пикноклина – промежуточный максимум. Интегральная величина МО, рассчитанная для этой зоны, была сопоставима с интегральной величиной МО на фоновой станции (табл. 2). Однако ниже пикноклина и до дна на станции над сипом выявлено ожидаемое резкое увеличение концентрации метана (рис. 2) и значительное (в разы) усиление активности микробного МО. Диапазон величин окисления метана увеличился от 81 (на 32 м) до 120 (на 48 м) и почти до 370 нл СН4/(л сут) в придонном горизонте (рис. 3д), а интегральная величина МО в итоге многократно превысила таковую для удаленной станции (табл. 2).
Распределение углерода метана, включенного в СО2, БМ и РОУ в процессе МО также было различным при расчете от поверхности до нижней части пикноклина или при расчете на всю глубину от поверхности до дна (табл. 2), что свидетельствует о различном функционировании метанокисляющих микробных сообществ в придонных и приповерхностных горизонтах станции, расположенной над метановым сипом (AMK73-6045).
Молекулярный анализ состава микробных сообществ. Поскольку на глубине расположения пикноклина на изученных станциях был выявлен пик концентрации метана, то для анализа филогенетического разнообразия микроорганизмов были выбраны три образца, два из которых отобраны с горизонта пикноклина обеих станций (АМК73-6045_25 и АМК73-6053_25), а третий – с горизонта выше пикноклина на станции над сипом (АМК73-6045_16). В результате секвенирования после первичной обработки данных получено от 640 до 833 последовательностей 16S рРНК со средней длиной 254 п.н. Полученные прочтения объединены в оперативные таксономические единицы (ОТЕ) на уровне сходства 97%. Покрытие разнообразия филотипов, рассчитанное с помощью метода Chao1, варьирует от 82.8 до 83.8% (табл. 3), кривые насыщения не выходят на плато, но близки к этому состоянию (доп. материалы, рис. S1 ). Такое покрытие не позволяет делать выводы о количественной представленности минорных групп прокариот, однако его достаточно для описания доминирующих таксонов.
Таблица 3.
Результаты секвенирования тотальной ДНК и оценка покрытия разнообразия филотипов пелагических микробных сообществ с горизонта пикноклина (25 м) и горизонта выше пикноклина (16 м) на станциях АМК73-6045 (над метановым сипом) и АМК73-6053 (вне зоны активных газовыделений)
| Образец (станция_глубина) |
Число прочтений | Число ОТЕ | Археи, % | Chao1 | Насыщение, % |
|---|---|---|---|---|---|
| АМК73-6045_16 | 640 | 163 | 0.9 | 194.4 | 83.8 |
| АМК73-6045_25 | 780 | 159 | 1.9 | 191.3 | 83.1 |
| АМК73-6053_25 | 833 | 175 | 1.8 | 211.4 | 82.8 |
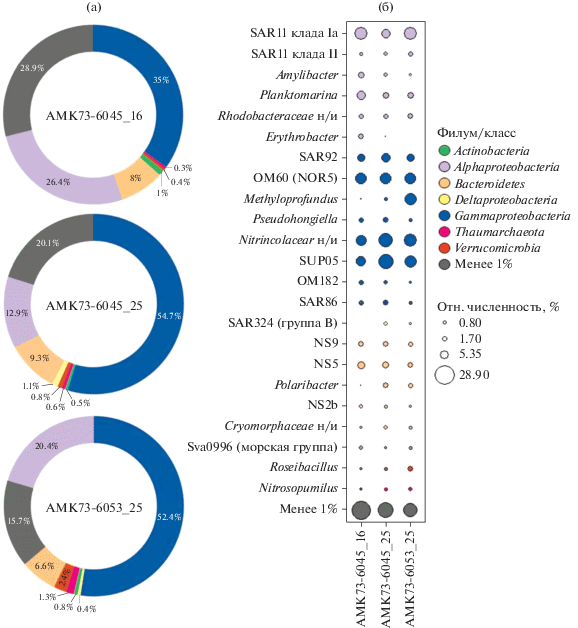
Состав трех сообществ на уровне крупных таксонов оказался сходным. Отмечено преобладание последовательностей представителей домена Bacteria (более 97% от общего числа прочтений) над доменом Archaea (рис. 3, табл. S1 ). Последовательности архей принадлежали представителям двух филумов: Thaumarchaeota (“Candidatus Nitrosopumilus”; 0.3–1.3%) и Euryarchaeota (Marine Group II; 0.3–0.6%). Преобладающая часть последовательностей представителей домена Bacteria принадлежала филуму Proteobacteria (75.6–81.5%), который включал классы Alphaproteobacteria (16.5–33.5%), Gammaproteobacteria (42.0–59.3%) и Deltaproteobacteria (0–2.8%). Помимо протеобактерий выявлены представители филумов Bacteroidetes (9.9–11.5%), Actinobacteria (0.5–1.8%) и Verrucomicrobia (0.6–2.2%). Другие филумы домена Bacteria суммарно составляли не более 0.9% от общего числа прочтений. Наиболее многочисленными (более 10% от общего числа прочтений) в исследованных образцах были представители следующих филогенетических групп: клада SAR11 (класс Alphaproteobacteria; 7.2–15.2%), кластеры SUP05 (семейство Thioglobaceae; 7.5–17.4%) и OM60(NOR5) (9.6–10.5%), род Methyloprofundus (0.1–11.6%) и неидентифицированные представители семейства Nitrincolaceae (8.9–13.2%). Значимыми компонентами сообществ были также представители рода Planktomarina (2.7–6.4%) и клад SAR92 (4.5–6.6%), NS5 (2.1–4.3%). Цианобактерии в образцах не выявлены, но обнаружены последовательности хлоропластов (1.3–4.2%).
Среди представителей клады SAR11 преобладали последовательности подклады Ia (6.1–13.4% от общего числа прочтений), типичные для высокоширотных областей (Brown et al., 2012). Последовательности гаммапротеобактерий, отнесенные к кластеру SUP05, оказались близки к подкластеру Arctic96BD-19, включающему аэробных сероокисляющих литогетеротрофных представителей “Ca. Thioglobus” sp. NP1 и “Ca. Thioglobus singularis” PS1. Последовательности ОТЕ из наших образцов, отнесенные к кластеру OM60(NOR5), оказались близки к гетеротрофному виду Marimicrobium arenosum CAU 1038. Последовательности неидентифицированных представителей семейства Nitrincolaceae оказались близки к клонам некультивируемых морских гаммапротеобактерий Arctic96B-16 и Ant4D3.
ОБСУЖДЕНИЕ
Ранее для центральной части Северного Ледовитого океана было установлено, что в зоне влияния атлантических вод подповерхностная концентрация метана близка к значениям, равновесным с атмосферой (3.5–4 нМ), в то время как в зоне влияния тихоокеанских вод она достигала 5–7 нМ, что во втором случае связывалось с аэробной биологической продукцией метана пелагическими сообществами (Damm et al., 2010). Содержание метана в верхних горизонтах водной толщи на исследованных нами станциях над метановым сипом (АМК73-6045) и на удалении от него (АМК73-6053) имело сопоставимые значения и находилось в пределах 25.9–50.4 нM (табл. 1), что говорит о значительном пересыщении поверхностных вод исследуемого региона метаном. Принимая значения, измеренные Damm et al. (2010) в качестве фоновых (то есть однозначно не обусловленных деятельностью метановых сипов), можно заключить, что обе исследованные нами станции были подвержены влиянию метановых сипов. Так, повышенная концентрация метана во всей водной толще на станции АМК73-6045 напрямую обусловлена разгрузкой пузырьков метана из донных отложений, а на станции АМК73-6053, удаленной от сипа, – адвективным переносом вод, обогащенных метаном. Такой перенос от мощного источника пузырькового метана может прослеживаться в слое, ассоциированном с пикноклином, на расстояния в сотни километров (Shakhova et al., 2015). На исследованных станциях на глубине расположения пикноклина были, действительно, зафиксированы локальные максимумы содержания метана с наибольшим значением 116 нМ на станции АМК73-6053 (рис. 2). И именно здесь (образец АМК73-6053_25) было выявлено максимальное число последовательностей гена 16S рРНК, относящихся к роду метанотрофных бактерий Methyloprofundus (11.6%). В двух образцах со станции над сипом (АМК73-6045_16 и АМК73-6045_25) их относительное обилие составило менее 1%, что коррелирует с более низкими концентрациями растворенного метана (47.3 и 61.6 нМ соответственно). Интенсивность МО на обеих станциях была также невысокой, то есть вклад метанотрофных бактерий в трофическую сеть в пелагиали существенно ниже, чем в сообществах донных осадков (Пименов и соавт., 2000; Savvichev et al., 2018).
Несмотря на явное влияние мощных метановых сипов на концентрацию растворенного метана в водной толще исследуемого региона, вопрос о возможности и интенсивности биологической продукции метана in situ остается открытым. Во всех исследованных горизонтах водной толщи радиоуглеродным методом нам не удалось достоверно измерить интенсивность процесса гидрогенотрофного МГ. В нашем исследовании не был учтен метилотрофный путь МГ, который по некоторым данным может быть значимым источником метана в аэробной водной толще Северного Ледовитого океана (Damm et al., 2010). Однако тот факт, что в составе микробных сообществ трех изученных нами образцов (АМК73-6045_16, АМК73-6045_25 и АМК73-6053_25) не были обнаружены последовательности гена 16S рРНК, относящиеся к метаногенным археям, свидетельствует в пользу иного механизма потенциальной продукции метана.
В олиготрофных условиях арктических морей структуру и функционирование микробных сообществ пелагиали определяют такие физико-химические факторы, как свет, доступность биогенов и органического вещества. Согласно нашим данным, в среднем от 43 до 75% (а на некоторых горизонтах исследованных станций до 90%) углерода углекислоты и углерода метана трансформируется в РОУ в ходе ПП, ТАУ и МО (табл. 2, рис. 3), что создает основу для метаболической активности разнообразных групп пелагических гетеротрофных микроорганизмов. Возможность использовать энергию солнечного света наряду с энергией, получаемой при разложении РОВ, дает физиологические преимущества фотогетеротрофным и протеородопсин-содержащим хемогетеротрофным бактериям (Boeuf et al., 2014). К таким организмам относятся представители аэробных аноксигенных бактерий пор. Rhodobacterales (Amylibacter, Planktomarina, другие Rhodobacteraceae) и протеородопсин-содержащие представители клад SAR11 (Pelagibacterales), SAR86, SAR92, в значительном количестве выявленные в исследованных образцах (рис. 4, табл. S1 ).
Рис. 4.
Разнообразие и относительное обилие филумов (а) и филогенетических групп родового уровня (б) прокариот в образцах воды на станциях АМК73-6045 (метановый сип) и АМК73-6053 (вне зоны активных газовыделений). Приведены только те филогенетические группы, относительное обилие которых составило более 1% от общего количества прочтений хотя бы в одном из образцов. Суммарное обилие филогенетических групп, каждая из которых составила менее 1% изображено серым цветом. Образцы АМК73-6045_25 и АМК73-6053_25 были отобраны с горизонта пикноклина, образец АМК73-6045_16 – с горизонта выше пикноклина. н/и - не идентифицированные представители группы.
Способность аэробного сообщества пелагиали продуцировать метан определяется составом РОВ и доступностью биогенов. В качестве предшественников метана в аэробной морской воде в настоящее время рассматривают метилфосфоновую кислоту (метилфосфонат, MPn) и диметилсульфониопропионат (ДМСП) (Karl et al., 2008; Damm et al., 2010). Наличие этих веществ в наших образцах не было напрямую показано, однако выявлены микроорганизмы, для которых известна способность к синтезу и разложению этих веществ, а также установлены гидрохимические предпосылки для обоих путей продукции метана.
Гены синтеза метилфосфоната известны у широко распространенных морских аммоний-окисляющий архей Nitrosopumilus maritimus (Thaumarchaeota), а также у представителей клады SAR11 (Pelagibacterales) (Metcalf et al., 2011; Born et al., 2017). В трех исследованных нами образцах выявлены последовательности, близкие к Nitrosopumilus с небольшим относительным обилием (0.3–1.3% от общего числа прочтений). Последовательности, относящиеся к представителям клады SAR11, были, напротив, многочисленны (7.2–15.2%). Последние способны не только синтезировать метилфосфонат, но и в условиях фосфатного голодания использовать его в качестве источника фосфора с побочным выделением метана в эквимолярных количествах (Carini et al., 2014).
Деметилирование метилфосфоната осуществляется посредством фермента СР-лиазы. Гены, кодирующие этот фермент, найдены не только у представителей SAR11, но и у разнообразных других бактерий и широко распространены в тех областях Мирового океана, для которых характерно лимитирование по фосфору (Karl et al., 2008; Sosa et al., 2019). Содержание фосфатов на обеих исследованных станциях не было низким по абсолютным концентрациям, однако положительные значения N* на удаленной от сипа станции АМК73-6053 свидетельствуют о дисбалансе в соотношении Редфилда в сторону переизбытка азота относительно фосфора, и можно предположить условия фосфатного голодания на этой станции (табл. 1). В море Лаптевых такое нарушение баланса биогенных элементов может быть связано с характерными особенностями деградации эрозионного органического вещества, поступающего с речным стоком (Semiletov et al., 2011). Таким образом, совместная метаболическая активность Nitrosopumilus и SAR11 по синтезу и деметилированию метилфосфоната может теоретически привести к процессу аэробной продукции метана в исследуемом регионе.
Данное предположение, безусловно, необходимо проверять экспериментально, поскольку работы, в которых было описано выделение метана из метилфосфоната через СР-лиазный путь, были сделаны в основном в низкоширотных областях Мирового океана (Karl et al., 2008; Sosa et al., 2019), в то время как в центральной части Северного Ледовитого океана была выявлена обратная картина: образование метана происходило в зоне влияния тихоокеанских вод, богатых фосфатами, но не в зоне влияния обедненных фосфатами атлантических вод. То есть выделение метана происходило в условиях доступности фосфатов и лимитирования по азоту. Предшественником метана в этом случае служил ДМСП (Damm et al., 2010). В исследованных нами образцах лимитирование по азоту (N* $ \ll $ 0) зафиксировано на станции АМК73-6045 над метановым сипом (табл. 1), и здесь можно предположить путь аэробной продукции метана из ДМСП.
Известно, что моря полярных и субполярных широт характеризуются повышенным содержанием ДМСП, как растворенного, так и в составе биомассы микроорганизмов. ДМСП синтезируется разнообразным морским фито- и бактериопланктоном и выполняет ряд функций, включая осмо- и криопротекторную, антиоксидантную, сигнальную, регуляторную, а также функцию запасания углерода, серы и/или энергии (см. обзор Zhang et al., 2019 и ссылки в нем). В исследованных нами образцах способностью утилизировать ДМСП обладают представители клад SAR11, SAR86 и рода Planktomarina (Sun et al., 2016; Voget et al., 2015). Клетки SAR11 не способны к ассимиляции сульфатов и поэтому облигатно нуждаются в органических соединениях серы, таких как ДМСП, метионин и цистеин (Tripp et al., 2008). Для северной Атлантики показано, что на клетки SAR11 в поверхностных водах приходится 50% активности по ассимиляции аминокислот и 30% активности по ассимиляции ДМСП (Malmstrom et al., 2004). Таким образом, клада SAR11 может являться функционально наиболее значимой в силу массовой представленности в сообществе (7.2–15.2% от общего числа прочтений) и предполагаемой высокой активности.
ДМСП катаболизируется двумя конкурирующими путями: деметилированием с образованием метилмеркаптана (метантиола, MeSH) и расщеплением с образованием диметилсульфида (ДМС) (Zhang et al., 2019). Основываясь на данных о том, что в анаэробных условиях метилмеркаптан и ДМС могут служить субстратами для метилотрофного метаногенеза (Tallant, Krycki, 1997), Damm et al. (2015) выдвинули гипотезу о принципиальной возможности морских микроорганизмов продуцировать метан в аэробной окружающей среде. Согласно их модели, рассчитанной для условной клетки Roseobacter, высокая дыхательная активность и низкая проницаемость клеточных мембран может способствовать поддержанию анаэробных внутриклеточных условий, благоприятных для образования метана даже в насыщенных кислородом водах. Подобный механизм, направленный на защиту нитрогеназы от ингибирования кислородом, известен для азотфиксирующих микроорганизмов, в частности, цианобактерий (Peschek et al., 1991). Однако выделение метана по пути метилотрофного метаногенеза требует наличия специфических ферментных систем (Kurth et al., 2020), которые неизвестны у неметаногенных прокариот. Но интересным является факт, выявленный в модельных экспериментах Damm et al. (2010): в тех образцах природной арктической воды, к которым добавляли ДМСП, и где происходило выделение метана, было выявлено увеличение количества копий nifH-генов. Можно предположить, что выделение метана при разложении ДМСП в условиях азотного голодания и азотфиксация являются процессами, связанными друг с другом.
Таким образом, в результате нашего исследования выявлены гидрохимические предпосылки и возможные микробные агенты для аэробной продукции метана через деметилирование метилфосфоната и при разложении ДМСП. То есть метан предположительно может продуцироваться in situ в аэробных условиях водной толщи моря Лаптевых за счет РОВ, которое, согласно нашим данным, синтезируется в значительном количестве в ходе процессов ПП, ТАУ и МО. Однако на основании полученных результатов мы не можем оценить вклад процесса аэробного образования метана в формирование общего пула метана в водной толще изученного района моря Лаптевых.
Оценка метан-продуцирующей активности аэробных пелагических микробных сообществ не может быть осуществлена радиоуглеродным методом, традиционно используемым для определения интенсивности архейного метаногенеза, поскольку пути продукции метана пелагическими микроорганизмами разнообразны и часто не связаны с потреблением таких “классических” субстратов, как углекислота, ацетат, метанол и метиламины. Таким образом, требуются дальнейшие исследования и экспериментальное подтверждение различных механизмов аэробного образования метана широким спектром гетеротрофных микроорганизмов, образующих устойчивые сообщества в водной толще морских водоемов разных климатических зон. Моря Восточной Арктики крайне привлекательны для развития этого направления исследований, поскольку разделены на две биогеохимические провинции: западную “гетеротрофную” и восточную “автотрофную” (Semiletov et al., 2005, 2016), что позволяет в рамках одной экспедиции проводить исследования в районах, которые характеризуются дефицитом азота и/или фосфора.
Список литературы
Меркель А.Ю., Тарновецкий И.Ю., Подосокорская О.А., Тощаков С.В. Анализ систем праймеров на ген 16S рРНК для профилирования термофильных микробных сообществ // Микробиология. 2019. Т. 88. С. 655–654.
Merkel A.Yu., Tarnovetskii I.Yu., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA primer systems for profiling of thermophilic microbial communities // Microbiology (Moscow). 2019. V. 88. P. 671–680.
Пименов Н.В., Саввичев A.C., Русанов И.И., Леин А.Ю., Иванов М.В. Микробиологические процессы цикла углерода и серы на холодных метановых сипах северной Атлантики // Микробиология. 2000. Т. 69. С. 831–843.
Pimenov N.V., Savvichev A.S., Rusanov I.I., Lein A.Yu., Ivanov M.V. Microbiological processes of the carbon and sulfur cycles at cold methane seeps of the North Atlantic // Microbiology (Moscow). 2000. V. 69. P. 709–721.
Пименов Н.В., Меркель А.Ю., Тарновецкий И.Ю., Малахова Т.В., Самылина О.С., Канапацкий Т.А., Тихонова Е.Н., Власова М.А. Структура микробных матов в прибрежных районах Мраморной бухты // Микробиология. 2018. Т. 87. С. 561–572.
Pimenov N.V., Merkel A.Y., Samylina O.S., Kanapatskii T.A., Tikhonova E.N., Vlasova M.A., Tarnovetskii I.Y., Malakhova T.V. Structure of microbial mats in the Mramornaya Bay (Crimea) coastal areas // Microbiology (Moscow). 2018. V. 87. P. 681–691.
Русанов И.И., Саввичев А.С., Юсупов С.К., Пименов Н.В., Иванов М.В. Образование экзометаболитов в процессе микробного окислении метана в морских экосистемах // Микробиология. 1998. Т. 67. С. 710–717.
Rusanov I.I., Savvichev A.S., Yusupov S.K., Pimenov N.V., Ivanov M.V. Production of exometabolites in the microbial oxidation of methane in marine ecosystems // Microbiology (Moscow). 1998. V. 67. P. 590–596.
Berchet A., Bousquet P., Pison I., Locatelli R., Chevallier F., Paris J.-D., Dlugokencky E.J., Laurila T., Hatakka J., Viisanen Y., Worthy D.E.J., Nisbet E., Fisher R., France J., Lowry D., Ivakhov V., Hermansen O. Atmospheric constraints on the methane emissions from the East Siberian Shelf // Atmos. Chem. Phys. 2016. V. 16. P. 4147–4157.
Bianchi M., Marty D., Teyssie J.L., Fowler S.W. Strictly aerobic and anaerobic bacteria associated with sinking particulate matter and zooplankton fecal pellets // Marine Ecol. Progr. Ser. 1992. V. 88. P. 55–60.
Bižic M., Grossart H.-P., Ionescu D. Methane Paradox // eLS / Chichester: John Wiley & Sons, Ltd, 2020a. https://doi.org/10.1002/9780470015902.a0028892
Boeuf D., Humily F., Jeanthon C. Diversity of Arctic pelagic bacteria with an emphasis on photoheterotrophs: a review // Biogeosciences. 2014. V. 11. P. 3309–3322.
Born D.A., Ulrich E.C., Ju K.-S., Peck S.C., van der Donk W.A., Drennan C.L. Structural basis for methylphosphonate biosynthesis // Science. 2017. V. 358. P. 1336–1339.
Brown M.V., Lauro F.M., DeMaere M.Z., Muir L., Wilkins D., Thomas T., Riddle M.J., Fuhrman J.A., Andrews-Pfannkoch C., Hoffman J.M., McQuaid J.B., Allen A., Rintoul S.R., Cavicchioli R. Global biogeography of SAR11 marine bacteria // Mol. Syst. Biol. 2012. V. 8. P. 595.
Carini P., White A.E., Campbell E.O., Giovannoni S.J. Methane production by phosphate-starved SAR11 chemoheterotrophic marine bacteria // Nat. Commun. 2014. V. 5. P. 4346.
Damm E., Helmke E., Thoms S., Schauer U., Nöthig E., Bakker K., Kiene R.P. Methane production in aerobic oligotrophic surface water in the central Arctic Ocean // Biogeosci. 2010. V. 7. P. 1099–1108.
Damm E., Thoms S., Beszczynska-Möller A., Nöthig E., Kattner G. Methane excess production in oxygen-rich polar water and a model of cellular conditions for this paradox // Polar Sci. 2015. V. 9. P. 327–334.
Ditchfield A., Wilson S., Hart M., Purdy K.J., Green D.H., Hatton A.D. Identification of putative methylotrophic and hydrogenotrophic methanogens within sedimenting material and copepod faecal pellets // Aquat. Microbial Ecol. 2012. V. 67. P. 151–160.
Fadrosh D.W., Ma B., Gajer P., Sengamalay N., Ott S., Brotman R.M., Ravel J. An improved dual-indexing approach for multiplexed 16S rRNA gene sequencing on the Illumina MiSeq platform // Microbiome. 2014. V. 2. P. 6.
Gruber N., Sarmiento J.L. Global patterns of nitrogen fixation and denitrification // Global Biogeochem. Cycles. 1997. V. 11. P. 235–266.
Hugerth L.W., Wefer H.A., Lundin S., Jakobsson H.E., Lindberg M., Rodin S., Engstrand L., Andersson A.F. DegePrime, a program for degenerate primer design for broad-taxonomic-range PCR in microbial ecology studies // Appl. Environ. Microbiol. 2014. V. 80. P. 5116–5123.
Karl D.M., Beversdorf L., Björkman K.M., Church M.J., Martinez A., DeLong E.F. Aerobic production of methane in the sea // Nat. Geosci. 2008. V. 1. P. 473–478.
Kurth J.M., Op den Camp H.J.M., Welte C.U. Several ways one goal – methanogenesis from unconventional substrates // Appl. Microbiol. Biotechnol. 2020. V. 104. P. 6839–6854.
Metcalf W.W., Griffin B.M., Cicchillo R.M., Gao J., Janga S.C., Cooke H.A., Circello B.T., Evans B.S., Martens-Habbena W., Stahl D.A., van der Donk W.A. Synthesis of methylphosphonic acid by marine microbes: a source for methane in the aerobic ocean // Science. 2012. V. 337. P. 1104–1107.
Methods of Seawater Analysis / Eds. Grashoff K., Kremling K., Ehrhard M. Weinheim-NewYork-Chichester-Brisbane-Singapore-Toronto: Wiley-VCH, 1999. 632 p.
Malmstrom R.R., Kiene R.P., Cottrell M.T., Kirchman D.L. Contribution of SAR11 bacteria to dissolved dimethylsulfoniopropionate and amino acid uptake in the North Atlantic Ocean // Appl. Environ. Microbiol. 2004. V. 70. P. 4129–4135.
Peschek G.A., Villgrater K., Wastyn M. “Respiratory protection” of the nitrogenase in dinitrogen-fixing cyanobacteria // Plant Soil. 1991. V. 137. P. 17–24.
Pimenov N.V., Bonch-Osmolovskaya E.A. In situ activity studies in thermal environments // Methods in Microbiology, 35. Extremophiles / Eds. Rainey F.A. and Oren A. Amsterdam: Acad. Press, Elsevier, 2006. P. 29–53.
Rogener M.K., Sipler R.E., Hunter K.S., Bronk D.A., Joye S.B. Pelagic methane oxidation in the northern Chukchi Sea // Limnol. Oceanogr. 2020. V. 65. P. 96–110.
Savvichev A.S., Kadnikov V.V., Kravchishina M.D., Galkin S.V., Novigatskii A.N., Sigalevich P.A., Merkel A.Yu., Ravin N.V., Pimenov N.V., Flint M.V. Methane as an organic matter source and the trophic basis of a Laptev Sea cold seep microbial community // Geomicrobiol. J. 2018. V. 35. P. 411–423.
Savvichev A.S., Kadnikov V.V., Rusanov I.I., Beletsky A.V., Krasnova E.D., Voronov D.A., Kallistova A.Yu., Veslopolova E.F., Zakharova E.E., Kokryatskaya N.M., Losyuk G.N., Demidenko N.A., Belyaev N.A., Sigalevich P.A., Mardanov A.V., Ravin N.V., Pimenov N.V. Microbial processes and microbial communities in the water column of the polar meromictic lake Bol’shie Khruslomeny at the White Sea coast // Front. Microbiol. 2020. V. 11. P. 1945.
Semiletov I., Dudarev O., Luchin V., Shin K.-H., Tanaka N. The East-Siberian Sea as a transition zone between Pacific-derived waters and Artic shelf waters // Geophys. Res. Let. 2005. V. 32. Art. L10614/2005GL022490.
Semiletov I., Pipko I., Gustafsson Ö., Anderson L.G., Sergienko V., Pugach S., Dudarev O., Charkin A., Gukov A., Bröder L., Andersson A., Spivak E., Shakhova N. Acidification of East Siberian Arctic Shelf waters through addition of freshwater and terrestrial carbon // Nature Geosci. 2016. V. 9. P. 361–365.
Semiletov I.P., Pipko I.I., Shakhova N.E., Dudarev O.V., Pugach S.P., Charkin A.N., McRoy C.P., Kosmach D., Gustafsson Ö. Carbon transport by the Lena River from its headwaters to the Arctic Ocean, with emphasis on fluvial input of terrestrial particulate organic carbon vs. carbon transport by coastal erosion // Biogeosci. 2011. V. 8. P. 2407–2426.
Shakhova N., Semiletov I., Leifer I., Salyuk A., Rekant P., Kosmach D. Geochemical and geophysical evidence of methane release over the East Siberian Arctic Shelf // J. Geophys. Res. 2010. V. 115. C08007.
Shakhova N., Semiletov I., Sergienko V., Lobkovsky L., Yu-supov V., Salyuk A., Salomatin A., Chernykh D., Kosmach D., Panteleev G., Nicolsky D., Samarkin V., Joye S., Charkin A., Dudarev O., Meluzov A., Gustafsson Ö. The East Siberian Arctic Shelf: towards further assessment of permafrost-related methane fluxes and role of sea ice // Phil. Trans. R. Soc. A. 2015. V. 373. Article 20140451.
Sosa O.A., Repeta D.J., DeLong E.F., Ashkezari M.D., Karl D.M. Phosphate-limited ocean regions select for bacterial populations enriched in the carbon–phosphorus lyase pathway for phosphonate degradation // Environ. Microbiol. 2019. V. 21. P. 2402–2414.
Sun J., Todd J.D., Thrash J.C., Qian Y., Qian M.C., Temperton B., Guo J., Fowler T.K., Aldrich J.T., Nicora C.D., Lipton M.S., Smith R.D., De Leenheer P., Payne S.H., Johnston A.W.B., Davie-Martin C.L., Halsey K.H., Giovannoni S.J. The abundant marine bacterium Pelagibacter simultaneously catabolizes dimethylsulfoniopropionate to the gases dimethyl sulfide and methanethiol // Nature Microbiol. 2016. V. 1. P. 16065.
Tallant T.C., Krycki J.A. Methylthiol: coenzyme M methyltransferase from Methanosarcina barkeri, an enzyme of methanogenesis from dimethylsulfide and methylmercatopropionate // J. Bacteriol. 1997. V. 179. P. 6902–6911.
Tripp H.J., Kitner J.B., Schwalbach M.S., Dacey J.W.H., Wilhelm L.J., Giovannoni S.J. SAR11 marine bacteria require exogenous reduced sulphur for growth // Nature. 2008. V. 452. P. 741–744.
Voget S., Wemheuer B., Brinkhoff T., Vollmers J., Dietrich S., Giebel H.-A., Beardsley C., Sardemann C., Bakenhus I., Billerbeck S., Daniel R., Simon M. Adaptation of an abundant Roseobacter RCA organism to pelagic systems revealed by genomic and transcriptomic analyses // ISME J. 2015. V. 9. P. 371–384.
Zhang X.H., Liu J., Liu J., Yang G., Xue C., Curson A.R.J., Todd J.D. Biogenic production of DMSP and its degradation to DMS – their roles in the global sulfur cycle // Sci. China Life Sci. 2019. V. 62. P. 1296–1319. https://doi.org/10.1007/s11427-018-9524-y
Дополнительные материалы
- скачать ESM.docx
- Рисунок S1. Кривые насыщения, полученные для образцов, отобранных из водной толщи с горизонта пикноклина (АМК73-6045_25 и АМК73-6053_25) и горизонта выше пикноклина (АМК73-6045_16). Станция АМК73-6045 располагалась над метановым сипом, станция АМК73-6053 – вне зоны активных газовыделений.
Таблица S1. Разнообразие и относительное обилие (%) филогенетических групп прокариот в образцах воды на станциях АМК73-6045 (над метановым сипом) и АМК73-6053 (вне зоны активных газовыделений)*.
Инструменты
Микробиология


