Микробиология, 2021, T. 90, № 3, стр. 259-285
Ацетогены: биохимия, энергетика, генетика, биотехнологический потенциал
В. Г. Дебабов *
ФГБУ Государственный научно-исследовательский институт генетики и селекции промышленных микроорганизмов Национального исследовательского центра “Курчатовский институт”
117545 Москва, Россия
* E-mail: debabov13@yandex.ru
Поступила в редакцию 30.12.2020
После доработки 25.01.2021
Принята к публикации 25.01.2021
Аннотация
Ацетогены – это анаэробные грамположительные бактерии, способные к росту на газовых субстратах – СО2, СО, Н2. Отличительной особенностью этих бактерий служит биохимический путь восстановления СО2 до ацетил СоА, называемый ацетил-СоА восстановительный путь или путь Вуда–Люнгдала (Wood Ljungdahl Pathway, WLP). Это единственный путь фиксации СО2, сопряженный с запасанием энергии. Вследствие эффективной нефотосинтетической фиксации двуокиси углерода ацетогены могут служить платформой для получения биотоплива и химикатов в будущей экономике, основанной на возобновляемой энергии и ресурсах. Недостатком ацетогенов, растущих на газовых субстратах, является низкая энергетическая обеспеченность и ограниченность синтезируемых конечных метаболитов, главным образом, уксусной кислоты и этанола, и в небольших количествах бутанола и масляной кислоты. Ацетогены обладают способностью к гетеротрофному росту на многих субстратах – сахарах, лактате, спиртах. Перспективным направлением увеличения энергообеспеченности процессов является миксотрофия – одновременное использование разных субстратов ацетогенами. Как для успешного сопряжения различных метаболических путей, так и для расширения репертуара синтезируемых соединений необходимо использование методов метаболической инженерии. В последние годы генетические инструменты для преобразования геномов ацетогенов существенно усовершенствованы. Данный обзор рассматривает современное состояние биохимии, энергетики, генетики ацетогенов и их биотехнологический потенциал.
ВВЕДЕНИЕ
Ацетогены – это анаэробные грамположительные бактерии, главным образом, филы Firmicutes, представленные более чем 20 родами (Darke et al., 2008, 2013). Ацетогены растут автотрофно на газовых субстратах (СО2, СО, Н2), и при этом основным продуктом метаболизма оказывается уксусная кислота (ацетат), что и послужило основанием для их названия. Значительная и наиболее изученная часть ацетогенов относится к роду Clostridia (Latif et al., 2014). Фиксацию двуокиси углерода ацетогены осуществляют через ацетил-СоА восстановительный путь, который также называется путем Вуда–Люнгдала (Wood–Ljungdahl Pathway или сокращенно WLP) (Rogsdale, Pierce, 2008). Отличительной чертой ацетогенов является то, что фиксация СО2 у них сочетается с накоплением энергии, что и позволяет им осуществлять литотрофный рост.
Большинство ацетогенов способны к гетеротрофному росту на разнообразных субстратах (сахара, спирты, лактат). Уникальная способность к фиксации СО2 и метаболическая гибкость способствовали широкому распространению ацетогенов в природе. Они широко представлены во многих анаэробных экологических нишах, таких как донные отложения морей и пресных водоемов, метаногенные сообщества, горячие источники и т.д. По некоторым оценкам, ацетогены ежегодно фиксируют до 10 млрд т СО2 (Rogsdale, 2008). Среди ацетогенов встречаются как мезофилы, так и термофилы (Basen, Müller, 2017). В последние годы показано, что способностью к фиксации СО2 обладают и некоторые археи (Rogsdale, 2008; He et al., 2016). Большая часть фундаментальных исследований и попыток практического применения выполнена на ограниченном числе представителей ацетогенов, главным образом, это Clostridium ljungdahlii, C. autoethanogenum, Acetobacterium woodii, Moorella thermoacetica, Sporomusa ovata.
ПУТЬ ВУДА–ЛЮНГДАЛА (WLP)
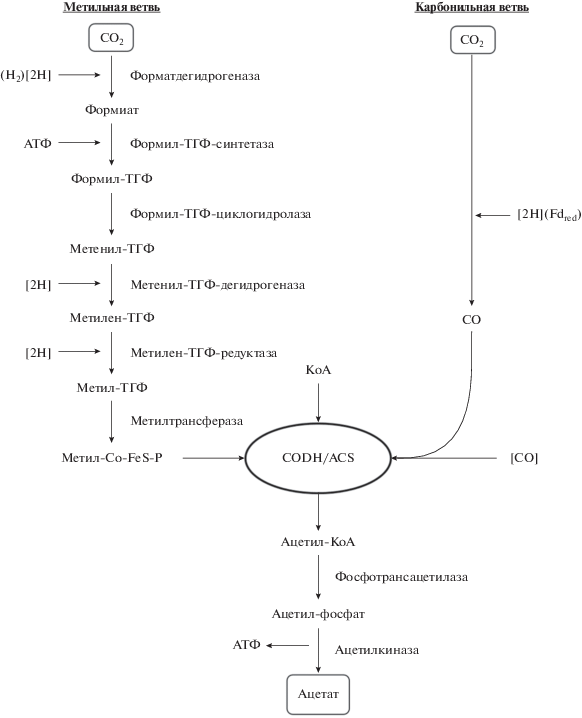
Используя путь Вуда–Люнгдала ацетогены способны синтезировать ацетил-СоА из двух молекул СО2, используя в качестве восстановителя молекулярный водород. На сегодня известно 6 различных биохимических путей биологической фиксации СО2 (Fast et al., 2012), но только ацетогены способны одновременно с фиксацией СО2 накапливать энергию. В отличие от других путей фиксации СО2, WLP – линейный путь, состоящий из двух ветвей – метильной и карбонильной (рис. 1). В метильной ветви СО2 восстанавливается до формиата с помощью фермента формиатдегидрогеназы. В качестве восстановителя в этой реакции используется NADPH. Далее формильная группа связывается с тетрагидрофолатом с образованием формилтетрагидрофолата. Эта реакция требует гидролиза 1 молекулы ATФ. Далее через ряд последовательных реакций формильная группа восстанавливается до метильной (метилтетрагидрофолат). Метильная группа с метилтетрагидрофолата переносится на специальный белок-переносчик, содержащий железосерные кластеры и кобаламин (Corrinoid Iron Sulfur Protein – FeSP) (Rogsdale, 2008). В карбонильной ветви молекула СО2 восстанавливается до СО с помощью фермента карбонмонооксид дегидрогеназы ацетил-СоА синтетазы (CoDH/Acs). Это ключевой фермент всего WLP пути. Далее CoDH/Acs катализирует реакцию синтеза ацетил-СоА из метильной группы, доставляемой белком CFeSP, CO и коэнзима А. На самом деле CoDH/Acs – два фермента, работающих в достаточно прочном комплексе. Карбонмонооксид дегидрогеназа (CoDH) может функционировать как независимый фермент в форме гомодимера. CoDH может взаимодействовать с гидрогеназой для сопряжения окисления СО и образования водорода (Burton et al., 2018). Восстановление СО2 до СО сопряжено с окислением ферредоксина (рис. 1).
Рис. 1.
Восстановление СО2 до ацетата – путь Вуда–Люнгдаля (WLP). THF – тетрагидрофолиевая кислота [H] – восстановительные эквиваленты; CoFeSP – белок, переносчик метильной группы; CODH/ACS – карбонилдегидрогеназа – СоА синтетаза.
Большинство ацетогенов превращает ацетил-СоА в ацетилфосфат с высвобождением кофермента СоА. Далее ацетаткиназа синтезирует уксусную кислоту с генерацией 1 моля АТФ. Таким образом, на уровне субстратного фосфолирирования, путь WLP оказывается нейтральным: 1 молекула АТФ образуется и 1 молекула расходуется. Вместе с тем, суммарная реакция образования уксусной кислоты из 4 молекул водорода и 2 молекул СО2 термодинамически выгодна и осуществляется с выделением энергии (уравнение 1):
(1)
$\begin{gathered} 4{{{\text{Н}}}_{2}} + 2{\text{С}}{{{\text{О}}}_{2}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СО}}{{{\text{О}}}^{--}} + {{{\text{Н}}}^{ + }} + 2{{{\text{Н}}}_{2}}{\text{О}} \\ \Delta {{G}^{0}} = - 95\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Ацетогены способны в ходе ацетогенеза использовать часть этой энергии путем создания мембранного ионного градиента и синтеза АТФ мембранно-связанными АТФазами (Schuchman, Müller, 2014).
КОНВЕРСИЯ ЭНЕРГИИ АЦЕТОГЕНАМИ
Для создания ионного градиента ацетогены обычно используют протоны, но некоторые виды используют ионы Na+. Для синтеза АТФ бактерии обладают либо Н+-зависимыми, либо Na+-зависимыми мембранными АТФазами. Транслокация ионов через мембрану осуществляется мембранно-связанными комплексами, движущей силой работы которых является окисление Fd. У ацетогенов обнаружено два типа таких комплексов, называемых Rnf и Ech (Schuchman, Müller, 2014). Оба комплекса – многосубъединичные образования, обязательной частью которых являются субъединицы, обеспечивающие локализацию комплексов в мембране. Субъединица, катализирующая окисление восстановленного ферредоксина, субъединица, обеспечивающая транслокацию ионов и субъединица, катализирующая сопряженную с окислением Fd восстановительную реакцию (см. рис. 2). В случае Rnf происходит восстановление NAD+ в NADH, а в случае Ech восстановление протонов до водорода. Была предложена классификация ацетогенов на основании наличия у них Rnf- или Ech-комплексов (Schuchman, Müller, 2014).
Рис. 2.
а – Структура Ech-комплекса в мембране Thermoanaerobacter kivui. б – Схема консервации энергии у ацетогенов через осмохимический механизм: ◻ – Na+- или Н+-зависимые мембранные АТР-азы; Ruf- и Ech-комплексы, обеспечивающие экспорт протонов и ионов Na; Fdred – восстановленный ферредоксин, обеспечивающий функционирование Ruf- и Ech-комплексов.
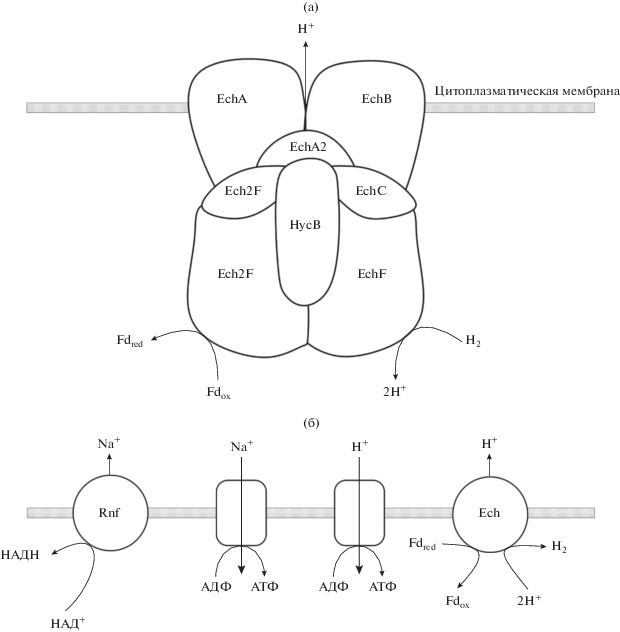
Кластеры Ruf способны транслоцировать как ионы Na+ (A. woodii) , так и Н+ (C. ljungdahlii). Как правило, Rnf- и Ech-комплексы содержат 8–9 субъединиц, и гены, ответственные за их синтез, образуют кластеры. Часто геномы бактерии содержат более одного кластера EcH и Rnf (Schoelmerich, Müller, 2020), тем не менее, делеция Rnf-генов у A. woodii полностью прекращает рост на H2 + CO2 (Westphal et al., 2018), что доказывает, что в данном случае это единственная функционирующая система. Геномный анализ 25 различных ацетогенов показал, что 19 из них содержат гены Rnf-комплексов, 9 Ech-комплексов, а 4 содержат как Rnf, так и Ech. Среди последних Sporomusa ovata и Clostridium scotologenes (Schoelmerich, Müller, 2020).
Недавно найдена анаэробная бактерия кишечника Pseudobutyrivibrio ruminis, у которой имеются функционально активные Ruf- и Ech-комплексы и Na+- и H+-зависимые АТФазы (Schoelmerich et al., 2020). Один из первых описанных ацетогенов, Clostridium aceticum, также способен к Na+-зависимому росту и, вместе с тем, может использовать H+-градиент для получения энергии (Mayer, Weuster-Botz, 2017).
Следует отметить, что детальное экспериментальное исследование функционирования Rnf- и Ech-комплексов осуществлено на небольшом числе примеров: Rnf-комплекс A. woodii (Hess et al., 2013) и C. ljungdahlii (Tremblay et al., 2012) и Ech-комплекс Thermoanaerobacter kivui (Schoelmerich, Müller, 2019b). Движущей силой работы как Rnf-, так и Ech-комплексов является окисление восстановленного ферредоксина (Fdred). Ферредоксины – древние белки, содержащие простетические группы в виде железосерных комплексов (FeS, Fe2S2 и Fe4S4). Стандартный окислительно-восстановительный потенциал пары Fdred/Fdox$E_{0}^{'}$ = ~470–500 мВ, т.е. восстановление ферредоксина – очень энергозатратная реакция. Для восстановления ферредоксина ацетогены используют специфический процесс, названный электронной бифуркацией.
ЭЛЕКТРОННАЯ БИФУРКАЦИЯ
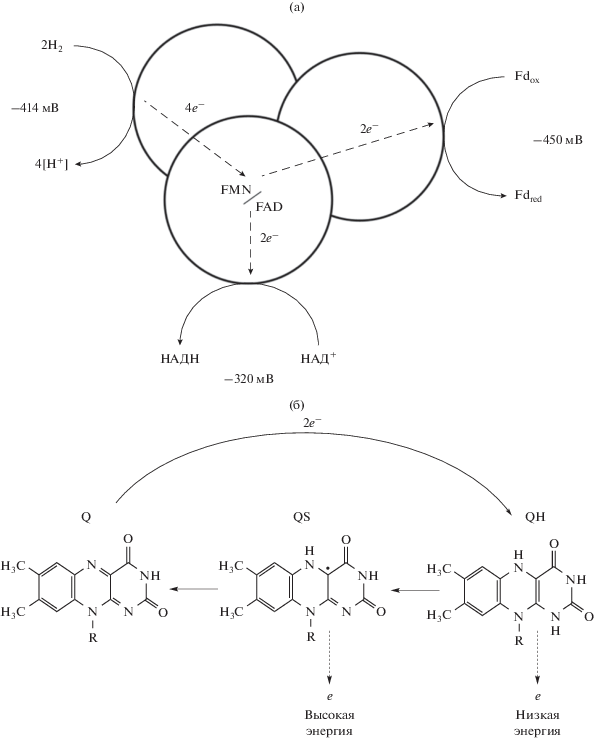
Электронная бифуркация – окислительно-восстановительный процесс, при котором окисление одного донора приводит к восстановлению двух акцепторов, причем одна из реакций восстановления идет с выделением энергии (экзергоническая реакция), а вторая – с поглощением энергии (эндергоническая реакция). Экзергоническая реакция обеспечивает энергией эндергоническую, делая процесс термодинамически разрешенным (рис. 3).
Рис. 3.
а – Флавин-зависимая бифуркация (пояснение в тексте); б – механизм окисления флавинов, связанный с бифуркацией. Q – флавинохинон; QS – флавиносемихинон (радикал); QH – гидрохинон. Флавинохинон окисляется в гидрохинон, акцептируя пару электронов от донора. QH отдает 1 электрон низкой энергии в экзергоническую ветвь и превращается в короткоживущий радикал QS. Флавиносемихинон отдает 1 электрон высокой энергии в эндергоническую ветвь, вновь возвращаясь в исходное состояние Q.
Процесс электронной бифуркации постулировал Петер Митчел в 1975 г. для объяснения процесса аэробного дыхания в митохондриях (Mitchell, 1975, 1976). В плане нашего рассмотрения анаэробных ацетогенов, нас будет интересовать вариант электронной бифуркации, открытой в 2008 г. (Herrmann et al., 2008) и названной флавин-зависимой электронной бифуркацией (Flavin based electronic bifurcation, FBEB). Этот процесс обеспечивает в анаэробных микроорганизмах биосинтез восстановленного ферредоксина (Fdred) – электронного переносчика с очень низким отрицательным потенциалом ($E_{0}^{'}$ = ~450–500 мВ).
Особенностями строения всех FBEB-комплексов является обязательное наличие флавина (FMN или FAD), который участвует в бифуркации электронов и субъединиц, осуществляющих окисление и восстановление субстратов. В качестве восстановленного продукта в эндерогенной реакции во всех комплексах выступает Fdred, в качестве доноров электронов используется молекулярный водород, формиат, NADH (см. рис. 3).
Все FBEB-комплексы – растворимые цитоплазматические образования. В настоящее время описано 12 комплексов 4 типов (Buckel, Thauer, 2018a, 2018b). Явление FBEB широко распространено у прокариот. Анализ 4588 геномов выявил наличие хотя бы одного гомолога для 12 известных типов FBEB-комплексов в 681 случаях. Обнаружено 512 видов бактерий и 169 видов архей, имеющих такие гены. Ни в одном случае эти гены не были обнаружены у эукариот (Poudel et al., 2018).
В настоящее время установлено, что бифуркация, т.е. разделение пары электронов на электрон с высокой и низкой энергией, осуществляется на молекулах флавинов (Lubner et al., 2017; Buckel, Thauer, 2018b; Peters et al., 2018). Флавины могут находиться в трех состояниях окисленности (см. рис. 3б): в виде флавохинонов (Q), флавосемихинонов (SQ) и флавогидрохинонов (HQ). Флавосемихинон представляет собой радикал со свободным электроном, который может иметь энергию выше, чем электрон в паре, передаваемый донором. Схематично можно представить события следующим образом: 1) cначала происходит двухэлектронное восстановление флавохинона (Q) в флавогидрохинон (QH); 2) затем QH теряет один электрон, который транспортируется в каталитический центр и восстанавливает акцептор в экзергонической реакции; 3) образуется нестабильный QS радикал, который мгновенно передает электрон в эндергоническую ветвь и регенерирует исходное Q состояние (рис. 3).
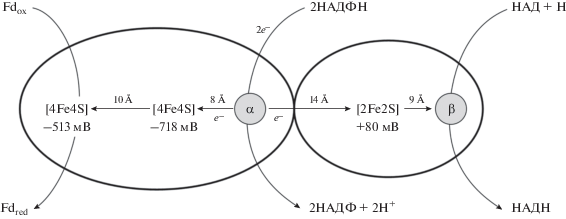
Существует небольшое число хорошо охарактеризованных комплексов, для которых известна пространственная структура. Именно на этих примерах выяснен молекулярный механизм функционирования комплексов, включая потенциалы всех окислительно-восстановительных центров, их взаимное расположение и расстояние между ними. Вероятно, лучше всего изучен комплекс NADH-зависимая ферредоксин:NADP+ восстанавливающая оксоредуктаза, называемая Nfn (Demmer et al., 2015; Liang et al., 2019). Nfn-комплекс катализирует реакцию (уравнение 2):
(2)
$\begin{gathered} 2{\text{NADPH}} + {\text{NAD}} + 2{\text{F}}{{{\text{d}}}_{{{\text{ox}}}}} \rightleftarrows \\ \rightleftarrows 2{\text{NADP}} + {\text{NADH}} + 2{\text{F}}{{{\text{d}}}_{{{\text{red}}}}}. \\ \end{gathered} $Схематически комплекс представлен на рис. 4. Nfn состоит из двух субъединиц. Большая субъединица содержит один флавин в центре окисления NADPH (называемый флавин А) и два железо-серных кластера [4Fe-4S]. Малая субъединица содержит один флавин в составе центра восстановления NAD (называемый флавин В) и один железо-серный кластер состава [2Fe-2S]. Эти пять редокс-центров расположены линейно. Бифуркацию электронов осуществляет флавин А, получающий пару электронов при окислении NADPH. В экзергонической ветви электрон с низкой энергией движется от флавина А к [2Fe-2S] кластеру, удаленному от него на 14 Å и затем к флавину В, который участвует в восстановлении NAD. В эндергонической ветви электрон с высокой энергией восстанавливает проксимальный к фла-вину А кластер [4Fe-4S], расположенный в 8 Å от него. Экспериментально показан удивительно высокий редокс-потенциал этого кластера [t0 –718 мВ]. Далее электрон передается на дистальный [4Fe-4S] кластер ($E_{0}^{'}$ = –513 мВ), который участвует в восстановлении ферредоксина (Lubner et al., 2017). В этой же работе показано, что потенциал [2Fe-2S] кластера ~+80 мВ. Таким образом, экспериментально продемонстрирована эффективность процесса бифуркации для получения электронного переносчика Fdred с очень низким потенциалом. Общее изменение свободной энергии в реакции с участием процесса бифуркации очень невелико, поэтому большинство реакций обратимо и служит для сохранения редокс баланса и соотношения NAD/NADH и NADP/NADPH в клетке (Schuchmann, Müller, 2014). Процесс, осуществляемый комплексом бифуркации в обратном направлении, называют “конфуркацией” (Shut, Adams, 2009).
МЕТАБОЛИЗМ АЦЕТОГЕНОВ ПРИ РОСТЕ НА РАЗЛИЧНЫХ СУБСТРАТАХ
Газовые субстраты
Ацетогены обладают способностью к росту на газовых субстратах (Н2, СО, СО2), на С1-соединениях (метанол, формиат), на сложных органических соединениях, таких как лактат, аминокислоты, сахара, спирты. Конечно, особое внимание привлекает способность ацетогенов к фиксации СО2 при росте на газовых субстратах.
В качестве восстановителя СО2 в газовых смесях может выступить Н2 или СО. В синтез-газе одновременно присутствуют оба восстановителя. Два восстановителя энергетически неравнозначны. В случае присутствия в газовой смеси СО бактериям не нужно расходовать энергию на восстановление СО2 до СО в карбонильной ветви WLP (рис. 1). Эта реакция, осуществляемая монокарбондегидрогеназой (CODH) проходит с использованием в качеcтве кофактора Fdred, восстановление которого требует больших затрат энергии.
Энергетический и редокс-балансы могут различаться у разных ацетогенов и не всегда могут быть точно учтены в силу недостаточной изученности многих из них. Для наиболее изученного ацетогена, A. woodii, был рассчитан энергетический баланс при росте на H2/CO и СО (Bertsch, Müller, 2015a). Рост на СО энергетически более выгоден. Ниже для сравнения приведены уравнения биосинтеза ацетата при росте на Н2/СО2 (уравнение 1) и на СО (уравнение 3):
(1)
$\begin{gathered} 4{{{\text{Н}}}_{2}} + 2{\text{С}}{{{\text{О}}}_{2}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СО}}{{{\text{О}}}^{--}} + {{{\text{Н}}}^{ + }} + 2{{{\text{Н}}}_{2}}{\text{О}} \\ \Delta {{G}^{{01}}} = - 95\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}, \\ \end{gathered} $(3)
$\begin{gathered} 4{\text{CО}} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СО}}{{{\text{О}}}^{--}} + {{{\text{Н}}}^{ + }} + 2{\text{С}}{{{\text{О}}}_{2}} \\ \Delta {{G}^{{01}}} = - 175\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $При росте на смеси Н2/СО2 в метильной ветви WLP расходуются две молекулы NADH и моль Н2 для восстановления СО2 до метильной группы, а в карбонильной 1 моль Fdred для восстановления СО2 до СО (рис. 1). У A. woodii Fdred образуется дегидрогеназой в реакции бифуркации. При этом из 3 молей Н2 образуется 1.5 моля NADH и 1.5 моля Fdred (рис. 3). Далее 1 моль Fdred используется на восстановление СО2 до СО и 0.5 моля Fdred потребляется Rnf-комплексом (рис. 2), который синтезирует 0.5 моля NADH и транспортирует 1 моль иона Na+ через цитоплазматическую мембрану. У A. woodii для синтеза 1 моля АТФ АТФаза требует 3 молей Na+. Таким образом, 4 молей водорода достаточно для синтеза 1 моля ацетата и 0.3 молей АТФ. В случае роста на СО не требуется Fdred для восстановления СО2 до СО, но зато требуется 1 моль водорода для восстановления СО2 до формиата. Из 4 молей СО (уравнение 3) 1 моль непосредственно вовлекается в WLP, а три других окисляются CODH до СО2 с одновременным восстановлением 3 молей Fd. Один моль водорода синтезируется в процессе конфуркации дегидрогеназой из 0.5 моля Fdred и 0.5 моля NADH. В Rnf-комплекс поступает 1.5 моля Fdred, что приводит к синтезу 2.5 моля NADH и выбросу 5 молей ионов Na+. Это количество ионов Na+ обеспечивает синтез 1.5 моля АТФ.
Большинство реакций WLP пути, реакции Rnf- и Ech-комплексов, а также реакции бифуркации электронов обратимы. Эта обратимость позволяет ацетогенам сохранять энергетический и редокс-баланс при росте на газообразных субстратах различного состава. Хотя рост на СО энергетически выгоден, но при этом синтезируется нежелательная двуокись углерода (уравнение 3). Рост на Н2/СО2 не образует СО2 (уравнение 1), но генерирует мало энергии и, следовательно, обладает низким потенциалом для биосинтеза полезных соединений.
Казалось бы идеальным субстратом для роста ацетогенов должен быть синтез-газ, содержащий СО, СО2 и Н2. Тем не менее, это не совсем так. Оказалось, что СО в концентрациях, присутствующих в синтез-газе, ингибирует некоторые ферменты. Так, при росте C. ljungdahlii на синтез-газе сначала потребляется СО, и только после того, как более 90% этого газа израсходовано, начинается потребление Н2 (Najafpour, Yones, 2006).
Экспериментально показано, что СО ингибирует прежде всего водород-зависимую СО2 редуктазу (HDCR), катализирующую восстановление СО2 в формиат (Bertsch, Müller, 2015b). Следует отметить, что если восстановление СО2 в СО у всех ацетогенов осуществляется практически одинаковым ферментом (CODH), то структура ферментативных систем, восстанавливающих СО2 в формиат достаточно разнообразна (Lemaire et al., 2020). Так, например, С. autoethanogenum использует для синтеза формиата дегидрогеназу, зависящую от окисления NADPH и Fdred и не ингибируемую СО (Wang et al., 2013).
Жидкие субстраты
Главным фактором, ограничивающим скорость роста ацетогенов на газовых субстратах, является плохая растворимость в воде Н2 и СО2, что снижает массообмен. Такого недостатка лишены метанол и формиат – С1-соединения, которые смешиваются с водой в любых соотношениях.
Формиат является первым соединение в метильной ветви WLP (рис. 1), а метильная группа метанола может быть превращена в метилтетрагидрофолат в той же ветви WLP (рис. 1).
И метанол, и формиат рассматриваются как перспективные субстраты для ферментации микроорганизмов (Cotton et al., 2020). Метанол сегодня получают из природного газа, а формиат – окислением метанола. Вместе с тем, в будущей зеленой циклической экономике формиат может быть будут получать электровосстановлением СО2 (Martin et al., 2015).
Метанол. Хотя рост ацетогенов на средах с метанолом был известен давно (Bache, Pfenning, 1981), сведения о механизмах и ферментах, участвующих в процессе, были получены лишь в последние годы. У бактерии A. woodii была идентифицирована специфическая трансметилаза, переносящая метильную группу от метанола к тетрагидрофолату. Идентификация фермента и соответствующих генов оказалась непростой задачей, так как геном A. woodii содержит около 30 генов, кодирующих потенциальные метилазы. Специфическую для метанола трансметилазу удалось обнаружить при анализе транскриптома. При переносе бактерий со среды с фруктозой на среду с метанолом активность специфической метилазы увеличилась в 10–14 раз (Kremp et al., 2018).
Метанол-специфическая трансметилаза содержит 3 субъединицы. Одна субъединица представляет собой корриноидный белок (CoP), а две другие субъединицы обеспечивают перенос метильной группы от метанола на СоР и от СоР на тетрагидрофолат с образованием метил-THF, промежуточного продукта WLP (рис. 1).
Мы уже говорили ранее о легкой обратимости реакций WLP. В данном случае молекула метил-THF окисляется по обращенному пути метильной ветви WLP с образованием АТФ, СО2 и Н2. Можно рассчитать, что Н2 и АТФ могут обеспечить образование 6 восстановительных эквивалентов, достаточных для восстановления 3 молекул СО2 до СО. Таким образом, потребление 4 молекул метанола может обеспечить синтез 3 молекул ацетата с одновременной фиксацией 2 молекул СО2 (Kremp et al., 2018) (уравнение 4):
(4)
$4{\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{ОН}} + 2{\text{С}}{{{\text{О}}}_{2}} \to 3{\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СООН}} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}}.$Донором метильной группы может быть не только метанол. Так, было показано, что такой же механизм использует A. woodii при росте на бетаине (триметилглицин) (Lechtenfeld et al., 2018). В процессе участвует бетаинспецифическая метилаза, которая может переносить метильную группу от бетаина к тетрагидрофолату. Интересно, что донором метильной группы не может быть диметилглицин или триметиламин (Kremp et al., 2018).
Формиат является промежуточным продуктом в WLP-пути (рис. 1). Многие ацетогены могут расти на формиате. Процесс протекает по уравнению 5:
(5)
$4{\text{НСООН}} \to 2{\text{С}}{{{\text{О}}}_{2}} + {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СООН}} + {\text{2}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}}.$В этом процессе электроны, необходимые для восстановления одного формиата и СО2 до ацетата, получаются за счет окисления формиата до СО2 и Н2. Пока еще недостаточно сведений о ферментах, принимающих участие в этом процессе (Müller, 2019).
Интересно, что при росте многих ацетогенов на газовых субстратах в среде накапливаются значительные количества формиата (Groher, Weuster-Botz, 2016). Неясно, является ли экскреция в среду и обратное поглощение формиата частью нормального метаболизма ацетогенов. Так как формиат является промежуточным продуктом в пути WLP, а метанол образует также промежуточный продукт метил-THF, то при росте на этих субстратах клетка должна экономить энергию, которую она затратила бы на синтез этих промежуточных продуктов. Действительно, энергоэффективность при росте на метаноле и формиате выше, чем при росте на газовых субстратах. Энергоэффективность определяется как доля энергии, сохраненной в продукте от энергии заключенной в субстрате. Это можно определить по энергии, выделяемой при сгорании (Classen et al., 2019). При росте на газовых субстратах энергоэффективность ацетогенов (при образовании ацетата) составляет 60–80%, а при росте на метаноле и формиате – 80–90% (Cotton et al., 2020).
Метанол и формиат при высоких концентрациях ингибируют рост ацетогенов. Так, было показано, что при рН 5.0–6.0 рост C. ljungdahlii полностью ингибируется 30 мМ формиата Na, но при рН 7.0 рост возобновляется (Romio-Pujol et al., 2014). На примере ацетогена Sporomusa ovata было показано, что бактерии можно адаптировать к росту на повышенных концентрациях метанола, и это приводит к усилению конверсии СО2 в органические продукты (Tremblay et al., 2015).
МЕТАБОЛИТЫ, СИНТЕЗУРУЕМЫЕ ПРИ АВТОТРОФНОМ РОСТЕ АЦЕТОГЕНОВ
Многие ацетогены при росте на газовых субстратах синтезируют исключительно ацетат, но ряд представителей этой группы, наряду с ацетатом, производят и другие метаболиты, которые представляют практический интерес.
Такие ацетогены, как Clostridium ljungdahhlii, C. autoethanogenum, C. regsdalei способны к синтезу больших количеств этанола, который при некоторых условиях ферментации становится преимущественным продуктом. Эти же ацетогены в качестве минорных продуктов синтезируют 2,3-бутандиол (2,3BD) и лактат. Некоторые ацетогены, такие как Clostridium carboxidivorans, Eubacterium limosum способны к синтезу бутирата и бутанола (De Tissera et al., 2019).
Все перечисленные продукты представляют практический интерес, особенно этанол, который сегодня производится в мире из пищевого сырья (кукурузы, сахарного тростника, злаков) в количествах более 100 млрд л (около 80 млн т в год) и используется в качестве моторного биотоплива. Производство топливного этанола с использованием газовых субстратов представляет удачную альтернативу, так как позволяет уйти от использования пищевого сырья и приводит к фиксации такого парникового газа как СО2 (http://www.statista.com; Дебабов, 2012; Köpke et al., 2011a).
Биосинтез этанола из ацетил-СоА у ацетогенов возможен двумя путями: прямым – восстановлением из ацетил-СоА, и непрямым – восстановлением из ацетата (см. рис. 5).
Рис. 5.
Схема биосинтеза ацетата, этанола, 2,3-бутандиола, 2-бутанола и лактата у C. ljungdahlii и C. autoethanogenum. Ацетил-СоА и пируват служат исходными субстратами для синтеза всех других метаболитов и синтеза биомассы. AOR – ацетильдегид ферредоксин оксоредуктаза; PFOR – пируват ферредоксин оксоредуктаза; Als – ацетолактатсинтаза; LdhA – лактатдегидрогеназа; Pta – фосфоацетилтрансфераза; Ack – ацетилкиназа; AdhE – бифункциональный фермент ацетальдегид/алкогольдегидрогеназа; Aldc – ацетолактатдекарбоксилаза; ADH – первично-вторичная алкогольдегидрогеназа; BDH – (R,R)2,3-бутанолдегидрогеназа; DDH – (R,S)2,3-бутанолдегидрогеназа; 2-бутанон (метил-этил кетон МЕК).
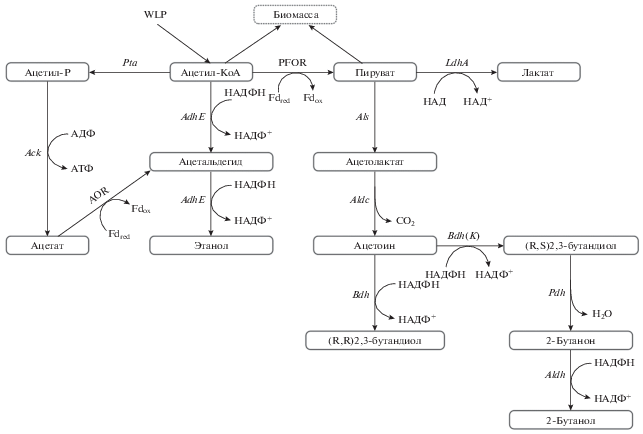
При прямом синтезе ацетил-СоА восстанавливается бифункциональным ферментом алкогольальдегиддегидрогеназой (AdhE), состоящим из двух субъединиц ацетил-СоА-зависимой альдегиддегидрогеназы (Ald) и алкогольдегидрогеназы (AdH). В этом синтезе расходуются два восстановительных эквивалента в виде NADPH.
Непрямой путь связан с восстановлением ацетата ацетальдегидферредоксин оксиредуктазой (AOR) в ацетальдегид и последующим его восстановлением алкогольдегидрогеназой в этанол. В реакции расходуется восстановленный ферредоксин и NADPH. Непрямая реакция энергетически выгоднее для клетки, так как в ходе синтеза ацетата образуется молекула АТФ.
Анализ геномов ацетогенов подтвердил наличие у них всех генов вышеперечисленных ферментов. Биохимическое подтверждение наличия AOR-активности и возможность непрямого пути биосинтеза этанола была постулирована для С. ljungdahlii (Köpke et al., 2011a) и C. autoethanogenum (Mock et al., 2015).
Соотношение этанола и ацетата сильно зависит от условий ферментации и, особенно, состава газовых субстратов. Биосинтез ацетата и этанола при росте на Н2/СО2 или СО происходит согласно уравнениям (1, 3, 6, 7) и сопровождается значительным уменьшением свободной энергии, т.е. термодинамически разрешен:
(1)
$\begin{gathered} 4{{{\text{Н}}}_{2}} + 2{\text{С}}{{{\text{О}}}_{2}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СО}}{{{\text{О}}}^{--}} + {{{\text{Н}}}^{ + }} + 2{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \\ \Delta {{G}^{{01}}} = - 95\,\,{\text{кДж}}, \\ \end{gathered} $(6)
$\begin{gathered} 6{\text{СО}} + {\text{3}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{С}}{{{\text{Н}}}_{{\text{2}}}}{\text{ОН}} + 4{\text{С}}{{{\text{О}}}_{2}} \\ \Delta {{G}^{{01}}} = - 224\,\,{\text{кДж}}, \\ \end{gathered} $(3)
$\begin{gathered} 4{\text{СО}} + {\text{2}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{СО}}{{{\text{О}}}^{--}} + {{{\text{Н}}}^{ + }} + 2{\text{С}}{{{\text{О}}}_{2}} \\ \Delta {{G}^{{01}}} = - 175\,\,{\text{кДж}}, \\ \end{gathered} $(7)
$\begin{gathered} 6{{{\text{Н}}}_{2}} + {\text{2С}}{{{\text{О}}}_{2}} \to {\text{С}}{{{\text{Н}}}_{{\text{3}}}}{\text{С}}{{{\text{Н}}}_{{\text{2}}}}{\text{ОН}} + {\text{3}}{{{\text{Н}}}_{{\text{2}}}}{\text{О}} \\ \Delta {{G}^{{01}}} = - 105\,\,{\text{кДж}}{\text{.}} \\ \end{gathered} $Рост на СО энергетически выгоднее, чем на Н2/СО2, что отражается прежде всего в том, что титр биомассы выше при росте на СО. Так, титр биомассы C. ljungdahlii при росте на СО/СО2 (80 : 20) составлял 8.4 OD600 (120 ч), а при росте на Н2/СО2 (60 : 40) только 1.84 (186 ч). В этих условиях при росте на Н2/СО2 клетки производят практически один ацетат, а при росте на СО/СО2–этанол (713 мM) и ацетат (188 мM) (Zhu et al., 2020).
При периодическом культивировании ацетогенов на синтез-газе обычно наблюдают две стадии: ацидогенез и сольватогенез (Richter et al., 2016; Arslan et al., 2019). На первой стадии синтезируется ацетат и происходит снижение рН среды, следствием чего является появление в растворе значительных концентраций недиссоциированной уксусной кислоты. Уксусная кислота проникает в клетку и ингибирует рост. Остановка роста приводит к появлению избытка восстановительных эквивалентов, которые реокисляются в процессе синтеза этанола на второй сольватогенной стадии. Интересно, что анализ экспрессии генов при переходе от ацетогенеза к сольватогенезу не показал заметных изменений, т.е. переход не регулируется на генетическом уровне. Регуляция осуществляется на уровне редокс-баланса и доступности АТФ, т.е. на термодинамическом уровне (Richter et al., 2016).
В качестве побочных продуктов этанолсинтезирующие ацетогены производят 2,3-бутандиол (2,3BD) и лактат, предшественником которых в клетке является пируват (рис. 5).
Представление о соотношении продуктов дает работа (Köpke et al., 2011b), в которой исследовали состав конечных продуктов при ферментации трех ацетогенов: С. ljungdahlii, C. autoethanogenum и C. regsdalei на синтетической смеси газов (44% СО2, 22% СО и 2% Н2). В конце ферментации концентрация ацетата составляла 28–32 мM, этанола 19–22 мM, 2,3BD – 1.4–2 мM и лактата 0.1–0.2 мM. Молярное отношение 2,3BD к ацетату было 1 : 15 и к этанолу 1 : 10 (Köpke et al., 2011b).
Пируват образуется из ацетил-СоА и СО2 с помощью пируват-ферредоксин оксиредуктазы (PFOR). Далее лактатдегидрогеназа (ldhA) восстанавливает пируват в лактат. Путь к 2,3BD начинается с конденсации двух молекул пирувата с образованием ацетолактата, который декарбоксилируется с образованием ацетоина. Ацетоин восстанавливается 2,3-бутандиолдегидрогеназой в 2,3BD (рис. 5).
Все гены, потенциально кодирующие вышеперечисленные ферменты, найдены в геномах ацетогенов. Лишь в относительно небольшом числе случаев была подтверждена функциональность этих ферментов. Так, с этой целью гены кандидаты были перенесены из C. autoethonogenum в E. coli. Было показано, что лактатдегидрогеназа экспрессируется в E. coli и образует лактат. Метаболический путь биосинтеза 2,3BD воссоздан в E. coli клонированием генов ацетолактатсинтетазы, ацетолактатдегидрогеназы и 2,3-бутандиолдегидрогеназы. Исследование последнего фермента показало, что этот NADPH-зависимый фермент обладает широкой специфичностью при восстановлении кетосоединений С2–С4 в соответствующие спирты. Фермент назван NADPH-зависимая первично-вторичная алкогольдегидрогеназа (CaADH). E. coli c реконструированным геномом при росте на фруктозе могли синтезировать 1.1 ± 0.2 мM 2,3BDO (Kӧpke et al., 2011), что сравнимо с его биосинтезом ацетогенами (см. выше) (Köpke et al., 2014).
К синтезу бутанола и бутирата способен ограниченный круг ацетогенов: C. carboxidivorans, C. deakei, C. scotologenes, C. regsdalei, Eubacterium limosum, Butyrobacterium methylotrophicum (Dürre, 2016).
Анализ геномов и биохимические данные говорят о том, что биосинтез бутанола и бутирата осуществляется у ацетогенов тем же путем, что и у сольватогенных бактерий, таких как Clostridium acetobutylicum (рис. 6). Биохимический путь начинается с объединения ферментом тиолазой (ThlA) двух молекул ацетил-СоА в ацетоацетил-СоА, который восстанавливается до 3-гидроксибутирил-СоА гидроксибутирил-СоА дегидрогеназой (Hbd). Далее кротоназа (Crt) дегидратирует 3-гидроксибутирил-СоА до кротонил-СоА, который восстанавливается до бутирил-СоА соответствующей дегидрогеназой (Bcd).
Рис. 6.
Биосинтез бутанола у ацетогенов. Thl – тиолаза; Hbd – гидроксибутирил-СоА дегидрогеназа; Crt – кротоназа; Bcd – бутирил-СоА дегидрогеназа в комплексе с бифуркационным комплексом двух флавопротеинов EtfA/EtfB; BalH – бутирилальдегиддегидрогеназа; Bdh – бутирилалкогольдегидрогеназа (у C. autoethanogenum BalH и Bdh заменены одним бифункциональным ферментом AdhE2); AcT – ацетил-СоА трансфераза; Ptb – фосфотрансбутирилаза; Buk – бутирилкиназа; BAOR – бутирилальдегид оксиредуктаза. ⊗ – Инактивация генов в рекомбинантных штаммах.
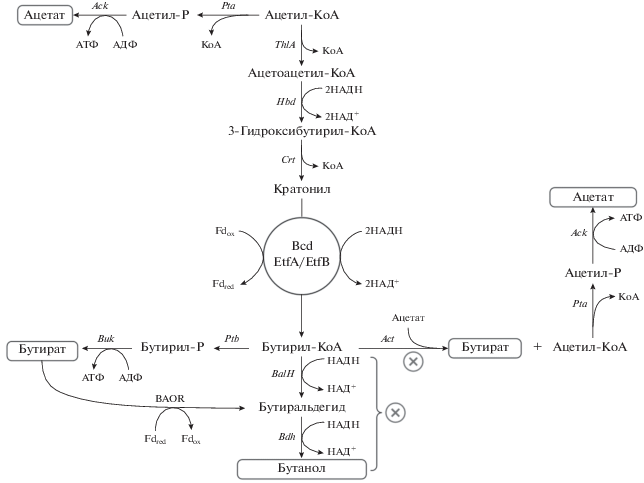
Бутирил-СоА может далее превращаться либо в бутанол, либо в бутират (рис. 6). Превращение в бутанол осуществляется последовательным восстановлением в бутиральдегид и бутанол. У Clostridium acetobutylicum обе реакции катализируются бифункциональным ферментом альдегид-алкогольдегидрогеназой (AdhE2), использующей в качестве кофактора NADH.
Бутирил-СоА может превратиться в бутират двумя путями (рис. 6): либо ацетил-СоА трансфераза превращает его в бутират и ацетил-СоА, либо фосфотрансбутирилаза превращает его в бутирил фосфат и бутират киназа в бутират. В последней реакции образуется 1 моль АТФ. При превращении ацетил-СоА в ацетат также образуется 1 моль АТФ (рис. 1), так что оба пути с энергетической точки зрения равнозначны. Бутират может быть восстановлен в бутанол через бутиральдегид (ферредоксиноксиредуктазой) и бутирилалкогольдегидрогеназой аналогично биосинтезу этанола у ацетогенов (рис. 5).
Помимо бутанола, некоторые ацетогены, например, C. carboxidivorans, способны синтезировать и гексанол. Титры бутанола и бутирата обычно невысоки, и были предприняты попытки оптимизировать этот процесс. Было показано, что низкие значения рН (6–4.5) и температуры (–25°С) способствуют биосинтезу бутанола. Тем не менее, максимальные выходы бутанола не превышают 14–15 мM бутанола и 8–9 мM гексанола (Rajagopalan et al., 2002; Phillips et al., 2015; Romio-Pujol et al., 2015, 2018), что значительно ниже титров, полученных при ферментации сольватогенных клостридий.
Учитывая привлекательность микробиологического синтеза ценных химикалиев на базе восстановления СО2, были предприняты значительные усилия как по совершенствованию процесса ферментации с использованием газовых субстратов, так и по генетическому совершенствованию продуцентов ацетогенных бактерий.
ГЕНЕТИКА АВТОТРОФНЫХ АЦЕТОГЕНОВ
Для реализации полного биотехнологического потенциала газовой ферментации с использованием ацетогенов необходимо произвести генетические изменения в геномах этих микроорганизмов. Цель таких изменений может заключаться в перенаправлении потока углерода к нужному метаболиту или даже в организации новых биохимических путей для расширения спектра продуктов, синтезируемых ацетогенами.
Для успешного применения методологии метаболической инженерии необходимы два условия: 1) иметь хорошо обоснованные цели (целевые гены), которые следует активировать или инактивировать или внести новые гетерологичные гены и 2) иметь генетические технологии, позволяющие эффективно вносить в геном мутации, делеции и вставки.
Расшифровка геномных последовательностей большого числа ацетогенов, изучение метаболических путей, в особенности механизмов консервации энергии, сделали возможным определение целевых генов, подлежащих изменениям (Humphreys et al., 2015; Shin et al., 2016).
За последние 15 лет достигнуты определенные успехи в развитии генетических технологий применительно к автотрофным ацетогенам, хотя до сих пор эффективность этих методов недостаточно высока. На пути развития таких технологий возникает ряд трудностей. Во-первых, толстая стенка этих бактерий затрудняет доставку ДНК, что делает малоэффективными такие методы трансформации, как электропорация. Во-вторых, очень активные системы рестрикции разрушают трансформированную ДНК. В третьих, самое главное препятствие – низкие частоты гомологичной рекомбинации, что требует специальных приемов обнаружения редких генетических событий.
Первая достаточно эффективная технология для бактерий рода Clostridium была развита в 2005–2007 гг. и была основана на инактивации генов транспозонным мутагенезом. Технология получила название ClosTron (Heap et al., 2010) и основана на использовании интронов группы II. Интроны группы II – это каталитическая РНК, которая вырезает себя из РНК транскрипта и внедряется в новый сайт. В одной рамке считывания с интроном II кодируется белок LtrA. Этот белок имеет много функций: определяет РНК сплайсинг, участвует в распознавании сайта интеграции, никирует ДНК-мишень и внедряет сплайсированную РНК молекулу и, наконец, синтезирует соответствующую комплементарную нить ДНК путем обратной транскрипции. После этого ферменты хозяина удаляют РНК и лигируют разрыв.
Распознавание мишени осуществляет РНП-комплекс (LtrA-белок + РНК). За узнавание отвечают 15 нуклеотидов РНК, которые можно менять для направления транспозиции на определенный участок хромосомы, но возможны только такие изменения последовательности, которые сохраняют структуру комплекса. Существует доступ через интернет к специальному алгоритму, который позволяет определить последовательность РНК для направления транспозиции в желаемую область. Собственно этот алгоритм и называется ClosTron. Недостатком метода является то, что не для каждого гена можно подобрать подходящую последовательность РНК и то, что внедрение транспозона имеет сильный полярный эффект.
Недавно описан другой метод, основанный на транспозиции и конъюгации и позволяющий вносить в геном Clostridium ljungdahlii большие фрагменты ДНК, кодирующие целые метаболические пути (Phillips et al., 2019). Метод использует конъюгативный перенос плазмид между E. coli и Clostridia и свойства транспозона Himar. Этот транспозон фланкирован обращенными повторами длиной в 27 п.н., которые служат мишенями транспозазы (ген HI). В ходе конъюгативного переноса преодолеваются рестрикционные барьеры, так как ДНК входит в реципиентную клетку в одноцепочечной форме и успевает правильно метилироваться. Кластер, предназначенный для внедрения в хромосому, располагается на конъюгативной плазмиде и ограничен инвертированными повторами. На той же плазмиде находится ген HI под контролем индуцибильного промотора (в качестве индуктора используют ксилозу). Включение в хромосому идет неспецифически по АТ последовательностям, причем возможны множественные интеграции. В качестве примера авторы перенесли в C. ljungdahlii кластер биосинтеза ацетона размером 11 т.п.о. из C. acetobutylicum (Phillips et al., 2019).
Недостатком метода является неспецифическое встраивание в геном. Процесс конъюгации между E. coli и Clostridia плохо изучен и занимает от 2 суток до недели. Практическую полезность этого метода еще предстоит оценить.
Достаточно давно были описаны шаттл-плазмиды, способные поддерживаться в E. coli и Clostridia, и трансформация в Clostridia методами электропорации или конъюгации. Однако частоты электропорации в первых попытках были низкими – около 103 колоний на мкг плазмидной ДНК (Strätz et al., 1994). Впоследствии протокол электропорации был улучшен. Компетентность клеток повышается после их экспонирования в средах, содержащих DL-треонин. Частота электропорации была увеличена на порядок до 1.7 × 10–4 колоний на один мкг плазмидной ДНК (Leang et al., 2013).
Стандартные для микроорганизмов методы делеции и вставки генетического материала посредством гомологичной рекомбинации в случае Clostridia имеют низкую эффективность. Требуются приемы мощной контрселекции для обнаружения редких событий. Предложено несколько способов контрселекции для этих микроорганизмов, но, очевидно, что самый удобный способ – CRiSPR/Cas система (McAllister, Sorg, 2019).
Главное преимущество CRiSPR/Cas системы – это возможность направить нуклеазу CaS практически в любую точку генома, где она произведет двойной разрыв ДНК. Бактерии не имеют систем репарации двойного разрыва, и только гомологичная рекомбинация в области разрыва может спасти бактерию от гибели.
Система CRiSPR/Cas9 была успешно применена для делетирования генов у C. ljungdahlii. Эффективность делеции четырех генов pta, adhE, ctf и pyrE составила, соответственно, 100, 75, 100 и 50% (Huang et al., 2016). Система CRiSPR/Cas9 также была использована для редактирования генома промышленно значимого ацетогена C. aтыutoethanogenum (Nagaraju et al., 2019), которая, кстати, имеет и собственную CRiSPR/Cas систему (Brown et al., 2014). В качестве объекта был использован ген 2,3-bdh, делеция которого осуществляется с 50% эффективностью (Nagaraju et al., 2019).
Род Clostridia характеризуется высоким содержанием в геноме АТ-пар (для C. ljungdahlii – 69.8%). В этой связи кажется более целесообразным использовать не систему CRiSPR/Cas9, для которой протоспейсер имеет последовательность GGN, а CRiSPR/Cas12, для которой протоспейсер TTN. Действительно, CRiSPR/Cas12 система успешно использована для делеций гена pyrE (opaтофосфорибозинтрансфераза) (Zhao et al., 2019). Данная работа хорошо иллюстрирует все преимущества и трудности использования CRiSPR систем. Успех и применение CRiSPR системы зависят от эффективности гомологичной рекомбинации клетки хозяина. Частоты гомологичной рекомбинации у C. ljungdahlii низкие, и для ее осуществления нужны плечи гомологии размером в 1000 п.о., а еще лучше и более длинные. В приведенной работе авторы усовершенствовали протокол электропорации, позволивший повысить эффективность трансформации плазмидами до 104 колоний на 1 мкг ДНК плазмиды. При оптимизированных условиях с использованием плеч гомологии в 1000 п.о. авторы получили 2–3 рекомбинанта в опыте и 10–17 рекомбинантов при увеличении плеч гомологии до 2500 п.о. Преимуществом метода является его высокая специфичность. При анализе 15 из 17 колоний рекомбинантов содержали ожидаемые вставки (Zhao et al., 2019).
Для успешного осуществления задач метаболической инженерии большое значение имеет наличие набора плазмид с нужными репликонами, промоторов разной силы, как конститутивных, так и индуцированных, терминаторов транскрипции, селективных и контрселективных маркеров. Такие конструкции созданы и для бактерий рода Clostridia, но, конечно, не в столь больших и совершенных формах, как для E. coli (Joseph et al., 2018).
МЕТАБОЛИЧЕСКАЯ ИНЖЕНЕРИЯ
Метаболическая инженерия может быть использована как для оптимизации производства метаболитов, нативных для ацетогенов, таких как ацетат, этанол, 2,3-бутандиол, так и для создания рекомбинантных штаммов, способных производить метаболиты, не свойственные ацетогенам, такие как ацетон, пропанол, 3-гидроксибутират и полигидроксибутират (Bengelsdorf, Dürre, 2017).
Ацетон
Ацетон относится к крупнотоннажным химикатам, его мировое производство превышает 5 млн т в год (Schiel-Bengelsdorf, Dürre, 2012). В настоящее время ацетон производят на базе углеводородного сырья, но в первой половине XX века большая часть ацетона, а также бутанола производилась микробиологическим путем в так называемом АBЕ-процессе (ацетон, бутанол, этанол). АBЕ-процесс использовал в качестве сырья пищевой продукт (мука злаков или кукурузы), и было бы заманчиво реанимировать процесс на новом уровне с использованием ацетогенов и такого сырья, как синтез-газ. ABE-процесс был основан на близких к ацетогенам микроорганизмах – сольватогенных клостридиях.
Было предпринято несколько попыток переноса пути биосинтеза ацетона из сольватогенных в ацетогенные клостридии. Все попытки были основаны на переносе оперона синтеза ацетона из Clostridium acetobutylicum (ASO-оперон). Этот оперон состоит из четырех генов (см. рис. 7). На первом этапе тиолаза (thl) конденсирует две молекулы ацетил-CoA с образованием ацетоацетил-CoA. Далее фермент, состоящий из двух субъединиц (ctfA/ctfB) ацетоацетил-CoA-ацетат/бутирил-CoAтрансфераза, используя ацетат как косубстрат, превращает ацетоацетил-CoA в ацетил-CoA и ацетоацетат. На последней стадии декарбоксилаза (ade) отщепляет молекулу СО2 от ацетоацетата и образует ацетон.
Рис. 7.
Схема биосинтеза ацетона и полигидроксибутирата (PHA). Thl – тиолаза; Tel1 (ybgl) – тиоэстеразы из B. subtilis и Haemophilus influenza соответственно; Pta –трансацетилаза; Ack – ацетаткиназа; ctfA/ctfB – ацетоацетил-СоАацетат/бутирил-СоА трансфераза; Adc – ацетоацетилдекарбоксилаза. Гены биосинтеза PHA перенесены из Cupriavidas necator; phaA – 3-кетотиолаза; phaB – НАДФ-зависимая ацетоацетил-СоА редуктаза; phaC – PHA синтаза; Btc – бутирилтиоэстераза.
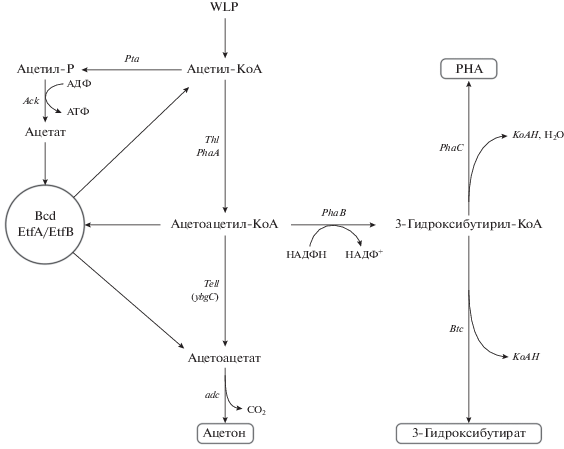
Синтез ацетона не требует затрат АТФ, но и не производит АТФ, в отличие от биосинтеза ацетата, который генерирует АТФ. Таким образом, аутотрофный рост ацетогенов при биосинтезе ацетона может происходить только при одновременном синтезе ацетата, поставляющего клеткам энергию.
Объектами метаболической инженерии были различные ацетогены. Так ASO-оперон под контролем промотора тиолазы (Pthl) был интегрирован в плазмиду (pJMP), и плазмида была трансформирована в Clostridium aceticum. Рекомбиантный штамм при росте на фруктозе синтезировал 9 мг л–1 ацетона, а при росте на газовой смеси СО2/Н2 – до 8 мг л–1 (Schiel-Bengelsdorf, Dürre, 2012).
Acetobacterium woodii, трансформированные плазмидой с ASO-опероном под контролем промотора Ppta-ack той же бактерии, оказались способными к синтезу ацетона при культивировании на синтез-газе. При периодическом культивировании (350 ч) концентрация ацетона достигала 15.2 мM (~800 мг л–1), а продуктивность – 26.4 мг л–1 ч–1 (Hoffmeister et al., 2016).
У рекомбинантных бактерий C. ljungdahlii и очень близкой к ней C. autoethanogenum вместо ацетона или наряду с ним синтезируется продукт его восстановления 2-пропанол (изопропанол), вследствие наличия у этих бактерий очень активной алкогольдегидрогеназы широкой специфичности (Köpke et al., 2014).
Продукция ацетона сильно зависит от промотора, который используется для экспрессии ASO-оперона. Так C. ljungdahlii не синтезирует ацетон после трансформации плазмидой с ASO-опероном под контролем промотора тиолазы C. acetobutylicum, но синтез обнаружен в случае, если ASO-оперон находится под контролем промотора Ppta-ack бактерий C. ljungdahlii. Правда, почти весь ацетон конвертируется в 2-пропанол, и количество продукта невелико (1.4 ± 0.5 мM) (Bengelsdorf et al., 2016).
Лучшие результаты получены при использовании индуцибельных промоторов. Так, трансформация C. ljungdahlii ASO-опероном под контролем индуцируемого лактозой промотора Plac привело к синтезу значительного количества ацетона, как при гетеротрофном росте на фруктозе, так и при автотрофном росте на углекислом газе. Концентрация ацетона при газовой ферментации составила ~15.2 мM (Banerjee et al., 2014). Неясно, почему в данной работе не обнаружен 2-пропанол, хотя он детектирован во всех последующих работах. Возможно, газовая хроматография, используемая авторами, не разделяла две субстанции – ацетон и 2-пропанол.
Запатентован штамм C. autoethanogenum с производительностью 300 мг л–1 ацетона и 25 мг л–1 2‑пропанола (Patent US, 2012).
Во всех вышеперечисленных случаях речь шла о штаммах, несущих ASO-оперон на плазмидах, но с использованием транспозона Himar (Phillips et al., 2019) удалось интегрировать ASO-оперон в хромосому C. ljungdahlii. Оперон находился под контролем промотора, индуцируемого ксилозой. Периодическое культивирование этого штамма на синтез-газе приводит к образованию смеси 2.4 мM ацетона и 2.4 мM изопропанола (Phillips et al., 2019).
Интересна попытка заменить зависимый от ацетата путь превращения ацетоацетил-CоА в ацетоацетил на путь, независимый от ацетата. С этой целью на плазмиде были клонированы гены тиоэстераз Bacillus subtilis (teII) и Haemophilus influenzae (ybgC), кодирующие белки, способные отщеплять СоА от ацетоацетил-СоА. Таким образом, был создан путь биосинтеза ацетона, неизвестный в природе (Patent Germany, 2007; Schiel-Bengelsdorf, Dürre, 2012).
РНВ (полигидроксибутират) – биодеградируемый полиэфир, который служит для некоторых бактерий резервным депо для хранения углерода и энергии (как крахмал для растений). РНВ накапливается внутри клеток в виде гранул иногда в очень больших количествах (до 70–80% от сухого веса клеток).
Одной из подробно изученных бактерий, синтезирующих РНВ, является Cupriavidas necator (прежнее название Ralstonia eutropha). Ацетогены не способны к синтезу РНВ. Для организации такого синтеза оперон биосинтеза РНВ, состоящий из трех генов из Cupriavidas necator, был перенесен на плазмиде в C. autoethanogenum. Оперон был предварительно модифицирован с учетом частоты использования кодонов у Clostridia и помещен под контроль нативного промотора одного из генов WLP пути (Lemgruber et al., 2019).
Путь биосинтеза РНВ приведен на рис. 7. Рекомбинантный штамм C. autoethanogenum был исследован на его способность синтезировать РНВ в проточной равновесной ферментации на газовых смесях, имитирующих синтез-газ (50% СО, 20% СО2, 20% Н2 и 10% аргона) и отходящие газы металлургического производства (50% СО2, 20% СО, 2% Н2 и 28% N2), при разных скоростях протока и разных значениях рН. Лучшие результаты были получены при росте на синтез-газе и при рН 5.5. Интересно отметить, что сдвиг рН от 5.0 до 5.5 увеличивает синтез РНВ в 10 раз. Максимальное содержание РНВ составило 5.6% на вес сухих клеток. Синтез РНВ приводит к падению синтеза ацетата, что, в свою очередь, вызывает недостаток АТФ в клетке. Авторы провели сравнение транскриптомов рекомбинантного штамма и контрольного, содержащего плазмиду без РНВ-оперона. Оказалось, что рекомбинантные клетки увеличивают транскрипцию всех генов, участвующих в синтезе АТФ. Это гены Rnf-комплекса (активация в 2 раза), гены WLP пути (активация в 2 раза), а также гены аргинин деиминазного пути деградации аргинина (в 3–7 раз), служащего у ацетогенов альтернативным путем синтеза АТФ (Nelson et al., 2017).
Получены рекомбинантные штаммы, синтезирующие РНВ у C. coskata и C. ljungdahlii, но содержание полимера у них при ауксотрофном росте невелико (около 1% в расчете на вес сухих клеток) (Flücher et al., 2019).
При отсутствии в клетке фермента, полимеризующего 3-гидроксибутирил-СоА, это соединение под действием эстераз клеток превращается в 3-гидроксибутират. В недавней работе (Karim et al., 2020) биосинтез 3-гидроксибутирата был использован в качестве примера для опробирования нового подхода к конструированию полезных штаммов микроорганизмов. Так как генетические инструменты часто малодоступны или малоэффективны для промышленных штаммов, авторы предложили проводить предварительную оптимизацию биохимических путей в системе in vitro (в бесклеточных экстрактах). Использовались лизаты клеток E. coli, в которые в определенной пропорции добавляли лизаты клеток E. coli, экспрессирующие определенные ферменты исследуемого пути. Метод получил название IPROBE (In vitro prototyping and rapid optimization of biosynthetic enzyme). Авторам удалось подобрать соотношение ферментов двух первых этапов на пути биосинтеза 3-гидроксибутирата (Thl и Hbd) (см. рис. 7). На базе полученных данных был сконструирован штамм C. autoethanogenum, который при росте на синтез-газе мог синтезировать до 15 г/л 3-гидроксибутирата со скоростью 1.5 г л–1 ч–1, что намного превосходит ранее полученные результаты не только для ацетогенов, но и для E. coli (Karim et al., 2020).
Бутанол и бутират
Бутанол относится к крупнотоннажным химикалиям. Его мировое производство составляет около 3.5 млн тонн в год (Patent WO, 2014). Подавляющее количество бутанола сегодня производят из углеводородов, хотя в первой половине прошлого века использовался микробиологический процесс АВЕ (ацетон, бутанол, этанол).
Некоторые ацетогены, такие как Clostridium carboxidivorans, способны синтезировать, наряду с уксусной кислотой и этанолом, и бутанол и даже гексанол (De Tissera et al., 2019). Оптимизация процесса (состав газовой смеси, рН, состав сред) позволяют повысить содержание высших спиртов в конечном продукте. Так, в работе (Phillips et al., 2015) удалось получить в конце ферментации 14.7 мM бутанола, 9.2 мM гексанола и 70.5 мM этанола. Эти показатели значительно уступают АВЕ процессу, что привело к попыткам использования методов метаболической инженерии для улучшения процесса. Объектом исследования стали бактерии C. ljungdahlii, которые сами по себе не синтезируют бутанол, но эти бактерии лучше других ацетогенов изучены и адаптированы к генетическим модификациям.
Бактерии C. ljungdahlii были трансформированы плазмидой (методом электропорации), которая содержала в своем составе оперон биосинтеза бутанола из сольватогенной бактерии C. acetobutylicum. Оперон содержал 6 генов под контролем промотора фосфотрансбутирилазы Pptl (гены оперона и биохимические реакции см. на рис. 6). Рекомбинантные бактерии синтезировали бутанол. В середине фазы роста (OD600 = 0.6) концентрация бутанола составляла 0.2 мM, однако в конце ферментации бутанол отсутствовал. Скорее всего, он трансформировался в бутират (концентрация 0.6–0.8 мкМ) (Köpke et al., 2010).
Как при синтезе ацетата, так и при синтезе бутирата образуется АТФ. Однако при синтезе ацетата образуется 1 моль АТФ на моль ацетата и только 0.5 моля АТФ при синтезе бутирата (см. рис. 6). Энергетический расчет показывает, что недостающая энергия может поступать из бифуркационного комплекса, в который входит бутирил-СоА дегидрогеназа (BclH) и два флавопротеина (EffA и EffB). Этот комплекс генерирует восстановленный ферредоксин, который далее может генерировать дополнительно АТФ через ионный мембранный градиент (Dürre, 2016).
В последующих работах в бактерии C. ljungdahlii и C. autoethanogenum вводили не только оперон биосинтеза бутанола, но и гены, кодирующие флавопротеины. Рекомбинантный штамм C. a-utoethanogenum был способен синтезировать 25.7 мM бутанола и 3.7 мM бутирата (Patent WO, 2012), что выше, чем у природного продуцента C. carboxidivorans (около 15 мM) (Phillips et al., 2015).
В целом, применение метаболической инженерии не привело к заметному увеличению синтеза бутанола рекомбинантными штаммами по сравнению с природными ацетогенными продуцентами.
Лучшие результаты продемонстрированы при конструировании штаммов-продуцентов бутирата. Бутират (масляная кислота) не является крупномасштабным химическим продуктом, но находит достаточно широкое применение в химической, пищевой и косметической промышленности. Схема реакций биосинтеза бутирата приведена на рис. 6. В работе (Ueki et al., 2014) описано конструирование штамма на основе C. ljungdahlii. В штамм ввели две плазмиды с генами из C. acetobutylicum. На одной плазмиде находились гены ptb и buk, а на другой гены thl, hbd, crt, bcd, etffA и etffB (см. рис. 6). На той и другой плазмидах гетерологичные гены находились под контролем промотора pta (Ppta) бактерий C. ljungdahlii. Такой рекомбинантный штамм синтезировал ацетат, этанол и бутират при росте как на фруктозе, так и на смеси газов (H2/CO2 или СО). Во всех случаях доминирующим продуктом был ацетат, но значительная часть углеродного субстрата оказывалась в составе бутирата (13% при росте на Н2/СО2 и 25% при росте на СО) (Ueki et al., 2014).
Транскрипционный анализ рекомбинантного штамма показал высокую экспрессию РНК всех гетерологичных генов. Протеомный анализ подтвердил высокий уровень синтеза всех этих белков, кроме кротоназы (Crt). Модификация сайта связывания с рибосомой (RBS) этого гена увеличила синтез кротоназы и привела к некоторому увеличению синтеза бутирата.
Была предпринята попытка интегрировать гетерологичные гены в хромосому C. ljungdahlii. Авторам удалось интегрировать гены ptb и buk двойным кроссовером. Однако встроить в хромосому таким путем более длинный фрагмент из шести генов не удалось. Фрагмент был встроен в хромосому единичным кроссовером (с включением плазмиды) по сайту pta промотора. Штаммы с интегрированными в хромосому генами росли несколько быстрее плазмид-содержащих штаммов, но синтез бутирата заметно не увеличился.
Интересно отметить, что интеграция прошла по сайту (с его инактивацией), но синтез ацетата не только не прекратился, он оставался главным продуктом, что предполагает наличие других путей его биосинтеза. Данные результаты демонстрируют ограниченность возможностей генетических манипуляций с ацетогенами и недостаток наших знаний о биохимии и физиологии этих микроорганизмов.
Для усиления синтеза бутирата в штамме были интактивированы гены adhE (альдегид/алкоголь дегидрогеназа) для перекрытия пути превращения бутирил-СоА в бутанол и act (ацетил-СоА трансфераза) для блокировки образования ацетата из бутирил-СоА. Конечный штамм направлял большую часть углерода субстрата на синтез бутирата. Выход бутирата по углероду составлял при росте на фруктозе 71%; на СО – 71% и на Н2/СО2 – 42% (Ueki et al., 2014).
Интересным подходом к получению бутирата и бутанола является совместное культивирование (ко-культивирование) различных клостридий, растущих на синтез-газе. Так, было показано, что Clostridium kluyveri при росте на ферментационной жидкости, содержащей ацетат и этанол, синтезирует С4–С6 карбоновые кислоты (бутират и капронат) по механизму обращенного пути β-окисления жирных кислот (Spirito et al., 2014).
Совместное культивирование C. ljungdahlii и C. kluyveri в непрерывной ферментации на синтез-газе в оптимальных условиях привело к синтезу 40 мM/сут/л капроната с эффективностью по углероду 90% (Gildemyn et al., 2017).
Накопление жирных кислот приводит к закислению среды и ингибированию роста и метаболической активности ацетогенов. Интересно, что можно найти узкий интервал рН, при котором образовавшиеся в процессе жирные кислоты будут восстанавливаться в соответствующие спирты – бутанол, гексанол и октанол (Richter et al., 2016a).
Описанные в литературе выходы спиртов невелики, но оптимизация условий культивирования (или разделения процесса на две последовательные стадии), подбор оптимальных пар штаммов и применение метаболической инженерии могут принципиально улучшить результаты (Jiang et al., 2018).
Метаболиты, синтезируемые из пирувата
У ацетогенов 2,3-бутандиол и лактат являются нативными метаболитами, синтезируемыми в клетке из пирувата (рис. 5) (Köpke et al., 2014).
Мировой рынок 2,3-бутандиола превышает 40 млрд долларов (Dürre, Eikmanns, 2015). Фирма “LanzaTech” разрабатывает процесс получения 2,3-бутандиола путем ферментации C. autoethanogenum и/или C. ljungdahlii при росте их на СО-содержащих газах (http://www.chemicals). Исследователи этой фирмы разработали и запатентовали штаммы C. autoethanogenum и C. ljungdahlii, производящие метил-этил кетон (бутанон-2) и 2-бутанол – метаболиты, которые не синтезируются ацетогенами естественным путем.
Следует отметить, что 2,3-бутандиол в силу наличия двух ассиметричных атомов углерода может существовать в трех изоформах: (R,R)-2,3-бутандиол; (S,S)-2,3-бутандиол и в мезоформе (RS)-2,3-бутандиол. Ацетогены синтезируют (RR) изомер, тогда как для биосинтеза метил-этил кетона (МЕК) и 2-бутанола нужен (RS) изомер.
Для осуществления нового пути ген (R,R)-2,3-бутандиол дегидрогеназы был инактивирован, и в ацетогены ввели три новых гена: R,S-2,3-бутанолдегидрогеназу, пропил-глицеролдегидратазу и ген, кодирующий белок, реактивирующий дегидротазу под контролем промотора Ppta/ack. Гетерологичные гены были взяты из бактерии Klebsiela pneumonia и состав их кодонов был оптимизирован. Бактерии С. autoethanogenum, трансформированные плазмидой, содержащей вышеприведенные гены, способны синтезировать небольшие количества 2-бутанола при росте на газовой смеси (44% СО; 32% N2; 22% СО2 и 2% Н2). Культуральная жидкость в конце ферментации содержала 2.97 ± 0.115 г л–1 ацетата; 1.33 ± 0.06 г л–1 этанола и лишь 13.33 ± 1.53 мг л–1 2-бутанола.
Интересно отметить, что рекомбинантные бактерии способны катализировать трансформацию МЕК в 2-бутанол. Так, к бактериям, растущим на газе вышеприведенного состава, в середине лаг-фазы добавляли МЕК в концентрации 5 г л–1 и в конце ферментации наблюдали почти 100% трансформацию его в 2-бутанол (Patent US, 2018).
Метаболическая инженерия может быть направлена не только на конструирование продуцентов новых метаболитов, но и на улучшение биосинтеза веществ, являющихся природными продуктами биосинтеза ацетогенов, таких как этанол и ацетат.
Так, было показано, что инактивация гена альдегид/алкоголь дегидрогеназы (AdhE) у С. autoethanogenum увеличивает синтез этанола на 180% (Liew et al., 2017). Очевидно, что весь поток углерода идет теперь через ацетат, увеличивая обеспеченность клетки АТФ (см. рис. 1).
Другой пример – это усиление синтеза ацетата бактериями Acetobacterium woodii. Были клонированы и сверхэкспрессированы гены фосфотрансацетилазы и ацетаткиназы, а также 4 THF-зависимых гена WLP-пути. Рекомбинантный штамм при периодическом культивировании на смеси Н2/СО2 синтезировал до 50 г л–1 ацетата при низкой концентрации биомассы (1.5–2 г л–1 на вес сухой биомассы) (Straub et al., 2014).
Метаболическая инженерия может помочь и в улучшении технологических свойств штаммов-продуцентов. Так, два близкородственных и широко используемых ацетогена C. ljungdahalii и С. autoethanogenum являются природными ауксотрофами и требуют для роста добавки в среду витаминов – пантотената, тиамина и биотина. Геномный анализ показал, что у этих бактерий отсутствует три гена, необходимых для синтеза пантотената, и пять генов, необходимых для синтеза биотина (Annan et al., 2019). Для восстановления прототрофности на плазмидах были клонированы кластеры генов panBCD, кодирующих синтез пантотената у C. acetobutylicum и гены биосинтеза тиамина thicC-purF – оперона из C. regsdale. Трансформация плазмид в бактерии C. autoethanogenum восстанавливает прототрофность по пантотенату и тиамину.
Для восстановления прототрофности по биотину на плазмидах клонировали два кластера генов биосинтеза биотина bioBDF и bioHCA из бактерий Desulfomaculum nigrificans. Важно отметить, что авторам удалось интегрировать гены биосинтеза витаминов в хромосомы C. ljungdahlii и С. au-toethanogenum, создав удобные для промышленного использования штаммы (Annan et al., 2019).
БИОТЕХНОЛОГИЧЕСКИЙ ПОТЕНЦИАЛ АЦЕТОГЕНОВ
Газовая ферментация
Существует ряд объективных трудностей, которые необходимо преодолеть для реализации замечательных свойств ацетогенов в промышленности.
Одной из таких трудностей при газовой ферментации является низкая растворимость СО и Н2 в воде, что приводит к плохому массообмену и, следовательно, к замедлению процессов. Очевидным способом преодоления этой трудности является повышение давления, что увеличивает растворимость газов (Van Hecke et al., 2019).
Вторая трудность связана с медленным ростом ацетогенов, что преодолевается либо возвратом биомассы, либо использованием мембранных биореакторов, задерживающих биомассу в непрерывном процессе. Другой подход для решения этой проблемы – использование реакторов с иммобилизованными клетками. Хотя такие приемы усложняют и удорожают технологию, но они могут привести к ускорению процесса и к увеличению выхода продукта. Так, использование реактора с иммобилизованными клеткам при ферментации C. aceticum на смеси СО2/Н2 приводит к синтезу ацетата с выходом 96% при скорости синтеза 14 мМ л–1 ч–1 (Riegler et al., 2019).
Разновидностью реактора и использованием иммобилизованных клеток является реактор, представляющий собой колонку с полыми волокнами из полупроницаемых мембран. Бактерии образуют на поверхности волокон биопленку, а газы и жидкости циркулируют внутри полых волокон и во внешнем контуре.
Для газовой ферментации использовали почти все известные типы реакторов. Бóльшая часть исследований выполнена на ферментерах с механической мешалкой (Continuous stirred-tank reactor – CSTR). В этом типе ферментеров удобно контролировать рН, температуру, состав сред и скорость подачи субстратов, но большие энергетические затраты на перемешивание затрудняют использование этих аппаратов в промышленности, особенно при получении таких недорогих продуктов как ацетат или этанол.
Наиболее дешевым и легко масштабируемым реактором является колонка, через которую пробулькивают (барботируют) пузырьки газа (Bubble column reactor – BCR). В промышленности популярны аппараты, где струя газа используется для перемешивания (циркуляции) жидкости (Air-lift reactor) (Stoll et al., 2020).
Важным условием успеха газовой ферментации является отсутствие примесей в газовых см-есях.
Так как ацетогены являются строгими анаэробами, желательно полное отсутствие кислорода в газовой смеси, что не всегда легко достигается. Для устранения примесей кислорода предложена ко-культивация ацетогенов с карбоксидотрофами. Так, культивирование C. ljungdahlii с водородокисляющей бактерией Paregeodacillus thermoglucosidasis на смеси газов, содержащих СО2, СО, Н2 и О2 привело к успешному синтезу ацетата с выходом 63% (Mohr et al., 2019).
Синтез-газ можно получать при газификации любых углеродсодержащих субстанций, начиная от природного газа, нефти, угля, древесины и кончая муниципальным мусором. Синтез-газ, полученный из таких субстанций, часто (кроме основных компонентов СО, СО2, Н2, N2) содержит минорные примеси, такие как Н2S, NH3, HCN. Некоторые из перечисленных примесей могут отрицательно влиять на процессы газовой ферментации. Так, маленькая компания “INEOS-BIO” в 2013 г. построила в штате Флорида (США) пилотный завод проектной мощностью около 20 тыс. тонн в год этанола из синтез-газа. В качестве сырья для получения синтез-газа использовались отходы деревопереработки. В конце 2013 г. компания сообщила о трудностях проведения процесса из-за наличия в составе синтез-газа синильной кислоты (HCN). Фирма объявила о реконструкции производства с целью очистки синтез-газа, но завод так не приступил к промышленному производству (http://biomassmagazin).
В будущем, при падении цен на электричество из возобновляемых источников, основным сырьем для ацетогенов может стать синтез-газ, получаемый электролизом воды в присутствии СО2, который не будет содержать токсичных примесей.
Недавно ученые фирмы “Siemens” предложили использовать для электрохимического получения синтез-газа промышленный электролизер с серебряным газо-диффузионным катодом, который применяется в хлор-щелочном производстве. Продемонстрирована успешная работа в течение 1200 ч непрерывной работы с плотностью тока 300 мA см–2. Важно отметить, что полученный синтез-газ имел низкое содержание кислорода (⪡100 ppm) (Haas et al., 2018).
Проблемы газовой ферментации неоднократно освещались в обзорах (Liew et al., 2016; Molitor et al., 2017; Takors et al., 2018; De Tissera et al., 2019; Stoll et al., 2020).
Для промышленного производства крупнотоннажных химикатов, к которым относятся производства с объемом 100 000 тонн в год (в английской литературе они обозначаются как commodities chemicals), нужна высокая продуктивность процесса (г л–1 ч–1), высокие выходы (г продукта на 1 г субстрата) и, желательно, высокий конечный титр продукта (г л–1).
Промышленно значимые характеристики процесса газовой ферментации получены только для ацетата и этанола, и только для этанола развит индустриальный процесс. Для этанола сообщены высокие скорости продукции – 195 г л–1 сут–1 (Patent US, 2014; Molitor et al., 2016) с бактериями C. ehtanogenum и даже 360 г л–1 сут–1 с бактериями C. ljungdahlii (Patent US, 2007). Правда, все эти высокие цифры известны только из патентов и обзоров, где эти патенты упоминаются (Patent US, 2014; Takors et al., 2018; Norman et al., 2018).
Три компании интенсивно разрабатывали и осваивали технологию получения этанола из синтез-газа: “Coskata” (США), “INEOS-Bio” (США) и “LanzaTech” (Новая Зеландия).
Фирма “Coskata”в течение нескольких лет эксплуатировала опытную установку, но так и не построила промышленный завод. О печальной судьбе завода фирмы “INEOS-Bio” мы уже упоминали в нашем обзоре. Наиболее успешной оказалась деятельность фирмы “LanzaTech”, первоначально организованной в Новой Зеландии, а теперь имеющей офисы в США, Китае, Индии.
Основным сырьем для разработок фирмы “LanzaTech” являются отходящие газы металлургического производства, которые содержат СО, Н2 и СО2, но сильно обогащены СО. В качестве микроорганизма фирма выбрала C. autoehtanogenum (Norman et al., 2018). Первая опытная установка была построена в Новой Зеландии в 2008 г. В 2014 г. компания построила пилотный завод мощностью 300 тонн в год с китайской компанией “Bao Steel” около Шанхая, который успешно функционирует (http://www.lanzatech). В настоящее время в Бельгии (г. Гент) строится промышленный завод совместно с металлургическим гигантом “Arcelormittal” мощностью 60 тыс. тонн в год стоимостью около 150 млн евро. Предполагается, что в ходе строительства будет создано 500 рабочих мест и 30 постоянных рабочих мест при эксплуатации завода (http://belgium). На заводе будут использованы колоночные Air-lift ферментеры. Производительность процесса будет составлять 10 г л–1 ч–1 (Takors et al., 2018). Пуск завода намечен на 2021 год.
Использование продуктов газовой ферментации в качестве субстратов
Главными продуктами при газовой ферментации ацетогенов являются ацетат и этанол. Оба эти вещества могут использоваться в качестве субстратов при ферментации с другими микроорганизмами.
Для получения из ацетата и этанола более дорогих продуктов – бутанола и гексанола, была использована способность C. kluyveri трансформировать С2-соединения в С4, С6 и более высокомолекулярные органические кислоты согласно уравнению (8) и способность C. ljungdahlii восстанавливать органические кислоты в соответствующие спирты в присутствии Н2 и СО, согласно уравнению (9) (Dinder et al., 2016; Richter et al., 2016a):
(8)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{CO}}{{{\text{O}}}^{--}} + {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\text{C}}{{{\text{H}}}_{{\text{2}}}}{\text{O}}{{{\text{H}}}^{--}} \to \\ \to {\text{C}}{{{\text{H}}}_{3}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{CO}}{{{\text{O}}}^{--}} + {{{\text{H}}}_{{\text{2}}}}{\text{O}}, \\ \end{gathered} $(9)
$\begin{gathered} {\text{C}}{{{\text{H}}}_{{\text{3}}}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{CO}}{{{\text{O}}}^{--}} + {\text{CO}} + {{{\text{H}}}_{2}} \to \\ \to {\text{C}}{{{\text{H}}}_{3}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{C}}{{{\text{H}}}_{2}}{\kern 1pt} --{\kern 1pt} {\text{OH}} + {\text{C}}{{{\text{O}}}_{2}}. \\ \end{gathered} $Эти разработки были использованы при конструировании опытной установки, созданной двумя промышленными гигантами “Siemens” и “Evonik”. Установка включает электролизер для получения синтез-газа, разработанный фирмой “Siemens”, и ферментацию синтез-газа в бутанол и гексанол с использованием двух бактерий C. ljungdahlii и C. kluyveri. Установка будет функционировать в течение 2020 г. в Марли (Германия), и по результатам ее работы будет сделана оценка пригодности процесса для масштабирования. Самым дорогим ресурсом в этом процессе является электричество, расход которого составляет 22 кВт ч на 1 кг бутанола. При современной цене электричества около 4.5 евроцента за 1 кВт ч процесс уже может конкурировать по цене с нефтехимическим производством бутанола (https://press.siemens).
Большинство работ по получению соединений на базе продуктов газовой ферментации не имеют на сегодня практического значения, а скорее просто демонстрируют принципиальную возможность осуществления таких процессов. Так, финские исследователи использовали бактерию Actinobacter baylyi, которая хорошо растет на ацетате и способна синтезировать большое количество липидов. Эта бактерия была генетически модифицирована таким образом, что она стала способна синтезировать алканы или алкиловые эфиры жирных кислот. Количество этих соединений было очень незначительным – 90 мг л–1 эфиров (Lechtienen et al., 2017) и 1 мг л–1 алканов (Lechtienen et al., 2018).
Уксусная кислота, полученная из газовой ферментации ацетогенов, была использована для роста дрожжей с целью получения микробного белка (Single-cell protein). Получение белка одноклеточных организмов – это один из путей удовлетворения растущего спроса на кормовой и пищевой белок. Считается, что к 2050 г. население земли достигнет 9 млрд человек, и потребности в белке возрастут с 473 до 943 Мт. В предложенном двустадийном процессе 25% углерода СО2 оказывается в составе дрожжевой биомассы, содержащей 40–50% белка (Molitor et al., 2019).
Многие бактерии могут использовать уксусную кислоту как источник углерода и энергии. Так, в СССР на заводе “Прогресс” (г. Степногорск, Казахская ССР) осуществлялся промышленный выпуск незаменимой аминокислоты L-лизина с использованием уксусной кислоты в качестве сырья и бактерий Corynebacterium glutamicum в качестве продуцента. Титр лизина достигал 70 г/л в аппаратах объемом 64 куб. м, а выпуск продукции составлял многие тысячи тонн в год.
Хранение водорода
Водород является перспективным энергоносителем для будущей циклической экономики. Одной из основных трудностей “водородной” энергетики является хранение и транспортировка этого высокореакционного газа, что требует построения новой и дорогой инфраструктуры.
Путем решения этой проблемы является хранение и транспортировка водорода в связанном состоянии в виде формиата. Реакция восстановления СО2 водородом идет по уравнению (10):
(10)
$\begin{gathered} {\text{C}}{{{\text{O}}}_{2}} + {{{\text{H}}}_{2}} \rightleftarrows {\text{HCO}}{{{\text{O}}}^{ - }} + {{{\text{H}}}^{ + }} \\ \Delta C_{0}^{'} = - 3\,\,{{{\text{кДж}}} \mathord{\left/ {\vphantom {{{\text{кДж}}} {{\text{моль}}}}} \right. \kern-0em} {{\text{моль}}}}. \\ \end{gathered} $Формиат достаточно стабилен в водных растворах и может транспортироваться и храниться с использованием существующей инфраструктуры. В месте потребления водород получают из формиата достаточно просто в силу обратимости реакции (например, нагреванием раствора формиата).
В настоящее время формиат получают гидрированием СО2 с помощью химических катализаторов при повышенных температурах и давлении. Вместе с тем реакция гидрирования СО2 с образованием формиата – это первая реакция WLP-пути, и ацетогены осуществляют ее при комнатной температуре и нормальном давлении. К сожалению, большинство формиатдегидрогеназ, катализирующих эту реакцию, имеют в качестве кофакторов NADH и NADPH, что затрудняет использование этих ферментов для биокаталитического получения формиата.
Положение изменилось после открытия в 2013 г. у бактерий A. woodii фермента, осуществляющего гидрирование СО2 с использованием только водорода. Фермент получил название водород зависимой СО2 редуктазы (Hydrogen dependent carbon dioxide reductase, HDCR) (Schuchman, Müller, 2013). У бактерий Thermoanaerobacter kivui была обнаружена термостабильная HDCR (Schazz et al., 2018). Термостабильный фермент имеет оптимум действия при 70°С и катализирует как прямую, так и обратную реакции со скоростью около 930 мкмоль Н2 мин–1 мг–1 (Schazz et al., 2018). Была предложена технология биокатализа с использованием целых клеток для продукции формиата из синтез-газа (Schazz, Müller, 2020) и водорода из формиата (Kottenhahn et al., 2018), что снижает затраты и повышает стабильность биокатализа.
HDCR-ферменты превосходят по эффективности химические катализаторы. Так, число оборотов химического катализатора при 30°С составляет 3400 ч–1 и при 80°C – 8050 ч–1, а для HDCR из T. kivui число оборотов при 60°С достигает 9 555 000 ч–1 (Müller, 2019). Таким образом, ацетогены имеют хорошие перспективы для развития биотехнологических процессов для получения формиата и его использования как в химической промышленности, так и в “водородной” энергетике будущего (Müller, 2019).
Электробиосинтез
Еще одним перспективным направлением практического применения ацетогенов является электробиосинтез. Электробиосинтез – это прямое поглощение электронов бактериями с электрода (катода) и использование этих электронов в качестве восстановительных эквивалентов. Феномен был открыт 10 лет назад на примере ацетогена Sporomusa ovata, который поглощал электроны с катода и, восстанавливая СО2, синтезировал уксусную кислоту (Nevin et al., 2010). Процесс проводят при напряжении на катоде, которое не позволяет образование водорода. К электробиосинтезу кроме S. ovata способны еще некоторые ацетогены, например, C. ljyungdahlii, Sporomusa spheroides, Moorella thermoacetica, но далеко не все (Shin et al., 2017).
Следует отметить, что механизм транспорта электронов для ацетогенов не известен.
Электробиосинтез осуществляется с очень высокой кулоновской эффективностью (то есть все электроны, полученные с катода, расходуются на восстановление СО2 и формирование конечных продуктов), но скорости очень низкие. Так, электробиосинтез с S. ovata дикого типа приводит к накоплению около 1.8 мM ацетата за 5 сут. Штамм был улучшен путем его адаптации к быстрому росту на метаноле (лабораторная эволюция). Такой штамм (S. ovata T18-2) за 5 сут синтезировал уже 13 мM ацетата (Tremblay et al., 2015).
Совершенствование процесса связано с подбором условий процесса, особенно с подбором материала электродов. На сегодня скорости электробиосинтеза заметно увеличены и достигнуты показатели в 13.1 г м–2 сут–1 (Aryal et al., 2018) и даже 25.2 г м–2 сут–1 (May et al., 2016).
Высказывается предположение, что электробиосинтез хорошо бы сочетать с установками для получения электричества с помощью солнца или/и ветра. Такие установки работают неравномерно (в зависимости от силы ветра и освещенности), и возникают ситуации, когда электроэнергию хорошо бы законсервировать в виде химических связей. В этой связи важно понять, как будет вести себя электробиосинтез в случае периодического включения и выключения электрического тока. Этот случай был исследован, и оказалось, что прерывание подачи электричества даже на 64 ч не приводит к гибели микроорганизмов на катоде, и через 6 ч после возобновления подачи тока электробиосинтез восстанавливается в полном объеме (Rojas et al., 2018).
Несмотря на достигнутые успехи, биоэлектросинтезу присущи внутренние противоречия. Для высоких скоростей биосинтеза нужна высокая плотность тока, но в этом случае снижается кулоновская эффективность. При малой плотности тока эффективность процесса высока, но скорости малы. В целом электробиосинтез проигрывает по эффективности процессам, основанным на абиотическом электровосстановлении СО2 в синтез-газ и последующей газовой ферментации (Prevotean et al., 2020).
Миксотрофия
Многие ацетогены могут усваивать различные органические субстраты и осуществлять гетеротрофный рост. Усвоение сахаров осуществляется у них по широко распространенному пути Эмбдена–Мeйергофа–Парнаса (Embden–Meyerhof–Parnas-pathway, EMP). Конечными продуктами этого пути при уксуснокислом брожении являются 2 молекулы ацетил-CoA, 2 молекулы АТФ, 2 молекулы СО2 и 8 электронов из 1 молекулы гексозы. Теоретически, так как ацетогены имеют WLP-путь фиксации СО2, то они могут, используя энергию АТФ и наличие восстановительных эквивалентов, восстановить 2 молекулы СО2 в ацетил-СоА и далее синтезировать ацетат. Таким образом, теоретически, при гетеротрофном росте на гексозах ацетогены могут синтезировать 3 моля ацетата на 1 моль гексозы. Условием такого сверхсинтеза ацетата является одновременная работа в клетке EMP и WLP путей биосинтеза. Это явление наблюдали экспериментально при росте ацетогенов на сахарах, и оно получило название анаэробная нефотосинтетическая миксотрофия – ANP (Anaerobic nonphotosinthetic mixotrophy) (Fast et al., 2015).
Хотя явление миксотрофии известно давно (Braun, Gottschalk, 1981), но оно до сих пор изучено недостаточно. Мало сведений о взаимодействии EMP и WLP путей. У некоторых ацетогенов обнаружена катаболитная репрессия, но для других отмечен равномерный рост на газовых субстратах в присутствии гексоз. В любом случае, наличие миксотрофии наблюдали в экспериментальных условиях неоднократно. Так, было исследовано 17 ацетогенных бактерий, как мезофильных, так и термофильных, и у всех отмечалось явление ANP. Наличие миксотрофии оценивается по величине отношения углерода в субстрате (гексозе) Сс к углероду в продукте Сп. Углерод в продукте – это сумма углерода в биомассе и синтезированных метаболитах. Для EMP пути Сс/Сп = 0.67 (что связано с выделением СО2 в процессе). Всякое превышение Сс/Сп выше 0.67 будет означать наличие миксотрофии. Действительно, для всех изученных ацетогенов Сс/Сп колебался от 0.78 до 0.80 (Maru et al., 2018).
Явление миксотрофии можно использовать для увеличения энергообеспеченности ацетогенов при синтезе ими таких соединений как липиды или алканы. Интересным, но пока нереализованным направлением является перенос WLP-пути в промышленные гетеротрофы для увеличения выхода продуктов ферментации.
ЗАКЛЮЧЕНИЕ
Направлением современного научно-технического прогресса является движение от экономики, основанной на ископаемых ресурсах (нефть, газ, уголь) к циклической неисчерпаемой экономике, основанной на возобновляемых источниках энергии (ветер, солнце, биомассы растений, гидро- и геотермальная энергия) и замкнутом цикле использования углерода. Рецикл углерода может осуществляться через газификацию любых углеродсодержащих соединений с образованием синтез-газа. Синтез-газ в свою очередь будет субстратом для синтеза химикатов, полимеров и биотоплива.
Энергетика и химия – это гигантские и очень инерционные отрасли, и, конечно, переход их на рельсы циклической экономики займет многие десятилетия, возможно, весь оставшийся XXI век. Тем не менее, тенденция явно прослеживается. Уже сегодня цены ветровой и солнечной электроэнергии приблизились к ценам электричества, получаемого традиционными способами. К 2030 г. около 20% всей электроэнергии в мире будет получено из возобновляемых источников.
В новой циклической экономике большой удельный вес будет иметь биотехнология и, в частности, промышленная микробиология, которая будет производить различные химикаты, биотопливо, незаменимые аминокислоты, витамины, кормовой и пищевой белок, биодеградируемые биополимеры и многие другие продукты. Сегодня можно предполагать различные способы использования ацетогенов в будущей биоэкономике, несмотря на имеющиеся свойственные им ограничения. Эти ограничения связаны с бедным репертуаром синтезируемых ацетогенами метаболитов и энергетическими ограничениями, приводящими к медленному росту и невозможности синтеза энергоемких соединений, таких как алканы или высшие жирные кислоты и спирты.
Уже сегодня преодолены многие технические трудности газовой ферментации и синтез этанола из газов металлургического производства, обогащенных СО, реализован в промышленном масштабе. Нет технологических препятствий в тиражировании этой технологии. Сырьем для процесса могут быть растительная биомасса, подвергнутая газификации, или в будущем синтез-газ, получаемый электролизом воды в присутствии СО2. Учитывая современное производство 100 млн тонн топливного этанола, легкость превращения этанола в этилен и полиэтилен, а также прогресс в технологиях получения авиационного топлива из этанола, будущий рынок этанола можно оценить в 0.5–0.8 млрд тонн в год.
Расширение состава синтезируемых ацетогенами метаболитов будет увеличиваться по мере совершенствования методологии метаболической инженерии. Другой и очень простой подход к расширению набора синтезируемых метаболитов – это двустадийный процесс ферментации, когда на первом этапе ацетогены из синтез-газа образуют ацетат и этанол, а на втором гетеротрофы используют ацетат и этанол как источник углерода и энергии и синтезируют желаемые метаболиты. Двустадийный процесс пригоден почти для всех известных на сегодня продуктов микробиологической промышленности.
Большой и пока мало используемый потенциал заключается в явлении миксотрофии. В случае ацетогенов газовая ферментация с одновременным использованием сахаров усиливает энергообеспеченность, что делает возможным синтез энергоемких продуктов, например, алканов. Заманчива перспектива переноса WLP-пути в промышленные гетеротрофные микроорганизмы с целью повышения выхода целевых продуктов при ферментации сахаров.
В будущей “водородной” энергетике ацетогены могут найти применение в синтезе формиата из Н2 и СО2 и в процессе разложения формиата на водород и углекислоту. Синтез формиата может представлять и самостоятельный интерес для современной химической индустрии.
Успех всех вышеперечисленных направлений будет зависеть от прогресса в исследовании ацетогенных микроорганизмов, поиске новых представителей с уникальными свойствами, совершенствовании инструментов генетических преобразований, от успехов в понимании функционирования, регуляции и сопряжения метаболических сетей у этих микроорганизмов.
СОБЛЮДЕНИЕ ЭТИЧЕСКИХ СТАНДАРТОВНастоящая статья не содержит результатов исследований, в которых в качестве объектов использовались люди или животные.КОНФЛИКТ ИНТЕРЕСОВАвторы заявляют об отсутствии конфликта интересов.
Список литературы
Дебабов В.Г. Биоэтанол из синтез-газа // Биотехнология. 2012. Т. 28. № 3. С. 8–19.
Annan F.J., Al-Sinawi B., Humphreys C.H., Normann R, Winzer K., Köpke M., Simpson S.D., Mitton N.P., Henstra A.M. Engineering of vitamin prototrophy in Clostridium ljungdahlii and Clostridium autoethanogenum // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 4633–4648.
Arslan K., Bayer B., Abubackar H.V., Veiga M., Kennes C. Solventogenesis in Clostridium aceticum producing high concentrations of ethanol from syngas // Bioresour. Technol. 2019. V. 292. P. 12191.
Aryal N., Tremblay P.L., Xu M., Dangaard A.E., Zhang T. Highly conductive poly (3,4-ethylenedioxythiophene) polystyrene sulfonate polymer coated cathode for the microbial electrosynthesis of acetate from carbon dioxide // Front. Energy Res. 2018. V. 6. P. 72.
Bache R., Pfennig N. Selective isolation of Acetobacterium woodii on metoxylated aromatic acids and determination of growth yields // Arch. Microbiol. 1981. V. 130. P. 255–261.
Basen M., Müller V. Hot acetogenesis // Extremophiles. 2017. V. 21. P. 15–26.
Banerjee A., Leang C., Ueki T., Nevin K.P. Lovley D.R. Lactose-inducible system for metabolic engineering of Clostridium ljungdahlii // Appl. Environ. Microbiol. 2014. V. 80. P. 2410–2417.
Bengelsdorf F.R., Dürre P. Gas fermentation for commodity chemicals and fuels // Microbiol. Biotechnol. 2017. V. 10. P. 1167–1170.
Bengelsdorf F.R., Poehlein A., Linder S., Erz C., Hummel T., Hoffmeister S., Daniel R., Dürre P. Industrial acetogenic biocatalysts: a comparative metabolic and genomic analysis // Front. Microbiol. 2016. V. 7. P. 1036.
Bertsch J., Müller V. Bioenergetic constrains for conversion of syngas to biofuels in acetogenic bacteria // Biotechnol. Biofuel. 2015a. V. 81. P. 210.
Bertsch J., Müller V. CO metabolism in the acetogene Acetobacter woodii //Appl. Environ. Microbiol. 2015b. V. 81. P. 5949–5956.
Braun K., Gottschalk G. Effect of molecular hydrogen and carbon-dioxide on chemo-organotrophic growth of Acetobacterium woodii and Clostridium aceticum // Arch. Microbiol. 1981. V. 128. P. 294–298.
Brown S.D., Nagaraju S., Utturkar S., De Tissera S., Segovia S., Mitchell W., Land M.I., Dassanayake A., KöpkeM. Comparative single-molecule sequencing and hybrid approach for finishing the genome of Clostridium autoethanogenum and analysis CRiSPR systems in industrial relevant clostridia // Biotechnol. Biofuel. 2014. V. 7. P. 40–58.
Buckel W., Thauer R. Flavin-based electron bifurcation, ferredoxin, flavodoxin and anaerobic respiration with proton (Ech) or NAD (Rnf) as electron acceptors: A historical review // Front. Micribiol. 2018a. V. 9. P. 401.
Buckel W., Thauer R. Flavin-based electron bifurcation. A new mechanism of biological energy coupling // Chem. Rev. 2018b. V. 118. P. 3862–3886.
Burton R., Can M., Esckilsen D., Wiley S., Ragsdahl S.W. Production and properties of enzymes that activate and produce carbon monoxide // Methods Enzymol. 2018. V. 613. P. 297–324.
Classen N.J., Cotton C.A.R., Kopljar D., Bar-Even A. Making quantitative sense of electromicrobial production // Nat. Catal. 2019. V. 2. P. 437–447.
Cotton C.A.R., Claassens N.J., Benito-Vequezizo S., Bar-Even A. Renewable methanol and formate as microbial feed stocks // Curr. Opin. Biotechnol. 2020. V. 62. P. 168–180.
Drake H.L., Gossner A.S., Daniel S.L. Old acetogenes new light // Ann. N.Y. Acad. Sci. 2008. V. 1125. P. 100–128.
Drake H.L. Kiisel K., Matthies M. “Acetogenic Procaryotes” // The Prokaryotes / Eds. Rosenberg E., De Long E.F., Lory S., Stackelbrandt E., Tompson F. Berlin, Heidelberg: Springer, 2013.
Demmer K., Huang H., Wang S., Demmer U., Tauer R.K., Ermler U. Insight into flavin-based electron bifurcation via the NAD-dependent reduced ferredoxin NADP oxidoreductase structure // J. Biol. Chem. 2015. V. 290. P. 21985–21995.
De Tissera S., Kӧpke M., Simpson S.D., Humphreys C., Minton N.P., Dürre P. Syngas biorefinery and syngas utilization in Biorefineries, Wagemann K. and Tippkotter N., Eds. // Adv. Biochem. Biotechnol. 2019. V. 166. P. 247–280.
Diender M., Stams A.J., Souza D.Z. Production of medium-chain acids and higher alcohols by a synthetic coculture grown on carbonmonoxide or syngas // Biotechnol. Biofuels. 2016. V. 9. P. 82.
Dürre P. Butanol formation from gaseous substates // FEMS Microbiol. Lett. 2016. V. 363. fnw040.
Dürre P., Eikmanns B. C1-carbon sources for chemical and fuel production by microbial gas fermentation // Curr. Opin. Biotechnol. 2015. V. 35. P. 63–72.
Fast A.G., Papoutsakis E.T. Stoichiometric and energetic analysis of non-photosynthetic CO2 fixation pathways to support synthetic biology strategies for production of fuel and chemicals // Curr. Opin. Chem. Engin. 2012. V. 1. P. 380–395.
Fast A.G., Schmidt E.D., Joness W., Tray B.P. Acetogenic mixotrophy novel options for yield improvement in biofuel and biochemical production // Curr. Opin. Biotechnol. 2015. V. 33. P. 60–72.
Flüchter S., Follonier S. Schiel-Bengelsdorf B., Bengelsdorf F.R., Zinn M., Dürre P. Anaerobic production of poli (3-hydroxybutirate) and its precursor 3-hydroxybutirate from synthesis gas by autotrophic Clostridia // Biomacromolecules. 2019. V. 20. P. 3271–3282.
Gildemyn S., Molitor B., Usack G., Nguen M., Rabaey K., Angenent L.T. Upgrading syngas fermentation effluent using Clostridium kluyveri in a continous fermentation // Biotechnol. Biofuel. 2017. V. 10. P. 83.
Groher A., Weuster-Botz D. Comperative reaction engineering analysis of different acetogenic bacteria for gas fermentation // J. Biotechnol. 2016. V. 288. P. 82–94.
Haas T., Krause R., Weber R., Demler M., Schmid G. Technical photosynthesis involving CO2 electrolysis and fermentation // Nature Catal. 2018. V. 1. P. 32–39.
He Y., Li M., Perumal V., Feng X., Fang Y., Xie Y., Sievert S.M., Wang F. Genomic and enzymatic evidence for acetogenesis among multiple lineages of the archaeal phylum Bathyarchaeota widespread in marine sediments // Nature Microbiol. 2016. V. 1. P. 16035.
Heap J.T., Kuchne S.A., Ehsaan M., Gartman S.T., Cooksley C.M., Scott J.C., Minton N.P. The GlosTron mutagenesis in Clostridium refined and streamlind // J. Microbiol. Meth. 2010. V. 80. P. 49–55.
Herrmann G., Jayamani E., Mai G., Buckel W. Energy conservation via electron-transferring flavoprotein in anaerobic bacteria // J. Bacteriol. 2008. V. 190. P. 784–791.
Hess V., Schehman K., Müller V. The ferredoxin:NAD+ ox-idoreductase from acetogen Acetobacter woodii requires Na+ and reversible coupled to the membrane potential // J. Biol. Chem. 2012. V. 288. P. 31496–31502.
Hoffmeister S., Gerdom M., Bengelsdorf F.R., Linder S., Flüchter S., Oztürk H., Blümke W., May A., Fischer Y., Bahl H., Dürre P. Acetone production with metabolically engineered strain Acetobacterium woodii // Metabolic. Engin. 2016. V. 36. P. 37–47.
https://belgium/arcelorm:ttal.com/en/ ArcelorMittal and LanzaTech break ground on €150million project to revolutionise blast furnace carbon emissions capture
http://biomassmagazine.com/articles/13662/ineos-bio-to-sell-ethanol-business-including-vero-beach-plant.
https://www.chemicals-technology.com/projects/LanzaTech 2,3-Butanediol Demonstration Plant
https://www.lanzatech.com.
https://press.siemens.com/global/en/pressrelease/research- project-rheticus.
https://www.statista.com/statistics/281606/ethanol-production-in-selected-countries/.
Huang H., Chai C., Ci N., Rove P., Minton N.P., Yang S., Liang W., Gu Y. CRiSPR/cas9-based efficient genome editing in Clostridia ljungdahlii an autotrophic gas-fermenting bacterium // ACS Synt. Biol. 2016. V. 5. P. 1355–1361.
Humphzeys C.M., McLean, S., Schatschneider M.S., Milat S., Henstra A.M., Annan F.J., Breitkopf R., Pander B., Piatek P., Rowe P., Wichlacz A.T., Woods C., Norman R., Blom J., Goesman A., Hodgman C., Barrett D., Thomas N.R., Winzer K., Minton N.P. Whole genome sequence and manual annotation of Clostridium ethanogenum and industrial relevant bacterium // BMC Genomics. 2015. V. 16. P. 1085.
Jiang Y., Zhang T., Lu J., Dürre P., Zhang W., Doung W., Zhou J., Jiang M., Xin F. Microbial co-culturing systems butanol production from organic waste through consolidated bioprocessing // Appl. Microbiol. Biotechnol. 2018. V. 102. P. 5419–5425.
Joseph R.C., Kim N.M., Sandoval N.R. Recent development of the synthetic biology Toolkit for Cloctridium // Front. Microbiol. 2018. V. 9. P. 154.
Karim A.S., Dudlen Q.M., Juminaga A., Yuan Y., Crowe S.A., Heggstad J.T., Gary S., Abdalla T., Grubbe W., Rasor R.J., Coar D.N., Torulas S.M., Krein M., Liew F.M., Qua-Tellbaum A., Jensen R.O., Stuart J.A., Simpson S.D., Kӧpke M., Jewett M.C. In vitro prototyping and rapid optimisation of biosynthetic enzymes for cell design // Nature Chem. Biol. 2020. https://doi.org/10.1038/s41589-020-0959-0
Kӧpke M., Held C., Hujer S., Liesegang H., Weizer A., Wellherr A., Ehrenreich A., Liebel W., Gottshalk G., Dürre P. Clostridium ljungdahlii represent a microbial production platform based on syngas // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 13087–13092.
Kӧpke M., Mihalcea C., Bromley J.C., Simpson S.D. Fermentative production of ethanol from carbon monoxide // Curr. Opin. Biotechnol. 2011a. V. 22. P. 320–325.
Kӧpke M., Mihalcea C., Liew F.M., Tizard J.H., Ali M.S., Konnoly J.J., Sinawi A.L., Simpson S.D. 2,3-Butandiol proguction by acetogenic bacteria, an alternative route to chemical synthesis, using industrial waste gas // Appl. Environ. Microbiol. 2011b. V. 77. P. 5467–5475.
Kӧpke M., Gerth M.L., Maddok D.J., Mueller A.P., Liew F.M., Simpson S.D., Patrick W.M. Reconstruction of acetogenic 2,3-butandiol pathway involving a novel NADPH-dependent primary-secondary alcohol dehydrogenase // Appl. Environ. Microbiol. 2014. V. 80. P. 3394–3403.
Kottenhahn P., Schuchman K., Müller V. Efficient whole-cell biocatalyst formate based hydrogen production // Biotechnol. Biofuels. 2018. V. 11. P. 93.
Kremp F., Poelein A., Daniel R., Müller V. Methanol metabolism in the acetogenic bacterium Acetobacterium woodii // Environ. Microbiol. 2018. V. 20. P. 4369–4384.
Latif H., Zeidan A.A., Nielson A.T., Zendler K. Trash to treasure: production of biofuels and commodity chemicals via syngas fermenting microorganisms // Curr. Opin. Biotechnol. 2014. V. 27. P. 79–87.
Leang C., Ueki T., Nevin R., Lovley D.R. A genetic system for Clostridium ljungdahlii a chassis for autotrophic production of biocomodities and a model homoacetogen // Appl. Environ. Microbiol. 2013. V. 79. P. 1102–1109.
Lechtenfeld M., Heine J., Sameith J., Kremp F., Müller V. Glycine betaine metabolism in the acetogenic bacterium Acetobacterium woodii // Environ. Microbiol. 2018. V. 20. P. 4512–4525.
Lehtinen T., Efimova E., Tremblay P.L., Santala S., Zhang T., Santala V. Production of long chain alkyl esters from carbon dioxide and electricity by a two-stage bacterial process // Bioresour. Technol. 2017. V. 43. P. 30–36.
Lehtinen T., Vitrauen M., Santala S., Santala V. Production of alkanes from CO2 by engineered bacteria // Biotechnol. Biofuels. 2018. V. 11. P. 228.
Lemaire O.N., Jespersen M., Wagner T. CO2-fixation strategies in energy extremophiles: what can we learn from acetogenes? // Front. Microbiol. 2020. V. 11. P. 486.
Lemgruber R.S.P., Valgepea K., Tappel R., Behrendorff J.B., Palfreyman R.W., Plan M., Hodson M.P., Simpson S.D., Nielsen L.K., Kӧpke M., Marcellin E. System-level engineering and characterization of Clostridium autoethanogenum through heterologous production of poly-3-hydroxybutirate (PHB) // Metabol. Eng. 2019. V. 53. P. 14–23.
Liang J., Huang H., Wang S. Distribution, evolution, catalytic mechanism and physiological functions of the flavin-based electron bifurcating NADH-dependent reduced ferredoxin NADP oxidoreductase // Front. Microbiol. 2019. V. 10. Art. 373.
Liew F.-M., Martin M.E., Tappel R.C., Heijstra V.D., Mihalcea C., Köpke M. Gas fermentation – a flexible platform for commercial scale production of low-carbon-fuels and chemicals from waste and renewable feed stocks // Front. Microbiol. 2016. V. 7. Art. 694.
Liew E., Henstra A.M., Köpke M., Winzer K., Simpson S.D., Minton N. Metabolic engineering of Clostridium autoethanogenum for selective alcohol production // Metab. Engin. 2017. V. 40. P. 104–114.
Lubner C.E., Jennigs D.P., Mudler D.W., Schut G.J., Zodvorny O.A., Hoben J.P., Tokmina-Lukaszewska M., Berry L., Nguen D.M., Lipscomb G., Bother B., Jones A.K., Miller A.F., King P.W., Adams M.W., Peters Y.W. Mechanistic insight in to energy conservation by flavin-based electron bifurcation // Nat. Chem. Biol. 2017. V. 13. P. 655–659.
Martin A.J., Larrazable G.O., Peretz-Ramirez Y. Towards sustainable fuels and chemicals through the electrochemical reduction of CO2: lesson from water electrolysis // Green Chem. 2015. V. 17. P. 5114–5130.
Maru B.T., Munasinghe P.C., Gilary H., Yones S.W., Tray P. Fixation of CO2 and CO on a diverse range of carbohydrates using anaerobic, non-photosynthetic mixotrophy // FEMS Microbiol. Lett. 2018. V. 365. Fny 039.
May H.D., Evans P.J., La Belle E.V. The bioelectrosynthesis of acetate // Curr. Opin. Biotechnol. 2016. V. 42. P. 225–233.
Mayer A., Weuster-Botz D. Engineering analysis of the autotrophic energy metabolism of Clostridium aceticum // FEMS Microbiol. Letters. 2017. V. 364.https://doi.org/10.1093/femsle/fnx2019
McAllister K.N., Sorg J.A. CRiSPR genome editing systems in the genus Clostridium: a timely advancement // J. Bacteriol. 2019. V. 201(16). e 00219-19.
Mitchell P. The protonmotive Q cycle: a general formulation // FEBS Lett. 1975. V. 59. P. 137–139.
Mitchell P. Possible molecular mechanism of the proton motive function of cytochrome system // J. Theor. Biol. 1976. V. 62. P. 317–327.
Mock J., Zheng Y., Mueller A.P., Ly S., Trau L., Segovia S., Nagaraju S., Kӧpke M., Dürre P., Thauer R.K. Energy conservation associated with ethanol formation from H2 and CO2 in Clostridium autoethanogenum involving electron bifurcation // J. Bacteriol. 2015. V. 197. P. 2965–2980.
Mohr T., Intantes A., Biebinger L., Mayer P., Neuman A. A-cetogenic fermentation from oxygen containing waste gas // Front. Bioengin. Biotechnol. 2019. V. 7. Art. 433.
Molitor B., Richter H., Martin M.F., Jensen R.Q., Juminada A., Mihalcea C., Augenent L.T. Carbon recovery by fermentation of CO-rich gasses-turning steel mills in to biorefineris // Bioresour. Technol. 2016. V. 15. P. 386–398.
Molitor B., Marcellin E., Augenent L. Overcoming the energetic limitations of syngas fermentation // Curr. Opinion. Chem. Biol. 2017. V. 84. P. 84–92.
Molitor B., Mishra A., Augenent L.T. Power-to-protein: converting renewable electric power and carbon dioxide into cell protein with two-stage bioprocess // Energy Environ. Sci. 2019. V. 12. P. 3515–3521.
Müller V. New horizons in acetogenic conversion of one-carbon substrates and biological hydrogen storage // Trends Biotechnol. 2019. V. 37. P. 1344–1354.
Nagarajiu S., Davis N.K., Jeffery D., Walker F., Kӧpke M., Simpson S.D. Genome editing Clostridium autoethanogenum using CRiSPR/cas9 // Biotechnol. Biofuel. 2019. V. 9. P. 219–227.
Najafpour G.D., Yones H. Ethanol and acetate synthesis from waste gas using butch culture of Clistridium ljungdahlii // Enzyme. Microbiol. Technol. 2006. V. 38. P. 223–228.
Nelson L.K., Marcellin E., Valdepea K., Loi K.Q., Behrendorff J.B., Lemgruber R.S.P., Hodson M.P., Kӧpke M. Arginine deaminase pathway provides ATP and boosts growth of the gas-fermenting acetogen Clostridium autoethanogenum // Metab. Engin. 2017. V. 41. P. 202–211.
Nevin K.P., Woodart T.L., Franks A.E., Summers Z.M., Lovley D.R. Microbial electrosynthesis: feeding microbes electricity to convert carbon dioxide and water to multicarbon extracellular organic compounds // mBio. 2010. V. 1. e00103−e00110.
Norman R.O.J., Millat T., Winzer K., Minton N.P., Hogman C. Progress towards platform chemical production using Clostridium autoethanogenum // Biochem. Soc. Trans. 2018. V. 46. P. 523–535.
Patent Germany DE. № 102007052463 A1.
Patent US. 2007. № 7285402.
Patent US. 2012. № 0252083.
Patent US. 2014. № 20140273115 A1.
Patent US. 2018. № 890384132.
Patent WO. 2012. № 2012/053905.
Patent WO. 2014. № 2014/1132209 A1.
Peters J.W., Beratan D.N., Bother B., Dyer R.B., Harwood S., Heiden Z.M., Hill R., Jones A.K., King P.W., Lu Ji., Luber C.E., Minteer S.D., Mudler D.W., Rangei S., Schut G.J., Seefeld L.C., Tokmina-Lukaszewska M., Zadvornyy O.A., Zhang P., Adams M.W. A new era for electron bifurcation // Curr. Opin. Chem. Biol. 2018. V. 47. P. 32–38.
Phillips J.R., Atiyeh H.K., Tanner R.S., Torres J.R.Saxena Y., Wilkins M.R., Hunke R.L. Butanol and hexanol production in Clostridium carboxidivoraus syngas fermentation: medium development and culture techniques // Bioresour. Technol. 2015. V. 190. P. 114–121.
Phillips G., de Vieres S., Jennevein S. Development of a metabolic pathway transfer and genomic integration system for the syngas-fermenting bacterium Clostridium ljungdahlii // Biotechnol. Biofuel. 2019. V. 12. P. 112.
Poudel S., Dunham E.C., Lindsay M.R., Amenober M.J., Fones E.M. Colman D.R., Boyd E.S. Origin and evolution of flavin-based electron bifurcating enzymes // Front. Microbiol. 2018. V. 9. P. 1762.
Prevotean A., Carvajal-Arroyo J.M., Ganique R., Rabaey R. Microbial electrosynthesis from CO2: forever a promise? // Curr. Opin. Biotechnol. 2020. V. 62. P. 48–57.
Rajagopalan S., Datar R.P., Lewis R.S. Formation of ethanol from carbon monoxide via new microbial catalyst // Bioenergy. 2002. V. 23. P. 487–493.
Ramio-Pujol S., Ganique R., Baneras L., Calprim J. Impact of formate on the growth and productivity of Clostridium ljugdahlii PETO and Clostridium carboxidivoraus P7 grown on syngas // Int. Microbiol. 2014. V. 17. P. 195–204.
Ramio-Pujol S., Ganigue R., Baneras L., Colprim J. Incubation at 25°C prevents acid crush and enhances alcohol production in Clostridium carboxidivoraus P7 // Bioresours. Technol. 2015. V. 192. P. 296–303.
Ramio-Pujol S., Ganigue R., Banaras L., Colprim J. Effect ethanol and butanol on autotrophic growth on model homoacetogenes // FEMS Microbiol. Letters. 2018. V. 365. fny084.
Riegler P., Bieringer F., Chrousel T., Stazz T., Lowe M., Webster-Botz D. Continuous conversion CO2/H2 with Clostridium aceticum in biofilm reactors // Bioresour. Technol. 2019. V. 291. P. 121760.
Richter H., Molitor B., Diender M., Sousa D.Z., Augenent L.T. A narrow pH range supports butanol, hexanol and octanol production from syngas in a continus co-culture of Clostridium ljungdahlii and Clostridium kluyveri with in-line product extaction // Front. Microbiol. 2016a. V. 7. P. 1773.
Richter H., Molitor B., Wei H., Chen W., Aristide L., Augenent L.A. Ethanol production in syngas-fermentating Clostridium ljungdahlii controlled by thermodinamic rather than enzymatic expression // Energy Environ. Sci. 2016b. V. 9. P. 2392–2399.
Rogsdale S.W., Pierce E. Acetogenesis and the Wood-Ljungdahl pathway of CO2 fixation // Biochim. Biophys. Acta. 2008. V. 1784. P. 1873–1898.
Rogsdale S.W. Enzymology of the Wood-Ljungdahle pathway of acetogenes // Ann. N.Y. Acad. Sci. 2008. V. 1125. P. 129–136.
Rojas M., Zaiat M., Gonzalez E.R., Wiver H., Pant D. Effect of the electric supply interruption on a microbial electrosynthesis system converting in organic carbon into acetate // Bioresour. Technol. 2018. V. 206. P. 203–210.
Schwarz M.F., Schuchman K., Müller V. Hydrogenation of CO2 at ambient pressure catalyzed by a highly active thermostable biocatalysis // Biotechnol. Biofuels. 2018. V. 11. P. 237.
Schwarz M.F., Müller V. Whole-ctll biocatalysis for hydrogen storage and syngas conversion to for mate using thermophilic acetogen // Biotechnol. Biofuels. 2020. V. 13. P. 13.
Schoelmerich M.C., Müller V. Energy-converting hydrogenases: the link between H2 metabolism and energy conservation // Cell Mol. Life Sci. 2019a. V. 77. P. 1461–1481.
Schoelmerich M.C., Müller V. Energy conservation by a hydrogenase-dependent chemiosmotic mechanism in an ancient metabolic pathway // Proc. Natl. Acad. Sci. USA. 2019b. V. 116. P. 6329–6334
Schoelmerich M.C., Katsyv A., Dinig J., Hackmann T.J., Müller V. Energy conservation involving 2 respiratory circuits // Proc. Natl. Acad. Sci. USA. 2020. V. 117. P. 1167–1173.
Schiel-Bengelsdorf B., Dürre P. Pathway engineering and synthetic biology using acetogenes // FEBS Letters. 2012. V. 586. P. 2190–2198.
Shin J., Song Y., Jeong Y., Cho B.-K. Analysis of the core genome and pangenome of autotrophic acetogenic bacteria // Front. Microbiol. 2016. V. 7. P. 1531.
Shin H.J., Yuang K.A., Nam C.W., Park J.M. A genetic approach for microbial electrosynthesis system as biocommodities production platform // Bioresour. Technol. 2017. V. 245. P. 1421–1429.
Schuchman K., Müller V. Direct and reversible hygrogenation of CO2 to formate by a bacterial carbon dioxide reductast // Science. 2013. V. 342. P. 1380–1385.
Schuchman K., Müller V. Autotrophy at the thermodynamic limit of life. A model for energy conservation in acetogenic bacteria // Nat. Rew. Microbiol. 2014. V. 12. P. 809–821.
Shut G.J., Adams M.V. The iron-hydrogenase of Termotoga maritima utilizes ferredoxin and NADH synergistically: a new perspective an anaerobic hydrogen production // J. Bacteriol. 2009. V. 191. P. 4451–4457.
Spirito C.M., Richter H., Rabaey K., Stams A.J.M., Augenent L.T. Chain elongation in anaerobic reactor microbiomes to recover resources from waste // Curr. Opin. Biotechnol. 2014. V. 27. P. 115–122.
Stoll R., Boukis N., Sauer J. Syngas fermentation to alcohols: reactor technology and application // Chen. Ind. Tech. 2020. V. 92. P. 125–136.
trätz M., Sauer U., Kuhn A., Dürre P. Plasmid transfer into the homoacetogen Acetobacter woodii by electroporation and conjugation // Appl. Environ. Microbiol. 1994. V. 60. P. 1033–1037
Straub M., Demler M., Wenster-Botz D., Dürre P. Selective enhancement of autotrophic acetate production with genetically modified Acetobacterium woodii // Biotechnol. 2014. V. 178. P. 67–72.
Takors R., Kopf M., Mampel J., Bluemke W., Blombach B., Eikmanns B., Bengelsdorf F.R., Weuster-Botz D., Dürre P. Using gas mixture of CO, CO2 and H2 as microbial substrates: the do’s and don’ts of successful technology transfer from laboratory to production scale // Microbial. Biotechnol. 2018. V. 11. P. 606–625.
Tremblay P.L., Zhang T., Dar S.A., Leang C., Lovley D.K. The Rnf complex Clostridium ljungdahlii is a proton-translocating ferredoxin:NAD oxireductase essential for autotrophic growth // mBio. 2012. e00406-12.
Tremblay P.L., Hӧglund D., Koza A., Bonde I., Zhang T. Adaptation of the aututrophic acetogen Sporomusa ovata to methanol accelerate the conversion CO2 to organic products // Sci. Rep. 2015. V. 5. P. 16168.
Ueki T., Nevin K.P., Woodart T.L., Lovley D.R. Converting carbon dioxide to butyrate with engineered strain of Clostridium ljungdahlii // mBio. 2014. e01636-14-e4.
Van Hecke W., Bockrath R., De Wever D. Effects of moderately elevated pressure on gas fermentation process // Bioresuor. Technol. 2019. V. 293. P. 122129.
Wang S., Huang H., Kahut Y., Mueller A.P., Kӧpke M., Thauer R.K. NADP-specific electron-bifurcating [Fe-Fe]-hydrogenase in functional complex with formate dehydrogenase in Clostridium autoethanogenum grown on CO // J. Bacteriol. 2013. V. 195. P. 4373–4386.
Westphal L., Wiechmann A., Baker J., Minton N.A., Müller V. The Rnf complex is an energy coupled transhydrogenase essential to reversibly link cellular NADH and ferredoxin pools in the Acetobacterium woodii // J. Bacheriol. 2018. V. 200. e00357-18.
Zhao R., Lin Y., Zhang M., Chai C., Wang J., Yiang W., Gu Y. CRiSPR/gas12-mediated gene deletion and regulation in Clostridia ljungdahlii and its application in carbon flux redirection in synthesis gas fermentation // ACS Synth. Biol. 2019. V. 8. P. 2270–2279.
Zhu H.-F., Lin Z.Y., Zhou L., Yi J-H., Lun Z.-M., Wang S.-N., Tang W.-Z., Li F.-L. Energy conservation and carbon flux distribution during fermentation of CO and H2/CO2 by Clostridium ljungdahlii // Front. Microbiol. 2020. V. 11. P. 416.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология