Микробиология, 2021, T. 90, № 3, стр. 315-328
Таксономическое разнообразие и размерно-морфологическая структура бактериопланктона Рыбинского водохранилища
Е. В. Кузнецова a, *, Е. В. Суханова b, Д. Б. Косолапов a, c
a Институт биологии внутренних вод им. И.Д. Папанина Российской академии наук
152742 Некоузский район, Ярославская область, Борок, Россия
b Лимнологический институт Сибирского отделения Российской академии наук
664033 Иркутск, Россия
c Череповецкий государственный университет
162600 Вологодская область, Череповец, Россия
* E-mail: elivic.rum@gmail.com
Поступила в редакцию 30.12.2020
После доработки 20.01.2021
Принята к публикации 27.01.2021
Аннотация
Впервые с помощью молекулярно-биологических методов изучен таксономический состав бактериопланктона Рыбинского водохранилища. Получены 58 нуклеотидных последовательностей, которые отнесены к 26 операционным таксономическим единицам (ОТЕ): Eubacterium (24 ОТЕ) и Eukaryota (2 ОТЕ). Разнообразие бактериопланктона представлено семью филумами эубактерий: Proteobacteria, Bacteroidetes, Verrucomicrobia, Firmicutes, Actinobacteria, Gemmatimonadetes и Acidobacteria. Доминирующими отмечены альфапротеобактерии вида Candidatus Fonsibacter ubiquis, а также неидентифицированные представители филумов Bacteroidetes и Verrucomicrobia, гомологи которых широко распространены в пресных водоемах и имеют маленькие размеры геномов и клеток. В период проведения исследований в бактериопланктоне преобладали (70–99%) одиночные мелко- и среднеразмерные клетки, наименее уязвимые для элиминирующих факторов контроля “сверху” и “снизу”. Основу численности бактериального сообщества составляли кокки (50–80%), тогда как значительная доля его биомассы приходилась на мелкие палочки (длиной до 2 мкм) (20–30%).
Рыбинское водохранилище – это крупное (4550 км2) равнинное мелководное (средняя глубина 5.6 м) эвтрофное (хлорофилл a – до 40 мкг/л) водохранилище озерного типа (Верхняя Волга). Оно образовано в 1940–1949 гг. и состоит из четырех плесов Центрального, Волжского, Моложского и Шекснинского (Романенко, 1985; Минеева, Макарова, 2018). Регулярные гидрологические, гидрохимические и гидробиологические исследования проводятся на этой сетке станций с конца 1950-х гг. (Романенко, 1985). В результате этих исследований, в частности, выявлены закономерности пространственного распространения и временной динамики бактериопланктона. В годовом цикле в пелагиали водоема наблюдаются два максимума количественного развития бактериопланктона – в конце весны и в конце лета–начале осени (Романенко, 1985; Копылов, Косолапов, 2008).
Таксономическое разнообразие бактериопланктона водохранилищ обычно выше по сравнению с озерными и речными экосистемами (Iliev et al., 2017; Qu et al., 2018), причем оно увеличивается вдоль продольного профиля к приплотинной части водохранилищ (Simek et al., 2008; Wei et al., 2014). Доминирующими филами в водохранилищах, как и в большинстве других пресных водоемов, являются Proteobacteria, Actinobacteria и Bacteroidetes, доля которых в общем количестве бактериопланктона может достигать 95% (Iliev et al., 2017). Кроме того, высоким разнообразием и обилием характеризуются филумы Verrucomicrobia, Firmicutes, Acidobacteria и Cyanobacteria (Polverino et al., 2012; Qu et al., 2018; Кузнецова и соавт., 2020a). Разные филы бактерий по-разному реагируют на зарегулирование рек, например, пространственное распределение Cyanobacteria не изменяется, а распределение Betaproteobacteria и Gammaproteobacteria претерпевает значительные изменения (Ruiz-Gonzalez et al., 2013). В формировании структуры бактериопланктона водохранилищ участвуют абиотические и биотические факторы, такие как температура, концентрация растворенного кислорода, фосфора, неорганического и общего азота, электропроводность и рН воды (Ruiz-Gonzalez et al., 2013; Wei et al., 2014; Yang et al., 2015; Qu et al., 2018). Важную роль играют также прижизненные выделения фитопланктона, выедание протистами и лизис вирусами (Simek et al., 2008).
До сих пор изучение видового состава бактериопланктона Рыбинского водохранилища проводили традиционными культуральными методами. С помощью этих методов определяли также численность физиологических групп микроорганизмов: сапрофитных, нитрифицирующих, денитрифицирующих, амилолитических, целлюлозо- и нефтеразлагающих и др. (Романенко, 1985; Романенко и соавт., 1990). Молекулярно-генетические методы использовали для характеристики эпифитных бактериальных сообществ водохранилища, в составе которых в вегетационный период доминировали два филума: Cyanobacteria и Proteobacteria (Рыбакова и соавт., 2009). При этом изучением микробных сообществ других водоемов занимается множество отечественных авторов (например, Раднагуруева и соавт., 2016; Tsydenova et al., 2018).
Исследование размерно-морфологической структуры бактериоплантона особенно ценно во взаимосвязи с его таксономическим составом. Важно охарактеризовать динамику как генетической, так и фенотической составляющих клеток бактерий. Бактериопланктон функционирует в условиях “функциональной избыточности”, поэтому определяющим критерием генетического обеспечения его регуляции становится способность к накоплению биомассы во взаимосвязи со скоростью метаболизма и частотой размножения (Кузнецова и соавт., 2020б).
Цель работы – с помощью метода секвенирования по Сэнгеру и эпифлуоресцентной микроскопии изучить таксономическую и размерно-морфологическую структуру бактериопланктона Рыбинского водохранилища.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб. Пробы воды отбирали 7 июля 2014 г. на стандартных станциях, расположенных в Волжском (Коприно и Молога) и Центральном (Наволок, Измайлово, Средний Двор и Брейтово) плесах Рыбинского водохранилища. Интегральные пробы получали, смешивая воду, отобранную с каждого метра водной толщи от поверхности до дна, плексигласовым батометром Рутнера. Для количественного учета бактерий, гетеротрофных нанофлагеллят (жгутиконосцев, ГНФ) и вирусных частиц 60 мл интегральной пробы воды помещали в стерильные флаконы и фиксировали формалином, предварительно профильтрованным через мембранный фильтр с диаметром пор 0.2 мкм, до конечной концентрации 2%, хранили в темноте при 4°С и обрабатывали в лаборатории в течение месяца.
Микроскопия. Численность и размерно-морфологические группы бактериопланктона, ГНФ, а также количество вириопланктона определяли методом эпифлуоресцентной микроскопии. Бактерии учитывали на черных ядерных фильтрах с диаметром пор 0.17 мкм (ОИЯИ, г. Дубна, Россия) с использованием флуорохрома DAPI (Porter, Feig, 1980). Фильтровали 2 мл образца. Препараты просматривали при увеличении ×1000 под эпифлуоресцентном микроскопом Olympus BX51 (“Olympus”, Япония), соединенным с цифровой камерой ColorView III (“Olympus”, Япония), при освещении ультрафиолетовыми лучами. Изображение преобразовывали в цифровую форму с помощью программного обеспечения CellF и использовали для последующего подсчета и измерения бактериальных клеток различной морфологии. Объемы бактерий вычисляли с использованием значений длины и диаметра клеток по формуле объема цилиндра с закругленными концами или шара (W = L): V = (π/4) × W 2 × (L – (W/3)), где V – объем клетки, W – ее диаметр и L – ее длина (Krambeck et al., 1981). Сырую биомассу микроорганизмов получали путем умножения их численности на средний объем клеток.
Численность и размеры ГНФ определяли с использованием флуорохрома примулин (Caron, 1983). Численность планктонных вирусных частиц (вириопланктона) определяли с использованием флуорохрома SYBR Green I (Noble, Fuhrman, 1998).
Первичную продукцию фитопланктона и темновую ассимиляцию СО2 определяли радиоуглеродным методом в интегральных пробах воды от поверхности до глубины тройной прозрачности по диску Секки и от поверхности до дна, соответственно (Романенко, 1985).
Молекулярно-генетические методы. Изучение таксономического разнообразия бактериопланктона проводили на стандартной станции Молога, расположенной в Волжском плесе Рыбинского водохранилища на бывшем русле р. Молога в месте ее впадения в р. Волга. Этот глубоководный участок характеризуется высокой продуктивностью и богатством фито- и зоопланктона (Романенко, 1985).
Интегральную пробу воды (800 мл) подвергали префильтрации через поликарбонатные фильтры с диаметром пор 1.5 мкм (ОИЯИ, Дубна, Россия). Затем пробу воды концентрировали на нитроцеллюлозных фильтрах SterivexTM-GS (“Millipore”, США) с диаметром пор 0.22 мкм. Фильтры с биоматериалом фиксировали 80%-ным этиловым спиртом и хранили при температуре 4 ± 2°С.
Выделение суммарной ДНК с фильтров проводили, используя комплект реагентов АмплиПрайм® ДНК-сорб-В (“ИнтерЛабСервис”, Москва, Россия). ДНК элюировали и использовали в качестве матрицы в ПЦР на наборе Encyclo Plus PCR Kit (“Евроген”, Россия). В работе были использованы праймеры, комплементарные наиболее консервативным участкам гена 16S рРНК бактерий (500L–1350R) (Денисова и соавт., 1999).
Лигирование ампликонов осуществляли с помощью набора Clone JETТМ PCR Cloning Kit (“Fermentas”, Литва) по прилагаемой инструкции. Подготовку компетентных клеток штамма E. coli DH5α и трансформацию проводили, используя стандартные методики (Sambrook et al., 1989). Сиквенсную реакцию вели с набором BigDye® Terminator (“Applied Biosystems”, США) согласно протоколу фирмы-производителя. В реакцию брали 10–20 нг ампликона и 3–5 пмоль праймера. Нуклеотидные последовательности определяли на автоматическом капиллярном секвенаторе ABI3500 Genetic Analyzer (“Applied Biosystems”, США) в ГБУЗ “Областной онкологический диспансер” (Иркутск). Идентификацию проводили с помощью сравнительного анализа, используя он-лайн сервисы BLAST и FASTA. Выравнивание последовательностей и построение филогенетических деревьев проводили в программе MEGA v6.
Нуклеотидные последовательности депонированы в базу данных, и им присвоены следующие номера (28 шт.): LT796232–LT796259.
РЕЗУЛЬТАТЫ
В период проведения исследований глубина на стандартных станциях отбора проб в глубоководной части Рыбинского водохранилища находилась в пределах 5–12 м, температура поверхностного слоя воды составляла 18.7–22.2°С, придонного – 14.9–16.3°С. Прозрачность воды изменялась от 100 до 130 см и была ниже в Волжском плесе по сравнению с Центральным (табл. 1). Первичная продукция фитопланктона в период проведения исследований в Волжском плесе была ниже, чем в Центральном плесе: 352–669 и 462–1093 мг С/(м3 сут) соответственно (табл. 1). Однако в среднем за вегетационный сезон значение этого показателя максимальное на ст. Молога (Копылов и соавт., 2007). По-видимому, летнее развитие фитопланктона в начале июля начинается в центральной части водохранилища. Темновая ассимиляция СО2 как интегральный показатель микробной активности, наоборот, была выше в Волжском плесе по сравнению с Центральным: 11.6–11.7 и 6.06–10.1 мг С/(м3 сут) соответственно (табл. 1).
Таблица 1.
Гидрологические и микробиологические параметры воды на стандартных станциях Рыбинского водохранилища 07.07.2014
| Параметры | Станции | |||||
|---|---|---|---|---|---|---|
| Волжский плес | Центральный плес | |||||
| Молога | Коприно | Наволок | Измайлово | Средний Двор | Брейтово | |
| Глубина, м | 12 | 11 | 8 | 5 | 12 | 10 |
| Прозрачность, см | 100 | 100 | 120 | 130 | 110 | 110 |
| Тпов, °С | 20.4 | 18.7 | 18.7 | 19.5 | 19.1 | 22.2 |
| Тдно, °С | 14.9 | 15.7 | 16.0 | 16.3 | 15.5 | 16.0 |
| NBAC, ×106 кл./мл | 6.99 | 5.69 | 7.80 | 5.62 | 4.39 | 5.98 |
| VBAC, мкм3 | 0.032 | 0.059 | 0.018 | 0.034 | 0.029 | 0.038 |
| BBAC, мг С/м3 | 61.2 | 86.3 | 55.0 | 57.8 | 41.5 | 67.0 |
| NHNF, ×103 кл./мл | 5511 | 4101 | 1922 | 3076 | 1538 | 2050 |
| BHNF, мг/м3 | 435 | 398 | 209 | 289 | 92 | 127 |
| NVIR, ×106 частиц/мл | 54.7 | 77.2 | 76.9 | 70.5 | 88.0 | 47.9 |
| NVIR/NBAC | 7.8 | 13.6 | 9.9 | 12.5 | 20.0 | 8.0 |
| PPHY, мг C/(м3 сут) | 669 | 352 | 1093 | 1034 | 882 | 462 |
| DF CO2, мг C/(м3 сут) | 11.7 | 11.6 | 10.1 | 6.93 | 6.27 | 6.06 |
Примечание. Тпов и Тдно – температура воды у поверхности и дна; NBAC, VBAC и BBAC – численность, средний объем клеток и биомасса бактериопланктона; NHNF и BHNF – численность и биомасса ГНФ; NVIR – численность вириопланктона; PPHY – первичная продукция фитопланктона; DF CO2 – темновая ассимиляция СО2.
Численность и биомасса ГНФ на ст. Молога достигали наибольших значений (5511 × 103 кл./мл) и в среднем были выше в Волжском плесе по сравнению с Центральным. Численность вириопланктона на ст. Молога была ниже (55 × 106 частиц/мл), чем на ст. Коприно (77 × 106 частиц/мл), также расположенной в Волжском плесе. Отношение численности вирусов к численности бактерий на ст. Молога было в два раза ниже (7.8), чем на ст. Коприно (13.6), а также на других станциях, расположенных в Центральном плесе (табл. 1).
Численность и размерно-морфологическая структура бактериопланктона. Общая численность бактериопланктона изменялась в пределах (4.4–7.8) × 106 кл./мл. На ст. Молога общая численность бактерий составила 7.0 × 106 кл./мл, средний объем клеток – 0.032 мкм3, биомасса – 224 мг/м3 (табл. 1). Биомасса бактериопланктона была меньше, чем на ст. Коприно Волжского плеса (336 мг/м3), но больше, чем на станциях Центрального плеса (127–188 мг/м3), за исключением ст. Брейтово (227 мг/м3).
В период проведения исследований основу бактериопланктона составляли мелкие и среднеразмерные клетки (табл. 2). Самые мелкие клетки (кокки) составляли большинство от численности бактериопланктона в восточной части Центрального плеса водохранилища: 63% (ст. Наволок) и 44% (ст. Измайлово). В западной части Центрального плеса, а также в Волжском плесе доминирование мелких кокков было менее значительным: 33% (ст. Брейтово) и 35% (ст. Молога) (табл. 2). В центральной части Центрального плеса и на речном участке Волжского плеса численно преобладали среднеразмерные кокки и коккобациллы: 37% (ст. Средний Двор) и 23% (ст. Коприно). Количество среднеразмерных кокков и коккобацилл, а также мелких палочек было примерно одинаковым на станциях Коприно, Наволок и Измайлово, тогда как на станциях Молога, Средний Двор и Брейтово была примерно одинаковой биомасса этих групп. Биомасса мелких палочек на всех станциях составляла 20–30% биомассы всего сообщества. Биомасса мелких и среднеразмерных кокков и коккобацилл была наиболее высокой на станциях Наволок и Средний Двор (более 60%), тогда как на остальных станциях она не превышала 50% общей биомассы бактериопланктона. На ст. Коприно в размерно-морфологической структуре бактериопланктона присутствовали крупные палочки, бактерии, агрегированные с детритом, а биомасса мелких и среднеразмерных кокков и коккобацилл составляла примерно 25% общей бактериальной биомассы (табл. 2).
Таблица 2.
Вклад различных размерно-морфологических групп в формирование общей численности и биомассы в сообществе бактериопланктона на стандартных станциях в Рыбинском водохранилище в летний период (07.07.2014)
| Группа бактерий | Доля в NBAC или BBAC, % | Станции | |||||
|---|---|---|---|---|---|---|---|
| Волжский плес | Центральный плес | ||||||
| Молога | Коприно | Наволок | Измайлово | Ср. Двор | Брейтово | ||
| Мелкие кокки | N/NBAC | 34.8 | 22.1 | 63.2 | 43.9 | 33.6 | 33.3 |
| B/BBAC | 18.7 | 8.6 | 44.5 | 21.6 | 21.1 | 15.2 | |
| Среднеразмерные кокки и коккобациллы | N/NBAC | 31.3 | 23.5 | 17.8 | 15.1 | 37.5 | 28.5 |
| B/BBAC | 28.3 | 17.6 | 23.0 | 12.8 | 39.3 | 25.9 | |
| Крупные кокки | N/NBAC | 0.0 | 2.1 | 1.0 | 0.8 | 1.0 | 1.6 |
| B/BBAC | 0.0 | 6.1 | 3.7 | 2.2 | 2.6 | 3.8 | |
| Мелкие палочки | N/NBAC | 20.9 | 23.5 | 16.8 | 15.9 | 24.0 | 17.9 |
| B/BBAC | 28.4 | 21.8 | 26.9 | 23.8 | 30.5 | 21.8 | |
| Крупные палочки | N/NBAC | 0.0 | 0.2 | 0.0 | 0.0 | 0.0 | 0.0 |
| B/BBAC | 0.0 | 1.7 | 0.0 | 0.0 | 0.0 | 0.0 | |
| Агрегированные | N/NBAC | 13.0 | 28.7 | 1.3 | 24.3 | 3.9 | 18.7 |
| B/BBAC | 24.6 | 44.3 | 2.0 | 40.0 | 6.5 | 33.3 | |
Примечание. Мелкие кокки – диаметр >0.35 мкм, среднеразмерные кокки и коккобациллы – 0.35–0.5 мкм, крупные кокки – >0.5 мкм, мелкие палочки – длина >2 мкм, крупные палочки – длиной ≥2 мкм и агрегированные (ассоциированные с детритом) бактерии. NBAC и BBAC – общая численность и биомасса бактериопланктона; N и B – численность и биомасса его отдельных размерно-морфологических групп.
Таксономическое разнообразие бактериопланктона. В результате молекулярно-генетического анализа бактериопланктона получено 58 нуклеотидных последовательностей, которые были отнесены к 26 операционным таксономическим единицам (ОТЕ) (табл. 3). Процент гомологии полученных последовательностей с идентифицируемыми представителями из баз данных варьировал в диапазоне значений 91–100%.
Таблица 3.
Таксономический статус ближайших гомологов нуклеотидных последовательностей 16S рДНК, полученных из интегральной пробы воды ст. Молога (Рыбинское водохранилище) и размеры их клеток
| Номер ОТЕ | Название клона | Номер в базе | Количество последова-тельностей | Ближайший гомолог, % | Таксономия | Размеры клеток, мкм |
|---|---|---|---|---|---|---|
| Proteobacteria, Alphaproteobacteria | ||||||
| 1 | Bor6-7 | LT796232 | 13 | CP024034 Candidatus Fonsibacter ubiquis LSUCC0530, 99,78 JX448575 Uncultured bacterium clone BT3900DF_07G, 100 |
Pelagibacterales, Pelagibacteracea | 0.12–0.20 |
| 2 | Bor6-29 | LT796233 | 1 | MT733969 Sphingobium hydrophobicum JZY5-15, 99.66 | Sphingomonadales, Sphingomonadaceae | 0.2–1.4 × 0.5–4.0 |
| Proteobacteria, Betaproteobacteria | ||||||
| 3 | Bor6-16 | LT796234 | 1 | HE814741 Variovorax sp. S2H12, 98.8 DQ535024 Beta proteobacterium LH10, 99.0 |
Burkholderiales, Comamonadaceae | 0.5–0.6 × 1.2–3.0 |
| 4 | Bor6-137 | LT796235 | 1 | LC065124.1 Ferrigenium kumadai 98,32 JQ278768.1 Uncultured Rhodocyclaceae bacterium clone fjc-20, 98.77 |
Nitrosomonadales, Gallionellaceae |
0.5–0.7 × 0.8–1.8 |
| Proteobacteria, Gammaproteobacteria | ||||||
| 5 | Bor6-2 | LT796236 | 4 | LR699008 Hafnia alvei MGYG-HGUT-0250, 100.0 | Enterobacteriales, Enterobacteriaceae | 1.0 × 2.0–5.0 |
| 6 | Bor6-46 | LT796237 | 1 | KP318037 Serratia sp. LT10-MRL, 99.89 | Enterobacteriales, Enterobacteriaceae | 0.5–0.8 × 0.9–2.0 |
| 7 | Bor6-149 | LT796238 | 1 | EU434503 Yersinia kristensenii b355, 99.9 | Enterobacterales, Yersiniaceae |
0.5–0.8 × 1.0–2.0 |
| Firmicutes | ||||||
| 8 | Bor6-26 | LT796239 | 1 | KC354637 Bacillus fumarioli, 99.8 | Bacilli, Bacillales, Bacillaceae |
0.6–0.7 × 1.2–3.0 |
| 9 | Bor6-113 | LT796240 | 1 | EF059533 Sedimentibacter sp. JN18_V27_I, 96.6 FJ672111 Uncultured bacterium clone Ll142-3B3, 98.3 |
Tissierellia | 0.35 × 7.0 |
| 10 | Bor6-151 | LT796241 | 1 | KF149330 Leuconostoc lactis IMAU32662, 99.8 | Bacilli, Lactobacillales, Leuconostocaceae |
0.5–0.7 × 0.7–1.2 |
| Actinobacteria | ||||||
| 11 | Bor6-49 | LT796242 | 1 | CP016768 Candidatus Nanopelagicus limnes MMS-21-122, 99.55 JN869205.1 Uncultured bacterium clone NS01 99.66 |
0.4–0.5 × 1.2 | |
| Bacteroidetes, Flavobacteriia, Flavobacteriales | ||||||
| 12 | Bor6-28 | LT796243 | 2 | KF499997 Flavobacterium sp., 98.4–98.6 | Flavobacteriaceae | 0.3–0.5 × 1.0–5.0 |
| 13 | Bor6-52 | LT796244 | 3 | AB517714 Salinirepens amamiensis, 93.1–93.6 EU801372 Uncultured bacterium clone 3C002643, 99.9 |
Cryomorphaceae | 0.3–0.8 × 1.0 |
| Bacteroidetes, Cytophagia, Cytophagales | ||||||
| 14 | Bor6-21 | LT796245 | 1 | AB682160 Algoriphagus aquatilis NBRC 104237, 98.99 AJ697704 uncultured Sphingobacteriales bacterium clone SF68, 100 |
Cyclobacteriaceae | 0.2–0.4 × 1.6–4.0 |
| Bacteroidetes, Chitinophagia, Chitinophagales, Chitinophagaceae | ||||||
| 15 | Bor6-147 | LT796246 | 3 | MF040568.1 Uncultured bacterium clone DWI05E 99.78 | 1.0–2.0 × <4.0 | |
| 16 | Bor6-56 | LT796247 | 1 | KX990239 Flavitalea sp. Ap19E, 93.1 GU305721 Uncultured bacterium clone MYY31, 99.7 |
0.2–0.4 × 1.7–2.0 | |
| 17 | Bor6-62 | LT796248 | 1 | KY060007 Terrimonas sp. C3-5, 96.5 FN668080 Uncultured Sphingobacterium sp. clone ZS-2-342, 99.8 |
0.3–0.5 × 1.8–3.0 | |
| 18 | Bor6-104 Bor6-152 | LT796249 LT796250 |
3 | KC505149 Sediminibacterium sp. JJ2209, 96.5 FN668082 Uncultured Sphingobacterium sp., clone ZS-2-52, 99.8 |
0.2–0.8 × 1.0–3.0 | |
| Gemmatimonadetes | ||||||
| 19 | Bor6-57 | LT796251 | 2 | KF481682 Gemmatimonas phototrophica AP64, 91.3 EU803292 Uncultured bacterium clone 5C230840, 99.7 |
Gemmatimonadales, Gemmatimonadaceae | 0.7–2.5 × 3.2 |
| Verrucomicrobia | ||||||
| 20 | Bor6-34 | LT796252 | 4 | NR_133878 Terrimicrobium sacchariphilum NM-5, 93.56 KP686964 Uncultured bacterium clone T6_0211_66, 99.78 |
0.5–0.7 × 0.6–1.2 | |
| 21 | Bor6-22 | LT796253 | 1 | GU305779 Uncultured bacterium clone MYW38, 100 | Opitutae, Puniceicoccales, Puniceicoccaceae | 0.8–1.0 |
| 22 | Bor6-10 | LT796254 | 1 | HM856557 Uncultured Opitutae bacterium clone YL196, 100 | ||
| 23 | Bor6-101 | LT796255 | 1 | HF947551 Limisphaera ngatamarikiensis NGM72.4, 91.4 HM856557 Uncultured Opitutae bacterium clone YL196, 100 |
Verrucomicrobiae, Verrucomicrobiales | 0.5–0.8 |
| Acidobacteria | ||||||
| 24 | Bor6-64 | LT796256 | 1 | HF559177 Geothrix fermentans HradG1, 93.8 EU803771 Uncultured bacterium clone 5C231394, 99.7 |
Holophagae, Holophagales, Holophagaceae | 0.1–2.0 × 3.0 |
| Eukaryota | ||||||
| 25 | Bor6-12 Bor6-59 |
LT796257 LT796258 |
7 | MG520331 Chrysochromulina parva, 99.89–100.0 AB930789 Uncultured bacterium clone Fei_13Dec10m_67, 99.7–99.8 |
Haptista; Haptophyta; Prymnesiophyceae; Prymnesiales; Chrysochromulinaceae |
3.0–50.0 |
| 26 | Bor6-150 | LT796259 | 1 | LC484192 Cryptomonas curvata CCAP979/52, 99.1 MW128024 Uncultured bacterium clone SupB2020, 99.6 |
Cryptophyta; Cryptomonadales; Cryptomonadaceae |
4.0–9.0 |
В результате сравнительного анализа идентифицировано семь филумов эубактерий: Proteobacteria (7 ОТЕ), Bacteroidetes (7 ОТЕ), Verrucomicrobia (4 ОТЕ), Firmicutes (3 ОТЕ), Actinobacteria (1 ОТЕ), Gemmatimonadetes (1 ОТЕ) и Acidobacteria (1 ОТЕ). Кроме того, определена хлоропластная ДНК гаптофитовых и криптофитовых водорослей (табл. 3). Доминирующими генотипами отмечены неидентифицируемые и некультивируемые представители филумов Proteobacteria, Bacteroidetes и Verrucomicrobia.
На основании сравнительного и филогенетического анализа с последовательностями типовых штаммов с высоким процентом гомологии идентифицированы представители следующих родов: Sphingobium (Alphaproteobacteria), Ferrigenium (Betaproteobacteria), Hafnia, Serratia и Yersinia (Gammaproteobacteria), Bacillus, Leuconostoc и Sedimentibacter (Firmicutes), Flavobacterium, Algoriphagus, Sediminibacterium и Terrimonas (Bacteroidetes) (табл. 3, рис. 1а, 1б). Кроме того, определены представители таких видов, как Candidatus Fonsibacter ubiquis (Alphaproteobacteria) и Candidatus Nanopelagicus limnes (Actinobacteria) (Neuenschwander et al., 2018; Tsementzi et al., 2019). Описание и идентификациях данных организмов была сделала только на исследованиях их геномов.
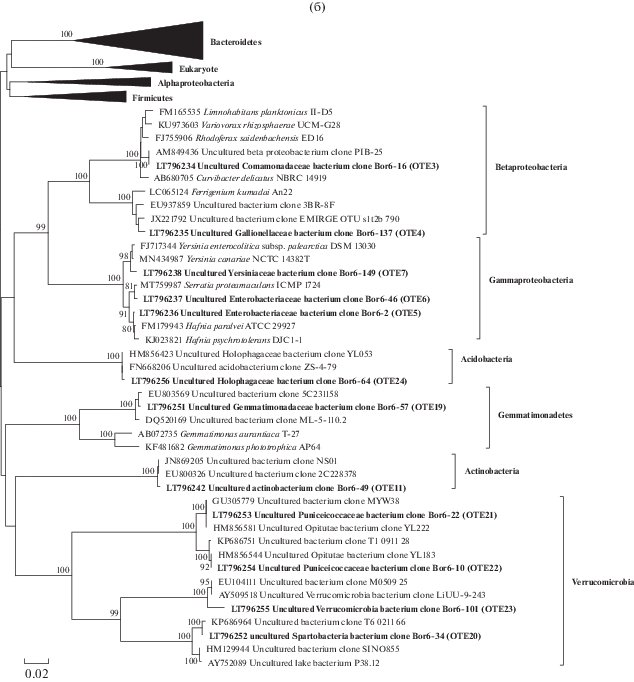
Рис. 1.
Филогенетическое древо, построенное методом объединения ближайших соседей (Kimura 2-parameter model) по фрагменту гена 16S рРНК (850 п.н.). (а) – Представители филумов эубактерий Bacteroidetes, Alphaproteobacteria, Firmicutes, а также Eukaryota; (б) – представители филумов Betaproteobacteria, Gammaproteobacteria, Gemmatimonadetes, Acidobacteria, Verrucomicrobia и Actinobacteria. Последовательности, полученные в данной работе, выделены жирным шрифтом. В круглых скобках указаны номера OTE. Бутстреп-поддержка рассчитана с учетом 1000 реплик, значения меньше 80 не представлены. Масштаб соответствует 2 заменам на 100 пар нуклеотидов.
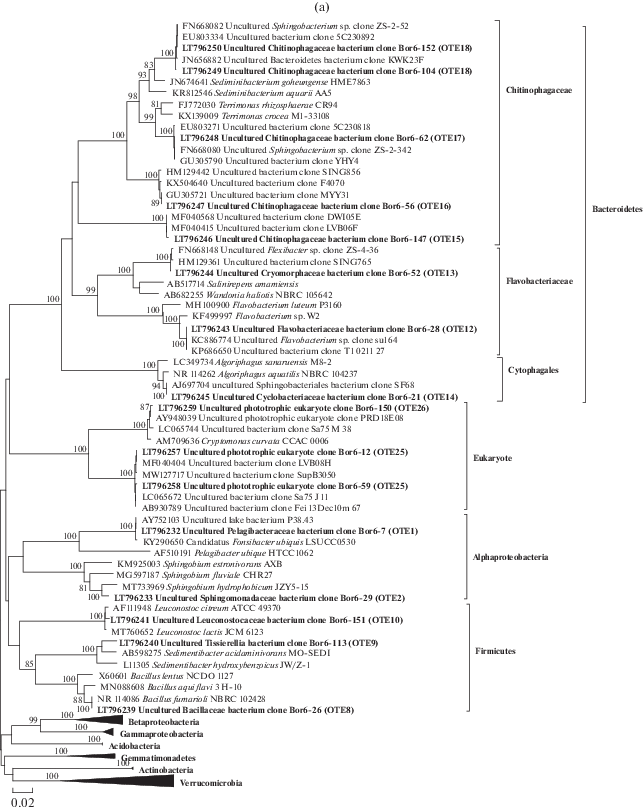
Рис. 1.
Окончание
На рис. 1а представлен филогенетический анализ представителей филума Bacteroidetes. Всего для этого филума получено четырнадцать последовательностей, который распределились на 7 ОТЕ. В классе Flavobacteriia последовательность ОТЕ 12 (клон Bor6-28) формирует кластер с ближайшими некультивируемыми гомологами в пределах рода Flavobacterium, гомология к которым составила 98%. Последовательность клона Bor6-52 (ОТЕ 13) образует кластер с последовательностями некультивируемых бактерий, при этом ближайшие последовательности типовых штаммов родов Salinirepens, Fluviicola и Wandonia с гомологией 93% образуют отдельные кластеры (рис. 1a, табл. 3). В классе Cytophagia последовательность ОТЕ 14 образует кластер с некультивируемыми бактериями в пределах рода Algoriphagus с высоким процентом гомологии (рис. 1а, табл. 3). В результате филогенетического анализа к классу Chitinophagia были отнесены четыре ОТЕ 15–18, которые формируют кластеры с последовательностями, полученными из других пресноводных экосистем, расположенных в различных географических зонах: водохранилище Греции и озер Китая, Швейцарии, Панамы. Однако только ОТЕ 17 и 18 можно определить на уровне рода как Terrimonas и Sediminibacterium, они находятся внутри кластеров типовых штаммов этих родов (рис. 1а). Очевидно, что это могут быть новые виды в пределах описываемых родов.
Отдельная ветвь получена для ОТЕ 25 и 26, которые принадлежат хлоропластной ДНК фототрофных эукариот. ОТЕ 25 образовала кластер с гаптофитовыми одноклеточными водорослями Chrysochromulina parva (семь последовательностей) (рис. 1а, табл. 3). Две последовательности ОТЕ 26 с фотосинтезирующими одноклеточными эукариотическими криптофитовыми водорослями Cryptomonas curvata CCAP979/52.
Ветка Alphaproteobacteria включает в себя ОТЕ 1 и 2. Стоит отметить, что для ОТЕ 1 получено тринадцать последовательностей, которые имели гомологию 99.7% с последовательностью вида Candidatus Fonsibacter ubiquis (рис. 1а). Для ОТЕ 2 ближайшим гомологом является вид Sphingobium hydrophobicum, также с высокой гомологией.
Нуклеотидные последовательности клонов Bor6-26, Bor6-113 и Bor6-151 образовали три кластера в пределах филы Firmicutes и распределились в три рода: Bacillus, Leuconostoc и Sedimentibacter (рис. 1а).
На рис. 1б представлен филогенетический анализ нуклеотидных последовательностей клонов Bor6-16 и Bor6-137, которые относятся к представителям класса Betaproteobacteria. В результате анализа последовательность клона Bor6-16 распределилась в семейство Comamonadaceae с гомологией 98.8%, с такими родами как Rhodoferax, Variovorax, Limnohabitans и Curvibacter. Последовательность клона Bor6-137 принадлежит классу Gallionellaceae, ближайшим культивируемым видом является Ferrigenium kumadai с гомологией 98.8%, которая относится к железоокисляющим бактериям.
ОТЕ 5–7 принадлежат классу Gammaproteobacteria, которые в результате филогенетического анализа были распределены на три рода: Hafnia, Serratia (Enterobacteriaceae) и Yersinia (Yersiniaceae) (рис. 1б).
К филуму Verrucomicrobia были отнесены ОТЕ 20–23, которые распределились в три класса: Opitutae, Terrimicrobia и Verrucomicrobiae, ближайшие гомологи которых являются некультивируемыми бактериями (рис. 1б).
Для ОТЕ 11 ближайшим родственником является вид Candidatus Nanopelagicus limnes с гомологией 99.55% (Actinobacteria) (табл. 3). Последовательность 16S рРНК данного вида не использовали в филогенетическом анализе, т.к. в базе зарегистрирован его полный геном.
Нуклеотидные последовательности клонов Bor6-57 и Bor6-64 принадлежат филумам Gemmatimonadetes и Acidobacteria соответственно. Ближайшими гомологами являются некультивируемые бактерии с высокой гомологией (рис. 1б).
ОБСУЖДЕНИЕ
Размерно-морфологическая структура бактериопланктона. Основу бактериопланктона Рыбинского водохранилища, как и большинства других водоемов, составляют одиночные бактерии, занимающие более половины его биомассы. Доля бактерий, прикрепленных к детриту, увеличивается в летний период. В среднем за вегетационный сезон основной вклад в продукцию бактериопланктона и его потребление консументами вносят крупные палочки (Копылов, Косолапов, 2008). Остальные группы бактерий имеют менее высокие скорости роста, проигрывают крупным палочкам конкурентную борьбу за субстраты, но при этом остаются разнообразными. В связи с благоприятными фотическими условиями, сравнительно высоким содержанием биогенных элементов и органических субстратов на ст. Молога процессы первичной продукции планктона, продукции гетеротрофных бактерий и деструкции органических веществ протекают в 1.5–2 раза интенсивнее, чем на других участках водохранилища (Романенко, 1985; Копылов, Косолапов, 2008).
Отбор проб проводили в сезон, когда крупные палочки элиминируются естественным путем и в сообществе их становится значительно меньше, чем во время пиков количественного развития бактериопланктона, когда они могут составлять до 5% биомассы (Копылов, Косолапов, 2008). В начале июля в период уменьшения численности бактерий их продукция в Волжском плесе снижается до среднего уровня по водохранилищу (Копылов и соавт., 2007).
В период отбора проб на ст. Молога численность и биомасса ГНФ были сравнительно высокими, а численность вириопланктона низкой, по сравнению с другими участками. В бактериопланктоне, биомасса которого была также высокой, отсутствовали крупные палочки, а преобладали средне- и мелкоразмерные клетки. К развитию последних, по-видимому, приводит избирательное действие протистов и вирусов.
Ранее было показано, что в размерно-морфологической структуре бактериопланктона пресноводного озера в Австрии мелкие клетки (диаметром <0.4 мкм) составляют 15–33% его численности, но при этом занимают не более 6% общей биомассы (Pernthaler et al., 1996). Наиболее представлены в бактериопланктоне кокки диаметром ≥0.4 мкм и мелкие палочки (1.2 × 0.4 мкм), которые занимают до 70% общей биомассы сообщества, а крупные палочки (>2.4 × 0.4 мкм) составляют 20–50% биомассы. Вероятно, в среднем за сезон приоритет в метаболизме сообщества у мелких кокков и крупных палочек, которые выигрывают конкурентную борьбу за субстраты, но наиболее уязвимы для консументов и вирусов. Клетки средних размеров проявляют активность в периоды элиминирования мелких клеток и крупных палочек, также они постоянно преобладают по численности и биомассе. В начале июля в Рыбинском водохранилище доминирующими морфотипами были мелкие палочки и кокки. Эти же группы в водохранилище Сербии составляли до 68% и до 40% численности бактериопланктона соответственно (Ciric et al., 2012).
Итак, сообщество планктонных бактерий на ст. Молога Рыбинского водохранилища активно функционирует даже в период понижения его количественных показателей на фоне развития ГНФ. Главная роль в выполнении основных функций сообщества переходит к мелким палочкам, рост и размножение которых ускоряется, а разнообразие остается на высоком уровне.
Таксономическое разнообразие бактериопланктона. Среди доминирующих филумов в бактериопланктоне Рыбинского водохранилища отмечены Proteobacteria и Bacteroidetes, а также Verrucomicrobia, что согласуется с опубликованными данными мировой литературы (Polverino et al., 2012; Iliev et al., 2017; Qu et al., 2018; Кузнецова и соавт., 2020).
Представители Proteobacteria включали три класса Alpha-, Beta- и Gammaproteobacteria. Разнообразие класса альфапротеобактерий на данной станции было низким, но по количественному показателю отмечено преобладание одного вида, который является многочисленным и широко распространенным в пресноводных экосистемах со сложными сезонными моделями аллохтонных и автохтонных источников углерода. Максимальная представленность (13 последовательностей) получена для ОТЕ 1, которая охарактеризована как Candidatus Fonsibacter ubiquis – это маленькие изогнутые палочки размером 1 × 0.2 мкм. Типовым материалом для этого вида является геном WB8_6_001, идентифицированный в пресноводных озерах вдоль реки Чаттахучи, США (Tsementzi et al., 2019). Бактерии отряда “Ca. Pelagibacterales”, обычно обозначаемые как SAR11, составляют самую многочисленную группу микробов в океанах. Бактерии SAR11 клады IIIb распространены глобально и исключительно в пресноводных средах, где они являются одними из наиболее доминирующих представителей, составляя до 20% сообществ озерных бактерий (Tsementzi et al., 2019).
Интересно отметить присутствие гаммапротеобактерий таких родов как Hafnia, Serratia и Yersinia, представители которых относятся к условно-патогенным микроорганизмам, что указывает на поступление антропогенного загрязнения исследуемого участка водохранилища. В летний период при высокой температуре поверхности воды (20°С) данные бактерии способны сохраняться длительное время. Кроме того, их присутствие в воде может указывать на высокую трофность водохранилища.
Следующей группой по представленности последовательностей стал филум Bacteroidetes. Филогенетический анализ показал высокое разнообразие полученных последовательностей, без доминирующего вида в этой группе. Большая часть последовательностей принадлежала семейству Chitinophagaceae и порядку Flavobacteriales. Представителей этой филы бактерий часто детектируют при интенсивном цветении водоемов (Fernandez-Gomez et al., 2013), кроме того ближайшие родственники были выделены из пресных озер и рек. В бактериопланктоне мезотрофного озера во Франции преобладали филумы Proteobacteria и Bacteroidetes (Debroas et al., 2009). Экологическая роль бактерий филума Bacteroidetes состояла в потреблении и переработке гликана и углеводов. Можно предположить, что выявленное в пелагиали Рыбинского водохранилища высокое разнообразие филума Bacteroidetes свидетельствует о том, что на этом участке активно метаболизируются легкоокисляемые органические вещества. Богатство представителей филума Bacteroidetes положительно коррелирует с продуктивностью вод, что обычно наблюдается у животных и растений, но в меньшей мере выявляется или отсутствует у других филумов эубактерий (Lindstrom, 2001).
Представители филума Verrucomicrobia образовали кластеры с некультивируемыми бактериями. Филум Verrucomicrobia содержит пресноводных представителей, которые остаются малоизученными на геномном, таксономическом и экологическом уровнях (Cabello-Yeves et al., 2017). Недавно были реконструированы геномы веррукомикробий из двух пресноводных водоемов, расположенных близко друг к другу (Тус и Амадорио, Испания). Эти геномы, собранные метагеномами (MAG), показывают таксономическое разнообразие внутри филума и включают широкий диапазон предполагаемых размеров генома (от 1.8 до 6 Мб). Среди всех изученных Verrucomicrobia был обнаружен одни из самых маленьких геномов классов Spartobacteria и Opitutae (Cabello-Yeves et al., 2017). Некоторые из семейства Opitutae были небольшими, космополитичными, с общим гетеротрофным метаболизмом с предпочтением углеводов и способными к деградации ксилана, хитина или целлюлозы. Кроме того, получены большие копиотрофные геномы, которые содержат участки, ответственные за разложение полисахаридов и в целом имеют больше стратегий для поглощения питательных веществ и углеводного обмена (Cabello-Yeves et al., 2017). Выявлены геномы с интересными особенностями, например, обнаружены родопсины, поглощающие зеленый свет, и полный набор генов, участвующих в азотфиксации. Эти результаты подчеркивают разнообразие этой клады в пресноводных водах и еще больше расширяют и без того широкий эко-физиологический диапазон этих микробов (Cabello-Yeves et al., 2017).
Бактерии родов Bacillus, Leuconostoc и Sedimentibacter (Firmicutes) – крупные палочки с гетеротрофным типом питания, участвуют в разложении органических веществ, способны образовывать споры в неблагоприятный период развития. Вероятно, в бактериопланктоне присутствовали именно споровые формы, поскольку в размерно-морфологической структуре отсутствовали крупные палочки.
Хлоропластная ДНК определена для хризофитовых и гаптофитовых водорослей, которые характеризуются как фототрофные эукариоты, принадлежащие одноклеточным водорослям. Известно, что особи Chrysochromulina вырастают от 3.0 до 13.0 мкм в длину. Chrysochromulina, как один из родов гаптофитовых водорослей, играет важную роль в глобальном связывании углерода и формировании токсичного цветения в Мировом океане (Cuvelier et al., 2010). Большинство гаптофитов являются фотосинтезирующими микроводорослями, а некоторые из них миксотрофны. Гаптофиты могут жить как в пресных, так и в морских водоемах. Такой комбинированный образ жизни делает гаптофиты эффективными организмами в глобальной фиксации углерода, и они занимают от 30 до 50% фотосинтетической биомассы в океане.
Минорными отмечены представители филумов Gemmatimonadetes, Acidobacteria и Actinobacteria. Нуклеотидные последовательности, принадлежащие филумам Gemmatimonadetes и Acidobacteria, имеют не идентифицированных гомологов. Нуклеотидная последовательность клона Bor6-49 имеет ближайшего гомолога Candidatus Nanopelagicus limnes MMS-21-122 с гомологией 99.55% (Actinobacteria). Этот вид является одним из самых мелких бактерий, объем клетки 0.018 мкм3, размер генома 1.24 Мб, выделен из олигомезотрофного Цюрихского озера (Швейцария), которое характеризуется стойким ежегодным цветением токсичных цианобактерий Planktothrix rubescens (Neuenschwander et al., 2018). Уменьшение генома этих бактерий могло привести к ауксотрофии по различным витаминам, аминокислотам, тем самым создавая зависимость от сопутствующих организмов (гипотеза “Черной королевы”). Более того, анализ генома выявил удивительную степень меж- и внутривидового разнообразия метаболических путей, особенно транспорта и метаболизма углеводов. Поразительная микродиверсификация генотипов актинобактерий acI может объяснить их глобальный успех в высокодинамичных пресноводных средах со сложными сезонными моделями аллохтонных и автохтонных источников углерода (Neuenschwander et al., 2018).
Интересно отметить, что полученные данные в дальнейшем можно использовать для in situ гибридизации, чтобы оценить вклад каждой из таксономической групп в этот период развития бактериального сообщества. В результате проведенной префильтрации проб, мы отсекли агрегированные и крупные бактерии, тем самым изучили разнообразие одиночных средних и мелких микроорганизмов. Кроме того, интересно изучить таксономический состав бактериопланктона в период максимальных пиков развития с преобладанием крупных клеток. Эти исследования покажут полную картину разнообразия и структуры бактериопланктона Рыбинского водохранилища.
Таким образом, на станции Молога генетическое разнообразие бактериопланктона в летний период (июль) представлено филумами Proteobacteria, Bacteroidetes, Verrucomicrobia, Firmicutes, Gemmatimonadetes, Acidobacteria и Actinobacteria. Доминирующими отмечены альфапротеобактерии, бактероиды и веррукомикробии, ближайшие гомологи которых, являются некультивируемыми и широко распространенными в пресных водоемах. Данные виды бактерий имеют маленькие размеры клеток и геномы, при этом активно участвуют в разложении органических веществ.
Впервые с помощью молекулярно-генетических методов изучено таксономическое разнообразие и соотнесено с размерно-морфологической структурой бактериопланктона Рыбинского водохранилища в летний период. Установлено высокое таксономическое разнообразие (26 ОТЕ) с преобладанием некультивируемых и неидентифицируемых бактерий. Результаты согласуются с мировыми публикациями и показывают, что Рыбинское водохранилище – это резервуар для развития широко распространенных бактерий из филумов Proteobacteria, Bacteroidetes, Verrucomicrobia, Firmicutes, Gemmatimonadetes, Acidobacteria и Actinobacteria. Кроме того, морфологическая структура бактериального сообщества подтверждает молекулярно-генетические исследования о присутствии и доминировании средне- и мелкоразмерных клеток, к которым относятся ближайшие гомологи полученных нуклеотидных последовательностей.
Список литературы
Денисова Л.Я., Белькова Н.Л., Тулохонов И.И., Зайчиков Е.Ф. Биоразнообразие бактерий на различных глубинах южной котловины озера Байкал, выявленное по последовательностям 16S рРНК // Микробиология. 1999. Т. 68. С. 475–483.
Denisova L.Ya., Bel’kova N.L., Tulokhonov I.I., Zaichikov E.F. Bacterial diversity at various depths in the southern part of Lake Baikal as revealed by 16S rRNA sequencing // Microbiology (Moscow). 1999. V. 68. P. 547–556.
Копылов А.И., Косолапов Д.Б., Заботкина Е.А. Вирусы в планктоне Рыбинского водохранилища // Микробиология. 2007. Т. 76. С. 879–887.
Kopylov A.I., Kosolapov D.B., Zabotkina E.A. Viruses in the plankton of the Rybinsk Reservoir // Microbiology (Moscow). 2007. V. 76. P. 782–790.
Копылов А.И., Косолапов Д.Б. Бактериопланктон водохранилищ Верхней и Средней Волги. М.: Изд-во совр. гум. универ., 2008. 377 с.
Кузнецова Е.В., Косолапов Д.Б., Белькова Н.Л. Разнообразие планктонных бактерий Дургунского и Тайширского водохранилищ (Западная Монголия) // Микробиология. 2020a. Т. 89. С. 604–611.
Kuznetsova E.V., Kosolapov D.B., Belkova N.L. Diversity of planktonic bacteria in Durgun and Taishir reservoirs (Western Mongolia) // Microbiology (Moscow). 2020. V. 89. P. 595–602.
Кузнецова Е.В., Косолапов Д.Б., Косолапова Н.Г. Таксономическая и размерно-морфологическая структура двух водохранилищ Монголии // Известия РАН. Серия биологическая. 2020б. № 1. С. 22–29.
Kuznetsova E.V., Kosolapov D.B., Kosolapova N.G. Taxonomic and size-morphological groups of bacterioplankton in two mongolian reservoirs // Biology Bull. 2020. V. 47. P. 27–34.
Минеева Н.М., Макарова О.С. Содержание хлорофилла как показатель современного (2015–2016 гг.) трофического состояния водохранилищ Волги // Биол. внутр. вод. 2018. № 3. С. 107–110.
Mineeva N.M., Makarova O.S. Chlorophyll content as indicator of the modern (2015–2016) trophic state of Volga River reservoirs // Inland Water Biol. 2018. V. 11. P. 367–370.
Раднагуруева А.А, Зайцева С.В., Лаврентьева Е.В. Таксономическое разнообразие микробного сообщества термальных источников Байкальской рифтовой зоны // Биотехнология в интересах экономики и экологии Сибири и Дальнего Востока. 2016. С. 98–100.
Романенко В.И. Микробиологические процессы продукции и деструкции органического вещества во внутренних водоемах. Л.: Наука, 1985. 295 с.
Романенко В.И., Захарова Л.И., Романенко В.А. Оценка качества воды по микробиологическим показателям в Рыбинском водохранилище у г. Череповца // Влияние стоков Череповецкого промышленного узла на экологическое состояние Рыбинского водохранилища / Отв. ред. Флеров Б.А. Рыбинск: 1990. С. 24–41.
Рыбакова И.В., Белькова Н.Л., Лаптева Н.А., Суханова Е.В. Адаптация молекулярно-генетических методов для изучения таксономического разнообразия, ассоциированных с макрофитами // Биол. внутр. вод. 2009. № 1. С. 102–110.
Rybakova I.V., Lapteva N.A., Sukhanova E.V., Bel’kova N.L. Adapting molecular-genetic methods for studying the taxonomic diversity of microbial communities associated with macrophytes // Inland Water Biol. 2009. V. 2. P. 96–103.
Cabello-Yeves P.J., Ghai R., Mehrshad M., Picazo A., Camacho A., Rodriguez-Valera F. Reconstruction of diverse verrucomicrobial genomes from metagenome datasets of freshwater reservoirs // Front. Microbiol. 2017. V. 8. Art. 2131. https://doi.org/10.3389/fmicb.2017.02131
Caron D.A. Technique for enumeration of heterotrophic and phototrophic nanoplankton, using epifluorescence microscopy, and comparison with other procedures // Appl. Environ. Microbiol. 1983. V. 46. P. 491–498.
Ciric S., Ilic Z., Milosevic B., Knezevic J., Spasic Z. Abundance and morphotype diversity of bacterioplankton in Celije Reservoir, Serbia // Fresen. Environ. Bull. 2012. V. 21. № 6b. P. 1647–1653.
Cuvelier M., Allen A., Monier A., McCrow J., Messié M., Tringe S., Woyke T., Welsh R., Ishoey T., Lee J.-H., Binder B.J., Dupont C.L., Latasa M., Guigand C., Buck K.R., Hilton J., Thiagarajan M., Caler E., Read B., Lasken R.S., Chavez F.P., Worden A.Z. Targeted metagenomics and ecology of globally important uncultured eukaryotic phytoplankton // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 14679–14684.
Debroas D., Humbert J.-F., Enault F., Bronner G., Faubladier M., Cornillot E. Metagenomic approach studying the taxonomic and functional diversity of the bacterial community in a mesotrophic lake (lac du Bourget – France) // Environ. Microbiol. 2009. V. 11. P. 2412–2424.
Fernandez-Gomez B., Richter M., Schüler M., Pinhassi J., Acinas S.G., González J.M., Pedrós-Alió C. Ecology of marine Bacteroidetes: a comparative genomics approach // ISME J. 2013. V. 7. P. 1026–1037.
Iliev I., Yahubyan G., Marhova M., Apostolova E., Gozmanova M., Gecheva G., Kostadinova S., Ivanova A., Baev V. Metagenomic profiling of the microbial freshwater communities in two Bulgarian reservoirs // J. Basic Microbiol. 2017. V. 57. P. 669–679.
Karayanni H., Macingo S.C., Tolis V., Alivertis D. Diversity of bacteria in lakes with different chlorophyll content and investigation of their respiratory activity through a long-term microcosm experiment // Water. 2019. V. 11. P. 467–482. https://doi.org/10.3390/w11030467
Krambeck C., Krambeck H.-J., Overbeck J. Microcomputer assisted biomass determination of plankton bacteria on scanning electron micrographs // Appl. Environ. Microbiol. 1981. V. 42. P. 142–149.
Lindström E.S. Investigating influential factors on bacterioplankton community composition: results from a field study of five mesotrophic lakes // Microbial Ecol. 2001. V. 42. P. 598–605.
Neuenschwander S.M., Ghai R., Pernthaler J., Salcher M.M. Microdiversification in genome-streamlined ubiquitous freshwater Actinobacteria // ISME J. 2018. V. 12. P. 185–198.
Noble R.T., Fuhrman J.A. Use of SYBR Green I for rapid epifluorescence counts of marine viruses and bacteria // Aquat. Microb. Ecol. 1998. V. 14. P. 113–118.
Pernthaler J., Sattler B., Simek K., Schwarzenbacher A., Psenner R. Top-down effects on the size-biomass distribution of a freshwater bacterioplankton community // Aquat. Microb. Ecol. 1996. V. 10. P. 255–263.
Polverino D., Marinelarena A.J., McCarthy C.B., Rivera-Pomar R.V. Culture-independent characterization of the bacterioplankton community composition of a mesotrophic reservoir (Embalse Rio III, Argentina) // Revista Mexicana de Biodiversidad. 2012. V. 83. P. 548–552.
Porter K.G., Feig Y.S. The use of DAPI for identifying and counting of aquatic microflora // Limnol. Oceanogr. 1980. V. 25. P. 943–948.
Qu J., Jia C., Liu Q., Li Z., Liu P., Yang M., Zhao M., Li W., Zhu H., Zhang Q. Dynamics of bacterial community diversity and structure in the terminal reservoir of the South-to North water diversion project in China // Water. 2018. V. 10. P. 709–722.
Ruiz-Gonzalez C., Proia L., Ferrera I., Gasol J.M., Sabater S. Effects of large river dam regulation of bacterioplankton community structure // FEMS Microbiol. Ecol. 2013. V. 84. P. 316–331.
Sambrook J., Fritsch E.F., Maniatis T. Molecular Cloning: A Laboratory Manual. N.Y.: Cold Spring Harbor Laboratory Press, 1989.
Schiaffino M.R., Sanchez M.L., Gerea M., Unrein F., Balague V., Gasol J.M., Izaguirre I. Distribution patterns of the abundance of major bacterial and archaeal groups in Patagonian lakes // J. Plankton Res. 2016. V. 38. P. 64–82.
Simek K., Hornak K., Jezbera J., Nedoma J., Znachor P., Hejzlar J., Seda J. Spatio-temporal patterns of bacterioplankton production and community composition related to phytoplankton composition and protistan bacterivory in a dam reservoir // Aquat. Microb. Ecol. 2008. V. 51. P. 249–262.
The Prokaryotes. A Handbook on the Biology of Bacteria / Eds. Dworkin M., Falkow S., Rosenberg E., Schleifer K.-H., Stackebrandt E. New York: Springer-Verlag, 2006.
Tsementzi D., Rodriguez-R.L.M., Ruiz-Perez C.A., Meziti A., Hatt J.K., Konstantinidis K.T. Ecogenomic characterization of widespread, closely-related SAR11 clades of the freshwater genus “Candidatus Fonsibacter” and proposal of Ca. Fonsibacter lacus sp. nov. // Syst. Appl. Microbiol. 2019. V. 42. P. 495–505.
Tsydenova B.V., Dagurova O.P., Garankina V.P., Dambaev V.B., Matafonov D.V., Baturina O.A. Abundance and taxonomic composition of bacterioplankton in freshwater Lake Gusinoye (Buryatia) in the warm water zone of the Gusinoozerskaya thermal power plant // J. Siberian Fed. Univ. Biology. 2018. V. 11. P. 356–366.
Wei G., Li J., Wang N., Gao Z. Spatial abundance and diversity of bacterioplankton in a typical stream-forming ecosystem, Huangqian Reservoir, China // J. Microbiol. Biotechnol. 2014. V. 24. P. 1308–1318.
Yang X., Huang T., Zhang H. Effects of seasonal thermal stratification on the functional diversity and composition of the microbial community in a drinking water reservoir // Water. 2015. V. 7. P. 5525–5546.
Дополнительные материалы отсутствуют.


