Микробиология, 2021, T. 90, № 3, стр. 304-314
Метанокисляющая активность и филогенетическое разнообразие аэробных метанотрофов в поверхностных осадках моря Лаптевых
Е. Н. Тихонова a, *, В. В. Кадников b, И. И. Русанов a, А. В. Белецкий b, Е. Е. Захарова a, О. С. Самылина a, Н. В. Равин b, Н. В. Пименов a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
b Институт биоинженерии, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” РАН
119071 Москва, Россия
* E-mail: katerina_inmi@mail.ru
Поступила в редакцию 10.01.2021
После доработки 22.01.2021
Принята к публикации 23.01.2021
Аннотация
Исследованы интенсивность процесса окисления метана и разнообразие метанокисляющих микроорганизмов в поверхностных слоях донных отложений моря Лаптевых в районе метановых сипов, в авандельте р. Лены, краевого шельфа и верхнего участка склона вне прямого влияния сипов и речного выноса. Наибольшие концентрации метана и величины скорости метанокисления были выявлены на сиповых станциях и составляли до 1.16 мкмоль СН4 дм–3 сут–1. Основным продуктом микробного окисления метана для всех исследованных образцов являлась углекислота. На основе анализа последовательностей фрагментов гена 16S рРНК выявлены организмы, относящиеся к классу Gammaproteobacteria, порядку Methylococcales. В местах непрерывного газовыделения доля метанотрофов в составе бактериального сообщества была высока (до 1.93% от общего количества прочтений), что позволяло выявлять их методом секвенирования нативных образцов. Филогенетическое разнообразие метанокисляющих бактерий было невелико, все детектированные последовательности принадлежали организмам, входящим в кластер “Deep-Sea” 1. На филогенетическом дереве последовательности формировали отдельный кластер вместе с родом Methyloprofundus. В накопительных культурах, полученных из образцов осадков прибрежных станций, были обнаружены представители родов Methylomonas и Methylobacter, близкие к метанотрофам, населяющим пресноводные экосистемы.
Одной из серьезных экологических проблем современности является постоянное и значительное увеличение в атмосфере концентрации метана (CH4), который обладает существенно большей способностью к формированию парникового эффекта, чем углекислый газ.
Эмиссия метана с поверхности океанов составляет в среднем 14 (от 5 до 25 по оценкам разных исследователей) Тг (миллионов тонн) С/год (Saunois et al., 2016). Это примерно 4% от общих выбросов из естественных источников и 1.9% от общей эмиссии метана в атмосферу.
Было показано, что важнейшим источником эмиссии метана в атмосферу являются мелководные шельфовые моря Восточной Арктики (МВА): Лаптевых, Восточно-Сибирское и Чукотское (Shakhova et al., 2010, 2014).
Шельф морей Восточной Арктики характеризуется целым рядом особенностей, которые делают его исключительным с точки зрения цикла углерода. Благодаря географическому положению и особенностям седиментации, МВА являются регионом, особенно благоприятным для накопления в их донных отложениях огромных запасов органического углерода (Гинсбург, Соловьев, 1994). Мощные осадочные бассейны, которые формируются в условиях пассивной континентальной окраины, создают благоприятные условия для метаногенеза и формирования залежей метана в донных отложениях. Благодаря длительному субаэральному промерзанию и формированию зон стабильности газогидратов, сохранение метана в таких залежах определяется состоянием мерзлоты (Romanovskii et al., 2005). Глобальное потепление климата в арктическом регионе сопровождается уменьшением зоны мерзлоты осадочной толщи и высвобождением метана в виде локальных сипов (Shakhova et al., 2014).
Значительная часть метана окисляется в верхних слоях осадка и толще воды, не достигая атмосферы (James et al., 2016). Относительно низкий суммарный поток метана в атмосферу из морских экосистем напрямую связан с эффективным микробным фильтром, функционирующим в морских отложениях и водной толще, способным окислять более 80% выделяющегося метана. Процессы метанобразования и метанокисления в биогеохимически активных зонах Северного Ледовитого океана активно изучаются на протяжении более 30 лет (Охотское, Баренцево, Карское, Лаптевых, Белое, Чукотское моря) (Леин и соавт., 1994, 1996; Pimenov et al., 1999; Леин и соавт., 2000; Саввичев и соавт., 2000, 2004, 2007). Результаты этих исследований позволили количественно оценить интенсивности микробных процессов метаногенеза в донных осадках и сопоставить их со скоростями микробного окисления метана в осадках и водной толще других морских регионов. Однако данные о таксономическом разнообразии и функциональной активности отдельных филогенетических групп метанокисляющих бактерий фрагментарны.
В связи с этим целью данной работы была оценка разнообразия и активности аэробных метанокисляющих микроорганизмов в поверхностных осадках моря Лаптевых.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор образцов. Пробы донных осадков были отобраны в ходе 73-го рейса НИС “Академик Мстислав Келдыш” в октябре 2018 г. в море Лаптевых. Для данной работы взяты поверхностные осадки на 6 станциях из 3 различных районов (рис. 1). Две станции (АМК6005 и АМК6009) располагались в районе влияния дельты р. Лены. Три станции находились в районе краевого шельфа. Из них две располагались в районе метановых сипов (АМК6027 и АМК6045), а одна (АМК6053) являлась фоновой, не подверженной прямому влиянию сипов. Еще одна станция (АМК6068) отобрана в верхней части континентального склона. Координаты отбора и описание исследованных осадков приведены в табл. 1.
Рис. 1.
Карта-схема расположения исследованных станций, распределение интегральных величин (рассчитанных под 1 м2 для верхних 10 см осадка) (1) концентрации метана (СН4, мкмоль/дм3) и (2) интенсивности микробного окисления метана (МО, мкмоль/дм3 сут) в море Лаптевых.
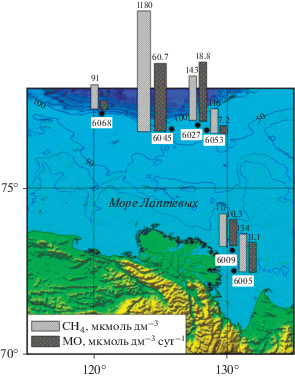
Таблица 1.
Характеристика станций отбора образцов, исследованных в ходе 73 рейса НИС “Академик Мстислав Келдыш”
| Место отбора пробы, горизонт, см | Координаты | Глубина, м | Краткая характеристика осадков | Хлорид, мг/л |
Сульфат, мг/л |
|---|---|---|---|---|---|
| АМК73-6005 0–4 см |
72°30′ с.ш. 130°29.94′ в.д. |
14 | Песчано-алевритовый ил с небольшой примесью мелкозернистого песка, окисленный, темно-коричневый | 8040 | 1190 |
| 4–20 см | Гетерогенный слой алеврита | 10 550 | 1550 | ||
| АМК73-6009 0–2 см |
73°6.9′ с.ш. 130°22.44′ в.д. |
23 | Пелитовый алеврит, сметанообразный, окисленный. Граница с нижележащим слоем постепенная | 11 670 | 1700 |
| 2–10 см | Пелитовый алеврит тeмно-серый, мягкий, со следами биотурбации и рыжими пятнами. Граница плавная | 10 100 | 1400 | ||
| АМК73-6027 (метановый сип) 0–1 см | 76°53.52′ с.ш. 127°47.82′ в.д. |
64 | Алевритово-песчаный наилок, коричневый, окисленный | 14 250 |
2100 |
| 1–6 см | Алевритово-песчаный ил серого цвета с трубками вестиментифер. Граница с нижележащим слоем постепенная | 9850 | 1700 | ||
| АМК73-6045 (метановый сип) 0–3 см | 76°46.44′ с.ш. 125°50.16′ в.д. |
72 | Песчанистый алеврит, полужидкий, окисленный, коричневого цвета. Граница с нижележащим слоем резкая | 12 700 |
2100 |
| 3–7 см | Песчанистый алеврит светло-серого цвета, мягкий. Граница с нижележащим слоем резкая | 13 670 | 2230 | ||
| АМК73-6053 (фоновая станция) 0–4 см |
76°44.34′ с.ш. 128°27.18′ в.д. |
65 | Пелитовый алеврит коричневого цвета, окисленный, полужидкий. Граница с нижележащим слоем постепенная | 13 500 |
2390 |
| 4–10 см | Пелитовый алеврит мягкий, однородный | 12 850 | 2180 | ||
| АМК73-6068 0–1 см |
77°14.76′ с.ш. 120°36.84′ в.д. |
185 | Алевритовый песок, полужидкий, окисленный. Граница с нижележащим слоем постепенная | 11 600 |
1800 |
| 2–5 см | Песчаный алеврит мягкий, с неравномерными включениями линз более плотного осадка. Граница с нижележащим слоем постепенная | 11 900 | 1850 |
В работе использован комплекс радиоизотопных, газо-геохимических, микробиологических и молекулярно-биологических методов. Немедленно после подъема на борт судна коробчатого дночерпателя типа “Box-corer” вставляли в осадок пластиковую трубку диаметром 15 см и отбирали осадочный керн. Затем в судовой лаборатории послойно отбирали образцы донных осадков для измерения содержания и скорости окисления метана, проведения молекулярно-биологического анализа и посевов на селективную минеральную среду для метанотрофов.
Концентрацию метана в придонной воде и донных отложениях измеряли на газовом хроматографе Кристалл-2000-М (ЗАО СКБ “Хроматэк”, Россия) с пламенно-ионизационным детектором методом фазово-равновесной дегазации (Egorov, Ivanov, 1998). Погрешность измерения не превышала 5%.
Измерение скорости окисления метана радиоизотопным методом. Скорость окисления метана (МО) определяли радиоизотопным методом с 14С-метаном, растворенным в дегазированной дистиллированной воде. Из каждого горизонта ненарушенные осадки в количестве 2.5 см3 отбирали пластиковыми шприцами (общий объем 5 см3) с резиновым поршнем и обрезанным краем, герметично закрывали пробкой из бутиловой резины. 0.2 мл меченого 14С-метана (1 мкКи на пробу) вносили туберкулиновым шприцем, прокалывая резиновую пробку иглой по центру и равномерно распределяя субстрат по длине шприца с осадком. Контролем служили пробы, фиксированные 1 мл 0.5 н раствора КОН и выдержанные в холодильнике 6 ч до внесения меченого субстрата. После внесения меченого метана образцы донных осадков инкубировали в течение 2 сут при температуре, близкой к температуре in situ. После инкубации пробы фиксировали и транспортировали в стационарную лабораторию для дальнейшего определения продуктов микробного окисления и трансформации С-метана: в углекислоту (СО2), в биомассу микроорганизмов (БМ) и в растворенный органический углерод (РОУ) в составе растворенного органического вещества (РОВ). Обработку проб и расчеты интенсивности метанокисления проводили по ранее описанной методике (Русанов и соавт., 1998; Ivanov et al., 2002). Радиоактивность (14С) продуктов микробного процесса МО измеряли на жидкостном сцинтилляционном счетчике PackardTRI-CarbTR 2400 (США). Для расчетов численных показателей интенсивности образования продуктов микробного окисления и трансформации углерода метана использовали среднюю величину, полученную из двух повторностей измерений для каждого образца.
Определение состава микробных сообществ методом высокопроизводительного секвенирования гена 16S рРНК. Суммарная ДНК была выделена из 3 г осадка с помощью DNeasy PowerMax Soil Kit (“Qiagen”, Carlsbad, CA, США). ПЦР фрагменты гена 16S рРНК были получены с использованием универсальных праймеров 341F (5'-CCTAYGGGDBGCWSCAG-3') и 806R (5'-GGACTACNVGGGTHTCTAAT-3') (Frey et al., 2016). ПЦР фрагменты были баркодированы с помощью Nextera XT Index Kit v.2 (“Illumina”, США) и очищены с использованием Agencourt AMPure beads (“Beckman Coulter”, Brea, CA, США). Концентрация полученных ПЦР продуктов была подсчитана с помощью Qubit dsDNA HS Assay Kit (“Invitrogen”, Carlsbad, CA, США). Затем все ПЦР фрагменты были смешаны в равных количествах и секвенированы на Illumina MiSeq (2 × 300 нт с обоих концов). Парные чтения были объединены с использованием FLASH v.1.2.11 (Magoc, Salzberg, 2011). Полученные последовательности были кластеризованы в операционные таксономические единицы (ОТЕ) при 97% идентичности с помощью программы Usearch (Edgar, 2010); низкокачественные чтения, химерные и единичные последовательности были удалены при кластеризации с использованием алгоритма Usearch. Таксономическая идентификация была выполнена по базе SILVA v.132 с использованием алгоритма VSEARCH (Rognes et al., 2016). Полученные последовательности были депонированы в GenBank NCBI в рамках проекта PRJNA679168.
Получение и анализ накопительных культур. Для получения накопительных культур метанотрофных бактерий использовали минеральную среду следующего состава: (г/л): КNO3 – 0.25; NH4Cl – 0.25; MgSO4 · 7H2O – 0.4; СaCl2 – 0.1; NaCl – 20.0; КCl – 1.5; Na2HPO4 – 0.358; KH2PO4 – 0.13. Микроэлементы 1 мл/л состава: (мг/100 мл): нитрилтриуксусная кислота (НТА) – 150; MnSO4 ⋅ ⋅ 2H2O – 50; FeSO4 ⋅ 7H2O – 10; CoCl2 – 10; ZnSO4 – 10; CuSO4 ⋅ 5H2O – 1; AlK(SO4)2 – 1; H3BO3 – 1; Na2MoO4 ⋅ 2H2O – 1; рН готовой среды составлял 6.8–7.2.
Во флаконы объемом 120 мл помещали 10 мл среды, 0.5 г образца осадка, герметично закрывали резиновой пробкой. В газовую фазу шприцем добавляли 30% метана. Инкубировали статично при 15°С в течение 1 мес.
После инкубации отбирали аликвоты накопительных культур объемом 2 мл. Выделение тотальной ДНК и секвенирование фрагментов гена 16S рРНК проводили аналогично описанной выше методике.
РЕЗУЛЬТАТЫ
Характеристика районов исследования и микробного окисления метана. На рис. 1 представлено расположение станций отбора образцов. Две станции располагались в авандельте р. Лены (ст. АМК73-6005 и АМК73-6009), две станции в районе метановых сипов (АМК73-6027 и АМК73-6045) и две станции были условно фоновыми, не подверженными прямому влиянию выноса реки или метановых сипов – в районе краевого шельфа (АМК73-6053) и верхнего склона (АМК73-6068). На каждой станции было исследовано 3–4 горизонта осадка от поверхности до глубины 8–10 см. Глубины станций отбора, а также некоторые характеристики исследованных осадков представлены в табл. 1. Верхние 2–4 см всех осадков были представлены окисленными алеврито-песчанистыми или алеврито-пелитовыми илами. Глубже осадки приобретали сероватый оттенок, характерный для слабо окисленных или слабо восстановленных илов.
Содержание метана в верхних горизонтах большинства исследованных станций характеризовалось достаточно высокими величинами и варьировало в интервале 1–2 мкмоль дм–3. Исключение составляют осадки станции АМК73-6045, расположенной в зоне сипа. Концентрация метана на этой станции уже в верхнем горизонте осадка составляла 2.6 мкмоль дм–3, а к 10 см практически линейно увеличилась на порядок до 20.3 мкмоль дм–3 (рис. 1 и 2, табл. 2).
Рис. 2.
Профили распределения величин концентрации метана (мкмоль/дм3) и интенсивности микробного окисления метана (мкмоль/дм3 сут) в верхних горизонтах исследованных станций в море Лаптевых: а, б – авандельта р. Лены (ст. АМК73-6005 и АМК73-6009); в, г – станции над сипами (АМК73-6027 и АМК73-6045); д, е – станция верхнего склона (АМК73-6068) и фоновая станция на шельфе (АМК73-6053).
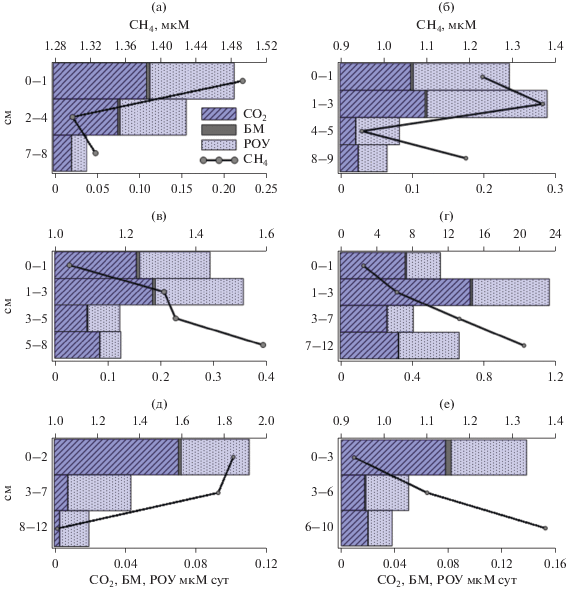
Таблица 2.
Содержание метана и активность его окисления в образцах осадков, отобранных в ходе 73 рейса НИС “Академик Мстислав Келдыш”
| Место отбора пробы, горизонт, см | Содержание метана, мкМ | Скорость окисления метана, мкМ сут |
Включение С-СН4 в СО2, мкМ сут (%) | Включение С-СН4 в БМ, мкМ сут (%) | Включение С-СН4 в РОУ, мкМ сут (%) |
|---|---|---|---|---|---|
| АМК73-6005 | |||||
| 0–1 см 2–4 см 7–8 см |
1.49 1.30 1.33 |
0.21 0.16 0.04 |
0.109 (52) 0.076 (48) 0.021 (54) |
0.004 (2) 0.003 (2) 0.000 (1) |
0.098 (46) 0.077 (50) 0.018 (45) |
| АМК73-6009 | |||||
| 0–1 см 1–3 см 4–5 см |
1.23 1.37 0.95 |
0.197 0.227 0.042 |
0.098 (50) 0.117 (52) 0.021 (51) |
0.004 (2) 0.003 (1) 0.000 (1) |
0.095 (48) 0.106 (47) 0.020 (48) |
| АМК73-6027 | |||||
| 0–1 см 1–3 см 3–5 см 5–8 см |
1.04 1.31 1.34 1.59 |
0.293 0.356 0.123 0.125 |
0.154 (53) 0.185 (52) 0.61 (50) 0.85 (68) |
0.006 (2) 0.005 (2) 0.002 (1) 0.001 (1) |
0.133 (45) 0.166 (47) 0.060 (49) 0.040 (32) |
| АМК73-6045 | |||||
| 0–1 см 1–3 см 3–7 см |
2.58 6.27 13.17 |
0.554 1.155 0.404 |
0.359 (65) 0.718 (62) 0.257 (64) |
0.008 (1) 0.012 (1) 0.003 (1) |
0.187 (34) 0.425 (37) 0.143 (36) |
| АМК73-6053 | |||||
| 0–3 см 3–6 см 6–10 см |
0.93 1.10 1.38 |
0.138 0.050 0.038 |
0.078 (56) 0.017 (35) 0.020 (52) |
0.004 (3) 0.001 (2) 0.000 (1) |
0.56 (41) 0.32 (63) 0.18 (47) |
| АМК73-6068 | |||||
| 0–1 см 10 см |
1.8 1.0 |
0.110 0.020 |
0.070 (64) 0.003 (17) |
0.002 (1) 0.000 (1) |
0.038 (35) 0.016 (82) |
Послойное распределение концентрации метана по горизонтам, в верхнем 10 см слое, также различалось для осадков из разных районов отбора. На станциях авандельты (АМК73-6005 и АМК73-6009) и на станции (АМК73-6068) верхней части склона после поверхностного относительного максимума следовал подповерхностный минимум (рис. 2). Затем с глубиной концентрация метана плавно нарастала. Это может объясняться схожестью в скоростях осадконакопления, наличием лабильного органического вещества на поверхности и интенсивностью микробиологических процессов. В осадках краевого шельфа, как в районе сипов (ст. АМК73-6027 и АМК73-6045), так и на фоновой станции АМК73-6053, слабо подверженной влиянию сипов, наблюдался другой профиль в распределении метана. Начиная от поверхности, концентрация метана практически линейно, плавно или резко, нарастала с глубиной осадка. Максимальное увеличение детектировано на “сиповой” станции АМК73-6045 (рис. 2).
Наибольшие величины скорости МО выявлены в поверхностных окисленных горизонтах 0–1 и 1–3 см осадочной толщи (рис. 2). Ниже окисленной зоны активность метанотрофов резко снижалась на всех исследованных станциях. Максимальные значения величин МО зафиксированы на сиповой станции АМК73-6045, где от поверхностных горизонтов к глубине 1–3 см скорость процесса возрастала в 2 раза от 0.56 до 1.16 мкмоль СН4 л–1 сут–1, а затем на глубине 3–7 см резко уменьшалась до 0.4 мкмоль СН4 л–1 сут–1 (рис. 2).
Профиль распределения продуктов микробного окисления и трансформации углерода метана (до ${\text{НСО}}_{{\text{3}}}^{ - }$, БМ и РОУ) на большинстве станций различался между собой. При этом во всех исследованных осадках наблюдалась общая закономерность. Основным продуктом микробной утилизации метана для всех исследованных образцов являлся ${\text{НСО}}_{{\text{3}}}^{ - }$ (до 68%), в экзометаболиты (РОУ) переходит 30–60% углерода метана, а в биомассу включается до 2%. Исключение составляет осадок с глубины 10 см станции АМК73-6068, где до СО2 окисляется лишь 17% метана.
Характеристики накопительных культур. Первичные накопительные культуры содержали большоеколичество минеральных частиц из образца осадка, поэтому визуально оценить рост метанокисляющих микроорганизмов было практически невозможно. Последующие пересевы на минеральную среду с метаном в качестве источника углерода показали стабильный рост для культур, полученных из образцов осадков со станций АМК73-6005 и АМК73-6009. Равномерный рост характерен для культуры 11L и хлопьевидный рост для культур 13L, 14L и 16L. В фазах экспоненциального и линейного роста преобладали одиночные клетки или диплоформы, в фазе замедленного роста и стационарной фазе за счет выделяемой метанотрофами слизи образовывались скопления, которые выглядели как хлопья.
Идентификация метанотрофов в нативных осадках и накопительных культурах. В результате секвенирования фрагментов генов 16S рРНК для нативных образцов и первичных накопительных культур было получено 4 202 726 и 187 820 последовательностей соответственно. Дальнейшая их кластеризация и анализ по базе SILVA выявили метанотрофных бактерий, относящихся к порядку Methylococcales класса Gammaproteobacteria (рис. 3).
Рис. 3.
Филогенетическое дерево, построенное на основе сравнительного анализа частичных последовательностей гена 16S рРНК и отображающее положение выявленных в ходе данного исследования ОТЕ.

Таксономическое разнообразие метанотрофов в нативных образцах оказалось невелико, были выявлены представители Methylococcaceae, отнесенные только к 4 ОТЕ (табл. 3). Их доля составляла от 0.01 до 1.93% от общего числа последовательностей всех микроорганизмов. На филогенетическом дереве последовательности формировали отдельный кластер вместе с родом Methyloprofundus (рис. 3).
Таблица 3.
Таксономическое разнообразие и относительное обилие метанотрофов в образцах ила моря Лаптевых (% от всего сообщества)
| Организм (ОТЕ) | АМК73-6005 | АМК73-6009 | АМК73-6027 | АМК73-6045 | АМК73-6053 | АМК73-6068 | |||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| горизонт, см | |||||||||||||||
| 0–1 | 7–8 | 0–1 | 3–7 | 0–1 | 3–5 | 5–8 | 0–1 | 1–3 | 3–7 | 0–3 | 3–6 | 6–10 | 0–2 | 10 | |
| ОТЕ75 | 0.01 | – | 0.02 | 0.01 | 1.04 | 0.66 | 1.93 | 0.96 | 0.48 | 0.14 | 0.02 | 0.01 | – | – | – |
| ОТЕ1473 | 0.01 | – | – | – | 0.39 | 0.01 | 0.01 | 0.13 | 0.02 | – | 0.11 | – | – | 0.06 | – |
| ОТЕ991 | – | – | – | – | – | – | – | – | – | 0.01 | – | – | – | – | – |
| ОТЕ1000 | – | – | – | – | 0.01 | – | – | – | – | – | – | – | – | – | – |
В результате секвенирования и филогенетического анализа первичных накопительных культур после инкубирования в среде с метаном были выявлены метанокисляющие бактерии, отличные от организмов в нативных осадках (рис. 3).
Для накопительных культур 11L (культура получена из образца со станции АМК73-6005, 0–1 см), 13L (АМК73-6005, 7–8 см), 14L (АМК73-6009, 0–1 см) и 16L (АМК73-6009, 4–5 см) было получено дополнительно 5 ОТЕ, относящихся к метанотрофам (табл. 4).
Таблица 4.
Таксономическое разнообразие и относительное обилие метанотрофов в первичных накопительных культурах (% от всего сообщества)
| Организм (ОТЕ) | Ближайший культивируемый родственник | % сходства | 11L | 13L | 14L | 16L |
|---|---|---|---|---|---|---|
| ОТЕ19 | Methylomonas lenta | 99 | 11.37 | 2.05 | 0.00 | 0.01 |
| ОТЕ216 | Methylomonas koyamae | 96 | 0.02 | 2.51 | 0.00 | 0.00 |
| ОТЕ16 | Methylomonas koyamae | 97 | 7.39 | 0.02 | 0.00 | 0.00 |
| ОТЕ14 | Methylobacter marinus | 98 | 0.12 | 0.14 | 0.20 | 22.75 |
| ОТЕ1 | Methylobacter tundripaludum | 99 | 9.53 | 43.17 | 53.76 | 39.13 |
В накопительных культурах обнаружены метанотрофы родов Methylomonas (0.01–18.78% от общего числа прочтений) и Methylobacter (9.64–61.88% от общего числа последовательностей). Представители рода Methyloprofundus выявлены не были (в отличие от данных секвенирования для нативных образцов).
ОБСУЖДЕНИЕ
Микробные сообщества осадков Арктических морей активно изучаются с применением методов молекулярной биологии (Koch et al., 2009; Kirchman et al., 2010; Z-eng et al., 2013; Lin et al., 2017). При анализе результатов секвенирования гена 16S рРНК основное внимание, как правило, уделяется крупным таксонам на уровне семейств и выше (Bienhold et al., 2012; Yergeau et al., 2017; Savvichev et al., 2018). Детекция метанотрофов методом секвенирования гена 16S рРНК в сложных микробных сообществах затруднена ввиду того, что эти физиологические группы не являются монофилетичными, и их доля в сообществе обычно невелика (Bapteste, 2005; Knittel, 2009).
Микробиологические исследования метановых сипов в Арктических морях вызывают особый интерес, поскольку в районах газовых высачиваний формируются уникальные бентосные сообщества, основу трофической цепи которых составляют метанотрофные бактерии и археи (Pimenov et al., 1999; Pimenov et al., 2000; Lӧsekann et al., 2007; Savvichev et al., 2018).
Для сравнения на каждой станции нами были рассчитаны интегральные величины для верхнего 10-сантиметрового слоя с площадью 1 м2. Распределение интегральных величин концентрации метана и интенсивности его микробного окисления были сходными на станциях авандельты р. Лены (ст. АМК73-6005 и АМК73-6009), фоновой станции краевого шельфа (АМК73-6053) и станции верхнего склона (АМК73-6068). На “сиповой” станции АМК73-6027 эти величины были несколько выше, а на ст. АМК73-6045 многократно превосходили значения, полученные на других станциях (рис. 1).
Присутствие метанотрофных бактерий было показано на всех исследованных станциях в результате секвенирования последовательностей гена 16S рРНК. Их доля в сообществе резко возрастала в осадках, отобранных в районах метановых сипов (станции АМК73-6027 и АМК73-6045), что обусловлено высоким содержанием метана глубинного происхождения. Данные о процентном соотношении метанотрофов в сообществах согласуются с высокими скоростями микробного метанокисления в этих районах.
Наибольшая доля метанотрофов и интенсивности окисления метана выявлены на сиповой станции АМК73-6045. Осадки этой станции характеризуются резким увеличением количества метана с увеличением глубины осадочной толщи. В условиях разгрузки глубинного метана здесь формируется микробное сообщество, в котором метанотрофы составляют до 1%, что является весьма высоким показателем для этой группы организмов в зонах газопроявления.
Заметному влиянию метановых сипов подвержено микробное сообщество станции АМК73-6027, расположенной на расстоянии 30 миль от станции АМК73-6045. Здесь содержание метана и интегральные интенсивности процесса МО в поверхностных осадках были почти в 2 раза ниже. Однако метанотрофы составляли на этой станции также значительную величину (до 1.94% от всех бактерий), что может быть обусловлено как разгрузкой глубинного метана, так и распространением метана в составе придонных течений на значительные расстояния от площадок активных газовыделений (Shakhova et al., 2010, 2014, 2015). С увеличением расстояния уменьшается влияние сипов: для станций АМК73-6053 и АМК73-6068 зафиксированы невысокие скорости процесса МО и низкая доля метанокисляющих бактерий в микробном сообществе, что согласуется с низким содержанием метана в поверхностных осадках этих станций.
В образцах нативных осадков для всех станций были обнаружены последовательности генов 16S рРНК, принадлежащие метанокисляющим организмам (рис. 3), входящим в кластер “Deep-Sea” 1 (Luke, Frenzel, 2011). Обнаруженные метанотрофы являются филогенетически близкими и характерны для морских экосистем, в том числе для районов, где наблюдаются разгрузки метановых сипов (Bessette et al., 2017; Тихонова и соавт., 2020). Единственным культивируемым организмом в кластере “Deep-Sea” 1 на данный момент является Methyloprofundus sedimenti WF1 (Tavormina et al., 2014), который детектируется во многих морских экосистемах. Этот организм микроаэрофилен, способен расти при низких температурах и высоких значениях солености. Кроме того, показана его способность к образованию эндосимбиотических связей с морскими моллюсками.
Большее таксономическое разнообразие аэробных метанокисляющих бактерий было выявлено методом культивирования для станций АМК73-6005 и АМК73-6009. Здесь количество метана не возрастает с увеличением глубины осадка, процессы его микробного окисления не превышают 0.22 мкмоль СН4 л–1 сут–3. Метан-окисляющие бактерии в составе сообщества не превышали 0.02%, однако их разнообразие оказалось выше, чем в глубоководных станциях. Помимо найденных в нативных образцах представителей кластера “Deep-Sea” 1, характерных для глубоководных морских экосистем, в накопительных культурах были обнаружены организмы, близкие к метанотрофам, населяющим пресноводные экосистемы. В накопительных культурах, полученных из образцов осадков, отобранных на станциях АМК73-6005 и АМК73-6009, обнаружены представители родов Methylomonas и Methylobacter. Их количество в нативных образцах было ниже уровня детекции молекулярно-биологическими методами. Обнаружение этих организмов стало возможным лишь в результате анализа первичных накопительных культур. Вероятно, пресноводные микроорганизмы попадают в осадочную толщу на частицах речной взвеси и сохраняют жизнеспособность в условиях значительного распреснения районов, подверженных влиянию речного стока. Однако низкое содержание метана в поверхностных осадках этих станций не позволяет метанотрофным микроорганизмам активно развиваться и составлять значительную долю в структуре микробного сообщества.
Неожиданным оказалось отсутствие достоверного роста в накопительных культурах из образцов осадков станций АМК73-6027, АМК73-6045, АМК73-6053, АМК73-6068, где наблюдались высокое содержание метана, скорости его микробного окисления, а также в нативных образцах выявлено присутствие метанотрофов. По-видимому, нам не удалось подобрать условия для получения активных накопительных культур этих микроорганизмов. Известно, что представители рода Methyloprofundus и близкие к ним организмы, являются трудно культивируемыми и для получения накопительных культур этих метанотрофов требуется не менее 12 месяцев (Tavormina et al., 2014).
Результаты наших исследований позволяют заключить, что метанотрофные бактерии кластера “Deep-Sea” 1, филогенетически близкие к единственному культивируемому представителю организму Methyloprofundus sedimenti, доминируют в составе сообщества метанотрофов в поверхностных осадках районов газопроявления в море Лаптевых.
Список литературы
Гинсбург Г.Д., Соловьев В.А. Субмаринные газовые гидраты. СПб.: ВНИИОкеангеология, 1994. 199 с.
Леин А.Ю., Миллер Ю.М., Намсараев Б.Б., Павлова Г.А., Пименов Н.В., Русанов И.И., Саввичев А.С., Иванов М.В. Биогеохимические процессы цикла серы на ранних стадиях диагенеза осадков на профиле река Енисей–Карское море // Океанология. 1994. Т. 34. С. 681–692.
Lein A.Yu., Miller Yu.M., Namsaraev B.B., Pavlova G.A., Pimenov N.V., Rusanov I.I., Savvichev A.S., Ivanov M.V. Biogeochemical processes of sulfur cycling in the early stages of sediments diagenesis along the profile from the Yenisei River to the Kara Sea // Oceanology. 1994. V. 34. P. 681–692.
Леин А.Ю., Пименов Н.В., Саввичев А.С., Павлова Г.А., Русанов И.И., Миллер Ю.М., Иванов М.В. Геохимические особенности диагенеза голоценовых отложений в районе архипелага Шпицберген // Океанология. 2000. Т. 40. С. 247–256.
Lein A.Yu., Pimenov N.V., Savvichev A.S., Pavlova G.A., Rusanov I.I., Miller Y.M., Ivanov M.V. Geochemical features of the diagenesis of the holocene deposits in the area of the Spitsbergen Archipelago // Oceanology. 2000. V. 40. P. 228–236.
Леин А.Ю., Русанов И.И., Пименов Н.В. Биогеохимические процессы циклов углерода и серы в Карском море // Геохимия. 1996. Т. 11. С. 1027–1044.
Русанов И.И., Саввичев А.С., Юсупов С.К., Пименов Н.В., Иванов М.В. Образование экзометаболитов в процессе микробного окислении метана в морских экосистемах // Микробиология. 1998. Т. 67. С. 710–717.
Rusanov I.I., Savvichev A.S., Yusupov S.K., Pimenov N.V., Ivanov M.V. Exometabolite formation during microbial oxidation of methane in marine ecosystems // Microbiology (Moscow). 1998. V. 5. P. 710–717.
Саввичев А.С., Русанов И.И., Пименов Н.В., Захарова Е.Е., Веслополова Е.Ф., Леин А.Ю., Крейн К., Иванов М.В. Микробные процессы циклов углерода и серы в Чукотском море // Микробиология. 2007. Т. 76. С. 682–693.
Savvichev A.S., Rusanov I.I., Pimenov N.V., Zakharova E.E., Veslopolova E.F., Ivanov M.V., Lein A.Yu., Crane K. Microbial processes of the carbon and sulfur cycles in the Chukchi Sea // Microbiology (Moscow). 2007. V. 76. P. 603–613.
Саввичев А.С., Русанов И.И., Пименов Н.В., Мицкевич И.Н., Байрамов И.Т., Леин А.Ю., Иванов М.В. Микробиологические исследования северной части Баренцева моря в начале зимнего сезона // Микробиология. 2000. Т. 69. С. 819–830.
Savvichev A.S., Rusanov I.I., Pimenov N.V., Mitskevich I.N., Ba$\overset{\lower0.5em\hbox{$\smash{\scriptscriptstyle\smile}$}}{\iota } $ramov I.V., Lein A.Yu., Ivanov M.V. Microbiological study of the northern part of the Barentz Sea at the onset of winter // Microbiology (Moscow). 2000. V. 69. P. 819–830.
Саввичев А.С., Русанов И.И., Юсупов С.К., Пименов Н.В., Леин А.Ю., Иванов М.В. Биогеохимический цикл метана в прибрежной зоне и литорали Кандалакшского залива Белого моря // Микробиология. 2004. Т. 73. С. 540–552.
Savvichev A.S., Rusanov I.I., Yusupov S.K., Pimenov N.V., Ivanov M.V., Lein A.Yu. The biogeochemical cycle of methane in the coastal zone and littoral of the Kandslaksha Bay of the White Sea // Microbiology (Moscow). 2004. V. 73. P. 457–468.
Тихонова Е.Н., Тарновецкий И.Ю., Малахова Т.В., Гулин М.Б., Меркель А.Ю., Пименов Н.В. Идентификация аэробных метанокисляющих бактерий в прибрежных осадках Крымского полуострова // Микробиология. 2020. Т. 89. С. 737–747.
Tikhonova E.N., Tarnovetskii I.Yu., Malakhova T.V., Gulin M.B., Merkel A.Yu., Pimenov N.V. Identification of aerobic methane-oxidizing bacteria in coastal sediments of the Crimean Peninsula // Microbiology (Moscow). 2020. V. 89. P. 740–749.
Bapteste E., Brochier C., Boucher Y. Higher-level classification of the Archaea: evolution of methanogenesis and methanogens // Archaea. 2005. V. 1. P. 353–363.
Bessette S., Moalic Y., Gautey S., Lesongeur F., GodfroyA., Toffin L. Relative abundance and diversity of bacterial methanotrophs at the oxic–anoxic interface of the Congo deep-sea fan // Front. Microbiol. 2017. V. 8. Art. 715.
Bienhold C., Boetius A., Ramette A. The energy-diversity relationship of complex bacterial communities in Arctic deep-sea sediments // ISME J. 2012. V. 6. P. 724–732.
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461.
Egorov A.V., Ivanov M.K. Hydrocarbon gases in sediments and mud breccias from the central and eastern part of the Mediterranean Ridge // Geo-Mar. Lett. 1998. V. 18. P. 127–138.
Frey B., Rime T., Phillips M., Stierli B., Hajdas I., Widmer F., Hartmann M. Microbial diversity in European alpine permafrost and active layers // FEMS Microbiol. Ecol. 2016. V. 92. fiw018.
Ivanov M.V., Rusanov I.I., Lein A.Yu., Pimenov N.V., Y-usupov S.K. Biogeochemical cycle of methane at North-Western shelf area of the Black Sea // Proc. 6th Int. conf. “Gas in marine sediments”. St. Petersburg, September 5–8. 2000.
James R.H., Bousquet P., Bussmann I., Haeckel M., Kipfer R., Leifer I., Niemann H., Ostrovsky I., Piskozub J., Rehder G., Treude T., Vielstädte L., Greinert J. Effects of climate change on methane emissions from seafloor sediments in Arctic Ocean: A review // Limnol. Oceanogr. 2016. V. 61. S283–S299.
Kirchman D.L., Cottrell M.T., Lovejoy C. The structure of bacterial communities in the western Arctic Ocean as revealed by pyrosequencing of 16S rRNA genes // Environ. Microbiol. 2010. V. 12. P. 1132–1143.
Knittel K., Boetius A. Anaerobic oxidation of methane: progress with an unknown process // Annu. Rev. Microbiol. 2009. V. 63. P. 311–334.
Koch K., Knoblauch C., Wagner D. Methanogenic community composition and anaerobic carbon turnover in submarine permafrost sediments of the Siberian Laptev Sea // Environ. Microbiol. 2009. V. 11. P. 657–668.
Lin X., Zhang L., Liu Y., Li Y. Bacterial and archaeal community structure of pan-Arctic Ocean sediments revealed by pyrosequencing // Acta Oceanologica Sinica. 2017. V. 36. № 8. P. 146–152.
Lüke C., Frenzel P. Potential of pmoA amplicon pyrosequencing for methanotroph diversity studies // Appl. Environ. Microbiol. 2011. V. 77. P. 6305–6309.
Magoc T., Salzberg S.L. FLASH: fast length adjustment of short reads to improve genome assemblies // Bioinformatics. 2011. V. 27. P. 2957–2963.
Pimenov N., Savvichev A., Rusanov I., Lein A., Egorov A., Gebruk A., Moskalev L., Vogt P. Microbial processes of carbon cycle as the base of food chain of Haakon Mosby Mud Volcano benthic community // Geo-Mar. Lett. 1999. V. 19. P. 89–96.
Pimenov N.V., Savvichev A.S., Rusanov I.I., Lein A.Yu., Ivanov M.V. Microbiological processes of the carbon and sulfur cycle in cold methane seeps in the North Atlantic // Microbiology (Moscow). 2000. V. 69. P. 831–843.
Rognes T., Flouri T., Nichols B., Quince C., Mahé F. VSEARCH: a versatile open source tool for metagenomics // PeerJ Preprints. 2016. V. 4. e2409v1.
Romanovskii N.N., Hubberten H.-W., Gavrilov A.V., Eliseeva A.A., Tipenko G.S. Offshore permafrost and gas hydrate stability zone on the shelf of East Siberian Seas // Geo-Mar. Lett. 2005. V. 25. P. 167–182.
Saunois M., Bousquet P., Poulter B., Peregon A., Ciais P., Canadell J.G., et al. The global methane budget 2000–2012 // Earth Syst Sci Data. 2016. V. 8. P. 697–751.
Savvichev A.S., Rusanov I.I., Kadnikov V.V., Beletskii A.V., Ravin N.V., Pimenov N.V. Microbial community composition and rates of the methane cycle microbial processes in the upper sediments of the Yamal sector of the southwestern Kara Sea // Microbiology (Moscow). 2018. V. 87. P. 238–248.
Shakhova N., Semiletov I., Leifer I., Salyuk A., Rekant P., Kosmach D. Geochemical and geophysical evidence of methane release over the East Siberian Arctic Shelf // J. Geophys. Res. 2010. V. 115. C08007.
Shakhova N., Semiletov I., Leifer I., Sergienko V., Salyuk A., Kosmach D., Chernykh D., Stubbs C., Nicolsky D., Tumskoy V., Gustafsson O. Ebullition and storm-induced methane release from the East Siberian Arctic Shelf // Nat. Geosci. 2014. V. 7. P. 64–70.
Shakhova N., Semiletov I., Sergienko V., Lobkovsky L., Yu-supov V., Salyuk A., Salomatin A., Chernykh D., Kosmach D., Panteleev G., Nicolsky D., Samarkin V., Joye S., Charkin A., Dudarev O., Meluzov A., Gustafsson Ö. The East Siberian Arctic Shelf: towards further assessment of permafrost-related methane fluxes and role of sea ice // Phil. Trans. R. Soc. A. 2015. V. 373. Art. 20140451.
Yergeau E., Michel C., Tremblay J., Niemi A., King T.L., Wyglinski J., Lee K., Greer C.W. Metagenomic survey of the taxonomic and functional microbial communities of seawater and sea ice from the Canadian Arctic // Sci. Rep. 2017. V. 7. Art. 42242. https://doi.org/10.1038/srep42242
Zeng Y., Zhang F., He J., Lee S.H., Qiao Z., Yu Y., Li H. Bacterioplankton community structure in the Arctic waters as revealed by pyrosequencing of 16S rRNA genes // Antonie van Leeuwenhoek. 2013. V. 103. P. 1309–1319.
Дополнительные материалы отсутствуют.


