Микробиология, 2021, T. 90, № 3, стр. 337-343
Рамнан клеточной стенки актинобактерий рода Curtobacterium
В. А. Зайчиков a, Н. В. Потехина a, *, А. С. Дмитренок b, Дин Фань a, Е. М. Тульская a, Л. В. Дорофеева c, Л. И. Евтушенко c
a Московский государственный университет им. М.В. Ломоносова,
биологический факультет
119234 Москва, Россия
b Институт органической химии им. Н.Д. Зелинского РАН
119991 Москва, Россия
c Всероссийская коллекция микроорганизмов (ВКМ), Институт биохимии и физиологии микроорганизмов
им. Г.К. Скрябина, ФИЦ Пущинский научный центр биологических исследований РАН
142290 Пущино, Московская обл., Россия
* E-mail: potekhina56@mail.ru
Поступила в редакцию 30.09.2020
После доработки 24.11.2020
Принята к публикации 26.11.2020
Аннотация
С использованием химических и ЯМР-спектроскопических методов впервые установлено, что представители рода Curtobacterium (семейство Microbacteriaceae) содержат в клеточных стенках нейтральный гликополимер рамнан. Рамнан со структурой повторяющегося звена, →2)-α-L-Rhap-(1 → 3)-α-L-Rhap-(1→, обнаружен у C. flaccumfaciens pv. flaccumfaciens ВКМ Ас-1923T, C. flaccumfaciens pv. poinsettiae ВКМ Ас-1924T, C. pusillum ВКМ Ac-2099T, C. herbarum ВКМ Ac-2512T и Curtobacterium sp. ВКМ Ас-1811. Каждый из изученных штаммов содержал также второй гликополимер – кислый бесфосфатный полисахарид. ЯМР-спектры этих полисахаридов различались, указывая на отличия в их структурах. В гидролизатах клеточных стенок всех изученных штаммов выявлены рамноза, манноза, глюкоза, галактоза и глюкозамин. Дальнейшие исследования позволят более полно охарактеризовать состав гликополимеров клеточных стенок различных видов куртобактерий и оценить их таксономическую значимость. Данные по структурам полимеров будут также способствовать пониманию механизмов колонизации и инфекции куртобактериями высших организмов, а также взаимодействия бактерий в микробных сообществах и с различными абиотическими объектами окружающей среды.
Изучение гликополимеров у микроорганизмов различных групп представляет интерес для многих областей фундаментальной и прикладной науки. Клеточные стенки актинобактерий и других грамположительных бактерий обычно содержат вторичные гликополимеры разных типов (классов), ковалентно связанные с пептидогликаном (Kohler et al., 2009; Potekhina et al., 2011; Тульская с соавт., 2011; Schade, Weidenmaier, 2016; Sadovskaya et al., 2017; Шашков с соавт., 2020). Наиболееизученными из них являются фосфатсодержащие полимеры, традиционно называемые тейхоевыми кислотами (Rautenberg et al., 2010; Potekhina et al., 2011). В меньшей степени известно о роли и распространении различных типов бесфосфатных гликополимеров.
Для рамнозосодержащих полимеров, обнаруженных у ряда грамположительных бактерий, было показано, что они являются своеобразными аналогами тейхоевых кислот по локализации и основным функциям в клетке (играют важную роль в биогенезе клеточной стенки и делении клетки, определяют адгезивные свойства и патогенность бактерий, являются рецепторами фагов) (Caliot et al., 2012; van Sorge et al., 2014; Mistou et al., 2016; Sadovskaya et al., 2017).
При сравнительном изучении состава клеточных стенок актинобактерий семейства Microbacte-riaceae (роды Clavibacter, Microbacterium и Rathayi-bacter) были выявлены разнообразные по структуре рамнозосодержащие гликополимеры и показана их специфичность для изученных видов (Takeuchi et al., 1990; Ким с соавт., 2019; Шашков с соавт., 2020). Рамноза была обнаружена также у представителей других родов семейства Microbacteriaceae, в частности, Curtobacterium (Diaz-Maurino, Perkins, 1974; Takeuchi, Yokota, 1989; Takeuchi, Yokota, 1993; Aizawa et al., 2007).
Род Curtobacterium содержит в настоящее время 7 видов (C. albidum, C. ammoniigenes, C. citreum, C. flaccumfaciens, C. herbarum, C. luteum, C. pusillum) (https://lpsn.dsmz.de/genus/curtobacterium). Описанные виды ассоциированы с растениями или их местообитаниями, и лишь C. pusillum выделен из нефтяного месторождения (Iizuka, Komagata, 1965; Evtushenko, Takeuchi, 2006; Saddler et al., 2017). Ряд сообщений, однако, свидетельствует о том, что куртобактерии широко распространены в различных почвах и подпочвенных горизонтах (Chase et al., 2016; Yu et al., 2016; Wang et al., 2017), обнаруживаются в многолетней мерзлоте и ледниках Арктики (Sanyika et al., 2012; Wilhelm et al., 2012). Описано несколько случаев выделения представителей Curtobacterium из клинического материала (Funke et al., 2005; Francis et al., 2011; Rivera et al., 2012).
Некоторые виды Curtobacterium ранее были охарактеризованы по наличию и типу вторичных гликополимеров (отсутствие тейхоевых кислот и наличие бесфосфатных полисахаридов) (Diaz-Mauriño, Perkins, 1974; Takeuchi, Yokota, 1989). Однако химические структуры полимеров установлены не были.
Целью настоящей работы было изучение гликополимеров клеточных стенок у 5 штаммов рода Curtobacterium с разной видовой принадлежностью и отличающихся по экологическим (биологическим) характеристикам и источникам выделения.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы для исследований были получены из Всероссийской коллекции микроорганизмов (ВКМ) (https://www.vkm.ru) и включали фитопатогенов C. flaccumfaciens pv. flaccumfaciens ВКМ Ас-1923T и C. flaccumfaciens pv. poinsettiae ВКМ Ас-1924T, сапрофитов C. herbarum ВКМ Ac-2512T (выделен из травяной подстилки) и C. pusillum ВКМ Ac-2099T (из водного пласта нефтяного месторождения), а также Curtobacterium sp. ВКМ Ac-1811 с неустановленной видовой принадлежностью, изолированного из нематодного галла на стебле вейника (Calamagrostis sp.).
Выращивание культур и получение клеточных стенок проводили, как описано ранее (Potekhina et al., 2011).
Гликополимеры экстрагировали из клеточных стенок с помощью трихлоруксусной кислоты (10% ТХУ при 4°C 24 ч, и затем 5% ТХУ при 100°C 20 мин). Экстракты объединяли, диализовали, лиофилизировали с получением препарата гликополимеров (Potekhina et al., 2011).
Кислотный гидролиз клеточных стенок и препаратов гликополимеров проводили с использованием 2 M HСl (3 ч, 100°C). Для нисходящей хроматографии и электрофореза использовали бумагу “Filtrak FN-3” (Германия) и различные системы растворителей (Potekhina et al., 2011). Фосфатсодержащие соединения проявляли реактивом Ишервуда; соединения, содержащие аминогруппу – нингидрином; полиолы и моносахариды – 5%-ным AgNO3; восстанавливающие моносахариды – анилинфталатом (Potekhina et al., 2011).
Абсолютную конфигурацию рамнозы определяли модифицированным методом с использованием ГЖХ ацетилированных гликозидов с (S)-октан-2-ол, как описано (Potekhina et al., 2011).
Разделение препаратов гликополимеров (на колонке с DEAE-целлюлозой) и ЯМР-эксперименты проводили, как описано ранее (Шашков с соавт., 2020).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ кислотных гидролизатов клеточных стенок всех пяти штаммов и выделенных из них препаратов гликополимеров показал, что они содержат одинаковый набор сахаров (рамноза как доминирующий сахар, манноза, глюкоза, галактоза и глюкозамин) в разных соотношениях. У штамма C. herbarum ВКМ Ac-2512T дополнительно присутствовала фукоза (табл. 1). Фосфорные эфиры глицерина и других полиолов обнаружены не были. Полученные результаты указывали на отсутствие тейхоевых кислот и наличие бесфосфатных гликополимеров.
Таблица 1.
Сахара клеточных стенок пяти изученных штаммов Curtobacterium
| Штаммы Curtobacterium | Сахара клеточной стенки (2 М HCl, 3 ч, 100°С) | |||||||
|---|---|---|---|---|---|---|---|---|
| Gal | Glc | Man | Fuc | Rib | Rha | Амино-сахар | Gro | |
| C. flaccumfaciens pv. flaccumfaciens ВКМ Ас-1923T | +++ | + | ++ | − | + | +++ | GlcN, GalN | сл |
| C. flaccumfaciens pv. poinsettiae ВКМ Ас-1924T | +++ | + | ++ | − | + | ++++ | GlcN, GalN | сл |
| C. herbarum ВКМ Ac-2512T | сл | ++ | ++++ | + | сл | ++++ | GlcN, GalN | + |
| Curtobacterium sp. ВКМ Ас-1811 | +++ | + | ++ | − | − | ++++ | GlcN | + |
| C. pusillum ВКМ Ac-2099T | сл | + | ++ | − | − | ++++ | GlcN | + |
Исследование препаратов гликополимеров с использованием методов ЯМР-спектроскопии показало, что каждый из пяти штаммов содержит в клеточной стенке нейтральный полисахарид рамнан, а также второй полимер кислой природы. Развернутое описание анализа ЯМР-спектроскопических данных приведено для препарата из клеточной стенки штамма ВКМ Ac-1811.
В аномерной области спектра ЯМР 13C препарата гликополимеров, выделенного с помощью экстракции ТХУ, было обнаружено два набора сигналов различной интенсивности: более интенсивные сигналы при δC 102.2 и 103.3 м.д. и несколько менее интенсивных при δC 97–104 м.д. Спектр содержал сигнал карбоксильной группы при δC 175 м.д. и метила пируватной группы при δC 26.4 м.д. и выглядел как спектр смеси кислого и нейтрального полимеров. В результате хроматографического разделения препарата гликополимеров было получено две фракции – с нейтральным и кислым полисахаридами.
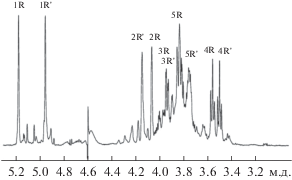
Спектр 13С ЯМР нейтрального полисахарида (табл. 2, рис. 1) был типичным для регулярного полимера с дисахаридным повторяющимся звеном. Спектр содержал два сигнала в области аномерного углеродного резонанса при δC 102.2 и 103.3 м.д., восемь сигналов в области –CH–O– при δC 70–80 м.д. и два сигнала при δC 18.0 и 18.1 м.д.
Таблица 2.
Химические сдвиги в спектрax ЯМР 13С и 1H нейтрального полисахарида рамнана, из клеточной стенки Curtobacterium sp. ВKM Ac-1811
| Химические сдвиги ЯМР 13С (δC TSP* −1.6) и 1H (δH TSP 0.0) | ||||||
|---|---|---|---|---|---|---|
| Остаток | C-1 | C-2 | C-3 | C-4 | C-5 | C-6 |
| H-1 | H-2 | H-3 | H-4 | H-5 | H-6 | |
| Нейтральный полисахарид, рамнан | ||||||
| →2)-α-L-Rhap-(1→ R | 102.2 | 79.4 | 71.3 | 73.0 | 70.4 | 18.0 |
| 5.18 | 4.07 | 3.94 | 3.56 | 3.81 | 1.27 | |
| →3)-α-L-Rhap-(1→ R' | 103.3 | 71.2 | 78.9 | 73.6 | 70.7 | 18.1 |
| 4.96 | 4.15 | 3.85 | 3.50 | 3.76 | 1.31 | |
Рис. 1.
Спектр 13C ЯМР нейтрального полисахарида из клеточной стенки Curtobacterium sp. ВКМ Ac-1811. Обозначения приведены в соответствии с табл. 1. Арабские цифры относятся к номерам атомов углерода в остатках, обозначенных как в табл. 2.
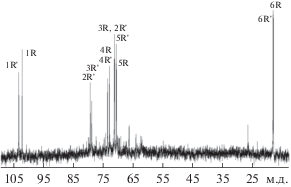
Спектр ЯМР 1H (рис. 2) отображал два сигнала в аномерной области при δH 4.96 и 5.18 м.д. с малыми значениями J, два высокопольных дублета (δH 1.27 м.д., J 6 Гц и δH 1.31 м.д., J 6 Гц) и сигналы в области δH 3.55–4.2 м.д. Кроме того, в спектре 1H ЯМР наблюдали минорные сигналы кислого полимера.
Спектры 1H и 13C ЯМР были расшифрованы с помощью двумерных гомоядерных и гетероядерных методик. В спектрах 1H,1H COSY и TOCSY выявлены два остатка α-рамнопиранозы (α-Rhap) в качестве компонентов повторяющегося звена полисахарида.
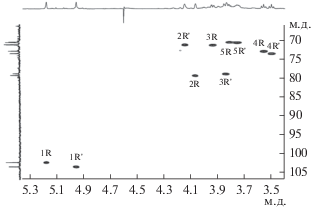
Анализ спектров 1H,13C HSQC (рис. 3, табл. 2) показал замещение одного из остатков α-Rhap в положение 2 (химический сдвиг С-2 при 79.4 м.д.) и второго остатка α-Rhap в положение 3 (C-3 при 78.9 м.д.).
Рис. 3.
Часть 1H,13C-HSQC-спектра нейтрального полисахарида из клеточной стенки Curtobacterium sp. ВКМ Ac-1811. Соответствующие части 1H и 13C ЯМР-спектров приведены вверху и слева от двумерного спектра соответственно. Арабские цифры относятся к атомам в остатках, обозначенных как в табл. 2.
Линейность полимерной цепи была доказана с помощью анализа спектра 1H,1H ROESY (табл. 2), где наблюдали корреляционные пики между остатками H-1(R)/H-3(R') и H-1(R')/H-2(R) (5.18/3.85 и 4.96/4.07). Структура полисахаридной повторяющейся единицы была подтверждена анализом спектра 1H,13C HMBC (табл. 2), в котором были видны пики корреляции между остатками H-1 (R)/C-3 (R') и H-1 (R')/C-2 (R) (5.18/78.9 и 4.96/79.4).
Таким образом, нейтральный полисахарид, с учетом абсолютной L-конфигурации рамнозы, является линейным рамнаном со следующей структурой повторяющегося звена:
Анализ ЯМР-спектров нейтральных фракций гликополимеров четырех других исследованных штаммов куртобактерий показал их полную идентичность с аналогичными спектрами штамма ВКМ Ac-1811, что свидетельствовало об идентичности структур выявленных рамнанов.
Как отмечено ранее, препараты гликополимеров клеточных стенок бактерий всех 5 изученных штаммов содержали также кислые полисахариды, ЯМР-спектры которых имели различия, которые указывали на отличия в структуре полимеров. Предварительный анализ спектров показал присутствие в структуре кислых гликополимеров из штаммов C. flaccumfaciens pv. flaccumfaciens ВКМ Ас-1923T и Curtobacterium sp. ВКМ Ac-1811, наряду с моносахаридными остатками – остатков пировиноградной кислоты (в виде 4,6-связанного пирувата галактозы).
Таким образом, нами установлено, что клеточные стенки актинобактерий рода Curtobacterium содержат, наряду с пептидогликаном В-типа (вариация B2β, D-орнитин в тетрапептидной цепочке) (Schleifer, Kandler, 1972; Saddler et al., 2017), нейтральный гликополимер рамнан с повторяющимся звеном, →2)-α-L-Rhap-(1→3)-α-L-Rhap-(1→, и кислые бесфосфатные полимеры, структуры которых пока не установлены. К общим характеристикам исследованных штаммов следует отнести также набор сахаров (рамноза, манноза, глюкоза, галактоза и глюкозамин), определяемый в кислотных гидролизатах клеточных стенок и выделенных из них препаратов гликополимеров (по методам, описанным в работе Potekhina et al., 2011). У представителей всех видов рода (C. albidum, C. ammoniigenes, C. citreum, C. flaccumfaciens, C. herbarum, C. luteum, C. pusillum), как показано ранее (Diaz-Maurino, Perkins, 1974; Takeuchi, Yokota, 1989) и подтверждено или установлено в настоящей работе, отсутствуют тейхоевые кислоты и гликозил-1-фосфатные полимеры.
Интересно отметить, что вышеперечисленные характеристики свойственны всем изученным штаммам (видам) рода, вне зависимости от их экологических (биологических) особенностей и источника выделения.
Несмотря на то, что рамноза и рамнозосодержащие полимеры встречаются в клеточных стенках многих актинобактерий, рамнаны (основная цепь полимера состоит только из остатков рамнозы) были описаны в единичных случаях, а именно, у актинобактерий родов Bifidobacterium и Rathayibacter (структуры приведены на сайте https://www.csdb.glycoscience.ru). Ранее различные по структуре рамнаны были описаны у бактерий родов Streptococcus и Lactococcus (полимеры, ковалентно связанные с пептидогликаном) (Messner, Schaffer, 2003; Sadovskaya et al., 2017). Рамнаны также были идентифицированы у споро-образующих бактерий семейств Bacillaceae и Paenibacillaceae (в составе гликопротеинов S-слоя) и разных родов филума Proteobacteria (как О-полисахариды) (https://www.csdb.glycoscience.ru). Следует отметить, что наличие остатков рамнозы в гликополимерах поверхностных структур клетки некоторых бактерий связывают с адгезией, образованием биопленок и патогенностью (фитопатогенностью) (Clifford et al., 2013; Michael et al., 2016; Mistou et al., 2016).
Присутствие в клеточной стенке рамнана с повторяющимся звеном →2)-α-L-Rhap-(1→3)-α-L-Rhap-(1→ является одной из хемотаксономических характеристик изученных видов и, по-видимому, рода Curtobacterium в целом. Дальнейшие исследования позволят установить структуры кислых полисахаридов и оценить возможность их использования в качестве хемотаксономических признаков видов. Результаты исследований будут также способствовать пониманию роли гликополимеров в процессах колонизации и инфекции куртобактериями высших организмов, выяснению механизмов взаимодействия бактерий в микробных сообществах и с различными абиотическими объектами окружающей среды.
Список литературы
Ким Д., Тульская Е.М., Дмитренок А.С., Стародумова И.П., Дорофеева Л.В. Сравнительное изучение двух штаммов рода Clavibacter // Всероссийская конф. с международным участием “Микробиология: вопросы экологии, физиологии, биотехнологии”. М.: Макс-Пресс, 2019. С. 58.
Наумова И.Б., Шашков А.С. Анионные полимеры клеточных стенок грамположительных бактерий // Биохимия. 1997. Т. 62. С. 947–982.
Naumova I.B., Shashkov A.S. Anionic polymers in cell walls of gram-positive bacteria // Biochemistry (Moscow). 1997. V. 62. P. 809–840.
Тульская Е.М., Шашков А.С., Стрешинская Г.М., Сенченкова С.Н., Потехина Н.В., Козлова Ю.И., Евтушенко Л.И. Тейхуроновые и тейхулозоновые кислоты актиномицетов // Биохимия. 2011. Т. 76. № 7. С. 904–913.
Tul’skaya E.M., Shashkov A.S., Streshinskaya G.M., Senchenkova S.N., Potekhina N.V., Kozlova Y.I., Evtushenko L.I. Teichuronic and teichulosonic acids of actinomycetes // Biochemistry (Moscow). 2011. V. 76. P. 736–744.
Шашков А.С., Тульская Е.М., Стрешинская Г.М., Дмитренок А.С., Потехина Н.В., Сенченкова С.Н., Пискункова Н.Ф., Дорофеева Л.В., Евтушенко Л.И. Рамноманнаны и тейхуроновая кислота из клеточной стенки Rathayibacter tritici ВКМ Ас-1603Т // Биохимия. 2020. Т. 85. С. 428–437.
Shashkov A.S., Tul’skaya E.M., Streshinskaya G.M., Dmitrenok A.S., Potekhina N.V., Senchenkova S.N., Piskunkova N.F., Dorofeeva L.V., Evtushenko L.I. Rhamnomannans and teichuronic acid from the cell wall of Rathayibacter tritici VKM Ac-1603T // Biochemistry (Moscow). 2020. V. 85. P. 369–377.
Aizawa T., Ve N.B., Kimoto K.I., Iwabuchi N., Sumida H., Hasegawa I., Sasaki S., Tamura T., Kudo T., Suzuki K.I., Nakajima M., Sunairi M. Curtobacterium ammoniigenes sp. nov., an ammonia-producing bacterium isolated from plants inhabiting acidic swamps in actual acid sulfate soil areas of Vietnam // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 1447–1452.
Caliot E., Dramsi S., Chapot-Chartier M.P., Courtin P., Kulakauskas S., Pechoux C., Trieu-Cuot P., Mistou M.Y. Role of the Group B antigen of Streptococcus agalactiae: a peptidoglycan-anchored polysaccharide involved in cell wall biogenesis // PLoS Pathog. 2012. V. 8. e1002756.
Chase A.B., Arevalo P., Polz M.F., Berlemont R., Martiny J.B. Evidence for ecological flexibility in the cosmopolitan genus Curtobacterium // Front. Microbiol. 2016. V. 7. P. 1874.
Clifford J.C., Rapicavoli J.N., Roper M.C. A rhamnose-rich O-antigen mediates adhesion, virulence, and host colonization for the xylem-limited phytopathogen Xylella fastidiosa // Mol. Plant Microbe Interact. 2013. V. 26. P. 676–685.
Diaz-Maurino T., Perkins H.R. The presence of acidic polysaccharides and muramic acid phosphate in the walls of Corynebacterium poinsettiae and Corynebacterium betae // J. Gen. Microbiol. 1974. V. 80. P. 533–539.
Evtushenko L.I., Takeuchi M. Family Microbacteriaceae // The Prokaryotes. 3rd ed. / Eds. Dworkin M., Falkow S., Rosenberg E., Schleifer K.H., Stackebrandt E. N.Y.: Springer Science, 2006. P. 1020–1098.
Francis M.J., Doherty R.R., Patel M., Hamblin J.F., Ojaimi S., Korman T.M. Curtobacterium flaccumfaciens septic arthritis following puncture with a Coxspur Hawthorn thorn // J. Clin. Microbiol. 2011. V. 49. P. 2759–2760.
Funke G., Aravena-Roman M., Frodl R. First description of Curtobacterium spp. isolated from human clinical specimens // J. Clin. Microbiol. 2005. V. 43. P. 1032–1036.
Iizuka H., Komagata K. Microbiological studies on petroleum and natural gas. III. Determination of Brevibacterium, Arthrobacter, Micrococcus, Sarcina, Alcaligenes, and Achromobacter isolated from oil-brines in Japan // J. Gen. Appl. Microbiol. 1965. V. 11. P. 1–14.
Kohler T., Xia G., Kulauzovic E., Peschel A. Teichoic acids, lipoteichoic acids, and related cell wall glycopolymers of Gram-positive bacteria // Microbial Glycobiology: Structures, Relevance and Applications / Eds. Moran A., Holst O., Brennan P.J., von Itzstein M. Amsterdam: Elsevier, 2009. Ch. 5. P. 75–91.
Messner P., Schaffer C. Prokaryotic glycoproteins // Progress in the Chemistry of Organic Natural Products (Fortschritte der Chemie organischer Naturstoffe) / Eds. Chakraborty D.P., Krohn K., Messner P., Roy S., Schaffer C. Vienna: Springer, 2003. V. 85. P. 51–124.
Michael V., Frank O., Bartling P., Scheuner C., Goker M., Brinkmann H., Petersen J. Biofilm plasmids with a rhamnose operon are widely distributed determinants of the ‘swim-or-stick’ lifestyle in roseobacters // ISME J. 2016. V. 10. P. 2498–2513.
Mistou M.Y., Sutcliffe I.C., van Sorge N.M. Bacterial glycobiology: rhamnose-containing cell wall polysaccharides in gram-positive bacteria // FEMS Microbiol. Rev. 2016. V. 40. P. 464–479.
Potekhina N.V., Streshinskaya G.M., Tul’skaya E.M., Shashkov A.S. Cell wall teichoic acids in the taxonomy and characterization of Gram-positive bacteria // Methods in Microbiology / Eds. Rainey F.A., Oren A. Amsterdam: Academic Press/Elsevier, 2011. V. 38. Ch. 6. P. 131–164.
Rautenberg M., Kohler T., Xia G., Kulauzovic E., Peschel A. Structure, biosynthesis, and function of teichoic acids and related cell wall glycopolymers in the Gram-positive cell envelope // Prokaryotic Cell Wall Compounds / Eds. Konig H., Claus H., Varma A. Berlin: Springer, 2010. P. 155–174.
Rivera R., Cheema A., Mai J., Oehler R.L., Sandin R.L., Greene J.N. Curtobacterium brain abscess: case report // Infect. Dis. Clin. Pract. 2012. V. 20. P. e17–e19.
Saddler G.S., Guimaraes P.M., Hamada M., Suzuki K.I. Curtobacterium // Bergey’s Manual of Systematics of Archaea and Bacteria / Eds. DeVos P., Dedysh S., Hedlund B., Kampfer P., Rainey F., Trujillo M.E., Bowman J.P., Brown D.R., Glockner F.O., Oren A., Paster B.J., Wade W., Ward N., Busse H.J., Reysenbach A.L. UK: John Wiley and Sons, Ltd., 2017. Version 2. P. 1–16.
Sadovskaya I., Vinogradov E., Courtin P., Armalyte J., Meyrand M., Giaouris E., Palussiere S., Furlan S., Pechoux C., Ainsworth S., Mahony J., van Sinderen D., Kulakauskas S., Guerardel Y., Chapot-Chartier M.P. Another brick in the wall: a rhamnan polysaccharide trapped inside peptidoglycan of Lactococcus lactis // mBio. 2017. V. 8. e01303-17.
Sanyika T.W., Stafford W., Cowan D.A. The soil and plant determinants of community structures of the dominant actinobacteria in Marion Island terrestrial habitats, Sub-Antarctica // Polar Biol. 2012. V. 35. P. 1129–1141.
Schade J., Weidenmaier C. Cell wall glycopolymers of Firmicutes and their role as nonprotein adhesins // FEBS Lett. 2016. V. 590. P. 3758–3771.
Schleifer K.H., Kandler O. Peptidoglycan types of bacterial cell walls and their taxonomic implications // Bacteriol. Rev. 1972. V. 36. P. 407–477.
Takeuchi M., Yokota A. Cell-wall polysaccharides in coryneform bacteria // J. Gen. Appl. Microbiol. 1989. V. 35. P. 233–252.
Takeuchi M., Yokota A. Evaluation of cell-wall sugar composition as a taxonomic marker of some coryneform bacteria // J. Gen. Appl. Microbiol. 1993. V. 39. P. 505–512.
Takeuchi M., Yokota A., Misaki A. Comparative structures of the cell-wall polysaccharides of four species of the genus Microbacterium // J. Gen. Appl. Microbiol. 1990. V. 36. P. 255–271.
van Sorge N.M., Cole J.N., Kuipers K., Henningham A., Aziz R.K., Kasirer-Friede A., Lin L., Berends E.T.M., Davies M.R., Dougan G., Zhang F., Dahesh S., Shaw L., Gin J., Cunningham M., Merriman J.A., Hütter J., Lepenies B., Rooijakkers S.H.M., Malley R., Walker M.J., Shattil S.J., Schlievert P.M., Choudhury B., Nizet V. The classical lancefield antigen of group a Streptococcus is a virulence determinant with implications for vaccine design // Cell Host Microbe. 2014. V. 15. P. 729–740.
Wang Q., Wang R., He L., Sheng X. Location-related differences in weathering behaviors and populations of culturable rock-weathering bacteria along a hillside of a rock mountain // Microb. Ecol. 2017. V. 73. P. 838–849.
Wilhelm R.C., Radtke K.J., Mykytczuk N.C., Greer C.W., Whyte L.G. Life at the wedge: the activity and diversity of Arctic ice wedge microbial communities // Astrobiology. 2012. V. 12. P. 347–360.
Yu Y., Sheng X., He L., Huang Z. Linkage between culturable mineral-weathering bacteria and their weathering effectiveness along a soil profile // Geomicrobiol. J. 2016. V. 33. P. 10–19.
Дополнительные материалы отсутствуют.