Микробиология, 2021, T. 90, № 3, стр. 286-303
Микроорганизмы донных отложений Байкала – самого глубокого и древнего озера мира
Т. И. Земская a, *, С. В. Букин a, А. В. Ломакина a, О. Н. Павлова a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
* E-mail: tzema@lin.irk.ru
Поступила в редакцию 09.12.2020
После доработки 24.12.2020
Принята к публикации 25.12.2020
Аннотация
В обзоре обобщены результаты исследования микробных сообществ в донных осадках озера Байкал, полученные в последние десятилетия с помощью разных подходов. С использованием метабаркодинга в осадках районов со спокойным осадконакоплением показано доминирование представителей Alpha-, Gammaproteobacteria (включая Betaproteobacteriales), Bacteroidetes, Acidobacteria, Verrucomicrobia, Thaumarchaeota, характерных обитателей других пресноводных озер. Структура микробных сообществ изменялась в зонах разгрузки газосодержащих минерализованных флюидов в зависимости от наличия акцепторов электронов, интенсивности и компонентного состава газосодержащих флюидов, обеспечивающих миграцию микроорганизмов из глубинной зоны в поверхностные слои донных отложений и наоборот. В осадках Байкала детектированы археи, способные образовывать метан по всем четырем известным катаболическим путям: гидрогенотрофному, ацетокластическому, метилотрофному и водород-зависимому метилотрофному. В сообществах архей доминировали гидрогенотрофные метаногены семейства Methanoregulaceae (род Methanoregula, Methanosphaerula и некультивируемые), водород-зависимые метилотрофные археи порядка Methanomassiliicoccales и ацетокластические метаногены семейства Methanosaetaceae (род Methanothrix (Methanosaeta)), составляющие ядро метаногенных сообществ в донных отложениях других пресноводных озер. Экспериментально доказано протекание процесса анаэробного окисления метана (АОМ) по нитрат- и нитритзависимому пути с участием архей подкластера ANME-2d и бактерий филума NC10, с высокой степенью идентичности структур генов 16S рРНК, mcrA и pmoA пресноводным участникам этого процесса. Разнообразие микробных сообществ в районах естественных выходов нефти отличалось на уровне семейств и порядков, а также наличием в геномах культивируемых видов алкангидроксилаз.
ДОННЫЕ ОТЛОЖЕНИЯ ОЗЕРА БАЙКАЛ КАК СРЕДА ОБИТАНИЯ МИКРООРГАНИЗМОВ
Озеро Байкал – самое глубокое и древнее озеро мира, общий объем его донных отложений составляет около 75 тыс. км3, их максимальная мощность превышает 9 км (Логачев, 2003). Байкальская впадина с максимальной глубиной 1642 м расположена в центре тектонически активной рифтовой зоны, самые древние отложения датируются олигоценовым возрастом (Hutchinson et al., 1992; Мац и соавт., 2001). Впадина разделена на три котловины – южную, среднюю и северную, отделенные друг от друга подводными возвышенностями – Бугульдейской перемычкой и Академическим хребтом (риc. 1). Осадки в трех глубоководных частях озера имеют идентичный химический состав в результате гомогенизации мелких фракций, поступающего терригенного материала, переносимого установившимися течениями (Гвоздков, 1998). Вся центральная часть дна озера занята диатомовыми илами, концентрация биогенного кремния в поверхностных илах пелагиали в среднем составляет 19%. До 90% дна покрыто осадками, с содержанием SiO2биог. более 10% (Гранина, 2008). Средняя концентрация Сорг в осадках Байкала 1.9%, в отложениях Южного и Среднего Байкала 1.5–2.5%, в северной котловине – 1.0–1.3% (Выхристюк, 1980), что сопоставимо с отмечаемыми значениями в океанических отложениях в высокопродуктивных континентальных окраинах (Qiu et al., 1993). По данным Л.А. Вы-христюк (1980) в состав захороненного органического вещества (ОВ) входят гуминовые кислоты и целлюлоза, сильно разложившиеся остатки высших наземных растений и фитопланктона, обладающие высокой устойчивостью к дальнейшей деградации.
Геохимические процессы в донных отложениях Байкала были предметом исследований многих авторов (Мизандронцев, 1975; Погодаева и соавт., 2007; Гранина, 2008; Och et al., 2012; Pogodaeva et al., 2017). Одной из важнейших особенностей озера Байкал является широко представленная окислительная стадия раннего диагенеза (Гранина, 2008). Глубина проникновения кислорода в осадки от менее 2 до более 50 мм, толщина окисленного слоя от 0.2 до >30 см. Величины рН в осадке в основном находятся в интервале 6.9–7.4, при диапазоне от 6 до >8 (Мизандронцев, 1975; Гранина, 2008). По данным И.Б. Мизандронцева (1978) глубокое проникновение кислорода обусловлено медленным накоплением осадков в Байкале, причем поверхностные осадки окислены на большей части дна (Гранина, 2008). Скорости осадконакопления в открытом Байкале меняются от 0.015 до более 1 мм/год (Колман и соавт., 1993; Vologina et al., 2000).
Поровые воды донных отложений в районах со спокойным осадконакоплением наследуют химический состав озерных вод и характеризуются однородным солевым составом. Наиболее распространенными растворенными ионами в озере Байкал являются ${\text{HCO}}_{3}^{ - }$ и Ca2+. Что касается цепных биогеохимических процессов, наиболее важным отличием от морской воды является очень малая концентрация растворенного ${\text{SO}}_{4}^{{2 - }}$ в водах озера Байкал (0.05 мМ) по сравнению с морской водой (28.9 мМ) (Aloisi et al., 2019). Другие ионы, которые составляют большую часть растворенных солей в морской воде (Cl–, Na+, Mg2+ и K+), присутствуют в водах озера Байкал в очень малых концентрациях (≤0.15 мМ) (Погодаева и соавт., 2007; Pogodaeva et al., 2017). При диагенетических преобразованиях суммарные концентрации ионов в поровых водах увеличиваются с глубиной осадка за счет увеличения концентрации ионов бикарбоната и кальция. Из-за нехватки акцепторов электронов ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - },$ большая часть растворенного неорганического вещества, образующегося в результате разложения ОВ и последующих окислительно-восстановительных реакций, находится в форме CO2, а не ${\text{HCO}}_{3}^{ - },$ что приводит к более низким pH в диагенетической среде (Мизандронцев, 1975). Пополнение ОВ ежегодно происходит в весенний и осенний периоды за счет массового развития диатомовых водорослей (Вотинцев и соавт., 1975), в летний период – пикопланктона (Nagata et al., 1994). С использованием седиментационных ловушек показано присутствие раковин диатомовых водорослей и органического вещества автохтонного происхождения на всех глубинах водной толщи (Вологина, Штурм, 2017), тогда как лишь 10% пикопланктона достигает дна.
МИКРОБИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ ДОННЫХ ОТЛОЖЕНИЙ ОЗЕРА БАЙКАЛ
Микробиологические исследования донных отложений озера Байкал проводятся с начала прошлого столетия с использованием подходов и методов, широко используемых в водной микробиологии. Направления исследований и основные результаты приведены в монографиях и многочисленных статях (Микроорганизмы в экосистемах озер и водохранилищ, 1985; Намсараев, Земская, 2000; Микробиологическое наследие ХХ века, 2004). На Байкале работала целая плеяда ведущих микробиологов России, включая С.И. Кузнецова, А.Е. Крисса, Ю.И. Сорокина, А.П. Романову, А.Г. Родину, Г.А. Дубинину, В.Н. и Э.А. Максимовых, Б.Б. Намсараева. В публикациях приведены сведения о количестве микроорганизмов в осадках озера Байкал с различными геохимическими обстановками, проанализировано распространение физиологических групп микроорганизмов в разных районах и глубинах осадочной толщи, дана оценка метаболической активности микробных сообществ, в том числе в районах с повышенным антропогенным воздействием (Микроорганизмы в экосистемах озер и водохранилищ, 1985; Намсараев, Земская, 2000; Микробиологическое наследие ХХ века, 2004). Новый этап исследований роли микробных сообществ в донных отложениях был начат в период масштабных геолого-геофизических работ, проводимых международными коллективами ученых на Байкале с конца 90-х годов прошлого столетия. В эти годы основное внимание было уделено исследованию микроорганизмов, участвующих в разных этапах деструкции ОВ, оценке скоростей процессов деструкции органического вещества в осадочной толще Байкала (Максимова, Максимов, 1989; Намсараев, Земская, 2000; Пименов и соавт., 2014). Было установлено, что развитие определенных физиологических групп микроорганизмов в донных отложениях определяется доступностью субстратов, окисленными или восстановленными условиями на определенных глубинах осадочной толщи и поступлением газосодержащих минерализованных флюидов из глубинных осадков. Ежегодное поступление в осадки органического вещества и низкие концентрации сульфат иона обеспечивают доминирование процесса метангенерации на конечных этапах деструкции.
РАЗНООБРАЗИЕ МИКРООРГАНИЗМОВ В ДОННЫХ ОТЛОЖЕНИЯХ ОЗЕРА БАЙКАЛ
Особый прогресс по оценке разнообразия микробных сообществ достигнут с применением молекулярно-биологических методов и подходов. С помощью методов секвенирования генов 16S рРНК и mcrA получены данные о разнообразии и функционировании микроорганизмов в осадках с различным составом поровых вод (Шубенкова и соавт., 2005; Kadnikov et al., 2012; Черницына и соавт., 2016; Lomakina et al., 2018). Как и в других пресноводных озерах, таксономический состав микробных сообществ по глубине осадка в Байкале неодинаков и определялся наличием окислителей, концентрацией и составом доступного ОВ и других жизненно важных элементов (Кузнецов, 1970; Заварзин, 2003; Huang et al., 2019; Han et al., 2020). В одних случаях микробиомы в осадках одного района и со сходными условиями различались вкладом доминирующих таксонов (Земская и соавт., 2018; Zakharova et al., 2018), а в других отмечалось их сходство с микробиомами из других районов и слоев донных отложений (Шубенкова и соавт., 2005; Kadnikov et al., 2012; Zemskaya et al., 2015а; Черницина и соавт., 2016; Bukin et al., 2016; Lomakina et al., 2018). В сообществах окисленных осадков и до нижней границы проникновения кислорода (2 см) доминировали типичные для пресноводных озер органотрофные бактерии (Actinobacteria, Proteobacteria, Verrucomicrobia), для которых показано участие в первых этапах деструкции органических соединений (Newton et al., 2011). Большой вклад представителей двух первых филумов в бактериальные сообщества характерен для окисленных слоев всех исследованных нами осадков Байкала, тогда как доминирование в сообществах представителей филума Verrucomicrobia отмечалось не везде (Kadnikov et al., 2012; Zemskaya et al., 2015а; Земская и соавт., 2018; Zakharova et al., 2018). Согласно данным по структуре геномов микроорганизмов из тех же таксономических групп, которые были выявлены в аэробной зоне осадков Байкала (в основном Alpha-, Beta- и Gammaproteobacteria, Bacteroidetes, Acidobacteria, Verrucomicrobia, Planctomycetes), а также их ближайших известных родственников, в окисленной зоне обитают аэробные и факультативно анаэробные бактерии, окисляющие углеводы, аминокислоты и жирные кислоты (Yoon et al., 2008; Pujalte et al., 2014; Sun et al., 2016), и аэробные нитрифицирующие археи (MGI и SCG) (Cabello-Yeves et al., 2020; Han et al., 2020; Spang et al., 2012). На границе аэробной и анаэробной зон, при высоком вкладе таксонов, доминирующих в вышерасположенных слоях осадка, как правило, увеличивался вклад представителей Bacteroidetes, принадлежащих семействам Flavobacteriaceae, Sphingobacteriaceae, а также неклассифицированных микроорганизмов. В анаэробной зоне осадка, в частности, в зоне залегания железо-марганцевого слоя (ЖМС), преобладали последовательности с неустановленной таксономической принадлежностью, положительно коррелирующие с концентрацией ионов марганца, и последовательности Alpha- и Betaproteobacteria, сопряженные с содержанием ионов железа (Земская и соавт., 2018). Согласно данным H.T. Торрес и соавт. (2014), Mn(IV) (и потенциально Fe(III)) могут действовать как окислители для микробиологически опосредованного процесса нитрификации. Действительно, в сообществах исследованного нами керна, ниже границы проникновения кислорода, наблюдалось увеличение вклада нитритокисляющих бактерий филума Nitrospirae, а также присутствие архей филума Thaumarchaeota, обеспечивающих процессы окисления аммония до нитрита. Их участие в метаболизме азота было подтверждено при метагеномном анализе геномов (MAGs) из глубинной зоны Южного Байкала (Cabello-Jeves et al., 2020). В геномах микроорганизмов, в том числе принадлежащих этим таксонам, выявлены гены окисления аммония и нитрита, разложения мочевины и цианата или ассимиляции нитратов/нитритов, денитрификации. Представители филума Firmicutes, для культивируемых штаммов которых показано участие в окислении Fe(II) и Mn(II) в Байкале (Захарова и соавт., 2010), составляли незначительный процент в сообществе из верхнего слоя ЖМС и более значимый вклад в нижнем слое (7.6%). Среди них большая часть принадлежит родам Bacillus и Clostridium, идентичность которых культивируемым железо-марганцевым бактериям из озера Байкал не подтверждена. Изменения в структуре микробного сообщества при смене окисленных условий на восстановленные отмечены при исследовании микробных сообществ донных осадков в озере Штехлин и в пяти озерах Центральной Швейцарии (Wurzbacher et al., 2017; Han et al., 2020). Как полагают авторы, разнообразие сообществ в этих зонах определялось изменениями источников ОВ, реакциями дыхания и избирательным выживанием микроорганизмов. Поэтому таксоны, которые уже присутствовали в осадках во время седиментации, могут быть лучше приспособлены к выживанию в условиях низкой доступности источников энергии и должны доминировать с увеличением глубины отложений (Lever et al., 2015; Starnawski et al., 2017; Rissanen et al., 2019). Это согласуется с нашими данными по исследованию разнообразия микробных сообществ донных осадков Южного Байкала. Мы отмечали увеличение вклада представителей Bacteroidetes, Alpha-, Betaproteobacteria в микробное сообщество осадка, на глубине 8–9 см, минорное присутствие которых регистрировалось в поверхностном слое этого осадка. Согласно данным (Колман и соавт., 1993; Vologina et al., 2000) возраст осадка на этой глубине оценивается в 100–500 лет, и вполне вероятно, что именно представители этих таксонов оказались более адаптированными к существованию в низкоэнергетических условиях. Культивируемые представители таксонов из этой зоны являются хемоорганотрофами, хемолитотрофами и факультативными фотогетеротрофами и встречаются в различных биотопах. Следует отметить разнообразное бактериальное сообщество и в более глубоких (до 4 м) слоях донных отложений озера Байкал (Zemskaya et al., 2015а; Черницына и соавт., 2016; Bukin et al., 2016; Lomakina et al., 2018).
Важной частью микробных сообществ в осадках озера Байкал являются археи. Их присутствие зафиксировано уже в первых сантиметрах окисленных осадков, и увеличение разнообразия в захороненных окисленных осадках и в слоях с повышенными концентрациями марганца и железа (Земская и соавт., 2018). Одним из доминирующих таксонов в осадках Байкала являются представители филума Thaumarchaeota (линии Marine Group I), широко распространенные в почвенных и водных экосистемах и участвующие в аэробном окислении аммония (Walker et al., 2010). В осадках из разных районов Байкала идентифицированы кластеры последовательностей родственные культивируемому виду Nitrosopumilus maritimus линии MGI и некультивируемым представителям данного филума (Lomakina et al., 2018). В осадках фоновых районов обнаружены представители филумов E-uryarchaeota (Uncultured Methanomicrobia), Bath-yarchaeota, Aigarchaeota, Aenigmarchaeota, Wo-esearchaeota, Thaumarchaeota, Hadesarchaeota (ранее известные как SAGMEG-1). Выявлены также представители некультивируемой линии Marine Bentic Group D (MBG-D) порядка Thermoprofundales, ранее относящиеся к Thermoplasmatales и широко распространенные в пресноводных и морских местах обитания (Schubert et al., 2011). Их большой вклад отмечался в сообществах метановых сипов (Beal et al., 2009), осадков из озера Павин (Borrel et al., 2012). Предполагается, что они могут осуществлять деструкцию белков в морских осадках, а также участвовать в процессах метаногенеза или анаэробного окисления метана (АОМ) (Schubert et al., 2011).
Иной состав архей наблюдался в осадочных толщах, приуроченных к зонам высачивания минерализованных газосодержащих флюидов. Поровые воды в таких местах характеризуются как гидрокарбонатно-сульфатные, сульфатные или хлоридные (Мизандронцев, 1975; Клеркс и соавт., 2003; Гранина 2008; Minami et al., 2010; Zemskaya et al., 2015а; Pogodaeva et al., 2020). На состав поровых вод значительное влияние оказывали интенсивность флюидопотоков и конкретный состав химических компонентов (Aloisi et al., 2019). Как оказалось, механизмы миграционных флюидопотоков в районах грязевых вулканов и метановых сипов влияют также на состав и структуру микробных сообществ (Шубенкова и соавт., 2005; Kadnikov et al., 2012; Ломакина и соавт., 2014; Zemskaya et al., 2015а; Черницына и соавт., 2016; Bukin et al., 2016; Lomakina et al., 2018). В частности, в районе метанового сипа “Красный Яр” показано поступление насыщенных кислородом поверхностных осадков и аэробных микроорганизмов на глубину более 1 м, а в осадках сипа на поднятии Посольская Банка – поступление глубинной микрофлоры на поверхность осадка за счет функционирования “флюидной петли” (Nauds et al., 2012; Черницына и соавт., 2016; Pogodaeva et al., 2020). Особые пути миграции флюидных потоков, циркулирующих в зоне стабильности газовых гидратов (400 м) объясняют присутствие в значительных количествах последовательностей филумов Chloroflexi и Acidobacteria, филумов-кандидатов Aminicenantes и Atribacteria в поверхностных слоях донных отложений, а филума Deinococcus–Thermus в глубинных донных отложениях. В зонах с особо интенсивными потоками минерализованных флюидов и газов отмечено формирование микробных матов двух типов: с доминированием бесцветных серных бактерий (Кузнецов и соавт., 1991) или метанотрофных бактерий (Zemskaya et al., 2015b). Микробные сообщества, функционирование которых основано на метанотрофии, характерны для лесных почв, лугов, рисовых полей, водно-болотных угодий и донных отложений в пресных, соленых или щелочных озерах (Ding, Valentine, 2008). Наличие больших полей микробных матов было обнаружено над массивными слоями гидратов метана в батипелагиали Среднего Байкала с помощью ГОА “Мир”, где они обеспечивали жизнедеятельность широкого спектра бентосных животных (Zemskaya et al., 2012; Ситникова и соавт., 2017). Интенсивные потоки метана, образующегося как за счет растворения гидратов метана, так и за счет деятельности гидрогентрофных метаногенов, обеспечивали развитие в аэробном слое микробных матов метано- и метилотрофных бактерий (Kadnikov et al., 2012; Zemskaya et al., 2015b), которые потреблялись бентосными животными, что подтверждено результатами изотопного состава углерода бентосных животных из данного района (Zemskaya et al., 2012). В сообществе микробных матов выявлены представители родов Methylobacter, Methylophilus, Methylotenera, обитающие в различных холодноводных экосистемах (Dedysh et al., 2001; Pacheco-Oliver et al., 2002) и обладающие ферментными системами, обеспечивающими различные шаги окисления метана до СО2 и биомассы. Под слоем матов, в поверхностных слоях осадка этого района доля археи составляла около 2/3 всего микробного сообщества (Kadnikov et al., 2012), включая анаэробных метанотрофов Candidatus Methanoperedens sp. (ANME-2d) и гидрогенотрофных метаногенов рода Methanosphaerula. В районе интенсивных минерализованных потоков в других районах Байкала также формировались микробные маты, где доминирующая роль принадлежит бесцветным серным бактериям, относящимся к роду Thioploca (Кузнецов и соавт., 1991; Земская и соавт., 2001). Аналогично морским представителям данного рода, обитающие в Байкале серные бактерии, осуществляют процесс окисления сульфидов за счет редукции нитратов и являются хемоорганогетеротрофами (Земская и соавт., 2001). Функционирование сообщества бактериальных матов в этом районе, как и в районах морских метановых сипов, обеспечивается за счет хемосинтеза и метанотрофии (Намсараев, Земская, 2000; Ding, Valentine, 2008).
МИКРООРГАНИЗМЫ, УЧАСТВУЮЩИЕ В ПРОЦЕССЕ МЕТАНГЕНЕРАЦИИ
Ранее было показано, что основным конечным продуктом деструкции органического вещества в донных отложениях Байкала является метан (Намсараев, Земская, 2000; Дагурова и соавт., 2004), а процессы его биогенного образования могут распространяться на сотни метров вглубь осадочной толщи озера (Кузьмин и соавт., 2001). В зонах разгрузок углеводородов, илах низкотемпературного вента Фролиха и отложениях ряда районов с повышенным содержанием органического вещества, генерировалось 5.0–534.7 мкл CH4/кг в сутки, что соответствуют скоростям метангенерации в других олиготрофных и мезотрофных пресноводных озерах (Duc et al., 2010; Fuchs et al., 2016; Yang et al., 2020), однако интенсивность метаногенеза в фоновых районах пелагической зоны озера была ниже (0.01–32.29 мкл CH4/кг в сутки) и сопоставима с таковой в осадках высокопродуктивных районов океана и соленых меромиктических озер Шира и Шунет (Capone, Kiene, 1988; Каллистова и соавт., 2006). Как и во многих других пресноводных озерах, из-за низких концентраций ${\text{SO}}_{4}^{{2 - }}$ в поровых водах, верхняя граница зоны метангенерации в осадках Байкала определяется только глубиной проникновения O2 (Намсараев, Земская, 2000; Koizumi et al., 2003; Conrad et al., 2007). Так, в районах сипов, грязевых вулканов и подводного низкотемпературного источника зафиксировано активное образование метана уже в первом сантиметре восстановленных с поверхности донных отложений (Намсараев, Земская, 2000; Дагурова и соавт., 2004), а метан и этан, поступающие с глубинным флюидом и связанные в структуре газовых гидратов, имели биогенное, термогенное или смешанное биогенно-термогенное происхождение (Клеркс и соавт., 2003; Калмычков и соавт., 2006). Паттерн вертикального распределения метангенерации в таких районах различался, но зачастую повышенные значения скоростей метаногенеза фиксировались в поверхностных илах до глубин 20–30 см, с последующим всплесками активности в отдельных глубинных слоях (Намсараев, Земская, 2000; Дагурова и соавт., 2004). Исследования, проведенные в зонах, не подверженных влиянию разгрузок углеводородов, показали почти линейное увеличение содержания метана в осадках до глубин 2–2.5 м, что коррелировало с содержанием гидрокарбонат-иона, высвобождающегося в ходе диагенеза органического вещества (Pogodaeva et al., 2017). Однако в ряде случаев, от 2.5 м и до самых нижних вскрытых слоев, при переходе к серо-голубым глинам отмечалось резкое возрастание концентраций метана и скоростей его образования, что также подтверждает наличие активных метаногенных сообществ в глубинах осадочной толщи озера Байкал (Намсараев, Земская, 2000).
Как известно, метаногенные археи способны использовать в качестве источников углерода и энергии весьма ограниченный спектр субстратов, образующихся на первых этапах анаэробной деструкции органического вещества. Среди них выделяют H2 : CO2, ацетат, С1-метилированные соединения (метанол, метиламины, метилсульфиды и др.), которые потребляются гидрогенотрофными, ацетокластическими и метилотрофными метаногенами соответственно (Thauer et al., 2008). В донных отложениях глубоководных зон стратифицированных озер зачастую отмечается увеличение вклада ацетокластического метаногенеза, что обусловлено деятельностью гомоацетогенных микроорганизмов (Schulz, Conrad, 1996; Nozhevnikova et al., 2007). В психрофильных условиях гомоацетогены способны эффективно конкурировать с гидрогенотрофными метаногенами за H2, осуществляя редукцию СO2 до ацетата, который накапливается в осадке и далее диспропорционируется до метана ацетокластическими метаногенами (Kotsyurbenko et al., 2005). Однако в озере Байкал доминирование ацетокластического метаногенеза установлено только в осадках мелководных районов, тогда как в донных отложениях глубоководной зоны 75–100% метана образовывалось из H2 : CO2, а концентрация ацетата варьировала от 4 до 98 мкмоль/л (Намсараев, Земская, 2000). Высокий вклад гидрогенотрофного метаногенеза (99%) был отмечен даже в районе низкотемпературного вента Фролиха, где содержание ацетата в поровых водах может достигать 1 ммоль/л, а среди архей выявлена большая доля (25%) ацетокластических метаногенов (Lomakina et al., 2018). Точная причина данного феномена не выяснена. Концентрации H2 в составе газа осадочной толщи озера Байкал не превышает 0.0632 об. % (Кузьмин и соавт., 2001), а температура донных отложений в глубоководной части озера (≤4°C) делает термодинамически не выгодным синтрофное окисление ацетата, что не позволяет объяснить доминирование гидрогенотрофного пути дополнительным подтоком водорода или утилизацией ацетата в обход ацетокластического метаногенеза, как в озерах Киву и Кинерет (Nulssein et al., 2001; Pasche et al., 2011). Возможно, высокий вклад CO2-редукции может быть обусловлен ее большей термодинамической выгодностью в условиях осадочной толщи пелагической зоны, в сравнении с ацетокластическим метаногенезом, в совокупности с наличием в сообществах пула активных психротолерантных гидрогенотрофных метаногенов и потребляющих ацетат сульфатредуцирующих бактерий (Букин и соавт., 2018). Следует отметить, что преимущественное образование метана в ходе CО2-редукции происходит также в осадках холодноводных антарктических (Wand et al., 2006) и альпийских озер (Mandic-Mulec et al., 2012), озер Тибетского нагорья (Liu et al., 2017).
Кроме H2 : CO2 важную роль в процессах образования метана в донных отложениях озера Байкал могут играть и метилированные субстраты. При культивировании природного осадка из поверхностного слоя на среде с метанолом в анаэробных условиях наблюдалось активное образование метана из метанола при участии метилотрофных архей семейства Methanosarcinaсeae (Букин и соавт., 2018).
С применением методов иммунофлуоресцентного окрашивания (Намсараев, Земская, 2000), культивирования (Павлова и соавт., 2014; Букин и соавт., 2018) и секвенирования генов 16S рРНК и mcrA (Шубенкова и соавт., 2005; Kadnikov et al., 2012; Ломакина и соавт., 2014; Черницына и соавт., 2016; Lomakina et al., 2018) установлено, что в осадках озера присутствуют археи, способные образовывать метан по всем четырем известным катаболическим путям: гидрогенотрофному (Methanoregulaceae, Methanobacteriaceae, Methanocellaceae, Methanocaldococcaceae, Ca. “Methanoflorentaceae”), ацетокластическому (Methanosaetaceae), метилотрофному (Methanosarcinaseae) и водород-зависимому метилотрофному (Methanomassiliicoccales, Methanomethyliaceae, Methanofastidiosaceae). По данным метабаркодинговых исследований, наибольшая доля выявляемых метаногенных микроорганизмов в осадках Байкала относится к гидрогенотрофным представителям семейства Methanoregulaceae (р. Methanoregula, р. Methanosphaerula и некультивируемые), водород-зависимым метилотрофным археям порядка Methanomassiliicoccales и ацетокластическим метаногенам семейства Methanosaetaceae (р. Methanothrix (Methanosaeta)), составляющих ядро метаногенных сообществ в донных отложениях пресноводных озер по всему миру, вне зависимости от их лимнологических и гидрохимических свойств (Wen et al., 2017). В Байкале представители данных таксонов обнаруживаются как в зонах метановых сипов и грязевых вулканов (Zemskaya et al., 2010; Kadnikov et al., 2012; Черницына и соавт., 2016; Lomakina et al., 2018), так и в осадках фоновых районов (Земская и соавт., 2018; Zakharova et al., 2018). Большая доля архей семейств Methanoregulaceae и Methanosaetaceae может быть связана с их высокой конкурентоспособностью в условиях существования при низких концентрациях субстратов, а также способностью создавать устойчивые синтрофные ассоциации при разложении летучих жирных кислот (Borrel et al., 2011). Микроорганизмы порядка Methanomassiliicoccales (Thermoplasmata), выявляемые в Байкале как в сообществах поверхностных, так и глубинных слоев, нацелены на утилизацию широкого спектра метилированных субстратов, включая метанол, метиламины и метилсульфиды, концентрации которых в пресноводных экосистемах ранее считались незначительными (Conrad, Claus, 2005). Обычно метилотрофные метаногены обнаруживаются в пищеварительном тракте насекомых и животных, гиперсоленых водоемах, где основными метилированными субстратами для них являются метиламины, образующиеся в результате разложения осмопротекторов, выделяемых галофильными протеобактериями (Liu, Whitman, 2008). В осадках пресноводных экосистем основным субстратом для них может служить метанол, образующийся при деструкции пектина и лигноцеллюлозы, входящих в состав клеточных стенок водорослей и растений (Sollinger, Urich, 2019). Однако, несмотря на обширное присутствие молекулярных маркеров представителей данного семейства в сообществах донных отложений Байкала, они не были выявлены в составе метаногенных накопительных культур при культивировании на среде с метанолом (Букин и соавт., 2018). Одной из причин может служить несоответствие условий культивирования, и другой – возможное использование “байкальскими” Methanomassiliicoccales не метанола, а других C1-метилированных соединений. Их наличие в верхних слоях осадков в зонах разгрузок в Байкале может обеспечиваться миграцией этих соединений из глубинных осадков с потоками глубинных высокоминерализованных флюидов. Это согласуется с изотопными характеристиками растворенного биогенного метана (δ13C1 ≈ –41.0…‒67.3‰, δDC1 = –311…–300‰), которые характерны для этого газа, образованного преимущественно по пути восстановления метильных групп (Калмычков и соавт., 2006; Hachikubo et al., 2010). Учитывая низкие скорости ацетокластического метаногенеза в глубоководной зоне озера, образование метана с использованием метильных групп C1‑метилированных соединений вполне вероятно.
МИКРООРГАНИЗМЫ, УЧАСТВУЮЩИЕ В АНАЭРОБНОМ ОКИСЛЕНИИ МЕТАНА
Наиболее очевидное различие между биогеохимическими процессами в местах высачиваний минерализованных газосодержащих флюидов в Байкале от процессов в океанических областях заключается в содержании сульфат-иона. В поровых водах большинства исследованных нами районов концентрация сульфат-ионов была недостаточной для осуществления сульфатзависимого АОМ (Пименов и соавт., 2014). Исключительными в этом отношении являются районы высачиваний сульфатных и сульфидсодержащих глубинных флюидов – Кукуйский каньон и грязевой вулкан “Маленький”, где содержание сульфат-иона достигало 15 мМ. Процесс сульфатредукции регистрировался в осадках разных районов озера Байкал непосредственно под слоем окисленных отложений, но его роль в процессах деструкции ОВ была вторичной (Намсараев, Земская, 2000; Пименов и соавт., 2014), что подтверждалось сравнением интегральных скоростей метанокисления и сульфатредукции. Несмотря на незначительные концентрации сульфат-иона (от 0.05 до 0.16 мM) в большинстве донных отложений на озере Байкал, анализ профилей концентраций метана свидетельствовал о протекании процесса АОМ. Сравнение интегральных скоростей аэробного и анаэробного окисления метана в отложениях озера Байкал, показало, что их значения сопоставимы по величине, а в некоторых районах (метанового сипа “Посольская Банка”, нефтяного сипа “Горевой Утес” и грязевого вулкана “Большой”) АОМ было значительно выше скорости окисления метана (МО) в аэробной зоне. Однако типичных для морских осадков метанокисляющих архей кластеров ANME-1, 2 и 3 в исследованных осадках не выявлено (Zemskaya et al., 2010; Черницына и соавт., 2016; Lomakina et al., 2018). Было высказано предположение о возможности осуществления АОМ в осадках озера Байкал представителями других таксонов, в частности, археями подкластера ANME-2d и бактериями NC10 (Raghoebarsing et al., 2006; Haroon et al., 2013). Представители ANME-2d изначально обнаруживались вместе с представителями кандидатного бактериального филума NC10 – Ca. Methylomirabilis oxyfera в накопительных культурах, полученных из пресноводных осадков (Raghoebarsing et al., 2006). Эти уникальные бактерии считаются первыми анаэробными метанотрофами, которые способны производить кислород внутриклеточно из нитрита и использовать его для активации метана, аналогично аэробным метанотрофам (Ettwig et al., 2010). Представители архей подкластера ANME-2d и бактерий филума NC10 широко распространены в пресноводных экосистемах, почвах, рисовых полях, очистных сооружениях (Raghoebarsing et al., 2006; Haroon et al., 2013; Fu et al., 2016; Welte et al., 2016; Timmers et al., 2017). Ранее их участие в процессе АОМ также было экспериментально подтверждено при культивировании пресноводных осадков (озер Чаоху, Тайху, Китай), лагун повторного использования воды (Luggage Point, Brisbane, Australia) на среде, обогащенной нитрат- и нитрит-ионами (Hu et al., 2009; Ettwig et al., 2010; Haroon et al., 2013). Протекание процесса АОМ по нитратзависимому пути в осадках Южного Байкала было подтверждено нами при культивировании природного микробного сообщества из грязевого вулкана “Песчанка” на среде с добавлением нитрат-ионов (Ломакина и соавт., 2018). В экспериментальных образцах отмечалась убыль метана и формирование консорциумов микроорганизмов, в составе которых с помощью флуоресцентной in situ гибридизации со специфичными зондами детектированы представители бактерий филума NC10 и археи подкластера ANME-2d. Проведенный филогенетический анализ библиотек генов 16S рРНК показал сходство байкальских архей подкластера ANME-2d с последовательностями из пресноводных осадков альпийского озера, осадков озера Монун, биореакторов, где также зафиксированы процессы АОМ. Еще одним участником процесса АОМ в осадках озера Байкал являются представители филума NC10. Последовательности этого филума выявлены в микробных сообществах всех исследованных нами осадков, включая грязевые вулканы “Маленький” и “Кедр”, метановые сипы “Посольская Банка” и “Красный Яр”. Филогенетически представители этого таксона не были полностью идентичными, они группировались в 4 OTUs и имели сходство с последовательностями из осадков озер Констанс и Бива, а также с Ca. Methylomirabilis sp. из накопительных культур, осуществляющих нитритзависимое АОМ. Известно, что в цепи трофических взаимодействий с участием нитрат- и нитритзависимых микроорганизмов, осуществляющих АОМ, могут вовлекаться ANAMMOX-бактерии, аэробные аммоний- и нитрит-окисляющие бактерии (Welte et al., 2016). В результате синтрофного взаимодействия при наличии аммония в среде и ANAMMOX-бактерий или бактерий филума NC10 и нитрита, образованного в процессе нитратзависимого АОМ, последний восстанавливается до газообразного азота (Zhu et al., 2010; Haroon et al., 2013).
Рис. 1.
Карта-схема озера Байкал и районов исследования: ⚫ – грязевой вулкан; ⚪ – метановый сип; ◻ – нефтяной сип; △ – термальный вент.
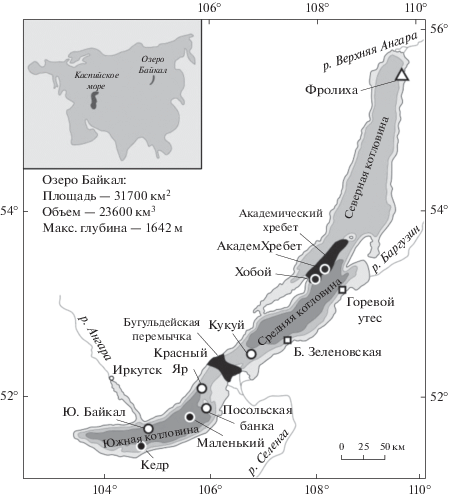
Следует заметить, что механизм АОМ и количество его участников в осадках озера Байкал до конца не выяснен. Ведь даже в районах разгрузки минерализованных флюидов содержание нитрат-ионов в поровых водах не превышало 0.0096 мM, а нитрит-ионы не детектировались использованными методами (Zemskaya et al., 2015а; Pogodaeva et al., 2020). Можно предположить, что недостаток концентраций нитрат-ионов восполняется деятельностью аммоний-окисляющих архей филума Thaumarchaeota, способных окислять аммоний до нитрата (Zhu et al., 2010). Действительно, представители этого филума в осадках озера Байкал составляли значительную долю (до 26%) в глубинных осадках районов разгрузок газосодержащих флюидов и до 100% в глубинных осадках нефтяного сипа “Горевой Утес” (Kadnikov et al., 2012; Черницына и соавт., 2016; Lomakina et al., 2018). Возможность участия микроорганизмов в процессах нитрат- и нитритзависимого АОМ в осадках озера Байкал подтверждено наличием в суммарной ДНК маркерных генов – mcrA для подкластера архей ANME-2d и pmoA для филума NC10. Аминокислотные последовательности гена mcrA из разных районов озера Байкал были идентичны последовательностям Ca. Methanoperedens sp. из осадков очистных сооружений и биореакторов, а аминокислотные последовательности гена pmoA – некультивируемым представителям NC10 из осадков озер Бива, Констанс, денитрифицирующих резервуаров.
Нельзя исключить в качестве еще одного возможного участника процессов цикла метана в осадках озера Байкал – представителей филума Bathyarchaeota. Недавно проведенные метагеномные исследования двух геномов филума Bathyarchaeota (ранее Miscellaneous Crenarchaeota Group) показали наличие генов, которые кодируют комплекс метил-кофермент М-редуктаза (MCR), в том числе гена mcrA (Evans et al., 2015). Авторы не исключают участие Bathyarchaeota не только в процессе метангенерации, а также в процессе АОМ по механизму обратного метаногенеза. Каков метаболизм архей этого филума в природе, в том числе и осадках Байкала, еще предстоит определить. По результатам высокопроизводительного секвенирования, представители этого филума в осадках Байкала составляли от 28 до 76% от всех проанализированных последовательностей 16S рРНК архей в районах грязевых вулканов и метановых сипов. Кроме того, ферменты метил-редуцирующего метаногенеза обнаружены у представителей филума Verstraetearchaeota, что указывает на их участие в метаболизме метана (Vanwonterghem et al., 2016). Последовательности Verstraetearchaeota, у которых обнаружены гены mcrA, были выделены из мезофильного метаногенного реактора и осадков пресноводного озера Павин (Франция). Однако в осадках озера Байкал последовательности данного филума являются минорными компонентами исследованных микробных сообществ.
В публикациях (Och et al., 2012; Torres et al., 2014; Aloisi et al., 2019) рассматривалось участие оксидов Mn(IV) и Fe(III) в процессе АОМ, приводящего к образованию ${\text{HCO}}_{3}^{ - }$ в осадках озера Байкал. Повышенные концентрации ионов железа в поровых водах при недостаточных для протекания АОМ значениях ${\text{SO}}_{4}^{{2 - }}$ и ${\text{NO}}_{3}^{ - }$ отмечались в поверхностных осадках (первые сантиметры) в разных районах озера Байкал (Granina et al., 2004; Och et al., 2012; Zemskaya et al., 2015а). Ранее протекание этого процесса отмечено в осадках озера Эрн, где в зонах с низким содержанием нитратов и сульфатов, и при наличии ионов Fe, детектированы представители ANME-2d (Norgi et al., 2013; Weber et al., 2017). Микроорганизмы, осуществляющие данный процесс достоверно не установлены, хотя в процессе железозависимого АОМ предполагается и участие представителей ANME-2d (Cai et al., 2018). Поэтому, в настоящее время представители подкластера ANME-2d рассматриваются как универсальные анаэробные метанотрофы, которые используют различные ионы в качестве акцепторов электронов для АОМ и, тем самым, играют важную роль в эмиссии метана (Shen et al., 2019).
В океанических осадках холодных сипов отмечаются повышенные потоки ${\text{HCO}}_{3}^{ - },$ образующиеся в результате сульфатзависимого АОМ и приводящие к повсеместному осаждению аутигенных карбонатов в виде конкреций в осадках и карбонатных корок (Bohrmann et al., 1998; Luff et al., 2004; Aloisi et al., 2019). В отличие от морских экосистем, районы формирования аутигенных карбонатов встречаются не по всему Байкалу, а имеют локальное расположение. В этих районах обнаруживаются небольшие по размерам (до 0.5 см) включения аутигенного сидерита и родохрозита (Мизандронцев, 1975; Гранина, 2008; Krylov et al., 2018), что может быть следствием низкой концентрации ионов ${\text{HCO}}_{3}^{ - }$ в таких зонах. Отсутствие аутигенных карбонатов на большей площади отложений предполагает, что скорости этих процессов недостаточно высоки, чтобы значительно сместить равновесие растворенного неорганического углерода в пользу осаждения карбонатных минералов. Наконец, ограниченное выпадение карбонатных минералов в отложениях холодных сипов на Байкале также связано с концентрацией растворенного кальция, содержание которого в 20 раз ниже, чем в океане. Для формирования аутигенных карбонатов необходимы повышенные величины карбонатной щелочности в поровых водах/флюидах и наличие процессов АОМ или метангенерации. В байкальских осадках, где присутствовали аутигенные карбонаты, действительно отмечалось увеличение щелочности. Концентрации гидрокарбонат-ионов в поровой воде составляли более 8.19 мM, что значительно выше значений, отмечаемых в осадках фоновых районов (1.09 мM) (Zemskaya et al., 2015а; Pogodaeva et al., 2017). Анализ библиотек генов 16S рРНК карбонатсодержащих осадков, показал присутствие последовательностей архей подкластера ANME-2d и представителей других филумов. Так, в сообществах архей из олигонита (Fe(Mn,Zn)(CO3)2), отобранного из осадков грязевого вулкана “Маленький”, доминировали Euryarchaeota (до 99%), среди которых 20% составляли последовательности подкластера ANME-2d и 73% порядка Thermoplasmatales (Lomakina et al., 2018). В районе, где карбонат идентифицирован как сидерит (FeCO3), доминировали последовательности Bathyarchaeota (от 33 до 76.6%), доля представителей подкластера ANME-2d была около 16% (Lomakina et al., 2020). Следует также отметить в бактериальных сообществах из этих же образцов высокий процент представителей бактериальных филумов Chloroflexi и Atribacteria, являющихся типичными представителями морских карбонатных осадков (Yanagawa et al., 2019). Очевидно, что данные о таксономическом составе сообществ не позволяют расшифровать механизм образования карбонатов в осадках озера Байкал, но могут быть использованы для планирования дальнейших исследований в этом направлении.
МИКРООРГАНИЗМЫ, УЧАСТВУЮЩИЕ В ОКИСЛЕНИИ НЕФТЯНЫХ УГЛЕВОДОРОДОВ
В число уникальных характеристик озера Байкал входит не только его возраст, глубины и высокое разнообразие биоты озера, а также природные выходы нефти. Кроме оз. Байкал, данным феноменом характеризуются рифтовое глубоководное озеро Танганьика и мелководное озеро Чапала (Simoneit et al., 2000; Zarate-del Valle et al., 2006). На оз. Байкал известны два района естественных нефтепроявлений: один расположен в устье р. Большая Зеленовская (БЗ) и известен с конца XVIII века; второй – у м. Горевой Утес (ГУ) (открыт в 2005 г.). В 2005 г. нефть в районе ГУ характеризовалась экстремально высоким содержанием н-алканов и была идентифицирована как небиодеградированная парафинистая нефть, в районе БЗ – как биодеградированная ароматико-нафтеновая нефть (Конторович и соавт., 2007). Микробиологические исследования района нефтепроявлений в районе устья БЗ были начаты в 80-е гг. XX в. С.Д. Талиевым и соавт. (1985). В воде и донных осадках изучено распределение углеводородокисляющих микроорганизмов, способных усваивать углеводороды солярового масла, метановой нефти и индивидуальные углеводороды С3Н8, С4Н10, С5Н12, С9Н20 (Петрова, Мамонтова, 1985; Талиев и соавт., 1985).
Открытие в 2005 г. нового района естественного выхода углеводородов позволило в режиме онлайн следить за явлениями, происходящими в данной акватории, и in situ наблюдать за качественными и количественными изменениями в составе нефти, структуре микробных сообществ и их адаптационными возможностями. В первые годы исследований отмечалось увеличение численности углеводородокисляющих микроорганизмов (УВОМ) как в водной толще, так и в донных отложениях. В зоне нефтяных сликов, образующихся на поверхности водной толщи, количество культивируемых УВОМ в 12 раз превышало значения в воде фоновых районов. Наблюдения за численностью культивируемых микроорганизмов, окисляющих нефть и н-алканы в донных осадках ГУ, в течение 15 лет показали ее увеличение в первые два года (2005–2007 гг.) (до 250 ± 27 тыс. КОЕ/г) и последующее уменьшение к 2017–2019 гг. до 90 ± ± 1 тыс. КОЕ/г (Павлова и соавт., 2020). Увеличение количества углеводородокисляющих бактерий после техногенного разлива нефти отмечается во многих исследованиях (King et al., 2015). Так, через месяц после аварии нефтяной платформы Deepwater Horizon, общая численность микроорганизмов в глубоководном нефтяном шлейфе в Мексиканском заливе составляла 5.51 ± 0.33 × 104 кл./мл, вне его – 2.73 ± 0.33 × 104 кл./мл (Hazen et al., 2010). Высокие показатели численности культивируемых УВОМ (до 170 ± 13 тыс. КОЕ/г) зарегистрированы в битумных постройках, обнаруженных в районе ГУ с помощью ГОА “Мир” в 2008 г. Они формируются из парафиновых нефтяных битумов и населены большим количеством разнообразных бентосных животных. Основой их пищевой цепи являются микроорганизмы, осуществляющие аэробное и анаэробное окисление углеводородов (Zemskaya et al., 2012; Kadnikov et al., 2013; Ситникова и соавт., 2017). Микробное сообщество битумных построек на 80% состояло из представителей филума Proteobacteria, среди которых около 40% принадлежат некультивируемым представителям Alpha- и Betaproteobacteria. Археи представлены типичными ацетокластическими и гидрогенотрофными метаногенами порядков Methanosarcinales, Methanomicrobiales и Methanobacteriales (Kadnikov et al., 2013).
Анализ структуры микробных сообществ в донных осадках из районов нефтепроявлений ГУ и БЗ с помощью высокопроизводительного секвенирования выявил доминирование представителей тех же филумов – Actinobacteria, Cyanobacteria и Proteobacteria, что и в районах со спокойным осадконакоплением (Земская и соавт., 2018). Состав бактериальных сообществ в донных осадках БЗ и ГУ совпадал на уровне крупных таксонов, за исключением представителей филума Actinobacteria, которые более разнообразно представлены в осадках ГУ (Zemskaya et al., 2015а). Среди Proteobacteria доминировали представители классов Alpha-, Beta-, Gamma- и Deltaproteobacteria, присутствие которых характерно для метаногенных углеводород-окисляющих сообществ, включая метаногенные нефтяные хвосты, загрязненные углеводородами водные экосистемы и донные осадки (Johnson et al., 2015).
Наиболее очевидные различия наблюдались в составе архейных сообществ. В сообществах осадков ГУ доминировали представители Tha-umarchaeota и Euryarchaeota, что характерно для байкальских осадков районов метановых сипов и грязевых вулканов. В окисленных слоях осадка БЗ среди архей выявлены представители Crenarchaeota (47%) и Thaumarchaeota (53%), в восстановленных – последовательности филумов Euryarchaeota (52%), Thaumarchaeota (26%), Bathyarchaeota (20%) и Crenarchaeota (2%). Филум Euryarchaeota представлен гидрогенотрофными археями порядка Methanomicrobiales и ацетокластическими метаногенами порядка Methanosarcinales, а также последовательностями подкластера ANME-2d (Lomakina et al., 2018). Более высокое разнообразие архей в осадках района БЗ, скорее всего, обусловлено достаточно длительным периодом их существования в среде с нефтью, служащей дополнительным источником углерода. Это было показано ранее для морских экосистем, где хроническое загрязнение нефтью приводило к более высокому разнообразию микроорганизмов в результате индуцированной устойчивости, вызванной длительным воздействием углеводородов (Jeanbille et al., 2016). Следует отметить, что представители филумов Bathyarchaeota и Crenarchaeota присутствовали только в сообществах района БЗ, где нефть глубоко биодеградирована. Предполагается, что представители филума Bathyarchaeota могут быть вовлечены в процесс АОМ (Evans et al., 2015) и деградацию ароматических соединений (Jeanbille et al., 2016). Филум Crenarchaeota в донных осадках района нефтепроявления БЗ был представлен некультивируемыми представителями порядка Desulfurococcales, класс Thermoprotei. В автотрофных условиях эти микроорганизмы получают энергию путем окисления водорода с использованием элементарной серы, тиосульфата, нитрата или нитрита в качестве акцептора электронов и используют CO2 в качестве источника углерода (Huber, Stetter, 2006). Доминирование представителей филумов Thau-marchaeota и Euryarchaeota в донных осадках нефтепроявления ГУ может быть обусловлено не только более разнообразным составом нефти, в которой присутствуют н-алканы, алкилциклогексаны, изопреноиды, ПАУ и другие соединения, но и присутствием метана. Показано, что представители метаногенных архей семейств Methanomicrobiaceae, Methanosarcinaceae, Ca. Methanofastidiosa и порядка Thermoplasmatales способны не только к генерации метана и его анаэробному окислению, но и к деградации нефти в нефтезагрязненных почвах (Miettinen et al., 2019). В биодеградации нефти также могут участвовать и представители филума Thau-marchaeota, у которых предполагается гетеротрофный тип метаболизма с использованием соединений, полученных из сырой нефти (Mussmann et al., 2011).
Мониторинговые исследования состава байкальской нефти в районе нефтепроявления у м. Горевой Утес в течение 15 лет свидетельствуют о ее биодеградации (Gorshkov et al., 2020). Очевидно, что в водной толще, насыщенной кислородом, и в поверхностных донных осадках с высоким содержанием О2 доминируют аэробные процессы окисления углеводородов нефти. Исследования микроорганизмов, участвующих в деградации нефти в анаэробной зоне осадочной толщи озера Байкал, пока находятся на начальном этапе. Получены первые экспериментальные данные о способности микробных сообществ из донных осадков ГУ в анаэробных условиях деградировать углеводороды нефти в присутствии различных акцепторов электронов. В поверхностных осадках конверсия н-алканов наиболее интенсивно протекала в накопительных культурах, на среде, обогащенной сульфат-ионом, в глубинных – гидрокарбонат-ионом. В глубинных осадках микробное сообщество более ориентировано на анаэробное окисление полициклических ароматических углеводородов, о чем свидетельствует высокая степень их биодеградации (до 46%), вне зависимости от присутствующих в среде акцепторов электронов. Анализ клональных библиотек генов 16S рРНК бактерий и архей в накопительных культурах показал идентичность (97–99%) полученных последовательностей некультивируемым микроорганизмам из термофильных местообитаний, осадков грязевых вулканов и загрязненных углеводородами сред. В библиотеках генов 16S рРНК бактерий доминировали представители филумов Firmicutes, Chloroflexi, Caldiserica (OP5), классов Delta- и Epsilonproteobacteria (Pavlova et al., 2020). Филогенетическое разнообразие анаэробных микроорганизмов, участвующих в биодеградации нефти, сходно по составу микроорганизмам, входящих в “ядро микробиома” нефтяных резервуаров, где наиболее представлены три класса бактерий (Gammaproteobacteria, Clostridia и Bacteroidia) и археи класса Methanomicrobia. Функционирование сообществ в нефтяных коллекторах обеспечивается синтрофным взаимодействием этих микроорганизмов (Sierra-Garcia et al., 2017; Pannekens et al., 2019). Мы не исключаем наличие синтрофных взаимоотношений для микробных сообществ донных осадков озера Байкал, поскольку во всех экспериментальных образцах развивались микроорганизмы, осуществляющие взаимозависимые последовательные реакции в общем метаболическом процессе.
Способность деградировать углеводороды закреплена в геномах байкальских микроорганизмов (Ломакина и соавт., 2014; Likhoshvay et al., 2014). Анализ нуклеотидных последовательностей alk-генов, кодирующих алкан-1-монооксигеназу, показал, что у большинства культивируемых углеводородокисляющих микроорганизмов (76%), выделенных из водной толщи и донных осадков в районах естественных выходов нефти в оз. Байкал, содержатся alkВ-гены, идентичные в большинстве случаев alkВ-генам, обнаруженным ранее у Rhodococcus erythropolis (Ломакина и соавт., 2014). Наличие alk-генов подтверждено метагеномным анализом геномов микроорганизмов, обитающих в батипелагиали Южного Байкала (Cabello-Yeves et al., 2020). Особенно активным деструктором н-алканов оказался штамм Rhodococcus erythropolis № 4–08, изолированный из битумной постройки оз. Байкал, в геноме которого показано четыре типа alkB-генов, кодирующих алкан-1-монооксигеназу (Likhoshvay et al., 2013, 2014). Скорость роста Rhodococcus erythropolis увеличивалась в 2–16 раз при культивировании на среде с добавлением стимулятора роста, что делает его перспективным для биотехнологических целей (Павлова и соавт., 2019; Pavlova et al., 2019).
ЗАКЛЮЧЕНИЕ
Осадки озера Байкал населены микроорганизмами с различным метаболизмом, обеспечивающим их участие в деструкции широкого спектра субстратов, включая фотосинтезированное ОВ, газообразные и нефтяные углеводороды. Наиболее значимые изменения в структуре сообществ и смена доминирующих таксонов микроорганизмов наблюдались в осадках с выраженным градиентом физико-химических параметров, но и в этих экотопах выявлены таксоны бактерий и архей, характерные для пресноводных экосистем (Newton et al., 2011). Низкая минерализация среды, доступность источников углерода и энергии обеспечивают развитие микроорганизмов, участвующих как в образовании метана, так и его анаэробном окислении по метаболическим путям, характерным для микроорганизмов пресноводных экосистем. Разнообразие микробных сообществ в осадках озера Байкал перекрывается на уровне филумов и демонстрирует возрастающее несходство микроорганизмов ниже уровня класса и рода. В этом плане очевидна необходимость более широкого метагеномного анализа геномов и исследование метаболизма уникальных видов микроорганизмов, в том числе поступающих из глубинной зоны донных отложений озера Байкал. Древний возраст озера Байкал, мощная осадочная толща и наличие метана разного генезиса, в том числе в форме газовых гидратов, служат основанием для продолжения исследований роли микроорганизмов, участвующих в цикле этого парникового газа, особенно в период глобальных изменений климата.
Список литературы
Букин С.В., Павлова О.Н., Калмычков Г.В., Иванов В.Г., Погодаева Т.В., Галачьянц Ю.П., Букин Ю.С., Хабуев А.В., Земская Т.И. Субстратная специфичность метаногенных сообществ из донных отложений оз. Байкал, ассоциированных с разгрузками углеводородных газов // Микробиология. 2018. Т. 87. С. 409–420.
Bukin S.V., Pavlova O.N., Kalmychkov G.V., Ivanov V.G., Pogodaeva T.V., Galachyants Yu.P., Bukin Yu.S., Khabuev A.V., Zemskaya T.I. Substrate specificity of methanogenic communities from Lake Baikal bottom sediments associated with hydrocarbon gas discharge // Microbiology (Moscow). 2018. V. 87. P. 549–558.
Вологина Е.Г., Штурм М. Потоки осадочного вещества в Южном Байкале: результаты экспериментов с седиментационными ловушками // Геология и геофизика. 2017. Т. 58. С. 1314–1323.
Vologina E.G., Sturm M. Particulate fluxes in South Baikal: evidence from sediment trap experiments // Russ. Geol. Geophys. 2017. V. 58. P. 1045–1052.
Вотинцев К.К., Мещерякова А.И., Поповская Г.И. Круговорот органического вещества в озере Байкал. Новосибирск: Наука, 1975. 189 с.
Выхристюк Л.А. Органическое вещество донных осадков Байкала // Труды ЛИН СО АН СССР. Новосибирск: Наука, 1980. Т. 32. С. 80.
Гвоздков А.Н. Геохимия современных донных осадков озера Байкал. Автореферат дис. … канд. геол.-минер. наук, 07.10.1998. Иркутск: Институт геохимии им. А.П. Виноградова СО РАН, 1998. 28 с.
Гранина Л.З. Ранний диагенез донных осадков озера Байкал. Новосибирск: ГЕО, 2008. 160 с.
Дагурова О.П., Намсараев Б.Б., Козырева Л.П., Земская Т.И., Дулов Л.Е. Бактериальные процессы цикла метана в донных осадках озера Байкал // Микробиология. 2004. Т. 74. С. 248–257.
Dagurova O.P., Namsaraev B.B., Kozyreva L.P., Zemsk-aya T.I., Dulov L.E. Bacterial processes of the methane cycle in bottom sediments of Lake Baikal // Microbiology (Moscow). 2004. V. 74. P. 202–210.
Заварзин Г.А. Становление системы биогеохимических циклов // Палеонтол. журн. 2003. Т. 37. № 6. С. 16–24.
Zavarzin G.A. Formation of the system of biogeochemical cycles // Paleontol. J. 2003. V. 37. P. 576–583.
Захарова Ю.Р., Парфенова В.В., Гранина Д.З., Кравченко О.С., Земская Т.И. Распределение культивируемых железо и марганецокисляющих бактерий в донных осадках озера Байкал // Биология внутренних вод. 2010. № 4. С. 22–30.
Zakharova Y.R., Parfenova V.V., Granina L.Z., Kravchenko O.S., Zemskaya T.I. Distribution of iron- and manganese-oxidizing bacteria in the bottom sediments of Lake Baikal // Inland Water Biol. 2010. V. 3. P. 313–321.
Земская Т.И., Намсараев Б.Б., Дульцева Н.М., Ханаева Т.А., Голобокова Л.П., Дубинина Г.А., Дулов Л.Е., Вада Э. Экофизиологические особенности матообразующей бактерии Thioploca в донных осадках бухты Фролиха, Северный Байкал // Микробиология. 2001. Т. 70. С. 391–397.
Zemskaya T.I., Namsaraev B.B., Dul’tseva N.M., Khanaeva T.A., Golobokova L.P., Dubinina G.A., Dulov L.E., Wada E. Ecophysiological characteristics of the mat-forming bacterium Thioploca in bottom sediments of the Frolikha Bay, Northern Baikal // Microbiology (Moscow). 2001. V. 70. P. 335–341.
Земская Т.И., Ломакина А.В., Мамаева Е.В., Захаренко А.С., Лихошвай А.В., Галачьянц Ю.П., Миллер Б. Состав микробных сообществ в осадках южного Байкала, содержащих Fe/Mn конкреции // Микробиология. 2018. Т. 87. С. 291–302.
Zemskaya T.I., Lomakina A.V., Mamaeva E.V., Zakharenko A.S., Likhoshvai A.V., Galachyants Yu.P., Miller B. Composition of microbial communities in sediments from southern Baikal containing Fe/Mn concretions // Microbiology (Moscow). 2018. V. 87. P. 382–392.
Каллистова А.Ю., Кевбрина М.В., Пименов Н.В., Русанов И.И., Рогозин Д.Ю., Верли Б., Ножевникова А.Н. Сульфатредукция и метаногенез в меромиктических озерах Шира и Шунет (Хакасия) // Микробиология. 2006. Т. 75. С. 828–835.
Kallistova A.Y., Kevbrina M.V., Pimenov N.V., Rusanov I.I., Rogozin D.Y., Wehrli B., Nozhevnikova A.N. Sulfate reduction and methanogenesis in the Shira and Shunet meromictic lakes (Khakasia, Russia) // Microbiology (Moscow). 2006. V. 75. P. 720–726.
Калмычков Г.В., Егоров А.В., Кузьмин М.И., Хлыстов О.М. Генетические типы метана озера Байкал // Докл. АН. 2006. Т. 411. № 5. С. 672–675.
Kalmychkov G.V., Egorov A.V., Kuz’min M.I., Khlystov O.M. Genetic types of methane from Lake Baikal // Dokl. Earth Sci. 2006. V. 411. P. 1462–1465.
Клеркс Я., Земская Т.И., Матвеева Т.В., Хлыстов О.М., Намсараев Б.Б., Дагурова О.П., Голобокова Л.П., Воробьева С.С., Погодаева Т.П., Гранин Н.Г., Калмычков Г.В., Пономарчук В.А., Шоджи Х., Мазуренко Л.Л., Каулио В.В., Соловьев В.А., Грачев М.А. Гидраты метана в поверхностном слое глубоководных осадков озера Байкал // Докл. АН. 2003. Т. 393. № 6. С. 822–826.
Klerkx J., Zemskaya T.I., Matveeva T.V., Khlystov O.M., Namsaraev B.B., Dagurova O.P., Golobokova L.P., Vorobyeva S.S., Pogodaeva T.P., Granin N.G., Kalmychkov G.V., Ponomarchuk V.A., Shoji H., Mazurenko L.L., Kaulio V.V., Soloviev V.A., Grachev M.A. Methane hydrates in surface layer of deep-water sediments in Lake Baikal // Dokl. Earth Sci. 2003. V. 393. P. 822–826.
Колман С.М., Купцов В.М., Джойнс Г.А., Картер С.Д. Радиоуглеродное датирование байкальских осадков // Геология и геофизика. 1993. Т. 34. № 10–11. С. 68–77.
Конторович А.Э., Каширцев В.А., Москвин В.И., Бурштейн Л.М., Земская Т.И., Калмычков Г.В., Костырева Е.А., Хлыстов О.М. Нефтегазоносность отложений оз. Байкал // Геология и геофизика. 2007. Т. 48. С. 1346–1356.
Kontorovich A.E., Kashirtsev V.A., Moskvin V.I., Burshtein L.M., Zemskaya T.I., Kostyreva E.A., Kalmychkov G.V., Khlystov O.M. Petroleum potential of Baikal deposits // Russ. Geol. Geophys. 2007. V. 12. P. 1046–1053.
Кузнецов С.И. Микрофлора озер и ее геохимическая деятельность. Л.: Наука, 1970. 440 с.
Кузнецов А.П., Стрижов В.П., Кузин В.С., Фиалков В.А., Ястребов В.С. Новое в природе Байкала. Сообщество, основанное на бактериальном хемосинтезе // Изв. АН СССР. Сер. биол. 1991. № 5. С. 766–772.
Кузьмин М.И., Карабанов Е.Б., Каваи Т., Вильямс Д., Бычинский В.А., Кербер Е.В., Кравчинский В.А., Безрукова Е.В., Прокопенко А.А., Гелетий В.Ф., Калмычков Г.В., Горегляд А.В., Антипин В.С., Хомутова М.Ю., Со-шина Н.М., Иванов Е.В., Хурсевич Г.К., Ткаченко Л.Л., Солотчина Е.П., Йошида Н., Гвоздков А.Н. Глубоководное бурение на Байкале – основные результаты // Геология и геофизика. 2001. Т. 42. С. 8–34.
Логачев Н.А. История и геодинамика Байкальского рифта // Геология и геофизика. 2003. Т. 44. С. 391–406.
Ломакина А.В., Погодаева Т.В., Морозов И.В., Земская Т.И. Микробные сообщества зоны разгрузки газонефтесодержащих флюидов ультрапресного озера Байкал // Микробиология. 2014. Т. 83. С. 355–365.
Lomakina A.V., Pogodaeva T.V., Morozov I.V., Zemskaya T.I. Microbial communities of the discharge zone of oil- and gas-bearing fluids in low-mineral Lake Baikal // Microbiology (Moscow). 2014. V. 83. P. 278–287.
Ломакина А.В., Мамаева Е.В., Погодаева Т.В., Калмычков Г.В., Хальзов И.А., Земская Т.И. Окисление метана в анаэробных условиях при культивировании накопительных культур из глубинных осадков района грязевого вулкана Песчанка (Южный Байкал) // Микробиология. 2018. Т. 87. С. 242–251.
Lomakina A.V., Mamaeva E.V., Pogodaeva T.V., Kalmychkov G.V., Khalzov I.A., Zemskaya T.I. Anaerobic methane oxidation in enrichment cultures from deep sediments of a mud volcano Peschanka (South Baikal) // Microbiology (Moscow). 2018. V. 87. P. 317–325.
Максимова Э.А., Максимов В.Н. Микробиология вод Байкала. Иркутск: Иркут. ун-т, 1989. 168 с.
Мац В.Д., Уфимцев Г.Ф., Мандельбаум М.М., Алакшин А.М., Поспеев А.В., Шимараев М.Н., Хлыстов О.М. Кайнозой Байкальской рифтовой впадины: строение и геологическая история. Новосибирск: Гео, 2001. 252 с.
Мизандронцев И.Б. К геохимии грунтовых растворов // Труды ЛИН СО АН СССР. 1975. Т. 21. № 41. С. 203–230.
Мизандронцев И.Б. Осадкообразование // Труды ЛИН СО АН СССР. 1978. Т. 16. № 36. С. 33–46.
Микроорганизмы в экосистемах озер и водохранилищ / Под ред. Дрюккера В.В. Новосибирск: Наука, 1985. 115 с.
Микробиологическое наследие ХХ века / Под ред. Виноградовой Т.П. Иркутск: Изд-во Ин-та географии СО РАН, 2004. 93 с.
Намсараев Б.Б., Земская Т.И. Микробиологические процессы круговорота углерода в донных осадках озера Байкал. Новосибирск: Гео, 2000. 160 с.
Павлова О.Н., Букин С.В., Ломакина А.В., Калмычков Г.В., Иванов В.Г., Морозов И.В., Погодаева Т.В., Пименов Н.В., Земская Т.И. Образование углеводородных газов микробным сообществом донных осадков оз. Байкал // Микробиология. 2014. Т. 83. С. 694–702.
Pavlova O.N., Bukin S.V., Lomakina A.V., Kalmychkov G.V., Ivanov V.G., Morozov I.V., Pogodaeva T.V., Pimenov N.V., Zemskaya T.I. Production of gaseous hydrocarbons by microbial communities of Lake Baikal bottom sediments // Microbiology (Moscow). 2014. V. 83. P. 798–804.
Павлова О.Н., Адамович С.Н., Мирскова А.Н., Земская Т.И. Стимулятор роста клеток углеводородокисляющих бактерий Rhodococcus erythropolis (варианты). Патент РФ № 2694593. 2019.
Павлова О.Н., Изосимова О.Н., Горшков А.Г., Новикова А.С., Букин С.В., Иванов В.Г., Хлыстов О.М., Земская Т.И. Современное состояние глубоководного выхода нефти у мыса Горевой Утес (Средний Байкал) // Геология и геофизика. 2020. Т. 61. С. 1231–1240.
Pavlova O.N., Izosimova O.N., Gorshkov A.G., Novikova A.S., Bukin S.V., Ivanov V.G., Khlystov O.M., Zemskaya T.I. Current state of deep oil seepage near cape Gorevoi Utes (Central Baikal) // Russ. Geol. Geophys. 2020. V. 61. P. 1007–1014.
Петрова В.И., Мамонтова Л.М. Изменение численности бактерий в экспериментах с добавками нефти // Микроорганизмы в экосистемах озер и водохранилищ. Новосибирск, 1985. С. 144–150.
Пименов Н.В., Захарова Е.Е., Брюханов А.Л., Корнеева В.А., Кузнецов Б.Б., Турова Т.П., Погодаева Т.В., Калмычков Г.В., Земская Т.И. Активность и структура сообщества сульфат-редуцирующих бактерий в осадках южной котловины оз. Байкал // Микробиология. 2014. Т. 83. С. 180–190.
Pimenov N.V., Zakharova E.E., Bryukhanov A.L., Korneeva V.A., Kuznetsov B.B., Tourova T.P., Pogodaeva T.V., Kalmychkov G.V., Zemskaya T.I. Activity and structure of the sulfate-reducing bacterial community in the sediments of the southern part of Lake Baikal // Microbiology (Moscow). 2014. V. 83. P. 47–55.
Погодаева Т.В., Земская Т.И., Голобокова Л.П., Хлыстов О.М., Минами Х., Сакагами Х. Особенности химического состава поровых вод донных отложений различных районов озера Байкал // Геология и геофизика. 2007. Т. 48. С. 1144–1160.
Ситникова Т.Я., Сиделева В.Г., Кияшко С.И., Земская Т.И., Механикова И.В., Хлыстов О.М., Хальзов И.А. Сравнительный анализ сообществ макробеспозвоночных и рыб, ассоциированных с метановым и нефте-метановым сипами в абиссали оз. Байкал // Успехи современной биологии. 2017. Т. 137. С. 373–386.
Талиев С.Д., Кожова О.М., Моложавая О.А. Углеводородокисляющие микроорганизмы в биоценозах некоторых районах Байкала // Микроорганизмы в экосистемах озер и водохранилищ. Новосибирск, 1985. С. 64–74.
Черницына С.М., Мамаева Е.В., Ломакина А.В., Погодаева Т.В., Галачьянц Ю.П., Букин С.В., Пименов Н.В., Хлыстов О.М., Земская Т.И. Филогенетическое разнообразие микробных сообществ в донных отложениях Посольской банки, оз. Байкал // Микробиология. 2016. Т. 85. С. 652–662.
Chernitsyna S.M., Mamaeva E.V., Lomakina A.V., Pogodaeva T.V., Galach’yants Yu.P., Bukin S.V., Pimenov N.V., Khlystov O.M., Zemskaya T.I. Phylogenetic diversity of microbial communities of the Posolsk Bank bottom sediments, Lake Baikal // Microbiology (Moscow). 2016. V. 85. P. 672–680.
Шубенкова О.В., Земская Т.И., Черницына С.М., Хлыстов О.М., Трибой Т.И. Первые результаты исследования филогенетического разнообразия микроорганизмов осадков Южного Байкала в районе приповерхностного залегания гидратов метана // Микробиология. 2005. Т. 74. С. 370–377.
Shubenkova O.V., Zemskaya T.I., Chernitsyna S.M., Khlystov O.M., Triboi T.I. The first results of an investigation into the phylogenetic diversity of microorganisms in southern Baikal sediments in the region of subsurface discharge of methane hydrates // Microbiology (Moscow). 2005. V. 74. P. 314–320.
Aloisi G., Pogodaeva T.V., Poort J., Khabuev A.V., Kazakov A.V., Akhmanov G.G., Khlystov O.M. Biogeochemical processes at the Krasniy Yar seepage area (Lake Baikal) and a comparison with oceanic seeps // Geo-Mar. Lett. 2019. V. 39. P. 59–75.
Beal E.J., House C.H., Orphan V.J. Manganeseand iron-dependent marine methane oxidation // Science. 2009. V. 325. P. 184–187.
Bohrmann G., Greinert J., Suess E., Torres M. Authigenic carbonates from the Cascadia subduction zone and their relation to gas hydrate stability // Geology. 1998. V. 26. P. 647.
Borrel G., Jézéquel D., Biderre-Petit C., Morel-Desrosiers N., Morel J.-P., Peyret P., Fonty G., Lehours A.-C. Production and consumption of methane in freshwater lake ecosystems // Res. Microbiol. 2011. V. 162. P. 832–847.
Borrel G., Lehours A.C., Crouzet O., Jézéquel D., Rockne K. Kulczak A., Duffaud E., Joblin K., Fonty G. Stratification of Archaea in the deep sediments of a freshwater meromictic lake: vertical shift from methanogenic to uncultured archaeal lineages // PLoS One. 2012. V. 7. e43346.https://doi.org/10.1371/journal.pone.0043346
Bukin S.V., Pavlova O.N., Manakov A.Y., Kostreva E.A., Chernitsyna S.M., Mamaeva E.V., Pogodaeva T.V., Zemskaya T.I. The ability of microbial community of Lake Baikal bottom sediments associated with gas discharge to carry out the transformation of organic matter under thermobaric conditions // Front. Microbiol. 2016. V. 7. Art. 690.
Cabello-Yeves P.J., Zemskaya T.I., Zakharenko A.S., Sakirko M.V., Ivanov V.G., Ghai R., Rodriguez-Valera F. Microbiome of the deep Lake Baikal, a unique oxic bathypelagic habitat // Limnol. Oceanogr. 2020. V. 65. P. 1471–1488.
Cai C., Leu A.O., Xie G.J., Guo J., Feng Y., Zhao J.X., Tyson G.W., Yuan Z., Hu S. A methanotrophic archaeon couples anaerobic oxidation of methane to Fe(III) reduction // ISME J. 2018. V. 12. P. 1929–1939.
Capone D.G., Kiene R.P. Comparison of microbial dynamics in marine and freshwater sediments: Contrasts in anaerobic carbon catabolism // Limnol. Oceanogr. 1988. V. 33. P. 725–749.
Conrad R., Claus P. Contribution of methanol to the production of methane and its 13C-isotopic signature in anoxic rice field soil // Biogeochem. 2005. V. 73. P. 381–393.
Conrad R., Chan O.-C., Claus P., Casper P. Characterization of methanogenic Archaea and stable isotope fractionation during methane production in the profundal sediment of an oligotrophic lake (Lake Stechlin, Germany) // Limnol. Oceanogr. 2007. V. 52. P. 1393–1406.
Dedysh S.N., Derakshani M., Liesack W. Detection and enumeration of methanotrophs in acidic Sphagnum peat by 16S rRNA fluorescence in situ hybridization, including the use of newly developed oligonucleotide probes for Methylocella palustris // Appl. Environ. Microbiol. 2001. V. 67. P. 4850–4857.
Ding H., Valentine D. Methanotrophic bacteria occupy benthic microbial mats in shallow marine hydrocarbon seeps, Coal Oil Point, California // J. Geophys. Res. 2008. V. 113. G-1. https://doi.org/10.1029/2007jg000537
Duc N.T., Crill P., Bastviken D. Implications of temperature and sediment characteristics on methane formation and oxidation in lake sediments // Biogeochem. 2010. V. 100. P. 185–196.
Ettwig K.F., Butler M.K., Le Paslier D., Pelletier E., Mangenot S., Kuypers M.M., Schreiber F., Dutilh B.E., Zedelius J., de Beer D., Gloerich J., Wessels H.J., van Alen T., Luesken F., Wu M.L., van de Pas-Schoonen K.T., Op den Camp H.J., Janssen-Megens E.M., Francoijs K.J., Stunnenberg H., Weissenbach J., Jetten M.S., Strous M. Nitrite-driven anaerobic methane oxidation by oxygenic bacteria // Nature. 2010. V. 464. P. 543–548.
Evans P.N., Parks D.H., Chadwick G.L., Robbins S.J., Orphan V.J., Golding S.D., Tyson G.W. Methane metabolism in the archaeal phylum Bathyarchaeota revealed by genome-centric metagenomics // Science. 2015. V. 350. P. 434–438.
Fu L., Li S.W., Ding Z.W., Ding J., Lu Y.Z., Zeng R.J. Iron reduction in the DAMO/Shewanella oneidensis MR-1 coculture system and the fate of Fe(II) // Water Res. 2016. V. 88. P. 808–815.
Fuchs A., Lyautey E., Montuelle B., Casper P. Effects of increasing temperatures on methane concentrations and methanogenesis during experimental incubation of sediments from oligotrophic and mesotrophic lakes // J. Geophys. Res. Biogeosci. 2016. V. 121. P. 1394–1406.
Gorshkov A.G., Pavlova O.N., Khlystov O.M., Zemskaya T.I. Fractioning of petroleum hydrocarbons from seeped oil as a factor of purity preservation of water in Lake Baikal (Russia) // J. Great Lakes Res. 2020. V. 46. P. 115–122.
Granina L., Muller B., Wehrli B. Origin and dynamics of Fe and Mn sedimentary layers in Lake Baikal // Chem. Geol. 2004. V. 205. P. 55–72.
Hachikubo A., Khlystov O., Krylov A., Sakagami H., Minami H., Nunokawa Y., Yamashita S., Takahashi N., Shoji H., Nishio S., Kida M., Ebinuma T., Kalmychkov G., Poort J. Molecular and isotopic characteristics of gas hydrate-bound hydrocarbons in southern and central Lake Baikal // Geo-Mar. Lett. 2010. V. 30. P. 321–329.
Han X., Schubert C.J., Fiskal A., Dubois N., Lever M.A. Eu-trophication as a driver of microbial community structure in lake sediments // Environ. Microbiol. 2020. V. 22. P. 3446–3462.
Haroon M.F., Hu S., Shi Y., Imelfort M., Keller J., Hugenholtz P., Yuan Z., Tyson G.W. Anaerobic oxidation of methane coupled to nitrate reduction in a novel archaeal lineage // Nature. 2013. V. 500. P. 567–570.
Hazen T.C., Dubinsky E.A., DeSantis T.Z., Andersen G.L., Piceno Y.M., Singh N., Jansson J.K., Probst A., Borglin S.E., Fortney J.L., Stringfellow W.T., Bill M., Conrad M.E., Tom L.M., Chavarria K.L., Alusi T.R., Lamendella R., Joyner D.C., Spier C., Baelum J., Auer M., Zemla M.L., Chakraborty R., Sonnenthal E.L., D’haeseleer P., Holman H.-Y.N., Osman S., Lu Z., Van Nostrand J.D., Deng Y., Zhou J., Mason O.U. Deep-sea oil plume enriches indigenous oil-degrading bacteria // Science. 2010. V. 330. P. 204–208.
Hu S., Zeng R.J., Burow L.C., Lant P., Keller J., Yuan Z. Enrichment of denitrifying a anaerobic methane oxidizing microorganisms // Environ. Microbiol. Rep. 2009. V. 1. P. 377–384.
Huang W., Chen X., Wang K., Chen J., Zheng B., Jiang X. Comparison among the microbial communities in the lake, lake wetland, and estuary sediments of a plain river network // Microbiol. Open. 2019. V. 8. e644.https://doi.org/10.1002/mbo3.644
Huber H., Stetter K.O. Desulfurococcales // The Prokaryotes / Eds. Dworkin M., Falkow S., Rosenberg E., Schleifer K.H., Stackebrandt E. New York: Springer, 2006. P. 52–68.
Hutchinson D.R., Golmshtok A.J., Zonenshain L.P., Moore T.C., Scholz C.A., Klitgord K.D. Depositional and tectonic flamework of the rift basins of Lake Baikal from multichannel seismic data // Geology. 1992. V. 20. C. 589–592.
Jeanbille M., Gury J., Duran R., Tronczynski J.K, Ghiglione J.-F., Agogue H., Said O.B., Taib N., Debroas D., Garnier C., Auguet J.-C. Chronic polyaromatic hydrocarbon (PAH) contamination is a marginal driver for community diversity and prokaryotic predicted functioning in coastal sediments // Front. Microbiol. 2016. V. 7. Art. 1303.
Johnson J.M., Wawrik B., Isom C., Boling W.B., Callaghan A.V. Interrogation of Chesapeake Bay sediment microbial communities for intrinsic alkane-utilizing potential under anaerobic conditions // FEMS Microbiol. Ecol. 2015. V. 91. № 2. P. 1–14.
Kadnikov V.V., Mardanov A., Beletsky A.V, Shubenkova O.V., Pogodaeva T.N., Zemskaya T.I., Ravin N.V., Skryabin K.G. Microbial community structure in methane hydrate-bearing sediments of freshwater Lake Baikal // FEMS Microbiol.- Ecol. 2012. V. 79. № 1. C. 348–358.
Kadnikov V.V., Lomakina A.V., Likhoshvai A.V., Gorshkov A.G., Pogodaeva T.V., Beletsky A.V., Mardanov A.V., Zemskaya T.I., Ravin N.V. Composition of the microbial communities of bituminous constructions at natural oil seeps at the bottom of Lake Baikal // Microbiology (Moscow). 2013. V. 82. P. 373–382.
King G.M., Kostka J.E., Hazen T.C., Sobecky P.A. Microbial responses to the Deepwater Horizon Oil Spill: from Coastal Wetlands to the deep sea // Annu. Rev. Mar. Sci. 2015. V. 7. P. 377–401.
Koizumi Y., Takii S., Nishino M., Nakajima T. Vertical distributions of sulfate-reducing bacteria and methane-producing archaea quantified by oligonucleotide probe hybridization in the profundal sediment of a mesotrophic lake // FEMS Microbiol. Ecol. 2003. V. 44. Art. 101e108.
Kotsyurbenko O.R. Trophic interactions in the methanogenic microbial community of low-temperature terrestrial ecosystems // FEMS Microbiol. Ecol. 2005. V. 53. P. 3–13.
Krylov A.A., Hachikubo A., Minami H., Pogodaeva T.V., Zemskaya T.I., Krzhizhanovskaya M.G., Poort J., Khlystov O.M. Authigenic rhodochrosite from a gas hydrate-bearing structure in Lake Baikal // Int. J. Earth Sci. 2018. V. 107. P. 2011–2022.
Lever M.A., Rogers K.L., Lloyd K.G., Overmann J., Schink B., Thauer R.K., Jørgensen B.B. Life under extreme eenergy limitation: a synthesis of laboratory- and field-based investigations // FEMS Microbiol. Rev. 2015. V. 39. P. 688–728.
Likhoshvay A., Khanaeva T., Gorshkov A., Zemskaya T., Grachev M. Do oil-degrading Rhodococci contribute to the genesis of deep water bitumen mounds in Lake Baikal? // Geomicrobiol. J. 2013. V. 30. P. 209–213.
Likhoshvay A., Lomakina A., Grachev M. The complete alk sequences of Rhodococcus erythropolis from Lake Baikal // Springer Plus. 2014. V. 3. Art. 621.
Liu Y., Whitman W.B. Metabolic, phylogenetic and ecological diversity of the methanogenic Archaea // Ann. N.Y. Acad. Sci. 2008. V. 1125. P. 171–189.
Liu Y., Conrad R., Yao T., Gleixner G., Claus P. Change of methane production pathway with sediment depth in a lake on the Tibetan plateau // Palaeogeogr. Palaeoclimatol. Palaeoecol. 2017. V. 474. P. 279–286.
Lomakina A.V., Mamaeva E.V., Galachyants Y.P., Petrova D.P., Pogodaeva T.V., Shubenkova O.V., Khabuev A.V., Morozov I.V., Zemskaya T.I. Diversity of Archaea in bottom sediments of the discharge areas with oil- and gas-bearing fluids in Lake Baikal // Geomicrobiol. J. 2018. V. 35. P. 50–63.
Lomakina A., Pogodaeva T., Kalmychkov G., Chernitsyna S., Zemskaya T. Diversity of NC10 bacteria and ANME-2d Archaea in sediments of fault zones at Lake Baikal // Diversity-Basel. 2020. V. 12. https://doi.org/10.3390/d12010010
Luff R., Wallmann K., Aloisi G. Numerical modeling of carbonate crust formation at cold vent sites: significance for fluid and methane budgets and chemosynthetic biological communities // Earth Planet. Sci. Lett. 2004. V. 221. P. 337–353.
Mandic-Mulec I., Gorenc K., Petrišiš M.G., Faganeli J., Ogrinc N. Methanogenesis pathways in a stratified eutrophic alpine lake (Lake Bled, Slovenia) // Limnol. Oceanogr. 2012. V. 57. P. 868–880.
Miettinen H., Bomberg M., Nyyssönen M., Reunamo A., Jørgensen K.S., Vikman M. Oil degradation potential of microbial communities in water and sediment of Baltic Sea coastal area // PloS One. 2019. V. 17. e0218834. https://doi.org/10.1371/journal.pone.0218834
Minami H., Pogodaeva T., Sakagami H., Hachikubo A., Krylov A., Harada D., Saito C., Tatsumi K., Hyakutake K., Ya-mashita S., Nishio S., Takahashi N., Shoji H., Khlystov O., Zemskaya T., Grachev M., Naudts L., Poort J. Traces of original gas hydrate-forming fluid observed in subsurface gas hydrates retrieved from Lake Baikal, Russia // 10th Int. Conf. on Gas in Marine Sediments. Listvyanka, Russia. 2010. P. 129.
Mussmann M., Brito I., Pitcher A., Sinninghe Damste J.S., Hatzenpichler R., Richter A., Nielsen J.L., Nielsen P.H., Muller A., Daims H., Wagner M., Head I.M. Thaumarchaeotes abundant in refinery nitrifying sludges express amoA but are not obligate autotrophic ammonia oxidizers // Proc. Natl. Acad. Sci. USA. 2011. V. 108. P. 16771–16776.
Nagata T., Takai K., Kawanobe K., Kim D.-S., Nakazato R., Guselnikova N., Bondarenko N., Mologawaya O., Kostornova T., Drucker V., Satoh Y., Watanabe Y. Autotrophic picoplankton in southern Lake Baikal: abundance, growth and grazing mortality during summer // J. Plankton Res. 1994. V. 16. P. 945–959.
Newton R.J., Jones S.E., Eiler A., McMahon K.D., Bertilsson S. A guide to the natural history of freshwater lake bacteria // Microbiol. Mol. Biol. R. 2001. V. 75. P. 14–49.
Norgi K.A., Thamdrup B., Schubert C.J. Anaerobic oxidation of methane in an iron-rich Danish freshwater lake sediment // Limnol. Oceanogr. 2013. V. 58. P. 546–554.
Nozhevnikova A.N., Nekrasova V., Ammann A., Zehnder A.J.B., Wehrli B., Holliger C. Influence of temperature and high acetate concentrations on methanogenensis in lake sediment slurries // FEMS Microbiol. Ecol. 2007. V. 62. P. 336–344.
Och L.M., Muller B., Voegelin A., Ulrich A., Göttlicher J., Steiniger R., Mangold S., Vologina E., Sturm M. New insight into the formation and burial of Fe/Mn accumulations in Lake Baikal sediments // Chem. Geol. 2012. V. 330–331. P. 244–259.
Pacheco-Oliver M., McDonald I., Groleau D., Murrell J.C., Miguez C. Detection of methanotrophs with highly divergent pmoA genes from Arctic soils // FEMS Microbiol. Lett. 2002. V. 209. P. 313–319.
Pannekens M., Kroll L., Müller H., Mbow F.T., Meckenstock R.U. Oil reservoirs, an exceptional habitat for microorganisms // New Biotechnol. 2019. V. 49. P. 1–9.
Pasche N., Schmid M., Vazquez F., Schubert C. J., Wüest A., Kessler J. D., Pack M.A., Reeburgh W.S., Bürgmann H. Methane sources and sinks in Lake Kivu // J. Geophys. Res. 2011. V. 116. G03006.
Pavlova O.N., Adamovich S.N., Novikova A.S., Gorshkov A.G., Izosimova O.N., Ushakov I.A., Oborina E.N., Mirskova A.N., Zemskaya T.I. Protatranes, effective growth biostimulants of hydrocarbon-oxidizing bacteria from Lake Baikal, Russia // Biotechnol. Rep. 2019. V. 24. e00371.
Pavlova O.N., Izosimova O.N., Chernitsyna S.M., Ivanov V.G., Pogodaeva T.V., Gorchkov A.G. Process of anaerobic oxidation of oil in bottom sediments of Lake Baikal // Limnol. Freshwater Biol. 2020. № 3. P. 1006–1007.
Pogodaeva T.V., Lopatina I.N., Khlystov O.M., Egorov A.V., Zemskaya T.I. Background composition of pore waters in Lake Baikal bottom sediments // J. Great Lake Res. 2017. V. 43. P. 1030–1043.
Pogodaeva T.V., Poort J., Aloisi G., Bataillard L., Makarov M.M., Khabuev A.V., Kazakov A.V., Chensky A.G., Khlystov O.M. Fluid migrations at the Krasny Yar methane seep of Lake Baikal according to geochemical data // J. Great Lakes Res. 2020. V. 46. P. 123–131.
Pujalte M.J., Lucena T., Ruvira M.A., Arahal D.R., Macian M.C. The family Rhodobacteraceae // The Prokaryotes: Alphaproteobacteria and Betaproteobacteria / Eds. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin Heidelberg, Germany: Springer-Verlag, 2014. P. 439–512.
Qiu L., Williams D.F., Gvorzdkov A., Karabanov E., Shimaraeva M. Biogenic silica accumulation and paleoproductivity in the northern basin of Lake Baikal during the Holocene // Geology. 1993. V. 21. P. 25–28.
Raghoebarsing A.A., Pol A., van de Pas-Schoonen K.T., Smolders A.J., Ettwig K.F., Rijpstra W.I., Schouten S., Damsté J.S.S., Op den Camp J.M., Jetten M.S., Strous M. A microbial consortium couples anaerobic methane oxidation to denitrification // Nature. 2006. V. 440. P. 918–921.
Rissanen A.J., Peura S., Mpamah P.A., Taipale S., Tiirola M., Biasi C., Maki A., Nykanen H. Vertical stratication of bacteria and archaea in sediments of a small boreal humic lake // FEMS Microbiol. Lett. 2019. V. 366. № 5. fnz044.
Schubert C.J., Vazquez F., Losekann-Behrens T., Knittel K., Tonolla M., Boetius A. Evidence for anaerobic oxidation of methane in sediments of a freshwater system (Lago di Cadagno) // FEMS Microbiol. Ecol. 2011. V. 76. P. 26–38.
Schulz S., Conrad R. Influence of temperature on pathways to methane production in the permanently cold profundal sediment of Lake Constance // FEMS Microbiol. Ecol. 1996. V. 20. P. 1–14.
Shen L., Ouyang L., Zhu Y., Trimmer M. Active pathways of anaerobic methane oxidation across contrasting riverbeds // ISME J. 2019. V. 13. P. 752–766.
Sierra-Garcia I.N., Dellagnezze B.M., Santos V.P., Chaves M.R., Capilla R., Neto S., Gray N., Oliveira V.M. Microbial diversity in degraded and non-degraded petroleum samples and comparison across oil reservoirs at local and global scales // Extremophiles. 2017. V. 21. P. 211–229.
Simoneit B.R.T., Aboul-Kassim T.A.T., Tiercelin J.J. Hydrothermalpetroleum from lacustrine sedimentary organic matter in the East Afri-can Rift // Appl. Geochem. 2000. V. 15. P. 355–368.
Söllinger A., Urich T. Methylotrophic methanogens everywhere – physiology and ecology of novel players in global methane cycling // Biochem. Soc. Trans. 2019. V. 47. P. 1895–1907.
Spang A., Poehlein A., Offre P., Zumbragel S., Haider S., Rychlik N., Nowka B., Schmeisser C., Lebedeva E.V., Rattei T., Böhm C., Schmid M., Galushko A., Hatzenpichler R., Weinmaier T., Daniel R., Schleper C., Spieck E., Streit W., Wagner M. The genome of the ammonia-oxidizing Candidatus Nitrososphaera gargensis: Insights into metabolic versatility and environmental adaptations // Environ. Microb-iol. 2012. V. 14. P. 3122–3145.
Starnawski P., Bataillon T., Ettema T.J.G., Jochum L.M., Schreiber L., Chen X., Lever M.A., Polz M.F., Jørgensen B.B., Schramm A., Kjeldsen K.U. Microbial community assembly and evolution in subseafoor sediment // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. 2940–2945.
Sun L.W., Toyonaga M., Ohashi A., Tourlousse D.M., Matsuura N., Meng X.Y., Tamaki H., Hanada S., Cruz R., Yamaguchi T., Sekiguchi Y. Lentimicrobium saccharophilum gen. nov., sp nov., a strictly anaerobic bacterium representing a new family in the phylum Bacteroidetes, and proposal of Lentimicrobiaceae fam. nov. // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 2635–2642.
Thauer R.K., Kaster A.K., Seedorf H., Buckel W., Hedderich R. Methanogenic archaea: ecologically relevant differences in energy conservation // Nat. Rev. Microbiol. 2008. V. 6. P. 579–591.
Timmers P.H., Welte C.U., Koehorst J.J., Plugge C.M., Jetten M.S., Stams A.J. Reverse methanogenesis and respiration in methanotrophic archaea // Archaea. 2017. V. 2017. 1654237.
Torres N.T., Och L.M., Hauser P.C., Furrer G., Brandl H., Vologina E., Sturm M., Bürgmann H., Müller B. Early diagenetic processes generate iron and manganese oxide layers in the sediments of Lake Baikal, Siberia // Environ. Sci. 2014. V. 16. P. 879–889.
Vanwonterghem I., Evans P.N., Parks D.H., Jensen P.D., Woodcroft B.J., Hugenholtz P., Tyson G.W. Methylotrophic methanogenesis discovered in the archaeal phylum Verstraetearchaeota // Nature Microbiol. 2016. V. 1. P. 16170.
Vologina E.G., Sturm M., Vorobyova S.S., Granina L.Z. New results of high-resolution studies of surface sediments of Lake Baikal // Terra Nostra. 2000. № 9. P. 115–131.
Walker C.B., de la Torrea J.R., Klotz M.G., Urakawa H., Pinel N., Arp D.J., Brochier-Armanet C., Chain P.S., Chan P.P., Gollabgir A., Hemp J., Hugler M., Karr E.A., Konneke M., Shin M., Lawton T.J., Lowe T., Martens-Habbena W., Sayavedra-Soto L.A., Lang D., Sievert S.M., Rosenzweig A.C., Manning G., Stahl D.A. Nitrosopumilus maritimus genome reveals unique mechanisms for nitrification and autotrophy in globally distributed marine crenarchaea // Proc. Natl. Acad. Sci. USA. 2010. V. 107. P. 8818–8823.
Wand U., Samarkin V.A., Nitzsche H.-M., Hubberten H.-W. Biogeochemistry of methane in the permanently ice-covered Lake Untersee, central Dronning Maud Land, East Antarctica // Limnol. Oceanogr. 2006. V. 51. P. 1180–1194.
Weber H.S., Habicht K.S., Thamdrup B. Anaerobic methanotrophic archaea of the ANME-2d cluster are active in a low-sulfate, iron-rich freshwater sediment // Front. Microbiol. 2017. V. 8. P. 619.
Welte C.U., Rasigraf O., Vaksmaa A., Versantvoort W., Arshad A., Op den Camp H.J., Jetten M.S., Lüke C., Reimann J. Nitrate- and nitrite-dependent anaerobic oxidation of methane // Environ. Microbiol. Rep. 2016. V. 8. P. 941.
Wen X., Yang S.Z., Horn F., Winkel M., Wagner D., Liebner S. Global biogeographic analysis of methanogenic Archaea identifies community-shaping environmental factors of natural environments // Front. Microbiol. 2017. V. 8. Art. 1339.
Wurzbacher C., Nilsson R.H, Rautio M. Peura S. Poorly known microbial taxa dominate the microbiome of permafrost thaw ponds // ISME J. 2017. V. 11. P. 1938–1941.
Yanagawa K., Shiraishi F., Tanigawa Y., Maeda T., Mustapha N.A., Owari S., Tomaru H., Matsumoto R., Kano A. Endolithic microbial habitats hosted in carbonate nodules currently forming within sediment at a high methane flux Site in the Sea of Japan // Geosciences. 2019. V. 9. P. 463.
Yang Y., Chen J., Tong T., Xie S., Liu Y. Influences of eutrophication on methanogenesis pathways and methanogenic microbial community structures in freshwater lakes // Environ. Pollut. 2020. V. 260. Art. 114106.
Yoon J., Matsuo Y., Katsuta A., Jang J.H., Matsuda S., Adachi K., Kasai H., Yokota A. Haloferula rosea gen. nov., sp. nov., Haloferula harenae, sp. nov., Haloferula phyci sp. nov., Haloferula helveola sp. nov and Haloferula sargassicola sp. nov., five marine representatives of the family Verrucomicrobiaceae within the phylum “Verrucomicrobia”// Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 2491–2500.
Zakharova Y.R., Petrova D.P., Galachyants Y.P., Bashenkhaeva M.Y., Kurilkina M.I., Likhoshway Y.V. Bacterial and archaeal community structure in the surface diatom sediments of deep freshwater Lake Baikal (Eastern Siberia) // Geomicrobiol. J. 2018. V. 35. P. 635–647.
Zarate-del Valle P.F., Rushdi A.I., Simoneit B.R.T. Hydrothermal petroleum of Lake Chapala, Citala Rift, western Mexico: Bitumen compositions from source sediments and application of hydrous pyrolysis // Appl. Geochem. 2006. V. 21. P. 701–712.
Zemskaya T.I., Sitnikova T.Y., Kiyashko S.I., Kalmychkov G.V., Pogodaeva T.V., Mekhanikova I.V., Naumova T.V., Shubenkova O.V., Chernitsina S.M., Kotsar O.V., Chernyaev E.S., Khlystov O.M. Faunal communities at sites of gas- and oil-bearing fluids in Lake Baikal // Geo-Mar. Lett. 2012. V. 32. P. 437–451.
Zemskaya T.I., Lomakina A.V., Mamaeva E.V., Zakharenko A.S., Pogodaeva T.V., Petrova D.P., Galachyants Yu.P. Bacterial communities in sediments of Lake Baikal from areas with oil and gas discharge // Aquat. Microbiol. Ecol. 2015a. V. 75. P. 95–109.
Zemskaya T.I., Lomakina A.V., Shubenkova O.V., Pogodaeva T.V., Morozov I.V., Chernitsina S.M., Sitnikova T.Ya., Khlystov O.M., Egorov A.V. Jelly-like microbial mats over subsurface fields of gas hydrates at the St. Petersburg methane Seep (Central Baikal) // Geomicrobiol. J. 2015b. V. 32. P. 89–100.
Zhu G., Jetten M.S.M., Kuschk P., Ettwig K.F., Yin C. Potential roles of anaerobic ammonium and methane oxidation in the nitrogen cycle of wetland ecosystems // Appl. Microbiol. Biotechnol. 2010. V. 86. P. 1043–1055.
Дополнительные материалы отсутствуют.


