Микробиология, 2021, T. 90, № 4, стр. 387-399
Катаболический потенциал и сурфактантная активность галотолерантных углеводородокисляющих бактерий
А. Е. Иванова 1, *, И. А. Борзенков 1, Д. Ш. Соколова 1
1 Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
* E-mail: a.e.ivanova@mail.ru
Поступила в редакцию 24.11.2020
После доработки 27.02.2021
Принята к публикации 02.03.2021
Аннотация
Исследованы углеводородокисляющий потенциал, способность к синтезу биосурфактантов и устойчивость к экологически значимым факторам ранее выделенных штаммов-деструкторов: Acinetobacter seifertii WS-1, Pseudomonas extremaustralis WS-1, Dietzia maris 367-2, Rhodococcus qingshengii 367-6, Gordonia cholesterolivorans S12. Установлено, что в целом изученные штаммы способны функционировать как деструкторы углеводородов при умеренных (25–37°С) и пониженных (6–10°С) температурах, в широком диапазоне рН (4.0–11.5) и солености (0–9%) среды. Показано, что, наряду с индивидуальными н-алканами, они эффективно разлагали нефть (85–91% алифатической фракции за 5 сут), причем для разных культур бактерий биодеградация С10–С29н-алканов составила 96–100%, а С14–С20изо-алканов – 26–47%. Благодаря использованию модельной смеси н-алканов состава С10–С33 определены скорости потребления углеводородов и субстратные предпочтения штаммов. Обнаружено, что метаболизм обычно устойчивых к биодеструкции мультиразветвленных алканов, 2,2,4,4,6,8,8-гептаметилнонана (ГМН) и сквалана (С30Н62, 2,6,10,15,19,23-гексаметилтетракозан), активировался в присутствии н-алканов, при этом изо-алканы потреблялись одновременно, но с меньшей скоростью, чем н-алканы. После полного элиминирования н-алканов окисление сквалана тормозилось, тогда как биодеструкция ГМН активно продолжалась. Штаммы использовали 48–68% сквалана за 6 сут и 28–82% ГМН за 4 сут. ГМН не мог служить единственным источником углерода и энергии для исследованных штаммов, однако длительное культивирование (30 сут) со скваланом сопровождалось резким снижением значений поверхностного и межфазного натяжения среды, слабым ростом бактерий и потреблением до 15% углеводорода . Показано, что все изученные штаммы-деструкторы являются продуцентами поверхностно-активных веществ (ПАВ). Гидрофобные субстраты (жидкие парафины, сквалан, оливковое масло) индуцировали образование био-ПАВ с выраженной сурфактантной активностью, которые снижали межфазное и поверхностное натяжение до минимальных значений – 2.0 и 27.2 мН/м соответственно, тогда как водорастворимые источники углерода (этанол, бензоат, фенол) способствовали образованию эмульгаторов. Эмульгирующая активность была характерна для отдельных штаммов, проявлялась не на всех субстратах и не превышала 50%. Высокий метаболический и адаптивный потенциал исследованных штаммов может быть использован для биоремедиации нефтезагрязненных объектов.
Углеводородокисляющие бактерии (УОБ) в течение длительного времени остаются в фокусе интенсивных теоретических и прикладных исследований, что в значительной степени обусловлено их практическим использованием для очистки окружающей среды (Desai, Banat, 1997; Kumar et al., 2011; Rayu et al., 2012). Эта группа микроорганизмов широко распространена в природе и разнообразнав таксономическом отношении. Среди наиболее известных ее представителей, утилизирующих индивидуальные углеводороды и нефть, бактерии родов Acinetobacter (Lal, Khanna, 1996); Dietzia (Wang et al., 2011); Mycobacterium (Guo et al., 2010); Pseudomonas (Zhang et al., 2011); Rhodococcus (Binazadeh et al., 2009) и ряд других.
Нефть представляет собой сложную смесь, состоящую преимущественно из углеводородов. Микробной трансформации подвержен широкий спектр этих соединений (Xu et al., 2018), но степень и скорость биодеградации углеводородов определяется их химическим строением и биологическими возможностями бактерий-деструкторов. Например, мультиразветвленные алканы окисляют только уникальные микроорганизмы (Berekaa, Steinbüchel, 2000; Иванова и соавт., 2016), что стимулирует их дальнейший поиск.
На процесс биодеградации нефти влияют не только ее состав и количество, наличие и физиологические возможности УОБ, но также условия среды обитания микроорганизмов, определяющие саму возможность их активной жизнедеятельности. Поэтому успех применения биотехнологий зависит как от селекции наиболее активных деструкторов, так и от выбора среди них штаммов, приспособленных к основным абиотическим факторам (рН, температура, соленость) местообитания.
Таким образом, знание физиологии новых штаммов бактерий, деградирующих углеводороды разного химического строения, является критически важным для очистки загрязненных местообитаний путем биоремедиации.
Данная работа является частью комплексных исследований по созданию новых биокомпозитных материалов на основе инкапсулирования стабилизированных форм УОБ для очистки нефтезагрязненных систем. Выбор микробиологических объектов исследования, общих для всех этапов работы, связан, с одной стороны, с ведущей ролью УОБ в микробной трансформации нефтяных углеводородов, а с другой – с разработкой новых и универсальных для различных представителей этой группы бактерий методических подходов, обеспечивающих повышение жизнеспособности, стрессоустойчивости и функциональной активности бактерий-деструкторов. В работе использовали ранее выделенные нами природные изоляты A. seifertii WS-1, P. extremaustralis WS-1, D. maris 367-2, R. qingshengii 367-6, G. cholesterolivorans S12, которые характеризовались способностью использовать нефть в качестве единственного источника углерода и энергии, но отличались по источнику выделения и принадлежности к разным родам грамположительных и грамотрицательных бактерий. Уровень сходства с соответствующими типовыми штаммами по последовательности гена 16S рРНК, определенный при помощи программного обеспечения DNASTAR Inc. (https:// www.dnastar.com/software/lasergene/), составлял 99.9–100.0%.
Целью настоящей работы было изучить особенности биодеструкции нормальных и разветвленных алканов штаммами A. seifertii WS-1, P. extremaustralis WS-1, D. maris 367-2, R. qingshengii 367-6, G. cholesterolivorans S12 и оценить их способность синтезировать биосурфактанты в процессе роста на различных органических субстратах, а также устойчивость к температуре, рН и солености среды при росте на углеводородах.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. В работе исследовали бактерии, выделенные из нефтяной скважины Бондюжского месторождения нефти (штаммы R. qingshengii 367-6 и D. maris 367-2), болотистых почв Западной Сибири (штаммы A. seifertii WS-1 и P. extremaustralis WS-1) и активного ила очистного сооружения г. Альметьевск (штамм G. choleste-rolivorans S12). Последовательности гена 16S рРНК штаммов A. seifertii WS-1, P. extremaustralis WS-1, D. maris 367-2, R. qingshengii 367-6, G. cholesterolivorans S12 депонированы в базе данных NCBI под номерами MT632639, MT641229, MT632637, MT632489, MT632490 соответственно. Углеводородокисляющий потенциал и биологические особенности этих штаммов, прямо или косвенно связанные с использованием углеводородов, ранее не изучались.
Состав питательных сред и условия культивирования микроорганизмов. Исследуемые штаммы УОБ, если не указаны иные условия, культивировали при температуре 30°С и начальном рН 7.0 в течение 2–15 сут в статических условиях во флаконах объемом 125 мл, содержащих жидкую минеральную среду “М” и одно из выбранных органических соединений в качестве субстрата. Среда “М” содержала (г/л дистиллированной воды): Na2HPO4 – 1.5; KH2PO4 – 1.0; NH4NO3 – 1.0; MgSO4 ⋅ 7H2O – 0.2; MnSO4 ⋅ 7H2O – 0.02; FeSO4 ⋅ 7H2O – 0.01. В среду вносили микроэлементы (Pfennig, Lippert, 1966) в количестве 1 мл/л. Соотношение объемов питательной среды и газовой фазы (воздух), 1 : 10, было достаточным, чтобы исключить лимитацию по кислороду. Углеводороды (н-додекан, жидкие парафины состава С14–С21, 2,2,4,4,6,8,8-гептаметилнонан, сквалан), бензоат, метанол и фенол вносили в среду в количестве 0.1–0.2% (об./об.), остальные органические соединения (оливковое масло, ацетат, пропионат, этанол, глицерин) и нефть – в количестве 1%. Фенол добавляли до конечной концентрации 1 г/л дробно, по 100 мг, после полного потребления предыдущей порции субстрата. Заключение об использовании бактериями конкретного субстрата делали после трех последовательных пересевов культуры на тот же субстрат.
В некоторых экспериментах бактерии выращивали аналогичным образом, но на готовой среде Луриа–Бертани (LB) (“Carl Roth GmbH + Co. KG”, Германия) или на богатой среде “КД” слетыдующего состава (г/л дистиллированной воды): казаминовые кислоты – 10%; дрожжевой экстракт – 5%. Начальное значение рН среды устанавливали 7.2–7.5.
Инокулятом служила культура, выращенная в течение 1–2 сут в жидкой среде LB. Затем клетки осаждали центрифугированием, промывали стерильной водопроводной водой и вносили во флаконы с культуральной средой до получения начальной оптической плотности (OD600) 0.02–0.04, что соответствовало численности клеток 105–106 клеток в 1 мл в зависимости от штамма бактерий. Рост культур оценивали по оптической плотности на приборе Ultrospec 2100 pro UV/visible Spectrophotometer (“Amersham Biosciences”, США) в 10 мм кювете при длине волны (λ) 600 нм. В связи с негомогенным ростом бактерий в средах с углеводородами, биомассу перед измерением оптической плотности предварительно отделяли от гидрофобного субстрата центрифугированием, а затем суспендировали в том же объеме минеральной среды “М” без субстрата.
Влияние на исследуемые бактерии основных абиотических факторов среды (температура, рН и соленость) анализировали в жидкой минеральной среде “М” с углеводородами (1 об. %) в качестве субстрата. Зависимость роста УОБ от температуры определяли в среде с н-додеканом, от рН и солености – в среде с жидкими парафинами. Рост УОБ изучали в диапазоне рН 3.0–12.0, интервале температур для роста 6–45°С и солености 0–12% NaCl.
В ряде экспериментов субстратом для исследуемых бактерий служила нефть Московского нефтеперерабатывающего завода (МНПЗ). Инкубацию проводили в колбах объемом 500 мл, содержащих 100 мл жидкой минеральной среды “М” с 1 об. % нефти, на качалке (130 об./мин) при температуре 30°С в течение 5 сут. Клетки бактерий первоначально выращивали на среде LB и вносили в среду “М” в количестве 5 об. %.
Аналитические методы исследования. Степень биодеструкции нефти оценивали по изменению содержания н-алканов и изо-алканов в алифатической фракции биодеградированной нефти по сравнению с контролем (в %), как описано ранее (Иванова и соавт., 2018). Контролем служила стерильная среда с нефтью, которую инкубировали в тех же условиях. После инкубации нефть из культуральной жидкости экстрагировали гексаном, гексановую фракцию упаривали на роторном испарителе и из остатка выделяли алифатическую фракцию на колонке с силикагелем. Алифатическую фракцию анализировали методом ГЖХ на хроматографе Кристалл 5000.1 (ЗАО “Хроматэк”, Россия) с пламенно-ионизационным детектором и капиллярной колонкой ZebronTM ZB-1XT (30 м × × 0.53 мм × 2.65 мкм) в режиме: начальная температура колонки 100°С, скорость нагрева – 5°С/мин, конечная – 320°С (10 мин). Газом-носителем служил гелий.
Остаточное содержание (%) алканов нефти рассчитывали на основе хроматографических данных по методу внутренней нормализации. В качестве внутреннего стандарта при обсчете серии хроматограмм алифатической фракции сырой нефти использовали суммарную площадь пиков пристана и фитана (изо-С19 + изо-С20). Обсчет считался корректным при сохранении в ходе экспериментов соотношения изо-С19/изо-С20, характерного для нефти МНПЗ. При изменении указанного соотношения в ходе эксперимента более чем на 5% в качестве внутреннего стандарта использовали величину площади пика фитана.
В экспериментах с модельными смесями углеводородов использовали различные композиции н-алканов без добавок, а также смеси, дополненные гептаметилнонаном (ГМН) или скваланом (“Merck”, Германия; степень чистоты 98 и 98.5% соответственно). Смесь № 1 получали при растворении 4 г твердых парафинов П2 по ГОСТ 23683-89 в 10 мл смеси жидких парафинов, используемых при розжиге. На рис. S1 (см. Дополнительные материалы) представлена хроматограмма этой модельной смеси. Смесь № 2 состояла из индивидуальных н-алканов (н-С12 и н-С17) и ГМН в соотношении 1 : 1 : 1. Смесь № 3 получали при смешивании 2 мл сквалана и 8 мл смеси жидких парафинов, используемых при розжиге. Содержание индивидуальных углеводородов в модельных смесях представлено в табл. S1 (см. Дополнительные материалы).
Для инкубации со смесью № 1 бактерии предварительно подращивали на среде LB, разбавленной в 4 раза, до достижения величины оптической плотности (OD600), равной 1.0. В колбу со 100 мл среды “М” добавляли 300 мкл модельной смеси и 5 мл подращенной культуры УОБ. Через 48 ч инкубации на качалке (130 об./мин) при 30°С остаточные углеводороды экстрагировали путем добавления в каждую колбу 4.5 мл гексана, содержащего в качестве внутреннего стандарта 1 об. % сквалана.
При использовании в качестве источника углерода ГМН, сквалана, смеси № 2 и смеси № 3 биомассу УОБ предварительно подращивали в среде “М” со смесью № 1 до момента достижения величины оптической плотности OD600, равной 1.0. Затем в колбу со 100 мл среды “М” добавляли 300 мкл субстрата (индивидуального изо-алкана или изо-алкана в смеси с н-алканами) и 5 мл подращенной культуры. Бактерии культивировали в условиях перемешивания на качалке (130 об./мин) и 30°С. Через определенные периоды времени культуры снимали с качалки и остаточные углеводороды экстрагировали путем добавления в каждую 4.5 мл гексана с 1 об. % сквалана в качестве внутреннего стандарта для вариантов с ГМН или, наоборот, с 1 об. % ГМН для вариантов со скваланом. В процессе экстракции закрытые полиэтиленовой пленкой колбы помещали на качалку (130 об./мин) при комнатной температуре на 15 мин. После расслоения жидкостей пробу для хроматографического анализа объемом 0.5 мл отбирали из верхнего углеводородного слоя. Степень биодеградации углеводородов оценивали по изменению содержания детектируемых соединений в биодеградированном субстрате по сравнению со стерильным контролем без микроорганизмов, инкубируемым в тех же условиях.
Поверхностное натяжение против воздуха и межфазное натяжение на границе культуральная жидкость/гексадекан в культуральных средах исследуемых УОБ определяли полустатистическим методом отрыва кольца на тензиометре Surface Tensiomat 21 (“Cole-Parmer”, США). Индекс эмульгирования (Е24) определяли, как описано ранее (Иванова и соавт., 2016). Для того чтобы установить, связан био-ПАВ с клетками бактерий или выделяется в среду, исследовали реологические свойства культуральной жидкости с клетками, супернатанта и клеточной суспензии. Для получения последней 10 мл культуральной жидкости фильтровали через поликарбонатный фильтр с диаметром пор 0.2 мкм (“Millipore”, США) с последующим суспендированием биомассы в 10 мл стерильной водопроводной воды.
Статистический анализ данных. Представленные в работе результаты отражают усредненные величины по трем независимым сериям экспериментов при трехкратной повторности измерений. Статистическую обработку полученных данных проводили с использованием программного пакета Statistica (“TIBCO Software Inc.”, США). Для оценки достоверности различий средних данных использовали t-критерий Стьюдента с расчетом 95% доверительного интервала.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Изучение некоторых биологических особенностей исследуемых штаммов
Известно, что большинство УОБ утилизирует разнообразные органические субстраты, и только немногие представители группы (в английской транскрипции “hydrocarbonoclastic bacteria”) специализированы на окислении углеводородов. Однако использование углеводородов, как отличительная черта рассматриваемой физиологической группы бактерий в целом, накладывает на их биологию существенный отпечаток. Поэтому не вполне корректно изучать некоторые особенности физиологии УОБ на неспецифических субстратах и средах. Например, определять диапазон значений рН и солености для роста представителей УОБ на глюкозе или богатой органической среде и экстраполировать полученные данные на метаболизм углеводородов, что нередко встречается в литературе.
Влияние источника углерода на рост штаммов-деструкторов. Из табл. S2 видно, что рост бактерий поддерживали субстраты углеводородной природы (гексадекан, сквалан, вазелиновое масло) и их производные (ацетат, пропионат, этанол), ароматические соединения (бензоат, фенол), а также глицерин (побочный продукт производства биодизеля) и оливковое масло (пример возобновляемого сырья в качестве альтернативы ископаемым видам топлив). Таким образом, разнообразные широко распространенные и дешевые продукты могут служить для наращивания биомассы этих микроорганизмов.
Следует подчеркнуть, что сквалан поддерживал медленный и слабый рост исследуемых штаммов (за исключением P. extremaustralis WS-1), а ГМН не мог служить для них единственным субстратом. Полученные результаты согласуются с данными других авторов о сложности утилизации микроорганизмами сильноразветвленных алканов. В частности, только единичные представители УОБ эффективно утилизируют сквалан в качестве единственного источника углерода и энергии. Среди них быстро растущие актинобактерии Mycobacterium ratisbonense и M. fortuitum (Berekaa, Steinbüchel, 2000), медленно растущая ацидофильная микобактерия Mycobacterium sp. AGS10 (Иванова и соавт., 2016) и облигатно специализированная на окислении алифатических углеводородов бактерия Alkanindiges illinoisensis (Bogan et al., 2003).
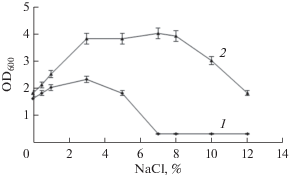
Влияние физико-химических характеристик среды на рост штаммов. Зависимость роста изучаемых штаммов от содержания хлорида натрия в среде проверяли на среде “М” с жидкими парафинами. Результаты представлены на рис. S2 . Как можно видеть, все исследуемые штаммы являются галотолерантными и хорошо растут в присутствии в среде до 4% NaCl, при этом рост D. maris 367-2 и G. cholesterolivorans S12 возможен в более широком диапазоне концентраций хлорида натрия (вплоть до 6 и 9% соли соответственно). Оптимальная концентрация NaCl для роста находится в пределах 0–0.5% NaCl для бактерий P. extremaustralis WS-1, A. seifertii WS-1, R. qingshengii 367-6, 1% NaCl для G. cholesterolivorans S12 и 3% NaCl для D. maris 367-2. Изменение условий культивирования путем замены минеральной среды на среду КД или LB приводило не только к расширению диапазона солености для роста культур, но и к смещению оптимальной величины этого параметра в сторону больших значений (рис. 1). Полагаем, что это обусловлено присутствием в использованных богатых питательных средах соединений с осмопротекторными свойствами (например, пролина), оказывающих защитное действие на клетки в условиях повышенного содержания соли.
Рис. 1.
Рост D. maris 367-2 в минеральной среде с жидкими парафинами (1) и на богатой среде КД (2) в присутствии разных концентраций NaCl. Условия инкубации: 5 сут культивирования в статических условиях при температуре 30°С и начальном рН 7.0.
Зависимость роста культур УОБ от величины начального рН среды изучали в минеральной среде “М” с жидкими парафинами в качестве единственного источника углерода и энергии в течение 2 сут (для A. seifertii WS-1) и 5 сут для остальных УОБ. На протяжении этого времени значение рН оставалось практически неизменным. Буферные растворы не использовали, так как при исследовании широкого диапазона рН приходится применять буферы разного состава, которые сами по себе могут оказывать воздействие на рост микроорганизмов. Результаты суммированы в табл. S3 . Для A. seifertii WS-1 и G. cholesterolivorans S12 оптимальной является слабокислая среда (рН 6.6–6.8), для остальных УОБ – слабощелочная среда в диапазоне рН 7.4–8.5 в зависимости от конкретной культуры бактерий. Следует отметить, что на богатых средах (КД, LB) как диапазон рН для роста, так и оптимальная величина этого параметра могут значительно отличаться от таковых на минеральной среде с углеводородами (данные не показаны). Наблюдаемая картина может объясняться способностью многих бактерий регулировать величину внешнего рН в благоприятную для роста сторону, если состав среды это позволяет.
Влияние температуры на рост культур УОБ изучали в минеральной вреде “М” с н-додеканом в качестве единственного источника углерода, так как этот н-алкан остается в жидком состоянии в исследуемом температурном диапазоне. По нашим данным (табл. S3 ), исследованные бактерии являются мезофилами, лучше растут в области умеренных температур с оптимумом 28–30°С, но могут активно функционировать и при пониженных температурах, 6–10°С.
Таким образом, штаммы-деструкторы приспособлены к нестабильным экологическим условиям окружающей среды. Наши данные позволяют предположить, что диапазоны рН и солености, поддерживающие рост штаммов, можно расширить, корректируя состав среды культивирования.
Образование био-ПАВ при росте штаммов УОБ на гидрофильных и гидрофобных субстратах
Ограниченная растворимость углеводородов в воде препятствует их проникновению в микробную клетку. Для ассимиляции подобных субстратов УОБ выработали различные приспособительные стратегии, в том числе механизм повышения биодоступности углеводородов, основанный на снижении поверхностного натяжения растворов посредством синтеза био-ПАВ (Desai, Banat, 1997).
Для определения спектра субстратов, способствующих образованию био-ПАВ, исследовали реологические свойства культуральных жидкостей бактерий, выращенных на различных органических соединениях в статических условиях при температуре 30°С в течение 5 сут. По нашим данным, все изученные штаммы-деструкторы являются продуцентами био-ПАВ (табл. S4 , табл. 1). Проведенные сравнительные исследования субстрат-зависимой сурфактантной активности бактерий свидетельствуют о том, что гидрофобные субстраты (жидкие парафины, сквалан, оливковое масло) индуцируют образование ПАВ с выраженными межфазными свойствами (снижают межфазное натяжение среды культивирования до минимальных значений 2.2–2.0 мН/м) и поверхностной активностью (снижают поверхностное натяжение вплоть до 28.7–27.2 мН/м), тогда как водорастворимые источники углерода (этанол, бензоат, фенол) способствуют образованию эмульгаторов (табл. S4 , табл. 1). Так, P. extremaustralis WS-1, по-видимому, образует комплекс веществ, обладающих эмульгирующими и поверхностно-активными свойствами. Причем на гидрофобном субстрате (жидкие парафины) синтезировались соединения с поверхностно-активными свойствами, а на гидрофильных (этанол, бензоат) – преимущественно эмульгатор. Однако есть и исключения. Так, у D. maris 367-2 эмульгирующая способность не выявлена ни на одном из использованных углеродных субстратов. С другой стороны, биосурфактанты A. seifertii WS-1 при росте на жидких парафинах и G. cholesterolivorans S12, выращенной на бензоате, феноле и парафинах, проявляли обе функциональные активности.
Таблица 1.
Реологические параметры культуральных жидкостей исследуемых бактерий при выращивании в среде с жидкими парафинами
| Штамм, проба | OD600 | Е24, % | ПН, мН/м | МН, мН/м |
|---|---|---|---|---|
| A. seifertii WS-1 | ||||
| Культуральная жидкость | 2.343 | 50.0 ± 3 | 43.1 ± 0.2 | 15.2 ± 0.1 |
| Супернатант культуральной жидкости | 0 | 42.0 ± 0.3 | 15.0 ± 0.2 | |
| Клеточная суспензия* | 50.0 ± 2 | 43.5 ± 0.4 | 19.8 ± 0.4 | |
| D. maris 367-2 | ||||
| Культуральная жидкость | 0.560 | 0 | 45.0 ± 0.2 | 12.5 ± 0.2 |
| Супернатант культуральной жидкости | 0 | 53.0 ± 0.2 | 19.2 ± 0.1 | |
| Клеточная суспензия* | 0 | 43.0 ± 0.3 | 2.0 ± 0.1 | |
| G. cholesterolivorans S12 | ||||
| Культуральная жидкость | 0.558 | 5.0 ± 0.2 | 43.5 ± 0.1 | 5.0 ± 0.2 |
| Супернатант культуральной жидкости | 0 | 53.9 ± 0.5 | 22.0 ± 0.4 | |
| Клеточная суспензия* | 50.0 ± 4 | 51.0 ± 0.2 | 3.1 ± 0.2 | |
| R. qingshengii 367-6 | ||||
| Культуральная жидкость | 0.582 | 10.0 ± 0.4 | 33.8 ± 0.3 | 2.3 ± 0.1 |
| Супернатант культуральной жидкости | 0 | 51.0 ± 0.1 | 20.0 ± 0.3 | |
| Клеточная суспензия* | 5.0 ± 0.3 | 38.2 ± 0.3 | 7.5 ± 0.4 | |
| P. еxtremaustralis WS-1 | ||||
| Культуральная жидкость | 0.372 | 0 | 35.0 ± 0.2 | 8.0 ± 0.2 |
| Супернатант культуральной жидкости | 0 | 46.0 ± 0.4 | 19.7 ± 0.4 | |
| Клеточная суспензия* | 0 | 44.9 ± 0.5 | 4.0 ± 0.1 | |
| Контроль без микроорганизмов | 0.05 | 0 | 55.0 ± 0.2 | 25.0 ± 0.5 |
Следует отметить, что поверхностно-активные свойства штаммов были более выражены, чем их эмульгирующая способность (табл. S4 , табл. 1). Последняя характерна для отдельных штаммов и проявлялась не на всех субстратах культивирования, при этом индекс эмульгирования не превышал 50%.
Необходимы дальнейшие исследования сурфактантной способности штаммов в зависимости от субстрата, поскольку есть перспективы для синтеза био-ПАВ с заданным типом функциональной активности.
Более детальное исследование реологических характеристик культуральных жидкостей, полученных после выращивания бактерий на жидких парафинах (табл. 1), позволяет предварительно отнести синтезируемые биосурфактанты к разным типам. Например, после отделения клеток G. сholesterolivorans S12 в супернатанте отмечено резкое снижение эмульгирующей активности с 50% до 0, которое коррелирует с повышением поверхностного (с 43.5 до 53.9 мН/м) и межфазного натяжения (с 5.0 до 22.0 мН/м), что может свидетельствовать об образовании гордонией био-ПАВ, связанных с клетками. R. qingshengii 367-6 и D. maris 367-2 тоже, по-видимому, синтезируют ПАВы эндо-типа, что характерно для большинства актиномицетов (Sutcliff, 1998).
Отметим, что поверхностное натяжение культуральной жидкости, супернатанта и собственно биомассы грамотрицательной бактерии A. seifertii WS-1 после роста на жидких парафинах характеризовалось близкими значениями параметра, в то время как высокая эмульгирующая активность (50%) была ассоциирована исключительно с клетками и падала до нуля в бесклеточном экстракте (табл. 1). Полученные результаты могут свидетельствовать о синтезе этой культурой биосурфактантов эндо- и экзо-типов, причем первый отличается значительной эмульгирующей активностью.
Что касается второй исследуемой грамотрицательной бактерии, P. extremaustralis WS-1, то определенного вывода относительно принадлежности синтезируемых ею био-ПАВ к конкретному типу пока делать рано. Необходимы дальнейшие исследования.
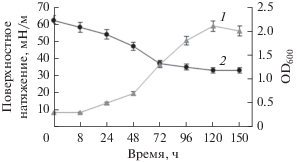
Нами прослежено образование био-ПАВ в динамике бактериями A. seifertii WS-1 и D. maris 367-2 (рис. 2 и 3 соответственно) в минеральной среде “М” с н-додеканом в качестве источника углерода и энергии. Вслед за инокуляцией среды культурой A. seifertii WS-1 поверхностное натяжение культуральной жидкости резко падало, достигая минимальных значений параметра (около 30 мН/м) в экспоненциальной фазе роста, после 24 ч культивирования штамма (рис. 2). При дальнейшей инкубации значительных изменений величины этого параметра не наблюдалось. Что касается D. maris 367-2, то и в этом случае синтез биосурфатанта из н-додекана происходил в основном в экспоненциальную фазу роста культуры, но максимум снижения поверхностного натяжения приходился на 72 ч культивирования (рис. 3). Полученные результаты свидетельствуют о том, что био-ПАВ образуется как первичный метаболит, сопровождающий рост клеточной биомассы. Это позволяeт предположить возможность эффективного синтеза биосурфактанта в условиях хемостата или иммобилизованными клетками бактерий.
Рис. 2.
Образование биосурфактанта в процессе роста A. seifertii WS-1 в минеральной среде с н-додеканом в динамике. Обозначения: 1 – рост штамма; 2 – поверхностное натяжение.
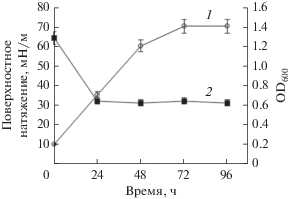
Рис. 3.
Рост и образованием био-ПАВ в процессе культивирования штамма D. maris 367-2 в среде с н‑додеканом. Обозначения: 1 – рост штамма; 2 – поверхностное натяжение.
Как известно, наиболее эффективные биосурфактанты снижают поверхностное натяжение воды с 72 до 28–24 мН/м (Cooper, Goldenberg, 1987; Morikawa et al., 1993). Перспективными продуцентами ПАВ считаются микроорганизмы, снижающие поверхностное натяжение культуральной среды более чем на 10 мН/м (Francy et al., 1991) или примерно до 35–30 мН/м (Desai, Banat, 1997). В настоящей работе определяли потенциальную сурфактантную активность исследуемых штаммов-деструкторов; задача оптимизировать состав среды и условия инкубации культур с целью максимального улучшения функциональных характеристик и интенсификации синтеза био-ПАВ не ставилась. Тем не менее продуцируемые ими биосурфактанты обладали выраженными поверхностными и межфазными свойствами, не уступая по этим параметрам известным продуцентам микробных ПАВ.
Особенности биодеградации нефтяных углеводородов исследуемыми штаммами УОБ
Биодеструкция нефти. Способность УОБ утилизировать нефтяные углеводороды делает их перспективными кандидатами для очистки загрязненных местообитаний. Как видно из сравнения хроматограмм алифатической фракции нефти МНПЗ после биодеградации ее исследуемыми штаммами (рис. S3 а–S3д) и контрольного образца без микроорганизмов (рис. S3 е), они существенно различались между собой. В табл. S5 представлены результаты обсчета полученной серии хроматограмм. Биодеструкция алканов за 5 сут культивирования составила от 85 до 91% (для P. extremaustralis WS-1 и D. maris 376-2 соответственно). Деструкция н-алканов приближалась к 100%, а деструкции изо-алканов достигала 26–47%.
Следует отметить, что способность исследованных бактерий утилизировать изо-алканы разного молекулярного веса и степени разветвленности одновременно с н-алканами важна для очистки объектов, загрязненных нефтью и нефтепродуктами, в которых, как правило, представлены оба типа углеводородов. Наши данные могут быть полезны в контексте биоремедиации, для интерпретации и прогнозирования деструкции углеводородов этими штаммами.
Дальнейшие исследования особенностей биодеградации углеводородов проводили с четырьмя штаммами, наиболее активными в отношении утилизации нефти, исключив из экспериментов P. extremaustralis WS-1.
Потребление индивидуальных н-алканов модельной смеси № 1. Сложность и непостоянство химической структуры нефтяных смесей может маскировать изменения входящих в их состав углеводородов под влиянием УОБ. Для расшифровки последовательности и особенностей биодеструкции конкретных детектируемых соединений использовали модельные смеси углеводородов разной степени сложности.
В табл. 2 представлены результаты биодеградации смеси № 1 после 48 ч инкубации с УОБ. Степень деструкции н-алканов состава С10–С17, С21 выше 90% была зафиксирована для A. seifertii WS-1 и н-алканов С10–С17, С21–С27 – для D. maris 367-2. Вероятно, аналогичным образом окислялись и С18–С20н-алканы, отсутствовавшие в смеси № 1. Следует отметить, что штаммы G. cholesterolivorans S12 и R. qingshengii 367-6 использовали н-алканы с заметно меньшей эффективностью. Последнее, по-видимому, не свидетельствует о более низкой углеводородокисляющей активности этих штаммов, а объясняется особенностями активации их ферментных систем в присутствии углеводородов после культивирования на богатой среде LB. В других экспериментах, где в качестве инокулята служила биомасса УОБ со среды с углеводородами, углеводородокисляющая активность всех штаммов существенно не различалась. Кроме того, из сравнения данных экспериментов с использованием нефти и смеси № 1 можно заключить, что на показатели биодеструкции (степень и скорость процесса) индивидуальных компонентов смеси влияет ее общий состав.
Таблица 2.
Степень деструкции (%) н-алканов модельной смеси № 1 культурами микроорганизмов
| н-Алкан | A. seifertii WS-1 | D. maris 367-2 | G. cholesterolivorans S12 | R. qingshengii 367-6 |
|---|---|---|---|---|
| С10 | 97 ± 2 | 100 | 91 ± 5 | 77 ± 5 |
| С11 | 93 ± 4 | 96 ± 4 | 65 ± 3 | 57 ± 4 |
| С12 | 95 ± 3 | 97 ± 2 | 22 ± 1 | 56 ± 3 |
| С13 | 98 ± 1 | 100 | 22 ± 1 | 81 ± 6 |
| С14 | 100 | 100 | 53 ± 2 | 83 ± 2 |
| С15 | 100 | 100 | 50 ± 4 | 81 ± 2 |
| С16 | 100 | 100 | 37 ± 2 | 75 ± 4 |
| C17 | 100 | 100 | 21 ± 1 | 43 ± 2 |
| С21 | 100 | 100 | 14 ± 1 | 49 ± 2 |
| С22 | 89 ± 5 | 100 | 2 | 42 ± 3 |
| С23 | 87 ± 4 | 100 | 0 | 45 ± 2 |
| С24 | 84 ± 2 | 100 | 0 | 46 ± 4 |
| С25 | 76 ± 5 | 92 ± 3 | 0 | 37 ± 2 |
| С26 | 59 ± 4 | 92 ± 6 | 0 | 28 ± 2 |
| С27 | 41 ± 1 | 91 ± 5 | 0 | 22 ± 1 |
| С28 | 19 ± 0 | 51 ± 5 | 0 | 19 ± 1 |
| C29 | 2 ± 1 | 31 ± 2 | 0 | 2 |
| С30 | 0 | 0 | 0 | 0 |
| C31 | 0 | 0 | 0 | 0 |
| C32 | 0 | 0 | 0 | 0 |
| C33 | 0 | 0 | 0 | 0 |
Разброс в степени биодеградации н-алканов позволил вычислить скорость окисления индивидуальных углеводородов по убыли конкретного компонента (рис. 4). Корректными считали величины, полученные при условии, что остаточное содержание детектируемого н-алкана составляло не менее 8–10%, т.е. при отсутствии дефицита по субстрату. Более других этому условию отвечали результаты, полученные для R. qingshengii 367-6 и G. cholesterolivorans S12. Для этих штаммов были вычислены скорости деструкции в широком диапазоне С10–С29н-алканов (рис. 4а). Максимальная скорость деструкции отмечена для С10–С13н‑алканов и составила 38.72–139.70 × 10–10 л сут–1. В диапазоне С14–С29н-алканов скорость деструкции резко снижалась и варьировала в пределах 0.31–22.00 × 10–10 л сут–1.
Рис. 4.
Скорость потребления н-алканов модельной смеси № 1 штаммами УОБ: а – R. qingshengii 367-6 и G. choleste-rolivorans S12; б – R. qingshengii 367-6, A. seifertii WS-1 и D. maris 367-2. Обозначения: (а) 1 – R. qingshengii 367-6, 2 – G. cholesterolivorans S12; (б) 1 – R. qingshengii 367-6, 2 – A. seifertii WS-1, 3 – D. maris 367-2.
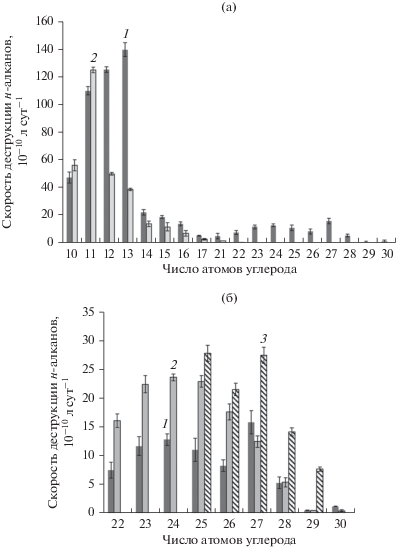
Аналогичные показатели были рассчитаны и для других культур, но для более узких интервалов длины углеродной цепи парафинов. На рис. 4б показано распределение величин скорости деструкции для R. qingshengii 367-6 в сравнении с A. seifertii WS-1 и D. maris 367-2 в диапазоне С22–С29н-алканов.
Данные показывают, что биодеградация н-алканов разного молекулярного веса происходит одновременно, при этом существенно более высокая скорость окисления отмечается в диапазоне С10–С13н-алканов. У разных штаммов УОБ наблюдается большой разброс скоростей окисления индивидуальных н-алканов. Например, в области длинноцепочечных н-алканов D. maris 367-2 лучше окисляет С23–С27н-алканы, а A. seifertii WS-1 – С23–С25н-алканы. По-видимому, подобные различия в метаболизме углеводородов определяются индивидуальными особенностями конкретных штаммов УОБ.
Углеводородокисляющая активность изучаемых штаммов УОБ в отношении мультиразветвленных алканов. Биодеструкция изо-алканов – относительно малоизученный процесс. Некоторые микроорганизмы используют изо-алканы разного молекулярного веса и степени разветвленности в качестве единственного источника углерода и энергии (Chen et al., 2017), однако большинство к этому неспособно. Судьба углеводородов в ходе биодеструкции зависит не только от биологических особенностей бактерий-деструкторов, но и от состава конкретного углеводородсодержащего субстрата. По данным (Marin et al., 1996), н-алканы ингибируют окисление изо-алканов, в то время как исследования других авторов (Solano-Serena et al., 2000) свидетельствуют об обратном. Так, показано (Rocha et al., 2011), что штамм Pseudomonas aeruginosa ATCC 55925 не использовал пристан (2,6,10,14-тетраметилпентадекан) как индивидуальное соединение или в смеси с С7–С18н-алканами, но демонстрировал такую способность, когда углеводороды были диспергированы в водной фазе с помощью биосурфактанта. В то же время пристан, как компонент топочного мазута, частично подвергался биоразрушению и без биосурфактанта.
В силу особенностей химического строения многие изо-алканы труднее поддаются биодеструкции по сравнению с нормальными парафинами, могут накапливаться в биосфере и являться остаточными загрязнителями после биоремедиации (Nocentini et al., 2000). Поэтому способность микроорганизмов разрушать сильно разветвленные алканы в составе смесей и как индивидуальные соединения представляет значительный интерес. На разнице скоростей потребления изопреноидов и насыщенных алканов основано широкое использование в органической геохимии нефти величины отношения суммарного содержания изо-С19 + изо-С20 (пристан + фитан) к суммарному содержанию н‑С17 + н-С18 (гептадекан + октадекан). Этот диагностический показатель характеризует степень биодеструкции нефти. В то же время биодеструкция изо-алканов более разветвленных или более тяжелых, чем указанные выше, исследована недостаточно. Это побудило нас к экспериментам с ГМН и скваланом, которые, в силу устойчивости к микробному воздействию, нередко используются как внутренний стандарт в хроматографическом анализе при изучении биодеградации или в качестве инертных растворителей (носителей), повышающих биодоступность целевых углеводородов.
Проведено исследование окисления ГМН в качестве единственного субстрата исследуемыми штаммами УОБ, и анализ проб, отобранных после 48 и 96 ч культивирования, продемонстрировал отсутствие его потребления микроорганизмами. Следует отметить, что и в долгосрочных экспериментах (более 12 сут культивирования) роста бактерий в среде с ГМН не было отмечено (табл. S2 ).
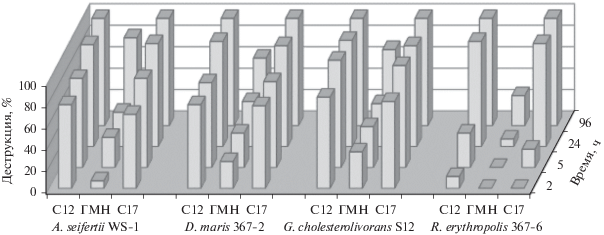
В другой серии экспериментов исследовали способность культур микроорганизмов использовать ГМН в составе композиции с н-алканами (смесь № 2), близкими по длине углеродной цепи (додекан, н-С12) или по молекулярному весу (гептадекан, н-С17). Для всех четырех штаммов скорость потребления додекана и гептадекана была высокой: содержание н-алканов снижалось практически до 0 в течение 24 ч культивирования (рис. 5). ГМН использовался бактериями медленнее, чем н-алканы, но по мере потребления последних (94–98% через 1 сут) степень его деструкции существенно возрастала: с 32 до 82% для A. seifertii WS-1, с 40 до 71% – для G. cholesterolivorans S12, с 7 до 28% – для R. erythropolis 367-6 и с 42 до 63% – для D. maris 367-2 за 4 сут. Скорости окисления ГМН бактериями A. seifertii WS-1, D. maris 367-2 и G. cholesterolivorans S12 были близки, тогда как для R. qingshengii 367-6 она была минимальной. Для исследуемых УОБ необходимым условием активации метаболизма ГМН было присутствие н-алканов.
Рис. 5.
Динамика потребления гептаметилнонана в модельной смеси углеводородов № 2. Бактерии культивировали на качалке (130 об./мин) при температуре 30°С и начальном значении рН 7.0. Обозначения: С12 – додекан, ГМН – гептаметилнонан, С17 – гептадекан.
Продолжительное культивирование со скваланом в качестве единственного субстрата сопровождалось медленным ростом УОБ и изменением реологических свойств культуральных жидкостей (табл. 2 и табл. S4 ), при этом деструкция субстрата бактериями R. qingshengii 367-6, G. cholesterоlivorans S12, D. maris 367-2 и A. seifertii WS-1 составляла, соответственно, 8, 10, 12 и 15% после 30 сут культивирования.
Результаты изучения биодеградации сквалана в составе композиции с С10–С17н-алканами (смесь № 3) представлены в табл. 3. Динамика процесса была сходной для всех исследованных УОБ; различия в основном касались скорости окисления н-алканов, которая была максимальной у A. seifertii WS-1. Окисление сквалана происходило с меньшей скоростью, но одновременно с окислением н-алканов и сильно тормозилось после полного потребления нормальных парафинов. Следует отметить, что деструкция сквалана в составе углеводородной смеси была значительно эффективнее (48–68% для разных штаммов за 6 сут), чем когда он служил единственным источником углерода и энергии (не более 15% за 30 сут). Эти результаты свидетельствуют о необходимости дальнейшего изучения процесса биодеструкции сквалана у исследованных штаммов-деструкторов, в том числе путем анализа разнообразия генов, присутствующих в геномах этих бактерий и обеспечивающих способность к деградации алканов, а также их избирательной транскрипции в зависимости от условий роста и наличия дополнительных углеводородных субстратов.
Таблица 3.
Биодеградация индивидуальных углеводородов модельной смеси № 3 исследуемыми бактериями
| Время культивирования, ч | Степень деструкции н-алканов и сквалана, % | ||||||||
|---|---|---|---|---|---|---|---|---|---|
| С10 | С11 | С12 | С13 | С14 | С15 | С16 | С17 | Сквалан | |
| A. seifertii WS-1 | |||||||||
| 24 | 100 | 86 ± 5 | 67 ± 3 | 59 ± 3 | 55 ± 2 | 55 ± 5 | 56 ± 3 | 60 ± 3 | 34 ± 2 |
| 48 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 61 ± 2 |
| 72 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 68 ± 4 |
| 144 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 68 ± 3 |
| G. cholesterolivorans S12 | |||||||||
| 24 | 100 | 100 | 88 ± 4 | 84 ± 6 | 74 ± 5 | 66 ± 3 | 71 ± 4 | 75 ± 4 | 22 ± 2 |
| 48 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 44 ± 3 |
| 72 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 47 ± 4 |
| 144 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 48 ± 2 |
| R. qingshengii 367-6 | |||||||||
| 24 | 100 | 83 ± 4 | 62 ± 2 | 66 ± 4 | 64 ± 2 | 60 ± 3 | 85 ± 4 | 67 ± 2 | 26 ± 2 |
| 48 | 100 | 100 | 94 ± 5 | 92 ± 6 | 92 ± 4 | 87 ± 4 | 99 ± 1 | 99 ± 1 | 55 ± 4 |
| 72 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 57 ± 2 |
| 144 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 58 ± 3 |
| D. maris 367-2 | |||||||||
| 24 | 100 | 78 ± 3 | 32 ± 3 | 5 ± 1 | 0 | 0 | 0 | 0 | 0 |
| 48 | 100 | 100 | 84 ± 3 | 68 ± 3 | 55 ± 1 | 51 ± 2 | 44 ± 2 | 52 ± 3 | 47 ± 1 |
| 72 | 100 | 100 | 100 | 94 ± 5 | 94 ± 3 | 92 ± 3 | 95 ± 4 | 96 ± 2 | 49 ± 2 |
| 144 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 100 | 51 ± 4 |
Полученные данные свидетельствуют о том, что известные таксоны родового уровня, Acinetobacter, Pseudomonas, Rhodococcus, Gordonia и Dietzia, к которым принадлежат исследованные штаммы, могут быть источником новых эффективных нефтедеструкторов и продуцентов биосурфактантов. По совокупности характеристик: способности к деградации широкого спектра нормальных и изо-алканов, высокому адаптивному потенциалу к факторам внешней среды, способности образовывать био-ПАВ, – бактерии A. seifertii WS-1, P. extremaustralis WS-1, R. qingshengii 367-6, G. cholesterоlivorans S12, D. maris 367-2 могут рассматриваться как перспективные кандидаты для очистки загрязненных нефтью и нефтепродуктами почвенных и водных объектов. Изученные штаммы пригодны для использования в условиях умеренных и пониженных (6–10°С) температур, при содержании NaCl в среде до 4% и рН в диапазоне 5.0–9.0. Окончательный вывод об эффективности, целесообразности и безопасности их практического применения в целях биоремедиации можно будет сделать на основании результатов дополнительных исследований. В этой связи следует изучить влияние сурфактантной активности штаммов на десорбцию нефти из почвы. Также представляет интерес интенсификация процесса окисления углеводородов путем создания микробных ассоциаций на основе исследованных культур УОБ и посредством иммобилизации живых клеток-деструкторов на органических носителях. Кроме того, необходимо исключить наличие среди штаммов-деструкторов патогенных и условно патогенных представителей, поскольку последние имеют ограниченное практическое использование.
Список литературы
Иванова А.Е., Соколова Д.Ш., Канатьева А.Ю. Биодеградация углеводородов и образование поверхностно-активных соединений ацидофильными микобактериями // Микробиология. 2016. Т. 85. С. 300–308.
Ivanova A.E., Sokolova D.Sh., Kanat’eva A.Yu. Hydrocarbon biodegradation and surfactant production by acidophilic mycobacteria // Microbiology (Moscow). 2016. V. 85. P. 317–324.
Иванова А.Е., Борзенков И.А. Аэробная биодеградация компонентов сырой нефти ацидофильными микобактериями // Микробиология. 2018. Т. 87. С. 344–355.
Ivanova A.E., Borzenkov I.A. Aerobic biodegradation of crude oil components by acidophilic mycobacteria // Microbiology (Moscow). 2018. V. 87. P. 453–462.
Berekaa M.M., Steinbüchel A. Microbial degradation of the multiply branched alkane 2,6,10,15,19,23-hexamethyltetracosane (squalane) by Mycobacterium fortuitum and Mycobacterium ratisbonense // Appl. Environ. Microbiol. 2000. V. 66. P. 4462–4467.
Binazadeh M., Karimi I.A., Li Z. Fast biodegradation of long chain n-alkanes and crude oil at high concentrations with Rhodococcus sp. Moj-3449 // Enzyme Microb. Technol. 2009. V. 45. P. 195–202.
Bogan B.W., Sullivan W.R., Kayser K.J., Derr K.D., Aldrich H.C., Paterek J.R. Alkanindiges illinoisensis gen. nov., sp. nov., an obligately hydrocarbonoclastic, aerobic squalane-degrading bacterium isolated from oilfield soils // Int. J. Syst. Evol. Microbiol. 2003. V. 53. P. 1389–1395.
Cooper D.G., Goldenberg D.G. Surface-active agents from two Bacillus species // Appl. Environ. Microbiol. 1987. V. 50. P. 520–529.
Chen W., Li J., Sun X., Min J., Hu X. High efficiency degradation of alkanes and crude oil by a salt-tolerant bacterium Dietzia species CN-3 // Int. Biodeter. Biodegr. 2017. V. 118. P. 110–118.
Desai J.D., Banat I.M. Microbial production of surfactants and their commercial potential // Microbiol. Mol. Biol. Rev. 1997. V. 61. P. 47–64.
Francy D.S., Thomas J.M., Raymond R.L., Ward C.H. Emulsification of hydrocarbons by subsurface bacteria // J. Ind. Microbiol. 1991. V. 8. P. 237–245.
Guo C., Dang Y., Wong Y., Tam N.F. Biodegradation ability and dioxygenase genes of PAN-degrading Sphingomonas and Mycobacterium strains isolated from mangrove sediments // Int. Biodeter. Biodegr. 2010. V. 64. P. 419–426.
Kumar A., Bisht B.S., Joshi V.D., Dhewa T. Review on bioremediation of polluted environment: a management tool // Int. J. Environ. Sci. 2011. V. 1. P. 1079–1093.
Lal B., Khanna S. Degradation of crude oil by Acinetobacter calcoaceticus and Alkaligenes odorans // J. Appl. Bacteriol. 1996. V. 81. P. 355–362.
Morikawa M., Daido H., Takao T., Murata S., Shimonishi Y., Imanaka T. A new lipopeptide biosurfactant produced by Arthrobacter sp. strain MIS38 // J. Bacteriol. 1993. V. 175. P. 6459–6466.
Nocentini M., Pineli D., Fava F. Bioremediation of a soil contaminated with hydrocarbon mixtures: the residual concentration problem // Chemosphere. 2000. V. 41. P. 1115–1123.
Pfennig N., Lippert K.D. Uber das vitamin B12 – Bedurfnis phototropher Schweferelbakterien // Arch. Microbiol. 1966. V. 55. P. 245–256.
Rayu S., Karpouzas D.G., Singh B.K. Emerging technologies in bioremediation: constraints and opportunities // Biodegradation. 2012. V. 23. P. 917–926.
Rocha C.A., Pedregosa A.M., Laborda F. Biosurfactant-mediated biodegradation of straight and methyl-branched alkanes by Pseudomonas aeruginosa ATCC 55925 // AMB Express. 2011. V. 1. Art. 9. https://doi.org/10.1186/2191-085-1-9
Solano-Serena F., Marchal R., Casaregola S., Vasnier C., Lebeault J.-M., Vandecasteele J.-P. Mycobacterium strain with extended capacities for degradation of gasoline hydrocarbons // Appl. Environ. Microbiol. 2000. V. 66. P. 2392–2399.
Sutcliff I.C. Cell envelope composition and organization in the genus Rhodococcus // Antonie van Leeuwenhoek. 1998. V. 74. P. 49–58.
Wang X.-B., Chi C.-Q., Nie Y., Tang Y.-Q., Tan Y., Wu G., Wu X.-L. Degradation of petroleum hydrocarbons (C6–C40) and crude oil by a novel Dietzia strain // Bioresour. Technol. 2011. V. 102. P. 7755–7761.
Xu X., Liu W., Tian S., Wang W., Qi Q., Liang P., Gao X., Li F., Li H., Yu H. Petroleum hydrocarbon-degrading bacteria for the remediation of oil pollution under aerobic conditions: a perspective analysis // Front. Microbiol. V. 9. Art. 2885. https://doi.org/10.3389/fmicb.2018.02885
Zhang Z.Z., Hou Z.W., Yang C.Y., Ma C.Q., Tao F., Xu P. Degradation of n-alkanes and polycyclic aromatic hydrocarbons in petroleum by newly isolated Pseudomonas aeruginosa DQ8 // Bioresour. Technol. 2011. V. 102. P. 4111–4116.
Дополнительные материалы
- скачать ESM.docx
- Рис. S1. - Рис. S3.
Таблица S1. - Таблица S5.
Инструменты
Микробиология


