Микробиология, 2021, T. 90, № 4, стр. 443-458
Делимитация видов и анализ криптического разнообразия микроводорослей клады Parachlorella (Chlorophyta)
Е. С. Кривина a, *, А. Д. Темралеева a, Ю. С. Букин b
a ФИЦ “Пущинский научный центр биологических исследований Российской академии наук”
142290 Пущино, Россия
b Лимнологический институт Сибирского отделения Российской академии наук
664003 Иркутск, Россия
* E-mail: pepelisa@yandex.ru
Поступила в редакцию 27.01.2021
После доработки 17.03.2021
Принята к публикации 22.03.2021
Аннотация
В статье рассматривается система зеленых микроводорослей клады Parachlorella, построенная на основании морфологических, экологических и молекулярно-генетических данных. Обсуждаются диагностические признаки выделенных родов и видов, а также систематическое положение некоторых таксонов. Молекулярно-филогенетический анализ клады Parachlorella показал, что, несмотря на относительную простоту морфологии, для нее характерно высокое криптическое разнообразие. Показана полифилетичность рода Dictyosphaerium, а также ряда видов: D. libertatis, D. ehrenbergianum, Compactochlorella kochii, Mucidosphaerium pulchellum, M. palustre, Closteriopsis acicularis. Использование интрона в качестве критерия разделения близкородственных видов эффективно для представителей групп II, IV, VII, VIII, а также для штаммов видов Compactochlorella kochii и D. libertatis. Применение классического СВС-подхода, основанного на поиске СВС в консервативных регионах ITS2, было успешным только для группы II. Результаты анализа генетических дистанций и алгоритмов делимитации видов GMYC, PTP, ABGD не являются универсальными инструментами для обнаружения видовых границ и нуждаются в подтверждении другими признаками, такими как форма клеток, способность формировать колонии, способ крепления клеток к гиалиновым тяжам, тип хлоропласта, количество пиреноидов, присутствие слизи, наличие интронов, уровень генетических различий, наличие СВС в ITS1 и ITS2, среда обитания. Благодаря совместному использованию морфологических, экологических и генетических характеристик, удалось охарактеризовать 11 групп и 2 филогенетические линии в рамках клады Parachlorella и выдвинуть предположения о разделении родов и видов внутри выделенных групп.
Клада Parachlorella, сестринская кладе Chlorella, была выделена Krienitz и соавт. в 2004 г., когда, исходя из различий в нуклеотидных последовательностях гена 18S рРНК и внутреннего транскрибируемого спейсера ITS2, С. kessleri была перенесена в отдельный род Parachlorella. Впоследствии это разделение было подтверждено Yamamoto и соавт. (2005) на основании биохимических и ультраструктурных исследований синтеза клеточных стенок автоспор. Кроме микроводорослей с одиночными шаровидными и овальными клетками к Parachlorella-кладе также принадлежат организмы с удлиненными или игловидными клетками – Dicloster и Closteriopsis, а также колониальные роды, традиционно определяемыекак Dictyosphaerium Nägeli (Krienitz et al., 2004; Luo et al., 2010; Bock et al., 2010; Krienitz et al., 2010; Škaloud et al., 2014; Song et al., 2018b). В настоящее время в составе клады Parachlorella описано 12 родов: Closteriopsis (Lemmermann, 1899), Compactochlorella (Krienitz et al., 2012), Coronacoccus (Song et al., 2018b), Dicloster (Jao, 1975), Dictyosphaerium (Nägeli, 1849), Kalenjinia (Krienitz et al., 2012), Marasphaerium (Krienitz et al., 2012), Marinichlorella (Aslam et al., 2007), Masaia (Krienitz et al., 2012), Mucidosphaerium (Bock et al., 2011b), Parachlorella (Krienitz et al., 2004), Planktochlorella (Škaloud et al., 2014). Представители клады являются свободноживущими организмами, большинство из которых входят в состав планктона пресных и морских вод, и лишь некоторые встречаются в почвах.
Цель данной работы заключалась в комплексном исследовании морфологии, экологии и филогении представителей клады Parachlorella, включая штаммы Альгологической коллекции ACSSI, для разграничения близкородственных таксонов на уровне вида и рода. Впервые для всех описанных представителей клады (за исключением Marinichlorella, для которой внутренние транскрибируемые спейсеры не секвенированы) были обобщены морфологические и экологические характеристики, проанализированы результаты филогенетического анализа фрагмента 18S–ITS1–5.8S–ITS2, включая наличие интронов и их характеристики, значения генетических дистанций, оценены различия во вторичных структурах ITS1 и ITS2, в том числе присутствие компенсаторных замен (CBC), и определены видовые границы с помощью методов GMYC, PTP и ABGD. На основании проведенного анализа были выдвинуты предположения о критериях разделения родов и видов внутри данной клады.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Объектами данного исследования стали штаммы зеленых микроводорослей коллекции ACSSI, являющиеся субкультурами Коллекции микроводорослей и цианобактерий IPPAS: Parachlorella kessleri ACSSI 334 (=IPPAS C-9), P. kessleri ACSSI 336 (=IPPAS C-62) и P. kessleri ACSSI 337 (=IPPAS C-100) (рис. ESM_1).
Культивирование штаммов ACSSI 334, ACSSI 336, ACSSI 337 проводили на твердой среде BG-11 (Гайсина и соавт., 2008).
Микроскопия, выделение, амплификация, очистка и секвенирование ДНК проводились по стандартным протоколам, описанным ранее (Кривина, Темралеева, 2020). Праймеры для ПЦР генов 18S, 5.8S рРНК, спейсеров ITS1, ITS2 и условия амплификации приведены в табл. ESM_2.
Молекулярно-филогенетический анализ. Для анализа филогении и уточнения таксономического положения штаммов ACSSI 334, ACSSI 336, ACSSI 337 был осуществлен поиск гомологии нуклеотидных последовательностей 18S–ITS1–5.8S–ITS2 по алгоритму BLASTn в GenBank (https://blast.ncbi.nlm.nih.gov). Отбор последовательностей осуществляли исходя из критериев максимального родства (сходство ≥95%), качества прочтения, длины прочтения (не менее 2300 п.н.) и принадлежности к типовым видам и аутентичным штаммам. В состав выборки для филогенетического анализа вошли 117 штаммов (табл. ESM_3). Названия таксонов приведены согласно Международной электронной базе данных AlgaeBase (Guiry, Guiry, 2021). При наличии интронов в гене 18S рРНК они удалялись до выравнивания, информация о них указана на рис. 1. Филогенетический анализ клады Parachlorella производили по стандартным протоколам (Temraleeva et al., 2018). В качестве внешней группы при филогенетических реконструкциях выбрали представителей сестринской клады Chlorella (класс Trebouxiophyceae, Chlorophyta) – Chlorella vulgaris и Hindakia tetrachotoma. Генетические различия между нуклеотидными последовательностями охарактеризовали с помощью генетических дистанций, вычисление которых проводили в программе MEGA 6.0. Боксплот генетических дистанций построен в среде статистического программирования R 3.4.4 (https://www.R-project.org/). Для сравнения топологии деревьев использовали данные статей Bock и соавт. (2011a, 2011b), Krienitz и соавт. (2004, 2010, 2012), Škaloud и соавт. (2014), Song и соавт. (2018a, 2018b).
Рис. 1.
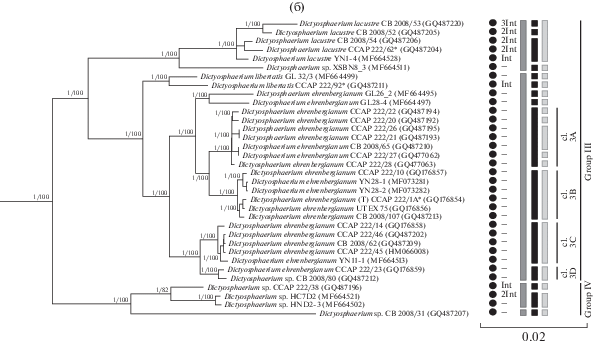
(a) – Укорененное филогенетическое дерево клады Parachlorella, построенное методом Байеса (BI), на основе последовательностей генов 18S и 5.8S рРНК и спейсеров ITS1 и ITS2 (2644 п.н.). В качестве статистической поддержки узлов дерева указаны апостериорные вероятности (PP) и бутстреп-значения (BP) соответственно; значения <0.7 для BI и <70% для ML не показаны. Модель нуклеотидных замен: GTR + I + G. (б) – Фрагмент укорененного филогенетического дерева зеленых микроводорослей клады Parachlorella (группа III и IV). Обозначения: жирным шрифтом выделены штаммы ACSSI, исследуемые в рамках данной работы, * – аутентичные штаммы; (T) – типовой вид, белый круг – Chlorella-подобный морфотип, черный круг – Dictyosphaerium-подобный морфотип, белый квадрат – Scenedesmus-подобный морфотип, черный квадрат – Actinastrum-подобный морфотип, Int – наличие интронов, рядом указано количество интронов; “–” – нет интрона. Серый прямоугольник – кластеризация ABGD, черный прямоугольник – кластеризация GMYC, светло-серый прямоугольник – кластеризация PTP.
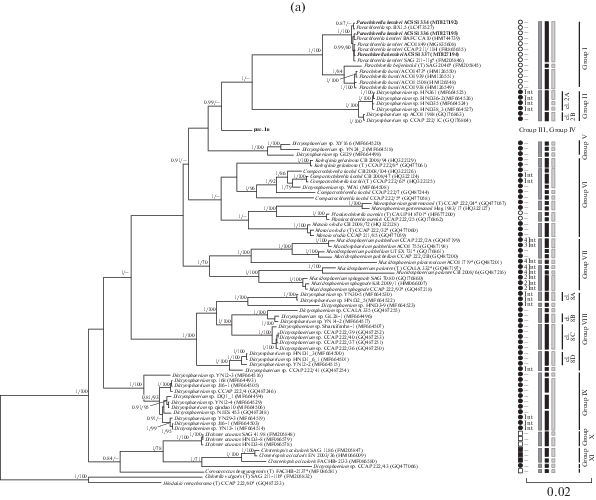
Рис. 1.
Окончание
Фолдинг вторичной структуры ITS1 проводили с помощью веб-сервера RNAfold web server (http:// rna.tbi.univie.ac.at//cgi-bin/RNAWebSuite/RNAfold.cgi) в соответствии с принципом минимальной энергии. При оценке правильности фолдинга ITS1 ориентировались на работу А. Coleman (2015). Для анализа вторичной структуры ITS2 была выполнена аннотация спейсера в ITS2-DataBase (http://its2.bioapps.biozentrum.uni-wuerzburg.de) и фолдинг также с помощью веб-сервера RNAfold web server по принципу минимальной энергии. Правильность фолдинга ITS2 оценивали, ориентируясь на работу Caisová и соавт. (2013). Сравнение вторичной структуры ITS1 и ITS2 между штаммами, поиск консервативных мотивов и компенсаторных замен (CBC) осуществляли в программе 4SALE. При анализе вторичных структур ITS2 для разделения видов особое внимание уделено подходу А. Coleman (2000, 2009), согласно которому наличие даже одной CBC в консервативных регионах ITS2 (5 п.н. I шпильки, 10 п.н. II шпильки, вся III шпилька) у двух микроводорослей коррелирует с их половой несовместимостью. Вторичные структуры спейсеров визуализированы в программе PseudoViewer3.
Делимитация видов. Реконструированное методом максимального правдоподобия (ML) филогенетическое дерево было использовано для делимитации видов с помощью алгоритма “Poisson tree processes” (PTP) на онлайн-сервере https:// species.h-its.org/. Для делимитации видов в массиве данных применяли метод автоматического поиска межвидового пробела/разрыва (gap) в генетических дистанциях (automatic barcode gap discovery – ABGD) (Puillandre et al., 2012) на онлайн сервере https://bioinfo.mnhn.fr/abi/public/abgd/. Для анализа ABGD использовалась матрица генетических дистанций, рассчитанная в программе IQ-TREE. Третьим методом была обобщенная смешанная модель Юла с учетом целостности видов (general mixed Yule coalescent model, GMYC) (Fujisawa, Barraclough, 2013), реализованная в пакете “splits” для языка программирования R. Для GMYC анализа использовалось ультраметрическое дерево, реконструированное в программе BEAST.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Анализ показал, что лучшей моделью эволюции ДНК для исследуемого набора комплексных нуклеотидных последовательностей (18S–ITS1–5.8S–ITS2) является GTR с инвариантной и гамма коррекцией (GTR + I + G) (AIC = 36 846.9), эта модель использовалась для всех дальнейших расчетов. Результаты “path sampling” анализа показали, что наилучшей моделью для реконструкции филогенетического дерева является модель видообразования рождения–гибели видов с расслабленными молекулярными часами со скоростями эволюции, распределенными по логнормальному распределению (наименьшее значение показателя маргинального правдоподобия Ln(L) = –18 996.049). Эта модель видообразования использовалась для расчетов в программе BEAST.
Клада Parachlorella включает 11 групп и 2 самостоятельные филогенетические линии с высокими статистическими поддержками (апостериорные вероятности (PP) – 0.81–1.00, бутстреп-поддержки ML (BP) – 70–100%). Все представители данной клады характеризовались коккоидной организацией таллома. В рамках клады выделено 4 морфотипа: Chlorella-подобный (группа I), Dictyosphaerium-подобный (группы II–IX), Scenedesmus-подобный (группа X, р. Coronacoccus), Actinastrum-подобный (группа XI). Хлоропласт пристенный. Пиреноид с фрагментированной крахмальной обверткой, как правило, один, кроме представителей рода Dicloster, у которых количество пиреноидов может варьировать до 5 или отсутствует (табл. 1). Размножение бесполое – автоспорами. Рассмотренные представители являются свободноживущими организмами; большинство из них – обитатели пресноводных водоемов, и лишь некоторые встречаются в почвах (Krienitz et al., 2004, 2012; Bock et al., 2010, 2011a, 2011b; Škaloud et al., 2014; Song et al., 2018a, 2018b). Длина ITS1 у членов Parachlorella-клады варьировала от 230 до 335 н., длина ITS2 – от 241 до 273 н. Вторичные структуры ITS1 и ITS2 в целом соответствовали моделям, предложенным Coleman (2003, 2009, 2015) для эукариотических организмов.
Таблица 1.
Основные морфологические характеристики представителей клады Parachlorella
| Группа | Кластер/линия | A* | B | C | D | Ey | Ead | F | G |
|---|---|---|---|---|---|---|---|---|---|
| I | Parachlorella kessleri | 2 | 1 | – | 1 | 2, 3 | 1, 2 | 3, 6 | 1 |
| P. beijerinckii | 2 | 1 | – | 2 | 2, 3 | 1, 2 | 2, 4 | 1 | |
| P. hussii | 2 | 1 | – | 1 | 2, 3 | 1, 2 | 1 | 1 | |
| II | Dictyosphaerium sp. кластеры 2A, 2B | 1 | 6 | 1 | 1 | 2, 3 | 1, 2 | 1 | 1 |
| III | D. lacustre | 1 | 6 | 2 | 1 | 3, 6 | 1, 3 | 1, 2 | 1 |
| Dictyosphaerium sp. XSBN8_3 | 1 | 6 | 2 | 1 | 2, 3 | 2, 3 | 1, 2 | 1 | |
| D. libertatis | 1 | 6 | 2 | 1 | 3, 4 | 3 | 1, 2 | 1 | |
| D. ehrenbergianum | 1 | 6 | 2 | 1 | 3 | 3 | 1, 2 | 1 | |
| IV | Dictyosphaerium sp. CCAP 222/38, HC7D2, HND2-3, CB 2008/31 | 1 | 6 | 2 | 1 | 3 | 3 | 1, 2 | 1 |
| V | Dictyosphaerium sp. XY16-6, YN24_2 | 1 | 6 | 2 | 1 | 3 | 3 | 1, 2 | 1 |
| Dictyosphaerium sp. Gl29 | 1 | 6 | 1 | 1 | 3 | 3 | 1, 2 | 1 | |
| VI | Kalenjinia gelatinosa | 1 | 2 | 2 | 1 | 1, 3, 4, 5 | 1, 3, 4, 5 | 1 | 1 |
| Compactochlorella kochii | 1 | 2 | 1 | 1 | 1, 3, 4 | 1, 3, 4 | 1 | 1 | |
| Dictyosphaerium sp. WfA1 | 1 | 2 | 1 | 1 | 1, 3, 4 | 1, 3, 4 | 1 | 1 | |
| C. dohrmannii | 1 | 2 | 1 | 1 | 1, 3, 4 | 1, 3, 4 | 1 | 1 | |
| Marasphaerium gattermannii | 1 | 2 | 1 | 1 | 1, 2 | 1, 2 | 1 | 1 | |
| Planktochlorella nurekis | 2 | 1 | – | 2 | 1, 2 | 1 | 1 | 1 | |
| Masaia oloidia | 1 | 3 | 2 | 1 | 1, 3, 4 | 1, 3, 4 | 1 | 1 | |
| VII | Mucidosphaerium pulchellum | 1 | 6 | 1 | 1 | 3, 4 | 1, 3 | 1, 2 | 1 |
| M. planctonicum | 1 | 6 | 1 | 1 | 2, 3 | 1 | 1, 7 | 1 | |
| M. spagnale | 1 | 5 | 1 | 1 | 3, 7 | 1, 2 | 1, 7 | 1 | |
| M. palustre | 1 | 6 | 1 | 1 | 3 | 1 | 1, 7 | 1 | |
| VIII | Dictyosphaerium sp. кластеры 8A−8D, штаммы HND3-9, CCALA 335, CCAP 222/41 | 1 | 5 | 2 | 1 | 2, 3 | 2, 3 | 1 | 1 |
| IX | Dictyosphaerium sp. YN12-3, I68, JI8-2, CCAP 222/4, DQ1_1, YN12-4, qingdao10, NIES 453, YN29-3, JI6-1, YN12-1 | 1 | 6 | 2 | 1 | 1, 3 | 1, 3 | 1 | 1 |
| X | Dicloster acutus | 3 | 2 | – | 2 | 7 | 7 | 8 | 0, 1, 2, 3 |
| XI | Closteriopsis acicularis | 1, 2 | 4 | – | 1 | 8 | 8 | 5 | 0, 1, 2 |
| Dictyosphaerium sp. CCAP 222/43 | 1 | – | 1 | 1 | 1, 3 | 1, 3 | 1 | 1 | |
| Coronacoccus hengyangensis | 1 | 3 | – | 1 | 1, 2, 3, 4, 9 | 1, 2, 3, 4, 9 | 1 | 1 |
* A – Форма: 1 – колонии; 2 – одиночные клетки; 3 – ценобий. B – количество клеток: 1 – 1; 2 – до 4; 3 – до 8; 4 – до 16; 5 – до 32; 6 – до 64. С – крепление клеток к гиалиновым тяжам: 0 – нет тяжей; 1 – узкой стороной; 2 – широкой стороной. D – слизь: 1 – есть; 2 – нет. E – форма клеток: Ey – форма молодых клеток, Ead – форма взрослых клеток: 1 – шаровидная; 2 – широкоовальная; 3 – овальная; 4 – яйцевидная; 5 – каплевидная; 6 – почковидная, 7 – изогнутая с заостренными концами; 8 – веретеновидная; 9 – четырехгранная. F – тип хлоропласта: 1 – чашевидный; 2 – блюдцевидный; 3 – мантиевидный; 4 – корытовидный; 5 – желобовидный; 6 – шаровидный; 7 – поясковидный; 8 – пристенный. G – количество пиреноидов: 0 – нет пиреноида; 1 – 1; 2 –2; 3 – от 3 до 5. Прочерк означает отсутствие информации.
Метод делимитации видов ABGD в составе клады Parachlorella выделил 24 кластера видового уровня, не считая внешнюю группу. Дистанция разделения видов составила 0.0164. С помощью метода GMYC выделено 57 кластеров видового уровня (дистанция разделения видов 0.00343). Статистическая поддержка результатов делимитации P = 6.979972e-13 < 0.05, следовательно, в массиве достаточно данных для получения достоверных результатов делимитации. С помощью метода PTP выделено 55 видов, что близко к результатам делимитации GMYC. Результаты делимитации видов методами ABGD, GMYС и PTP приведены на филогенетическом дереве (рис. 1a, 1б). Все кластеры видового уровня, выделенные методами делимитации, имеют высокие статистические поддержки (PP – 0.95–1.00, BP – 90–100%). По сравнению с другими методами ABGD выделил в кладе Parachlorella наименьшее количество видов при наибольшей дистанции их разделения. Количество выделенных кластеров разными методами делимитации видов ABGD, GMYC и PTP согласуется с работами Zou и соавт. (2016a, 2016b) и Zhu и соавт. (2017), в которых ABGD также разделял массив данных на меньшее количество предполагаемых видов, чем GMYC и PTP. Это связано с тем, что в качестве исходных данных метод ABGD использует матрицу генетических дистанций и поэтому является менее чувствительным (“грубым”) методом для разделения видов. Алгоритмы GMYC и PTP в качестве исходных данных используют филогенетические деревья, которые обычно строятся совершенными дискретными методами филогенетического анализа (ML или BI). Поэтому методы GMYC и PTP могут идентифицировать более “тонкие” генетические различия между штаммами в исследуемом наборе данных и выделяют бóльшее количество предполагаемых видов.
Далее мы приводим отличительные морфологические, молекулярно-генетические и экологические характеристики каждой из групп. Отметим, что, исходя из работ Škaloud и соавт. (2014) и Song и соавт. (2018b), изначально пороги внутривидовых, межвидовых и межродовых дистанций были установлены на основании представителей родов Parachlorella, Kalenjinia, Planktochlorella, Masaia, монофилетичность которых не вызывала сомнений. Минимальная внутривидовая генетическая дистанция (на базе штаммов вида P. hussii) – 0%, минимальная межвидовая дистанция (на основе различий между P. hussii и P. beijerinckii) – 0.4%, межродовая (между родами Kalenjinia и Masaia) – 1.2%. Далее нами был проведен комплексный анализ остальных видов и родов, который позволил уточнить границы генетических различий (см. ниже).
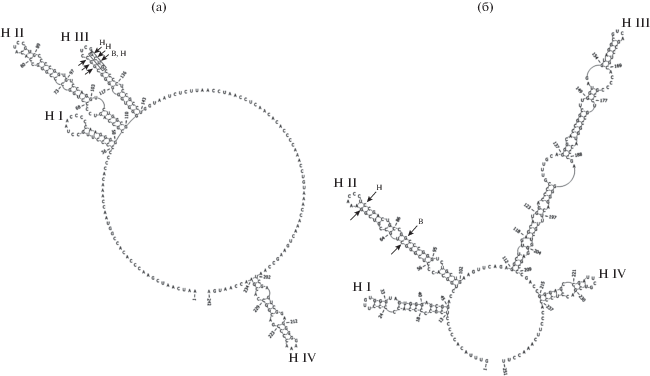
Группа I объединяет представителей рода Parachlorella, которые имеют Chlorella-подобный морфотип (табл. 1). Они широко распространены в водной, почвенной и наземно-воздушной средах (Krienitz et al., 2004; Bock et al., 2011a; Song et al., 2018b). В состав группы входят три самостоятельных вида: типовой вид рода P. beijerinckii, P. kessleri, P. hussii. Отличительными морфологическими признаками являются тип хлоропласта и слизистой оболочки. Уровень генетических различий между видами варьирует от 0.4 до 0.8% (ESM_4). Последовательности ITS1 и ITS2 для трех штаммов P. kessleri ACSSI 334, 336 и 337 были идентичны, различия с аутентичным штаммом SAG 211-11g также отсутствовали. Анализ вторичной структуры ITS1 представителей данных видов выявил мотив, расположенный сразу после вершины III шпильки c 3'-стороны, который можно рассматривать как молекулярную подпись: для P. kessleri – мотив GCUG, для P. beijerinckii – AGCC, для P. hussii – GAAA (рис. 2а). Между видами P. beijerinckii и P. hussii CBC не обнаружено. P. kessleri отличается от других видов на 1 СВС в III шпильке ITS2 от двух других видов и на 2 дополнительных СВС в этой же шпильке от P. hussii (табл. ESM_5). СВС между видами в консервативных регионах ITS2 отсутствовали (рис. 2б). В неконсервативных регионах каждый из видов P. beijerinckii и P. hussii по сравнению c другими видами группы имели по 1 CBС (табл. ESM_6). Анализы GMYC и PTP, в отличие от метода ABGD, подтвердили видовой статус всех 3 видов. Таким образом, разделение видов внутри рода Parachlorella подтверждается морфологическими отличиями (тип хлоропласта, слизь), величиной генетических дистанций (0.4–0.8%), наличием молекулярных подписей и СВС во вторичной структуре ITS1 и ITS2, результатами делимитации видов методом GMYC и PTP.
Рис. 2.
Вторичная структура ITS1 (а) и ITS2 (б) штаммов Parachlorella kessleri ACSSI 334, ACSSI 336, ACSSI 337. Стрелками показаны СВС, B – P. beijerinckii, H – P. hussii. Черный прямоугольник – молекулярная подпись.
Группа II является близкородственной группе I; в нее вошли штаммы микроводорослей с Dictyo-sphaerium-подобным морфотипом. Колонии состоят из 16–64 клеток, которые крепятся к гиалиновым тяжам узкой стороной (табл. 1). Все представители – обитатели пресноводных водоемов (Song et al., 2018b). Группа включает 2 кластера (рис. 1а). Члены кластера 2A, в отличие от кластера 2B, в составе гена 18S рРНК имеют интрон длиной 457 н. Генетические дистанции внутри вышеописанных кластеров были менее 0.1%, между ними – 0.4% (межвидовой уровень), с представителями сестринской группы I – 3.4%–3.7% (межродовой уровень) (табл. ESM_7). У штаммов кластеров 2A и 2B была обнаружена 1 СВС в ITS1 и 1 CBC в консервативном регионе ITS2 (табл. ESM_8, ESM_9). Метод ABGD объединяет оба кластера в один вид, метод GMYC, напротив, разделяет их на 2 самостоятельных вида. Метод PTP подтверждает самостоятельный видовой статус кластера 2B и дополнительно разделяет кластер 2A на 3 вида, но последнее не подтверждается другими признаками.
Обобщая все изученные характеристики, мы предполагаем, что кластеры 2A и 2B являются криптическими видами со сходной морфологией, но отличающиеся присутствием интрона в составе гена 18S рРНК у штаммов кластера 2A; наличием 1 CBC в ITS1 и 1 CBC в консервативном регионе ITS2. Генетические дистанции между кластерами соответствовали межвидовому уровню (0.4%), разделение кластеров также было подтверждено двумя методами делимитации видов – GMYC и PTP. Оба вида не вошли в группу “истинных” Dictyosphaerium, включающую аутентичный штамм типового вида D. ehrenbergianum CCAP 222/1A (группа III), т.е. являются членами нового неописанного рода с Dictyosphaerium-подобной морфологией.
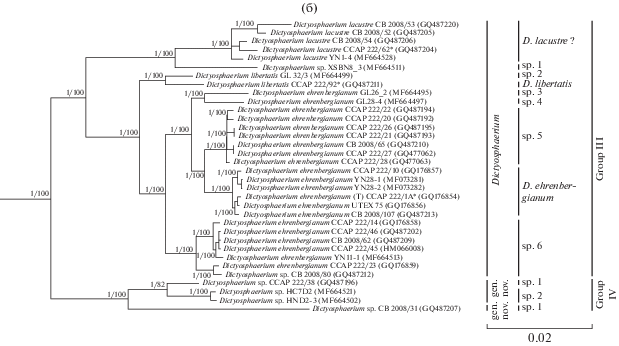
Группа III объединяет штаммы, кластеризующиеся с D. ehrenbergianum – типовым видом рода Dictyosphaerium – и являющиеся, вероятно, его “истинными” представителями (рис. 1б). В колониях обычно от 4 до 32 клеток, реже – до 64, которые, в отличие от группы II, крепятся к гиалиновым тяжам широкой стороной (табл. 1). Форма молодых клеток варьирует в зависимости от видовой принадлежности. Взрослые клетки преимущественно овальные. Все представители – обитатели пресноводных водоемов (Bock et al., 2011b). В состав группы входят 30 штаммов, которые образуют несколько кластеров:
1) отличительной чертой D. lacustre является почковидная форма молодых и шаровидная форма зрелых клеток (Bock et al., 2011b). Штаммы имели разное количество интронов в составе гена 18S рРНК: у штамма CB 2008/53 – 3 интрона (356 н., 465 н., 503 н.), у CB 2008/52, CB 2008/54 и аутентичного штамма CCAP 222/62 – 2 интрона (467 н., 503 н.), у штамма YN 1-4 – 1 интрон (501 н.). Генетические различия между CCAP 222/62, CB 2008/54 и YN 1-4 соответствовали внутривидовому уровню (≤0.3%), в остальных случаях – межвидовому (≥0.4%) (табл. ESM_10). СВС между указанными штаммами в ITS1 и в ITS2 не были обнаружены (табл. ESM_11, ESM_12). Алгоритмы ABGD и PTP объединили штаммы D. lacustre в один вид. Согласно результатам GMYC они относятся к 3 разным видам: 1) штамм CB 2008/53; 2) штамм CB 2008/52; 3) аутентичный штамм CCAP 222/62, штаммы CB 2008/54, YN1-4. Это согласуются со значением генетических дистанций (0.4–0.9%), однако не подтверждается результатами анализа интронов, поиска СВС и методами ABGD и PTP. Поэтому для уточнения таксономического статуса и точного разграничения криптических видов, штаммы D. lacustre нуждаются в дополнительном изучении;
2) отдельную филогенетическую линию образует штамм Dictyosphaerium sp. XSBN8_3, имеющий типичную для представителей группы III морфологию (Song et al., 2018b). Генетические дистанции между штаммом XSBN8_3 и сестринским кластером D. lacustre колебались от 1 до 1.6% (межвидовой уровень) (табл. ESM_10). Также у штамма XSBN8_3 по сравнению с D. lacustre обнаружено 2 СВС в ITS1 (табл. ESM_11, ESM_12). Методы делимитации видов GMYC и PTP подтвердили его самостоятельный видовой статус. Таким образом, штамм Dictyosphaerium sp. XSBN8_3 является представителем нового вида в рамках группы “истинных” Dictyosphaerium;
3) отличительной чертой штаммов D. libertatis от других представителей группы является наличие молодых клеток яйцевидной формы (Bock et al., 2011b). В составе гена 18S рРНК у CCAP 222/92 в отличие от GL 32/3 присутствует интрон длиной 403 н. Уровень генетических различий между ними – 0.5% (межвидовой уровень) (табл. ESM_10). Между указанными штаммами найдена 1 CBC в неконсервативном регионе ITS2. От остальных представителей группы оба штамма отличались на 1 СВС в неконсервативном регионе ITS2 (табл. ESM_11, ESM_12). Методы GMYC и PTP подтвердили принадлежность этих штаммов к разным видам. Метод ABGD, напротив, объединил представителей D. libertatis и D. ehrenbergianum в один кластер. Таким образом, о том, что D. libertatis может быть разделен на 2 вида свидетельствуют наличие/отсутствие интрона (403 н.), уровень генетических различий (0.5%), 1 CBC в ITS2, результаты делимитации видов методами GMYC и PTP;
4) голотип рода Dictyosphaerium – D. ehrenbergianum. В отличие от D. libertatis и D. lacustre, диаметр колоний его представителей может достигать 80 мкм; кроме чашевидного, в клетках встречается поясковидный хлоропласт (табл. 1) (Nägeli, 1849; Bock et al., 2011b). D. ehrenbergianum является полифилетичным видом, представители которого формируют 2 филогенетические линии и 4 кластера видового уровня согласно алгоритмам делимитации GMYC (рис. 1б). Морфологические различия между ними не были обнаружены. Уровень генетических различий каждого из штаммов GL 26_2 и GL 28_4 по сравнению с остальными от 0.5% и выше (межвидовой уровень) (табл. ESM_10). Штамм GL 26_2 отличается от родственного штамма GL 28_4 на 1 СВС в ITS1 и 1 СВС в неконсервативном регионе ITS2. Метод PTP также подтверждает их видовую специфичность. Генетические дистанции внутри кластеров 3A, 3B, 3C, 3D составляла 0–0.2% (внутривидовой), между кластерами 3С и 3D – 0.3% (внутривидовой уровень), в остальных случаях – 0.5–1.1% (межвидовой). В неконсервативном регионе ITS2 у штаммов кластера 3B была найдена 1 специфическая СВС по сравнению с остальными, у штаммов кластеров 3C и 3D – 2 СВС (табл. ESM_11, ESM_12). Анализ PTP разделяет кластер 3А на 5 видов, однако это дробление ничем более не подтверждается. В остальном результаты соответствуют GMYC. Кластеры 3C и 3D, выделенные методом GMYC и PTP, следует рассматривать как представителей одного вида, поскольку уровень генетических различий между кластерами соответствует внутривидовому уровню (0.3%), СВС или иных существенных различий в строении ITS1 и ITS2 между ними не найдено. Таким образом, самостоятельный видовой статус каждого из штаммов GL 26_2, GL 28_4, а также кластеров 3A, 3B и объединенной подгруппы 3С и 3D, подтверждены генетическими дистанциями (≥0.5%), наличием СВС в ITS1 и/или ITS2 по сравнению с сестринскими филогенетическими линиями, методами делимитации видов PTP и/или GMYC.
Группа IV выделена на основании уникального филогенетического положения и объединяет 4 штамма с Dictyosphaerium-подобной морфологией, у которых гиалиновые тяжи в колониях крепятся к широкой стороне клеток (табл. 1) (Song et al., 2018b). Штамм CCAP 222/38 в составе гена 18S рРНК имеет интрон длиной 542 н., штамм HC7D2 – 2 интрона длиной 349 н. и 402 н. Генетические дистанции между HC7D2 и HND2-3 соответствовали внутривидовому уровню (0.2%), между ними и штаммом CCAP 222/38 – межвидовому (0.6–0.7%), между штаммом CB 2008/31 и остальными представителями группы – межродовому (2.5%) (табл. ESM_13). Уровень генетических различий с сестринской группой III – 3.1–3.6% (межродовой). Штаммы HC7D2 и HND2-3 отличались от CCAP 222/38 на 1 СВС в ITS1. Штамм CB2008/31 отличался от других представителей на 2 CBC в неконсервативных регионах ITS2 (табл. ESM_14, ESM_15). Самостоятельный видовой статус штамма CB2008/31 подтвержден всеми методами делимитации видов. Остальные штаммы согласно анализу ABGD относятся к одному кластеру, тогда как PTP и GMYC выделяет еще 2. Таким образом, вероятно, группа IV объединяет 2 криптических рода. Первый род состоит из двух видов (1-й вид – штамм CCAP 222/38; 2-й вид – штаммы HC7D2 и HND2-3). Второй род представлен только штаммом CB 2008/31.
Группа V содержит 3 штамма с Dictyosphaerium-подобным морфотипом, которые различаются способом прикрепления клеток к гиалиновым тяжам (Song et al., 2018b). У штаммов XY16-6, YN24_2 клетки крепятся к ним широкой стороной, у штамма Gl29 – узкой (табл. 1). Генетические дистанции между штаммами группы соответствовали межвидовому уровню (0.5–0.8%) (ESM_16). При анализе ITS1 у штаммов были выявлены различия в длине шпильки III. У штамма XY16-6 она составляла 40 н., у штамма YN24_2 – 33 н., у штамма Gl29 – 27 н. CBC не были обнаружены ни в ITS1, ни в ITS2. Согласно анализам GMYC и PTP все исследуемые штаммы являются представителями неописанных видов, тогда как метод ABGD объединял их в один кластер. Видовой статус штамма Gl29 подтверждают особенности морфологии (крепление клеток штамма к гиалиновым стеблям узкой стороной), уровень генетических дистанций (≥0.5%), результаты анализа GMYC и PTP. Разделение штаммов XY16-6, YN24_2 на 2 самостоятельных вида, помимо алгоритмов делимитации, подтверждено только уровнем генетических различий. Однако для понимания таксономического статуса данные штаммы нуждаются в дополнительном исследовании.
Группа VI микроводоросли с Dictyosphaerium-подобным морфотипом, у которых колонии состоят, как правило, из 2–4 клеток, соединяющихся с гиалиновыми стеблями узкой стороной (табл. 1). Все представители группы обитатели пресноводных водоемов (Krienitz et al., 2012; Škaloud et al., 2014; Song et al., 2018b). В ее состав входят (рис. 1а):
1) монотипный род Kalenjinia. Он представлен типовым видом K. gelatinosa. Генетические дистанции между штаммами 0.1%, с другими родами – 1.2–2.5% (межродовой уровень) (табл. ESM_17). Между штаммами СВС нет (табл. ESM_18, ESM_19). Видовой статус K. gelatinosa подтвержден всеми методами делимитации;
2) отдельный кластер формируют представители рода Compactochlorella и штамм Dictyosphaerium sp. WfA1. Типовой вид рода C. kochii образует подгруппу с Dictyosphaerium sp. WfA1. Она характеризуется генетической неоднородностью. Так, только у штаммов CCAP 222/61, CB 2008/47 в составе гена 18S рРНК имеется интрон длиной 708 н. Генетическая дистанция между этими штаммами – <0.1% (внутривидовой уровень), между ними и Dictyosphaerium sp. WfA1, штаммом CB 2008/14 – 0.4% (межвидовой), штаммом CCAP 222/7 – 1.2% (табл. ESM_17). Штаммы CCAP 222/61, CB 2008/47 отличаются от остальных членов подгруппы на 1 CBC в неконсервативном регионе ITS2 (табл. ESM_18, ESM_19). Согласно методу GMYC, штаммы данной подгруппы относятся к 4 видам, PTP – к 2 видам. Полифилетичность вида C. kochii подтверждают наличие/отсутствие интронов, уровень генетических дистанций (0.4–1.2%), СВС в ITS2, результаты анализа GMYC и PTP. Истинными представителями вида C. kochii являются, вероятно, аутентичный штамм CCAP 222/61 и близкородственный ему CB 2008/47. Таксономический статус остальных штаммов подгруппы нуждается в уточнении. Сестринской филогенетической линией к C. kochii является аутентичный штамм C. dohrmannii CCAP 222/5. Уровень генетических различий между C. dohrmannii CCAP 222/5 и подгруппой, объединяющей штаммы C. kochii и Dictyosphaerium sp. WfA1, колебался в пределах от 1.2 до 1.8% (табл. ESM_17). От всех представителей сестринской подгруппы C. dohrmannii CCAP 222/5 отличается 1 СBC в ITS1 и на 1 CBC в неконсервативном регионе ITS2. Кроме того, по сравнению с CCAP 222/61 и CB 2008/47 он имеет еще по 1 СВС в ITS1 и неконсервативном регионе ITS2, c CCAP 222/7 – 1 CBC в ITS1, c Dictyosphaerium sp. WfA11 – 1 дополнительную CBC в неконсервативной части ITS2 (табл. ESM_18, ESM_19). Таким образом, видовой статус C. dohrmannii подтвержден генетическими дистанциями (≥1.2%), СВС в ITS2, результатами анализов GMYC и PTP;
3) род Marasphaerium, включающий типовой вид M. gattermannii, в отличие от остальных имеет преимущественно шаровидную форму взрослых клеток (Krienitz et al., 2012). Генетические дистанции между штаммами CCAP 222/24 и Heg 1983/17 – 0.1% (внутривидовой уровень) (табл. ESM_17). Аутентичный штамм CCAP 222/24 по сравнению со штаммом Heg 1983/17 имел 3 СВС в неконсервативных регионах ITS2 (табл. ESM_18, ESM_19). ABGD и PTP относят их к одному виду, GMYC – к разным. Поэтому мы считаем, что штаммы CCAP 222/24 и Heg 1983/17 принадлежат одному виду – M. gattermannii;
4) сестринский кластер к роду Marasphaerium образует монотипный род Planktochlorella. Голотип рода P. nurekis представлен аутентичным штаммом CAUP H8701 и штаммом CCAP 222/25. Диакритические признаки: клетки одиночные, имеют двуслойную клеточную стенку, не формируют колоний. Однако сами авторы отмечают, что, возможно, способность формировать колонии может проявиться у данного вида при определенных условиях, например, при интенсивной “пастбищной” нагрузке (Škaloud et al., 2014). Генетические дистанции внутри вида составляли 0.2%, межродовые варьировали от 1.8 до 2.9% (табл. ESM_17). СВС между штаммами не обнаружено (табл. ESM_18, ESM_19). Анализ GMYC отнес штаммы к разным видам, ABGD и PTP к одному виду. Самостоятельный видовой статус подтверждают все методы делимитации. Исходя из уровня генетических различий, отсутствия СВС, результатов ABGD и PTP, можно сказать, что штаммы CAUP H8701 и CCAP 222/25 относятся к одному виду P. nurekis;
5) род Masaia, представленный типовым видом M. oloidia (3 штамма, в т.ч. аутентичный штамм CCAP 222/32), в отличие от других членов группы способен формировать 8-клеточные колонии (Krienitz et al., 2012). Уровень генетических дистанций между штаммами был равен ≤0.2%, с представителями других родов – 1.2–2.2% (табл. ESM_17). СBC между штаммами не обнаружены ни в ITS1, ни в ITS2 (табл. ESM_18, ESM_19). На основании вышесказанного, а также результатов ABGD, GMYC и PTP, все три штамма принадлежат к виду M. oloidia.
В группу VII входят представители рода Mucidosphaerium. Они морфологически идентичны группе III и встречаются в сходных экологических условиях (табл. 1) (Bock et al., 2011b). Морфологически виды внутри рода различаются формой молодых клеток (рис. 1):
1) M. pulchellum от других представителей рода отличается яйцевидной или овальной формой молодых клеток (табл. 1) (Bock et al., 2011b). Между штаммами имеются расхождения в составе гена 18S рРНК. Так штамм ACOI 755 имеет 3 интрона (355 н., 518 н., 497 н.), штамм CCAP 222/2A – 4 интрона (355 н., 732 н., 513 н., 497 н.). Генетические дистанции между штаммами CCAP 222/2A и ACOI 755, а также между UTEX 731 и CCAP 222/2B – 0.2–0.3% (внутривидовой уровень), между этими подгруппами – 0.8% (межвидовой), c другими видами – 2.0–3.9% (табл. ESM_20). Штаммы CCAP 222/2A и ACOI 755 по сравнению с остальными имели 1 CBC в ITS1 и 1 CBC в неконсервативном регионе ITS2 (табл. ESM_21, ESM_22). Анализ ABGD отнес все штаммы к одному виду, GMYC выделил 2 вида, а PTP – 3. Результаты GMYC подтверждаются генетическими дистанциями, отсутствием интронов у UTEX 731, CCAP 222/2B, 1 СВС в ITS1 и 1 СВС в ITS2. Таким образом, вид M. pulchellum, вероятно, является полифилетичным и включает в себя 2 вида (1-й вид – CCAP 222/2A, ACOI 755, 2-й вид – UTEX 731, CCAP 222/2B);
2) аутентичный штамм M. planctonicum ACOI 1719, характерной особенностью которого являются исключительно овальная форма молодых клеток (Bock et al., 2011b). В составе нуклеотидной последовательности гена 18S рРНК присутствует 4 интрона длиной 368 н., 428 н., 440 н., 498 н. Уровень генетических различий от других видов группы VII – 2.2–4.5% (табл. ESM_20). Между M. planctonicum и штаммами M. pulchellum CCAP 222/2A, ACOI 755 была найдена 1 CBC в неконсервативном регионе ITS2 (табл. ESM_21, ESM_22). Видовой статус был подтвержден всеми методами делимитации;
3) типовой вид рода Mucidosphaerium – M. palustre, у которого форма молодых клеток варьирует от овальной до почковидной (Bock et al., 2011b). Аутентичный штамм CCALA 332 отличается от штамма CB2008/6 строением и длиной интронов в гене 18S рРНК (штамм CCALA 332 – 4 интрона длиной 422 н., 440 н., 462 н., 429 н., штамм CB2008/6 – 4 интрона длиной 422 н., 356 н., 447 н., 429 н.). Уровень генетических дистанций между ними – 2.2%, с другими видами – 2.2–3.9% (табл. ESM_20). СВС между штаммами M. palustre не были обнаружены ни в ITS1, ни в ITS2 (табл. ESM_21, ESM_22). От родственного M. sphagnale они отличаются на 2 CBC в неконсервативных участках ITS2. Анализы GMYC и PTP, в отличие от ABGD, относят штаммы к разным видам, что подтверждается расхождением в составе и длине интронов и высокими значениями генетических дистанций (2.2%);
4) M. sphagnale, характерной чертой которого является узкоовальная или полулунная форма молодых клеток (Bock et al., 2011b). Все представители вида в составе гена 18S рРНК имеют два интрона, длина которых составляет 356 н. и 447 н. Генетическая дистанция между штаммами M. sphagnale – 0–0.2%, с другими членами группы – 1.9–3.1% (табл. ESM_20). СВС в ITS1 и ITS2 между данными штаммами не обнаружено (табл. ESM_21, ESM_22). Объединение всех трех штаммов в один кластер видового уровня подтверждено методами делимитации GMYC и PTP, метод ABGD объединяет данный вид с представителями M. palustre. Однако расхождения в форме молодых клеток, количестве и составе интронов, наличие 2 СВС в ITS2 по сравнению с M. palustre, результаты GMYC и PTP позволяют утверждать, что M. sphagnale – самостоятельный вид. Таким образом, таксономически признанный род Mucidosphaerium характеризуется высоким генетическим полиморфизмом.
Группа VIII объединяет штаммы с Dictyosphaerium-подобным морфотипом, у которых гиалиновые стебли крепятся к широкой стороне клеток (табл. 1) (Krienitz et al., 2012; Song et al., 2018b). Несмотря на морфологию, данная группа c “истинными” представителями рода Dictyosphaerium (группа III) не группируется. В состав входят 7 кластеров предположительно видового уровня, выделенных на основании анализов GMYC и PTP (рис. 1a):
1) кластер 8A объединяет штаммы, имеющие в составе гена 18S рРНК интрон длиной 660 п.н. Генетические дистанции между штаммами – 0.2% (внутривидовой), с другими кластерами – 1.3–1.6% (межвидовой) (табл. ESM_23). Между кластером 8A и сестринским штаммом HND 3-9 обнаружена 1 CBC в неконсервативном регионе ITS2 (табл. ESM_24, ESM_25). Все методы делимитации подтвердили видовой статус кластера. Таким образом, доказательствами валидности видового статуса кластера 8А являются наличие интрона, уровень генетических дистанций (≥0.6%), результаты алгоритмов ABGD, GMYС и PTP;
2) штамм Dictyosphaerium sp. HND 3-9, имеющий в гене 18S рРНК интрон длиной 506 п.н. Уровень генетических различий с другими членами группы – 1.4–1.6% (межвидовой уровень) (табл. ESM_23). Между HND 3-9 и штаммом CCALA 335 имел 3 СВС в неконсервативных регионах ITS2, с кластером 8B – 3 СВС в ITS1 и 5 СВС в неконсервативных регионах ITS2, с кластером 8D – 4 CBC в неконсервативных регионах ITS2, со штаммом CCAP 222/41 – 4 СВС в неконсервативных регионах ITS2 (табл. ESM_24, ESM_25). Наличие интрона, генетические дистанции ≥0.7%, СВС в ITS2, анализы ABGD, GMYС и PTP подтверждают то, что штамм HND 3-9 относится к новому виду неописанного Dictyosphaerium-подобного рода;
3) уровень генетических дистанций штамма CCALA 335 от других представителей группы VIII варьировал от 1.4–1.8% (межвидовой уровень) (табл. ESM_23). У данного штамма была найдена 1 специфическая СВС в ITS1, отличающая его от остальных членов группы. Штамм CCALA 335 отличается от кластера 8A и штамма HND 3-9 на 1 CBC в консервативном регионе ITS2. В неконсервативной части ITS2 штамм CCALA 335 по сравнению с кластером 8B и 8С имеет по 1 СВС, кластером 8D – 5 СВС, от штамма CCAP 222/41 – 2 (табл. ESM_24, ESM_25). Таким образом, самостоятельный видовой статус штамма CCALA 335 подтверждают генетические дистанции ≥1.4%), наличие CBC в ITS1 и ITS2, результаты GMYС и PTP;
4) генетические дистанции между штаммами кластера 8B – 0.2% (внутривидовой уровень), с другими членами группы VIII – 0.6–1.6% (межвидовой) (табл. ESM_23). Кластер 8B имеет уникальную для группы VIII СВС в I шпильке и 2 СВС в IV шпильке ITS1, по сравнению со всеми штаммами, кроме HND 3-9. Кроме того, между кластером 8B и штаммом CCAP 222/41 найдено 2 CBC в неконсервативных регионах ITS2 (табл. ESM_24, ESM_25). Итак, уровень генетических различий (≥0.6%), наличие СBC в ITS1 и ITS2, результаты GMYС и PTP указывают, что штаммы кластера 8B относятся к самостоятельному виду;
5) внутри кластера 8С генетические дистанции соответствовали внутривидовому уровню (≤0.2%), с остальными представителями группы межвидовому – 1.2–1.7% (табл. ESM_23). Кроме СВС, приведенных ранее, представители кластера 8С отличались на 1 CBC в консервативной III шпильке ITS2 от остальных членов группы, за исключением Dictyosphaerium sp. CCALA 335 и штаммов кластера 8B (табл. ESM_24, ESM_25). Таким образом, видовой статус штаммов кластера 8С подтверждают генетические дистанции (≥1.2%), СВС в ITS2, анализы ABGD, GMYC и PTP;
6) штаммы кластера 8D в отличие от сестринской филогенетической линии Dictyosphaerium sp. CCAP 222/41 в составе гена 18S рРНК не имеют интрона. Генетические дистанции внутри кластера 8D – 0–0.1% (внутривидовой уровень), между кластером 8D и штаммом CCAP 222/41 – 0.3% (внутривидовой), между ними и остальными кластерами – 1.0–1.7% (межвидовой) (табл. ESM_23). СВС между кластером 8D и штаммом CCAP 222/41 ни в ITS1, ни в ITS2 не обнаружено (табл. ESM_24, ESM_25). Вероятно, кластер 8D и штамм CCAP 222/41 относятся к одному и тому же криптическому виду, принадлежащему Dictyosphaerium-подобному роду, о чем свидетельствуют единая морфология, уровень генетических различий, отсутствие СВС в ITS1 и ITS2.
Группа IX объединяет микроводоросли с Dictyosphaerium-подобным морфотипом, у которых гиалиновые стебли крепятся к широкой стороне клеток (табл. 1) (Krienitz et al., 2012; Song et al., 2018b). Члены группы XI также к “истинным” Dictyosphaerium не относятся. В состав группы входят (рис. 1a):
1) штамм Dictyosphaerium sp. YN12-3;
2) кластер, включающий 10 штаммов. Данный кластер характеризуется гетерогенностью в строении гена 18S рРНК: штаммы YN29-3, JI6-1, YN12-1 имеют интрон длиной 403 н. Уровень генетических различий внутри кластера – 0.1 до 0.2% (внутривидовой уровень), между кластером и штаммом Dictyosphaerium sp. YN12-3 – 0.4–0.5% (межвидовой уровень) (табл. ESM_26). Штамм Dictyosphaerium sp. YN12-3 отличался от других представителей группы на 2 CBC в ITS1, от штаммов I68, JI8-2, CCAP 222/4 – на еще 1 дополнительную СВС в ITS1 (табл. ESM_27). CBC в ITS2 отсутствовали. Согласно методу ABGD все штаммы группы относятся к одному виду, согласно PTP – к 2 видам, GMYC – к 4. Видовой статус штамма Dictyosphaerium sp. YN12-3 подтверждают уровень генетических различий (≥0.4), 2 CBC в ITS1, результаты GMYC, PTP. Все остальные представители группы относятся к другому виду. Генетические дистанции между ними невелики и соответствуют внутривидовому уровню (≤0.2%), СBC в ITS1 и ITS2 не найдены. Наличие интрона у некоторых из них может указывать на начавшиеся процессы видообразования, но пока происходящие на популяционном уровне (Gaonkar et al., 2018).
Группа X состоит из монотипного рода Dicloster и включает в себя 3 штамма типового вида Dicloster acutus (рис. 1a). Нуклеотидные последовательности аутентичного штамма в GenBank отсутствует. Отличительными признаками являются Scenedesmus-подобный морфотип, клетки изогнутые, с длинными сужающимися, заостренными концами, хлоропласт чаще всего с 1–2 пиреноидами (реже отсутствует или от 3 до 5) (табл. 1). Кроме того, может активно развиваться в кислых водах, в т.ч. в болотах (Jao et al., 1975). Генетические дистанции между штаммами были не более 0.1% (внутривидовой уровень). Межродовые различия с сестринской группой XI, включающей род Closteriopsis, составляли 2.1–2.2%. CBC внутри группы отсутствовали. Методы делимитации видов GMYC и ABGD в отличие от PTP подтвердили принадлежность всех штаммов группы к одному виду.
Группа XI представлена видом Closteriopsis acicularis (рис. 1а). К сожалению, информация о нуклеотидных последовательностях типового вида рода C. longissima и аутентичного штамма C. acicularis отсутствует в GenBank. Характерные черты: Actinastrum-подобный морфотип, клетки веретеновидные, прямые или изогнутые, одиночные или в небольших скоплениях, хлоропласт желобовидный с 1, 2 или без пиреноида, размножение автоспорами (табл. 1). Представители данной группы – обитатели пресноводных водоемов (Belcher, Swale, 1962). Генетические дистанции между штаммами SAG 11.86 и EN 2003/36 были менее чем 0.1% (внутривидовой уровень), между подгруппой штаммов SAG 11.86, EN 2003/36 и штаммом FACHB-2133 – ≥0.5% (межвидовой уровень). Между штаммами SAG 11.86, EN 2003/36, FACHB-2133 выявлена 1 СВС в ITS1 (H III: G–U→C–G, 11 п.н.). Анализы GMYC и PTP, в отличие от метода ABGD, подтвердили разделение группы на 2 вида. Таким образом, учитывая генетические дистанции (≥0.5%), наличие СВС в ITS1, результаты GMYC и PTP, можно предположить, что вид Closteriopsis acicularis состоит из двух независимых видов: 1-й вид – штаммы SAG 11.86, EN 2003/36; 2-й вид – штамм FACHB-2133.
Сестринскую к группе XI филогенетическую линию образует штамм Dictyosphaerium sp. CCAP 222/43. Имеет типичный Dictyosphaerium-подобный морфотип (табл. 1) (Song et al., 2018b). Генетические дистанции с представителями группы X составляли 2.7%, группы XI – 2.3–2.5%. Методы делимитации видов GMYC, PTP и ABGD подтвердили, что Dictyosphaerium sp. CCAP 222/43 является представителем нового, пока не описанного вида, принадлежащего Dictyosphaerium-подобному роду.
Самостоятельную филогенетическую линию образует род Coronacoccus, представленный типовым видом рода C. hengyangensis (рис. 1а). Характеризуется способностью формировать 4- реже 8-клеточные колонии, Scenedesmus-подобные, покрытые аморфной слизью (табл. 1). Форма молодых и взрослых клеток внутри колоний варьирует. Иногда встречаются четырехгранные клетки или слегка асимметричные (Song et al., 2018a). Уровень генетических различий данного вида с группами X, XI и Dictyosphaerium sp. CCAP 222/43 составляли 3–4.1%, а методы делимитации видов GMYC, PTP и ABGD подтвердили его самостоятельный таксономический статус.
Топология дерева, представленного в работе, соответствовала более ранним исследованиям (Bock et al., 2011b; Krienitz et al., 2012; Škaloud et al., 2014; Song et al., 2018a, 2018b). Группы II, IV, V, VIII, IX, объединяющие штаммы, идентифицированные как Dictyosphaerium sp., соответствовали линиям, выделенным Song и соавт. (2018b). Увеличение выборки представителей клады Parachlorellа, используемых в анализе (Krienitz et al., 2012 – 36 штаммов, Škaloud et al., 2014 – 30 штаммов, Song et al., 2018а – 67 штаммов, Song et al., 2018b – 105 штаммов, данная работа – 115 штаммов) позволило уточнить филогенетическое положение этих групп, а также способствовало тому, что представители родов с преимущественно Dictyo-sphaerium-подобным морфотипом, колонии которых состояли не более чем из 8 клеток, вошли в состав группы VI. Сравнение рассчитанных генетических дистанций с другими диакритическими признаками (форма клеток, способность формировать колонии, способ крепления клеток к гиалиновым тяжам, тип хлоропласта, количество пиреноидов, присутствие слизи, наличие интронов, уровень генетических различий, наличие СВС в ITS1 и ITS2, среда обитания, кластеризация методами ABGD, GMYC, PTP) позволило уточнить внутривидовые, межвидовые и межродовые уровни различий (рис. 3).
Рис. 3.
Генетические дистанции (%) внутри видов (А), между видами (В) и между родами (С). Границы бокса показывают первый и третий квартили, жирная горизонтальная линия – медианное значение, “усы” – размах. Таксоны с неясным систематическим положением, требующие дополнительных исследований, не учтены.
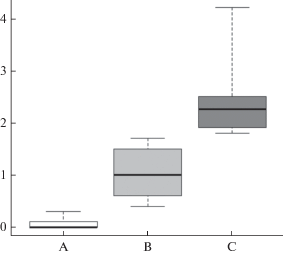
На сегодняшний день в составе клады Parachlorella описано c применением совокупности морфологических и молекулярно-генетических методов всего 12 родов и порядка 20 видов, но по результатам проведенного анализа истинное видовое и родовое богатство данной группы оказалось существенно выше – не менее 20 родов и 46 видов. К диакритическим морфологическим признакам, обеспечивающим таксономическое разделение микроводорослей внутри клады, можно отнести размер и форму молодых и взрослых клеток, способ крепления клеток к гиалиновым тяжам, диаметр колоний, наличие и толщина слизи, тип хлоропласта, наличие и количество пиреноидов. Дополнительной экологической характеристикой также может служить специфическое местообитание, например, болота или поверхность почвы. По итогам анализа генетических дистанций нуклеотидных последовательностей 18S–ITS1–5.8S–ITS2 можно предположить, что внутривидовые различия, как правило, находятся в пределах 0–0.2%, межвидовые – в пределах 0.4–2.6%, межродовые – 1.2–4.2%. Представители группы VII (род Mucidosphaerium) отличались высоким генетическим полиморфизмом: генетические различия между таксономически признанными видами в этой группе соответствовали диапазону 1.9–4.5%, который являлся межродовым уровнем для других групп клады. Использование интрона в качестве критерия разделения близкородственных видов было эффективно для представителей групп II, IV, VIII, рода Mucidosphaerium, а также для штаммов видов Compactochlorella kochii и D. libertatis. Применение классического СВС-подхода, основанного на поиске СВС исключительно в консервативных регионах ITS2 (Coleman, 2003, 2009, 2015), было успешным только для представителей группы II. Низкую эффективность СВС-подхода для Parachlorella-клады отмечали также в своей работе Song и соавт. (2018a, 2018b). В связи с этим, в остальных группах в роли вспомогательного инструмента для разграничения видов были использованы СВС в ITS1 и в неконсервативных регионах ITS2. Кроме того, в качестве молекулярной подписи видов рода Parachlorella можно рассматривать мотив, расположенный сразу после вершины III шпильки ITS1: для P. kessleri – мотив GCUG, для P. beijerinckii – AGCC, для P. hussii – GAAA. Используемые алгоритмы делимитации видов имели различные результаты по количеству выделенных кластеров потенциально видового уровня: дистанционный метод ABGD является менее “чувствительным” и выделил 24 кластера, в то время как более совершенные топологические алгоритмы GMYC и PTP – 57 и 55 кластеров соответственно. Следует отметить, что выделенные кластеры по своей сути являются молекулярными оперативными таксономическими единицами (molecular operational taxonomic units, MOTUs), т.е. представляют собой предварительные гипотезы о валидности вида, нуждающиеся в подтверждении другими характеристиками. На наш взгляд, GMYC и PTP более реалистично отражают систематику клады Parachlorella, являясь эффективным вспомогательным инструментом для разграничения видов, валидность которых была подтверждена также и другими дополнительными признаками.
Таким образом, по результатам кластеризации методами делимитации видов GMYC, PTP и ABGD, наличию/отсутствию интронов и их характеристикам, значению генетических дистанций, сравнению вторичных структур ITS1 и ITS2, нам удалось охарактеризовать 11 групп и 2 филогенетические линии в рамках клады Parachlorella и выдвинуть предположения о разделении родов и видов внутри выделенных групп. Предположена полифилетичность видов D. libertatis, D. ehrenbergianum, Compactochlorella kochii, Mucidosphaerium pulchellum, M. palustre, Closteriopsis acicularis. Истинными представителями рода Dictyosphaerium могут считаться виды группы III, которые объединились с типовым видом рода – D. ehrenbergianum, что согласуется с результатами Song et al. (2018b). Остальные представители рода, определенные как Dictyosphaerium sp., но вошедшие в состав групп II, IV, V, VII, VIII, IX, а также штамм CCAP 222/45, формирующие отдельные филогенетические линии, по-видимому, “истинными” членами рода Dictyosphaerium не являются, и их таксономическая принадлежность нуждается в дальнейшем изучении и уточнении (рис. 4).
Рис. 4.
Предполагаемое разделение родов и видов внутри клады Parachlorella. (а) – Клада Parachlorella; (б) – группа III и IV. Обозначения: жирным шрифтом выделены штаммы ACSSI, исследуемые в рамках данной работы, * – аутентичные штаммы; (T) – типовой вид, ? – таксономический статус нуждается в уточнении.
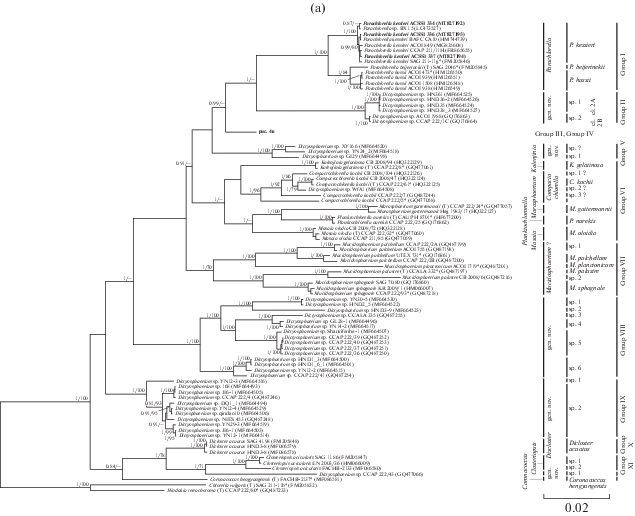
Рис. 4.
Окончание
Список литературы
Гайсина Л.А., Фазлутдинова А.И., Кабиров Р.Р. Современные методы выделения и культивирования водорослей: учеб. пособие. Уфа: Изд-во БГПУ, 2008. 152 с.
Кривина Е.С., Темралеева А.Д. Проблема идентификации и криптическое разнообразие микроводорослей клады Chlorella (Chlorophyta) // Микробиология. 2020. Т. 89. С. 714–727.
Krivina E.S., Temraleeva A.D. Identification problems and cryptic diversity of Chlorella-clade microalgae (Chlorophyta) // Microbiology (Moscow). 2020. V. 89. P. 720–732.
Aslam Z., Shin W., Kim M.K., Im W.-T., Lee S.-T. Marinichlorella kaistiae gen. et sp. nov. (Trebouxiophyceae, Chlorophyta) based on polyphasic taxonomy // J. Phycol. 2007. P. 576–584.
Belcher J.H., Swale, E.M.F. Some Chlorococcales new to Britain // Brit. Phycol. Bull. 1962. V. 2. P. 121–125.
Bock C., Pröschold T., Krienitz L. Two new Dictyosphaerium-morphotype lineages of the Chlorellaceae (Trebouxiophyceae): Heynigia gen. nov. and Hindakia gen. nov. // Eur. J. Phycol. 2010. V. 45. P. 267–277.
Bock C., Pažoutová M., Krienitz L. Phylogenetic position of Coronastrum ellipsoideum and description of Parachlorella hussii sp. nov. // Biologia. 2011a. V. 66/4. P. 585–594.
Bock C., Pröschold T., Krienitz L. Updating the genus Dictyosphaerium and description of Mucidosphaerium gen. nov. (Trebouxiophyceae) based on morphological and molecular data // J. Phycol. 2011b. V. 47. P. 638–652.
Caisová L., Marin B., Melkonian M. A consensus secondary structure of ITS2 in the Chlorophyta identified by phylogenetic reconstruction // Protist. 2013. V. 164. P. 482–496.
Coleman A.W. Is there a molecular key to the level of “biological species” in eukaryotes? A DNA guide // Mol. Phylogenet. Evol. 2009. V. 50. P. 197–203.
Coleman A.W. The significance of a coincidence between evolutionary landmarks found in mating affinity and a DNA sequence // Protist. 2000. V. 151. P. 1–9.
Coleman A.W. ITS2 is a double-edged tool for eukaryote evolutionary comparisons // Trends Genet. 2003. V. 19. P. 370–375.
Coleman A.W. Nuclear rRNA transcript processing versus internal transcribed spacer secondary structure // Trends Genet. 2015. V. 31. P. 157–163.
Drummond A.J., Nicholls G.K., Rodrigo A.G., Solomon W. Estimating mutation parameters, population history and genealogy simultaneously from temporally spaced sequence data // Genetics. 2002. V. 161. P. 1307–1320.
Fawley M.W., Dean M.L., Dimmer S.K., Fawley K.P. Evaluating the morphospecies concept in the Selenastraceae (Chlorophyceae, Chlorophyta) // J. Phycol. 2006. V. 42. P. 142–154.
Fujisawa T., Barraclough T.G. Delimiting species using single-locus data and the Generalized Mixed Yule Coalescent approach: A revised method and evaluation on simulated data sets // Syst. Biol. 2013. V. 62. P. 707–724.
Gaonkar C.C., Piredda R., Minucci C., Mann D., Montresor M., Sarno D., Kooistra W.H.C.F. Annotated 18S and 28S rDNA reference sequences of taxa in the planktonic diatom family Chaetocerotaceae // PLoS One. 2018. V. 13. e0208929. https://doi.org/10.1371/journal.pone.0208929.
Guiry M.D., Guiry G.M. AlgaeBase. World-wide electronic publication, National University of Ireland, Galway, 2021. http://www.algaebase.org.
Jao C.-C., Wei Y.X., Hu H.J. Dicloster, a new genus of Chlorococcales // Acta Hydrobiol. Sin. 1975. V. 6. P. 115–116.
Hoshina R., Iwataki M., Imamura N. Chlorella variabilis and Micractinium reisseri sp. nov. (Chlorellaceae, Trebouxiophyceae): Redescription of the endosymbiotic green algae of Paramecium bursaria (Peniculia, Oligohymenophorea) in the 120th year // Phycol. Res. 2010. V. 58. P. 188–210.
Krienitz L., Hegewald E.H., Hepperle D., Huss V.A.R., Rohr T., Wolf M. Phylogenetic relationship of Chlorella and Parachlorella gen. nov. (Chlorophyta, Trebouxiophyceae) // Phycologia. 2004. V. 43. P. 529–542.
Krienitz L., Bock C., Kotut K., Pröschold T. Genotypic diversity of Dictyosphaerium-morphospecies (Chlorellaceae, Trebouxiophyceae) in African inland waters, including the description of four new genera // Fottea. 2012. V. 12. P. 231–253.
Krienitz L., Bock C., Luo W., Pröschold T. Polyphyletic ori-gin of the Dictyosphaerium-morphotype within Chlorellaceae (Trebouxiophyceae) // J. Phycol. 2010. V. 46. P. 559–563.
Luo W., Pröschold T., Bock C., Krienitz L. Generic concept in Chlorella-related coccoid green algae (Chlorophyta, Trebouxiophyceae) // Plant Biol. 2010. V. 12. P. 545–553.
Puillandre N., Lambert A., Brouillet S., Achaz G. ABGD, Automatic Barcode Gap Discovery for primary species delimitation // Mol. Ecol. 2012. V. 21. P. 1864–1877.
Škaloud P., Němcová Y., Pytela J., Bogdanov N.I., Bock C., Pickinpaugh S.H. Planktochlorella nurekis gen. et sp. nov. (Trebouxiophyceae, Chlorophyta), a novel coccoid green alga carrying significant biotechnological potential // Fottea. 2014. V. 14. P. 53–62.
Song H., Liu X., Hu Y., Wang Q., Long J., Liu G., Hu Z. Coronacoccus hengyangensis gen. et sp. nov., a new member of Chlorellaceae (Trebouxiophyceae, Chlorophyta) with Radiococcacean morphology // Phycologia. 2018a. V. 57. P. 363–373.
Song H., Qinghua Wang Q., Liu X., Hu Y., Long J., Guoxiang Liu G., Hu Z. Phylogenic diversity and taxonomic problems of the Dictyosphaerium morphotype within the Parachlorella clade (Chlorellaceae, Trebouxiophyceae) // J. Eukaryot. Microbiol. 2018b. V. 65. P. 382–391.
Temraleeva A., Moskalenko S., Mincheva E., Bukin Y., Sinetova M. Spongiosarcinopsis terrestris gen. et sp. nov. (Chlorophyta, Chlorophyceae): a new genus of green algae from gray forest soil, Russia // Phytotaxa. 2018. V. 376. P. 291–300.
Ustinova I., Krienitz L., Huss V.A.R. Closteriopsis acicularis (G.M. Smith) Belcher et Swale is a fusiform alga closely related to Chlorella kessleri Fott et Nováková (Chlorophyta, Trebouxiophyceae) // Eur. J. Phyco. 2001. V. 36. P. 341–351.
Yamamoto M., Kurihara I., Kawano S. Late type daughter cell wall synthesis in one of the Chlorellaceae, Parachlorella kessleri (Chlorophyta, Trebouxiophyceae) // Planta. 2005. V. 221. P. 766–775.
Zhu X.C., Chen J., Chen R., Jiang L.Y., Qiao G.X. DNA barcoding and species delimitation of Chaitophorinae (Hemiptera, Aphididae) // ZooKeys. 2017. V. 656. P. 25–50.
Zou S., Fei C., Song J., Bao Y., He M., Wang C. Combining and comparing coalescent, distance and character-based approaches for barcoding microalgaes: a test with Chlorella-like species (Chlorophyta) // PLoS One. 2016a. V. 11. e0153833.
Zou S., Fei C., Wang C., Gao Z., Bao Y., He M., Wang C. How DNA barcoding can be more effective in microalgae identification: a case of cryptic diversity revelation in Scenedesmus (Chlorophyceae) // Sci. Rep. 2016b. V. 6. P. 1–13.
Дополнительные материалы
- скачать ESM.docx
- Рис. ESM_1.
Таблица ESM_2. - Таблица ESM_27.


