Микробиология, 2021, T. 90, № 4, стр. 459-470
Изменения в синтезе липополисахарида влияют на формирование биопленок Azospirillum baldaniorum in planta в условиях повышенного содержания меди
Л. П. Петрова a, *, Ю. А. Филипьечева a, Е. М. Телешева a, Т. Е. Пылаев a, b, c, А. В. Шелудько a, **
a Институт биохимии и физиологии растений и микроорганизмов Российской академии наук
410049 Саратов, Россия
b Саратовский государственный медицинский университет им. В.И. Разумовского Министерства здравоохранения Российской Федерации
410012 Саратов, Россия
c Федеральный аграрный научный центр Юго-Востока
410010 Саратов, Россия
* E-mail: petrova_lp@mail.ru
** E-mail: shel71@yandex.ru
Поступила в редакцию 03.02.2021
После доработки 17.03.2021
Принята к публикации 17.03.2021
Аннотация
В условиях повышенного содержания меди жизнеспособность бактерий Azospirillum baldaniorum на корнях проростков пшеницы, количество клеток, колонизирующих корни и образующих биопленку, зависели от физико-химических свойств липополисахаридов (ЛПС, Lps), синтезируемых этими бактериями. По сравнению со штаммом Cal+ LpsI LpsII A. baldaniorum Sp245, его мутанты Cal– LpsI– KM252, Lps II– KM139 и Cal– LpsII– Mot– KM018 хуже колонизировали корни и формировали более тонкие биопленки. Изменения в синтезе полисахаридов у KM252, KM139 и KM018 опосредовали увеличение аккумуляции клетками меди и снижение устойчивости бактериальных культур к негативному влиянию ионов этого металла. In planta и/или на модельной поверхности полистирола избыток меди приводил к увеличению содержания полисахаридных антигенов в биопленках штамма Sp245 и его мутантов с изменениями в составе гликополимеров. Инокуляция штаммом Sp245 положительно влияла на рост стеблей и листьев пшеницы как в присутствии количества меди, не оказывающего заметного влияния на рост каждого из партнеров (0.001 мМ), так и в условиях повышенной (до 0.5 мМ) концентрации ионов этого металла. Штаммы КМ018, КМ139 и КМ252 положительно влияли на проростки только при высокой концентрации меди в среде.
Азоспириллы – это ризобактерии, способствующие росту и развитию широкого круга растений благодаря своей способности фиксировать атмосферный азот, вырабатывать фитогормоны, контролировать развитие фитопатогенов и защищать от стресса, в том числе обусловленного тяжелыми металлами (Döbereiner, Day, 1976; Fibach-Paldi et al., 2012; Abd El-Samad, 2017; Fendrihan et al., 2017). Типовой штамм A. baldaniorum Sp245 (ранее A. brasilense; Dos Santos Ferreira et al., 2020) является модельным в исследованиях приспособления азоспирилл к существованию в динамичной почвенной среде, в том числе в ассоциации с растениями (Lugtenberg, Kamilova, 2009; Шелудько и соавт., 2010; Fibach-Paldi et al., 2012). Перестройки в геноме у A. baldaniorum Sp245, сопровождающиеся изменениями в продукции поверхностных гликополимеров, влияют на устойчивость бактерий к ионам кобальта(II), меди(II), серебра(I) и цинка(II) (Shelud’ko et al., 2012). Механизмы, обеспечивающие устойчивость микробов к ионам тяжелых металлов и поддержание гомеостаза металлов, необходимых для жизнедеятельности, тесно взаимосвязаны (Nies, 1999; Tak et al., 2013) и могут осуществляться с участием гликополимеров (Stoderegger, Herndl, 1998; Lino et al., 2006). Ионы меди необходимы для многих биохимических реакций; тем не менее, медь относится к тяжелым металлам, которые в высоких концентрациях токсичны для почвенной микрофлоры, подавляют многие микробиологические процессы, снижают урожайность растений и содержание питательных веществ (Kamnev et al., 2005; Jing et al., 2007; Tak et al., 2013).
В естественных экосистемах большинство микроорганизмов существует в виде прикрепленных к субстрату биопленок. Образуя биопленки, бактерии повышают устойчивость своей популяции к динамическим условиям окружающей среды, различным негативным факторам и токсическим элементам (Flemming, Wingender, 2010; Nocelli et al., 2016; Шелудько и соавт., 2018; Shelud’ko et al., 2019). Биопленки – это структурированные сообщества микроорганизмов, встроенных в матрикс (Flemming, Wingender, 2010). Матрикс представляет собой структурный каркас биопленок, резервуар факторов роста, ферментов и питательных веществ; кроме того, он выполняет защитную функцию. Основой внеклеточного матрикса биопленок является смесь экзополисахаридов, белков, нуклеиновых кислот и других биополимеров. Разнообразие структурных компонентов матрикса биопленок сопоставимо с количеством видов бактерий и даже штаммов, образующих биопленки (Flemming, Wingender, 2010).
Штамм A. baldaniorum Sp245 продуцирует липополисахарид, состоящий из LpsI и LpsII с разной антигенной структурой и разным зарядом углеводной части, О-специфического полисахарида (ОПС) и/или корового олигосахарида (Fedonenko et al., 2002; Petrova et al., 2020, 2020a). Повторяющимся звеном ОПС, входящим в состав LpsI (с негативно заряженной углеводной частью) и LpsII (с незаряженной углеводной компонентой), является пентасахарид, состоящий из остатков D-рамнозы (Fedonenko et al., 2002). Было показано, что калькофлуор-связывающие полисахариды (Cal– фенотип) и комплексы, содержащие ЛПС, белковые структуры и полярный жгутик, фиксируют зрелые биопленки азоспирилл на твердых поверхностях и выполняют каркасную функцию (Шелудько и соавт., 2010, 2018). Компоненты матрикса биопленок Azospirillum, участвующие в защите бактерий от окружающей их среды, включая ионы тяжелых металлов, практически не охарактеризованы. Характеристика функциональной роли компонентов матрикса биопленок необходима для понимания механизмов образования и распространения биопленок, а также для разработки методов регулирования этих процессов в экологических и биотехнологических целях. Обсуждается использование микробных биопленок для устранения загрязнения тяжелыми металлами (Chang et al., 2006; Nocelli et al., 2016).
Мутанты A. baldaniorum Sp245 с фенотипом LpsII– (KM018 и KM139) или LpsI– (KM252) являются интересными моделями для анализа влияния изменений степени гетерогенности ЛПС на устойчивость биопленок Azospirillum к избыточному содержанию меди в культуральной среде. Мутанты содержат одиночную вставку искусственного транспозона Omegon-Km в гены биосинтеза полисахаридов (AZOBR_p60025, AZOBR_p60126 и AZOBR_p60120) плазмиды AZOBR_p6 (Кацы, Прилипов, 2015; Petrova et al., 2020, 2020a). Спонтанные или индуцированные изменения состава и/или структуры плазмид штамма A. baldaniorum Sp245, приводящие к дефектам в образовании липополисахарида и полисахаридов, связывающих калькофлуор, оказывают заметное влияние на эффективность формирования биопленок азоспирилл на абиотических поверхностях (Шелудько и соавт., 2008; Petrova et al., 2020). Известно, что бактериальные липолисахариды связывают ионы меди (Lino et al., 2006). Вполне вероятно, что изменение физико-химических свойств липополисахаридов, синтезируемых бактериями, способно оказать влияние на формирование микроорганизмами биопленок in planta и эффективность функционирования ассоциативного симбиоза с растениями и в условиях повышенного содержания ионов тяжелых металлов.
Целью данной работы явился анализ влияния изменений в синтезе полисахаридов у мутантов A. baldaniorum Sp245 на рост бактериальных культур, колонизацию проростков пшеницы и формирование биопленок in planta в присутствии различных концентраций ионов меди.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Штаммы и условия культивирования бактерий. В работе использовались штамм A. baldaniorum Sp245, выделенный в Бразилии из корней пшеницы (Triticum sp.) (Baldani et al., 1983; Dos Santos Ferreira et al., 2020). KmR мутанты этого штамма – KM252 (Cal– LpsI–), KM139 (LpsII–) и KM018 (Cal– LpsII– Mot–), содержащие одиночную вставку искусственного транспозона Omegon-Km в генах биосинтеза полисахаридов, локализованных на плазмиде AZOBR_p6 (Кацы, Прилипов, 2015; Petrova et al., 2020, 2020a). Бактерии выращивали в малатно-солевой среде (МСС) (Döbereiner, Day, 1976) при 30°C. При необходимости в среду вносили канамицин (Km) до конечной концентрации 50 мкг/мл или 0.625 мкМ карбонилцианида м-хлорфенилгидразона (CCCP).
Определение уровня устойчивости бактерий к ионам меди. Определяли минимальную ингибирующую концентрацию (МИК), т.е. минимальную концентрацию CuSO4, предотвращающую видимый рост бактерий в течение 24–72 ч инкубации. 24-ч культуры, выращенные в жидкой МСС, инокулировали в жидкие МСС с 0.01% дрожжевого экстракта и различными концентрациями CuSO4 до ОП590 = 0.05–0.10 (l = 0.5 см). Шаг концентрации составлял 0.1 мМ. Инкубировали с аэрацией при 140 об./мин и 30°C. Через 24–72 ч инкубации измеряли ОП590 (l = 0.5 см).
Инокуляция растений бактериями. Семена мягкой яровой пшеницы сорта Саратовская 29 (ВНИИСХ Юго-Востока РАСХН, Саратов) стерилизовали и проращивали в течение 3-х сут как описано ранее (Шелудько и соавт., 2010). Инокуляцию растений проводили выращенными в жидкой МСС и отмытыми 50 мМ фосфатным буфером (рН 7.0) (ФБ) от среды бактериями способом, описанным ранее (Шелудько и соавт., 2010). Инокулированные проростки пшеницы помещали над слоем жидкости в пробирки, содержащие 10 мл среды для растений следующего состава (г/л): KH2PO4 – 4; CaCl2 – 1.25; H3BO3 – 0.0016; CuSO4 · 5H2O – 0.00025; MgSO4 – 0.09; Na2MoO4 · 2H2O – 0.0025; KJ – 0.008; ZnSO4 – 0.015; FeSO4 · 7H2O – 0.028; этилендиаминтетрауксусной кислоты динатриевая соль – 0.037 (рН 6.0). В ряде вариантов опыта концентрацию CuSO4 · 5H2O увеличивали с 0.001 до 0.5, 1.0 или 5.0 мМ. Растения выращивали 7 дней при 22°С и естественном освещении. Распределение биопленок на поверхности корней исследовали с использованием микроскопа Leica DM6000 B (“Leica Microsystems”, Германия).
Определение численности бактерий на корнях проростков пшеницы. Из навесок стерильно отмытых корней 10-дневных проростков готовили гомогенат, в котором определяли количество колониеобразующих единиц (КОЕ) посредством высевов серийных разведений на плотную МСС. Количество бактерий, высеваемых с корней, пересчитывали на одно растение. Контролировали наличие посторонней микрофлоры в гомогенатах корней (Шелудько и соавт., 2010). Образцы, в высевах которых встречались колонии с нехарактерной для азоспирилл морфологией, отбрасывали.
Определение аккумуляции меди бактериальными клетками и проростками пшеницы. Исследования проводили на атомно-абсорбционном спектрометре Thermo Scientific iCE 3500 (“Thermo Scientific”, США). В качестве источника света использовали лампы полого катода. Бактериальные культуры выращивали 24 ч в жидкой МСС в присутствии 0.2 или 0.5 мМ CuSO4. Клетки отделяли от культуральной жидкости центрифугированием, ресуспендировали в 50 мМ ФБ (pH 7.0) и осаждали. Осадок клеток высушивали при 70°С до постоянного веса. Растительные образцы также промывали ФБ (pH 7.0) и высушивали при 70°С. Процесс разложения проб осуществляли в микроволновой системе MARS Xprees (США). Для градуировки спектрометра использовались государственный стандартный образец растворов металлов.
Определение относительного количества биомассы биопленок и анализ ее респираторной активности. Ночные (24 ч) культуры азоспирилл, выращенные с аэрацией в жидкой МСС, отмывали 50 мМ ФБ (pH 7.0) и суспендировали до ОП590 = = 0.05–0.10 (l = 0.5 см) в свежей МСС. Вносили по 0.2 мл полученных суспензий в ячейки полистирольных планшетов с 96-ю плоскодонными лунками и инкубировали 6–7 сут при 30°С в стационарных условиях (зрелые биопленки; Шелудько и соавт., 2018). Относительное количество биомассы в зрелых биопленках оценивали посредством окраски биопленок кристаллическим фиолетовым (O’Toole, Kolter, 1998), как подробно описано Шелудько и соавт. (2010, 2018). Уровень относительной респираторной активности клеток в биопленках определяли флуориметрическим резазурин-тестом с модификациями. Из лунок планшета с биопленками отбирали планктонную культуру и вносили по 0.2 мл раствора AlamarBlue (“Sigma”, США) в ФБ (pH 7.0) (0.01 г/л). Планшеты инкубировали 24 ч при температуре 30°С. Интенсивность флуоресценции регистрировали на спектрофлуориметре Cary Eclipse (“Agilent”, США) при следующих параметрах: длина волны возбуждения 530 нм, длина волны эмиссии – 600 нм, ширина щели – 10 нм.
Твердофазный непрямой иммуноферментный анализ (ИФА). Относительное количество бактериальных полисахаридных антигенов определяли в 7-суточных биопленках, сформированных азоспириллами в лунках полистирольных планшетов (Шелудько и соавт., 2008), или в гомогенатах инокулированных корней проростков пшеницы (Шелудько и соавт., 2010). Полисахаридные бактериальные антигены в ИФА выявляли кроличьими антителами (Ат) на ЛПС штамма A. baldaniorum Sp245. Измерение окрашенного продукта ИФА исследуемых проб (ОП492) проводили на фотометре Multiskan Ascent (“ThermoLabsystems”, Финляндия).
Определение морфометрических и морфофизиологических параметров проростков пшеницы. Линейный размер надземной части проростков (в мм) определяли от первого узла кущения до верхушки первого листа. Для определения морфофизиологического показателя (сухой массы в мг) надземную часть и корневую систему разделяли и высушивали при 70°С до постоянного веса. Данные измерений выражали в процентах от контроля – среднего значения исследованных параметров стерильных растений, выращенных в сходных условиях. Также для каждого растения определяли процент разветвленных корней (корни с боковыми отростками) в корневой системе. Деформацию корневых волосков оценивали при микроскопии корней, определяя процент искривленных от общего числа волосков на 50–90 участках корня.
Статистическая обработка результатов. Морфометрические и морфофизиологические параметры проростков пшеницы определяли у 100–150 растений в каждом варианте опыта. В случае остальных количественных измерений выполняли не менее трех независимых экспериментов, как минимум, в двух повторностях. Статистическую обработку данных проводили с использованием t‑критерия Стьюдента (доверительные интервалы даны для 95% уровня значимости). Для статистической обработки использовали пакет программ Microsoft Office Excel 2010.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Влияние ионов меди на жизнеспособность азоспирилл. Клетки мутанта KM018, синтезирующие кислый LpsI (Cal– LpsII–), при культивировании с 0.2 мМ CuSO4 аккумулировали в 2.3 больше меди по сравнению с клетками родительского штамма Sp245 (Cal+ LpsI+ LpsII+) (табл. 1). В сходных условиях культивирования клетки мутанта KM139 с кислым LpsI (Cal+ LpsII–) содержали в 3.4 раза больше металла, чем Sp245 (табл. 1). После культивирования с 0.5 мМ меди ее содержание в клетках Sp245 возрастало до 1.4 ± 0.1 мг/г, что в 2.0 раза больше величины, характерной для клеток этого штамма, выращенных с 0.2 мМ CuSO4 (табл. 1).
Таблица 1.
Влияние CuSO4 на рост планктонных культур A. baldaniorum (а, в) и аккумуляцию клетками меди (б) МСС
| Штамм | (а) *ОП590 (l = 0.5 см) планктонных культур |
(б) Содержание меди в сухой биомассе, мг/г |
(в) **МИК CuSO4, мМ |
|||||
|---|---|---|---|---|---|---|---|---|
| CuSO4 в жидкой среде МСМ, мМ | СССР, мкМ | |||||||
| 0 | 0.2 | 0.5 | 0.9 | 0.2 | 0.5 | |||
| Sp245 | 1.34 ± 0.06 | 1.14 ± 0.19 | 0.72 ± 0.11 | 0.04 ± 0.01 | 0.7 ± 0.1 | 1.4 ± 0.1 | 0.9 ± 0.03 | 0.6 ± 0.09 |
| KM018 | 1.36 ± 0.24 | 1.15 ± 0.14 | 0.06 ± 0.03 | 0.05 ± 0.01 | 1.6 ± 0.2 | Н.о. | 0.5 ± 0.09 | 0.3 ± 0.04 |
| KM139 | 1.43 ± 0.27 | 1.20 ± 0.19 | 0.06 ± 0.01 | 0.05 ± 0.02 | 2.4 ± 0.4 | Н.о. | 0.5 ± 0.09 | 0.3 ± 0.04 |
| KM252 | 1.40 ± 0.10 | 1.12 ± 0.10 | 0.06 ± 0.02 | 0.06 ± 0.02 | 1.3 ± 0.1 | Н.о. | 0.4 ± 0.03 | 0.4 ± 0.03 |
* 24 ч жидкие культуры азоспирилл разводили до ОП590 (l = 0.5 см) свежей МСС с различными концентрациями CuSO4 и инкубировали 24 ч при интенсивном перемешивании. ** МИК – минимальная ингибирующая концентрация, т.е. минимальная концентрация CuSO4, предотвращающая видимый рост бактерий. *** Количество СССР, не оказывающее существенного влияния на рост планктонных культур A. baldaniorum, но подавляющее активный транспорт и эфлюкс ионов меди (Shelud’ko et al., 2012). Н.о. – не определяли.
МИК меди для KM018 и KM139 составляла 0.5 ± 0.09 мМ. У штамма Sp245 рост отсутствовал на МСС в присутствии 0.9 ± 0.03 мМ меди. Для штаммов Sp245, KM018 и KM139 МИК меди в присутствии ингибитора энергетического обмена СССР (подавляется активный транспорт и эффлюкс) снижалась примерно на 33–40% (табл. 1). У штамма Sp245 в состав липополисахарид-белкового комплекса капсулы входят сходные моносахариды и преимущественно антигены, идентичные таковым у LpsI мембранного ЛПС (Матора, Щеголев, 2002). Вероятно, мутанты, синтезирующие только кислый LpsI, максимально сорбируют металл на клеточной поверхности и в капсуле. Известно, что бактериальные ЛПС связывают ионы меди (Lino et al., 2006). Капсула также может являться частью системы защиты бактерий от катионов тяжелых металлов (Stoderegger, 1998).
Клетки мутанта KM252 с нейтральным LpsII (Cal– LpsI–) при культивировании с 0.2 мМ CuSO4 аккумулировали в 1.9 раз больше меди (табл. 1) по сравнению с показателем Sp245. Для этого мутанта МИК меди меньше показателя Sp245 (0.4 ± ± 0.03 мМ). В присутствии СССР МИК для KM252 оставалась неизменной (табл. 1). Таким образом, барьер для ионов меди, создаваемый нейтральными LpsII мембраны и/или капсулы, одинаково эффективен как в обычных условиях, так и в присутствии ингибитора энергетического обмена.
У штамма Sp245 разнообразен состав и макромолекулярная организация биополимеров полисахаридной природы, представленных на клеточной поверхности/в капсуле (Cal+ LpsI+ LpsII+), создающих барьер для избыточного поступления ионов металлов в цитоплазму. Это, несомненно, сказывается на количестве меди, накапливающейся в клетках, и отчасти обуславливает определенный уровень устойчивости бактериальных культур Sp245 к негативному влиянию избытка меди в окружающей среде.
Влияние ионов меди на численность бактерий, обитающих в корневой системе проростков пшеницы. Количество клеток A. baldaniorum, прикрепившихся к корням, стабилизировалось в течение 3 ч инкубации суспензии бактерий с трехсуточными проростками пшеницы, как в случае штамма Sp245 дикого типа (Shelud’ko et al., 2010), так и его дериватов, имеющих мутации в синтезе полисахаридов. Мутанты, утратившие один из Lps, адсорбировались на корнях хуже штамма Sp245 (табл. 2). Через 7 дней культивирования инокулированных растений в присутствии 0.001 мМ Cu-SO4 размер популяции Sp245, КМ139 и КМ252 снижался в 1.6–3.3 раза (табл. 2). Медь в концентрации 0.001 мМ не оказывала влияния на рост азоспирилл, что позволяет объяснить снижение числа бактерий на корнях растущих проростков миграцией в среду для выращивания растений части адсорбировавшихся клеток (Shelud’ko et al., 2010). Популяция неподвижного мутанта КМ018, обитающая в корневой системе, за 7 сут инкубации оставалась неизменной, что характерно для мутантов штамма Sp245, утративших способность к подвижности при помощи жгутиков (Shelud’ko et al., 2010).
Таблица 2.
Влияние различных концентраций CuSO4 в среде культивирования на численность A. baldaniorum в корневой системе пшеницы, содержание меди в корнях и морфометрические показатели корней
| Штамм | CuSO4 в среде, мМ | Численность бактерий, (КОЕ × 106/растение) |
Корни после 7 дней культивирования | ||||
|---|---|---|---|---|---|---|---|
| сухой вес корневой системы, мг | содержание Cu в корневой системе, мг/г | морфометрические показатели | |||||
| культивирование | разветвленные корни, % | искривленные корневые волоски, % | |||||
| 3 ч | 7 дней | ||||||
| Без бактерий | 0.001 | 0 | 0 | 4.0 ± 0.3 | 0.07 ± 0.008 | 38.9 ± 2.5 | 16.3 ± 1.6 |
| 0.5 | 0 | 3.7 ± 0.4 | 1.4 ± 0.2 | 31.4 ± 2.8 | 17.6 ± 1.5 | ||
| 1.0 | 0 | 3.8 ± 0.3 | 2.0 ± 0.3 | 33.8 ± 5.4 | 17.9 ± 2.0 | ||
| Sp245 | 0.001 | 20.5 ± 2.3 | 12.5 ± 1.7 | 4.2 ± 0.3 | 0.03 ± 0.002 | 60.8 ± 3.0 | 39.3 ± 2.3 |
| 0.5 | 12.9 ± 2.2 | 3.9 ± 0.4 | 1.5 ± 0.1 | 39.3 ± 3.8 | 31.5 ± 3.1 | ||
| 1.0 | 6.6 ± 0.9 | 3.2 ± 0.5 | 2.7 ± 0.2 | 29.4 ± 3.8 | 33.5 ± 3.8 | ||
| KM018 | 0.001 | 1.6 ± 0.2 | 1.4 ± 0.3 | 3.9 ± 0.3 | 0.03 ± 0.001 | 56.5 ± 3.4 | 19.6 ± 2.6 |
| 0.5 | 0.15 ± 0.02 | 3.7 ± 0.5 | 1.4 ± 0.2 | 26.6 ± 2.7 | 19.4 ± 2.4 | ||
| 1.0 | 0.28 ± 0.08 | 3.4 ± 0.5 | 2.1 ± 0.1 | 32.8 ± 5.8 | Н.о. | ||
| KM139 | 0.001 | 4.6 ± 0.8 | 1.4 ± 0.2 | 4.2 ± 0.4 | 0.04 ± 0.008 | 55.1 ± 3.3 | 19.2 ± 2.3 |
| 0.5 | 0.74 ± 0.07 | 3.6 ± 0.4 | 1.4 ± 0.2 | 29.4 ± 4.7 | Н.о. | ||
| 1.0 | 0.1 ± 0.04 | 3.5 ± 0.5 | 2.3 ± 0.1 | 25.5 ± 3.9 | 19.4 ± 2.2 | ||
| KM252 | 0.001 | 7.2 ± 1.1 | 2.4 ± 0.3 | 4.0 ± 0.5 | 0.08 ± 0.02 | 55.2 ± 3.2 | 25.7 ± 1.8 |
| 0.5 | 0.26 ± 0.07 | 3.8 ± 0.3 | 1.3 ± 0.1 | 34.1 ± 5.9 | 24.5 ± 2.2 | ||
| 1.0 | 0.36 ± 0.12 | 3.2 ± 0.5 | 2.3 ± 0.1 | 30.7 ± 4.5 | 26.6 ± 2.4 | ||
В экспериментах in planta концентрация меди, ингибирующая рост азоспирилл в чистой культуре (табл. 1), не оказывала подобного влияния на бактерии (табл. 2). В корневой системе инокулированных штаммом Sp245 растений, инкубированных в присутствии 1.0 мМ CuSO4, количество бактерий лишь в два раза уступало числу клеток, обитающих на корнях в присутствии 0.001 мМ соли (табл. 2). В указанном временном промежутке медь в количестве 0.5 мМ не влияла на численность популяции Sp245 in planta. В случае мутантов при увеличении концентрации ионов меди в среде инкубации с 0.001 до 0.5 или 1.0 мМ численность клеток снижалась на порядок (табл. 2).
Численность бактерий всех штаммов, высеваемых с корней растений после инокуляции, существенно снижалась лишь в случае проростков, инкубированных в присутствии 5 мМ CuSO4. Из корневой системы высевались единичные колонии, вероятно, являющиеся потомками покоящихся форм азоспирилл (Шелудько и соавт., 2020). Концентрация меди 5 мМ ингибировала рост не только бактериальной популяции, но и растений (рис. 1), что позволяет предположить наличие некоторой зависимости жизнеспособности азоспирилл в условиях высокого содержания ионов меди в среде инкубации от физиологического состояния растительного партнера.
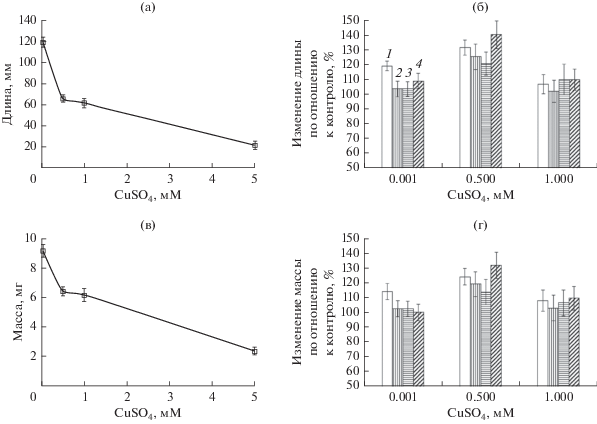
Рис. 1.
Влияние меди на длину (а, б) и массу (в, г) надземных частей 10-дневных проростков пшеницы: стерильные (а, в) и инокулированные (б, г) Sp245 (1), КМ018 (2), КМ139 (3), КМ252 (4) проростки. Контролем (б, г) служили средние значения исследуемых показателей стерильных растений (а, б), выращенных в аналогичных условиях.
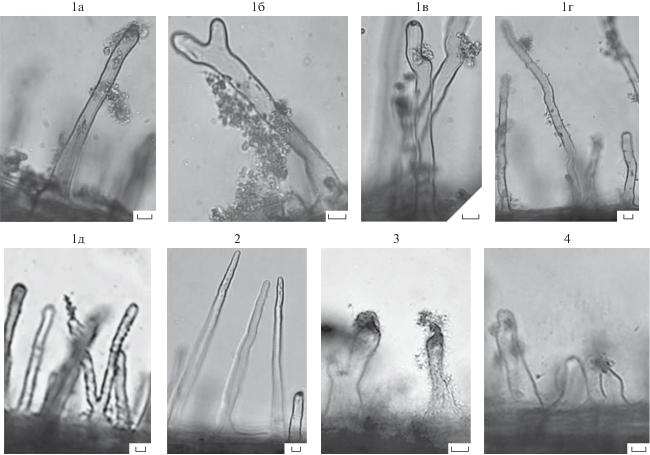
Характеристика биопленок, формируемых азоспириллами. На корневой поверхности биопленки, сформированные азоспириллами к 7-м сут инкубации, располагались преимущественно в зоне всасывания и верхушки корня. Бактериальные скопления наблюдались у мест соединения корневых волосков с поверхностью корня, около кончика корневого волоска, а также встречались корневые волоски, заселенные бактериями вдоль всей поверхности (рис. 2). В присутствии 0.5 и 1.0 мМ меди бактерии предпочитали заселять преимущественно зону корневых волосков, формируя биопленку вдоль корневого волоска. В случае всех исследованных штаммов биопленки были представлены скоплениями агрегатов бактериальных клеток (рис. 2). Образование клеточных агрегатов на корнях растений характерно для азоспирилл (Burdman et al., 1998). Предполагают, что клеточными структурами, определяющими агрегацию, могут быть ЛПС, капсульные полисахариды, экзополисахариды (ЭПС) или белки внешней мембраны бактерий (Burdman et al., 1998; Шелудько и соавт., 2010). Эти структуры клеточной поверхности являются также частью матрикса биопленок азоспирилл, сформированных на абиотических поверхностях (Шелудько и соавт., 2018). Иммунофлуоресцентная микроскопия с антителами на антигены клеточной поверхности показала наличие экспонированных полисахаридных детерминант “планктонных клеток” у азоспирилл, сформировавших биопленки на корнях проростков пшеницы (Шелудько и соавт., 2010).
Рис. 2.
Формирование биопленки A. baldaniorum в зоне всасывания корней 10-дневных проростков пшеницы и влияние бактериальной инокуляции на деформацию корневых волосков: стерильных (2), инокулированных Sp245 (1), КМ018 (3) и КМ252 (4). Концентрация CuSO4: 0.001 (1а– 1в, 2, 3) и 1.0 (1г, 1д, 4) мМ. Масштаб 25 мкм.
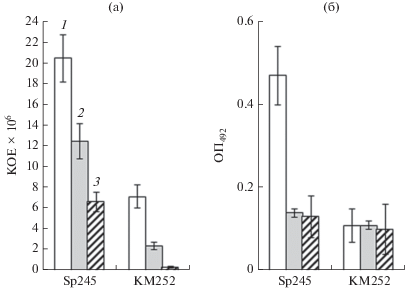
Иммуноферментный анализ и параллельный подсчет КОЕ позволяет отследить возможные изменения в содержании полисахаридных антигенов при адаптации азоспирилл к существованию на корнях растений (Шелудько и соавт., 2010). На примере штаммов Sp245 и KM252 был проведен подобный анализ. На этапе прикрепления бактерий к поверхности корня (3 ч инкубации) подсчет КОЕ в гомогенатах корней и ИФА этих же гомогенатов (рис. 3) свидетельствовал о том, что содержание бактериальных полисахаридов и количество заселивших корни клеток дикого и мутантного штаммов согласуются. Спустя неделю после инокуляции вариации в содержании полисахаридов в случае KM252 отсутствовали, несмотря на снижение численности клеток на корнях (рис. 3). Количество особей штамма Sp245 на корнях в течение недели также снижалось и зависело от концентрации меди в среде (рис. 3, столбцы 2 и 3). Численность клеток штамма Sp245 на корнях в присутствии 0.001 и 1.0 мМ меди различалось на порядок, а содержание полисахаридов оставалось одинаковым (рис. 3). Эти результаты являются косвенным свидетельством того, что при адаптации к корням растений у клеток штамма Sp245 в присутствии 1.0 мМ меди заметно активизировался синтез полисахаридных детерминант. У Cal– LpsI– – мутанта KM252 активация синтеза полисахаридов происходила независимо от присутствия меди.
Рис. 3.
Динамика колонизации корней проростков пшеницы штаммами A. baldaniorum: количество КОЕ в гомогенатах корней (а) и эффективность связывания антител к полисахаридным антигенам Sp245 с гомогенатами корня, определенная с помощью ИФА (б). Трехдневные проростки после 3-часовой инкубации с бактериальной суспензией (1) и проростки через 7 дней после инокуляции (2, 3). Концентрация CuSO4: 0.001 (2) и 1.0 (3) мМ. Горизонтальная ось – штаммы A. baldaniorum.
Мы также наблюдали активацию синтеза ЛПС в биопленках Sp245 и мутантов, сформированных на модельной абиотической поверхности в присутствии меди. Так, отношение показателя, характеризующего содержание ЛПС антигенов в биопленках, сформированных под МСС c 0.001/0.5 мМ CuSO4 в среде (рис. 4), к показателю, характеризующему их биомассу (рис. 4), в случае штаммов Sp245, КМ018 или КМ252 составило, соответственно, 0.7/2.4, 4.8/6.0 или 1.1/2.8.
Рис. 4.
Относительное количество биомассы в биопленках, образованных азоспириллами на полистироле под жидкой МСС за 7 дней культивирования (а), и эффективность связывания биопленкой антител к полисахаридным антигенам Sp245, определенная с помощью ИФА (б). ОП540, кристаллический фиолетовый, экстрагированный из окрашенных биопленок. ОП492, окрашенный продукт ИФА биопленок. Концентрация CuSO4: 0.001 (1) и 0.5 (2) мМ. Горизонтальная ось – штаммы A. baldaniorum.

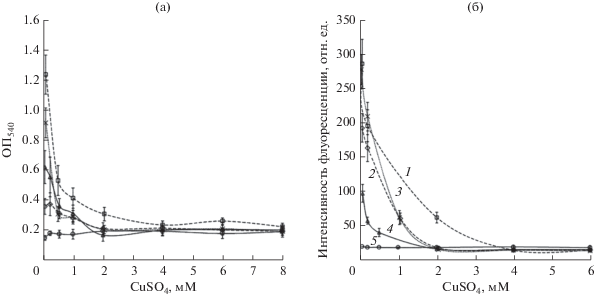
Стоит отметить, что биопленки, сформированные на модельной гидрофобной поверхности мутантными штаммами, уступали по количеству биомассы биопленкам родительского штамма Sp245 (рис. 4а, 5а). Медь в концентрациях, ингибирующих рост жидких планктонных культур (табл. 1), не препятствовала формированию бактериями био-пленок на модельной гидрофобной поверхности (5а). Тем не менее, биомасса биопленок штаммов Sp245, КМ139 и КМ252 в присутствии от 0.5 мМ меди в среде была существенно ниже показателя каждого штамма в контроле, содержащем 0.001 мМ металла (рис. 5а). Биомасса биопленок КМ018 не зависела от этого количества меди в среде (рис. 5а). В присутствии 4.0 мМ CuSO4 штамм Sp245 не образовывал пленку. В случае мутантов КМ018, КМ139 и КМ252 формирование биопленок ингибировалось 2.0 мМ CuSO4 (рис. 5). Респираторная активность биопленок, сформировавшихся в присутствии CuSO4, согласуется с количеством их биомассы (рис. 5).
Рис. 5.
Влияние CuSO4 на относительное количество биомассы (а) в биопленках Sp245 (1), КМ018 (2), КМ139 (3) и КМ252 (4), сформированных за 7 дней культивирования на полистироле под МСС, и респираторную активность клеток в них (б). ОП540, кристаллический фиолетовый, экстрагированный из окрашенных биопленок (а). Интенсивность флуоресценции раствора AlamarBlue после инкубации с биопленками (б). Лунки планшета со стерильной МСС (5).
Влияние меди и инокуляции азоспириллами на морфометрические и морфофизиологические параметры проростков пшеницы. Присутствие азоспирилл в корневой системе проростков пшеницы оказывало влияние на морфологию корневых волосков (табл. 2, рис. 2). Бактерии, продуцирующие полисахариды с разными физико-химическими свойствами, в разной степени способствовали деформации корневых волосков (табл. 2). В условиях высоких концентраций ионов меди число деформированных волосков снижалось, но не столь значительно, как это наблюдалось в случае ветвления корней в корневой системе (табл. 2). Например, увеличение концентрации меди в среде (0.001, 0.5, 1.0 мМ) существенно не влияло на процент деформированных корневых волосков в корневой системе как контрольных растений, так и проростков, инокулированных Sp245, KM018, KM139 или KM252 (табл. 2). Процент разветвленных корней у инокулированных проростков значительно увеличивался (по сравнению со стерильными растениями) только при 0.001 мМ меди (табл. 2). Медь в количестве 0.5 и 1.0 мМ подавляла данный эффект от инокуляции азоспириллами (табл. 2). Способность азоспирилл активировать образование боковых корней во многом обусловлена фитогормонами, вырабатываемыми этими бактериями (Lugtenberg, Kamilova, 2009; Tak et al., 2013), а высокие концентрации меди влияют на продукцию индолил-3-уксусной кислоты (ИУК) этими бактериями (Kamnev et al., 2005).
Содержание меди в корневой системе проростков, выращенных в присутствии 0.5 или 1.0 мМ CuSO4, как минимум на порядок уступало количеству меди в среде инкубации (табл. 2). При культивировании с 0.5 или 1.0 мМ CuSO4 проростки накапливали в корнях 0.02 или 0.03–0.05 мМ меди соответственно (табл. 2; количество меди определяли после пересчета ее содержания в биомассе корней). По-видимому, низкая концентрация меди, содержащаяся в корнях, позволяет бактериям, обитающим в корневой системе, сохранять жизнеспособность в условиях высокого содержания меди во внешней среде.
Инокуляция пшеницы бактериями Sp245 способствовала увеличению размера (на 19%) и веса (на 12%) надземных частей растений (рис. 1) в присутствии 0.001 мМ, а проростки, заселенные KM018 или KM139, не отличались по исследованным параметрам от неинокулированных растений (рис. 1). Лишь в случае инокуляции культурой мутанта KM252 размер надземной части увеличивался на 9%, однако ее вес оставался на уровне контроля. Однако в присутствии 0.5 мМ меди все штаммы оказывали положительное влияние на размер и вес надземных частей растений, которые увеличивались на 20–40 и 14–31% соответственно по сравнению со стерильными растениями (рис. 1). В присутствии 1.0 мМ меди морфометрические и морфофизиологические параметры инокулированных проростков не сильно отличались от таковых у стерильных растений.
Ионы меди в концентрации 5.0 мМ ингибировали рост как стерильных, так и инокулированных проростков пшеницы. В присутствии данной концентрации меди у 10-сут проростков размеры и вес вегетативных органов не отличались от морфометрических показателей 3-сут проростков, использованных для инокуляции. В корневой системе проростков после 7-сут инкубации с 5.0 мМ меди отсутствовали разветвленные корни, как и у трехсуточных.
Анализ численности клеток A. baldaniorum, колонизирующих корни и формирующих биопленки, показал, что эти показатели варьируют в зависимости от способности бактерий к синтезу того или иного Lps. Так, по сравнению с родительским штаммом, мутанты, имеющие отличия в антигенной структуре и заряде ЛПС, хуже колонизировали корни и образовывали на них менее выраженные биопленки. Формирование бактериями A. baldaniorum биопленок способствовало повышению их устойчивости к негативному влиянию ионов меди. Избыток меди в среде инкубации способствует увеличению содержания полисахаридных антигенов в биопленках, сформированных штаммом A. baldaniorum Sp245 и его мутантами с измененным составом гликополимеров in planta и/или на модельной поверхности полистирола. Вполне вероятно, что увеличение количества полисахаридов является одним из механизмов адаптации бактериальных клеток к существованию в условиях загрязнения медью. Полимерные соединения и клетки, аккумулируя ионы меди на периферии биопленки, могут снижать количество ионов, поступающих во внутренние слои пленки.
Адаптации бактерий к существованию в корневой системе растений в условиях высокого содержания меди во внешней среде также способствует слизь, выделяемая растительными клетками, компоненты которой могут связывать ионы металлов (Jing et al., 2007; Tak et al., 2013). Низкая концентрация меди, которую накапливает корневая система пшеницы, как минимум на порядок ниже, чем количество меди, присутствующее в инкубационной среде, что также позволяет бактериям находиться в физиологически активном состоянии in planta.
Мы показали, что штамм A. baldaniorum дикого типа Sp245 оказывал аналогичное положительное влияние на рост стеблей и листьев как в присутствии повышенной (до 0.5 мМ) концентрации ионов меди, так и в присутствии концентрации, которая не оказывала заметного влияния на рост каждого из партнеров (0.001 мМ). Мутанты Sp245, которые, как и родительский штамм, синтезируют ЛПС с пента-D-рамнановым ОПС, но с иной антигенной структурой и зарядом, оказывали положительное влияние на проростки пшеницы только в том случае, если концентрация меди в среде была высокой (0.5 мМ).
Таким образом, не только численность обитающих на растении азоспирилл, но и характеристики их поверхностных полисахаридов могут влиять на ответ проростков пшеницы на бактериальную инокуляцию.
Список литературы
Кацы Е.И., Прилипов А.Г. Инсерционная мутация в гене AZOBR_p60120 сопровождается дефектами в синтезе липополисахарида и связывающих калькофлуор полисахаридов у бактерии Azospirillum brasilense Sp245 // Генетика. 2015. Т. 51. С. 306–311.
Katsy E.I., Prilipov A.G. Insertional mutation in the A-ZOBR_p60120 gene is accompanied by defects in the synthesis of lipopolysaccharide and calcofluor-binding polysaccharides in the bacterium Azospirillum brasilense Sp245 // Russ. J. Genet. 2015. V. 51. P. 306–311.
Матора Л.Ю., Щеголев С.Ю. Антигенная идентичность липополисахаридов, капсулы и экзополисахаридов Azospirillum brasilense // Микробиология. 2002. Т. 71. С. 211–214.
Matora L.Yu., Shchegolev S.Yu. Antigenic identity of the capsule lipopolysaccharides, exopolysaccharides, and O-specific polysaccharides in Azospirillum brasilense // Microbiology (Moscow). 2008. V. P. 178–181.
Шелудько А.В., Кулибякина О.В., Широков А.А., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Влияние мутаций в синтезе липополисахаридов и полисахаридов, связывающих калькофлуор, на формирование биопленок Azospirillum brasilense // Микробиология. 2008. Т. 77. С. 358–363.
Sheludko A.V., Kulibyakina O.V., Shirokov A.A., Petrova L.P., Matora L.Yu., Katsy E.I. The effect of mutations affecting synthesis of lipopolysaccharides and calcofluor-binding polysaccharides on biofilm formation by Azospirillum brasilense // Microbiology (Moscow). 2008. V. 77. P. 313–317.
Шелудько А.В., Широков А.А., Соколова М.К., Соколов О.И., Петрова Л.П., Матора Л.Ю., Кацы Е.И. Колонизация корней пшеницы бактериями Azospirillum brasilense с различной подвижностью // Микробиология. 2010. Т. 79. С. 696–704.
Shelud’ko A.V., Shirokov A.A., Sokolova M.K., Sokolov O.I., Petrova L.P., Matora L.Yu., Katsy E.I. Wheat root colonization by Azospirillum brasilense strains with different motility // Microbiology (Moscow). 2010. V. 79. P. 688–695.
Шелудько А.В., Филипьечева Ю.А., Телешева Е.М., Буров А.М., Евстигнеева С.С., Бурыгин Г.Л., Петрова Л.П. Характеристика углеводсодержащих компонентов биопленок Azospirillum brasilense Sp245 // Микробиология. 2018. Т. 87. С. 483–494.
Shelud’ko A.V., Filip’echeva Y.A., Telesheva E.M., Burov A.M., Evstigneeva S.S., Burygin G.L., Petrova L.P. Characterization of carbohydrate-containing components of Azospirillum brasilense Sp245 biofilms // Microbiology (Moscow). 2018. V. 87. P. 610–620.
Шелудько А.В., Мокеев Д.И., Евстигнеева С.С., Филипьечева Ю.А., Буров А.М., Петрова Л.П., Пономарева Е.Г., Кацы Е.И. Анализ ультраструктуры клеток в составе биопленок бактерий Azospirillum brasilense // Микробиология. 2020. Т. 89. С. 59–73.
Shelud’ko A.V., Mokeev D.I., Evstigneeva S.S., Filip’echeva Yu.A., Burov A.M., Petrova L.P., Ponomareva E.G., Katsy E.I. Cell ultrastructure in biofilms of Azospirillum brasilense // Microbiology (Moscow). 2020. V. 89. P. 50–63.
Abd El-Samad H.M. The biphasic role of cupper and counteraction with Azospirillum brasilense application on growth, metabolities, osmotic pressure and mineral of wheat plant // A-mer. J. Plant Sci. 2017. V. 8. P. 1182–1195.
Baldani V.L.D., Baldani J.I., Döbereiner J. Effects of Azospirillum inoculation on root infection and nitrogen incorporation in wheat // Can. J. Microbiol. 1983. V. 29. P. 924–929.
Burdman S., Jurkevitch E., Schwartsburd B., Hampel M., Okon Y. Aggregation in Azospirillum brasilense: effects of chemical and physical factors and involvement of extracellular components // Microbiology (SGM). 1998. V. 144. P. 1989–1999.
Chang W.C., Hu G.S., Chiang S.M., Su M.C. Heavy metal removal from aqueous solution by wasted biomass from a combined AS-biofilm process // Bioresour. Technol. 2006. V. 97. P. 1503–1508.
Döbereiner J., Day J.M. Associative symbiosis in tropical grass: characterization of microorganisms and dinitrogen fixing sites // Symposium on Nitrogen Fixation / Eds. Newton W.E., Nijmans C.J. Pullman: Washington State University Press, 1976. P. 518–538.
Dos Santos Ferreira N., Sant’Anna F.H., Reis V.M., Ambrosini A., Volpiano C.G., Rothballer M., Schwab S., Baura V.A., Balsanelli E., de Oliveira Pedrosa F., Pereira Passaglia L.M., de Souza E.M., Hartmann A., Cassan F., Zilli J.E. Genome-based reclassification of Azospirillum brasilense Sp245 as the type strain of Azospirillum baldaniorum sp. nov. // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 6203–6212. https://doi.org/10.1099/ijsem.0.004517
Fedonenko Yu.P., Zatonsky G.V., Konnova S.A., Zdorovenko E.L., Ignatov V.V. Structure of the O-specific polysaccharide of the lipopolysaccharide of Azospirillum brasilense Sp245 // Carbohydr. Res. 2002. V. 337. P. 869–872.
Fendrihan S., Constantinescu F., Sicuia O., Dinu S. Azospirillum strains as biofertilizers and and biocontrol agents – a practical review // J. Adv. Agricult. 2017. V. 7. P. 1096–1108.
Fibach-Paldi S., Burdman S., Okon Y. Key physiological properties contributing to rhizosphere adaptation and plant growth promoting abilities of Azospirillum brasilense // FEMS Microbiol. Lett. 2012. V. 326. P. 99–108.
Flemming H.-C., Wingender J. The biofilm matrix // Nat. Rev. Microbiol. 2010. V. 8. P. 623–633.
Jing Y., He Z., Yang X. Role of soil rhizobacteria in phytoremediation of heavy metal contaminated soils // J. Zhejiang Univ. Sci. B. 2007. V. 8. P. 192–207.
Kamnev A.A., Tugarova A.V., Antonyuk L.P., Tarantilis P.A., Polissiou M.G., Gardiner P.H.Y. Effects of heavy metals on plant-associated rhizobacteria: comparison of endophytic and non-endophytic strains of Azospirillum brasilense // J. Trace Elem. Med. Biol. 2005. V. 19. P. 91–95.
Lino A.R., Farinha C.R., Pereira S., Bursakov S.A. Desulfovibrio gigas: toxicity of copper and molybdenum // Metal Ions in Biology and Medicine / Ed. Alpoim M.C. Lisbon: John Libbey Eurotext, 2006. V. 9. P. 231–235.
Lugtenberg B., Kamilova F. Plant-growth-promoting rhizobacteria // Annu. Rev. Microbiol. 2009. V. 63. P. 541–556.
Nies D.H. Microbial heavy-metal resistance // Appl. Microbiol. Biotechnol. 1999. V. 51. P. 730–750.
Nocelli N., Bogino P.C., Banchio E., Giordano W. Roles of extracellular polysaccharides and biofilm formation in heavy metal resistance of rhizobia // Materials. 2016. V. 9. P. 418. https://doi.org/10.3390/ma9060418
O’Toole G.A., Kolter R. Initiation of biofilm formation in Pseudomonas fluorescens WCS365 proceeds via multiple, convergent signalling pathways: a genetic analysis // Mol. Microbiol. 1998. V. 28. P. 449–461.
Petrova L.P., Yevstigneeva S.S., Filip’echeva Yu.A., Shelud’ko A.V., Burygin G.L, Katsy E.I. Plasmid gene for putative integral membrane protein affects formation of lipopolysaccharide and motility in Azospirillum brasilense Sp245 // Folia Microbiol. 2020. V. 65. P. 963–972.
Petrova L.P., Yevstigneeva S.S., Borisov I.V., Shelud’ko A.V., Burygin G.L, Katsy E.I. Plasmid gene AZOBR_p60126 impacts biosynthesis of lipopolysaccharide II and swarming motility in Azospirillum brasilense Sp245 // J. Basic Microbiol. 2020a. V. 60. P. 613–623.
Shelud’ko A.V., Varshalomidze O.E., Petrova L.P., Katsy E.I. Effect of genomic rearrangement on heavy metal tolerance in the plant-growth-promoting rhizobacterium Azospirillum brasilense Sp245 // Folia Microbiol. 2012. V. 57. P. 5–10.
Stoderegger K., Herndl G.J. Production and release of bacterial capsular material and its subsequent utilization by marine bacterioplankton // Limnol. Oceanogr. 1998. V. 43. P. 877–884.
Tak H.I., Ahmad F., Babalola O.O. Advances in the application of plant growth-promoting rhizobacteria in phytoremediation of heavy metals // Rev. Environ. Contam. Toxicol. 2013. V. 223. P. 33–52.
Дополнительные материалы отсутствуют.


