Микробиология, 2021, T. 90, № 4, стр. 430-442
Влияние минеральных соединений азота и метанола на состав метанотрофных накопительных культур из осадка метанового сипа озера Байкал
О. В. Шубенкова a, *, А. С. Захаренко a, Ю. П. Галачьянц a, Г. В. Калмычков b, В. Г. Иванов a, А. В. Хабуев a, Т. В. Погодаева a, С. М. Черницына a, Т. И. Земская a
a Лимнологический институт СО РАН
664033 Иркутск, Россия
b Институт геохимии им. А.П. Виноградова СО РАН
650033 Иркутск, Россия
* E-mail: olya@lin.irk.ru
Поступила в редакцию 21.01.2021
После доработки 16.03.2021
Принята к публикации 17.03.2021
Аннотация
Методом высокопроизводительного секвенирования V2–V3 участка гена 16S рРНК исследовано разнообразие метано- и метилотрофных бактерий при культивировании окисленного слоя донных отложений при температуре 10°С на минеральных средах с соединениями азота (${\text{NO}}_{3}^{ - },$ ${\text{NH}}_{4}^{ + }$) и метанолом. В донном осадке метанотрофы представлены бактериями порядка Methylococcales, с доминированием рода Methylobacter: 6.4 и 4.6% от общего числа последовательностей соответственно. Метилотрофное сообщество состоит из представителей рода Methylotenera (сем. Methylophilaceae). Накопительные культуры, полученные на среде с аммонием и метаном, характеризовались самым высоким разнообразием метанотрофов и содержали 22 ОТЕ семейства Methylococcaceae, девять из которых не были обнаружены в других условиях культивирования. В целом, только 6 из 28 ОТЕ метанотрофных бактерий продемонстрировали сходство с культивируемыми Methylobacter, Metyloglobulus и Methylomicrobium, а остальные показали разную степень сходства (94–99%) с некультивирумыми представителями сем. Methylococcaceae. Присутствие в среде метанола в концентрации 0.01% привело к развитию, в основном, метилотрофных бактерий, а при концентрации метанола в среде 0.5% отмечено угнетение развития метанотрофных бактерий независимо от добавленного источника азота.
Аэробные метанокисляющие бактерии (МОБ) являются уникальной группой микроорганизмов, способных использовать метан в качестве единственного источника углерода и энергии. Это возможно благодаря наличию у них специфической ферментативной системы – метанмонооксигеназ (ММО) (Fox et al., 1989), которaя существуeт в двух формах – растворимой (рММО), локализованной в цитоплазме, и мембранной (мММО), связанной с мембранами. ММО осуществляют первичную атаку молекулы СН4, затем с помощью специализированных ферментов происходит его дальнейшая поэтапная трансформация через образование метанола, формальдегида и формиата в качестве интермедиатов до углекислого газа и воды (Троценко, Хмеленина, 2008).
МОБ потребляют до 80% образующегося в пресноводных и морских экосистемах СН4 (Reeburg, 2007), и являются, таким образом, мощным биологическим фильтром, препятствующим поступлению этого парникового газа в водную толщу и атмосферу. В присутствии кислорода метан окисляется метанотрофными представителями Gamma- (МОБ I типа) и Alphaproteobacteria (МОБ II типа), которые широко распространены в природе (Hanson, Hanson, 1996; Гальченко, 2001), а также некоторыми представителями филума Verrucomicrobia (Op den Camp et al., 2009).
При исследовании природных метанотрофных сообществ показано существенное влияние на их состав и активность температуры, концентрации метана, кислорода и доступности источников азота (He et al., 2012; Crevecoeur et al., 2017). В лабораторных экспериментах отмечено, что тип источника азота оказывает влияние на формирование состава сообществ метанотрофных бактерий (Воробьев, Дедыш, 2008; Tays et al., 2018).
Азот является ключевым регулятором метанотрофии и метилотрофии в ассимиляционном и диссимиляционном метаболизме (Kalyuzhnaya, Xing, 2018). Большинство метанотрофов ассимилируют аммоний и нитрат в качестве источников азота, некоторые представители этой группы обладают способностью связывать N2 (Tays et al., 2018). Из всех типов азотных соединений на сегодняшний день наибольшее внимание привлекает аммоний, поскольку, как полагают, он сильно влияет на активность аэробного окисления метана (Yang et al., 2020). Работы в этой области показали противоречивые результаты: ингибирование процесса окисления метана (Murase, Sugimoto, 2005), отсутствие влияния (Liikanen, Martikainen, 2003), стимуляция процесса (Bodelier et al., 2000). Метан и аммоний имеют структурное сходство, что приводит к конкурентному ингибированию ключевых ферментов окисления метана – метанмонооксигеназ и соокислению аммиака в цитотоксические продукты: гидроксиламин и нитрит (Yang et al., 2020). В работе (Dam et al., 2014) показана дифференциальная экспрессия генов, кодирующих мMMO. Таким образом, влияние аммония на окисление метана в природных экосистемах является сложным процессом и во многом зависит от характеристик экосистемы и окружающей среды in situ.
Как отмечено выше, на начальном этапе процесса окисления метана образуется метанол. В природной среде метанол также может образовываться в результате деградации лигнина и пектина (Троценко, Хмеленина, 2008). Для морских и океанических экосистем с использованием 14C-меченного метанола отмечена высокая микробная ассимиляция углерода метанола в прибрежных апвеллинговых водах (Dixon et al., 2013). Показано, что в лабораторных условиях метанотрофы способны расти в присутствии метанола (Tays et al., 2018), но имеющиеся в литературе данные об отношении облигатных метанотрофов к метанолу, в силу его токсичности, весьма противоречивы (Гальченко, 2001; Tays et al., 2018).
Озеро Байкал является крупнейшим резервуаром ультрапресных поверхностных вод, составляющих около 20% мировых запасов. Как и в других пресноводных озерах, метан является конечным продуктом деструкции органического вещества (Намсараев, Земская, 2000). В последние десятилетия на дне озера обнаружены многочисленные геологические структуры, включая грязевые вулканы, нефтяные и метановые сипы (De Batist et al., 2002; Khlystov et al., 2013). Донные осадки и придонная вода в таких местах характеризуются высоким содержанием метана (Земская и соавт., 2008; Zakharenko et al., 2019) , наличием кислорода, проникающего в осадок на глубину 2–3 см (Martin et al., 1998), а также повышенной минерализацией поровых вод (Погодаева и соавт., 2019). В зонах с повышенными концентрациями метана создаются благоприятные условия для развития метанотрофных бактерий (Kadnikov et al., 2012; Zakharenko et al., 2019). С использованием метагеномного анализа геномов (MAG) в сообществе глубинного слоя водной толщи Южного Байкала выявлена значительная доля метанотрофов I типа. К настоящему времени аннотировано два генома метанотрофов порядка Methylococcales и один – Methyloglobulus sp. Baikal-deep-G142, филогенетически близкий виду Methyloglobulus morosus, но отличающийся от него небольшим размером генома – менее 2.5 Мб (Cabello-Yeves et al., 2020). Наши попытки получения чистой культуры М. morosus из озера Байкал при условиях, указанных для этого вида (Deutzmann et al., 2014), не привели к успешному результату, что, скорее всего, обусловлено особенностью его метаболизма. Однако получение чистых культур метанотрофов из холодноводного озера Байкал остается актуальной задачей.
Целью настоящей работы являлось исследование влияния минеральных источников азота (${\text{NO}}_{3}^{ - },$ ${\text{NH}}_{4}^{ + }$) на разнообразие метанотрофных бактерий при культивировании на средах с метаном и метанолом из окисленного слоя осадка метанового сипа Посольская Банка (Южный Байкал).
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Отбор проб. Образцы окисленного слоя поверхностных донных осадков (0–5 см) были отобраны с помощью грейфера в июле 2015 г с борта НИС “Г.Ю. Верещагин” в районе глубоководной разгрузки метана, расположенной на подводной возвышенности Посольская Банка (Южный Байкал; N 52.03568°, E 105.84337°). Пробы донных осадков для выделения ДНК упаковывали в стерильную фольгу и помещали в жидкий азот до момента их анализа в лаборатории. Поровые воды отжимали непосредственно после отбора проб, химический анализ проводили в ЦКП “Ультрамикроанализ” (ЛИН СО РАН) с помощью жидкостного хроматографа Милихром-А-02 (Россия, Новосибирск) по методикам, описанным ранее (Zemskaya et al., 2010).
Культивирование. Накопительные культуры получали инкубированием образца донного осадка во флаконах объемом 120 мл, содержащих 40 мл жидкой минеральной среды Whittenbury (Whittenbury et al., 1970) следующего состава: раствор № 1 (г/л): MgSO4 – 1.0; СаCl2 – 0.2; комплекс солей железа – 0.004; NH4Cl (KNO3) – 0.5 (1.0); раствор микроэлементов (Кузнецов, Дубинина, 1989); раствор № 2 (г/300 мл): KH2PO4 – 15; Na2HPO4 · · 12H2O – 15. Конечное значение pH среды 7.5. Использовали два варианта среды с разным источником азота: аммонийным (AMS) и нитратным (NMS). В среду вносили 1 см3 пробы донного осадка. В качестве источника углерода в газовую фазу вводили метан 4 об. % (3 ммоль/л). Данные значения соответствуют концентрациям метана в осадках фоновых районов Байкала (Земская и соавт., 2008), а также позволяют производить измерения метана без разбавления образца, избегая большей ошибки (5%). Определение концентраций метана в газовой фазе в экспериментальных флаконах выполняли методом фазово-равновесной дегазации Head–Space Technique (Большаков, Егоров, 1987) на хроматографе “ЭХО–ПИД” (Россия). Первичное измерение концентрации метана во флаконах проводилось непосредственно на НИС “Г.Ю. Верещагин”. В качестве дополнительного источника С1-соединений добавляли метанол в концентрациях, рекомендованных для развития большинства метанотрофов I и II типов, 0.01 и 0.5% соответственно (Гальченко, 2001). Всего исследовали 7 вариантов образцов, перечень которых представлен в табл. 1. Эксперименты проводили в трех повторностях. Для поддержания психрофильных условий культивирование проводили при 10°C в течение 5 недель в стационарных условиях на базе УНУ “Экспериментальный пресноводный аквариумный комплекс байкальских гидробионтов” ЛИН СО РАН. О росте метанотрофных бактерий в экспериментальных культурах судили по убыли метана и образованию пленок.
Таблица 1.
Источники углерода и связанного азота, добавляемые в минеральную среду для культивирования
| Номер образца | Минеральная среда |
Источник азота и углерода в образце |
|---|---|---|
| 1 | AMS | ${\text{NH}}_{4}^{ + }$ + CH4 |
| 2 | AMS | ${\text{NH}}_{4}^{ + }$ + CH4 + CH3OH (0.01%) |
| 3 | AMS | ${\text{NH}}_{4}^{ + }$ + CH4 + CH3OH (0.5%) |
| 4 | NMS | ${\text{NO}}_{3}^{ - }$ + CH4 |
| 5 | NMS | ${\text{NO}}_{3}^{ - }$ + CH4 + CH3OH (0.01%) |
| 6 | NMS | ${\text{NO}}_{3}^{ - }$ + CH4 + CH3OH (0.5%) |
| Без добавления источников азота и углерода | ||
| 7 | – | Нативный осадок |
Выделение ДНК и высокопроизводительное секвенирование. Повторности накопительных культур, в которых отмечалась убыль метана, объединяли для дальнейшего выделения ДНК. Суммарная ДНК из образца нативного донного осадка и экспериментальных накопительных культур была выделена (август 2015 г.), используя метод фенол-хлороформной экстракции (Шубенкова и соавт., 2005). До момента секвенирования (январь 2016 г.) образцы ДНК сохранялась при температуре –70°С. Для ПЦР-амплификации фрагментов гена 16S рРНК бактерий использовали праймеры 16S_BV2f (5'-AGTGGCGGACGGGTGAGTAA-3') и 16S_BV3r (5'-CCGCGGCTGCTGGCAC-3'), специфичные к участкам бактериальной рибосомной РНК, охватывающим гипервариабельную область V2–V3 16S рРНК. Секвенирование проводили на приборе MiSeq в ЦКП “Геномика”, г. Новосибирск.
Биоинформатический анализ. Обработка последовательностей 16S рРНК была выполнена с использованием программного обеспечения Mothur v.1.39.5 (Schloss et al., 2009) в соответствии с рекомендациями MiSeq SOP (Kozich et al., 2013). После фильтрации последовательностей было проведено их выравнивание, кластеризация и таксономическая идентификация с использованием базы данных SILVA 132 (http://www.arb-silva.de). Таксономическую сложность сообществ оценивали путем анализа кривых разрежения, отображающих зависимость числа обнаруженных филотипов от количества анализируемых последовательностей на уровне сходства 97%. Для характеристики молекулярно-генетического разнообразия были рассчитаны количество ОТЕ, Coverage (Chao) и индексы альфаразнообразия Chao1, АСЕ, Shannon, Simpson’s Inverse Index.
Филогенетические деревья были построены с использованием метода объединения ближайших соседей (NJ) с Kimura two-parameters алгоритмом в программе MEGA версия 5.1. Данные, полученные в работе, были депонированы в архив GenBank, секцию SRA, под номерами SRR8224213–SRR8224218.
РЕЗУЛЬТАТЫ
Физико-химическая характеристика исследуемого образца осадка. Изучаемые донные отложения представлены биогенно-терригенными тонкими алевритовыми илами. На границе раздела вода–дно осадки окислены (толщина окисленного слоя около 5 см, Eh = 110 мВ). Содержание кислорода в придонном слое воды составляло 11.5 мг/л, pH 7.78. Осадок был насыщен метаном (536 ммоль/л). Температура поверхностных слоев глубоководных донных осадков постоянная 3.4°С (Голубев, 1981). В поровых водах исследованного слоя осадка ионы аммония и нитрата не выявлены.
Статистический анализ и оценка разнообразия микробного сообщества на основе анализа библиотек генов 16S рРНК. В результате секвенирования фрагментов региона V2–V3 гена 16S рРНК после выравнивания, кластеризации, удаления химер и удаления ОТЕ, содержащих менее 3 последовательностей, было получено 192 074 последовательности со средней длиной 430 п.н. Анализ библиотек ампликонов гена 16S рРНК выявил 830 ОТЕ на уровне сходства 97%. Количество ОТЕ в образцах накопительных культур изменялось от 16 до 336, максимальное количество отмечено в сообществе природного осадка (образец 7) – 488 ОТЕ. Кривые разрежения, построенные для исследуемых библиотек на уровне сходства 97%, выходят на плато.
Индексы видового богатства (ACE, Chao) и видового разнообразия (Shannon и Invsimpson) были максимальными в образце 1. Наименее разнообразно сообщество из образца 6. Степень покрытия изменялась от 99.64% (образец 1) до 99.95% (образец 6).
Разнообразие генов 16S рРНК представителей домена Bacteria в нативном образце донного осадка. В полученной библиотеке генов 16S рРНК поверхностного осадка значительную долю всех последовательностей составляли представители филума Proteobacteria (63.2%) (рис. 1а, 1б). Большая их часть принадлежала классу Gammaproteobacteria (38%), доля представителей порядка Methylococcales составила 6.4%, из них 4.8% принадлежали роду Methylobacter (рис. 1в). Представители рода Metylotenera, являющиеся облигатными метилотрофами, в исходном образце были малочисленны (рис. 1в). Следует отметить, что последовательности Alphaproteobacteria, к которoму относятся МОБ II, в данном образце не обнаружены.
Рис. 1.
Сравнение таксономического состава бактериальных сообществ нативного поверхностного осадка из района метанового сипа Посольская Банка оз. Байкал и сообществ, полученных при культивировании на средах с аммонийным и нитратным источниками азота при различных концентрациях метанола: (а) на уровне филумов, (б) на уровне семейств (протеобактерии), (в) на уровне родов (протеобактерии). Данные анализа фрагментов генов 16S рРНК (S-ILVA 132).
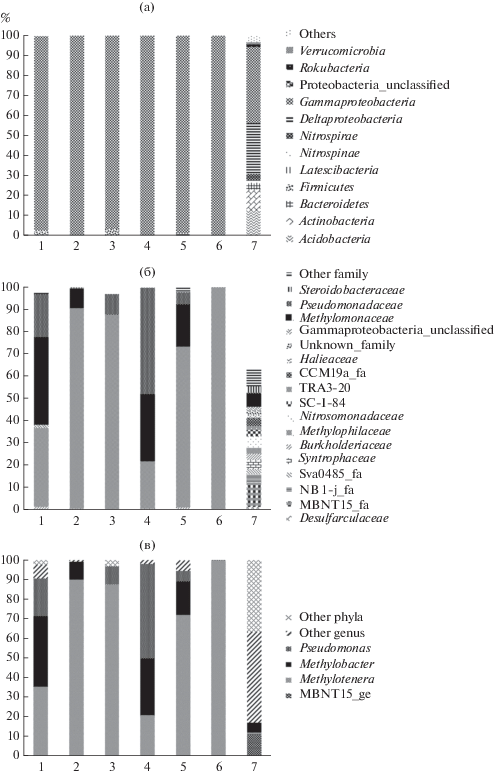
В микробном сообществе исследуемого осадка также выявлены представители Deltaproteobacteria (25.2%), Acidobacteria (12.9%), Actinobacteria (10.1%), Nitrospirae (3.5%), Bacteroidetes (2%), Nitrospinae (1.2%), Rocubacteria (1.2%), Verrucomicrobia (1%); 4.9% составили филы, представленные в минорных количествах (рис. 1а).
Структура и таксономический состав микробного сообщества, полученного в условиях культивирования с различными субстратами. При культивировании на среде с добавлением аммонийного источника азота и метана (в качестве единственного источника углерода) (образец 1) и нитратного азота и метана (образец 4) последовательности филума Proteobacteria составляли основную долю 97.5 и 99.8% соответственно (рис. 1а, 1б). Все они принадлежат классу Gammaproteobacteria. В образце 1 процент представителей порядка Methylococcales выше (39.5%), чем в образце 4 (29.6%). Доля последовательностей, принадлежащих роду Methylotenera, в образце 1 также выше (35.2%), чем в образце 4 (21.1%) (рис. 1в). В образце 1 обнаружено 2.6% последовательностей, принадлежащих неклассифицированным представителям семейства Methylococcaceae (Methylomonaceae) SILVA 132 (http:// www.arb-silva.de).
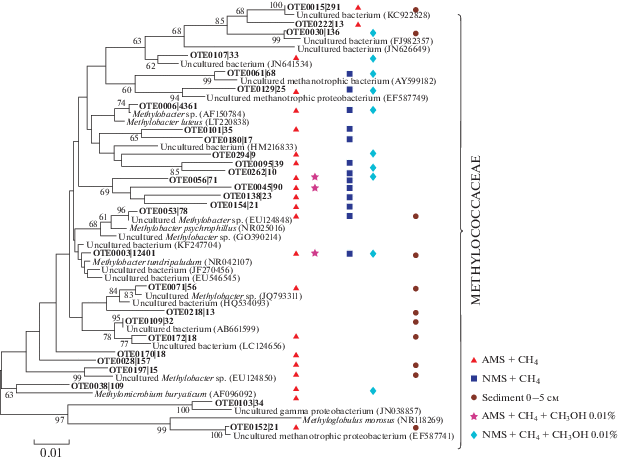
При культивировании на среде с добавлением аммонийного азота, метана и метанола (образец 2) и нитратного азота, метана и метанола (образец 5) в структуре сообщества наблюдалось заметное увеличение доли метилотрофных бактерий. Так в образце 2 лишь 9.2% составляли последовательности порядка Methylococcales, и 89.9% последовательностей принадлежало семейству Methylophilaceae (рис. 1б). В образце 5 процент Methylococcales и Methylophilaceae составил 18.7 и 72.4% соответственно. Также в сообществе на среде с нитратным азотом (образец 5) (рис. 1а) отмечено наличие последовательностей, принадлежащих Deltaproteobacteria (1%), Pseudomonadales (5.4%), и неклассифицированным представителям Methylococcaceae (1.5%). В данных образцах филогенетическое разнообразие метанотрофных бактерий было незначительным, в образце 5 детектировано 10 ОТЕ МОБ, а в образце 2 всего лишь 3 ОТЕ (рис. 2).
Рис. 2.
Филогенетическая дендрограмма, построенная на основе сравнительного анализа нуклеотидных последовательностей генов 16S рРНК (регион V2–V3) метанотрофных бактерий, полученных в ходе данного эксперимента. Использован метод объединения ближайших соседей. Эволюционные расстояния были рассчитаны с использованием метода Kimura 2-parameter (500 альтернативных последовательностей).
Культивирование на средах с содержанием метанола 0.5%, как с добавлением аммонийного азота (образец 3), так и нитратного азота (образец 6) (рис. 1а) привело к полному вытеснению метанотрофов независимо от используемого источника азота в среде. В образце 3 микробное сообщество представлено последовательностями класса Gammaproteobacteria (Betaproteobacteriales 87.6%, Pseudomonadales 9%) и филумом Firmicutes (3.4%). В образце 6 – 99.6% последовательностей принадлежало облигатному метилотрофу рода Methylotenera (рис. 1в).
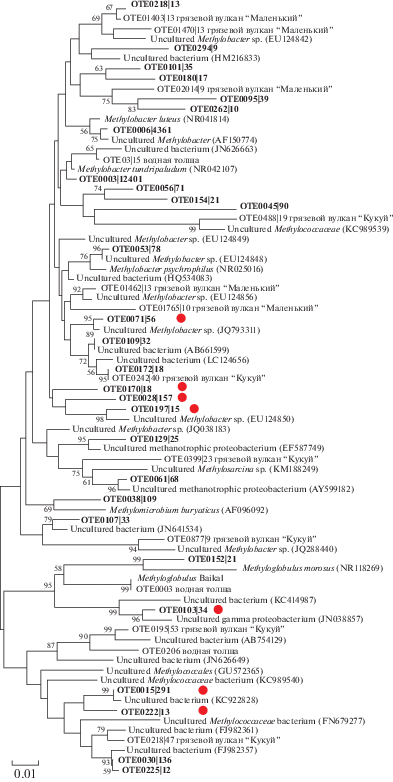
Филогенетический анализ 28 ОТЕ метанотрофных бактерий, полученных для всех 7 образцов, показал, что все последовательности принадлежат семейству Methylococcaceae (тип I) (рис. 2). Следует отметить, что в образце 1, где был использован аммонийный источник азота и метан в качестве единственного источника углерода, развивалось более разнообразное метанотрофное сообщество. При этих условиях культивирования выявлено 22 ОТЕ (рис. 2), причем 9 из них не детектировались в других экспериментальных образцах. Мы также провели сравнение полученных последовательностей с последовательностями метанотрофных бактерий семейства Methylococcaceae, обнаруженных ранее в осадках и водной толще других районов Байкала (рис. 3). Филогенетический анализ показал, что полученные в эксперименте последовательности входят в кластеры байкальских метанотрофов, но 7 из 9 ОТЕ не проявили высокого сходства с байкальскими МОБ и кластеризовались с некультивируемыми Methylococcaceae, выявленными ранее в арктических пресноводных осадках и вечной мерзлоте.
Рис. 3.
Филогенетическая дендрограмма, построенная на основе сравнительного анализа нуклеотидных
последовательностей генов 16S рРНК (регион V2–V3) метанотрофных бактерий, полученных
в ходе данного эксперимента (выделены жирным шрифтом) и метанотрофов, полученных ранее
из осадков других районов оз. Байкал (грязевой вулкан “Маленький”, “Кукуй”) и водной
толщи. Знаком  обозначены последовательности метанотрофных бактерий, которые были выявлены при культивировании
на субстрате ${\text{NH}}_{4}^{ + }$ + CH4, не обнаруживались в условиях культивирования на других субстратах и не проявили
высокой гомологии с последовательностями МОБ других районов оз. Байкал. Использован
метод объединения ближайших соседей. Эволюционные расстояния были рассчитаны с использованием
метода Kimura 2-parameter (500 альтернативных последовательностей).
обозначены последовательности метанотрофных бактерий, которые были выявлены при культивировании
на субстрате ${\text{NH}}_{4}^{ + }$ + CH4, не обнаруживались в условиях культивирования на других субстратах и не проявили
высокой гомологии с последовательностями МОБ других районов оз. Байкал. Использован
метод объединения ближайших соседей. Эволюционные расстояния были рассчитаны с использованием
метода Kimura 2-parameter (500 альтернативных последовательностей).
Только 6 из 28 ОТЕ метанотрофных бактерий, выявленных нами в эксперименте, обнаружили сходство с культивируемыми МОБ (табл. 2): ОТЕ0003 (Methylobacter tundripaludum), ОТЕ0006 (Methylobacter luteus), ОТЕ0180 (Methylobacter marinus), ОТЕ0152 (Metyloglobulus morosus), ОТЕ0053 (Methylobacter psychrophilus) и ОТЕ0038 Methylomicrobium buryaticum). Остальные 22 ОТЕ проявили разную степень идентичности (94–99%) с некультивирумыми представителями рода Methylobacter и некультивирумыми метанотрофными бактериями сем. Methylococcaceae, выявленными в природных образцах пресноводных озер Вашингтон, Констанц, арктического олиготрофного озера Чар, осадков озера Бива. ОТЕ0003 была самой многочисленной (12 401 последовательность), она присутствовала во всех экспериментальных образцах и принадлежала психротолерантному метанотрофу Methylobacter tundripaludum (сходство 99%).
Таблица 2.
Таксономическое разнообразие метанотрофов и метилотрофов в экспериментальных образцах
| Номер ОТЕ/ количество прочтений | Ближайший родственник | Откуда изолирован | Сходство, % |
|---|---|---|---|
| Метанотрофы | |||
| 0003/12401 | Methylobacter tundripaludum SV96T (NR042107) | Арктические болота, Россия | 99 |
| 0006/4361 | Methylobacter luteus (NR041814 ) | Типовой штамм | 99 |
| 0015/291 | Uncultured bacterium (KC922828) | Подземные воды, Канада | 99 |
| 0028/157 | Uncultured Methylobacter sp. (GU108569) | Вода (гл. 145 м), Черное море | 97 |
| 0030/136 | Uncultured bacterium (FJ982357) | Метановый гидротермальный источник, оз. Йеллоустон | 99 |
| 0038/109 | Methylomicrobium buryaticum 5G (AF096092) | Содовое озеро, Тува | 97 |
| 0045/90 | Uncultured Methylobacter (JQ038188) | Заболоченные почвы, Северо-Восточный Китай | 95 |
| 0053/78 | Methylobacter psychrophilus (NR025016) | Типовой штамм | 99 |
| 0056/71 | Methylobacter tundripaludum SV96T (NR042107) | Арктические болота | 97 |
| 0061/68 | Uncultured methanotrophic bacterium (AY599182) | Почва, Австрия | 99 |
| 0071/56 | Uncultured Methylobacter sp. (JQ793311) | Арктические пресноводные осадки | 99 |
| 0095/39 | Uncultured bacterium (HM216833) | Осадки озера Штехлин, Германия | 95 |
| 0101/35 | Uncultured Methylobacter sp. (JQ793045) | Арктическое озеро Чар, Канада | 97 |
| 0103/34 | Uncultured bacterium (KC414987) | Песочный фильтр на водопроводной станции, Китай | 97 |
| 0107/33 | Uncultured bacterium (JN641534) | Осадки, США | 99 |
| 0109/32 | Uncultured bacterium (AB661599) | Осадки оз. Бива, Япония | 100 |
| 0129/25 | Uncultured methanotrophic proteobacterium (EF587749) | Осадки оз. Констанц, Германия | 98 |
| 0138/23 | Uncultured Methylobacter sp. (GQ390214) | Осадки оз. Павин, Франция | 95 |
| 0152/21 | Uncultured methanotrophic proteobacterium (EF587741) | Осадки оз. Констанц, Германия | 99 |
| 0154/21 | Uncultured bacterium (JF270456) | Осадки арктического озера, Аляска | 97 |
| 0170/18 | Uncultured bacterium (KF247704) | Пресноводные осадки болот, Китай | 98 |
| 0172/18 | Uncultured bacterium (LC124656) | Осадки оз. Маруван | 99 |
| 0180/17 | Methylobacter sp. (AF150784) | Осадки оз. Вашингтон | 96 |
| 0197/15 | Methylobacter sp. (EU124850) | Почва, дельта р. Лены, Сибирь | 99 |
| 0218/13 | Uncultured bacterium (HQ534093) | Арктические болота | 98 |
| 0222/13 | Uncultured bacterium (JN626649) | Арктические озера, Аляска | 98 |
| 0262/10 | Methylobacter sp. (AF150784) | Осадки оз. Вашингтон | 97 |
| 0294/9 | Uncultured bacterium (EU546545) | Осадки оз. Вашингтон | 97 |
| Метилотрофы | |||
| 0002/58590 | Uncultured bacterium (LC124528) | Осадки оз. Бива, Япония | 98 |
| 0005/4969 | Uncultured Methylophilaceae bacterium (FN679079) | Осадки оз. Женева, Швейцария |
97 |
| 0007/4264 | Methylotenera sp. (LC368136) | Почва рисового поля, Япония | 99 |
| 0008/3647 | Uncultured bacterium (KC925540) | Осадки реки Уцзян, Китай | 99 |
| 0009/2203 | Methylotenera versatilis (NR074693) | Типовой штамм Methylotenera versatilis 301 | 99 |
| 0036/121 | Uncultured bacterium (KJ424846) | Угленосные осадки, Германия | 99 |
| 0049/85 | Uncultured bacterium (KP098594) | Почва рисового поля, Китай | 97 |
| 0052/78 | Uncultured Methylophilaceae bacterium (JX114343) | Почва, национальный парк, Испания | 96 |
| 0057/69 | Uncultured bacterium (KC922564) | Осадки в зоне разрузки подземных вод, Канада | 98 |
| 0076/50 | Uncultured bacterium (LC124528) | Осадки оз. Бива, Япония | 98 |
| 0083/44 | Uncultured bacterium (KP742409) | Горячий источник, Словакия | 95 |
| 0086/43 | Uncultured bacterium (JF323728) | Осадки оз. Киннерет | 97 |
| 0098/37 | Uncultured bacterium (KT900509) | Сточные воды, Южная Корея | 95 |
| 0130/25 | Uncultured bacterium (KC605970) | Подземная вода, США | 95 |
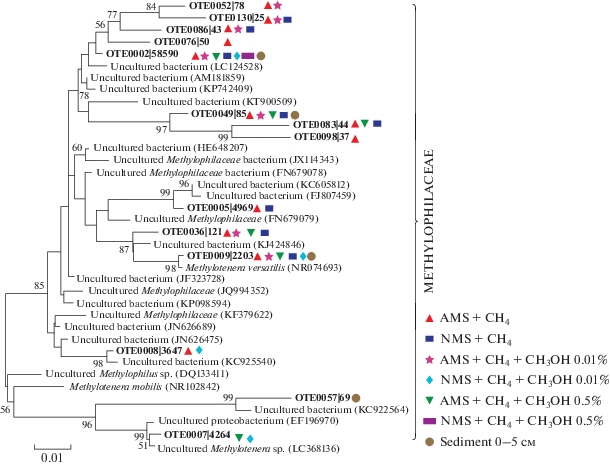
В ходе филогенетического анализа библиотек генов 16S рРНК выявлено 14 ОТЕ метилотрофных бактерий, принадлежащих семейству Methylophilaceae. Следует отметить, что условия, где был использован аммонийный азот и метан в качестве единственного источника углерода (образец 1), также оказались более благоприятными и для развития этой группы микроорганизмов. Из 14 ОТЕ двенадцать было получено при данных условиях (рис. 4). Последовательность только одной ОТЕ принадлежала культивируемому метилотрофу Methylotenera versatilis (сходство 99%), изолированному из пресноводного озера Вашингтон (табл. 2), для остальных 13 ОТЕ ближайшими гомологами были некультивируемые представители Methylophilaceae (95–99% сходства). Самой многочисленной в метилотрофном сообществе была ОТЕ0002, формирующая на филогенетическом дереве отдельную кладу. Последовательности этой ОТЕ на 98% идентичны некультивируемой бактерии, выявленной в осадках озера Бива. ОТЕ0049, 0083, 0098 также формировали кластер с некультивируемой бактерией (KT900509), выявленной в сточных водах (рис. 4).
Рис. 4.
Филогенетическая дендрограмма, построенная на основе сравнительного анализа нуклеотидных последовательностей генов 16S рРНК (регион V2–V3) метилотрофных бактерий, полученных в ходе данного эксперимента. Использован метод объединения ближайших соседей. Эволюционные расстояния были рассчитаны с использованием метода Kimura 2-parameter (500 альтернативных последовательностей).
ОБСУЖДЕНИЕ
Как показано в ряде работ, источники углерода (метана и метанола) и связанного азота (аммония и нитрата) по-разному влияют на физиологию и рост метанокисляющих бактерий (Воробьев, Дедыш, 2008; Nyerges et al., 2009; Tays et al., 2018), что подтверждается и нашими данными. Как показали эксперименты, развитие байкальского метанотрофного сообщества зависело от добавляемых в минеральную среду субстратов. Наиболее разнообразные представители Methylococcaceae отмечались на средах с добавлением достаточно высоких концентраций аммонийного азота (10 мМ), превышающих его содержание в осадках исследуемого района (Pogodaeva et al., 2012; Черницына и соавт., 2016). Тем не менее, это не привело к угнетению развития байкальских МОБ, а напротив, способствовало развитию более широкого спектра ОТЕ.
Известно, что в донных осадках глубоководной зоны озера Байкал концентрации азотных соединений достаточно низки (Muller et al., 2005; Pogodaeva et al., 2017), что предполагает конкуренцию микроорганизмов за их использование. В работе (Lomakina et al., 2018) высказано предположение, что в осадках озера Байкал недостаток нитрат-иона может восполняться благодаря активности архей филума Thaumarchaeota. Аммоний-окисляющие представители этого филума в разных районах оз. Байкал составляли значительную часть от всех архей (до 100% в районах нефтяных сипов, 40% в районах метановых сипов и 20% придонной области глубоководных районов) (Lomakina et al., 2018; Cabello-Yeves et al., 2020). Вполне вероятно, что эта группа архей может быть сопряжена с Methylococcaceae либо в качестве конкурента за аммоний, либо как продуцент нитратов в поверхностных осадках. Следует также учитывать способность метанотрофных бактерий семейства Methylococcaceae к диазотрофии, что может обеспечивать им преимущество перед Thaumarchaeota, позволяя выбирать разные жизненные стратегии в зависимости от доступности азотных соединений.
Следует отметить широкий спектр полученных нами ОТЕ метанотрофных бактерий в пределах сем. Methylococcaceae. Часть из них проявили высокую степень идентичности с M. psychrophilus и M. tundripaludum, другие ОТЕ формировали отдельный кластер. Ранее было показано, что в донных осадках Байкала, где отмечаются высокие концентрации метана, доминировали представители рода Methylobacter (Kadnikov et al., 2012; Zemskaya et al., 2015), а в водной толще при более низких его концентрациях – представители рода Methyloglobulus (Cabello-Yeves et al., 2020). Представители семейства Methylococcaceae имеют широкий ареал обитания, они выявлены в арктических, субарктических озерах и тундровых почвах, где отмечается сезонное изменение температуры, концентраций растворенного кислорода и метана, связанных с динамикой ледяного покрова и оттепели.
Метанотрофные бактерии разных таксономических групп чувствительны к метанолу (Гальченко, 2001; Tays et al., 2018), что подтверждается и нашими результатами. Даже при небольших концентрациях метанола в среде (0.01%) наблюдалось увеличение доли метилотрофных бактерий в сообществах, хотя, согласно Гальченко (2001), данная концентрация благотворно влияет на рост метанотрофных бактерий I типа. Увеличение концентрации метанола до 0.5% привело к полному подавлению развития байкальского метанотрофного сообщества. Биогеохимия метанола и его значение в качестве источника углерода для микроорганизмов озера Байкал не изучены. Ранее метилотрофное сообщество отмечалось при исследовании филогенетического разнообразия гена mxaF в придонной зоне и поверхностных осадках районов разгрузки углеводородов (Zemskaya et al., 2015; Zakharenko et al., 2019). Согласно (Букин и соавт., 2018), в поверхностных осадках с различным химическим составом поровых вод происходит активное образование метана по метилотрофному пути. Таким образом, в этой зоне осадка метанол может активно потребляется аэробными и анаэробными микроорганизмами и не влиять на развитие метанотрофов сем. Methylococcaceae. Можно отметить, что в наших экспериментах метилотрофы принадлежали роду Methylotenera. Представители этого же рода отмечались при изучении in situ окисленных слоев осадков пресноводных водоемов, таких как озеро Вашингтон, арктических и субарктических озер, пресноводных болот вблизи озера Эри (США) с помощью 13СН4 и метагеномного анализа (Kalyuzhnaya et al., 2008; He et al., 2012; Beck et al., 2013). Как показано в этих работах, в сообществах главную роль в ассимиляции С1-соединений выполняют представители облигатных метанотрофов рода Methylobacter (сем. Methylococcaceae) и облигатных метилотрофных представителей рода Methylotenera (сем. Methylophilaceae). Последние являются основными утилизаторами метанола в пресноводном озере Вашингтон (Kalyuzhnaya et al., 2008). Тем не менее, на сегодняшний день характер сотрудничества представителей видов Methylobacter и Methylotenera остается до конца не изученным и требует дальнейших исследований. Есть предположения, что Methylophilaceae могут быть вовлечены в детоксикацию форм азота, к которым чувствительны члены семейства Methylococcaceae (Nyerges, Stein, 2009), либо они вовлекают в свой метаболизм соединения, возникающие в результате лизиса Methylococcaceae (Beck et al., 2013).
Наше исследование свидетельствует о присутствии в поверхностных слоях осадка широкого спектра метанотрофных бактерий, приспособленных к существованию в условиях с широким диапазоном концентраций азотных минеральных соединений, что позволяет им участвовать в окислении метана и ограничивать его поступление из донных осадков в водную толщу озера Байкал.
Список литературы
Большаков А.М., Егоров А.В. Об использовании методики фазоворавновесной дегазации при газометрических исследованиях в акваториях // Океанология. 1987. Т. 37. С. 861–862.
Букин С.В., Павлова О.Н, Калмычков Г.В., Иванов В.Г., Погодаева Т.В., Галачьянц Ю.П., Букин Ю.С., Хабуев А.В., Земская Т.И. Субстратная специфичность метаногенных сообществ из донных отложений оз. Байкал, ассоциированных с разгрузками углеводородных газов // Микробиология. 2018. Т. 87. С. 409–420.
Bukin S.V., Pavlova O.N., Kalmychkov G.V., Ivanov V.G., Pogodaeva T.V., Galachyants Yu.P., Bukin Yu.S., Khabuev A.V., Zemskaya T.I. Substrate specificity of methanogenic communities from Lake Baikal bottom sediments associated with hydrocarbon gas discharge // Microbiology (Moscow). 2018. V. 87. P. 549–558. https://doi.org/10.1134/S0026261718040045
Воробьев А.В., Дедыш С.Н. Использование накопительных культур для оценки структуры сообществ метанотрофов в торфяной почве: проблема репрезентативности результатов // Микробиология. 2008. Т. 77. С. 566–569.
Vorob’ev A.V., Dedysh S.N. Inadequacy of enrichment culture technique for assessing the structure of methanotrophic communities in peat soil // Microbiology (Moscow). 2008. V. 77. P. 504–507.
Гальченко В.Ф. Метанотрофные бактерии. М.: ГЕОС, 2001. 500 с.
Голубев В.А. Температурная структура и статистическая устойчивость придонных вод озера Байкал // Водные ресурсы. 1981. № 6. С. 75–89.
Земская Т.И., Хлыстов О.М., Егоров А.В., Погодаева Т.В., Калмычков Г.В., Шубенкова О.В., Черницына С.М., Воробьева С.С., Грачев М.А. Комплексные исследования проявлений газовых гидратов в осадках грязевых вулканов озера Байкал. Изменение окружающей среды и климата: природные и связанные с ними техногенные катастрофы. М.: ИФЗ РАН, 2008. 268 с.
Кузнецов С.И., Дубинина Г.А. Методы изучения водных микроорганизмов. М.: Наука, 1989. 288 с.
Намсараев Б.Б., Земская Т.И. Микробиологические процессы круговорота углерода в донных осадках озера Байкал. Новосибирск: Издательство СО РАН, филиал “ГЕО”, 2000. 160 с.
Погодаева Т.В., Сыпачев Р.И., Ахманов Г.Г., Хлыстов О.М. Геохимия газонасыщенных флюидов грязевых вулканов и метановых сипов (озеро Байкал) // VIII Межд. научно-практ. конф. “Морские исследования и образование. Maresedu-2019”. Москва, Институт океанологии им. П.П. Ширшова РАН. Тверь: Издание ООО “ПолиПРЕСС”, 2019. Т. 2. С. 71–73.
Троценко Ю.А., Хмеленина В.Н. Экстремальные метанотрофы. Пущино: ОНТИ ПНЦ РАН, 2008. 206 с.
Шубенкова О.В., Земская Т.И., Черницын С.М., Хлыстов О.М., Трибой Т.И. Первые результаты исследования филогенетического разнообразия микроорганизмов осадков Южного Байкала в районе приповерхностного залегания гидратов метана // Микробиология. 2005. Т. 74. С. 370–377.
Shubenkova O.V., Zemskaia T.I., Chernitsyna S.M., Khlystov O.M., Triboy T.I. The first results of an investigation into the phylogenetic diversity of microorganisms in Southern Baikal sediments in the region of subsurface discharge of methane hydrates // Microbiology (Moscow). 2005. V. 74. P. 370–377.
Черницына С.М., Мамаева Е.В., Ломакина А.В., Погодаева Т.В., Галачьянц Ю.П., Букин С.В., Пименов Н.В., Хлыстов О.М., Земская Т.И. Филогенетическое разнообразие микробных сообществ в донных отложениях Посольской банки, оз. Байкал // Микробиология. 2016. Т. 85. С. 652–662.
Chernitsyna S.M., Mamaeva E.V., Lomakina A.V., Pogodaeva T.V., Galach’yants Y.P., Bukin S.V., Khlystov O.M., Zemskaya T.I., Pimenov N.V. Phylogenetic diversity of microbial communities of the Posolsk bank bottom sediment, Lake Baikal // Microbiology (Moscow). 2016. V. 85. P. 672–680. https://doi.org/10.1134/S0026261716060060
Beck D.A.C., Kalyuzhnaya M.G., Malfatti S., Tringe S.G., Glavina del Rio T., Ivanova N., Lidstrom M.E., Chistoserdova L. A metagenomic insight into freshwater methane-utilizing communities and evidence for cooperation between the Methylococcaceae and the Methylophilaceae // PeerJ. 2013. V. 1. e23–e23. https://doi.org/10.7717/peerj.23
Bodelier P.L.E., Roslev P., Henckel T., Frenzel P. Stimulation by ammonium-based fertilizers of methane oxidation in soil around rice roots // Nature. 2000. V. 403. P. 421–424. https://doi.org/10.1038/35000193
Cabello-Yeves P.J., Zemskaya T.I., Zakharenko A.S., Sakirko M.V., Ivanov V.G., Ghai R., Rodriguez-Valera F. Microbiome of the deep Lake Baikal, a unique oxic bathypelagic habitat // Limnol. Oceanogr. 2020. V. 65. P. 1471–1488. https://doi.org/10.1002/lno.11401
Crevecoeur S., Vincent W.F, Comte J., Matveev A., Lovejoy C. Diversity and potential activity of methanotrophs in high methane-emitting permafrost thaw ponds // PLoS One. 2017. V. 12. P. 1–22. https://doi.org/10.1371/journal.pone.0188223
Dam B., Dam S., Kim Y., Liesack W. Ammonium induces differential expression of methane and nitrogen metabolism-related genes in Methylocystis sp. strain SC2 // Environ. Microbiol. 2014. V. 16. P. 3115–3127. https://doi.org/10.1111/1462-2920.12367
De Batist M., Klerkx J., Rensbergen V., Vanneste M., Poort J., Golmshtok A.Y., Kremlev A., Khlystov O.M., Krinitsky P. Active Hydrate Destabilisation in Lake Baikal, Siberia // Terra Nova. 2002. V. 14. P. 436–442. https://doi.org/10.1130/0091-7613(2002)030<0631:SMVAMS> 2.0.CO;2
Deutzmann J.S., Hoppert M., Schink B. Characterization and phylogeny of a novel methanotroph, Methyloglobulus morosus gen. nov., spec. nov. // Syst. Appl. Microbiol. 2014. V. 37. P. 165–169. https://doi.org/10.1016/j.syapm.2014.02.001
Dixon J.L., Sargeant S., Nightingale P.D., Murrell J.C. Gradients in microbial methanol uptake: productive coastal upwelling waters to oligotrophic gyres in the Atlantic Ocean // Int. Soc. Microb. Ecol. 2013. V. 7. P. 568–580. https://doi.org/10.1038/ismej.2012.130
Fox B.G., Froland J.E., Dege J., Lipscomb J.D. Methane monooxygenase from Methylosimis trichosporiwn OB3b: Purification and properties of a three component system with high specific activity from a type II methanotroph // J. Biol. Chem. 1989. V. 264. P. 10023–10033.
Hanson R., Hanson T. Methanotrophic Bacteria // Microbiol. Rev. 1996. V. 60. P. 439–471.
He R., Wooller M., Pohlman J., Catranis C., Quensen J., Tiedje J., Leigh M. Identification of functionally active aerobic methanotrophs in sediments from an Arctic lake using stable isotope probing // Environ. Microbiol. 2012. V. 14. P. 1403–1419. https://doi.org/10.1111/j.1462-2920.2012.02725.x
Kadnikov V.V., Mardanov A.B., Beletsky A.V., Shubenkova O.V., Pogodaeva T.N., Zemskaya T.I., Ravin N.V., Skryabin K.G. Microbial community structure in methane hydrate-bearing sediments of freshwater Lake Baikal // FEMS Microbiol. Ecol. 2012. V. 79. P. 348–358. https://doi.org/10.1111/j.1574-6941.2011.01221.x
Kalyuzhnaya M.G., Lapidus A., Ivanova N., Copeland A.C., McHardy A.C., Szeto E., Salamov A., Grigoriev I.V., Suciu D., Levine S.R., Markowitz V.M., Rigoutsos I., Tringe S.G., Bruce D.C., Richardson P.M., Lidstrom M.E., Chistoserdova L. High-resolution metagenomics targets specific functional types in complex microbial communities // Nature Biotechnol. 2008. V. 26. P. 1029–1034.
Kalyuzhnaya M.G., Xing X.H. Methane Biocatalysis: Paving the Way to Sustainability. 2018. 312 p. https://doi.org/10.1038/nbt.1488
Khlystov O., De Batist M., Shoji H., Hachikubo A., Nishio S., Naudts L., Poort J., Khabuev A., Belousov O., Manakov A., Kalmychkov G. Gas hydrate of Lake Baikal: Discovery and varieties // J. Asian Earth Sci. 2013. V. 62. P. 162–166. https://doi.org/10.1016/j.jseaes.2012.03.009
Kozich J.J., Westcott S.L., Baxter N.T., Highlander S.K., Schloss P.D. Development of a dual-index sequencing strategy and curation pipeline for analyzing amplicon sequence data on the MiSeq Illumina sequencing platform // Appl. Environ. Microbiol. 2013. V. 79. P. 5112–5120. https://doi.org/10.1128/AEM.01043-13
Liikanen A., Martikainen P.J. Effect of ammonium and oxygen on methane and nitrous oxide fluxes across sediment–water interface in a eutrophic lake // Chemosphere. 2003. V. 52. P. 1287–1293.
Lomakina A., Mamaeva E., Pogodaeva T., Kalmychkov G., Khalzov I., Zemskaya T. Anaerobic methane oxidation in enrichment cultures from deep sediments of a mud volcano Peschanka (South Baikal) // Microbiology (Moscow). 2018. V.87. P. 317–325. https://doi.org/10.1134/S0026261718030049
Martin P., Granina L.Z., Martens K., Goddeeris B. Oxygen concentration profiles in sediments of two ancient lakes: Lake Baikal (Siberia, Russia) and Lake Malawi (East Africa) // Hydrobiologia. 1998. V. 367. P. 163–174.
Muller B., Maerki M., Schmid M., Vologina E.G., Wehrli B., Wuest A., Sturm M. Internal carbon and nutrient cycling in Lake Baikal: sedimentation, upwelling, and early diagenesis // Global Planet. Change. 2005. V. 46. P. 101–124.
Murase J., Sugimoto A. Inhibitory effect of light on methane oxidation in the pelagic water column of a mesotrophic lake (Lake Biwa, Japan) // Limnol. Oceanogr. 2005. V. 50. P. 1339–1343.
Nyerges G., Stein L.Y. Ammonia cometabolism and product inhibition vary considerably among species of methanotrophic bacteria // FEMS Microbiol. Lett. 2009. V. 297. P. 131–136. https://doi.org/10.1111/j.1574-6968.2009.01674.x
Op den Camp H., Islam T., Stott M., Harhangi H., Hynes A., Schouten S., Jetten M., Birkeland N., Pol A., Dunfield P. Minireview: Environmental, genomic, and taxonomic perspectives on methanotrophic Verrucomicrobia // Environ. Microbiol. Rep. 2009. V. 1. P. 293–306.
Pogodaeva T.V., Lopatina I.N., Khlystov O.M., Egorov A.V., Zemskaya T.I. Background composition of pore waters in Lake Baikal bottom sediments // J. Great Lakes Res. 2017. V. 43. P. 1030–1043. https://doi.org/10.1016/j.jglr.2017.09.003
Pogodaeva T.V., Zemskaya T.I., Khlystov O.M. Preliminary estimate of dissolved components flowing through water-bottom interfase at sites of oil and gas discharge in Lake Baikal // The 11th Conference of Gas in Marine Sediments. Nice, 2012. P. 74.
Reeburgh W.S. Oceanic methane biogeochemistry // Chem. Rev. 2007. V. 107. P. 486–513.
Schloss P.D., Westcott S.L., Ryabin T., Hall J.R., Hartmann M., Hollister E.B., Lesniewski R. A., Oakley B.B., Parks D.H., Robinson C.J., Sahl J.W., Stres B., Thallinger G.G., Van orn D.J., Weber C.F. Introducing mothur: open-source, platform-independent, community-supported software for describing and comparing microbial communities // Appl. Environ. Microbiol. 2009. V. 75. P. 7537–7541. https://doi.org/10.1128/AEM.01541-09
Tays C., Guarnieri M.T., Sauvageau D., Stein L.Y. Combined effects of carbon and nitrogen source to optimize growth of proteobacterial methanotrophs // Front. Microbiol. 2018. V. 9. P. 1–14. https://doi.org/10.3389/fmicb.2018.02239
Whittenbury R., Philips K., Wilkinson J. Enrichment isolation and some properties of methaneutilizing bacteria // Ibid. 1970. V. 61. P. 205–218.
Yang Y., Tong T., Chen J., Liu Y., Xie S. Ammonium impacts methane oxidation and methanotrophic community in freshwater sediment // Front. Bioeng. Biotechnol. 2020. V. 20. P. 1–11. https://doi.org/10.3389/fbioe.2020.00250
Zakharenko A.S., Galachyants Y.P., Morozov I.V., Shubenkova O.V., Morozov A.A., Ivanov V.G., Pimenov N.V., Krasnopeev A.Y., Zemskaya T.I. Bacterial communities in areas of oil and methane seeps in pelagic of Lake Baikal // Microb. Ecol. 2019. V. 78. P. 269–285. https://doi.org/10.1007/s00248-018-1299-5
Zemskaya T.I., Lomakina A.V., Shubenkova O.V., Pogodaeva T.V., Morozov I.V., Chernitsina S.M., Sitnikova T.Ya., Khlystov O.M., Egorov A.V. Jelly-like microbial mats over subsurface fields of gas hydrates at the St. Petersburg methane seep (Central Baikal) // Geomicrobiol. J. 2015. V. 32. P. 89–100. https://doi.org/10.1080/01400451.2014.910572
Zemskaya T.I., Pogodaeva T.V., Shubenkova O.V., Chernitsina S.M., Dagurova O.P., Buryukhaev S.P., Namsaraev B.B., Khlystov O.M., Egorov A.V., Krylov A.A., Kalmychkov G.V. Geochemical and microbiological characteristics of sediments near the Malenky mud volcano (Lake Baikal, Russia), with evidence of Archaea intermediate between the marine anaerobic methanotrophs ANME-2 and ANME-3 // Geo-Mar. Lett. 2010. V. 30. P. 411–425. https://doi.org/10.1007/s00367-010-0199-6
Дополнительные материалы отсутствуют.


