Микробиология, 2021, T. 90, № 4, стр. 480-491
Особенности дрожжевых сообществ, ассоциированных с термитами тропического муссонного леса: национальный парк Кат Тьен, Вьетнам
А. И. Зуева a, *, А. В. Качалкин b, c, И. А. Максимова b, Нгуен Ван Тхинь d, А. В. Тиунов a
a Институт проблем экологии и эволюции им. А.Н. Северцова РАН
119071 Москва, Россия
b Факультет почвоведения МГУ им. М.В. Ломоносова
119991 Москва, Россия
c Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина РАН
142290 Пущино, Россия
d Российско-Вьетнамский тропический научно-исследовательский и технологический центр
Хошимин, Вьетнам
* E-mail: aizueva.ecologist@gmail.com
Поступила в редакцию 25.02.2021
После доработки 12.03.2021
Принята к публикации 15.03.2021
Аннотация
Исследовано дрожжевое население субстратов, связанных с термитниками пяти видов термитов, распространенных на территории национального парка Кат Тьен (южный Вьетнам): стенок гнезда, грибных садов (при их наличии), кишечника и поверхности тела термитов, а также листового опада и верхних горизонтов почвы вблизи термитников. Проанализированы морфо-физиологические особенности выделенных из ассоциаций с термитами дрожжей. Выделенные грибы с дрожжевым ростом отнесены к 39 видам, из которых 10 не были описаны на момент проведения исследования. Сообщества дрожжей, формирующиеся на поверхности тел и в кишечнике термитов, характеризуются низким видовым разнообразием. Для дрожжевых грибов, выделенных из кишечника и с поверхности тел термитов, характерен относительно широкий спектр морфологических и физиологических свойств (от 24 до 33 показателей из 34 пунктов стандартного описания), среди наиболее общих свойств можно отметить наличие структур мицелиального роста, способность сбраживать глюкозу, потреблять в качестве источника питания растительные гликозиды (салицин) и простые продукты разрушения древесины (ксилозу и целлобиозу).
Биогенные структуры, возведенные и населенные почвенными беспозвоночными, оказывают влияние на плотность и видовой состав микробного населения почвы. Например, состав микромицетов и обилие бактерий в муравейниках значительно отличается от такового в контрольных образцах почвы (Чурилина и соавт., 2017), а деятельность норных дождевых червей изменяет таксономический состав дрожжевого населения растительных субстратов (Юрков и соавт., 2008).
Разнообразные субстраты, связанные с деятельностью беспозвоночных (древесина, разрушенная ксилофагами, цветки энтомофильных растений и т.д.), часто заселены специфическими сообществами дрожжевых грибов. Известны факты симбиоза насекомых и дрожжей; экспериментальное удаление дрожжевых симбионтов приводит к нарушениям роста и развития беспозвоночных-хозяев. Кроме того, многие насекомые (опылители, плодовые мушки) активно распространяют дрожжевые грибы (Чернов, 2013). Дрожжи обнаруживаются в гнездах насекомых, иногда даже если дрожжевые симбионты не выделяются из пищеварительного тракта беспозвоночных (Ganter, 2006). Таким образом, дрожжевые грибы присутствуют в микробных сообществах, ассоциированных с насекомыми, как в качестве постоянного симбиотического компонента, так и в роли временного или случайно привнесенного элемента микробного населения.
Одними из самых значимых разрушителей древесины и других растительных остатков, а также агентами изменения физических свойств почвы в тропических районах являются термиты (Ganter, 2006; Blackwell, 2017). Большинство исследований дрожжей, ассоциированных с термитами, фокусировались на кишечных симбионтах; особенности дрожжевого населения гнезд термитов, поверхности тел насекомых, а также субстратов, с которыми они взаимодействуют, изучались реже (Ganter, 2006).
Целью работы стало исследование дрожжевых сообществ, ассоциированных с термитами, в условиях тропического муссонного леса. Мы предполагали, что из-за активной деятельности термитов, преобразующей их местообитания, особенностей их поведения и выделяемых ими веществ (Guedegbe et al., 2009) дрожжевое население термитников и самих насекомых отличается от сообществ фоновых субстратов как по таксономическому составу дрожжей, так и по их морфо-физиологическим свойствам.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Образцы для исследования отбирали в ноябре 2018 года на равнинной территории национального парка Кат Тьен (Вьетнам). Среднегодовая температура около 26.4°С, с самым холодным периодом в январе (в среднем 24–25°С) и самым теплым в апреле (28°С). Годовое поступление осадков составляет около 2500 мм (Дещеревская и соавт., 2013). Отбор материала производили на двух модельных площадках – “Лагерстремия” и “Фикус”. Почвы обеих площадок классифицируются как темноцветные глинистые на базальтовых отложениях или Skeletic Greyzemic Umbrisols (Clayic). “Лагерстремия” (11°25′43′′ с.ш., 107°25′39′′ в.д.) – сравнительно ровная площадка с незначительным уклоном к северу. Первый подъярус лесного полога составляет Lagerstroemia calyculata; присутствует также Tetrameles nudiflora. Поверхность почвы покрыта в основном листьями, корой и ветками L. calyculata. “Фикус” (11°26′06′′ с.ш., 107°25′26′′ в.д.) – ровная площадка, расположенная под пологом одного дерева Ficus sp. Присутствуют также L. calyculata, Dalbergia multiflora, одиночные одревесневающие лианы. Опад состоит из листьев Ficus sp., L. calyculata, D. multiflora (Хохлова и соавт., 2017).
На площадках исследованы термитники пяти распространенных на территории национального парка видов термитов: Globitermes sulphureus (Haviland), Microcerotermes burmanicus Ahmad (=M. crassus Snyder), Macrotermes carbonarius (Hagen), Macrotermes gilvus (Hagen) и Odontotermes sp. (Беляева, Тиунов, 2010). Два первых вида относятся к подсемейству Amitermitinae, питаются древесиной, не выращивают грибные сады и могут быть вредителями построек и культурных растений (Lee et al., 2003; Wong, Lee, 2010). Три другие вида из подсемейства Macrotermitinae питаются преимущественно веточным и листовым опадом и выращивают грибные сады (Yamada et al., 2005).
На площадках были отобраны образцы структур термитников (стенки гнезда и грибные сады при их наличии), представители двух каст термитов (рабочие и солдаты), а также опад и почва вблизи гнезд. Образцы почвы и опада хранились и транспортировались в лабораторию в стерильных бумажных пакетах. Некоторые насекомые (часть солдат и рабочих M. gilvus и G. sulphureus, часть солдат M. carbonarius, рабочие M. burmanicus) были высушены при температуре 26–28°С и также хранились в стерильных пакетах. Живые насекомые (рабочие и солдаты M. carbonarius, M. gilvus, Odontotermes sp.) содержались и транспортировались в пластиковых контейнерах и препарировались непосредственно в день прибытия в лабораторию.
Микробиологический анализ проводили в лабораторных условиях. Из всех субстратов были приготовлены суспензии с разным разведением: для опада – 1 : 20, для почвы – 1 : 10, для стенок термитников – 1 : 10, для грибных садов – 1 : 20. Из каждого образца готовили 2 навески, затем в пробирках со стерильной водой готовили суспензии, соответствующие выбранному разведению: материал помещали в пробирку типа фалькон со стерильной водой и встряхивали на вортексе Multi Reax (“Heidoiph GmbH”, Германия) в режиме 1700 об./мин в течение 15 мин. Каждая суспензия была посеяна на чашки Петри в объеме 50 мкл в двух повторностях, в качестве питательной среды был использован глюкозо-пептонно-дрожжевой агар (ГПДА) (Максимова, Чернов, 2006).
Для приготовления смывов с поверхности тел и суспензий из кишечников термитов насекомых (от 3 до 19 особей, в зависимости от размера и числа насекомых, имеющихся в распоряжении) помещали в пробирки с 300 мкл стерильной воды и также встряхивали на вортексе. Полученную жидкость рассевали в трех повторностях, нанося на чашку Петри с ГПДА 50 мкл суспензии. После выполнения посева термитов извлекали из пробирки и промывали этиловым спиртом. Далее из насекомых с помощью пинцета извлекали кишечник, помещали его в стерильную воду и прокалывали, после чего встряхивали на вортексе. Обработанных спиртом высушенных термитов также помещали в стерильную воду и измельчали стерильной препаровальной иглой, после чего пробирка встряхивалась на вортексе. Полученные из высушенных насекомых препараты считали пригодными для выделения дрожжей из кишечника термитов, так как ранее подобный метод подготовки образцов успешно использовался в исследованиях микроорганизмов – потенциальных внутренних симбионтов насекомых (Hammer et al., 2015). Суспензию рассевали в трех повторностях. Микробиологические посевы выполняли методом Дригальского (Максимова, Чернов, 2006).
Чашки инкубировали при комнатной температуре от 4 до 9 сут. Сформировавшиеся за время инкубирования микробиологических посевов дрожжевые колонии подсчитывали (число КОЕ на 1 г веса сухого субстрата или на особь) и выделяли в чистую культуру. Штаммы были промикроскопированы и сгруппированы по морфологическим признакам (Максимова, Чернов, 2006). Всего было исследовано 44 образца; в 23 образцах грибы с дрожжевым ростом не были обнаружены.
Видовую идентификацию представителей каждого морфологического типа выделенных дрожжей проводили анализом последовательностей нуклеотидов ITS1−5.8S−ITS2 участка и/или D1/D2 доменов 26S (LSU) рДНК. Амплификацию рассматриваемых участков рДНК проводили с использованием праймеров ITS1f (5'-CTTGGTCATTTAGAGGAAGTA) и NL4 (5'-GGTCCGTGTTTCAAGACGG) (Глушакова и соавт., 2015). В отдельных случаях, когда реакция с данными праймерами не протекала или количество конечного продукта оказывалось недостаточным, амплификация проводилась повторно с применением вместо NL4 праймера ITS4-B (5'-CAGGAGACTTGTACACGGTCCAG) или ITS4 (5'-TCCTCCGCTTATTGATATGC) (Gardes, Bruns, 1993). Амплификация была выполнена с использованием оборудования ЦКП “Инструментальные методы в экологии” при Институте проблем экологии и эволюции им. А.Н. Северцова РАН. Секвенирование ПЦР-продуктов проводили в научно-производственной компании “Синтол” (Россия). Идентификацию до вида производили, используя данные генбанка NCBI (ncbi.nlm.nih.gov). Видовую принадлежность 5 штаммов из-за недостаточного количества биомассы и утраты культурами жизнеспособности определить не удалось.
Обработка и интерпретация данных. Для выделенных видов дрожжей было рассчитано относительное обилие в разных субстратах; виды, составлявшие около 20−50% и более дрожжевых сообществ исследованных образцов, рассматривались в качестве потенциальных доминантов (Чернов, 2013). По полученному массиву данных была проведена иерархическая кластеризация местообитаний (hierarchic clustering) методом средней связи (average linkage) (vegan) (r-project.org). Для субстратов был также рассчитан индекс Шеннона.
Для более полной экологической характеристики комплексов дрожжей, связанных с термитами, были исследованы их физиологические и некоторые морфологические особенности. Изучалось наличие или отсутствие у видов дрожжевых грибов способности сбраживать глюкозу, формировать мицелий или псевдомицелий, ассимилировать D-галактозу, D-глюкозу, L-сорбозу, L-арабинозу, D-арабинозу, L-рамнозу, D-ксилозу, лактозу, мальтозу, мелецитозу, мелибиозу, раффинозу, сахарозу, трегалозу, целлобиозу, инулин, растворимый крахмал, D-глюцитол, D-маннитол, глицерол, дульцит, инозитол, рибит, эритритол, этанол, α-метил-D-глюкозид, салицин, DL-лактат, цитрат, нитрат, расти при температурах 28 и 37°C – всего 34 показателя, входящих в стандартное описание видов дрожжей (Kurtzman et al., 2011). Информация о морфо-физиологических особенностях описанных видов дрожжей была получена из базы данных MycoBank (mycobank.org), определителя дрожжевых грибов (Kurtzman et al., 2011) и других работ об известных видах дрожжей (Thanh et al., 2006; Landell et al., 2014; Surussawadee et al., 2014; Liu et al., 2015; Surussawadee et al., 2015; Yurkov et al., 2015; Into et al., 2018). Были также проведены дополнительные физиологические тесты (согласно указанным в работе Максимова, Чернов, 2006) для 6 видов, не описанных на момент исследования, штаммы которых сохранили физиологическую активность и были пригодны для повторного посева.
По результатам анализа литературных и собственных данных была составлена бинарная матрица. На ее основании было произведено распределение видов по кластерам методом k-средних (k-means clustering) (программные пакеты “tidyverse”; “factoextra”; “cluster”). Число кластеров выбирали с помощью методов среднего силуэта (average silhouette method) (программный пакет “factoextra”) и статистики разрыва (gap statistic method) (программный пакет “cluster”). Из этого анализа были исключены грибы, не являющиеся истинными дрожжами (Acremonium sp., Aureobasidium thailandense, Verhulstia sp.), и виды, для которых не удалось произвести анализ физиологических свойств, так как соответствующие штаммы утратили жизнеспособность (Teunia sp., Papiliotrema sp., Saitozyma sp., Tremella sp.). По результатам тестов было визуализировано положение видов в поле морфо-физиологических свойств методом главных компонент с помощью функций princomp и biplot (программный пакет “vegan”). Затем для исследованных местообитаний была составлена бинарная матрица с информацией о наличии/отсутствии представителей выделенных “морфо-физиологических” кластеров в каждом субстрате. По полученному массиву данных сходные образцы были распределены по группам методом k-средних. Оптимальное число групп выбирали с помощью методов среднего силуэта и статистики разрыва. Для визуализации групп была применена функция fviz_cluster, использующая главные компоненты (программный пакет “factoextra”). Все статистические анализы и сравнения произведены в программной среде R (r-project.org).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Среднее количество дрожжей, обнаруженных в листовом опаде с двух площадок, варьировало от 1.4 × 103 до 3.8 × 104 КОЕ/г субстрата. В почве обнаружено от 1.8 × 102 до 2.0 × 102 дрожжевых КОЕ/г. Число колониеобразующих единиц в образцах стенок термитников находилось в диапазоне от 2.5 × 10 (площадка “Лагерстремия”, стенки термитника M. gilvus) до 2.2 × 103 (площадка “Лагерстремия”, стенки термитника M. carbonarius) на 1 г субстрата.
Среднее число дрожжевых колониеобразующих единиц, выделенных с поверхности тел рабочих термитов, было крайне низким и составило от 3 до 9 на особь. Кишечники рабочих содержали от 1 до 5 дрожжевых КОЕ/особь. В смывах с солдат обнаруживалось от 5 до 49 КОЕ/особь.
Всего было выделено 39 видов грибов с дрожжевым ростом (в том числе 10 ранее не описанных видов), относящихся к 13 аскомицетовым и 9 базидиомицетовым родам. Полученные нуклеотидные последовательности обнаруженных видов были депонированы в генбанк NCBI (MW325297— MW325342) (табл. 1).
Таблица 1.
Список обнаруженных грибов с дрожжевым ростом
| Род | Вид | Номер сиквенса в GenBank |
|---|---|---|
| Acremonium | Acremonium sp.* | MW325297 |
| Aureobasidium | Aureobasidium thailandense S.W. Peterson, Manitchotpisit & Leathers (2013) | MW325298 |
| Barnettozyma | Barnettozyma siamensis Polburee & Limtong (2014) | MW325299 |
| Blastobotrys | Blastobotrys capitulata de Hoog, Rantio-Lehtimäki & M.Th. Smith (1985) | MW325300, MW325301 |
| Blastobotrys sp. 1* | MW325335 MW325336 MW325337 MW325338 |
|
| Blastobotrys sp. 2* | MW325302 | |
| Candida | Candida dendronema van der Walt, van der Klift & D.B. Scott (1971) | MW325303 |
| Candida jaroonii Imanishi, Jindamorakot, Nakagiri, Limtong & Nakase (2008) | MW325339 MW325340 |
|
| Candida michaelii S.-O. Suh, N.H. Nguyen & M. Blackwell (2005) | MW325304 | |
| Candida orthopsilosis Tavanti, A. Davidson, Gow, M. Maiden & Odds (2005) | MW325307 | |
| Candida sp.* | MW325305 | |
| Verhulstia | Verhulstia sp.* | MW325306 |
| Hannaella | Hannaella pagnoccae Landell, M.F. et al. (2013) | MW325310 |
| Hannaella phyllophila Surussawadee, Jindam., Am-In, Nakase, C.F. Lee & Limtong (2015) | MW325311 | |
| Hanseniaspora | Hanseniaspora occidentalis M.Th. Smith (1974) | MW325312 |
| Kazachstania | Kazachstania africana (Van der Walt) Kurtzman (2003) | MW325313 |
| Kazachstania naganishii (Mikata, Ueda-Nishimura & Hisatomi) Kurtzman (2005) | MW325314 | |
| Kodamaea | Kodamaea ohmeri (Etchells & T.A. Bell) Y. Yamada, T. Suzuki, Matsuda & Mikata (1995) | MW325342 |
| Kwoniella | Kwoniella bestiolae (Thanh, Hai & Lachance) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325315 |
| Kwoniella dejecticola (Thanh, Hai & Lachance) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325316 | |
| Kwoniella mangrovensis Statzell, Belloch & Fell (2008) | MW325317 | |
| Meyerozyma | Meyerozyma caribbica (Vaughan-Martini, Kurtzman, S.A. Meyer & O’Neill) Kurtzman & M. Suzuki (2010) | MW325341 |
| Papiliotrema | Papiliotrema laurentii (Kuff.) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325320 |
| Papiliotrema leoncinii D.M. Pagani, L.R. Brandao, A.R.O. Santos, C.R. Felix, J.P. Ramos, Broetto, Scorzetti, Fell, C.A. Rosa, P. Valente & Landell (2016) | MW325319 MW325324 |
|
| Papiliotrema plantarum P. Into, A. Pontes, N. Jacques, Casareg., Limtong & J.P. Samp. (2018) | MW325318 | |
| Papiliotrema ruineniae (Yurkov, M.A. Guerreiro & Á. Fonseca) Yurkov (2015) | MW325321 | |
| Papiliotrema siamensis Suruss., Khunnamw. & Limtong (2014) | MW325322 | |
| Papiliotrema sp.* | MW325323 | |
| Rhodospo-ridobolus | Rhodosporidiobolus azoricus (Samp. & Gadanho) Q.M. Wang, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325325 |
| Rhodosporidiobolus ruineniae (Holzschu, Tredick & Phaff) Q.M. Wang, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325326 | |
| Rhynchogastrema | Rhynchogastrema sp.* | MW325327 |
| Saitozyma | Saitozyma podzolica (Babeva & Reshetova) Xin Zhan Liu, F.Y. Bai, M. Groenew. & Boekhout (2015) | MW325329 |
| Saitozyma sp.* | MW325328 | |
| Schwanniomyces | Schwanniomyces vanrijiae (van der Walt & Tscheuschner) M. Suzuki & Kurtzman (2010) | MW325308 MW325333 |
| Sugiyamaella | Sugiyamaella smithiae (Giménez-Jurado) Kurtzman & Robnett (2007) | MW325332 |
| Teunia | Teunia sp.* | MW325309 |
| Torulaspora | Torulaspora delbrueckii (Lindner) Lindner (1904) | MW325331 |
| Tremella | Tremella sp.* | MW325330 |
| Wickerhamomyces | Wickerhamomyces rabaulensis (Soneda & S. Uchida) Kurtzman, Robnett & Basehoar-Powers (2008) | MW325334 |
Неописанные на момент исследования виды сравнили с известными штаммами в генбанке NCBI (ncbi.nlm.nih.gov) и базе данных CBS (mycobank.org). При проценте перекрытия 93–100% сходство обнаруженных микроорганизмов с ранее описанными видами и референсными штаммами составляло 91.51–98.81% (табл. 2).
Таблица 2.
Сравнение неописанных видов с известными штаммами
| Вид, обнаруженный в ходе исследования | Штамм | Номер в GenBank | Близкий родственный штамм (NCBI) | Сходство, %/Процент перекрытия, % |
|---|---|---|---|---|
| Acremonium sp. | T75 | MW325297 | Furcasterigmium (Acremonium) furcatum CBS 610.69 (LR025837) | 97.08/100 |
| Blastobotrys sp. 1 | T9 | MW325335 | Blastobotrys capitulate CBS 287.82 (CBS database) | 92.22/100 |
| Blastobotrys sp. 2 | T27 | MW325302 | Blastobotrys attinorum CBS 9734 (KY106202) | 91.51/100 |
| Candida sp. | T71 | MW325305 | Candida nonsorbophila CBS 10862 (KY106601) | 96.81/100 |
| Verhulstia sp. | Т81 | MW325306 | Verhulstia trisororum CBS 143234 (MG022160) | 97.72/100 |
| Papiliotrema sp. | Т61 | MW325323 | Papiliotrema mangalensis CBS 10870 (KY107130) | 98.71/100 |
| Rhynchogastrema sp. | Т91 | MW325327 | Rhynchogastrema fermentans CBS 12399 (HM461720) | 97.53/93 |
| Saitozyma sp. | T69 | MW325328 | Saitozyma ninhbinhensis JCM 10836 (AB261011) | 98.81/99 |
| Teunia sp. | T62 | MW325309 | Teuniaglobosa CGMCC 2.5648 (MK050288) | 98.71/100 |
| Tremella sp. | T63 | MW325330 | Tremella sp. DSM 104578 (MK307723) | 95.16/100 |
Согласно кластерному анализу, по относительному обилию видов дрожжевые сообщества кишечников термитов и поверхности их тел обосабливаются от остальных исследованных местообитаний. В качестве отличительных особенностей данных субстратов можно назвать присутствие вида Sugiyamaella smithiae, а также ранее не описанного представителя рода Blastobotrys. В то же время, эти дрожжи не были обнаружены в кишечнике рабочих M. gilvus на площадке “Фикус”, а присутствие в данном субстрате дрожжеподобного гриба Aureobasidium thailandense сблизило характеристики его микробного населения со свойствами сообществ некоторых образцов опада и стенок термитников (рис. 1, табл. 3).
Рис. 1.
Результаты кластеризации субстратов по относительному обилию грибов с дрожжевым ростом. Опад: a – у термитника M. carbonarius на площадке “Лагерстремия”, b – у термитника M. gilvus на площадке “Лагерстремия”, c – у термитника Odontotermes sp. на площадке “Лагерстремия”, d – у термитника G. sulphureus на площадке “Фикус”, e – у термитника M. gilvus на площадке “Фикус”, f – у термитника M. burmanicus на площадке “Фикус”. Почва: g – у термитника M. carbonarius на площадке “Лагерстремия”, h – у термитника G. sulphureus на площадке “Фикус”, i – у термитника M. gilvus на площадке “Фикус”. Стенки термитников: j – M. carbonarius на площадке “Лагерстремия”, k – M. gilvus на площадке “Лагерстремия”, l – Odontotermes sp. на площадке “Лагерстремия”, m – G. sulphureus на площадке “Фикус”, n – M. gilvus на площадке “Фикус”. Смывы с тела рабочих термитов: o – M. carbonarius на площадке “Лагерстремия”, p – Odontotermes sp. на площадке “Лагерстремия”. Кишечник рабочих термитов: q – M. carbonarius на площадке “Лагерстремия”, r – Odontotermes sp. на площадке “Лагерстремия”, s – M. gilvus на площадке “Фикус”. Смывы с тела солдат: t – M. carbonarius на площадке “Лагерстремия”, u – Odontotermes sp. на площадке “Лагерстремия”.
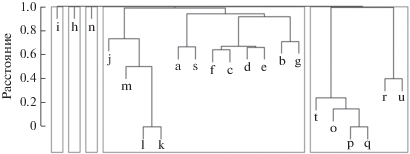
Таблица 3.
Список субстратов и выделенных из них грибов с дрожжевым ростом, с указанием индексов субстратов (см. рис. 1) и относительным обилием доминирующих видов от общего обилия идентифицированных до вида дрожжевых грибов в субстрате
| Индекс субстрата | Местообитание | Виды грибов с дрожжевым ростом |
|---|---|---|
| a | Опад вблизи гнезда M. carbonarius, площадка “Лагерстремия” | Acremonium sp., Aureobasidium thailandense (33.8%), Candida michaelii (18.8%), Candida orthopsilosis, Kwoniella dejecticola (20.7%), Meyerozyma caribbica, Papiliotrema leoncinii, Rhodosporidiobolus ruineniae, Saitozyma sp. |
| b | Опад вблизи гнезда M. gilvus, площадка “Лагерстремия” | Papiliotrema laurentii (33.9%), Rhodosporidiobolus ruineniae, Schwanniomyces vanrijiae (37.5%) |
| c | Опад вблизи гнезда Odontotermes sp., площадка “Лагерстремия” | Aureobasidium thailandense, Rhodosporidiobolus azoricus, Rhodosporidiobolus ruineniae (35.9%), Teunia sp. (36.3%), Tremella sp. |
| d | Опад вблизи гнезда G. sulphureus, площадка “Фикус” | Candida dendronema, Rhodosporidiobolus ruineniae (86.1%) |
| e | Опад вблизи гнезда M. gilvus, площадка “Фикус” | Kwoniella bestiolae, Papiliotrema plantarum, Papiliotrema sp., Rhodosporidiobolus ruineniae (33.9%), Rhynchogastrema sp. (27.1%) |
| f | Опад вблизи гнезда M.burmanicus, площадка “Фикус” | Blastobotrys sp. 2, Hannaella pagnoccae, Kwoniella bestiolae (22.0%), Kwoniella mangrovensis, Papiliotrema leoncinii, Papiliotrema sp., Rhodosporidiobolus azoricus, Rhodosporidiobolus ruineniae (28.5%), Tremella sp., Wickerhamomyces rabaulensis |
| g | Почва, M. carbonarius, площадка “Лагерстремия” | Barnettozyma siamensis (58.3%), Kazachstania africana,Schwanniomyces vanrijiae (29.2%) |
| h | Почва, G. sulphureus, площадка “Фикус” | Candida sp. (33.3%), Kazachstania naganishii (33.3%), Torulaspora delbrueckii |
| i | Почва, M. gilvus, площадка “Фикус” | Verhulstia sp. (100.0%) |
| j | Стенки термитника M. carbonarius, площадка “Лагерстремия” | Aureobasidium thailandense,Hannaella phyllophila, Papiliotrema laurentii (25.0%), Papiliotrema leoncinii, Papiliotrema ruineniae, Papiliotrema siamensis, Saitozyma podzolica (25.5%), Teunia sp. |
| k | Стенки термитника M. gilvus, площадка “Лагерстремия” | Saitozyma podzolica (100.0%) |
| l | Стенки термитника Odontotermes sp., площадка “Лагерстремия” | Saitozyma podzolica (100.0%) |
| m | Стенки термитника G. sulphureus, площадка “Фикус” | Papiliotrema leoncinii (50.0%), Saitozyma podzolica (50.0%) |
| n | Стенки термитника M. gilvus, площадка “Фикус” | Hanseniaspora occidentalis (50.0%) |
| o | Смывы с рабочих термитов, M. carbonarius, площадка “Лагерстремия” | Blastobotrys capitulata, Blastobotrys sp. 1 (85.2%), Kodamaea ohmeri |
| p | Смывы с рабочих термитов, Odontotermes sp., площадка “Лагерстремия” | Blastobotrys sp. 1 (100.0%) |
| q | Кишечник рабочих термитов, M. carbonarius, площадка “Лагерстремия” | Blastobotrys sp. 1 (100.0%) |
| r | Кишечник рабочих термитов, Odontotermes sp., площадка “Лагерстремия” | Blastobotrys capitulata, Sugiyamaella smithiae (60.0%) |
| s | Кишечник рабочих термитов, M. gilvus, площадка “Фикус” | Aureobasidium thailandense (100.0%) |
| t | Смыв с солдат, M. carbonarius, площадка “Лагерстремия” | Blastobotrys sp. 1 (75.0%), Candida jaroonii (21.7%), Kodamaea ohmeri |
| u | Смыв с солдат, Odontotermes sp., площадка “Лагерстремия” | Meyerozyma caribbica, Sugiyamaella smithiae (93.3%) |
Индекс Шеннона достигал наибольших значений в опаде (до 2.68 бит) и стенках термитников (до 2.67 бит); меньшие величины определялись для почв (до 1.95 бит), смывов с поверхности тела (1.42 бит) и кишечников рабочих (1.37 бит); наименьшие значения были отмечены для смывов с поверхности солдат (до 0.95 бит).
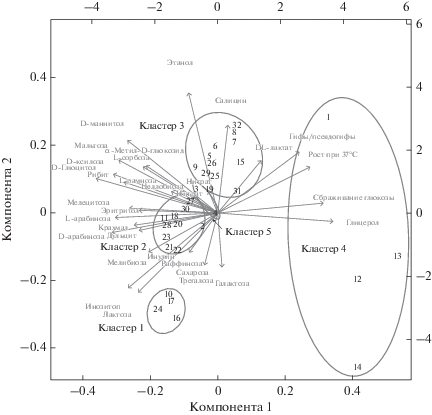
Анализ бинарной матрицы морфо-физиологических свойств методом k-средних распределил обнаруженные виды дрожжей на 5 кластеров. Представители кластеров 1, 2, 3, 5 отличались относительно широким спектром морфо-физиологических особенностей (присутствует от 21 до 33 свойств); все виды из кластера 5 были способны к брожению и образованию гиф/псевдогиф, а представители кластера 1, напротив, не сбраживали глюкозу и не формировали мицелиальных структур. Культуры кластера 4 характеризуются относительно узким спектром свойств (отмечено от 9 до 13 морфо-физиологических показателей). Представители кластеров отображены в поле морфо-физиологических свойств, построенном методом главных компонент (рис. 2).
Рис. 2.
Результаты анализа морфо-физиологических свойств обнаруженных дрожжевых грибов. Овалы являются вспомогательным элементом для обозначения кластеров, выделенных методом k-средних, и не отображают статистические показатели. 1 – Barnettozyma siamensis, 2 – Blastobotrys capitulata, 3 – Blastobotrys sp. 1, 4 – Blastobotrys sp. 2, 5 – Candida dendronema, 6 – Candida jaroonii, 7 – Candida michaelii, 8 – Candida orthopsilosis, 9 – Candida sp., 10 – Hannaella pagnoccae, 11 – Hannaella phyllophila, 12 – Hanseniaspora occidentalis, 13 – Kazachstania africana, 14 – Kazachstania naganishii, 15 – Kodamaea ohmeri, 16 – Kwoniella bestiolae, 17 – Kwoniella dejecticola, 18 – Kwoniella mangrovensis, 19 – Meyerozyma caribbica, 20 – Papiliotrema laurentii, 21 – Papiliotrema leoncinii, 22 – Papiliotrema plantarum, 23 – Papiliotrema ruineniae, 24 – Papiliotrema siamensis, 25 – Rhodosporidiobolus azoricus, 26 – Rhodosporidiobolus ruineniae, 27 – Rhynchogastrema sp., 28 – Saitozyma podzolica, 29 – Schwanniomyces vanrijiae, 30 – Sugiyamaella smithiae, 31 – Torulaspora delbrueckii, 32 – Wickerhamomyces rabaulensis.
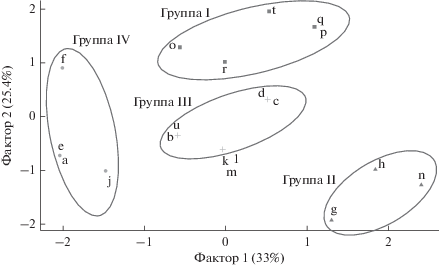
При анализе распределения дрожжей с разными морфо-физиологическими свойствами субстраты, относящиеся непосредственно к насекомым (смывы с тел и кишечники), обособились от прочих субстратов, сформировав группу I (рис. 3). Исключением стал смыв с тела солдат Odontotermes sp., объединившийся с образцами опада в группу III. Этот образец характеризовался одновременным присутствием представителей морфо-физиологических кластеров 2 и 3 и отсутствием элементов кластера 5, встречавшихся в других образцах тел и кишечников насекомых. В этом же образце присутствовал вид Sugiyamaella smithiae – единственный дрожжевой гриб, выделенный из термитов в данном исследовании, образующий мицелиальные структуры, но не способный к брожению (все остальные виды из данных субстратов как формируют гифы/ псевдогифы, так и сбраживают глюкозу). Кроме того, все дрожжи, выделенные с поверхности термитов и из их кишечников, характеризуются способностью ассимилировать салицин, что может указывать на участие дрожжевых грибов в детоксикации пищевых субстратов насекомых (Ganter, 2006). Ни в одном из образцов смывов с термитов и кишечников не обнаружились виды дрожжей из кластеров 1 и 4. Группа II включала образцы почвы, группа IV – образцы опада. Образцы из стенок термитников не формировали обособленного кластера и распределились по группам II, III и IV (рис. 3).
Рис. 3.
Классификация субстратов на основании наличия дрожжевых грибов с различными морфо-физиологическими свойствами (см. рис. 2). Обозначения субстратов даны на рис. 1. Овалы являются вспомогательным элементом для обозначения групп субстратов, выделенных методом k-средних, и не отображают статистические показатели.
В ходе исследования было выявлено 39 видов грибов с дрожжевым ростом, из которых 29 удалось определить до видового уровня; 10 относились к видам, не описанным на момент исследования; планируется описание нескольких новых видов. Неописанные виды встречались в каждом типе субстратов, из которых удавалось выделить дрожжи. Дрожжевые сообщества, ассоциированные с зоогенными структурами и телами термитов, отличались относительно низкими видовым разнообразием и численностью КОЕ; из ряда образцов дрожжи выделены не были.
Некоторые из изученных объектов относятся к субстратам, бедным доступными для дрожжей сахарами или отличающимся наличием факторов, препятствующих развитию дрожжевых грибов. Содержание органического углерода в стенках гнезд термитов рода Macrotermes часто ниже, чем в окружающей почве (Contour-Ansel et al., 2000), поскольку для строительства ими используется глина из глубоких горизонтов. Кроме того, некоторые термиты используют для строительства гнезд слюну и экскременты, содержащие вещества, обладающие антимикробной активностью (Rosengaus et al., 2011).
Механизмы, ограничивающие рост грибов, не выращиваемых термитами, и объясняющие низкую концентрацию несимбиотических дрожжей, присутствуют и в грибных садах. Вероятнее всего, регуляция численности посторонних микроорганизмов в садах осуществляется самими термитами, как посредством физического удаления, так и с помощью веществ с антимикробной активностью, обнаруживаемых в слюнных железах термитов. Фунгистатической активности нескольких видов рода Termitomyces, культивируемых термитами, по-видимому, недостаточно для регулирования роста других грибов. Деятельность актиномицетов – кишечных симбионтов термитов также не обеспечивает уничтожение посторонних видов, хотя эти микроорганизмы используются для регулирования состава населения садов другими насекомыми, выращивающими грибы – муравьями-листорезами (Guedegbe et al., 2009). Таким образом, состав микромицетов в термитнике зависит преимущественно от деятельности населяющих его насекомых. Секреты слюнных желез, в сочетании со способностью термитов распознавать патогены и аллогрумингом, позволяют ограничивать распространение посторонних микроорганизмов также и на поверхности тел насекомых (Rosengaus et al., 2011).
Перечисленные факторы могли стать причиной отсутствия дрожжевых грибов в некоторых образцах почв, стенок термитников, а также в образцах грибных садов и некоторых особях термитов.
Кластеризация по присутствию и относительному обилию грибов с дрожжевым ростом в исследованных образцах, а также по представленности групп с различными морфо-физиологическими особенностями показала, что субстраты, относящиеся непосредственно к самим термитам (поверхность тела и кишечник), отличаются от остальных местообитаний по характеристикам дрожжевого населения. Виды истинных дрожжей, обнаруженные в образцах данного типа, не были встречены в других субстратах (в том числе и в структурах термитников). Ранее эти дрожжевые грибы также упоминались в связи с исследованиями местообитаний, населенных насекомыми. Вид Blastobotrys capitulata, ассоциированный преимущественно с растительным материалом (Kurtzman et al., 2011), обнаруживался также в гниющей древесине, пораженной насекомыми (Ganter, 2006). Вид Candida jaroonii ранее был выделен из экскрементов насекомых (mycobank.org). Дрожжи Kodamae ohmeri часто упоминаются в связи с насекомыми-опылителями и общественными насекомыми. Отмечено обнаружение этого вида на пчелах (Kurtzman et al., 2011) и в грибных садах муравьев-листорезов Atta texana (Rodrigues et al., 2009). Ряд штаммов был выделен из жуков семейства Nitidulidae, питающихся грибами, пыльцой, ферментированными плодами и растительными остатками. Некоторые из этих жуков связаны с общественными насекомыми и обнаруживаются в гнездах пчел и муравьев. На всех стадиях жизненного цикла жука Brachypeplus glaber (Nitidulidae) выделялся также широко распространенный вид дрожжей Meyerozyma caribbica (Cline et al., 2014). Вид Sugiyamaella smithiae был обнаружен в экскрементах насекомых-древоточцев, обитающих в красной японской сосне; из субстратов этого же типа выделено большинство известных штаммов вида (Kurtzman et al., 2011). Эти дрожжи выделялись и из кишечника ксилофагов (в частности, термита Reticulitermes chinensis). Примечательно, что этот вид способен к образованию ксиланазы (Ali et al., 2017). В то же время, это единственный из перечисленных видов, не сбраживающий сахара.
Несмотря на то, что перечисленные виды в нашем исследовании были выделены только с поверхности тел или из кишечника термитов и ранее также выделялись из насекомых и их местообитаний, их нельзя назвать строго ассоциированными с насекомыми. Эти дрожжи часто выделялись и из других субстратов (Kurtzman et al., 2011). Однако наличие определенных морфо-физиологических свойств (способности к брожению, образованию мицелия/псевдомицелия, потреблению в качестве источника питания салицина и простых продуктов разрушения древесины) может оказаться характерной чертой дрожжей, связанных с насекомыми-ксилофагами.
Кишечник беспозвоночных ранее отмечался в качестве местообитания дрожжевых грибов, активно сбраживающих сахара (Чернов, 2013). Кишечный тракт термитов и других ксилофагов пригоден для развития копиотрофных микроорганизмов благодаря присутствию простых продуктов разрушения древесины (Ali et al., 2017). Тем не менее, кишечник термитов нельзя назвать субстратом с высоким содержанием доступных углеводов: концентрация сахаров иногда не достигает 1% (Veivers et al., 1991), тогда как высокосахаристые субстраты, например, ферментированные продукты, фрукты, сиропы, могут содержать от 20 до 40% (в ряде случаев – до 70%) свободных сахаров (Tokuoka, 1985; Чернов, 2013). Таким образом, одноклеточные формы роста, характерные для богатых питательными веществами сред (Чернов, 2013), в телах термитов обладают меньшим адаптивным значением. Напротив, развитые мицелиальные структуры, направленные на освоение плотных субстратов в условиях затрудненного распространения клеток (Yurkov, 2017), по-видимому, становятся важным приспособлением дрожжей, связанных с термитами.
На сочетание способности к брожению и формированию мицелиальных структур у элементов дрожжевых сообществ социальных насекомых, потребляющих древесину, указывали результаты и других исследований (Blackwell, 2017). Например, дрожжи, выделенные из кишечника и с поверхности жуков-ксилофагов из семейства Passalidae, были способны к мицелиальному росту и либо сбраживали сахара, либо являлись ксиланолитиками. Подобные особенности дрожжевого населения ранее отмечались также для субсоциальных насекомых: из кишечника древесных тараканов Cryptocercus sp. выделялись сбраживающие глюкозу виды дрожжей, способные к формированию хорошо развитого мицелия; при этом был обнаружен новый на момент исследования дрожжевой вид, сбраживающий ксилозу (Kurtzman, 2011; Blackwell, 2017).
Таким образом, можно предположить, что дрожжевые сообщества, ассоциированные с насекомыми-ксилофагами, обладают определенным набором морфо-физиологических свойств: способностью сбраживать сахара, усваивать относительно широкий спектр питательных веществ, в том числе простые продукты разрушения древесины, формировать мицелиальные структуры. Благодаря своей способности ассимилировать салицин, дрожжевые грибы, населяющие кишечник термитов, по-видимому, упрощают потребление ксилофагами древесных субстратов.
Местообитания общественных насекомых-ксилофагов интересны для микробиологических исследований как с таксономической (в качестве источника новых и неописанных видов), так и с экологической (при изучении механизмов формирования микробных сообществ) точек зрения. Проведенное исследование показало, что дрожжевое население субстратов, ассоциированных с термитами, отличается от сообществ фоновых субстратов – почвы и опада – по численности, видовому составу, относительному обилию и физиологическим свойствам элементов. Деятельность термитов определяет не только количество и разнообразие дрожжей, ассоциированных с термитником и его обитателями, но и морфо-физиологические особенности формируемых в нем дрожжевых сообществ.
Список литературы
Беляева Н.В., Тиунов А.В. Термиты (Isoptera) в лесных экосистемах национального парка Кат Тьен (южный Вьетнам) // Известия РАН, Сер. биол. 2010. № 4. С. 442–450. Belyaeva N.V., Tiunov A.V. Termites (Isoptera) in forest ecosystems of Cat Tien national park (Southern Vietnam) // Biol. Bull. 2010. V. 37. № 4. P. 374–381.
Глушакова А.М., Качалкин А.В., Чернов И.Ю. Почвенные дрожжевые сообщества в условиях агрессивной инвазии борщевика Cосновского (Heracleum sosnowskyi) // Почвоведение. 2015. № 2. С. 221–227. Glushakova A.M., Kachalkin A.V., Chernov I.Yu. Soil yeast communities under the aggressive invasion of Sosnowsky’s hogweed (Heracleum sosnowskyi) // Euras. Soil Sci. 2015. V. 48. № 2. P. 201–207.
Дещеревская О.А., Авилов В.К., Динь Б.З., Чан К.Х., Курбатова Ю.А. Современный климат национального парка Кат Тьен (южный Вьетнам): использование климатических данных для экологических исследований // Геофизические процессы и биосфера. 2013. Т. 12. № 2. С. 5–33. Deshcherevskaya O.A., Avilov V.K., Dinh B.D., Tran C.H., Kurbatova J.A. Modern climate of the Cát Tiên National Park (Southern Vietnam): climatological data for ecological studies // Izvestiya, Atmospheric and Oceanic Physics. 2013. V. 49. № 8. P. 819–838.
Максимова И.А., Чернов И.Ю. Руководство к практическим занятиям по биологии дрожжей. Тула: Гриф и К., 2006. 96 с.
Хохлова О.С., Мякшина Т.Н., Кузнецов А.Н., Губин С.В. Морфогенетические особенности почв национального парка Кат Тьен, Южный Вьетнам // Почвоведение. 2017. № 2. С. 176–194.
Khokhlova O.S., Myakshina T.N., Gubin S.V., Kuznetsov A.N. Morphogenetic features of soils in the Cat Tien National Park, Southern Vietnam // Euras. Soil Sci. 2017. V. 50. P. 158–175.
Чернов И.Ю. Дрожжи в природе. М.: Товарищество научных изданий КМК, 2013. 336 с.
Чурилина А.Е., Голиченков М.В., Иванова А.Е., Закалюкина Ю.В., Умаров М.М. Биологическая активность муравьиных гнезд среднетаежной зоны // Вестн. Московского ун-та. Сер. 17. Почвоведение. 2017. № 4. С. 40–44.
Юрков А.М., Чернов И.Ю., Тиунов А.В. Влияние дождевых червей Lumbricus terrestris на структуру дрожжевого сообщества лесной подстилки // Микробиология. 2008. Т. 77. № 1. С. 121–125.
Yurkov A.M., Chernov I.Yu., Tiunov A.V. Influence of Lumbricus terrestris earthworms on the structure of the yeast community of forest litter // Microbiology (Moscow). 2008. V. 77. P. 107–111.
Ali S.S., Wu J., Xie R., Zhou F., Sun J., Huang M. Screening and characterizing of xylanolytic and xylose-fermenting yeasts isolated from the wood-feeding termite, Reticulitermes chinensis // PLoS One. 2017. V. 12. e0181141.
Blackwell M. Yeasts in insects and other invertebrates // Yeasts in Natural Ecosystems: Diversity / Eds. Buzzini P., Lachance M.A., Yurkov A. Springer, Cham, 2017. P. 397–433.
Cline A.R., Skelley P.E., Kinnee S.A., Rooney-Latham S., Winterton S.L., Borkent C.J., Audisio P. Interactions between a sap beetle, sabal palm, scale insect, filamentous fungi and yeast, with discovery of potential antifungal compounds // PLoS One. 2014. V. 9. e89295.
Contour-Ansel D., Garnier-Sillam E., Lachaux M., Croci V. High performance liquid chromatography studies on the polysaccharides in the walls of the mounds of two species of termite in Senegal, Cubitermes oculatus and Macrotermes subhyalinus: their origin and contribution to structural stability // Biol. Fertil. Soils. 2000. V. 31. P. 508–516.
Ganter P.F. Yeast and invertebrate associations // Biodiversity and Ecophysiology of Yeasts / Eds. Rosa C., Péter G. Berlin, Heidelberg: Springer, 2006. P. 303–370.
Gardes M., Bruns. ITS Primers with enhanced specificity for Basidiomycetes – Application to the identification of mycorrhizae and rusts // Mol. Ecol. 1993. V. 2. P. 113–118.
Guedegbe H.J., Miambi E., Pando A., Roman J., Houngnandan P., Rouland-Lefevre C. Occurrence of fungi in combs of fungus-growing termites (Isoptera: Termitidae, Macrotermitinae) // Mycol. Res. 2009. V. 113. P. 1039–1045.
Hammer T.J., Dickerson J.C., Fierer N. Evidence-based recommendations on storing and handling specimens for analyses of insect microbiota // PeerJ. 2015. V. 3. e1190.
http://www.mycobank.org.
https://www.ncbi.nlm.nih.gov.
https://www.r-project.org.
Into P., Pontes A., Jacques N., Casaregola S., Limtong S., Sampaio J.P. Papiliotrema plantarum sp. nov., a novel tremellaceous sexual yeast species // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 1937–1941.
Kurtzman C.P., Fell J.W., Boekhout T. (Eds.). The Yeasts: a Taxonomic Study. 5th ed. Elsevier, 2011. V. 2. 1335 p., V. 3. 2080 p.
Landell M.F., Branda L.R., Barbosa A.C., Ramos J.P., Safar S.V.B., Gomes F.C.O., Sousa F.M.P., Morais P.B., Broetto L., Leoncini O., Ribeiro J.R., Fungsin B., Takashima M., Nakase T., Lee C.F., Vainstein M.H., Fell J.W., Scorzetti G., Vishniac H.S., Rosa C.A., Valente P. Hannaella pagnoccae sp. nov., a tremellaceous yeast species isolated from plants and soil // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 1970–1977.
Lee C.Y., Yap J., Ngee P., Jaal Z. Foraging colonies of a higher mound-building subterranean termite, Globitermes sulphureus (Haviland) in a Malaysia // Jap. J. Environ. Entomol. Zool. 2003. V. 14. P. 105–112.
Liu X.-Z., Wang Q.-M., Göker M., Groenewald M., Kachalkin A.V., Lumbsch H.T., Millanes A.M., Wedin M., Yurkov A.M., Boekhout T., Bai F.-Y. Towards an integrated phylogenetic classification of the Tremellomycetes // Studies in Mycology. 2015. V. 81. P. 85–147.
Rodrigues A., Cable R.N., Mueller U.G., Bacci M., Jr., Pagnocca F.C. Antagonistic interactions between garden yeasts and microfungal garden pathogens of leaf-cutting ants // Antonie van Leeuwenhoek. 2009. V. 96. P. 331–342.
Rosengaus R.B., Traniello J.F.A., Bulmer M.S. Ecology, behavior and evolution of disease resistance in termites // Biology of Termites: A Modern Synthesis / Eds. Bignell D.E., Roisin Y., Lo N. Dordrecht, Heidelberg, London, N.Y.: Springer, 2011. P. 165–191.
Surussawadee J., Jindamorakot S., Nakase T., Lee C.-F., Limtong S. Hannaella phyllophila sp. nov., a basidiomycetous yeast species associated with plants in Thailand and Taiwan // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 2135–2140.
Surussawadee J., Khunnamwong P., Srisuk N., Limtong S. Papiliotrema siamense f.a., sp. nov., a yeast species isolated from plant leaves // Int. J. Syst. Evol. Microbiol. 2014. V. 64. P. 3058–3062.
Thanh V.N., Hai D.A., Lachance M.A. Cryptococcus bestiolae and Cryptococcus dejecticola, two new yeast species isolated from frass of the litchi fruit borer Conopomorpha sinensis Bradley // FEMS Yeast Res. 2006. V. 6. P. 298–304.
Tokuoka K., Ishitani T., Goto S., Komagata K. Identification of yeasts isolated from high-sugar foods // J. Gen. Appl. Microbiol. 1985. V. 31. P. 411–427.
Veivers P.C., Mühlemann R., Slaytor M., Leuthold R.H., Bignell, D.E. Digestion, diet and polyethism in two fungus-growing termites: Macrotermes subhyalinus Rambur and M. michaelseni Sjøstedt // J. Insect Physiol. 1991. V. 37. P. 675–682.
Wong N., Lee C.Y. Intra-and interspecific agonistic behavior of the subterranean termite Microcerotermes crassus (Isoptera: Termitidae) // J. Econ. Entomol. 2010. V. 103. P. 1754–1760.
Yamada A., Inoue T., Wiwatwitaya D., Ohkuma M., Kudo T., Abe T., Sugimoto A. Carbon mineralization by termites in tropical forests, with emphasis on fungus combs // Ecol. Res. 2005. V. 20. P. 453–460.
Yurkov A. Temporal and geographic patterns in yeast distribution // Yeasts in Natural Ecosystems: Ecology / Eds. Buzzini P., Lachance M.A., Yurkov A. Springer, Cham, 2017. P. 101–130.
Yurkov A., Guerreiro M.A., Sharma L., Carvalho C., Fonseca A. Multigene assessment of the species boundaries and sexual status of the basidiomycetous yeasts Cryptococcus flavescens and C. terrestris (Tremellales) // PLoS One. 2015. V. 10. e0126996.
Дополнительные материалы отсутствуют.


