Микробиология, 2021, T. 90, № 5, стр. 515-530
Связь водородного и серного метаболизма у пурпурных серных бактерий
М. Х. Хасимов a, Т. В. Лауринавичене a, Е. П. Петушкова a, А. А. Цыганков a, *
a Институт фундаментальных проблем биологии РАН
142290 Пущино, Россия
* E-mail: ttt-00@mail.ru
Поступила в редакцию 09.03.2021
После доработки 03.04.2021
Принята к публикации 05.04.2021
Аннотация
В обзоре рассматривается роль пурпурных серных бактерий в глобальном цикле водорода и серы, экология и физиология этих бактерий в связи с метаболизмом серы и водорода. Представлены сведения о пяти типах гидрогеназ, участвующих в поглощении или выделении водорода, а также о разнообразных ферментах, участвующих в окислении/восстановлении серных соединений. Успехи в биохимии и генетике ферментов из этих микроорганизмов позволяют проанализировать взаимосвязь процессов на новом уровне.
Пурпурные серные бактерии являются аноксигенными фототрофными организмами, которые способны использовать серные соединения и водород как в светозависимых, так и темновых процессах. Это существенно для выживания в природных экосистемах, а также при их использовании в биотехнологических процессах. В представленном обзоре рассматривается взаимосвязь водородного и серного метаболизма у пурпурных серных бактерий с акцентом на роль гидрогеназ. Следует отдать должное классическим работам И.Н. Гоготова, В.М. Горленко, Р.Н. Ивановского, Е.Н. Кондратьевой, Н. Пфеннига, Г. Трюпера и Г. ван Гемердена и соавторов, которые изучали экологию и физиологию пурпурных бактерий и, в частности, выделение/поглощение водорода и использование серных соединений. Успехи в биохимии и генетике ферментов, участвующих в этих процессах, позволяют проанализировать их взаимосвязь на новом уровне. Ферменты водородного и серного метаболизма изучались и в другой группе фототрофных бактерий – зеленых серных бактериях. Однако к настоящему моменту экспериментальных свидетельств взаимосвязи метаболизма водорода и серы у этой группы бактерий, исключая очевидную конкуренцию за восстановление пула убихинонов, не представлено.
КРУГОВОРОТ БИОВОДОРОДА И СЕРЫ
В природе многие микробиологические процессы протекают с выделением или поглощением водорода. С участием микроорганизмов, выделяющих или поглощающих Н2, формируется глобальный цикл водорода, связанный с геохимическими циклами других элементов, таких как углерод, сера и азот (Кондратьева, Гоготов, 1981; Vignais, Billoud, 2007; Greening et al., 2015; Teng et al., 2019). В круговороте последних элементов, в частности, серы, так или иначе участвуют все микроорганизмы. Способностью к выделению и поглощению Н2 обладает достаточно большое, но ограниченное число микроорганизмов: примерно одна треть секвенированных геномов (Peters et al., 2015; Greening et al., 2016; Greening, Boyd, 2020). Эти микроорганизмы таксономически и физиологически не связаны между собой, и их представители обнаруживаются в разных местообитаниях. Ключевая роль водорода во взаимодействии разных видов общепризнана в таких экосистемах, как гидротермальные источники, анаэробные отложения и пищеварительный тракт животных, но, видимо, не ограничивается этим (Vignais, Billoud, 2007; Schwartz et al., 2013). Некоторые микроорганизмы образуют тесно связанные ассоциации на основе межвидового переноса водорода.
Поглощение молекулярного водорода и использование его как источника энергии описано у аэробных микроорганизмов, сульфатредукторов, ацетогенов и метаногенов, а также в процессах восстановления железа или галореспирации и в фумаратном дыхании. Кроме того, он является донором электронов для аноксигенных фототрофов. Наряду с этим существуют вспомогательные процессы, в которых Н2-поглощающая активность связана с Н2-выделяющей активностью в той же самой клетке, т.е. наблюдается рециклизация водорода (Schwartz et al., 2013).
Образование молекулярного водорода как конечного продукта имеет место у микроорганизмов, осуществляющих брожение или анаэробное окисление СО. Кроме того, Н2 является побочным продуктом при азотфиксации и окислении фосфита (Schwartz et al., 2013). С точки зрения биотехнологий важна как способность микроорганизмов к выделению Н2 (биотоплива), так и способность к поглощению Н2 в процессах ремедиации, т.е. деградациии токсических биополлютантов, таких как ароматические и алифатические галоген-содержащие вещества (Teng et al., 2019).
Сера относится к элементам с переменной валентностью (от –2 до +6), что обеспечивает ее химическую и биологическую подвижность. В виде неорганических соединений сера бывает в окисленной форме (сульфаты, политионаты и др.), в восстановленной форме (сульфиды) и в молекулярной. Цикл серы включает в себя окислительную и восстановительную ветви, а также превращения серы без изменения ее валентности (Кондратьева, 1996; Грабович, 1999). Восстановительная часть цикла серы включает обратный переход от ${\text{SO}}_{4}^{{2 - }}$ к S2– и осуществляется преимущественно биологическим путем (рис. 1). Ассимиляция сульфата для биосинтетических целей осуществляется многими микроорганизмами (рис. 1, путь 1). При последующей минерализации органических серосодержащих соединений образуется сульфид (рис. 1, путь 2). Прямое образование сульфида из сульфата связывается в основном с деятельностью сульфатредуцирующих бактерий и архей в процессе диссимиляционной сульфатредукции (анаэробного дыхания) (рис. 1, путь 3). Сероводород может образовываться также при восстановлении элементной серы с использованием двух механизмов (рис. 1, путь 4). Во-первых, путем диссимиляционной сероредукции (серного дыхания) с участием мезофильных и термофильных прокариот, что сопровождается синтезом АТФ. Во-вторых, за счет т.н. облегченного брожения, т.е. футильного сброса электронов без синтеза АТФ с участием прокариот и дрожжей (Грабович, 1999).
Рис. 1.
Круговорот серы в природе (по Грабович, 1999). 1 – ассимиляция сульфатов; 2 – минерализация органических серoсодержащих соединений; 3 – сульфатредукция; 4 – сероредукция; 5 – окисление сульфида; 6 – окисление серы.
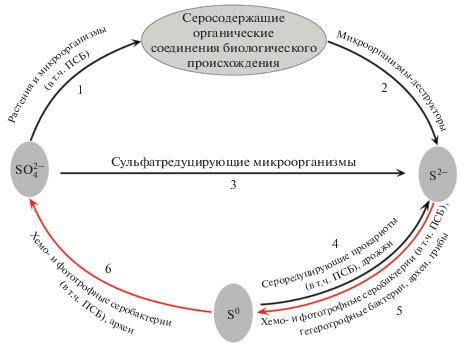
Окислительная часть круговорота серы (рис. 1, пути 5, 6) включает переход от S2– к ${\text{SO}}_{4}^{{2 - }},$ который в зависимости от условий может протекать без участия или с участием микроорганизмов, таких как хемо- и фототрофные серобактерии, археи и гетеротрофные микроорганизмы (Кондратьева, 1996; Грабович, 1999). Процесс может идти не до конца, с накоплением промежуточных продуктов, таких как элементарная сера, политионаты, сульфит (Грабович, 1999).
Таким образом, пурпурные серные бактерии участвуют как минимум в 4 из 6 ветвей круговорота серы, что подчеркивает их значимость.
ФИЗИОЛОГИЯ И ЭКОЛОГИЯ ПСБ
Пурпурные серные бактерии (ПСБ) относятся к порядку Chromatiales (класс гаммапротеобактерий), два из четырех семейств которого являются фототрофными: Chromatiaceae и Ectothiorhodospiraceae, фенотипически различающиеся по локализации элементарной серы – внутриклеточной или внеклеточной соответственно. Члены Chromatiaceae принадлежат к трем филогенетическим группам: а) морские и галофильные виды, относящиеся к Halochromatium, Isochromatium и Marichromatium; б) пресноводные виды, относящиеся к Chromatium и Thiocystis; в) морские/пресноводные виды Thiocapsa и Amoebobacter (Ghosh, Dam, 2009). В обзоре будет сделан акцент на два наиболее изученных вида – Allochromatium vinosum (ранее Chromatium vinosum) и Thiocapsa roseopersicina BBS. В 2009 г. таксономический статус последнего штамма был пересмотрен и выделен в самостоятельный вид Thiocapsa bogorovii sp. nov. (Турова и соавт., 2009). К сожалению, до сих пор авторы, работающие с этой бактерией, придерживаются прежней номенклатуры. Поэтому в обзоре даны преимущественно названия, использованные авторами конкретных исследований. Двойные названия использованы в тех случаях, где нужно подчеркнуть различия между штаммами Thiocapsa, которые могут оказаться межвидовыми.
ПСБ являются фототрофными бактериями, осуществляющими бактериальный тип фотосинтеза, т.е. в отличие от высших растений и водорослей они не используют воду в качестве восстановителя и не образуют О2. Вместо воды для этих бактерий характерно использование сульфида или других восстановленных серных соединений. Основные сведения по физиологии ПСБ суммированы в монографии Е.Н. Кондратьевой и нескольких обзорах (Кондратьева, 1996; Madigan, 2003; Madigan, Jung, 2009; Imhoff, 2014). Большинство ПСБ могут расти в автотрофных условиях, их способность использовать другие источники углерода весьма ограничена. Среди ПСБ есть виды, которые могут расти в темноте в аэробных или микроаэробных условиях, причем ряд микроорганизмов используют органические вещества в качестве окисляемых субстратов и источников углерода. Другие ПСБ в темноте при наличии О2 окисляют сульфид, тиосульфат и водород. Что касается роста в анаэробных темновых условиях, существуют неоднозначные мнения, поскольку строго анаэробные условия соблюдаются не всегда.
К настоящему времени накоплено много данных, касающихся геохимической деятельности и распространения ПСБ (Кондратьева, 1996; Van Gemerden, Mas, 1995; Overmann, 1997; Imhoff, 2005, 2014; Madigan, Jung, 2009). В небольших количествах аноксигенные фототрофные бактерии присутствуют практически во всех водоемах, а также в затопляемых почвах и зонах морских приливов. Места массового обитания фототрофных бактерий обычно делят на три типа: термальные источники, мелководные (соленые и пресные) водоемы, стратифицированные водоемы (Горленко и соавт., 1977; Нетрусов и соавт., 2013). В водоемах физико-химические условия закономерно изменяются с увеличением глубины: снижается температура, освещенность, редокс потенциал и рО2, но может увеличиваться соленость. Также в придонных слоях максимальна концентрация сероводорода за счет деятельности сульфатредуцирующих бактерий. ПСБ живут в водоемах на границе аэробно-анаэробных зон, где сохраняется достаточная освещенность для поддержания фотосинтеза в дневное время и мало кислорода. Глубина, на которой обнаруживается этот слой (обычно несколько метров, иногда десятки метров), варьирует в зависимости от характеристик водоема (Van Gemerden, Mas, 1995). Местообитания ПСБ, как правило, напрямую связаны с наличием серных соединений и жизнедеятельностью сульфатредуцирующих бактерий. Поскольку ПСБ используют восстановленные соединения серы в качестве доноров электрона для фотосинтеза, они могут образовывать ассоциации с серо- или сульфатредуцирующими бактериями, в которых партнеры зависят друг от друга. Сульфатредуцирующие бактерии образуют сульфид, необходимый ПСБ, а от продуктов окисления сульфида (сульфат, сера) в свою очередь зависит деятельность сульфатредуцирующих бактерий (Overmann, van Gemerden, 2000; Peduzzi et al., 2003; Bhatnagar et al., 2020). В таком замкнутом цикле один и тот же атом серы используется многократно (Overmann, van Gemerden, 2000). При высоких концентрациях серы сульфатредуцирующие бактерии также зависят от органических соединений, образуемых ПСБ.
Кроме того, ПСБ обнаруживаются на дне, в пограничном слое осадков, который обычно составляет лишь несколько миллиметров и находится под слоем оксигенных фототрофов. В таких условиях обычно формируются циано-бактериальные маты. Thiocapsa и Allochromatium – постоянные обитатели морских микробных матов, где они образуют окрашенный слой ниже расположения цианобактерий (van Gemerden, Mas, 1995). Такие микробные маты характеризуются высокими плотностями популяций микроорганизмов, между которыми, несмотря на конкуренцию, устанавливаются и взаимовыгодные отношения, основанные, как правило, на совместном использовании серных соединений. Взаимодействие микроорганизмов изучается и в лабораторных смешанных культурах, например, между разными видами Chromatium (van Gemerden, Mas, 1995), между ПСБ и зелеными серобактериями (Pringault et al., 1999; Masse et al., 2002), между ПСБ и бесцветными серобактериями (Visscher et al., 1992; van der Ende et al., 1996; Overmann, van Gemerden, 2000).
Если связь местообитания ПСБ с наличием (и использованием) восстановленных серных соединений очевидна и коррелирует с возможностью выращивания ПСБ в таких условиях, то в отношении молекулярного водорода нет определенных выводов. В водоемах водород образуется преимущественно за счет ферментации органических соединений в придонных слоях и диффундирует к поверхности, таким образом создавая градиент Н2 (рис. 2). Согласно этой схеме ПCБ находятся на границе аэробно/анаэробной зоны, однако концентрация Н2 в этой зоне неизвестна. Скорее всего, водород здесь не накапливается, а используется сразу же по мере образования.
Рис. 2.
Анаэробный и аэробный бактериальный метаболизм в водных стратифицированных системах. Схема иллюстрирует вертикальное распределение различных окислительно-восстановительных реакций, катализируемых Н2-образующими и Н2-потребляющими сообществами. Вертикальная стрелка указывает на уменьшение содержания Н2 от дна к поверхности (по Vignais, Billoud, 2007).
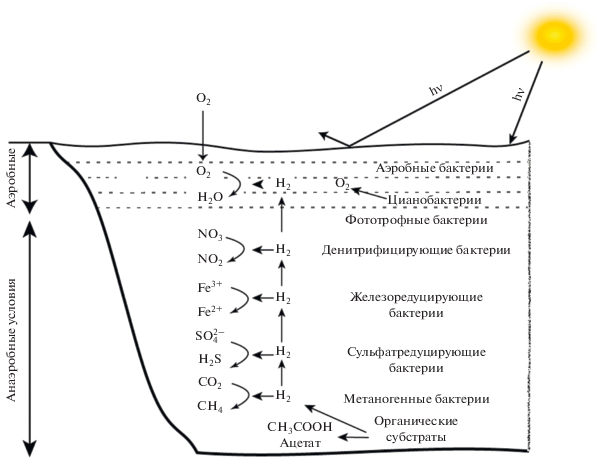
Можно обратиться к исследованиям, касающимся градиента концентрации растворенного водорода в зависимости от глубины придонного слоя и типа акцептора, используемого при анаэробном дыхании за счет окисления водорода. Они распределяются в направлении от дна к поверхности следующим образом: 7–10 нМ Н2, метаногенез или СО2 редукция; 1–1.5 нМ Н2, сульфатредукция; 0.2 нМ Н2, Fe(III) редукция; менее 0.05 нМ Н2, Mn(IV) или нитрат редукция (Lovely, Goodwin, 1988). Такое распределение определяется конкуренцией за продукты ферментации между процессами с разными акцепторами электрона, причем доминирующий процесс контролирует концентрацию Н2, ингибируя использование следующего термодинамически выгодного акцептора, пока концентрация доминирующего окислителя не снизится до лимитирующего уровня (Vandieken et al., 2014). Таким образом, можно предположить, что ПСБ обитают при концентрации <0.05 нМ. Однако можно исходить и из того, что ПСБ зависят от продуктов метаболизма сульфатредуцирующих бактерий (сульфида) и, следовательно, должны быть локализованы вблизи них, т.е. при концентрации около 0.2 нМ Н2. Тем не менее прямые указания на характерные для ПСБ концентрации Н2 отсутствуют.
Как же ПСБ могут использовать Н2 при условии его доступности? Известно, что на свету ПСБ могут ассимилировать СО2 и расти на минеральных средах в присутствии не только серных соединений, но и Н2 (Кондратьева, Гоготов, 1981). В темноте многие виды ПСБ могут расти в аэробных условиях за счет дыхания, используя серные соединения. При этом чувствительность к кислороду неодинакова у разных видов, а T. roseopersicina BBS (T. bogorovii) может расти даже при атмосферном рО2 в отличие от других штаммов T. roseopersicina, например, 6311, который растет при рО2 1% (Кондратьева, 1996; Overmann, Pfennig, 1992). Вероятно, в таких условиях ПСБ могли бы использовать и Н2, во всяком случае суспензии клеток ПСБ могут поглощать Н2 в присутствии О2 (Кондратьева, Гоготов, 1981). Что касается роста в темновых анаэробных условиях, он, по-видимому, невозможен (Кондратьева, 1996). Исследования темнового метаболизма показали, что суспензии бактерии T. roseopersicina BBS в анаэробных условиях в темноте способны использовать запасные полисахариды или глюкозу и восстанавливать S0 до H2S (Красильникова, 1976). Для этих же целей может использоваться и молекулярный водород (Красильникова, 1976; Laurinavichene et al., 2007).
Очевидно, что основным типом метаболизма ПСБ является фототрофия, при которой эксплуатируется главное преимущество ПСБ – возможность использовать энергию света. Однако в природе освещенность непостоянна в течение суток. Поэтому метаболизм фототрофных бактерий должен быть адаптирован не только к использованию солнечной энергии, но также химической энергии (хемосинтез), и если не для роста, то, во всяком случае, для поддержания жизнедеятельности при отсутствии света. Известно, что даже при минимальном содержании кислорода в темноте Chromatium okenii способна фиксировать СО2, окисляя сульфид, но в анаэробных условиях этого не наблюдали (Berg et al., 2019).
Суточные колебания в содержании запасных продуктов ПСБ обнаружены в природных популяциях. Ранее было показано, что содержание гликогена и серы ночью снижается, а днем возрастает (Del Don et al., 1994; Mas, van Gemerdem, 1995). Однако в недавних работах обнаружено, что колебания в содержании гликогена в течение суток (день/ночь) незначительны, также не отмечен синтез полигидроксибутирата (Berg et al., 2019). Авторы считают, что использование кислорода может иметь место даже в местообитаниях, считающихся анаэробными, поскольку О2 может потребляться так быстро, что его концентрация постоянно ниже пределов обнаружения (Berg et al., 2019).
В лабораторных экспериментах природные условия были имитированы при изучении хемостатных культур T. roseopersicina М1 в циклическом режиме (день, аэробно/ночь, анаэробно). При этом гликоген синтезировался на свету и расходовался в темноте, причем в темноте наблюдали синтез Бхл (de Wit, van Gemerden, 1990; Mas, van Gemerden, 1995). В недавних экспериментах с Thiodictyon syntrophicum Cad16 при моделировании природных условий также наблюдали темновое окисление глюкозы с образованием сероводорода за счет использования серных глобул (Luedin et al., 2018). Интересно, что в микроаэробных природных условиях у этого штамма изменения при чередовании день/ночь, как выяснилось, затрагивают лишь 1% белков в протеоме, причем днем отмечена положительная регуляция аэробного дыхания, а ночью – стресс-реактивных механизмов (Luedin et al., 2019).
Предполагалось, что темновое восстановление серы не представляет собой неспецифическую побочную реакцию, но является необходимым процессом диссимиляторного метаболизма и служит для поддержания жизнедеятельности в темноте (Pfennig, Biebl, 1981). В то же время эти процессы не могут обеспечить конкурентоспособный рост ПСБ в отсутствие света (Madigan, Jung, 2009). Следует отметить, что в работах, описывающих образование сульфида в темноте, делается акцент на разложение гликогена, а про возможность использования Н2 для этих целей есть лишь единичные упоминания. Можно предположить, что по исчерпании гликогена ПСБ могут использовать для той же цели экзогенные органические вещества или водород. При этом они будут испытывать конкуренцию с другими микроорганизмами за донор электрона, но, вероятно, иметь преимущество в виде эндогенных запасов акцептора электрона (серы).
Таким образом, можно с определенностью говорить о связи физиологии и экологии ПСБ с метаболизмом серных соединений. Однако в отношении метаболизма водорода такой определенности нет, хотя возможность выделять и поглощать водород существует и подкреплена наличием нескольких ферментов, участвующих в этих процессах (см. далее).
МЕТАБОЛИЗМ ВОДОРОДА И ГИДРОГЕНАЗЫ ПСБ
Фототрофные пурпурные бактерии способны к росту в разнообразных условиях: на свету автотрофно, миксотрофно или гетеротрофно, в темноте гетеротрофно или автотрофно. В некоторых условиях рост может происходить с выделением или использованием водорода, т.е. Н2 может являться акцептором электронов, донором электронов и источником энергии (Цыганков, Хуснутдинова, 2014). В качестве побочной реакции выделение водорода на свету катализируют нитрогеназы (НГ), однако для их дерепрессии необходимы специальные условия, как правило, азотное лимитирование или использование молекулярного азота.
Основные ферменты, катализирующие окисление и выделение Н2 – это металлоферменты гидрогеназы (ГД). Гены, кодирующие ГД, идентифицированы в 51 типах бактерий и архей. Гидрогеназные гены присутствуют в разных пропорциях в почвенных, водных и ассоциированных с хозяином метагеномах, что свидетельствует об их широком распространении. Предполагается, что содержание кислорода является главным фактором, влияющим на распределение этих генов в разных экосистемах (Greening et al., 2016). За счет значительной диверсификации ГД стало возможным использование реакций выделения/поглощения Н2 для поддержания роста и выживания микроорганизмов в широком диапазоне условий.
Гидрогеназы подразделяют на 8 основных групп, включающих [NiFe]-гидрогеназы, [FeFe]-гидрогеназы, а также [Fe]-гидрогеназы (Vignais, Billoud, 2007; Calusinska et al., 2010). В обзоре Цыганкова и Хуснутдиновой рассматривается 9 групп ГД (Цыганков, Хуснутдинова, 2014). Высказана точка зрения, что эта классификация недостаточно отражает разнообразие функций экспериментально изученных ГД (Greening et al., 2016). Поэтому были предложены уточнения классификации с учетом филогении аминокислотных последовательностей, металл-связывающих мотивов, прогнозируемой организации генов и биохимических характеристик (Greening et al., 2016). Согласно уточненной классификации выделяют четыре группы (22 подгруппы) [NiFe]-гидрогеназ, три группы (6 подгрупп) [FeFe]-гидрогеназ и небольшую группу [Fe]-гидрогеназ. У пурпурных бактерий обнаружены [NiFe]-гидрогеназы, относящиеся к группам 1, 2b, 3b, 3d и 4 (Цыганков, Хуснутдинова, 2014), по классификации, предложенной ранее (Vignais, Billoud, 2007). К настоящему времени в связи с появлением вновь описанных геномов и по современной классификации (Greening et al., 2016) у пурпурных бактерий обнаружены ГД группы 1 (1c, 1e, 1d), подгруппы 2b, подгруппы 3b и 3d, группы 4 (подгруппы 4a, 4b, 4c, 4d, 4e), а также [FeFe]-гидрогеназы группы A. ПСБ способны синтезировать ГД группы 1 (1c, 1e, 1d), подгруппы 2b, подгрупп 3b и 3d, а также подгруппы 4e (Greening et al., 2016). Кроме того, ген, кодирующий [Fe-Fe]-гидрогеназу группы A, обнаружен у Thiorhodococcus drewsii, однако данных о его экспрессии нет.
Гидрогеназы группы 1
Подгруппа 1с объединяет ГД, участвующие в фумаратном дыхании, причем с возможностью обратной реакции. Гены таких гидрогеназ обнаружены у Lamprocystis purpurea, Thyocystis violascens и Thiorhodovibrio sp. 970 (Greening et al., 2016). Эти гидрогеназы не выделены, и их роль в фумаратном дыхании указанных бактерий не описана.
Подгруппа 1d включает мембранно-связанные водородпоглощающие гидрогеназы, донирующие электроны в пул убихинонов через цитохром. Наиболее хорошо биохимически и молекулярно-биологически изучена гидрогеназа HupSL из пурпурной несерной бактерии Rhodobacter capsulatus (Serebryakova et al., 1984). Гены ГД такого типа обнаружены у T. roseopersicina BBS (T. bogorovii), T. roseopersicina 6311, T. marina, Thioflavicoccus mobilis, Thyocystis violascens, Thiorhodococcus drewsii, L. purpurea и Thiorhodovibrio sp. 970 (Greening et al., 2016). Туда же относятся гидрогеназы Ralstonia e-utropha (Fritsch et al., 2011), Escherichia coli (Volbeda et al., 2013), Aquifex aeolicus (Brugna-Guiral et al., 2003). Синтез этих гидрогеназ, как правило, регулируется в зависимости от концентрации Н2 посредством сенсорных гидрогеназ. Однако у T. roseopersicina BBS сенсорная ГД не функционирует, и синтез гидрогеназы HupSL регулируется тиосульфатом (Nagy et al., 2016). Этот тип ГД напрямую участвует в донировании электронов при фотоавтотрофном росте с использованием водорода. Кроме того, у пурпурных несерных бактерий именно этот тип гидрогеназ поддерживает хемолитоавтотрофный рост бактерий при низкой концентрации кислорода. Их функцию также связывают с участием в поглощении (рециклизации) водорода, выделяемого нитрогеназой на свету, поэтому с целью увеличения выхода водорода создаются мутанты, лишенные этой ГД. В ряде случаев авторам удалось продемонстрировать преимущество таких мутантов при получении водорода. Однако показано, что это преимущество проявлялось лишь при росте в микроаэробных условиях и использовании органических доноров электронов с низкой степенью восстановленности (условным зарядом) углерода, например, малата и сукцината (Laurinavichene et al., 2017).
Подгруппа 1e в новой классификации объединяет ГД isp типа. Это гидрогеназы, у которых между генами, кодирующими малую и большую субъединицу, расположены гены isp1 и isp2. Наиболее хорошо изучены ферменты этого типа у T. roseopersicina BBS (Gogotov et al., 1978) и A. vinosum (van Heerikhuizen et al., 1981). Это мембранно-ассоциированные ГД, активный центр которых расположен в периплазме, а закрепление на мембране, по-видимому, происходит за счет трансмембранного белка Isp1 (Tengolics et al., 2014). Согласно классификатору ГД, функции гидрогеназ Isp фундаментально связаны с серным метаболизмом и заключаются в серном дыхании с использованием водорода как донора электронов и серы в качестве терминального акцептора (Søndergaard et al., 2016).
Сенсорные гидрогеназы (группа 2b)
Это цитоплазматические ферменты, функция которых заключается в регуляции синтеза других ГД в ответ на появление Н2. При этом регуляция осуществляется с использованием каскадного гистидин-киназного механизма (Greening et al., 2016). Такие ГД обнаружены и у несерных, и у серных пурпурных бактерий (Цыганков, Хуснутдинова, 2014). Несмотря на то, что у пурпурной серной бактерии T. roseopersicina BBS обнаружены гены такой гидрогеназы (Kovacs et al., 2002), участие ее в регуляции синтеза других ГД не доказано (Kovacs et al., 2005b). Аналогичная ГД обнаружена у R. eutropha (Lenz, Friedrich, 1998). ГД такого типа свойственна низкая активность в сочетании со стабильностью в присутствии кислорода, что может быть обусловлено особенностями газового канала (Fritsch et al., 2013). Среди ПСБ гены таких ГД встречаются у других штаммов T. roseopersicina, T. marina, L. purpurea, Thiorhodococcus drewsii (Greening et al., 2016).
Обратимые гидрогеназы, взаимодействующие с НАДФ или НАД (группа 3b и 3d)
ГД группы 3 – это ферменты, имеющие диафоразную часть. Предполагается, что их роль состоит в поддержании редокс статуса клетки (Appel, Schulz, 1998). В условиях избытка внутриклеточного восстановителя (НАДФН или НАДН) ГД групп 3b и 3d выделяют водород. При недостатке восстановителя и наличии водорода эти ГД восстанавливают НАД (3b) или НАДФ (3d). При этом у T. roseopersicina BBS процесс поглощения водорода может быть светозависим (Rakhely et al., 2007).
ГД типа 3b (НАДФ-зависимые) обнаружены у A. vinosum и Thiorhodospira sibirica (Greening et al., 2016). Для экстремальных термофильных архей Pyrococcus furiosus отмечено, что Hyh-1 ГД 3b типа способна к восстановлению серы в присутствии Н2 (Ma et al., 1993). Однако ГД 3b типа у пурпурных серных бактерий биохимически не охарактеризованы, и их роль в метаболизме еще предстоит выяснить.
ГД типа 3d (НАД-зависимые) обнаружены, наряду с A. vinosum, у T. roseopersicina BBS (Kovacs et al., 2005a), T. roseopersicina 6311, T. marina, Thio-rhodovibrio sp. 970, Thioflavicoccus mobilis, L. purpurea, Thyocystis violascens, Thiorhodococcus drewsii, Thiohalocapsa sp. PB-PSB1 (Greening et al., 2016). Следует отметить, что гидрогеназный модуль (HoxYH) этой ГД выделен в чистом виде (Long et al., 2007), и показано, что она содержит лишь один FeS кластер в малой субъединице. Авторам не удалось получить полный комплекс, обладающий диафоразной частью.
Мембрансвязанные гидрогеназы, выделяющие водород (группа 4e)
Группа 4e объединяет так называемые Ech ГД. Это ферменты, выделяющие водород, взаимодействуя с восстановленным ферредоксином. Наиболее хорошо изучена роль Ech ГД у метаногенной архебактерии Methanosarcina barkeri Fusaro (Meuer, Kuettner, 2002). У этой бактерии показано, что в зависимости от субстратов эта мембранно-связанная ГД участвует или в поглощении водорода, или в его выделении. Гены этой ГД обнаружены у таких ПСБ, как Thioflavicoccus mobilis, Thiocystis violascens и A. vinosum. Однако роль этого фермента в метаболизме ПСБ неясна, сам фермент не выделен и не охарактеризован.
Таким образом, метаболизм водорода у ПСБ наиболее подробно изучен у T. roseopersicina BBS и A. vinosum. У T. roseopersicina BBS к настоящему времени обнаружено 4 экспрессируемых гидрогеназы: HupSL, Hox1, Hox 2 и HydSL (Rakhely et al., 2004; Palagy-Meszaros et al., 2009; Maroti et al., 2010). Структурные гены hydSL у T. roseopersiсina не кластеризованы с аксессорными генами (Kovacs et al., 2002), что не свойственно для генов ГД, но показано, что в ее сборке участвуют гены группы hyp, а также специфичная эндопептидаза hynD (Maroti et al., 2003). Гены большой и малой субъединиц разъединены генами isp1/isp2, предположительно связанными с серным метаболизмом. В последнее время ГД такого типа называют также isp-гидрогеназами (Greening et al., 2016), они обнаружены в геномах ряда микроорганизмов (Søndergaard et al., 2016).
У A. vinosum в геноме обнаружено 5 гидрогеназ: мембранно-связанные HydSL, HupSLC и, предположительно, ферредоксин-зависимая ГД; цитоплазматическая НАД-зависимая HoxEFUYH; возможно, мембранно-ассоциированная НАДФ-зависимая гидрогеназа, близкая к ГД, участвующим в восстановлении серы. Три последних ГД не изучены и их роль в метаболизме ПСБ неизвестна.
Такое разнообразие ГД способно обеспечивать процессы, связанные с выделением или поглощением водорода, как в аэробных, так и анаэробных условиях, в т.ч. связанные с окислением/восстановлением серы. Это аноксигенный фотосинтез, дыхание, брожение, фиксация СО2, сенсорные механизмы.
МЕТАБОЛИЗМ СЕРЫ У ПСБ
Для конструктивного метаболизма в качестве источника серы большинство ПНСБ и отдельные представители ПСБ используют сульфаты в процессе ассимиляторной сульфатредукции. Однако значительное число ПСБ не используют сульфат, некоторые не используют тиосульфат или серу, но все используют сульфид (Кондратьева, 1996; Frigaard, Dahl, 2009; Dahl, 2015). Метаболизм серы у ПСБ характеризуется разнообразием биохимических путей, при этом в исследованиях основное внимание уделяется окислительным процессам, которые имеют место при фотосинтезе или аэробном дыхании, а восстановительные (анаэробные) процессы освещены мало. У ПСБ окисление серных соединений начинается с образования серных глобул, которые у семейства Chromatiaceae расположены внутриклеточно, в периплазме, а у представителей Ectothiorhodospiraceae – внеклеточно (Pattaragulwanit et al., 1998; Frigaard, Dahl, 2009). Известен также один вид Thiorhodospira sibirica, у которого сера откладывается и внеклеточно, и внутриклеточно (Bryantseva et al., 1999).
Наиболее подробно изучен серный метаболизм у A. vinosum с использованием не только биохимического и структурного анализа ферментов, но и системного подхода, включая сравнительный геномный анализ, профили транскриптомики, протеомики, метаболомики (Weissgerber et al., 2013, 2014а, 2014b; Dahl, 2015). Имеющаяся информация о возможных путях метаболизма серы у ПСБ обобщена в обзорах К. Даль (Dahl, 2015, 2017) и представлена на рис. 3.
Рис. 3.
Модель путей окисления серных соединений у A. vinosum и связь серного метаболизма с HydSL гидрогеназой (по Dahl, 2017).
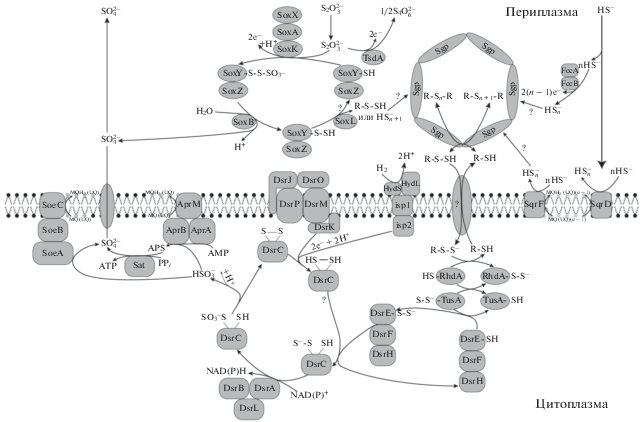
Окисление тиосульфата $\left( {{{S}_{2}}O_{3}^{{2--}}} \right)$
Окисление тиосульфата у ПСБ возможно двумя путями: с образованием тетратионата (S4${\text{O}}_{6}^{{2 - }}$) или его диспропорционированием с образованием сульфата $\left( {{\text{SO}}_{4}^{{2 - }}} \right)$ и молекулярной серы с участием Sox-пути, причем у A. vinosum есть ферменты обоих путей. В тетратионатном пути используется периплазматическая цитохром с-тиосульфатоксидоредуктаза TsdA, которая связана с фотосинтетической или дыхательной ЭТЦ через фьюжн белок TsdBA или высокопотенциальный железо-серный белок HiPIP (Dahl, 2017). Несмотря на видимое отсутствие серных глобул в некоторых условиях роста, их образование является обязательной стадией окисления тиосульфата у A. vinosum и других ПСБ. У них сульфановая сера с участием SoxY переносится на запасную серу с нулевой валентностью (Welte et al., 2009). В отличие от этого, окисление тиосульфата у некоторых факультативно хемо- или фотолитотрофных бактерий происходит через Sox-путь, но без образования запасной серы, при этом оба атома серы в тиосульфате окисляются до сульфата (Frigaard, Dahl, 2009).
Окисление сульфида (HS–)
Предполагается наличие двух путей окисления сульфида: через сульфид:хинон оксидоредуктазы SqrD и SqrF с восстановлением пула убихинонов/менахинонов или через флавоцитохром с‑сульфиддегидрогеназу FccAB (Reinartz et al., 1998; Gregersen et al., 2011; Weissgerber et al., 2011). У представителей Chromatiaceae как правило функционируют оба пути, тогда как у Ectothiorhodospiraceae обнаружен только второй путь (Dahl, 2017). Считается, что он приспособлен для окисления сульфида при низких концентрациях, т.к. обладает высокой аффинностью (Brune, 1995). В обоих случаях продуктами окисления сульфида являются полисульфиды, но механизм образования из них серных глобул пока не ясен.
Окисление серы (экстраклеточной и внутриклеточной)
Элементарная сера (S0) состоит из колец S8 (S7) и цепочек полимерной серы и практически нерастворима в воде. У ПСБ сера сначала поступает в клетку с формированием внутриклеточных серных глобул и лишь затем окисляется до сульфата. Серные глобулы представляют собой длинные цепочки серы, которые могут заканчиваться органическими остатками (Prange et al., 2002). У A. vinosum глобулы имеют белковую оболочку, состоящую из 4 гидрофобных белков, SgpABCD (Brune, 1995). Относительное количество мРНК соответствующих генов возрастает в присутствии сульфида или тиосульфата в среде (Weissgerber et al., 2013). Эти гены обнаруживаются у представителей семейства Chromatiaceae, но не Ectothiorhodospiraceae. В качестве транспортеров в цитоплазму экстраклеточной или периплазматической серы предположительно выступают низкомолекулярные персульфиды, например, персульфид глутатионамида. У A. vinosum существует обширная сеть переноса серы на основе Cys-SSH с последовательной передачей атомов серы на активный центр сульфитредуктазы через каскад промежуточных персульфидов белков с участием роданазы (RhdA) и белков TusA, DSrE2A, DsrE, DsrC (Dahl, 2015, 2017). Как полагают, цитоплазматические ферменты всегда имеют дело с серой, связанной с белками, а не со свободными серными соединениями. Таким образом, предотвращается возможное токсическое действие сульфида, а с другой стороны, такие белки могут служить серным депо в цитоплазме, способствуя быстрой адаптации клеток к меняющимся условиям (Dahl, 2015; Tanabe et al., 2019).
Обычно запасная сера рассматривается как донор электронов для фотосинтеза или дыхания. Ранее считалось, что серные глобулы могут служить также резервным электронным акцептором для осуществления рудиментарного серного дыхания. В анаэробных условиях в темноте ПСБ могут восстанавливать серу до сульфида (van Gemerden, 1968; Truper, 1984). Этот процесс может быть связанным с окислением гликогена до полигидроксибутирата и диссипированием избытка восстановительных эквивалентов (van Gemerden, 1968). Однако в последнее время эти процессы изучались мало.
Для окисления внутриклеточной серы предположительно используются два пути: Dsr-путь, использующий обратимую диссимиляторную сульфитредуктазу rDsrAB, и новый путь с использованием ферментов, аналогичных гетеродисульфидредуктазе (Hdr), обнаруженный у некоторых фототрофных представителей Ectothio-rhodospiraceae (Venceslau et al., 2014; Dahl, 2017). У фототрофов rDsrAB отвечает за образование сульфита при окислении в цитоплазме персульфидной серы белка DsrС (Stockdreher et al., 2014; Venceslau et al., 2014; Tanabe et al., 2019). Недавно установлено, что железо-серный флавопротеин DsrL является переносчиком электронов от НАДН к DsrAB (Loffler et al., 2020). У T. roseopersicina и C. vinosum, как и у других ПСБ, есть гены диссимиляторной сульфитредуктазы dsrE-C, ds-rM и dsrK, причем соответствующие белки dsrM и dsrK обнаруживают значительную гомологию с белками, участвующими в водородном метаболизме – isp1и isp2 (Dahl et al., 1999).
Окисление сульфита $SO_{3}^{{2--}}$ до сульфата $SO_{4}^{{2--}}$
Для окисления сульфита, находящегося в периплазме, могут использоваться два типа систем: Sor и Sox, из которых у ПСБ есть только вторая, хотя и в измененном виде. Она не включает So-xCD белков, но использует периплазматический субстрат-связывающий белок SoxYZ (Dahl et al., 2013). Использование сульфита, находящегося в цитоплазме, может протекать непрямым (sat, aprBA) или прямым путем (soe). Непрямой путь осуществляется через аденозин-5' фосфосульфат (АФС), с участием АФС редуктазы (AprBA) и АТФ сульфурилазы (Sat) (Dahl, 1996; Frigaard, Dahl, 2009). Предполагается, что электроны, освобождающиеся при образовании АФС из сульфита и АМФ, передаются на белок AprM, являющийся мембранным якорем (Meyer, Kuever, 2007). АФС редуктазный путь полностью отсутствует у Ectothiorhodospiraceae, обнаружен не у всех представителей Chromatiaceae, и, хотя есть у A. vinosum, но не является обязательным (Dahl, 2017). У этого организма основным сульфитокисляющим ферментом является мембранно-связанный железо-серный молибдопротеин SoeABC (прямой путь).
Ассимиляция сульфата $SO_{4}^{{2--}}$
Многие фототрофные бактерии способны ассимилировать и восстанавливать сульфат в отсутствие восстановленных соединений серы. В то же время некоторые виды, живущие в местообитаниях, богатых сероводородом, полностью утратили способность к сульфатредукции. Характерно, что пурпурные бактерии, не способные к фотоорганотрофному росту, не способны и к ассимиляции сульфата (Imhoff, 2005; Sander, Dahl, 2009). В частности, у T. roseopersicina BBS не обнаружено способности к ассимиляционной сульфат редукции, хотя пути окисления серных соединений близки к A. vinosum.
Ассимиляция сульфата и диссимиляторное окисление серы представляют собой отдельные пути, включающие специализированные ферменты. У A. vinosum поглощение сульфата осуществляется при участии периплазматической субстрат-связывающей транспортной системы (CysATWP), внутри клетки сульфат активируется АТФ-сульфурилазой (Frigaard, Dahl, 2009; Sander, Dahl, 2009). У A. vinosum отсутствует ген АФС киназы и присутствует ген АФС редуктазы, т.е. ассимиляция сульфата протекает без промежуточного образования ФАФС, как и у высших растений. Под действием АФС редуктазы происходит восстановительное расщепление АФС с образованием сульфита и АМФ, и далее сульфит восстанавливается до сульфида под действием ферредоксин-зависимой сульфитредуктазы (Dhillon et al., 2005; Frigaard, Dahl, 2009). Присутствие cysB означает, что гены ассимиляторной сульфатредукции экспрессируются только в отсутствие восстановленных серных соединений (Neuman et al., 2000).
СВЯЗЬ МЕТАБОЛИЗМА ВОДОРОДА И СЕРЫ У ПСБ
Физиологические процессы
Почти полвека тому назад проводились детальные физиологические исследования водородного и серного метаболизма у ПСБ в связи с изучением типа питания (см. работы Кондратьевой, Гоготова, Ивановского, Pfennig, Truper, van Gemerden). Исследования проводились главным образом на серных бактериях, относящихся к родам Allochromatium и Thiocapsa.
Известно, что ПСБ используют серные соединения в качестве доноров электрона для роста на свету за счет фотосинтеза и в микроаэробных условиях в темноте за счет дыхания (см. раздел 2). В ряде случаев в качестве доноров электрона наряду с серными соединениями (или вместо них) может использоваться молекулярный водород (Кондратьева, Гоготов, 1981; Imhoff, 2005). Это означает, что серные соединения и Н2 могут рассматриваться как альтернативные доноры электронов для одних и тех же восстановительных процессов. Некоторые примеры конкуренции между ними будут рассмотрены ниже.
Внутриклеточная сера, образующаяся при использовании серных соединений, может служить также и акцептором электронов. Этот независимый от света процесс идет с образованием сульфида, а в качестве основных доноров электрона используются запасные полисахариды или экзогенные органические вещества, а также молекулярный водород. Последнее было показано на примере суспензий клеток T. roseopersicina BBS (Красильникова,1976; Кондратьева, 1996; Laurinavichene et al., 2007). Предполагается, что эти процессы могут иметь энергетическое значение, но их роль в метаболизме ПСБ не доказана.
Помимо поглощения водорода возможно также выделение Н2 с использованием серных соединений (тиосульфат, сера), причем реакция протекает исключительно на свету. Ранее считалось, что этот процесс имеет место только в азотфиксирующих условиях и требует участия нитрогеназы (Кондратьева, Гоготов, 1981). Позднее было установлено, что при репрессии нитрогеназы выделение водорода может катализировать одна или даже две ГД (см. ниже, а также раздел 3). Полученные данные указывают на связь между водородным и серным метаболизмом с одной стороны и фотосинтезом с другой.
Связь отдельных ГД с метаболизмом серы
В последнее время водородный и серный метаболизм были изучены на генетическом уровне с уточнением возможных ферментативных путей. Следует отметить, что ферменты метаболизма водорода изучали главным образом у T. roseopersicina BBS, а ферменты метаболизма серы у A. vinosum, т.е. у бактерий близких во многих отношениях. Обнаружение четырех функционирующих NiFe гидрогеназ у T. roseopersicina (см. раздел 3) поставило вопрос, какая именно ГД принимает участие в том или ином ранее описанном процессе, в частности, в связи с метаболизмом серы. Получение мутантов, лишенных той или иной ГД или же содержащих единственную ГД, позволило высказать гипотезы о функциях каждой ГД и провести экспериментальные исследования (Rakhely et al., 2004, 2007; Laurinavichene et al., 2007). Дальнейший прогресс в этой области связан с выяснением структуры ГД оперонов, особенностей структурных и электрон-транспортных субъединиц ГД. Как уже упоминалось выше, в гидрогеназном опероне HynSL гены большой и малой субъединиц разъединены генами isp1 и isp2, причем последний имел сходство с гетеродисульфидредуктазой D метаногенов и с DsrK субъединицей комплекса, участвующего в окислении серы у ПСБ, что являлось косвенным указанием на связь этой ГД с серным метаболизмом (Rákhely et al., 1998; Dahl et al., 1999; Palágyi-Mészáros et al., 2009; Tengolics et al., 2014).
Текущие результаты пока не дают четкой картины взаимосвязи водородного метаболизма с серным, но освещают ее отдельные звенья с участием той или другой ГД.
Hup ГД. Основная функция мембранно-связанной поглощающей Hup ГД связана с передачей электронов от водорода в пул убихинонов/менахинонов с дальнейшим их использованием при анаэробном фотосинтезе или дыхании (Vignais, Billoud, 2007). Очевидно, Hup ГД непосредственно не участвует в восстановлении или окислении серных соединений. Однако на основании того, что эта гидрогеназа, как и у пурпурной несерной бактерии R. capsulatus (Vignais, 2001), содержит цитохром с (HupC), связывающий поглощение водорода с восстановлением убихинонов, а также косвенных данных, полученных на мутанте GB1131, содержащем только HupSL ГД (Laurinavichene et al., 2007), можно полагать, что серные соединения могут быть конкурентным к Н2 донором электронов при фотосинтезе и в темновых аэробных условиях.
Интересно, что Н2 не является регулятором синтеза этого фермента у T. roseopersicina, в отличие от аналогичных Н2-поглощающих ГД, вследствие отсутствия экспрессии сенсора ГД HupTUV. Вместо этого синтез регулируется концентрацией тиосульфата, т.е. серного соединения и конкурентного донора электронов (Nagy et al., 2016). В настоящее время предполагается тройной механизм контроля HupSL ГД у T. roseopersicina, в которой тиосульфат является первичным регулятором: при высокой концентрации тиосульфата синтез фермента репрессирован (независимо от присутствия/отсутствия регулятора hupО или другой ГД). При низкой концентрации тиосульфата экспрессия HupSL ГД повышена, однако при удалении Hox1 ГД активность и экспрессия HupSL понижаются, а при дополнительном удалении hupO – повышаются. При этом Н2 становится дополнительным модулятором экспрессии hup в hox1 мутанте. Таким образом, в настоящее время HupO рассматривается как звено, связывающее метаболизм тиосульфата с сетью ГД у T. roseopersicina (Nagy et al., 2016).
Hox ГД (1). Цитоплазматическая Hox1 гидрогеназа при репрессии НГ может участвовать в выделении Н2 на свету, в поглощении Н2 на свету, а также в темновом выделении водорода (Rakhely et al., 2004, 2007; Laurinavichene et al., 2007). Показано, что количество HydB увеличивается в 4.5 раза при росте A. vinosum на сульфиде (Weissberger et al., 2014a). На свету для выделения водорода могут использоваться серные соединения, донирующие электроны в фотосинтетическую электрон-транспортную цепь (сульфид, тиосульфат, S0). Так как окисление серных соединений является светозависимым процессом, то и выделение Н2 из серных соединений также зависит от света. В этом случае видна прямая связь серного и водородного путей. В темноте субстратами для выделения Н2 являются органические соединения (эндогенные или экзогенные углеводы). Они же могут служить восстановителями для серных соединений с образованием сульфида, следовательно, здесь возможна конкуренция между двумя путями использования субстрата – “водородным” и “сульфидным”. При репрессии НГ выделение Н2 на свету у мутанта GB1121 (Hox+) T. roseopersicina, не имеющих Hup и Hyn ГД, сохраняется на уровне дикого типа и обеспечивается исключительно Hox гидрогеназой (Rakhely et al., 2007). При наличии НГ у того же мутанта выделение Н2 находится на уровне дикого типа, но существенно ниже, чем у мутанта М539 (с нарушением синтеза всех ГД). Из этого следует, что рециклизация Н2 может обеспечиваться и Hox1 гидрогеназой (Rakhely et al., 2007). Предполагается, что эта ГД может также использовать Н2 как дополнительный донор электронов для фиксации СО2 на свету, но в присутствии серных соединений, что означает косвенную связь между серным метаболизмом и Hox1 гидрогеназой (Laurinavichene et al., 2007).
У T. roseopersicina BBS обнаружена еще одна гидрогеназа Hox типа (Maroti et al., 2010). Если Hox1 гидрогеназа проявляет активность при избытке тиосульфата, то Hox2 наиболее активна при малом содержании тиосульфата и при добавлении глюкозы. В этих условиях клетки выделяли водород. В условиях азотфиксации Hox2 ГД была способна к рециклизации выделяющегося за счет НГ водорода. Таким образом, обе Hox ГД являются обратимыми, причем только Hox1 гидрогеназа связана с серным метаболизмом.
Hyd ГД (isp тип). Как уже отмечалось выше, эта гидрогеназа считается связанной с серным метаболизмом.
У T. roseopersicina экспрессия HydSL гидрогеназы в анаэробных условиях активируется регулятором FnrT (Kovacs et al., 2005c; Vignais, 2009). Такие регуляторы Fnr-типа необходимы для перехода от аэробного к анаэробному метаболизму. Кроме того, показано, что тиосульфат не влияет на уровень экспрессии этого фермента у T. roseopersicina (Tengolics et al., 2014). При изучении культуры ПСБ Thiodiction syntrophicum Cad 16T, растущей в циклически меняющихся условиях анаэробно (свет)/микроаэробно (темнота), идентифицированы 50 белков, синтез которых заметно изменяется при смене условий, однако ГД в их числе не обнаружена (Luedin et al., 2019).
У A. vinosum было проведено детальное изучение экспрессии генов, белков и метаболитов при фотоавтотрофном росте (с использованием разных источников серы) и фотогетеротрофном росте с использованием малата (Weissgerber et al., 2013, 2014a, 2014b). При росте на сульфиде было обнаружено значительное увеличение уровня мРНК для оперона hyd (Alvin_2036–Alvin_2040), кодирующего HydSL гидрогеназу (Weissgerber et al., 2013). Далее было показано, что количество белков Isp1 и Isp2 также увеличивается в 2–3 раза при росте на сульфиде, тиосульфате, сере (Weissgerber et al., 2014a). У мутанта Alvin_2036–Alvin_2040 с канамициновой вставкой не обнаружилось серьезных изменений роста или ассимиляции сульфата. Однако при его выращивании при повышенной концентрации сульфида (8 мМ) скорость запасания внутриклеточной серы понизилась почти в 2 раза по сравнению с родительским штаммом. При этом общее содержание серы не изменилось. Не изменились также скорости окисления тиосульфата, серы и сульфита. Авторы считают, что это указывает на роль ГД в запасании серы (Weissgerber et al., 2014a). Возможная связь ГД с серным метаболизмом представлена на рис. 3. Гидрогеназный Isp1–Isp2 комплекс может переносить электроны от Н2, окисляемого в периплазме, через мембранно-связанный b-цитохром (D-srM-подобный Isp1) и мембран-ассоциированный цитоплазматически ориентированный Ds-rK-подобный белок (Isp2) на цитоплазматический гетеродисульфид. При этом DsrC-дисульфид (рис. 3) может быть донором серы для комплекса HydSL гидрогеназы и Isp1–Isp2 белков. При этом следует учитывать, что, несмотря на однонаправленный характер реакций, указанных на этом рисунке, ряд реакций могут быть обратимыми, в частности, реакции, катализируемые HydSL гидрогеназой.
Ранее было показано, что HydSL гидрогеназа T. roseopersicina участвует в независимом от света восстановлении запасной серы в атмосфере водорода (Laurinavichene et al., 2007). Физиологическая роль этой реакции неясна, однако есть свидетельства, что она требует присутствия электрон-транспортных субъединиц Isp1 и Isp2 (Palágyi-Mészáros et al., 2009). Позднее с использованием мутанта GB2131 (Hyd+), содержащего только эту ГД, было продемонстрировано ее участие в светозависимом образовании Н2 из тиосульфата и серы, т.е. в реакции, характерной для Hox ГД (Tengolicks et al., 2014). Причем серные соединения могут использоваться не только для выделения Н2, но и для образования сульфида. Поскольку количества образованного Н2 и сульфида находятся в обратной зависимости, эти процессы рассматриваются как конкурентные (Tengolicks et al., 2014). В соответствии со стандартным редокс-потенциалом восстановление серы (т.е. образование сульфида) предпочтительнее, чем образование Н2, хотя потенциал сильно зависит от фактической концентрации (Tengolicks et al., 2014). Другое объяснение этой обратной взаимосвязи у мутанта GB2131(Hyd+) заключается в возможности поглощения Н2, выделяемого Hox гидрогеназой, с восстановлением S0 и образованием сульфида, т.е. рециклизации Н2 (Rákhely et al., 2007; Weissberger et al., 2014a).
Несмотря на многочисленные доказательства участия HydSL гидрогеназы в реакциях окисления/восстановления серных соединений, пока не очевидно, какие преимущества бактериям дает наличие этой гидрогеназы (причем синтезируемой конститутивно). Следует отметить, что по нашим оценкам доля этой гидрогеназы среди других белков может составлять до 0.05%, что может подтверждать ее принадлежность к белкам энергетического метаболизма. Однако мутант, лишенный HydSL гидрогеназы, в лабораторных условиях на стандартной среде растет не хуже дикого штамма. Можно предположить, что этот фермент важен в природных условиях при непостоянстве концентраций субстратов/доноров электрона и изменяющейся освещенности. До сих пор такие условия не были промоделированы в лабораторных экспериментах.
ЗАКЛЮЧЕНИЕ
Таким образом, гидрогеназы ПСБ, хотя и по-разному, но функционально связаны с серным метаболизмом. Причем можно видеть и прямую связь (выделение/поглощение Н2 с использованием серных соединений), и конкурентные взаимоотношения (образование или Н2, или сульфида при использовании сахаров; окисление или серных соединений, или Н2 при аэробном дыхании). Учитывая, что роль некоторых ГД у ПСБ до сих пор неясна, нельзя исключить, что связь метаболизма серы и Н2 окажется еще более тесной, чем представляется в настоящий момент.
Список литературы
Горленко В.М., Дубинина Г.А., Кузнецов С.И. Экология водных микроорганизмов. М.: Наука, 1977. 288 с.
Нетрусов А.И., Бонч-Осмоловская Е.А., Горленко В.М., Иванов М.В., Каравайко Г.И., Кожевин П.А., Колотилова Н.Н., Котова И.Б., Максимов В.Н., Ножевникова А.Н., Семенов А.М., Турова Т.П., Юдина Т.Г. Экология микроорганизмов. М.: Юрайт, 2013. 268 с.
Грабович М.Ю. Участие прокариот в круговороте серы // Соросовский образовательный журн. 1999. Т. 12. С. 16–20.
Кондратьева Е.Н. Автотрофные прокариоты. М.: МГУ, 1996. 312 с.
Кондратьева Е.Н., Гоготов И.Н. Молекулярный водород в метаболизме микроорганизмов. М.: Наука; 1981. 344 с.
Красильникова Е.Н. О темновом анаэробном метаболизме Thiocapsa roseopersicina // Микробиология. 1976. Т. 45. С. 372–374.
Krassilnikova E.N. Anaerobic metabolism of Thiocapsa roseopersicina in the darkness // Mikrobilologiya (Russ.). 1976. V. 45. P. 372–374.
Турова Т.П., Кеппен О.И., Ковалева О.Л., Слободова Н.В., Берг И.А., Ивановский Р.Н. Филогенетическое положение пурпурной серной бактерии Thiocapsa sp. штамм BBS на основании анализа генов 16S рРНК, cbbL и nifH и описание его в качестве вида Thiocapsa bogorovii sp. nov. // Микробиология. 2009. Т. 78. С. 381–392.
Tourova T., Keppen O.I., Kovaleva O.L., Slobodova N.V., Berg I.A., Ivanovsky R. Phylogenetic characterization of the purple sulfur bacterium Thiocapsa sp. BBS by analysis of the 16S rRNA, cbbL, and nifH genes and its description as Thiocapsa bogorovii sp. nov., a new species // Microbiology (Moscow). 2009. V. 78. P. 339–349.
Цыганков А.А., Хуснутдинова А.Н. Участие Н2 в метаболизме пурпурных бактерий и перспективы практического использования // Микробиология. 2015. Т. 84. С. 3–26.
Tsygankov A.A, Khusnutdinova A.N. Hydrogen in metabolism of purple bacteria and prospects of practical application // Microbiology (Moscow). 2015. V. 84. P. 1–22.
Appel J., Schulz R. Hydrogen metabolism in organisms with oxygenic photosynthesis: Hydrogenases as important regulatory devices for a proper redox poising? // J. Photochem. Photobiol. B. Biol. 1998. V. 47. P. 1–11.
Berg J.S., Pjevac P., Sommer T., Buckner C.R.T., Philippi M., Hach P.F., Liebeke M., Holtappels M., Danza F., Tonolla M., Sengupta A., Schubert C.J., Milucka J., Kuypers M.M.M. Dark aerobic sulfide oxidation by anoxygenic phototrophs in anoxic waters // Environ. Microbiol. 2019. V. 21. P. 1611–1626.
Bhatnagar S., Cowley E.S., Kopf S.H., Castro S.P., Kearney S., Scott C. Dawson S.C., Hanselmann K., Emil Ruff S.E. Microbial community dynamics and coexistence in a sulfide-driven phototrophic bloom // Environ. Microbiome. 2020. V. 15. P. 1–17. https://doi.org/10.1186/s40793-019-0348-0
Brugna-Guiral M., Tron P., Nitschke W., Stetter K.-O., Burlat B., Guigliarelli B., Bruschi M., Giudici-Orticoni M.T. [NiFe] hydrogenases from the hyperthermophilic bacterium Aquifex aeolicus: Properties, function, and phylogenetics // Extremophiles. 2003. V. 7. P. 145–157.
Brune D.C. Sulfur compounds as photosynthetic electron donors // Anoxygenic Photosynthetic Bacteria. Advances in Photosynthesis and Respiration. V. 2 / Ed. Blankenship R.E., Madigan M.T., Bauer C.E. Dordrecht: Springer, 1995. P. 847–870.
Bryantseva I.A., Gorlenko V.M., Kompantseva E.I., Imhoff J.F., Süling J., Mityushina L. Thiorhodospira sibirica gen. nov., sp. nov., a new alkaliphilic purple sulfur bacterium from a Siberian soda lake // Int. J. Syst. Evol. Microbiol. 1999. V. 49. P. 697–703.
Calusinska M., Happe T., Joris B., Wilmotte A. The surprising diversity of clostridial hydrogenases: a comparative genomic perspective // Microbiology (SGM). 2010. V. 156. P. 1575–1588.
Dahl C. Insertional gene inactivation in a phototrophic sulphur bacterium: APS-reductase-deficient mutants of Chromatium vinosum // Microbiology (SGM). 1996. V. 142. P. 3363–3372.
Dahl C. Cytoplasmic sulfur trafficking in sulfur-oxidizing prokaryotes // IUBMB Life. 2015. V. 67. P. 268–274.
Dahl C. Sulfur metabolism in phototrophic bacteria // Modern Topics in the Phototrophic Prokaryotes: Metabolism, Bioenergetics, and Omics / Ed. Hallenbeck P.C., Cham: Springer Int. Publishing, 2017. P. 27–66.
Dahl C., Franz B., Hensen D., Kesselheim A., Zigann R. Sulfite oxidation in the purple sulfur bacterium Allochromatium vinosum: identification of SoeABC as a major player and relevance of SoxYZ in the process // Microbiology (SGM). 2013. V. 159. P. 2626–2638.
Dahl C., Rákhely G., Pott-Sperling A.S., Fodor B., Takacs M., Toth A., Kraeling M., Gyorfi K., Kovacs A., Tusz J., Kovacs K.L. Genes involved in hydrogen and sulfur metabolism in phototrophic sulfur bacteria // FEMS Microbiol. Lett. 1999. V. 180. P. 317–324.
de Wit R., van Gemerden H. Growth and metabolism of the purple sulfur bacterium Thiocapsa roseopersicina under combined light/dark and oxic/anoxic regimens // Arch. Microbiol. 1990. V. 154. P. 459–464.
Del Don C., Hanselmann K.W., Peduzzi R., Bachofen R. Biomass composition and methods for the determination of metabolic reserve polymers in phototrophic sulfur bacteria // Aquat. Sci. 1994. V. 56. P. 1–15.
Dhillon A., Goswami S., Riley M., Teske A., Sogin M. Domain evolution and functional diversification of sulfite reductases // Astrobiology. 2005. V. 5. P. 18–29.
Frigaard N.U., Dahl C. Sulfur metabolism in phototrophic sulfur bacteria // Advances in Microbial Physiology / Ed. Poole R. Academic Press, 2008. V. 54. P. 103–200.
Fritsch J., Lenz O., Friedrich B. The maturation factors HoxR and HoxT contribute to oxygen tolerance of membrane-bound [NiFe] hydrogenase in Ralstonia eutropha H16 // J. Bacteriol. 2011. V. 193. P. 2487–2497.
Fritsch J., Lenz O., Friedrich B. Structure, function and biosynthesis of O2-tolerant hydrogenases // Nat. Rev. Microbiol. 2013. V. 11. P. 106–114.
Ghosh W., Dam B. Biochemistry and molecular biology of lithotrophic sulfur oxidation by taxonomically and ecologically diverse bacteria and archaea // FEMS Microbiol. Rev. 2009. V. 33. P. 999–1043.
Greening C., Biswas A., Carere C.R., Jackson C.J., Taylor M.C., Stott M.B., Cook G.M., Morales S.E. Genomic and metagenomic surveys of hydrogenase distribution indicate H2 is a widely utilised energy source for microbial growth and survival // ISME J. 2016. V. 10. P. 761–777.
Greening C., Boyd E. Editorial: Microbial hydrogen metabolism // Front. Microbiol. 2020. V. 11. Art. 56. P. 1–4.
Greening C., Constant P., Hards K., Morales S.E., Oakeshott J.O., Russell R.J., Taylor M.C., Berney M., Conrad R., Gregory M. Cook G.M. Atmospheric hydrogen scavenging: from enzymes to ecosystems // Appl. Environ. Microbiol. 2015. V. 81. P. 1190–1199.
Gregersen L.H., Bryant D.A., Frigaard N.-U. Mechanisms and evolution of oxidative sulfur metabolism in green sulfur bacteria // Front. Microbiol. 2011. V. 2. Art. 116. P. 1–14.
Gogotov I.N., Zorin N.A., Serebriakova L.T., Kondratieva E.N. The properties of hydrogenase from Thiocapsa roseopersicina // Biochim. Biophys. Acta. 1978. V. 523. P. 335–343.
Imhoff J.F. Family Chromaticeae // Bergey’s Manual of Systematic Bacteriology. 2nd edn. / Ed. Brenner D.J., Krieg N.R., Staley J.T. N.Y.: Springer, 2005. V. 2. P. 3–9.
Imhoff J.F. The Family Chromatiaceae // The Prokaryotes: Gammaproteobacteria / Ed. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg: Springer, 2014. P. 151–178.
Kovács K.L., Fodor B., Kovács Á.T., Csanadi G., Maroti G., Balogh J., Arvani S., Rakhely G. Hydrogenases, accessory genes and the regulation of [NiFe] hydrogenase biosynthesis in Thiocapsa roseopersicina // Int. J. Hydrogen Energy. 2002. V. 27. P. 1463–1469.
Kovacs K.L., Kovacs A.T., Maroti G., Meszaros L.S., Balogh J., Latinovics D., Fulop A., David R., Doroghazi E., Rakhely G. The hydrogenases of Thiocapsa roseopersicina // Biochem. Soc. Trans. 2005a. V. 33. P. 61–63.
Kovács Á.T., Rákhely G., Balogh J., Maróti G., Cournac L., Carrier P., Mészáros L.S., Peltier G., Kovàcs K.L. Hydrogen independent expression of hupSL genes in Thiocapsa roseopersicina BBS // FEBS J. 2005b. V. 272. P. 4807–4816.
Kovács Á.T., Rákhely G., Browning D.F., Fulop A., Maroti G., Busby S.J., Kovacs K.L. An FNR-type regulator controls the anaerobic expression of hyn hydrogenase in Thiocapsa roseopersicina // J. Bacteriol. 2005c. V. 187. № 8. P. 2618–2627.
Laurinavichene T.V., Rákhely G., Kovács K.L., Tsygankov A.A. The effect of sulfur compounds on H2 evolution/consumption reactions, mediated by various hydrogenases, in the purple sulfur bacterium, Thiocapsa roseopersicina // Arch. Microbiol. 2007. V. 188. P. 403–410.
Laurinavichene T., Kitashima M., Nagashima K.V.P., Sato T., Sakurai H., Inoue K., Tsygankov A. Effect of growth conditions on advantages of hup− strain for H2 photoproduction by Rubrivivax gelatinosus // Int. J. Hydrogen Energy. 2017. V. 42. P. 8497–8504.
Lenz O., Friedrich B. A novel multicomponent regulatory system mediates H2 sensing in Alcaligenes eutrophus // Proc. Natl. Acad. Sci. USA. 1998. V. 95. P. 12474–12479.
Löffler M., Wallerang K.B., Venceslau S.S., Pereira I.A.C., Dahl C. The iron-sulfur flavoprotein DsrL as NAD(P)H: acceptor oxidoreductase in oxidative and reductive dissimilatory sulfur metabolism // Front. Microbiol. 2020. V. 11. Art. 578209. P. 1–15.
Long M., Liu J., Chen Z., Bleijlevens B., Roseboom W., Albracht S.P.J. Characterization of a HoxEFUYH type of [NiFe] hydrogenase from Allochromatium vinosum and some EPR and IR properties of the hydrogenase module // J. Biol. Inorg. Chem. 2007. V. 12. P. 62–78.
Lovley D.R., Goodwin S. Hydrogen concentrations as an indicator of the predominant terminal electron-accepting reactions in aquatic sediments // Geochim. Cosmochim. Acta. 1988. V. 52. P. 2993–3003.
Luedin S.M., Pothier J.F., Danza F., Storelli N., Frigaard N.-U., Wittwer M., Tonolla M. Complete genome sequence of “Thiodictyon syntrophicum” sp. nov. strain Cad16T, a photolithoautotrophic purple sulfur bacterium isolated from the alpine meromictic Lake Cadagno // Stand. Genom. Sci. 2018. V. 13. P. 1–14.
Luedin S.M., Storelli N., Danza F., Roman S., Wittwer M., Pothier J.F., Mauro Tonolla M. Mixotrophic growth under micro-oxic conditions in the purple sulfur bacterium Thiodictyon syntrophicum // Front. Microbiol. 2019. V. 10. Art. 384. P. 1–15.
Ma K., Schicho R.N., Kelly R.M., Adams M.W.W. Hydrogenase of the hyperthermophile Pyrococcus furiosus is an elemental sulfur reductase or sulfhydrogenase: evidence for a sulfur-reducing hydrogenase ancestor // Proc. Natl. Acad. Sci. USA. 1993. V. 90. P. 5341–5344.
Madigan M.T. Anoxygenic phototrophic bacteria from extreme environments // Photosynth. Res. 2003. V. 76. P. 157–171.
Madigan M.T., Jung D.O. An overview of purple bacteria: systematics, physiology, and habitats // The Purple Phototrophic Bacteria / Ed. Hunter C.N., Daldal F., Thurnauer M.C., Beatty J.T. Dordrecht: Springer Netherlands, 2009. P. 1–15.
Maróti G., Fodor B.D., Rákhely G., Kovács Á.T., Arvani S., Kovács K.L. Accessory proteins functioning selectively and pleiotropically in the biosynthesis of [NiFe] hydrogenases in Thiocapsa roseopersicina // Eur. J. Biochem. 2003. V. 270. P. 2218–2227.
Maróti J., Farkas A., Nagy I.K., Maroti G., Kondorosi E., Rakhely G., Kovacs K.L. A second soluble Hox-type NiFe enzyme completes the hydrogenase set in Thiocapsa roseopersicina BBS // Appl. Environ. Microbiol. 2010. V. 76. P. 5113–5123.
Mas J., Van Gemerden H. Storage products in purple and green sulfur bacteria // Anoxygenic Photosynthetic Bacteria / Ed. Blankenship R.E., Madigan M.T., Bauer C.E. Dordrecht: Springer Netherlands, 1995. Ch. 45. P. 973–990.
Massé A., Pringault O., de Wit R. Experimental study of interactions between purple and green sulfur bacteria in sandy sediments exposed to illumination deprived of near-infrared wavelengths // Appl. Environ. Microbiol. 2002. V. 68. P. 2972–2981.
Meyer B., Kuever J. Molecular analysis of the distribution and phylogeny of dissimilatory adenosine-5'-phosphosulfate reductase-encoding genes (aprBA) among sulfur-oxidizing prokaryotes // Microbiology (SGM). 2007. V. 153. P. 3478–3498.
Meuer J., Kuettner H. Genetic analysis of the archaeon Methanosarcina barkeri Fusaro reveals a central role for Ech hydrogenase and ferredoxin in methanogenesis and carbon fixation // Proc. Natl. Acad. Sci. USA. 2002. V. 99. P. 5632–5637.
Nagy I.K., Kovács K.L., Rákhely G., Maróti G. HupO, a novel regulator involved in thiosulfate-responsive control of HupSL [NiFe]-hydrogenase synthesis in Thiocapsa roseopersicina // Appl. Environ. Microbiol. 2016. V. 82. P. 2039–2049.
Neumann S., Wynen A., Trüper H.G., Dahl C. Characterization of the cys gene locus from Allochromatium vinosum indicates an unusual sulfate assimilation pathway // Mol. Bi-ol. Rep. 2000. V. 27. P. 27–33.
Overmann J. Mahoney Lake: A case study of the ecological significance of phototrophic sulfur bacteria // Advances in Microbial Ecology / Ed. Jones J.G. Boston, MA: Springer US, 1997. P. 251–288.
Overmann J., van Gemerden H. Microbial interactions involving sulfur bacteria: implications for the ecology and evolution of bacterial communities // FEMS Microbiol. Rev. 2000. V. 24. P. 591–599.
Overmann J., Pfennig N. Continuous chemotrophic growth and respiration of Chromatiaceae species at low oxygen concentrations // Arch. Microbiol. 1992. V. 158. P. 59–67.
Palágyi-Mészáros L.S., Maróti J., Latinovics D., Balogh T., Klement E., Medzihradszky K.F., Ryperli G., Koverl K.L. Electron-transfer subunits of the NiFe hydrogenases in Thiocapsa roseopersicina BBS // FEBS J. 2009. V. 276. P. 164–174.
Pattaragulwanit K., Brune D.C., Trüper H.G., Dahl C. Molecular genetic evidence for extracytoplasmic localization of sulfur globules in Chromatium vinosum // Arch. Microbiol. 1998. V. 169. P. 434–444.
Peduzzi S., Tonolla M., Hahn D. Isolation and characterization of aggregate-forming sulfate-reducing and purple sulfur bacteria from the chemocline of meromictic Lake Cadagno, Switzerland // FEMS Microbiol. Ecol. 2003. V. 45. P. 29–37.
Peters J.W., Schut G.J., Boyd E.S., Mulder D.W., Shepard E.M., Broderick J.B., King P.W., Adams M.W.W. [FeFe]- and [NiFe]-hydrogenase diversity, mechanism, and maturation // Biochim. Biophys. Acta – Mol. Cell. Res. 2015. V. 1853. P. 1350–1369.
Pfennig N., Biebl H. The dissimilatory sulfur-reducing bacteria // The Prokaryotes / Ed. Starr M.P., Stolp H., Trüper H.G., Balows A., Schlegel H.G. Berlin, Heidelberg: Springer, 1981. P. 941–947.
Prange A., Chauvistré R., Modrow H., Hormes J., Trüper H.G., Dahl C. Quantitative speciation of sulfur in bacterial sulfur globules: X-ray absorption spectroscopy reveals at least three different species of sulfur // Microbiology (SGM). 2002. V. 148. P. 267–276.
Pringault O., de Wit R., Kühl M. A microsensor study of the interaction between purple sulfur and green sulfur bacteria in experimental benthic gradients // Microb. Ecol. 1999. V. 37. P. 173–184.
Rakhely G., Colbeau A., Garin J., Vignais P.M., Kovacs K.L. Unusual organization of the genes coding for HydSL, the stable [NiFe]hydrogenase in the photosynthetic bacterium Thiocapsa roseopersicina BBS // J. Bacteriol. 1998. V. 180. P. 1460–1465.
Rákhely G., Kovács Á.T., Maróti G., Fodor B.D., Csanadi G., Latinovics D., Kovacs K.L. Cyanobacterial-type, heteropentameric, NAD+-reducing NiFe hydrogenase in the purple sulfur photosynthetic bacterium Thiocapsa roseopersicina // Appl. Environ. Microbiol. 2004. V. 70. P. 722–728.
Rákhely G., Laurinavichene T.V., Tsygankov A.A., Kovács K.L. The role of Hox hydrogenase in the H2 metabolism of Thiocapsa roseopersicina // Biochim. Biophys. Acta – Bioenerg. 2007. V. 1767. P. 671–676.
Reinartz M., Tschäpe J., Brüser T., Trüper H.G., Dahl C. Sulfide oxidation in the phototrophic sulfur bacterium Chromatium vinosum // Arch. Microbiol. 1998. V. 170. P. 59–68.
Sander J., Dahl C. Metabolism of inorganic sulfur compounds in purple bacteria // The Purple Phototrophic Bacteria / Ed. Hunter C.N., Daldal F., Thurnauer M.C., Beatty J.T. Dordrecht: Springer Netherlands, 2009. P. 595–622.
Schwartz E., Fritsch J., Friedrich B. H2-metabolizing prokaryotes // The Prokaryotes: Prokaryotic Physiology and Biochemistry / Ed. Rosenberg E., DeLong E.F., Lory S., Stackebrandt E., Thompson F. Berlin, Heidelberg: Springer, 2013. P. 119–199.
Serebryakova L.T., Zorin N.A., Gogotov I.N. Isolation and properties of hydrogenase from Rhodopseudomonas capsulata // Biochemistry (Moscow). 1984. V. 49. P. 1241–1247.
Søndergaard D., Pedersen C.N.S., Greening C. HydDB: A web tool for hydrogenase classification and analysis // Sci. Rep. 2016. V. 6. Art. 34212. P. 1–8.
Stockdreher Y., Sturm M., Josten M., Sahl H.-G., Dobler N., Zigann R., Dahl C. New proteins involved in sulfur trafficking in the cytoplasm of Allochromatium vinosum // J. Biol. Chem. 2014. V. 289. P. 12390–12403.
Tanabe T.S., Leimkühler S., Dahl C. The functional diversity of the prokaryotic sulfur carrier protein TusA // Adv. Microbial Physiol. 2019. V. 75. P. 233–277.
eng Y., Xu Y., Wang X., Christie P. Function of biohydrogen metabolism and related microbial communities in environmental bioremediation // Front. Microbiol. 2019. V. 10. Art. 106. P. 1–14
Tengölics R., Mészáros L., Győri E., Doffkay Z., Kovács K.L., Rákhely G. Connection between the membrane electron transport system and Hyn hydrogenase in the purple sulfur bacterium, Thiocapsa roseopersicina BBS // Biochim. Biophys. Acta – Bioenerg. 2014. V. 1837. P. 1691–1698.
Truper H.G. Phototrophic bacteria and their sulfur metabolism // Sulfur: Its Significance for Chemistry, for the Geo‑, Bio- and Cosmosphere and Technology / Ed. Müller A., Krebs B., 1984. V. 5. P. 367–382.
van den Ende F.P., Laverman A.M., van Gemerden H. Coexistence of aerobic chemotrophic and anaerobic phototrophic sulfur bacteria under oxygen limitation // FEMS Mi-crobiol. Ecol. 1996. V. 19. P. 141–151.
van Gemerden H. On the ATP generation by Chromatium in darkness // Arch. Mikrobiol. 1968. V. 64. P. 118–124.
van Gemerden H., Mas J. Ecology of phototrophic sulfur bacteria // Anoxygenic Photosynthetic Bacteria / Ed. Blankenship R.E., Madigan M.T., Bauer C.E. Dordrecht: Springer Netherlands, 1995. P. 49–85.
van Heerikhuizen H., Albracht S.P.J., Slater E.C., van Rheenen P.S. Purification and some properties of the soluble hydrogenase from Chromatium vinosum // Biochim. Biophys. Acta – Enzymol. 1981. V. 657. P. 26–39.
Vandieken V., Finke N., Thamdrup B. Hydrogen, acetate, and lactate as electron donors for microbial manganese reduction in a manganese-rich coastal marine sediment // FEMS Microbiol. Ecol. 2014. V. 87. P. 733–745.
Venceslau S.S., Stockdreher Y., Dahl C., Pereira I.A.C. The bacterial heterodisulfide DsrC is a key protein in dissimilatory sulfur metabolism // Biochim. Biophys. Acta – Bioenerg. 2014. V. 1837. P. 1148–1164.
Vignais P.M. Regulation of hydrogenase gene expression // The Purple Phototrophic Bacteria / Ed. Hunter C.N., Dal-dal F., Thurnauer M.C., Beaty J.T. Springer Science +Business Media B.V. 2009. P. 743–757.
Vignais P.M., Billoud B. Occurrence, classification, and biological function of hydrogenases: an overview // Chem. Rev. 2007. V. 107. P. 4206–4272.
Vignais P.M., Billoud B., Meyer J. Classification and phylogeny of hydrogenases // FEMS Microbiol. Rev. 2001. V. 25. P. 455–501.
Visscher P.T., van den Ende F.P., Schaub B.E.M., van Gemerden H. Competition between anoxygenic phototrophic bacteria and colorless sulfur bacteria in a microbial mat // FEMS Microbiol. Lett. 1992. V. 101. P. 51–58.
Volbeda A., Darnault C., Parkin A., Sargent F., Armstrong F.A., Fontecilla-Camps J.C. Crystal structure of the O2-tolerant membrane-bound hydrogenase 1 from Escherichia coli in complex with its cognate cytochrome b // Structure. 2013. V. 21. P. 184–190.
Weissgerber T., Dobler N., Polen T., Latus J., Stockdreher Y., Dahl C. Genome-wide transcriptional profiling of the purple sulfur bacterium Allochromatium vinosum DSM 180T during growth on different reduced sulfur compounds // J. Bacteriol. 2013. V. 195. P. 4231–4245.
Weissgerber T., Sylvester M., Kröninger L., Dahl C. A comparative quantitative proteomic study identifies new proteins relevant for sulfur oxidation in the purple sulfur bacterium Allochromatium vinosum // Appl. Environ. Microbiol. 2014a. V. 80. P. 2279–2292.
Weissgerber T., Watanabe M., Hoefgen R., Dahl C. Metabolomic profiling of the purple sulfur bacterium Allochromatium vinosum during growth on different reduced sulfur compounds and malate // Metabolomics. 2014b. V. 10. P. 1094–1112.
Weissgerber T., Zigann R., Bruce D., Chang Y.-J., Detter J.C., Han C., Hauser L., Jeffries C.D., Land M., Munk A.C., Tapia R., Dahl C. Complete genome sequence of Allochromatium vinosum DSM 180(T) // Stand. Genomic Sci. 2011. V. 5. P. 311–330.
Welte C., Hafner S., Krätzer C., Quentmeier A., Friedrich C.G., Dahl C. Interaction between Sox proteins of two physiologically distinct bacteria and a new protein involved in thiosulfate oxidation // FEBS Lett. 2009. V. 583. P. 1281–1286.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология


