Микробиология, 2021, T. 90, № 5, стр. 589-600
Микробное разнообразие и возможная активность в водоносных горизонтах подземных хранилищ газа
Т. Н. Назина a, *, Л. А. Абукова b, Т. П. Турова a, Т. Л. Бабич a, С. Х. Биджиева a, Д. С. Филиппова b, Е. А. Сафарова b
a Институт микробиологии им. С.Н. Виноградского, ФИЦ Биотехнологии РАН
119071 Москва, Россия
b Институт проблем нефти и газа РАН
119333 Москва, Россия
* E-mail: nazina@inmi.ru
Поступила в редакцию 09.05.2021
После доработки 14.05.2021
Принята к публикации 17.05.2021
Аннотация
В последние годы предлагается использовать подземные хранилища природного газа для хранения “зеленого” газа, содержащего биогаз, синтетический метан и молекулярный водород. Состав микробных сообществ подземных хранилищ газа (ПХГ) и воздействие на них H2 мало изучены. Настоящая работа посвящена определению микробного разнообразия в пробах пластовой воды из подземных горизонтов Щелковского, Касимовского и Калужского ПХГ. Подземные воды представляют собой анаэробное местообитание, содержащее уксусную кислоту и другие низшие жирные кислоты, метанол и растворенные газы, которые могут служить субстратами для микроорганизмов. Показана низкая численность культивируемых аэробных органотрофных бактерий и анаэробных бродильных, сульфатредуцирующих и метаногенных микроорганизмов в исследованных пробах. Методом высокопроизводительного секвенирования V4 региона гена 16S рРНК в составе всех исследуемых подземных микробных сообществ обнаружены бактерии Firmicutes (2.4–53.6%), Bacteroidetes (1.0–39.7%), Alphaproteobacteria (0.9–9.6%), Actinobacteria (0.1–1.7%), Desulfobacteria (0.1–1.6%), Verrucomicrobia (0–3.4%) и Planctomycetes (0–1.3%). Доля архейных последовательностей в библиотеках не превышала 1.5%. В пробе воды из Калужского ПХГ преобладали бактерии рода Marinobacter; среди минорных компонентов обнаружены метаногены родов Methanosphaera, Methanolobus и Methanobrevibacter. В пластовой воде из Щелковского и Касимовского ПХГ преобладали метилотрофные бактерии родов Methylococcus и Methylobacterium–Methylorubrum и анаэробные бродильные бактерии рода Bacteroides. С использованием программы iVikodak показана потенциальная способность микробных сообществ к использованию метана, метанола, бензоата и полициклических ароматических углеводородов и участию в превращениях соединений серы и азота. В составе подземных сообществ обнаружены бактерии и археи, потенциально способные использовать H2 в энергетическом метаболизме, в том числе, в процессах сульфатредукции, метаногенеза и ацетогенеза. Эти результаты свидетельствуют о необходимости микробиологического и геохимического мониторинга в ходе эксплуатации ПХГ, особенно при закачке водорода.
Диверсификация источников энергоснабжения сопровождается расширением использования возобновляемых источников энергии, в том числе, “зеленого” газа, включающего биогаз, синтетический метан и водород (Барсук и соавт., 2018). Увеличение доли молекулярного водорода, образуемого биогенно при переработке отходов или в процессе электролиза, обусловливает необходимость его хранения и транспортировки от места производства к месту потребления. Хранилищами газа служат истощенные нефтяные и газовые месторождения, соляные пещеры, глубинные водоносные горизонты, заброшенные шахты и др. Подземные системы населены микроорганизмами, что наиболее исследовано в случае месторождений нефти и газа (Magot et al., 2000). Поэтому необходима предварительная оценка влияния водорода на подземные микробные процессы и обратное воздействие микроорганизмов на запасы поступающего в пласт водорода. Немногочисленные работы, посвященные изучению разнообразия и функционирования микроорганизмов в ПХГ, обобщены в обзорах (Gregory et al., 2019; Dopffel et al., 2021). Высказано предположение, что нагнетание 5–10% водорода в ПХГ может приводить к активации трех основных микробных процессов – сульфатредукции, метаногенеза и ацетогенеза. Потери внесенного в пласт водорода и образование метана и сероводорода в результате активности метаногенных и сульфатредуцирующих прокариот были зарегистрированы в ПХГ в Лободице (Чехия) (Šmigáň et al., 1990). Состав населяющих пласт микроорганизмов, пластовых вод и пород оказывает определяющее влияние на минералогию и геохимические реакции в пласте. В пробе воды из водоносных горизонтов верхнеюрских отложений, отобранной на расстоянии 350 м от ПХГ (Париж, Франция), было обнаружено малочисленное микробное сообщество, включающее автотрофные сульфатредуцирующие бактерии Desulfovibrio aespoeensis и гомоацетогенные Acetobacterium carbinolicum, способные расти на водороде (Basso et al., 2009). Авторы сделали вывод о том, что поступающие в хранилище газы не влияют на микробное разнообразие в водоносном горизонте, расположенном вблизи ПХГ.
Показано, что микроорганизмы, населяющие нефтяные пласты (Nazina et al., 2017), гранитные породы (Pedersen et al., 2014) и другие подземные экосистемы, зависят от метаболизма водорода. Добавление молекулярного водорода в изолированные пробы пластовой воды из нефтяных месторождений приводило к стимуляции процессов сульфатредукции и метаногенеза (Nazina et al., 1995, 2017; Bonch-Osmolovskaya et al., 2003). Высокоактивный процесс литоавтотрофного ацетогенеза был также зарегистрирован в нефтяном пласте (Belyaev, Borzenkov, 1993). Эти результаты свидетельствуют о наличии в нефтяных пластах микроорганизмов, способных использовать молекулярный водород в процессах сульфатредукции, образования метана и ацетата. Можно полагать, что закачка водорода в выработанные нефтяные и газовые месторождения будет сопровождаться активизацией автохтонных микробных популяций, использующих молекулярный водород для восстановления сульфата или CO2/бикарбоната в зависимости от их наличия в подземном местообитании.
В настоящее время в России действует 25 ПХГ, из них 17 хранилищ создано на базе отработанных месторождений, 8 – в водоносных структурах. В пробах воды, отобранных из разных объектов Северо-Ставропольского ПХГ, были обнаружены бродильные, ацетогенные, железоредуцирующие, сульфатредуцирующие и метаногенные прокариоты, которые могут вносить определенный вклад в геохимию органических и неорганических соединений в экосистеме ПХГ (Иванова и соавт., 2007а, 2007b). Зарегистрированы высокие скорости сульфатредукции и метаногенеза в технологических емкостях этого ПХГ. Выделены чистые культуры прокариот родов Eubacterium, Sporomusa и Methanosarcina, использующие метанол и ацетат (Тарасов и соавт., 2011а). Ацетогенный штамм Eubacterium limosum AG12 рос также в среде с H2 и CO2, образуя бутират и ацетат. Штамм Methanobacterium formicicum MG134 рос на водород-углекислотной смеси, образуя метан. Ацетогенные штаммы E. limosum AG12 и Sporomusa sphaeroides AG8-2 при росте на метаноле продуцировали водород, который поддерживал рост водород-использующей сульфатредуцирующей бактерии Desulfovibrio desulfuricans SR12 или метаногена M. formicicum MG134 (Тарасов и соавт., 2011б). Микроорганизмы, населяющие подземные горизонты хранилища газа, были приспособлены к физико-химическим условиям местообитания и использовали молекулярный водород, метанол и другие органические субстраты в своем метаболизме. Эти результаты свидетельствуют о необходимости исследования микробных популяций, населяющих подземные горизонты, которые предполагается использовать для закачки “зеленого” газа, содержащего водород.
Целью настоящей работы было определение численности и филогенетического разнообразия микроорганизмов в пробах вод из подземных горизонтов Щелковского, Касимовского и Калужского хранилищ газа и оценка их возможной функциональной активности с использованием методов биоинформатики.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объекты исследования. Объектом микробиологических исследований были 17 проб пластовой воды, отобранные в сентябре–октябре 2020 г. с разной глубины из скважин на территории Щелковского, Касимовского и Калужского ПХГ. На Щелковском ПХГ анализировали пробы пластовой воды из щигровского и ряжского горизонтов с глубины 925–980 и 1115–1154 м соответственно (табл. S1 , дополнительные материалы). Верхний песчаный пласт щигровского горизонта используется в качестве пласта-коллектора для ПХГ и для захоронения промстоков. Перекрывается щигровский водоносный горизонт пачкой щигровских глин (20 м) и глинисто-карбонатными отложениями толщиной более 100 м. Воды щигровского горизонта – хлоридно-натриевые рассолы с минерализацией 129–131 г/л, рН 6.4–7.0. В состав водорастворенных газов входят азот (60–90 об. %), углекислота (0–4 об. %), метан (0–5 об. %) и водород (1–40 об. %). Пластовые воды ряжского горизонта представлены рассолами хлоридно-кальциевого типа с минерализацией 142.6–217.9 г/л, рН 6.3–7.3. На Касимовском ПХГ отбирали пластовую воду из нижнещигровского горизонта, залегающего на глубине 760–820 м. Пластовые воды горизонта представлены рассолами хлоридно-кальциевого типа (по Сулину) с минерализацией 137.4–219.4 г/л, рН 6.1–8.8. Водорастворенный газ преимущественно азотного состава, кроме того, в газе присутствовали углеводороды (0.5–13.6 об. %). На Калужском ПХГ анализировали пластовую воду гдовского горизонта, характеризующуюся значительным разнообразием по химическому составу и основным свойствам. Пластовые воды представлены солеными водами или рассолами хлоридно-кальциевого (скв. 13, 27, 31, 32, 61, 70, 81, 106, 121), хлоридно-магниевого (скв. 36 и 65) и гидрокарбонатно-натриевого (скв. 43 и 48) типа с минерализацией до 53.6 г/л. Кислотность вод варьирует от слабокислой до сильнощелочной (рН 5.4–9.7). Водорастворенные газы имеют различный состав от метанового, метаново-азотного до азотно-метанового и азотного. Температура пластов-коллекторов гдовского горизонта варьировала от 17 до 22°С, остальных коллекторов составляла 22–24°С. Характеристика ПХГ приведена в табл. S1 (дополнительные материалы).
Состав сред. Пробы подземных вод использовали для определения численности микроорганизмов ряда физиологических групп методом предельных десятикратных разведений. Результаты оценивали методом наиболее вероятного числа по таблице Мак Креди. Численность аэробных органотрофных микроорганизмов оценивали микроскопированием посевов пластовой воды в серии разведений в среде следующего состава (г/л): глюкоза – 1.0, бакто-триптон – 5.0, дрожжевой экстракт – 2.5, N-aCl – 2.0–60.0, pH 7.0–7.2. Численность бродильных микроорганизмов оценивали микроскопированием посевов и обнаружением молекулярного водорода в посевах в среде следующего состава (г/л): пептон – 4.0; глюкоза – 10.0; Na2SO4 – 2.0; MgSO4 – 1.0; NaCl – 2.0–60.0, соль Мора (FeSO4 · · (NH4)2SO4 · 6H2O) – 0.5; Na2S · 9H2O – 0.1. рН 7.2 (Postgate, 1984). В качестве газовой фазы использовали аргон, очищенный от кислорода. Численность денитрифицирующих бактерий оценивали по появлению молекулярного азота в среде следующего состава (г/л): KCl – 0.1; MgSO4 · 7H2O – 0.2; CaCl2 · 2H2O – 0.2; KH2PO4 – 0.75; K2HPO – 1.5; NH4Cl – 0.9; NaCl – 2.0–60.0; NaNO3 – 0.85; ацетат натрия – 2.0; газовая фаза – аргон. Параллельно с определением N2 в газовой фазе оценивали образование нитрита в среде с помощью реактива Грисса. Численность сульфатвосстанавливающих бактерий определяли по образованию сульфида в посевах в среде, содержащей (г/л): MgCl2 · 6H2O – 3.0; CaCl2 · 2H2O – 0.15; Na2SO4 – 4.0; NH4Cl – 0.25; KH2PO4 – 0.2; KCl – 0.5; NaHCO3 – 1.6; лактат натрия – 4.0; дрожжевой экстракт – 0.5; Na2S · 9H2O – 0.2; NaCl – 2.0–60.0 (Widdel, Bak, 1992); газовая фаза – аргон. Метаногенов учитывали по образованию метана в газовой фазе в серии разведений в среде следующего состава (г/л): MgCl2 · 6H2O – 0.3; CaCl2 · 2H2O – 0.15; NH4Cl – 0.25; KH2PO4 – 0.2; KCl – 0.5; NaCl – 2.0–60.0; NaHCO3 – 2.5; ацетат – 2.5; метанол 2.0 мл/л; Na2S · 9H2O – 0.5 г/л, газовая фаза – H2/CO2 (4 : 1). Во все среды вносили микроэлементы как описано ранее (Биджиева и соавт., 2018). Среды для анаэробных бактерий готовили, используя анаэробную технику Хангейта. Посевы инкубировали в стационарных условиях при температуре 20–22°С в течение 14–21 сут. Посевы микроскопировали, используя световой микроскоп Olympus c фазово-контрастным устройством, при увеличении 100 × 10.
Аналитические методы. Водород, азот, метан и углекислоту определяли газохроматографическим методом, сульфид – колориметрическим методом с N,N-диметил-р-фенилендиамином, летучие кислоты, низшие спирты и кетоны анализировали на газовом хроматографе “Shimadzu GC 2010 Plus” (Япония) с колонкой ZebronZB-FFAP как описано ранее (Биджиева и соавт., 2018).
Выделение ДНК, амплификация и секвенирование гена 16S рРНК микроорганизмов пластовой воды. Для определения состава микробного сообщества методом анализа гена 16S рРНК использовали пробы пластовой воды объемом 1 л каждая, фиксированные 96% этиловым спиртом (1 : 1, об./об.). Пробы фильтровали через мембранные фильтры с диаметром пор 0.22 мкм (“MerckMillipore”, США). Биомассу клеток смывали с фильтров лизирующим раствором, содержащим 0.15 M NaCl и 0.1 M Na2EDTA (pH 8.0), и использовали для выделения ДНК. Выделение тотальной ДНК проводили с использованием набора PowerSoil DNA Isolation Kit (“MoBio”, США), согласно рекомендациям производителя. Полученная ДНК хранилась в холодильнике при –20°С. Библиотеки гена 16S рРНК для высокопроизводительного секвенирования на системе Illumina MiSeq были приготовлены по схеме, описанной в статье (Gohl et al., 2016). Очищенный препарат ДНК использовали в качестве матрицы для амплификации V4 участка гена 16S рРНК путем ПЦР с использованием двух праймеров. Прямой праймер (5'-CAAGCAGAA- GACGGCATACGAGATGTGACTGGAGTTCAGA- CGTGTGCTCTTCCGATCTXXXXXXXXXXXXZ-ZZZGTGBCAGCMGCCGCGGTAA-3') состоял, соответственно, из “5' Illumina Linker Sequence”, “Index 1”, “Heterogeneity Spacer” (Fadrosh et al., 2014) и 515F праймерной последовательности (Hugerth et al., 2014); обратный праймер (5'-AATGATACGGCGACCACCGAGATCTACACTCTTT- CCCTACACGACGCTCTTCCGATCTXXXXXXXX-XXXXZZZZGACTACNVGGGTMTCTAATCC-3') включал “3' Illumina Linker Sequence”, “Index 2”, “Heterogeneity Spacer” и Pro-mod-805R праймерную последовательность (Merkel et al., 2019) соответственно. Длина прочтения составляла 200–250 нуклеотидов. Полученные парноконцевые чтения были подвергнуты процедуре контроля качества с использованием UPARSE (Edgar, 2013) и затем сгруппированы для создания операционных таксономических единиц (ОТЕ) с уровнем сходства 97% с использованием USEARCH (Edgar, 2010). ОТЕ идентифицировали с использованием базы данных QIIME, онлайн-ресурса SILVA (https:// www.arb-silva.de/ngs/). Анализ состава микробных сообществ методом тепловой карты был выполнен с использованием ClustVis (Metsalu, Vilo, 2015). Статистические подсчеты осуществляли с помощью Microsoft Excel. Индексы разнообразия были рассчитаны с использованием программы EstimateS (http://purl.oclc.org/estimates). Онлайн-ресурс ClustVis (https://biit.cs.ut.ee/clustvis/, декабрь 2020 г.) был использован для создания тепловых карт (heatmaps) членов сообщества на родовом уровне.
Последовательности прокариот c уровнем сходства ≥97%, объединенные в операционные таксономические единицы (OTE) и идентифицированные с использованием онлайн-ресурса SILVA, были использованы для предсказания функциональных характеристик бактериальных сообществ с использованием пакета программ iViko-dak (Nagpal et al., 2019). Модуль Global Mapper базы данных KEGG использовали для получения функциональных профилей, а Local Mapper – для прогнозирования индивидуальных профилей ферментов метаболизма азота, серы, бензоата и метана у бактерий исследуемых микробных сообществ. Тепловые карты функциональных профилей и ферментов, предсказанных для сообществ, были построены с использованием интернет-ресурса ClustVis (http://biit.cs.ut.ee/clustvis/, ноябрь 2020 г.).
Библиотеки фрагментов гена 16S рРНК исследованных микробных сообществ из водоносных горизонтов ПХГ депонированы в NCBI (Bioproject PRJNA724815, SRA 14189839–14189843).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Физико-химические условия и численность культивируемых микроорганизмов в пластовых водах из ПХГ. Пробы пластовой воды из подземных горизонтов Щелковского, Калужского и Касимовского подземных хранилищ газа характеризовались широким спектром минерализации от 1.4 до 232.8 г/л, реакцией среды от слабокислой до щелочной (рН 5.2–9.8). В пластовой воде обнаружены низшие спирты, концентрация которых достигала 15–19 г/л, уксусная кислота (0–93 мг/л) и другие С3–С5 низшие летучие кислоты (≤57 мг/л) (табл. 1).
Таблица 1.
Физико-химическая характеристика проб воды, отобранных на Щелковском, Касимовском и Калужском ПХГ в 2020 г.
| № скважины | Глубина отбора проб, м | Минерализация, г/л/ NaCl*, г/л | рН | Содержание, мг/л | |||
|---|---|---|---|---|---|---|---|
| метанол | Ʃ(С2–С4 спирты) | ацетат | Ʃ(С3–С5 ЛЖК) | ||||
| Щелковское ПХГ, щигровский горизонт | |||||||
| 67 | 900 | 124.04* | 7.2 | 474.6 | 11.7 | 22.9 | 11.7 |
| 105 | 950 | 136.57* | 6.4 | 41.2 | 15.9 | 55.1 | 20.5 |
| 161 | 980 | 142.95* | 6.6 | 0 | 0 | 93.1 | 32.2 |
| 170 | 925 | 138.17* | 8.7 | 5.5 | 5.6 | 39.0 | 17.5 |
| 162** | 1154 | 232.81* | 5.3 | 491.3 | 21.8 | 35.5 | 6.9 |
| Касимовское ПХГ, нижнещигровский горизонт | |||||||
| 5 | 820 | 147.3 | 7.0 | 0.7 | 13.0 | 91.1 | 40.5 |
| Калужское ПХГ, гдовский горизонт | |||||||
| 27 | 890 | 1.478 | 9.6 | 3.8 | 0 | 19.4 | 25.1 |
| 32 | 895 | 5.667 | 6.6 | 92.9 | 5.0 | 38.0 | 29.1 |
| 36 | 904 | 6.824 | 9.8 | 128.0 | 6.4 | 63.6 | 9.4 |
| 43 | 890 | 16.677 | 6.9 | 611.3 | 6.6 | 32.8 | 14.1 |
| 48 | 885 | 6.376 | 9.5 | 6.3 | 0 | 19.5 | 24.7 |
| 61 | 904 | 33.222 | 7.3 | 450.2 | 7.9 | 18.6 | 17.0 |
| 65 | 376 | 198.366 | 7.2 | 206.6 | 4.1 | 9.3 | 8.7 |
| 70 | 940 | 17.371 | 8.5 | 15 078.1 | 60.1 | 15.4 | 6.1 |
| 81 | 910 | 6.66 | 5.2 | 95.1 | 10.8 | 28.7 | 8.4 |
| 106 | 491 | 23.344 | 8.2 | 19 211.0 | 80.3 | 22.8 | 8.4 |
| 121 | 40 | 44.131 | 8.5 | 10.0 | 2.9 | 11.8 | 6.0 |
В результате посевов пластовой воды на питательные среды были обнаружены аэробные органотрофные бактерии, численность которых была очень низка (≤10 кл./мл) (рис. S1 , дополнительные материалы). Численность бродильных бактерий в единичных пробах составляла 102 кл./мл, среди них доля бактерий, образующих молекулярный водород в составе продуктов брожения, была на порядок ниже. Численность денитрифицирующих бактерий, восстанавливающих нитрат до стадии нитрита и далее до молекулярного азота, также ограничивалась 102 кл./мл. Культивируемые сульфатредуцирующие бактерии и метаногены были обнаружены лишь в единичных пробах пластовой воды из Калужского ПХГ. Получены накопительные культуры сульфидогенных и метаногенных прокариот в среде с молекулярным водородом (из скв. 106, 81, 61, 161, 121).
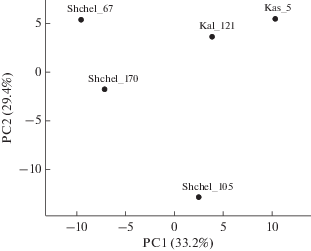
Филогенетическое разнообразие подземного микробного сообщества. ДНК микроорганизмов из пяти проб пластовой воды была использована для секвенирования V4 региона гена 16S рРНК. В результате было получено 5 библиотек, включающих суммарно 36 676 фрагментов гена (ридов) (табл. S2 , дополнительные материалы). В трех из пяти библиотек количество ОТЕ было в интервале от 1114 до 2068. Несмотря на похожие физико-химические условия, исследованные пробы пластовой воды отличались между собой по составу микроорганизмов, о чем свидетельствуют результаты сравнения бета-разнообразия (рис. 1).
Рис. 1.
Сравнение состава микробных сообществ пластовой воды из месторождения ПХГ методом анализа главных компонент (PCA), основанным на относительном обилии операционных таксономических единиц, включающих гены 16S рРНК (≥97% сходства) прокариот. Обозначения библиотек на рис. 1 и далее по тексту соответствуют номерам скважин, из которых получали пластовую воду, Щелковское ПХГ обозначено Shchel, Калужское ПХГ – Kal, Касимовское – Kas.
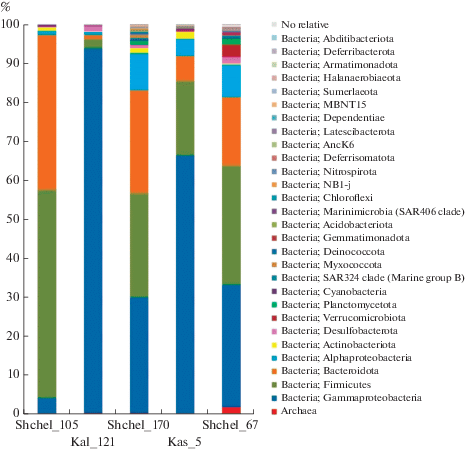
Количественное распределение полученных фрагментов гена 16S рРНК представителей доменов Bacteria и Archaea в библиотеках на уровне высших таксонов – филумов приведено на рис. 2. В составе микробных сообществ пластовой воды были обнаружены представители 28 филумов, однако только 8 высших таксонов включали более 1% последовательностей в составе хотя бы одной из библиотек, в том числе Firmicutes (2.4–53.6%), Bacteroidetes (1.0–39.7%), Proteobacteria (4.9–94.5%), Actinobacteria (0.1–1.7%), Desulfobacteria (0.1–1.6%), Verrucomicrobia (0–3.4%) и Planctomycetes (0–1.3%). Доля архейных последовательностей была низка и составляла 1.5% в библиотеке из пластовой воды скважины 121 Калужского ПХГ (рис. S2 , дополнительные материалы). В исследованных сообществах выявлены археи цикла азота – Candidatus Nitrosopumilus, метаногены родов Methanosphaera, Methanolobus и Methanobrevibacter, а также некультивируемые археи Woesearchaeales и Thermoplasmatota.
Рис. 2.
Относительная доля последовательностей фрагментов гена 16S рРНК Bacteria, представленных на уровне филумов/классов в библиотеках из пластовой воды. Перечислены таксоны, составляющие >1% в каждой библиотеке.
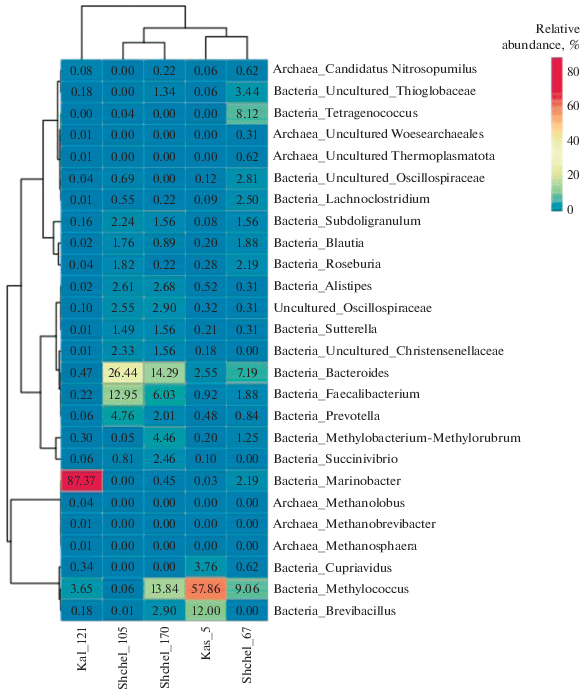
Перечень 25 родов, наиболее представленных в микробных сообществах хотя бы одного из образцов из ПХГ, приведен на рис. 3. В пластовой воде из Щелковского и Касимовского ПХГ преобладали метилотрофные бактерии родов Methylococcus и Methylobacterium–Methylorubrum, использующие метан и/или метанол и метилированные амины в аэробных условиях в присутствии молекулярного кислорода. Кроме того, в исследованных сообществах присутствовали анаэробные бактерии рода Bacteroides, способные сбраживать сахаросодержащие субстраты. Эти бактерии встречаются в метаногенных реакторах, перерабатывающих растительные остатки, в озерных и речных осадках, загрязненных хлорсодержащими органическими отходами, муниципальных сточных водах (Ho et al., 2020; Hou et al., 2020; Zerva et al., 2021). В пробе из Калужского ПХГ (Kal-121) преобладали бактерии рода Marinobacter, растущие при повышенной солености среды на широком ряде органических субстратов. В составе малочисленного архейного сообщества в этой пробе были обнаружены метаногены родов Methanosphaera, Methanolobus и Methanobrevibacter. Метаногены рода Methanosphaera облигатно нуждаются для роста в метаноле, который они восстанавливают молекулярным водородом (Miller, Wolin, 1985). Метаногены рода Methanolobus растут на метаноле и часто встречаются в подземных экосистемах, включая месторождения газа и угольные пласты (Moser et al., 2005; Mochimaru et al., 2009; Doerfert et al., 2009). Метаногены рода Me-thanobrevibacter используют для роста водород-углекислотную смесь. Обнаружение бактерий кишечной группы рода Faecalibacterium в пробах пластовой воды из Щелковского ПХГ может быть обусловлено захоронением промстоков в щигровский горизонт.
Рис. 3.
Тепловая карта (heatmap) распределения 25 доминантных родов в библиотеках фрагментов гена 16S рРНК прокариотных сообществ пластовой воды из ПХГ. Двойная иерархическая дендрограмма показывает распределение микроорганизмов в этих пробах. Относительные величины содержания отдельных родов от синего до красного цвета обозначают переход от менее представленного к более представленному роду в библиотеке. Цифры на диаграмме обозначают процент от общего количества последовательностей в библиотеке из каждой исследованной пробы жидкости.
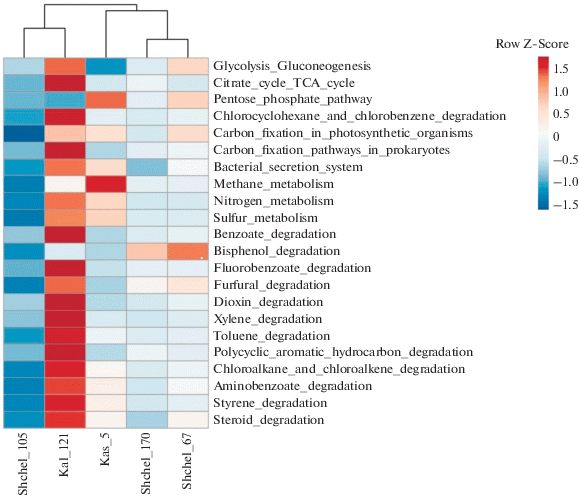
Потенциальные функциональные характеристики микробных сообществ пластовой воды из ПХГ. Функциональные характеристики исследуемых микробных сообществ пластовой воды из ПХГ были предсказаны с помощью модуля “Global Mapper” программы iVikodak на основании использования базы данных KEGG (Nagpal et al., 2019). Бактерии, входящие в эти сообщества, обладали потенциальной способностью осуществлять основные пути метаболизма углеводов и энергетического метаболизма, а также деградацию ксенобиотиков, бензоата, полициклических ароматических углеводородов (ПАУ), аминобензоата, толуола и хлорсодержащих органических соединений (рис. 4).
Рис. 4.
Тепловая карта, показывающая сравнение функциональных профилей бактериальных сообществ пластовой воды (в относительных процентах) в программе iVikodak. Анализируемые ниже метаболические пути отмечены ра-мкой.
У бактерий, входящих в исследуемые сообщества, было предсказано наличие ферментов метаболизма метана (рис. S3 а, S4), включающего ферменты двух путей метаногенеза. Ферменты первого пути, метанол кобаламин метилтрансфераза (EC: 2.1.1.90) и метил-коэнзим М редуктазa (EC: 2.8.4.1), катаболизирующие превращение метанола до метил-КоМ и метана соответственно, были наиболее представлены у метилотрофных метаногенных архей родов Methanosphaera и Methanolobus (сообщество Kal-121). Ферменты второго пути метаногенеза, включающие метилтрансферазы (EC: 2.1.1.249; 2.1.1.250; 2.1.1.248), катаболизирующие превращение ди-, три- и метиламинов до метана через метил-КоМ, вероятно, принадлежат некультивируемым Woesearchaeales (Shchel_67). Эта группа некультивируемых архей встречается также в морских осадках с газогидратами метана (Carrier et al., 2020). Кроме того, предсказаны ферменты аэробного окисления метана и С1-соединений и его окисленных или замещенных производных, не имеющих С–С связи (около 50 соединений). В этих процессах метан окисляется до метанола с помощью ключевых ферментов метанотрофии – метанмоноокигеназы (EC: 1.14.13.25) и метан/аммоний монооксигеназы (EC: 1.14.18.3), а затем с помощью метанолдегидрогеназы (EC: 1.1.2.7) окисляется до формальдегида. В пластовой воде Касимовского ПХГ (Kas-5) и Щелковского ПХГ присутствовали метилотрофные бактерии родов Methylococcus и Methylobacterium–Methy-lorubrum, обладающие ферментами деградации триметиламина, диметиламина и метиламина до формальдегида (рис. S5 , дополнительные материалы).
Во всех исследованных сообществах присутствовали бактерии, обладающие двумя ключевыми ферментами пути аэробной деградации бензоата (“Benzoate degradation I”), бензоат-1,2-диоксигеназой (EC: 1.14.12.10) и дигидрооксициклогексадиен дегидрогеназой (EC: 1.3.1.25), катаболизирующими образование катехола из бензоата (рис. S3 г, S6, дополнительные материалы). Предсказано также наличие бактерий, имеющих ферменты катаболизма катехола, как до сукцинил-КоА, так и до пирувата/ацетил-КоА. Кроме того, у бактерий присутствовал фермент бензоат-КoA-лигаза (EC: 6.2.1.25), катализирующий превращение бензоата в бензоил-КоА – интермедиат биодеградации многих ароматических соединений, и большинство ферментов другого пути деградации бензоата (“Benzoate degradation II”), преимущественно используемого анаэробными бактериями. Представленность ферментов этого пути была наиболее высокой у бактерий сообщества Kal-121, в котором за деградацию бензоата отвечали бактерии рода Marinobacter (рис. S7 , дополнительные материалы). Ряд видов этого рода являются деструкторами алифатических и полициклических ароматических углеводородов, а также ациклических изопреноидных соединений (Duran, 2010). В сообществе Kas-5 потенциальными деструкторами бензоата были бактерии рода Cupriavidus, известные способностью к деградации многих алифатических соединений (Pérez-Pantoja et al., 2008), а также бактерии рода Brevibacillus.
В исследуемых микробных сообществах присутствовали бактерии, имеющие ферменты метаболизма серы, включающие сульфат аденилилтрансферазу (EC: 2.7.7.4), катализирующую восстановление сульфата до аденилилсульфата в процессах сульфатредукции, а также ферментов, участвующих в дальнейшем восстановлении аденилилсульфата до сульфита в ассимиляционной и диссимиляционной сульфатредукции (рис. S3 в, S8, дополнительные материалы). Аденозилсульфаткиназа (EC: 2.7.1.25) и фосфоаденозин фосфосульфатредуктаза (EC: 1.8.4.8), восстанавливающие сульфит до сульфида в ассимиляционном процессе, были наиболее представлены у бактерий рода Marinobacter, доминирующих в сообществе Kal-121 (рис. S9 , дополнительные материалы). За диссимиляционное восстановление сульфата в пластовых водах, вероятно, отвечала немногочисленная популяция сульфатредуцирующих бактерий родов Desulfotignum, Desulfovibrio, Desufomicrobium и Desulfobulbus, содержащих аденилилсульфатредуктазу (EC: 1.8.99.2).
На рис. S10–S15 (дополнительные материалы) приведены ключевые микроорганизмы, участвующие в метаболизме азота, бисфенола и ПАУ в пробах пластовой воды. Несмотря на отсутствие нитрата в пластовых водах ПХГ, была предсказана потенциальная способность бактериальных сообществ к осуществлению превращений азота (рис. S3 б, S10). Во всех сообществах присутствовали бактерии, обладающие ферментом нитратредуктазой (EC: 1.7.5.1), который катализирует восстановление нитрата до нитрита в процессах денитрификации и диссимиляционной нитратредукции. Нитратредуктаза и остальные ферменты обоих процессов, катализирующие восстановление нитрита до молекулярного азота и аммония, были наиболее представлены у бактерий сообщества Kal-121. Выявлены бактерии, содержащие ферредоксин-нитратредуктазу (EC: 1.7.7.2), катализирующую восстановление нитрата до нитрита в процессе ассимиляционной нитратредукции, а также бактерии, обладающие ферредоксин-нитритредуктазой (EC: 1.7.7.1), восстанавливающей нитрит до аммония. Ферменты этого пути были наиболее характерны для бактерий сообществ Kas-5, Shchel-67, Shchel-105 и Shchel-170. В сообществе Kal-121 в преобразованиях азота участвовали в основном бактерии рода Marinobacter (рис. S11 ), среди которых известны виды, осуществляющие диссимиляционную нитратредукцию (Correia et al., 2008). В сообществе Kas-5 таким компонентом были бактерии рода Methylococcus, для к-оторых известно участие в процессах нитрификации, ключевой фермент которой метан/аммоний монооксигеназа (ЕС: 1.14.99.39) был наиболее представлен у бактерий сообщества (рис. S3 а). По-видимому, денитрификацию в этом сообществе способны осуществлять минорные компоненты. В пластовой воде из Щелковского ПХГ основной вклад в преобразования азота вносили бактерии родов Methylococcus и Marinobacter.
Таким образом, в результате биоинформатического анализа полученных библиотек генов 16S рРНК предсказана возможная функциональная активность бактерий родов Methylococcus, Methylobacterium и Bacteroides в пробах пластовой воды Щелковского и Касимовского ПХГ и бактерий рода Marinobacter в пластовой воде Калужского ПХГ.
Уксусная кислота, другие летучие кислоты и метанол, обнаруженные в пластовых водах ПХГ, и газы (CH4, CO2, H2), вероятно, служат субстратами для факультативно-аэробных и анаэробных микроорганизмов в подземных горизонтах.
Несмотря на присутствие молекулярного водорода в газовой фазе только Щелковского ПХГ (табл. S1 ), в составе сообществ выявлены метаногенные археи и бактерии, потенциально способные участвовать в потреблении молекулярного водорода, в том числе, родов Bacteroides, Desulfotignum, Desulfomicrobium, Faecalibacterium, Roseburia, Marinobacter, Subdoligranulum и семейств Lachnospira-ceae, Thioglobaceae и Oscillospiraceae. Сообщалось об использовании H2 в качестве источника энергии также штаммом Methylocystis sp. SC2 (Hakobyan et al., 2020). Продуцировать H2 может широкий ряд анаэробных микроорганизмов в процессе брожения органических субстратов. Показано образование H2 при дефиците кислорода аэробными метилотрофными бактериями Methylomicrobium alcaliphilum 20Z (Kalyuzhnaya et al., 2013), Methylocystis sp. (Jung et al., 2020) и Methylomonas sp. DH-1 (Jo et al., 2020).
Молекулярными методами в пробах пластовых вод обнаружены факультативно-анаэробные и строго анаэробные микроорганизмы, способные использовать метанол. В анаэробных условиях использовать метанол могут метаногенные археи родов Methanosphaera и Methanolobus, обнаруженные в пластовой воде из скв. 121 Калужского ПХГ. Сульфатредуцирующие бактерии, утилизирующие метанол, были родственны Desulfovibrio. В группе аэробных бактерий использовать метанол способны метилотрофные бактерии родов Methylococcus и Methylobacterium.
Cероводород, поступающий из ПХГ в период отбора газа, может быть внесен при закачке газа из магистрального газопровода или образовываться в пласте бактериями (Dopffel et al., 2021). Поступление метанола и/или молекулярного водорода в подземные горизонты, содержащие сульфат в пластовой воде или вмещающих породах, может способствовать росту сульфатредуцирующих бактерий.
В пластовой воде подземных хранилищ газа нами обнаружено малочисленное, но разнообразное микробное сообщество. Особенностью экосистемы ПХГ является отсутствие кислородсодержащих флюидов. Трансформация доступного микроорганизмам органического вещества происходит в условиях строгого анаэробиоза. При наличии сульфата и бикарбоната в пластовой воде поступление водорода в ПХГ может приводить к активации процессов восстановления сульфата, образования метана и ацетата подземным микробным сообществом, сопровождающихся снижением качества газа, изменением минералогии и проницаемости пород, коррозией стального оборудования. В этой связи необходимы дальнейшие исследования ключевых субстратов и путей их метаболизма и функциональной активности микробных сообществ водоносных горизонтов, используемых для подземного хранения газа.
Список литературы
Барсук Н.Е., Хайдина М.П., Хан С.А. “Зеленый” газ в газотранспортной системе Европы // Газовая промышленность. 2018. № 10. С. 104–109.
Биджиева С.Х., Соколова Д.Ш., Турова Т.П., Назина Т.Н. Бактерии рода Sphaerochaeta из низкотемпературных месторождений тяжелой нефти (Россия) // Микробиология. 2018. Т. 87. С. 649–658.
Bidzhieva S.Kh., Sokolova D.Sh., Tourova T.P., Nazina T.N. Bacteria of the genus Sphaerochaeta from low-temperature heavy-oil reservoirs (Russia) // Microbiology (Moscow). 2018. V. 87. P. 757–765.
Иванова А.Е., Борзенков И.А., Тарасов А.Л., Милехина Е.И., Беляев С.С. Микробиологические исследования на объектах подземного газового хранилища в процессе закачки газа // Микробиология. 2007a. Т. 76. С. 515–523.
Ivanova A.E., Borzenkov I.A., Tarasov A.L., Milekhina E.I., Belyaev S.S. A microbiological study of an underground gas storage in the process of gas extraction // Microbiology (Moscow). 2007a. V. 76. P. 524–532. Иванова А.Е., Борзенков И.А., Тарасов А.Л., Милехина Е.И., Беляев С.С. Микробиологические исследования на объектах подземного газового хранилища в процессе отбора газа // Микробиология. 2007b. Т. 76. С. 524–532. Ivanova, A.E., Borzenkov I.A., Tarasov A.L., Milekhina E.I., Belyaev S.S. A microbiological study of an underground gas storage in the process of gas extraction // Microbiology (Moscow). 2007b. V. 76. P. 524–532.
Тарасов А.П., Борзенков И.А., Черных Н.А., Беляев С.С. Выделение и изучение анаэробных микроорганизмов, участвующих в трансформации метанола в подземном хранилище газа // Микробиология. 2011. Т. 80. С. 184–191.
Tarasov A.L., Borzenkov I.A., Chernykh N.A., Belyayev S.S. Isolation and investigation of anaerobic microorganisms involved in methanol transformation in an underground gas storage facility // Microbiology (Moscow). 2011. V. 80. P. 172–179.
Тарасов А.Л., Борзенков И.А., Беляев С.С. Исследование трофических связей анаэробных микроорганизмов из подземного хранилища газа в процессе утилизации метанола // Микробиология. 2011. Т. 80. С. 192–199.
Tarasov A.L., Borzenkov I.A., Belyayev S.S. Investigation of the trophic relations between anaerobic microorganisms from an underground gas repository during methanol utilization // Microbiology (Moscow). 2011. V. 80. P. 180–187.
Меркель А.Ю., Тарновецкий И.Ю., Подосокорская О.А., Тощаков С.В. Анализ систем праймеров на ген 16S рРНК для профилирования термофильных микробных сообществ // Микробиология. 2019. Т. 88. С. 655–664.
Merkel A.Yu., Tarnovetskii I.Yu., Podosokorskaya O.A., Toshchakov S.V. Analysis of 16S rRNA primer systems for profiling of thermophilic microbial communities // Microbiology (Moscow). 2019. V. 88. P. 671–680.
Basso O., Lascourreges J.F., Le Borgne F., Le Goff C., Magot M. Characterization by culture and molecular analysis of the microbial diversity of a deep subsurface gas storage aquifer // Res. Microbiol. 2009. V. 160. P. 107–116. https://doi.org/10.1016/j.resmic.2008.10.010
Belyaev S.S., Borzenkov I.A. Microbial transformation of low-molecular-weight carbon compounds in the deep subsurface // Biogeochemistry of Global Change. N.Y.–London: Chapman & Hall, 1993. P. 825–838.
Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Lebedinsky A.V., Chernyh N.A., Nazina T.N., Ivoilov V.S., Belyaev S.S., Boulygina E.S., Lysov Yu.P., Perov A.N., Mirzabekov A.D., Hippe H., Stackebrandt E., L’Haridon S., Jeanthon C. Radioisotopic, culture-based, and oligonucleotide microchip analyses of thermophilic microbial communities in a continental high-temperature petroleum reservoir // Appl. Environ. Microbiol. 2003. V. 69. P. 6143–6151. https://doi.org/10.1128/aem.69.10.6143-6151.2003
Carrier V., Svenning M.M., Gründger F., Niemann H., Dessandier P.-A., Panieri G., Kalenitchenko D. The impact of methane on microbial communities at marine arctic gas hydrate bearing sediment // Front. Microbiol. 2020. V. 11. Art. 1932. https://doi.org/10.3389/fmicb.2020.01932
Correia C., Besson S., Brondino C.D., Gonzalez P.J., Fauque G., Lampreia J., Moura I., Moura J.J.G. Biochemical and spectroscopic characterization of the membrane-bound nitrate reductase from Marinobacter hydrocarbonoclasticus 617 // J. Biol. Inorg. Chem. 2008. V. 13. P. 1321–1333. https://doi.org/10.1007/s00775-008-0416-1
Dopffel N., Jansen S., Gerritse J. Microbial side effects of underground hydrogen storage – Knowledge gaps, risks and opportunities for successful implementation // Int. J. Hydrogen Energy. 2021. V. 46. P. 8594–8606. https://doi.org/10.1016/j.ijhydene.2020.12.058
Duran R. Marinobacter // Handbook of Hydrocarbon and Lipid Microbiology / Ed. Timmis K.N. Berlin, Heidelberg: Springer, 2010. P. 1725–1735. https://doi.org/10.1007/978-3-540-77587-4_122
Edgar R.C. Search and clustering orders of magnitude faster than BLAST // Bioinformatics. 2010. V. 26. P. 2460–2461. https://doi.org/10.1093/bioinformatics/btq461
Edgar R.C. UPARSE: highly accurate OTU sequences from microbial amplicon reads // Nature Methods. 2013. V. 10. P. 996–998. https://doi.org/10.1038/nmeth.2604
Gohl D.M., MacLean A., Hauge A., Becker A., Walek D., Beckman K.B. An optimized protocol for high-throughput amplicon-based microbiome profiling // Protoc. Exch. 2016 https://doi.org/10.1038/protex.2016.030
Gregory S.P., Barnett M.J., Field L.P., Milodowski A.E. Subsurface microbial hydrogen cycling: natural occurrence and implications for industry // Microorganisms. 2019. V. 7. Art. 53. https://doi.org/10.3390/microorganisms7020053
Hakobyan A., Zhu J., Glatter T., Paczia N., Liesack W. Hydrogen utilization by Methylocystis sp. strain SC2 expands the known metabolic versatility of type IIa methanotrophs // Metab. Eng. 2020. V. 61. P. 181–196. https://doi.org/10.1016/j.ymben.2020.05.003
Ho J.Y., Jong M.C., Acharya K., Liew S.S.X., Smith D.R., Noor Z.Z., Goodson M.L., Werner D., Graham D.W., Eswaran J. Multidrug-resistant bacteria and microbial communities in a river estuary with fragmented suburban waste management // J. Hazard Mater. 2021. V. 405. Art. 124687. https://doi.org/10.1016/j.jhazmat.2020.124687
Hou R., Gan L., Guan F., Wang Y., Li J., Zhou S., Yuan Y. Bioelectrochemically enhanced degradation of bisphenol S: mechanistic insights from stable isotope-assisted investigations // iScience. 2020. V. 24. Art. 102014. https://doi.org/10.1016/j.isci.2020.102014
Hugerth L.W., Muller E.E.L., Hu Y.O.O., Lebrun L.A.M., Roume H., Lundin D., Wilmes P., Andersson A.F. Systematic design of 18S rRNA gene primers for determining eukaryotic diversity in microbial consortia // PLoS One. 2014. V. 9. Art. e95567. https://doi.org/10.1371/journal.pone.0095567
Jo S.Y., Na Rhie M., Jung S.M., Sohn Y.J., Yeon Y.J., Kim M.-S., Park C., Lee J., Park S.J., Na J.-G. Hydrogen production from methane by Methylomonas sp. DH-1 under micro-aerobic conditions // Biotechnol. Bioprocess Eng. 2020. V. 25. P. 71–77. https://doi.org/10.1007/s12257-019-0256-6
Jung G.-Y., Rhee S.-K., Han Y.-S., So-Jeong Kim S.J. Genomic and physiological properties of a facultative methane-oxidizing bacterial strain of Methylocystis sp. from a wetland // Microorganisms. 2020. V. 8. Art. 1719. https://doi.org/10.3390/microorganisms8111719
Kalyuzhnaya M.G., Yang S., Rozova O.N., Smalley N.E., Clubb J., Lamb A., Gowda G.A.N., Raftery D., Fu Y., Bringel F., Vuilleumier S., Beck D.A.C., Trotsenko Y.A., Khmelenina V.N., Lidstrom M.E. Highly efficient methane biocatalysis revealed in a methanotrophic bacterium // Nat. Commun. 2013. V. 4. Art. 2785. https://doi.org/10.1038/ncomms3785
Magot M., Ollivier B., Patel B.K.C. Microbiology of petroleum reservoirs // Antonie van Leeuwenhoek. 2000. V. 77. P. 103–116. https://doi.org/10.1023/a:1002434330514
Metsalu T., Vilo J. ClustVis: A web tool for visualizing clustering of multivariate data using Principal Component Analysis and heatmap // Nucleic Acids Res. 2015. V. 43. P. W566–W570. https://doi.org/10.1093/nar/gkv468
Miller T.L., Wolin M.J. Methanosphaera stadtmaniae gen. nov., sp. nov.: a species that forms methane by reducing methanol with hydrogen // Arch. Microbiol. 1985. V. 141. P. 116–122. https://doi.org/10.1007/BF00423270
Moser D.P., Gihring T.M., Brockman F.J., Fredrickson J.K., Balkwill D.L., Dollhopf M.E., Lollar B.S., Pratt L.M., Boice E., Southam G., Wanger G., Baker B.J., Pfiffner S.M., Lin L.-H., Onstott T.C. Desulfotomaculum and Methanobacterium spp. dominate a 4- to 5-kilometer-deep fault // Appl. Environ. Microbiol. 2005. V. 71. P. 8773–8783. https://doi.org/10.1128/AEM.71.12.8773-8783.2005
Mochimaru H., Tamaki H., Hanada S., Imachi H., Nakamura K., Sakata S., Kamagata Y. Methanolobus profundi sp. nov., a methylotrophic methanogen isolated from deep subsurface sediments in a natural gas field // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 714–718. https://doi.org/10.1099/ijs.0.001677-0
Doerfert S.N., Reichlen M., Iyer P., Wang M., Ferry J.G. Methanolobus zinderi sp. nov., a methylotrophic methanogen isolated from a deep subsurface coal seam // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1064–1069. https://doi.org/10.1099/ijs.0.003772-0
Nagpal S., Haque M.M., Singh R., Mande S.S. iVikodak – a platform and standard workflow for inferring, analyzing, comparing, and visualizing the functional potential of microbial communities // Front. Microbiol. 2019. V. 9. Art. 3336. https://doi.org/10.3389/fmicb.2018.03336
Nazina T.N., Ivanova A.E., Borzenkov I.A., Belyaev S.S., Ivanov M.V. Occurrence and geochemical activity of microorganisms in high-temperature, water-flooded oil fields of Kazakhstan and Western Siberia // Geomicrobiol. J. 1995. V. 13. P. 181–192. https://doi.org/10.1080/01490459509378016
Nazina T.N., Shestakova N.M., Ivoilov V.S., Kostrukova N.K., Belyaev S.S., Ivanov M.V. Radiotracer assay of microbial processes in petroleum reservoirs // Adv. Biotech. Micro. 2017. V. 2. Art. 555591. https://juniperpublishers.com/aibm/pdf/AIBM.MS.ID.555591.pdf
Pedersen K., Bengtsson A.F., Edlund J.S., Eriksson L.C. Sulphate-controlled diversity of subterranean microbial communities over depth in deep groundwater with opposing gradients of sulphate and methane // Geomicrobiol. J. 2014. V. 31. P. 617–631. https://doi.org/10.1080/01490451.2013.879508
Pérez-Pantoja D., De la Iglesia R., Pieper D.H., González B. Metabolic reconstruction of aromatic compounds degradation from the genome of the amazing pollutant-degrading bacterium Cupriavidus necator JMP134 // FEMS Microbiol. Rev. 2008. V. 32. P. 736–794. https://doi.org/10.1111/j.1574-6976.2008.00122.x
Postgate J.R. The Sulfate-Reducing Bacteria. 2nd ed. Cambridge: Cambridge Univ. Press, 1984.
Šmigáň P., Greksák M., Kozánkova J., Buzek F., Onderka V., Wolf I. Methanogenic bacteria as a key factor involved in changes of town gas stored in an underground reservoir // FEMS Microbiol. Lett. 1990. V. 73. P. 221–224. https://doi.org/10.1111/j.1574-6968.1990.tb03944.x
Widdel F., Bak F. Gram-negative mesophilic sulfate-reducing bacteria // The Prokaryotes / Ed. Balows A., Truper H.G., Dworkin M., Harder W., Schleifer K.-Z. N.Y.: Springer-Verlag, 1992. Ch. 183. P. 3352–3337.
Zerva I., Remmas N., Kagalou I., Melidis P., Ariantsi M., Sylaios G., Ntougias S. Effect of chlorination on microbiological quality of effluent of a full-scale wastewater treatment plant // Life (Basel). 2021. V. 11. Art. 68. https://doi.org/10.3390/life11010068
Дополнительные материалы
- скачать ESM.docx
- Таблица S1. Характеристика исследованных подземных горизонтов ПХГ
Таблица S2. Индексы α-разнообразия микроорганизмов, рассчитанные на основе анализа генов 16S рРНК в библиотеках из водоносных горизонтов ПХГ
- скачать ESM_Page_01.tiff
- Рис. S1. Численность микроорганизмов основных метаболических групп в пробах пластовой воды из подземных хранилищ газа.
- скачать ESM_Page_02.tiff
- Рис. S2. Относительная доля последовательностей фрагментов гена 16S рРНК разных филумов среди последовательностей Archaea в библиотеках из пластовой воды.
Рис. S3. Тепловые карты относительной обильности ферментов, участвующих в метаболизме метана (а), азота (б), серы (в), бензоата (г) и полициклических ароматических соединений (д) в бактериальных сообществах пластовой воды из ПХГ.
- скачать ESM_Page_03.tiff
- Рис. S4. Прогнозируемый профиль ферментов для пути метаболизм метана в сообществах пластовой воды из ПХГ.
- скачать ESM_Page_04.tiff
- Рис. S5. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в пути метаболизма метана в сообществе пластовой воды Kas-5.
- скачать ESM_Page_05.tiff
- Рис. S6. Прогнозируемый профиль ферментов пути метаболизм бензоата в сообществе пластовой воды из скв. 121 Калужского ПХГ.
- скачать ESM_Page_06.tiff
- Рис. S7. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизма бензоата в сообществе пластовой воды Kal-121 из Калужского ПХГ.
- скачать ESM_Page_07.tiff
- Рис. S8. Прогнозируемый профиль ферментов для пути метаболизм серы в сообществах пластовой воды из ПХГ.
- скачать ESM_Page_08.tiff
- Рис. S9. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизма серы в сообществе пластовой воды Kal-121 из Калужского ПХГ.
- скачать ESM_Page_09.tiff
- Рис. S10. Прогнозируемый профиль ферментов пути метаболизма азота в сообществе пластовой воды Kal-121 из Калужского ПХГ.
- скачать ESM_Page_10.tiff
- Рис. S11. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизма азота в сообществе пластовой воды Kal-121 из Калужского ПХГ.
- скачать ESM_Page_11.tiff
- Рис. S12. Прогнозируемый профиль ферментов пути метаболизм полициклических ароматических углеводородов в сообществе пластовой воды из скв. 121 Калужского ПХГ.
- скачать ESM_Page_12.tiff
- Рис. S13. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизма полициклических ароматических углеводородов в сообществе пластовой воды Kal-121 из Калужского ПХГ.
- скачать ESM_Page_13.tiff
- Рис. S14. Прогнозируемый профиль ферментов пути метаболизм бисфенола в сообществах пластовой воды Щелковского ПХГ.
Рис. S15. Дендрограмма, показывающая ключевые микроорганизмы и их филогенетические линии, участвующие в метаболизма бисфенола в сообществах пластовой воды Щелковского ПХГ.


