Микробиология, 2022, T. 91, № 1, стр. 3-31
Разнообразие термофильных прокариот в природных горячих источниках Российской Федерации
Т. В. Кочеткова a, *, О. А. Подосокорская a, А. Г. Ельченинов a, И. В. Кубланов a
a ФИЦ Биотехнологии РАН, Институт микробиологии им. С.Н. Виноградского
117312 Москва, Россия
* E-mail: kochetkova.tatiana.v@gmail.com
Поступила в редакцию 25.08.2021
После доработки 24.09.2021
Принята к публикации 25.09.2021
- EDN: KXSXES
- DOI: 10.31857/S0026365622010062
Аннотация
В обзоре представлены ключевые результаты изучения разнообразия термофильных прокариот, обитающих в природных горячих источниках Российской Федерации. Основная часть обзора посвящена обобщению данных классических микробиологических, радиоизотопных, молекулярно-экологических работ, проведенных за десятки лет исследований термофильных микробных сообществ на территории полуострова Камчатка, Курильских островов и района озера Байкал. Также представлены данные по недавно изученным гидротермам Восточно-Тувинского нагорья, Чукотки, острова Сахалин, Северного Кавказа. Собраны воедино таксономические данные обо всех описанных термофильных прокариотах, выделенных из горячих источников на территории России. Рассмотрены основные энергодающие процессы, базирующиеся, в первую очередь, на окислительно-восстановительных реакциях неорганических (прежде всего, серы и железа) и органических соединений. Уделено большое внимание термофильным прокариотам, участвующим в круговороте углерода: от ассимилирующих углекислоту хемолитоавтотрофных прокариот до деструкторов органического вещества. Отдельно обсуждаются пока некультивируемые группы термофильных бактерий и архей, присутствие которых, а порой и их доминирование в источниках, было выявлено только благодаря молекулярно-экологическим методам.
ВВЕДЕНИЕ
Горячие (или термальные) источники – это выходы на поверхность подземных вод, температура в которых выше среднегодовой климатической температуры в регионе (Кейльгак, 1935). Тем не менее в данном обзоре будут обсуждаться только природные источники с температурой воды выше 45–50°С, так как эта температура считается нижней границей оптимума роста термофильных микроорганизмов. Горячие источники встречаются по всему миру и приурочены к зонам геотермальной активности. Большой интерес микробиологов к горячим источникам возник в 60-х годах XX века после опубликования работ американского исследователя Т. Брока (T. Brock), обнаружившего в гидротермах Йеллоустонского национального парка (США) микробные сообщества, растущие при температурах выше 50°С (Brock, Freeze, 1969). Ранее считалось, что некоторые микроорганизмы способны только переносить высокие температуры, например, за счет образования спор. Однако открытая Броком термофильная бактерия Thermus aquaticus оптимально росла при 65–70°С и не могла расти при температуре ниже 50°С. Впоследствии эта бактерия была использована для получения термостабильной ДНК-полимеразы, применяемой в ПЦР (Saiki et al., 1988) – методе, за который в 1993 г. разработчик новой биотехнологии К. Муллис (K. Mullis) получил Нобелевскую премию. Открытие в конце 70‑х годов глубоководных гидротермальных систем, так называемых “черных курильщиков”, расположенных в зонах разломов океанических плит, а также связанных с ними уникальных экосистем, практически не зависящих от энергии солнечного света, привело к следующему скачку интереса к термофильным микроорганизмам (Corliss et al., 1979).
Наибольшее количество природных горячих источников, как наземных, так и глубоководных, сконцентрировано в регионах современного вулканизма на границах литосферных плит (в зонах субдукции), а также в местах спрединга океанических плит или континентального рифта. Самая большая зона вулканической активности на нашей планете находится в Тихоокеанском Огненном Кольце, захватывающем регионы от Алеутских островов на севере до вулканов Новой Зеландии и Чили на юге. Помимо этого, гидротермальная активность хорошо выражена в вулканическом поясе Средиземноморья, на активных молодых океанических и континентальных рифтах (Срединно-Атлантический хребет, Исландия, Восточно-Африканский рифт).
Нагрев гидротермального флюида в вулканических местах обитания происходит за счет непосредственного контакта с магмой и/или сильно нагретыми породами. Поэтому температура воды на поверхности в таких местах может достигать точки кипения, а на морском дне из-за повышения гидростатического давления может быть выше 100°С. Геохимия горячих источников весьма разнообразна и, в первую очередь, определяется составом вмещающих пород, сквозь которые проходят горячие потоки воды, и выделяющимися на поверхность газами. Как следствие, рН в горячих источниках вулканического происхождения также может сильно варьировать – от 0–2 до 9–10. На территории России горячие источники вулканического происхождения сконцентрированы в Курило-Камчатском регионе, являющимся частью Тихоокеанского подвижного пояса. К ним относится большинство источников полуострова Камчатка, а также наземные и прибрежные горячие выходы Курильских островов.
Гидротермальные выходы обнаруживаются и в регионах, где нет современной вулканической активности. В таких местах горячие источники проявляются за счет повышенной тектоно-магматической активности. В данном случае атмосферные воды, попадающие с осадками и/или циркулирующие под землей, нагреваются только за счет контакта с нагретыми породами, но не с магмой. Как правило, температура воды в зоне разгрузки таких источников не превышает 70°С. Это напрямую влияет на химический состав термальной воды и, как следствие, на ее рН, который обычно варьирует в узкой околонейтральной и слабощелочной зоне (рН 6–8). В воде таких умеренно термальных источников практически нет соединений серы, чье присутствие связано исключительно с вулканическими процессами. Термальные источники невулканического генезиса в России расположены в Алтайском, Хабаровском крае, Магаданской области, на востоке Чукотского полуострова (Басков, Суриков, 1989; Polyak et al., 2013).
По одной из наиболее общепринятых теорий, жизнь на Земле началась именно в горячих источниках (Rasmussen, 2000; Des Marais, Walter, 2019), и первыми организмами, населившими нашу планету, были термофилы (Weiss et al., 2016). Считается, что все ныне живущие организмы являются потомками так называемого последнего общего предка – LUCA (Last Universal Common Ancestor) (Woese et al., 1990; Martin, Russel, 2003; Weiss et al., 2016). Изучение природных термальных экосистем и обитающих в них термофильных сообществ может приблизить нас к пониманию происхождения и ранних этапов эволюции жизни на Земле, а также, возможно, и на других планетах (Des Marais, Walter, 2019). Также большой интерес представляют ферменты термофилов и гипертермофилов (термозимы), характеризующиеся высокой стабильностью, что делает их перспективными для различных областей применения (DeCastro et al., 2016).
Данный обзор посвящен разнообразию термофильных прокариот, обитающих в горячих источниках России с температурой воды выше 45–50°С (рис. 1). Подробно рассмотрены микробные сообщества гидротерм Камчатки, Курильских островов, района озера Байкал, где многие годы велись микробиологические исследования. Огромный вклад в эти исследования был сделан академиком Г.А. Заварзиным и его сотрудниками, в первую очередь, группой под руководством Е.А. Бонч-Осмоловской. Также в обзоре представлены результаты микробиологических исследований горячих источников Чукотки, Тувы и острова Сахалин. Кавказские термальные источники, несмотря на историческую известность и популярность у населения, остаются практически неизученными с микробиологической точки зрения.
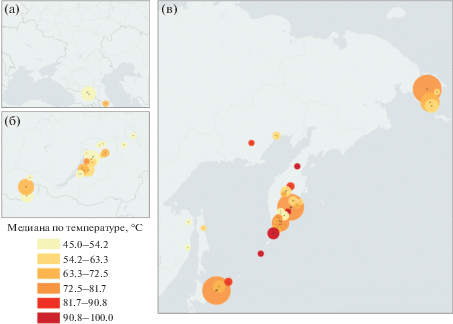
Рис. 1.
Географическое положение природных высокотемпературных горячих источников, расположенных на территории России: а – Кавказ; б – Байкальская рифтовая зона; в – Дальний Восток. Карта была отформатирована с использованием kepler.gl (https://kepler.gl): медианные температуры (см. шкалу) показаны для каждого кластера, который был сформирован на близко расположенных друг к другу горячих источниках.
ГОРЯЧИЕ ИСТОЧНИКИ КУРИЛО-КАМЧАТСКОГО РЕГИОНА
Горячие источники Камчатки
Наибольшее количество высокотемпературных гидротерм Камчатки сосредоточено в Узон-Гейзерной системе, кальдере Академии Наук, рядом с Большесемячинской кальдерой, Паужетке, Киреунской и Апапельской системах. Проявления геотермальной активности (фумаролы, сольфатары и др.) и обилие горячих источников можно наблюдать также в районах активных вулканов, например, Мутновского и Карымского (Федотов, 1991) (рис. 1в). Горячие источники Камчатки отличаются огромным разнообразием по химическому составу, рН и температуре, что обусловлено составом окружающих глубинных пород и мощностью горячего флюида. Самые крупные проявления геотермальной активности на Камчатке связаны с Узон-Гейзерной системой, центрами которой являются кальдера вулкана Узон (рис. 2) и долина р. Гейзерной. По химическому составу высокотемпературные термы Долины гейзеров и кальдеры Узон близки, однако в узонских термах почти вдвое выше общая минерализация. Кальдера Узон представляет собой овальную впадину площадью около 110 км2 с плоским дном и минимальной высотой в 650 м над уровнем моря (Karpov, Naboko, 1990). На Узоне можно обнаружить все типы поверхностных проявлений геотермальной активности: горячие источники, грязевые котлы и грязевые вулканы, фумаролы, а также относительно недавно “открывшийся” гейзер. Уникальность кальдеры Узон заключается в том, что здесь на сравнительно небольшом пространстве соседствуют все основные типы гидротерм: перегретые хлоридно-натриевые растворы с высокими концентрациями бора, мышьяка, сурьмы, ртути и лития; хлоридно-сульфатные, сульфат-хлоридные, сульфатные и бикарбонатные. На Узоне имеются большие запасы S–Hg–Sb–As–FeS-содержащих руд (Karpov, Naboko, 1990); обнаружены нефтяные образования сложного происхождения (Bazhenova et al., 1998). В то же время в Долине гейзеров ничего подобного не наблюдается. Газы, выходящие из горячих источников, в основном состоят из СО2 и N2, со значимым содержанием H2, CH4, H2S, паров серы, СО, NH3, которые могут служить донорами электронов для хемотрофных микроорганизмов (Заварзин и соавт., 1989).
Рис. 2.
Термальные ручьи (а, в), грязевые котлы (б) и горячие источники (г, д) кальдеры вулкана Узон, Камчатка.

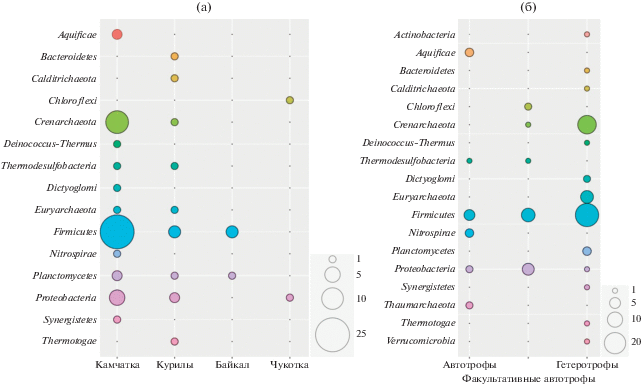
Следствием разнообразия физико-химических параметров горячих источников Камчатки является разнообразие населяющих их микробных сообществ. Основными источниками энергии для микроорганизмов являются восстановленные неорганические соединения, вулканические газы и органическое вещество, синтезируемое автотрофами за счет хемосинтеза или поступающее извне (Бонч-Осмоловская и соавт., 1999). Микробный фотосинтез ограничивается температурой 73°С (Brock, 1978; Boyd et al., 2012) и поэтому не играет ведущей роли в многочисленных высокотемпературных источниках Камчатки. Таким образом, хемолитоавтотрофные прокариоты, использующие восстановленные неорганические соединения вулканического происхождения (на Камчатке это, прежде всего, соединения серы и водород) в качестве донора электронов, являются главными первичными продуцентами в этих экосистемах (табл. 1), поэтому в первую очередь нами будет рассмотрено микробное разнообразие хемолитоавтотрофов.
Таблица 1.
Хемолитоавтотрофные термофильные прокариоты, выделенные из горячих источников Камчатки
| Филум | Название | Донор ${{\bar {e}}}$ | Акцептор ${{\bar {e}}}$ | Облигатная/ факультативная автотрофия |
Опт. Т°С/рН | Ссылка |
|---|---|---|---|---|---|---|
| Термофильные автотрофы, использующие энергию серных соединений | ||||||
| Aquificae | Hydrogenobacter hydrogenophilus | Н2 | O2 | Облигатная | 74–78/6–7 | Крюков и соавт., 1983; Eder, Huber, 2002 |
| Sulfurihydrogenibium rodmanii | S0, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$ | O2 | Облигатная | 75/6.0–6.3 | O’Neill et al., 2008 | |
| Thermocrinis sp. | H2, S0 | O2 | Облигатная | 80/5.0 | Eder, Huber, 2002 | |
| Firmicutes | Ammonifex thiophilus | Н2 | S0, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$, ${\text{SO}}_{{\text{4}}}^{{2 - }}{\text{,}}\,\,{\text{SO}}_{{\text{3}}}^{{2 - }}$ | Облигатная | 75/6.8 | Miroshnichenko et al., 2008а; Merkel et al., 2017 |
| Brockia lithotrophica | H2, формиат | S0, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$ | Облигатная | 60–65/6.5 | Perevalova et al., 2013 | |
| Carboxydothermus pertinax | H2 | ${\text{SO}}_{{\text{3}}}^{{2 - }}$ | Факультативная | 60/6.0 | Merkel et al., 2017 | |
| Desulfothermobacter acidiphilus | H2, формиат | ${\text{SO}}_{{\text{4}}}^{{2 - }}$, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$ | Факультативная | 55/4.5 | Frolov et al., 2018 | |
| Sulfobacillus thermosulfidooxidans | S0, S2–, Fe(II) | O2 | Облигатная | 50–55/1.9–2.4 | Головачева, Каравайко, 1978 | |
| Thermodesulfobium acidiphilum* | H2, формиат | ${\text{SO}}_{{\text{4}}}^{{2 - }}$, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$ | Облигатная | 55/4.8–5.0 | Frolov et al., 2017 | |
| Proteobacteria | Desulfurella acetivorans, D. kamchatkensis, D. propionica | H2 | S0 | Факультативная | 52–57/ около 7.0 | Bonch-Osmolovskaya et al., 1990а; Miroshnichenko et al., 1998 |
| Dissulfurimicrobium hydrothermale | S0 | S0 | Облигатная | 50–52/ 6.0–6.2 | Slobodkin et al., 2016 | |
| Thermothrix thiopara | H2S | O2 | Факультативная | 70–75 | Кузнецов, 1955 | |
| Thermodesulfobacteria | Caldimicrobium rimae | H2, S0 | ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$, S0, ${\text{SO}}_{{\text{3}}}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$ | Факультативная | 75/7.0–7.2 | Miroshnichenko et al., 2009; Merkel et al., 2017 |
| Crenarchaeota | Sulfurococcus mirabilis | S0 | O2 | Факультативная | 70–75/2.0–2.6 | Головачева и соавт., 1987 |
| Термофильные нитрификаторы | ||||||
| Nitrospirae | Nitrospira sp. | ${\text{NO}}_{2}^{ - }$ | O2 | Облигатная | 46/7.8 | Lebedeva et al., 2011 |
| Thaumarchaeota | ‘Ca. Nitrosotenuis uzonensis’ | ${\text{NH}}_{4}^{ + }$ | O2 | Облигатная | 46/6.5 | Lebedeva et al., 2013 |
| Термофильные карбоксидотрофы | ||||||
| Firmicutes | Carboxydocella thermautotrophica, C. sporoproducens | CO | H2O, Fe3+ | Факультативная | 58–60/7.0 | Sokolova et al., 2002; Slepova et al., 2006; Toshchakov et al., 2018 |
| Термофильные автотрофы, использующие энергию соединений железа | ||||||
| Firmicutes | Carboxydocella manganica | H2, формиат | Fe3+, Mn4+, ${\text{NO}}_{3}^{ - }$ | Факультативная | 58–60/6.5 | Slobodkina et al., 2012 |
| Thermoanaerobacter siderophilus | H2 | Fe3+, S0, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{{\text{3}}}^{{{\text{2}} - }}$, ${\text{SO}}_{{\text{3}}}^{{2 - }}$ | Факультативная | 70/6.3 | Slobodkin et al., 1999 | |
| Nitrospirae | Leptospirillum thermoferrooxidans | Fe2+ | O2 | Облигатная | 45–50/1.6–1.9 | Головачева и соавт., 1992 |
В большинстве источников доминирующей группой являются факультативные хемолитоавтотрофные микроаэрофильные бактерии одного из самых филогенетически глубоких бактериальных филумов – Aquificae11, составляя порой до 85% от всего сообщества микроорганизмов (Reigstad et al., 2010; Merkel et al., 2017). Их можно легко обнаружить по обильным серо-белым слизистым “космам”, активно развивающимся по стенкам источников или в руслах термальных ручьев (рис. 2а). Представители этого филума фиксируют углекислоту за счет окисления неорганических доноров электронов, в основном, водорода и восстановленных соединений серы, используя при этом практически весь спектр имеющихся в источниках акцепторов электронов (О2, ${\text{NO}}_{3}^{ - },$ S0, ${{{\text{S}}}_{{\text{2}}}}{\text{O}}_{3}^{{2 - }},$ ${\text{SO}}_{3}^{{2 - }},$ Fe3+, ${\text{AsO}}_{4}^{{3 - }},$ ${\text{SeO}}_{3}^{{2 - }}$) (Reysenbach et al., 2005; Hedlund et al., 2015). Некоторые Aquificae способны расти миксотрофно, а также использовать короткоцепочечные органические кислоты и/или амиды в качестве основного источника углерода и энергии при гетеротрофном росте (Urschel et al., 2015). При этом, как и в остальных наземных гидротермах по всему миру (Skirnisdottir et al., 2000; Inskeep et al., 2013; Hou et al., 2013; Huang et al., 2013; Hedlund et al., 2015), разнообразие Aquificae на Камчатке невелико (Merkel et al., 2017). Бактерии этого филума представлены несколькими родами: Sulfurihydrogenibium, Hydrogenobacter, Hydrogenobaculum, Thermocrinis и Thermosulfidibacter. В источниках с рН выше 5 и температурами от 60 до 97°С чаще всего встречаются представители рода Sulfurihydrogenibium (Wemheuer et al., 2013; Merkel et al., 2017; Mardanov et al., 2018; Wilkins et al., 2019). В кислых источниках бактерии Aquificae обнаруживаются в значительно меньшем количестве, и только представители рода Hydrogenobaculum (Mardanov et al., 2018). Из камчатских источников в чистые культуры удалось выделить S. rodmanii (O’Neill et al., 2008), Hydrogenobacter spp. (Крюков и соавт., 1983; Eder, Huber, 2002), а также представителя рода Thermocrinis (Eder, Huber, 2002).
Помимо представителей Aquificae, в горячих источниках Камчатки встречаются и другие термофильные автотрофные микроорганизмы, также получающие энергию, в основном, за счет окислительно-восстановительных реакций соединений серы (табл. 1). Среди них есть как археи, так и бактерии, ацидофилы и нейтрофилы, строгие аэробы, факультативные и строгие анаэробы. Последние характеризуются наибольшим разнообразием, что связано: а) с низкой растворимостью кислорода при высоких температурах и б) с отрицательным Eh из-за большой концентрации восстановленных соединений вулканического происхождения. Среди таких микроорганизмов стоит отметить факультативно автотрофную анаэробную гипертермофильную бактерию Caldimicrobium rimae (филум Thermodesulfobacteria), доля которой в горячих нейтральных источниках Камчатки, особенно высокотемпературных, часто составляет десятки процентов. Этот микроорганизм способен фиксировать углекислоту при росте за счет окисления водорода, сопряженного с восстановлением тиосульфата или серы, или за счет диспропорционирования серы (Miroshnichenko et al., 2009; Chernyh et al., 2015; Merkel et al., 2017). При понижении температуры воды до 50–60°С преимущество получают умеренно термофильные автотрофные анаэробные бактерии, также восстанавливающие различные соединения серы, как, например, Ammonifex thiophilus (Черных и соавт., 2017), Brockia lithotrophica (Perevalova et al., 2013), представители рода Desulfurella (Miroshnichenko et al., 1998; Mall et al., 2018) и другие (табл. 1). В кислых горячих источниках (при рН ниже 4) преобладают сероокисляющие хемолитоавтотрофные бактерии рода Acidithiobacillus (Mardanov et al., 2011, 2018), а также гетеротрофные аэробные археи рода Sulfolobus (Mardanov et al., 2018), некоторые из которых способны к автотрофному росту. Среди анаэробных прокариот в кислых источниках Камчатки обитают микроорганизмы, способные к диссимиляционной сульфатредукции, например, литоавтотрофная умеренно термофильная бактерия Thermodesulfobium acidiphilum, представитель новой филогенетической линии уровня филума (Frolov et al., 2017, 2021), и гипертермофильная архея ‘Ca. Vulcanisaeta mutnovskia’ (Prokofeva et al., 2005; Chernyh et al., 2020; Frolov et al., 2021).
Кроме соединений серы и водорода, вулканические газы содержат и другие энергетически богатые неорганические соединения, которые могут являться субстратами для литотрофных термофилов, обитающих в горячих источниках, например, восстановленные соединения азота, прежде всего аммоний. Архейная нитрификация в источниках Камчатки была показана молекулярно-биологическими методами в широком диапазоне рН (2.5–7.4), температур (49–94°С) и других физико-химических параметров (Reigstad et al., 2008). В некоторых высокотемпературных источниках была показана высокая доля представителей Thaumarchaeota (Eme et al., 2013; Wemheuer et al., 2013). Однако, несмотря на достаточно высокое число аммоний-окисляющих гипертермофилов в источниках, получить чистые культуры этих прокариот так пока и не удалось. Только из источника с температурой 45°С была получена накопительная культура, где доминировала аммоний-окисляющая автотрофная архея ‘Ca. Nitrosotenuis uzonensis’ (Lebedeva et al., 2013). Что касается аммоний-окисляющих термофильных бактерий, то данные об их существовании ограничиваются лишь получением из камчатских источников накопительных культур, развивающихся при 55°С (Головачева, 1976). Единственная термофильная нитритокисляющая бактерия, выделенная из горячего источника Камчатки, является представителем рода Nitrospira (Lebedeva et al., 2011). Продуктом окисления нитрита является нитрат, который используется в качестве акцептора электронов многими обитающими в горячих источниках факультативными анаэробами и микроаэрофилами – от типичных автотрофных бактерий филума Aquificae до типичных гетеротрофных представителей рода Thermus (Albuquerque et al., 2018).
Одним из часто обнаруживаемых компонентов вулканических газов является угарный газ (СО) (Symonds et al., 1994). Он не только поступает из недр земли, но и образуется в ходе термического и фотохимического разложения органического вещества в самих источниках (Hellebrand, Schade, 2008). Из горячих источников Камчатки было выделено большое количество анаэробных гидрогеногенных карбоксидотрофных микроорганизмов, окисляющих СО до СО2 с образованием водорода из воды. Прежде всего, это представители широко распространенного на Камчатке умеренно термофильного рода Carboxydocella – C. thermautotrophica (Sokolova et al., 2002; Toshchakov et al., 2018), C. sporoproducens (Slepova et al., 2006) и другие представители этого рода (Kochetkova et al., 2011), а также представители рода Carboxydothermus (Slepova et al., 2009), экстремально термофильная бактерия рода Dictyoglomus (Kochetkova et al., 2011) и гипертермофильная архея рода Thermofilum (Kochetkova et al., 2020а). При этом доля гидрогеногенных карбоксидотрофов в сообществах горячих источников невелика (Kochetkova et al., 2011), и, как правило, большинство представителей этой физиологической группы, помимо СО, способны использовать другие субстраты. Тем не менее, карбоксидотрофы играют важную роль микробного фильтра, удаляющего токсичный для большинства живых организмов угарный газ, образуя водород, используемый многими хемолитотрофными термофилами в качестве донора электронов.
Метан в горячих источниках Камчатки может иметь как абиогенное (компонент вулканических газов), так и биогенное происхождение. В кислых источниках на Камчатке он, по всей видимости, полностью имеет глубинное происхождение (Бонч-Осмоловская и соавт., 1999; Меркель и соавт., 2015). В то же время в источниках с нейтральными и слабощелочными условиями метан частично образуется в результате гидрогенотрофного метаногенеза, осуществляемого представителями порядков эвриархей Methanobacteriales, Methanosarcinales, Methanomassiliicoccales и Methanocellales (Меркель и соавт., 2015). Окисляется метан в горячих источниках аэробными метанотрофными бактериями. Из кислого источника кальдеры Узон был получен штамм ‘Ca. Methylacidiphilum kamchatkense’, относящийся к филуму Verrucomicrobia, оптимально растущий при 55°С и рН 3.5 (Islam et al., 2008; Op den Camp et al., 2009). Молекулярно-биологическими методами было показано высокое содержание представителей этой ветви Verrucomicrobia в источниках со схожими характеристиками (Mardanov et al., 2011). В не-йтральных же источниках на Камчатке за окисление метана отвечают аэробные представители Proteobacteria – умеренно термофильные бактерии родов Methylothermus и Methylobacter (Дворянчикова и соавт., 2011).
Глубинные гидротермальные воды несут большое количество восстановленного железа, которое в местах выхода на поверхность химически и биологически окисляется и откладывается в виде нерастворимых оксидов железа (Слободкин, 2005). Среди окисляющих железо термофильных микроорганизмов на Камчатке широко распространены аэробные бактерии Sulfobacillus thermosulfidooxidans, обитающие в кислых источниках с умеренными температурами (Головачева, Каравайко, 1978). Совсем недавно было показано, что окисление железа может поддерживать жизнь термофильных прокариот и в нейтральных условиях, при этом единственным акцептором электронов служит углекислота (Zavarzina et al., 2020). Процессы микробной трансформации минералов, содержащих окисленное и восстановленное железо, могли быть важными точками сопряжения биогеохимических циклов углерода и железа в биосфере ранней Земли (Walker, 1987; Zavarzina et al., 2020). Как и в случае соединений серы, соединения железа могут служить не только донорами, но и акцепторами электронов. “Железное дыхание”, открытое Балашовой и Заварзиным (1979), является глобальным биосферным процессом, связанным с биогеохимическими циклами углерода, кислорода и серы (Слободкин, 2005). Диссимиляционная железоредукция у термофилов впервые была показана на накопительной культуре, полученной из горячего источника Долины гейзеров, которая состояла из двух термофильных бактерий Caldanaerobacter subterraneues и Thermolithobacter ferrireducens и синтрофно окисляла ацетат, восстанавливая ферригидрит в магнетит (Слободкин и соавт., 1995). Позднее из камчатских горячих источников было выделено большое количество бактерий филума Firmicutes, способных к восстановлению железа: Caldanaerobacter subterraneues (Слободкин и соавт., 2011), Thermoanaerobacter siderophilus (Slobodkin et al., 1999), Thermovenabulum ferriorganovorum (Zavarzina et al., 2002), Carboxydocella thermautotrophica (Sokolova et al., 2002) и C. manganica (Slobodkina et al., 2012), Carboxydothermus siderophilus (Slepova et al., 2009), Moorella humiferra (Nepomnyashchaya et al., 2012). Также была выделена гипертермофильная архея Pyrobaculum ferrireducens (Slobodkina et al., 2015а), растущая на пептидах за счет восстановления железа и других акцепторов (табл. 2).
Таблица 2.
Гетеротрофные прокариоты, выделенные из горячих источников Камчатки
| Филум | Название | Субстрат | Акцептор ${{\bar {e}}}$ | Опт. Т°С/рН | Ссылка |
|---|---|---|---|---|---|
| Бактерии | |||||
| Deinococcus-Thermus | Meiothermus ruber | Сахара, белковые соединения | O2 | 60/6.5–7.3 | Loginova et al., 1984 |
| Dictyoglomi | Dictyoglomus turgidus, D. thermophilum, Dictyoglomus sp. |
Полисахариды, сахара, пептиды, CO | Без акцептора | 72/7.0 | Светличный, Светличная, 1988; Kublanov et al., 2009; Kochetkova et al., 2011 |
| Firmicutes | Anaerobranca zavarzinii | Пептиды | Без акцептора, фумарат, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, S0 | 54–60/8.5–9.0 | Kevbrin et al., 2008 |
| Anoxybacillus voinovskiensis, A. kamchatkensis | Сахара, белковые соединения | O2, ${\text{NO}}_{3}^{ - }$, без акцептора | 54–60/7.0–8.5 | Yumoto et al., 2004; Kevbrin et al., 2005 | |
| Caldanaerobacter uzonensis, C. subterraneus | Сахара, пептиды, полисахариды, Н2 | ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, Fe3+, без акцептора | 65–70/6.8 | Kublanov et al., 2009; Kozina et al., 2010; Слободкин и соавт., 2011 | |
| Caldalkalibacillus uzonensis | Белковые соединения, углеводороды | О2 | 50/8.2 | Zhao et al., 2008 | |
| Caldicellulosiruptor kronotskyensis, C. hydrothermalis, C. bescii | Полисахариды, сахара, белковые соединения | Без акцептора | 65–80/7.0 | Светличный и соавт., 1990; Miroshnichenko et al., 2008b | |
| Carboxydothermus siderophilus | CO, дрожжевой экстракт, сахара, лактат | Fe3+ | 65/6.5–7.2 | Slepova et al., 2009 | |
| Geobacillus icigianus | Сахара, белковые соединения | O2, ${\text{NO}}_{3}^{ - }$ | 60–65/6.5–7.0 | Bryanskaya et al., 2015 | |
| Moorella humiferrea | Органические кислоты, дрожжевой экстракт, сахара | Fe3+, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$, гуминовые кислоты, перхлорат | 65/7.0 | Nepomnyashchaya et al., 2012 | |
| Tepidibaculum saccharolyticum | Сахара, полисахариды, белковые соединения | Без акцептора | 50/8.0–9.0 | Slobodkina et al., 2018 | |
| Thermoanaerobacter sulfurophilus, T. uzonensis |
Сахара, полисахариды, оргкислоты, белковые соединения | S0, без акцептора | 55–60/6.8–7.2 | Бонч-Осмоловская и соавт., 1997; Wagner et al., 2008 | |
| Thermoanaerobacterium aciditolerans | Пептиды, полисахариды | ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, ${\text{SO}}_{3}^{{2 - }}$, без акцептора | 55/5.7 | Kublanov et al., 2007 | |
| Thermovenabulum ferriorganovorum | Белковые соединения, сахара, органические кислоты, крахмал | Fe3+, S0, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, ${\text{SO}}_{3}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$ | 65/6.7 | Zavarzina et al., 2002 | |
| Nitrospirae | Thermodesulfovibrio aggregans | H2 и ацетат | ${\text{SO}}_{4}^{{2 - }}$ | 65/5.5 | Frolov et al., 2021 |
| Planctomycetes | Tepidisphaera mucosa | Сахара, полисахариды | O2, без акцептора | 47–50/7.0–7.5 | Kovaleva et al., 2015 |
| Thermogemmata fonticola | Сахара, полисахариды | O2 | 54–60/7.5 | Elcheninov et al., 2021 | |
| Synergistetes | Thermanaerovibrio velox | Сахара, пептиды | S0, без акцептора | 60–65/7.3 | Zavarzina et al., 2000 |
| Verrucomicrobia | ‘Ca. Methylacidiphilum kamchatkense’ | Метан, метанол | О2 | 55/3.5 | Islam et al., 2008; Op den Camp et al., 2009 |
| Археи | |||||
| Crenarchaeota | Acidilobus aceticus, A. saccharovorans |
Крахмал, белковые соединения, углеводороды | S0, без акцептора | 85/3.8 | Prokofeva et al., 2000, 2009 |
| Desulfurococcus amylolyticus, D. mucosus | Пептиды, полисахариды | S0, без акцептора | 85−90/6.4 | Бонч-Осмоловская и соавт., 1988; Perevalova et al., 2016 | |
| Fervidicoccus fontis | Белковые соединения, липиды | S0, без акцептора | 67/5.6 | Perevalova et al., 2010; Карасева и соавт., 2021 | |
| Infirmifilum uzonense | Полисахариды, белковые соединения, сахара | Без акцептора | 85/6.0–6.5 | Toshchakov et al., 2015 | |
| Pyrobaculum ferrireducens | Пептиды | Fe3+, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, ${\text{NO}}_{3}^{ - }$, селенит, селенат и арсенат | 90–95/6–7 | Slobodkina et al., 2015а | |
| ‘Sulfolobus islandicus’ | S0 и пептиды | O2 | 75/3.5 | Whitaker et al., 2003 | |
| Thermofilum adornatum | Полисахариды, белковые соединения, сахара, СО | S0, без акцептора | 80/5.5–6.0 | Kochetkova et al., 2020а; Zayulina et al., 2020b | |
| Thermogladius calderae | Полисахариды, белковые соединения, сахара | S0, без акцептора | 84/7.1 | Kochetkova et al., 2016 | |
| ‘Thermoproteus uzoniensis’ | Пептиды | S0, без акцептора | 90/5.7 | Bonch-Osmolovskaya et al., 1990b | |
| ‘Ca. Vulcanisaeta moutnovskia’ | Дрожжевой экстракт, пептон | ${\text{SO}}_{4}^{{2 - }}$ | 84/4.8 | Prokofeva et al., 2005; Chernyh et al., 2020 | |
| Euryarchaeota | Methanothrix thermoacetophila | Ацетат | СО2 | 65 | Ножевникова и Чудина, 1984 |
| Thermoplasmatota | Thermoplasma sp. | Сахара, дрожжевой экстракт | О2, S0 | 60/3.0 | Prokofeva et al., 2005 |
Фотосинтезирующие микроорганизмы, являющиеся основными первичными продуцентами в мезофильных местах обитания, в горячих источниках лимитированы температурой – они могут развиваться лишь в источниках с температурой воды не выше 73°С (Brock, 1978; Boyd et al., 2012). Основные прокариотные фотосинтетики – цианобактерии – в горячих источниках на Камчатке обнаруживаются лишь при температуре ниже 60°С, а начинают доминировать только в мезофильных условиях (Горленко и соавт., 1987). Тем не менее, термофильные цианобактериальные маты горячих источников кальдеры Узон послужили моделью для изучения докембрийского сообщества, активно формирующего кислородную атмосферу (Заварзин и соавт., 1989). Среди термофильных фототрофов на Камчатке преобладают бактерии родов Chloroflexus, и, в меньшей степени, Roseoflexus, относящиеся к филуму Chloro-flexi (Горленко и соавт., 1987; Gaisin et al., 2016) и придающие матам оливковый цвет. Также в умеренно теплых матах развиваются пурпурные несерные бактерии Rhodocyclus gelatinosus, Rhodopseudomonas palustris, Rhodobacter capsulatus. Их присутствие объясняет оранжевый цвет матов (рис. 2в).
В фототрофных матах, а также в осадках горячих источников доля гетеротрофных прокариот значительно выше, чем в воде, и благодаря им не происходит большого накопления органики (Заварзин и соавт., 1989). Большинство гетеротрофных термофильных прокариот, населяющих горячие источники Камчатки, являются факультативными или строгими анаэробами (табл. 2). Согласно молекулярно-экологическим исследованиям микробных сообществ источников Камчатки, основными и наиболее часто встречающимися деструкторами являются представители таких бактериальных филумов, как Dictyoglomi, Thermotogae, Firmicutes, Caldiserica, Deinococcus-Thermus (Kublanov et al., 2009; Wemheuer et al., 2013; Rozanov et al., 2014а; Wilkins et al., 2019), многие из них были выделены в чистые культуры (табл. 2). Среди культивируемых гетеротрофных архей в нейтральных источниках с умеренно высокими температурами наиболее часто встречаются представители родов кренархеот Fervidicoccus и Caldisphaera (Perevalova et al., 2008; Kublanov et al., 2009; Merkel et al., 2017; Wilkins et al., 2019), в высокотемпературных (>80°С) – Pyrobaculum и Thermoproteus (Chernyh et al., 2015). В кислых источниках встречаются культивируемые гетеротрофные археи родов Acidilobus, Thermoplasma, Acidiplasma, а также некоторые представители ‘Ca. Microarchaeota’ (суперфилум DPANN), поддерживающиеся в накопительной культуре с археями-хозяевами порядка Thermoplasmatales (Prokofeva et al., 2005; Golyshina et al., 2019). Субстратами для гетеротрофных термофилов в источниках может служить огромный спектр органических соединений: сахара, включая полисахариды – компоненты клеток растений, водорослей и микроорганизмов, а также составляющие экзоскелет насекомых (целлюлоза, ксилан, крахмал, лихенан, хитин и др.); аминокислоты, пептиды и белки; липиды – компоненты клеточных мембран и запасных соединений клеток; углеводороды, образуемые в источниках из биомассы прокариот; низкомолекулярные органические соединение (кислоты, спирты, амиды и др.), образуемые в процессе сбраживания сахаров и пептидов (табл. 2).
Несмотря на внушительный список чистых культур термофильных бактерий и архей, выделенных к настоящему моменту из горячих источников Камчатки (табл. 1 и 2), основная масса таксонов была выявлена только при помощи молекулярно-экологических методов. При этом некультивируемые представители в ряде горячих источников доминируют или составляют значимую часть сообществ. Например, в сообществе источника Заварзина (рис. 2г, 60°С/6.5), активно исследуемого многие десятилетия, четвертая часть всего разнообразия микроорганизмов относится к некультивируемым бактериям, в том числе, уровня нового филума (Burgess et al., 2012). В другом модельном источнике – Солнечный (61–64°С/5.8) – половина сообщества состоит из некультивируемых бактерий (Menzel et al., 2015). Что касается архей, то в кислых источниках велика доля представителей Terrestrial Hot Spring Group (THSG) (Merkel et al., 2017) и Hot Thaumarchaeota-related Clade (HTC) (Eme et al., 2013; Mardanov et al., 2018). В источниках с рН от 3 до 6 и температурой до 65°С детектируется большое количество некультивируемых представителей Thermoplasmatales (группа А10) (Merkel et al., 2017; Golyshina et al., 2019; Wilkins et al., 2019) и Crenarchaeota (Меркель и соавт., 2016). С повышением температуры выше 70°С резко возрастает доля представителей суперфилума DPANN, являющихся симбионтами различных гипертермофильных архей и составляющих порой до 50% от всего сообщества (Chernyh et al., 2015; Merkel et al., 2017). В горячих источниках с околонейтральным рН часто обнаруживаются представители филума Korarchaeota (Reigstad et al., 2010; Wilkins et al., 2019). Роль большинства вышеперечисленных некультивируемых архей в микробных сообществах гидротерм остается малоизученной.
Как мы видим, многие из широко представленных в горячих источниках Камчатки таксонов некультивируемых микроорганизмов относятся к археям. Благодаря развитию молекулярно-экологических методов, к сегодняшнему дню стало понятно, что археи составляют значительную часть суммарной микробной биомассы Земли и играют большую роль в глобальных циклах химических элементов и, в первую очередь, в местообитаниях с умеренными физико-химическими параметрами (Karner et al., 2001; Fry et al., 2008; Adam et al., 2017). Несмотря на это, археи до сих пор ассоциируются с экстремальными экотопами. Это связано с тем, что подавляющее большинство культивируемых архей является экстремофилами. В этой связи важно оценить соотношение архей и бактерий в горячих источниках, исходя из всех имеющихся на сегодняшнее время данных. Сравнительный анализ соотношения количества обнаруженных молекулярными методами бактерий и архей в камчатских горячих источниках в зависимости от температуры не выявил тенденции превалирования архей с увеличением температуры (рис. 3а). При этом археи доминируют в гидротермах с низкими значениями рН (3–4) (рис. 3б), а в источниках с рН выше 4, напротив, как правило, преобладают бактерии (рис. 3б). Однако есть и исключения: в диапазоне рН от 5 до 6 также встречаются источники, где археи составляют внушительную долю, вплоть до 50–97% (Меркель и соавт., 2016; Merkel et al., 2017; Mardanov et al., 2018; наши неопубликованные данные).
Рис. 3.
Соотношение бактерий и архей в микробных сообществах горячих источников на Камчатке в зависимости от температуры (а) и pH (б). Значения на шкале отражают процент представленности домена в микробном сообществе. Данные были взяты из следующих источников (Mardanov et al., 2011; Rozanov et al., 2014; Добрецов и соавт., 2015; Меркель и соавт., 2016; Merkel et al., 2017; Mardanov et al., 2018; наши неопубликованные данные).

Таким образом, в горячих источниках Камчатки развивается сообщество в основном хемотрофных термофильных прокариот, среди которых главную роль играют микроорганизмы цикла серы и водорода. Развитие методов секвенирования позволило выявить доминирующих прокариот, некоторые из них были успешно выделены в чистые культуры и охарактеризованы. Тем не менее, наибольшая часть сообщества, и прежде всего, архейная составляющая, по-прежнему остается некультивируемой и малоизученной.
Горячие источники Курильских островов
Курильские острова – это цепь островов с высокой сейсмической активностью и большим количеством действующих вулканов и горячих источников (рис. 1в, 4а). Самый южный остров архипелага – о. Кунашир – является наиболее изученным с геологической и микробиологической точек зрения. Проявления гидротермальной активности на острове Кунашир сосредоточены, в основном, на юге – в кальдере вулкана Головнина и около вулкана Менделеева. Помимо них на Охотском побережье острова имеются еще две группы источников: южная, расположенная под сольфатарным полем на Внешнем куполе, и северная – вблизи поселка Алехино (Зотов и соавт., 1988). В участках проявления активной сольфатарной деятельности воды термальных источников характеризуются низкими значениями рН; разгружающиеся за пределами этих участков термальные воды, как правило, нейтральные или слабощелочные. Присутствие нейтральных источников на сольфатарных полях и близкое соседство их с кислыми источниками характерно для кальдеры Головнина. По анионному составу оба типа вод сульфатно-хлоридные (Зотов и соавт., 1988). В районе вулкана Менделеева располагаются Третьяковские, Валентиновские и Столбовские горячие источники.
Так же как и на Камчатке, в горячих источниках Кунашира соединения серы максимально широко вовлечены в метаболизм микробных сообществ. Основное отличие курильских гидротерм от камчатских состоит в том, что на Курильских островах довольно большая часть источников проявляется в приливно-отливной зоне и на мелководных участках побережья. С использованием радиоизотопных методов удалось показать, что на литорали в мелководных гидротермах бухты Кратерной скорость сероредукции опережает другие процессы (например, скорость автотрофного метаногенеза, сульфатредукции) на один–два порядка и является основным терминальным восстановительным процессом, в отличие от глубоководных источников, где скорость сероредукции на порядок ниже скорости других процессов (Бонч-Осмоловская и соавт., 1993). Одними из первых термофилов, выделенных из кунаширских источников, были сероредуцирующие гипертермофильные гетеротрофные археи – Desulfurococcus amylolyticus (Бонч-Осмоловская и соавт., 1988), Thermococcus stetteri (Miroshnichenko et al., 1989) и T. litoralis (Светличный и соавт., 1987) (табл. 3). D. amylolyticus был выделен из наземной гидротермы, однако молекулярно-экологические исследования показали присутствие представителей Desulfurococcus и в морских мелководных гидротермах Кунашира, что ранее считалось нехарактерным местообитанием для этого рода (Перевалова и соавт., 2003).
Таблица 3.
Термофильные прокариоты, выделенные из природных горячих источников Курильских островов
| Филум | Название | Субстрат | Акцептор ${{\bar {e}}}$ | Опт. Т°С/рН | Ссылка |
|---|---|---|---|---|---|
| Бактерии | |||||
| Bacteroidota | Tenuifilum thalassicum | Полисахариды, сахара, белковые соединения | Без акцептора | 50/6.5–7.0 | Podosokorskaya et al., 2020 |
| Calditrichota | Calorithrix insularis | Полисахариды, сахара, белковые соединения | ${\text{NO}}_{3}^{ - }$, без акцептора | 55/6.6 | Kompantseva et al., 2017 |
| Firmicutes | Bacillus acidocaldarius | Дрожжевой экстракт и простые сахара | O2 | 65–70/3.5–4.0 | Логинова и соавт., 1978 |
| Carboxydothermus hydrogenoformans | СО, органические кислоты, глицерин, H2/CO2 | Н2О, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, ${\text{SO}}_{4}^{{2 - }}$, S0, ${\text{NO}}_{3}^{ - }$, фумарат | 70–72/6.8–7.0 | Svetlichny et al., 1991b | |
| Thermincola ferriacetica | СО, органические кислоты, белковые соединения, гликоген, Н2/СО2 | Окись железа, MnO2, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$ | 60/7.0 | Zavarzina et al., 2007 | |
| Thermodesulfitimonas autotrophica | H2/СО2 | ${\text{SO}}_{3}^{{2 - }}$, SO2 | 65/6.0–6.5 | Slobodkina et al., 2017 | |
| Planctomycetes | Thermogutta terrifontis | Сахара, полисахариды | O2, ${\text{NO}}_{3}^{ - }$, ${\text{NO}}_{2}^{ - }$, без акцептора | 55–60/6.0–6.5 | Slobodkina et al., 2015b |
| Proteobacteria | Inmirania thermothiophila | S0, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$/СО2, органические кислоты, белковые соединения | ${\text{NO}}_{3}^{ - }$ | 65/6.5 | Slobodkina et al., 2016a |
| Dissulfurirhabdus thermomarina | H2/СО2 | ${\text{SO}}_{3}^{{2 - }}$, SO2 | 50/6.0–6.5 | Slobodkina et al., 2016b | |
| Thermodesulfobacteria | Thermosulfurimonas marina | S0, SO3, ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$/СО2 | ${\text{NO}}_{3}^{ - }$ | 74/6.7–7.0 | Фролова и соавт., 2018 |
| Thermotogota | Fervidobacterium riparium | Полисахариды, сахара, белковые субстраты | Без акцептора | 65/7.8 | Podosokorskaya et al., 2011 |
| Археи | |||||
| Crenarchaeota | Acidilobus aceticus | Крахмал, сахара, белковые соединения | S0, без акцептора | 85/3.5 | Prokofeva et al., 2005 |
| Desulfurococcus amyloliticus | Пептиды, полисахариды | S0, без акцептора | 90/6.4 | Бонч-Осмоловская и соавт., 1988 | |
| Euryarchaeota | Thermococcus litoralis, T. stetteri, Thermococcus sp. | Пептиды, аминокислоты, полисахариды | S0, без акцептора | 75–85/6.5 | Светличный и соавт., 1987; Miroshnichenko et al., 1989; Gavrilov et al., 2016 |
Помимо процессов сероредукции, в мелководных источниках бухты Кратерной радиоизотопными методами были исследованы процессы анаэробной деструкции и ассимиляции органического углерода. Было показано, что деструкция органического вещества в таких источниках характеризуется высокой скоростью и завершается метаногенезом, сульфат- или сероредукцией (Намсараев и соавт., 1994). С помощью классических микробиологических подходов из наземных и морских гидротерм Кунашира удалось выделить большое количество микроорганизмов-деструкторов (табл. 3), зачастую представителей новых таксонов: Fervidobacterium riparium (Podosokorskaya et al., 2011), Thermogutta terrifontis (Slobodkina et al., 2015b), Calorithrix insularis (Kompantseva et al., 2017), Tenuifilum thalassicum (Podosokorskaya et al., 2020). В гетеротрофных накопительных культурах, полученных при посеве образцов из термальных источников Кунашира, было показано присутствие представителей глубокой ветви архей, принадлежащих суперфилуму DPANN – ‘Ca. Micrarchaeota’ (Golyshina et al., 2019), а также потенциальных хозяев этих микроорганизмов – представителей рода Cuniculiplasma, и других архей порядка Thermoplasmatales.
Для высокотемпературных прибрежных гидротерм Кунашира отмечены незначительные скорости фиксации углекислоты в биомассу и метан, что объясняется наличием большого количества доступной органики, привносимой из низкотемпературных зон (Намсараев и соавт., 1994). Тем не менее, из курильских источников, как морских, так и наземных, был успешно выделен ряд хемолитоавтотрофных термофильных бактерий (табл. 3). Большинство из них используют различные соединения серы в качестве донора (элементная сера, тиосульфат) или акцептора электронов (сульфит, сернистый газ) и представляют новые таксоны внутри филумов Proteobacteria, например, Inmirania thermothiophila, Dissulfurirhabdus thermomarina (Slobodkina et al., 2016a, 2016b), и Firmicutes – Thermodesulfitimonas autotrophica (Slobodkina et al., 2017). Также из горячих источников о. Кунашир были выделены и описаны термофильные факультативные хемолитоавтотрофные бактерии, не связанные с циклом серы. Так, микробиологическими методами в морских и наземных гидротермах было показано широкое распространение термофильных анаэробных карбоксидотрофов (Svetlichny et al., 1991a). В чистые культуры были выделены представители филума Firmicutes, способные окислять СО с образованием водорода из воды – Carboxydothermus h-ydrogenoformans (Svetlichny et al., 1991b), или восстанавливая оксид Fe3+ – Thermincola ferriacetica (Zavarzina et al., 2007). В термальных источниках Кунашира, включая источники с температурой более 74°С, молекулярными и изотопными методами было показано присутствие метанотрофных бактерий. Помимо представителей аэробных родов Methylocystis и Methylothermus, были выявлены ранее неизвестные метанотрофы глубоких ветвей Gammaproteobacteria (Kizilova et al., 2014).
Представленные данные говорят о том, что, в целом, будучи похожими на гидротермы Камчатки (например, высоким содержанием разнообразных соединений серы), горячие источники Курильских островов обладают не меньшим, а возможно, и большим многообразием физико-химических параметров (за счет морской воды прибрежных гидротерм). Это определяет широчайшее разнообразие населяющих их микробных сообществ и вариативность метаболизма последних. В этой связи можно ожидать, что их дальнейшее всестороннее исследование с использованием разнообразных подходов, как включающих, так и минующих стадию культивирования, может дать интересные результаты.
ГОРЯЧИЕ ИСТОЧНИКИ БАЙКАЛЬСКОЙ РИФТОВОЙ ЗОНЫ
Байкальская рифтовая зона – глубинный разлом земной коры, простирающийся в северо-восточном направлении от Монголии до Восточных Саян с центром под озером Байкал (рис. 1б). Вся рифтовая система высокосейсмична, земная кора на всем протяжении утончена (Логачев, 2003). Этим объясняется высокая гидротермальная активность в регионе и большое количество термальных источников, включая высокотемпературные (до 90°С). Гидротермы Байкальской рифтовой зоны (рис. 4б) относятся к типу азотных термальных источников, формирующихся за счет инфильтрационных вод, проникающих на значительные глубины. Вследствие этого термальный флюид характеризуется отрицательными значениями Eh и высоким pH (до 10). В газовом составе байкальских гидротерм доминирует азот (до 95%), также обнаруживается метан и сероводород (Борисенко, Замана, 1978). По химическому составу высокотемпературные гидротермы Байкальского рифта делятся на четыре типа: горячинский, аллинский, кульдурский и питателевский. К горячинскому типу относятся сульфатно-натриевые источники, расположенные по горным хребтам (Нилова Пустынь, Гусиха, Гарга и др.) и на побережье о. Байкал (Горячинск, Хакуссы, Давша) с рН до 8.4. Источники Алла, Уро, бассейна реки Баргузин и ряда других рек относятся к аллинскому типу и характеризуются широким диапазоном концентрации сульфатов и гидрокарбонатов и рН 7–8. Источники, расположенные в северо-восточной части рифтовой системы, относятся к кульдурскому фторидно-гидрокарбонатно-натриевому типу с относительно высоким содержанием сероводорода биогенного происхождения (источники Котельниковский, Кучигер, Умхей, Большереченский и др.) и температурами до 75°С. Питателевские источники выделены в отдельный тип азотно-кремнистых хлоридно-сульфатных и хлоридно-карбонатных терм (см. ссылки Намсараев, 2008).
Рис. 4.
Горячие источники: а – Курильских островов; б – в районе озера Байкал; в – Чукотки; г – Северного Кавказа (Северной Осетии).

В отличие от камчатских горячих источников, основными первичными продуцентами в исследованных гидротермах Байкала являются цианобактерии. В микробных матах, а также в воде, покрывающей маты, начиная от 70°С и ниже, термофильные цианобактерии представлены, в основном, родами Leptolyngbya, Synechococcus и Nostoc, которые составляют до 70% от всего сообщества. В Уринском термальном источнике, характеризующемся отсутствием растворенного сероводорода, доминирующими были цианобактерии рода Phormidium, численность которых составляла более 90% в верхних слоях матов, и рода Mastigocladus, доминировавших в нижних слоях (Брянская и соавт., 2006). В то же время в Большереченском горячем источнике доминировали исключительно цианобактерии рода Phormidium, а Mastigocladus не встречался, что, судя по всему, обусловлено высоким содержанием сульфида (13.4 мг/л). Радиоизотопными методами было показано, что скорость фотосинтеза, как и в камчатских фототрофных сообществах, постепенно возрастает с понижением температуры, при этом аноксигенный фотосинтез с понижением температуры сменяется на оксигенный, что является следствием повышения доли цианобактерий в сообществах (Намсараев и соавт., 2003). За аноксигенный фотосинтез здесь (также как и на Камчатке) отвечают несерные фототрофные нитчатые бактерии родов Chloroflexus и/или Roseoflexus (Брянская и соавт., 2006; Калашников и соавт., 2014; Gaisin et al., 2015; Roza-nov et al., 2017а; Будагаева и соавт., 2021).
В горячем источнике Алла наряду с представителями Chloroflexi и Proteobacteria в микробных матах молекулярными методами было показано, что значительную долю сообщества составляют некультивируемые бактерии ‘Ca. Atribacteria’ (15–30% от всего сообщества) и бактерии класса Nitrospirae (Будагаева и соавт., 2021). Представители последнего были обнаружены впервые в горячих источниках Гарги (Lebedeva et al., 2005), а позднее из образцов Горячинского источника был получен микробный консорциум, где доминировала ‘Nitrospira calida’ (Lebedeva et al., 2011).
В осадках горячего источника Аллa, расположенных под фототрофными матами, основную часть сообщества (до 60%) составляют некультивируемые бактерии ‘Ca. Acetothermia’ (Будагаева и соавт., 2021). Представители этой глубокой линии бактерий обнаруживаются не только в осадках горячих источников (Hedlund et al., 2015), но и в подземных микробных матах и нефтяных ме-сторождениях со сходными температурами (Takami et al., 2012; Hu et al., 2016), а также мезофильных осадках морей, соленых озер и анаэробных биореакторов (Hao et al., 2018). Однако представленность этой группы в вышеуказанных сообществах всегда была невысокая. В горячем источнике Байкальской рифтовой зоны, таким образом, была обнаружена на сегодняшний момент самая высокая численность представителей ‘Ca. Acetothermia’, что указывает на важную роль этих бактерий в сообществе.
Вместе с тем, несмотря на доминирование в микробных сообществах байкальских источников бактерий глубоких филогенетических линий, опубликованные чистые культуры (табл. 4) относятся к достаточно хорошо изученным филумам Firmucutes, Deinococcus-Thermus и Proteobacteria (Храпцова и соавт., 1984; Nazina et al., 2004; Kublanov et al., 2009; Бабасанова и соавт., 2013; Rozanov et al., 2017b; Jung et al., 2018). Среди бактерий-деструкторов только представители филума Planctomycetes, выделенные из горячих источников Умхей и поселка Горячинск, оказались филогенетически далекими от уже известных представителей, что позволило описать новый порядок Tepidisphaerales (Kovaleva et al., 2015).
Таблица 4.
Термофильные прокариоты, выделенные из горячих источников других регионов
| Филум | Название | Субстрат | Акцептор ${{\bar {e}}}$ | Опт. Т°С/рН | Ссылка |
|---|---|---|---|---|---|
| Термофильные прокариоты, выделенные из горячих источников Байкальского региона | |||||
| Chloroflexi | Chloroflexus aurantiacus | Ацетат, NB/R2A – medium* | ${{{\text{S}}}_{2}}{\text{O}}_{3}^{{2 - }}$, O2 | 50–55/8.0–8.5 | Намсараев и соавт., 2003., Jung et al., 2018 |
| Deinococcus–Thermus | Meiothermus ruber, Meiothermus sp.** |
Дрожжевой экстракт | O2 | 60–65/7.5–8.0, 70–75/7.5–8.0 | Храпцова и соавт., 1984; Jung et al., 2018 |
| Thermus sp.** | NB/R2A – medium* | O2 | 55 | Jung et al., 2018 | |
| Nitrospirae | ‘Nitrospira calida’ | ${\text{NO}}_{2}^{ - }$ | O2 | 46–52/7.8 | Lebedeva et al., 2011 |
| Proteobacteria | Azoarcus sp.**, Caldimonas manganoxidans, Curvibacter fontanus, Dechloromonas agitate, Petrobacter succinatimandens, Tepidicella xavieri, Tepidimonas sp.**, Silanimonas lenta, Thermomonas hydrothermalis | NB/R2A – medium* | O2 | 55 | Jung et al., 2018 |
| Firmicutes | Aneurinibacillus sp.**, Brevibacillus sp.**, Paenibacillus sp.** | NB/R2A – medium* | O2 | 55 | Jung et al., 2018 |
| Anoxybacillus sp.** | NB/R2A – medium* | O2 | 45–55 | Бабасанова и соавт., 2013; Jung et al., 2018 | |
| Bacillus sp.** | NB/R2A – medium* | O2 | 45–55/8.5–9.0 | Бабасанова и соавт., 2013; Jung et al., 2018 | |
| Geobacillus sp.** | NB/R2A – medium* | O2 | 55 | Jung et al., 2018 | |
| Geobacillus gargiensis | Сахара, оргкислоты, углеводороды | O2 | 60–65/7.0–8.5 | Nazina et al., 2004 | |
| Thermoactinomyces vulgaris | Аминокислоты, дрожжевой экстракт | O2 | 50–60 | Rozanov et al., 2017b | |
| Thermincola carboxydiphila | CO | H2O | 55/8.0 | Sokolova et al., 2005 | |
| Thermoanaerobacter sp. | Кератины | Без акцептора | 60/9.3 | Kublanov et al., 2009 | |
| Tepidimicrobium ferriphilum | Белковые соединения, аминокислоты | Fe3+ | 50/7.5–8.0 | Slobodkin et al., 2006 | |
| Planctomycetes | Tepidisphaera mucosa | Сахара, полисахариды | О2, без акцептора | 47–50/7.0–7.5 | Kovaleva et al., 2015 |
| Thaumarchaeota | ‘Ca. Nitrosophaera gargensis’ | ${\text{NH}}_{4}^{ + }$ | O2 | 46 | Hatzenpichler et al., 2008 |
| Термофильные прокариоты, выделенные из горячих источников Чукотки | |||||
| Chloroflexi | Tepidiforma bonchosmolovskayae | Полисахариды, органические кислоты, белковые соединения, лигнин, FeCO3/CO2 | O2 | 50–54/7.2 | Kochetkova et al., 2020c |
| Proteobacteria | Arenimonas fontis | Полисахариды, кератины, белковые соединения | О2 | 50/7.5 | Zayulina et al., 2020а |
| Термофильные прокариоты, выделенные из горячих источников острова Сахалин | |||||
| Firmicutes | Bacillus acidocaldarius | Сахара, белковые соединения | О2 | 65/3.3–4.0 | Логинова и соавт., 1978 |
| Calorimonas adulescens | Метаксилированные ароматические соединения, углеводы, пептиды | Без акцептора | 60/5.5–6.0 | Khomyakova et al., 2020 | |
| Термофильные прокариоты, выделенные из горячих источников Северного Кавказа | |||||
| Nitrospirae | ‘Ca. Nitrospira inopinata’ | ${\text{NH}}_{4}^{ + }$/CO2 | O2 | 46/7.8 | Daims et al., 2015 |
Важной и активно исследуемой группой бактерий, обитающих в источниках Байкальского рифта, являются метанотрофы. Активное окисление метана было показано радиоизотопным методом в образцах донных отложений байкальских гидротерм с температурами на изливе 48–55°С (Цыренжапова и соавт., 2007). Более того, из этих экотопов удалось выделить первого термотолерантного представителя рода Methylocystis sp. (Троценко и соавт., 2009). В последующих работах методами молекулярной экологии было показано широкое распространение и активность метанотрофов в сообществах, развивающихся в прибрежных гидротермах оз. Байкал (Зеленкина и соавт., 2009). Анализ фрагмента гена pmoA показал, что при температурах 45–51°С, наблюдаемых в этих источниках, отмечается преобладание метанотрофов II типа, а именно представителей родов Methylocystis и Methylosinus, и только в одной накопительной культуре был обнаружен метанотроф I типа, имеющий не более 80% сходства по гену pmoA с Methylococcus capsulatus, однако в чистые культуры выделить данных представителей не удалось. Так же как на Камчатке и на Курилах, в байкальских гидротермах обитают анаэробные гидрогеногенные СО-трофы (Sokolova et al., 2005).
Археи обнаруживаются в байкальских щелочных источниках при температурах ≥70–75°С, иногда составляя значимые доли сообщества (до 20%) (Perevalova et al., 2008; Rozanov et al., 2017а). Среди культивируемых архей наиболее многочисленные относятся или близки к кренархейным родам Thermoproteus, Vulcanisaeta, а также другим гетеротрофным родам порядка Thermoproteales, обычно встречающихся в кислых горячих источниках (Rozanov et al., 2017а). При более низких температурах была получена одна накопительная культура архей – ‘Ca. Nitrososphaera gargensis’, принадлежащая филуму Thaumarchaeota (Hatzenpichler et al., 2008). Эта архея является умеренно термофильным организмом и способна к окислению аммония, а образованный ей нитрит окисляют до нитрата бактерии рода Nitrospira, о которых речь шла выше (Lebedeva et al., 2011).
Отдельно нужно сказать о горячих источниках Восточно-Тувинского нагорья, которые относятся к Байкальской рифтовой зоне, однако географически сильно удалены от вышеописанных источников района озера Байкал. В самом большом разломе нагорья находятся Уш-Бельдирские горячие источники азот-кремнистого типа (Пиннекер, 1968). Для этих источников характерны умеренно высокие температуры (около 55°С), низкая минерализация и высокая щелочность (рН около 9.8). Источник “Дикий аржаан” с температурой и рН воды 56°С и 9.2 соответственно, является пока единственным, где проводились исследования микробных сообществ (Корженков и соавт., 2018). Профилирование образцов микробных матов с применением высокопроизводительного секвенирования ампликонов участка V4 гена 16S рРНК показало, что в сообществе доминируют (20–30%) представители некультивируемого филума ‘Ca. Acetothermia’, что также было показано для одной из Байкальских гидротерм (см. выше). Эти бактерии, скорее всего, являются анаэробными факультативными хемолитоавтотрофами (Takami et al., 2012), и, таким образом, играют роль первичных продуцентов. Кроме того, существенную часть микробного сообщества составили бактерии семейства Thermodesulfovibrionaceae (филум Nitrospirae, до 18%), фототрофные бактерии Roseoflexus и некультивируемые хемогетеротрофные бактерии класса Anaerolinea (последние два относятся к филуму Chloroflexi, составляя в сумме 25–33% сообщества). Археи в тувинском источнике составляют не более 6% и представлены некультивируемыми Crenarchaeota.
Таким образом, в микробных сообществах горячих источников Байкальской рифтовой зоны, в основном, доминируют процессы фотосинтеза, где первичную роль играют термофильные цианобактерии и представители филума Chloroflexi. Хемотрофы представлены либо гетеротрофными бактериями, некоторые из которых выделены в чистые культуры, либо прокариотами с предположительно автотрофным типом метаболизма и в большинстве своем некультивируемыми. Микробные сообщества горячих источников Байкальской рифтовой зоны, в общих чертах, сходны между собой, а также с микробиомами горячих источников соседних регионов Китая и Индии (Lau et al., 2009; Panda et al., 2016).
ГОРЯЧИЕ ИСТОЧНИКИ ДРУГИХ РЕГИОНОВ
Горячие источники Чукотки
Горячие источники полуострова Чукотка расположены в Арктическом регионе, где повсеместно распространена криолитозона. Несмотря на то, что на Чукотке нет проявлений современного вулканизма, на полуострове, особенно в северо-восточной его части (рис. 1в), обнаружено большое количество горячих источников с температурой воды вплоть до 94–97°С (Polyak et al., 2013; Kochetkova et al., 2020b). Источники на Чукотке относятся к хлоридно-карбонатному типу с малым содержанием сульфатов и различной минерализацией. Основные выделяющиеся газы – это азот и углекислота, в следовых количествах обнаруживают водород, метан и СО. Значения рН в источниках соответствуют околонейтральным или слабощелочным условиям, что отражает невулканическую природу формирования гидротермальных выходов (Polyak et al., 2013). Горячие источники Чукотки, по нашим данным, являются самыми высокотемпературными источниками, разгружающимися в зоне вечной мерзлоты, а также самыми северными горячими источниками РФ (Kochetkova et al., 2020b).
Первое исследование микробных сообществ гидротерм Чукотки, а именно Мечигменских, Сенявинских и Чаплинских, было проведено совсем недавно (Kochetkova et al., 2020b). Молекулярными методами было показано, что доминируют там термофильные аэробные или факультативно анаэробные бактерии. Археи обнаружены в минорных количествах (не более 7% от сообщества) и представлены, в основном, некультивируемыми филумами, такими как Bathyarchaeota, Aigarchaeota и Thaumarchaeta. В микробных матах, обильно развивающихся в горячих ручьях и источниках с температурой ниже 75°С, доминирующим таксоном являются фототрофные несерные бактерии рода Chloroflexus, составляя порой до 80% от всего сообщества. В более высокотемпературных источниках большую часть сообщества составляют микроаэрофильные хемолитоавтотрофные бактерии филума Aquificae. В горячих ручьях они образуют бело-серые хорошо видимые обрастания (но не такие обильные, как на Камчатке) и представлены, в основном, родами Sulfurihydrogenibium и Hydrogenobacter, которые составляют от 70 до 92% от всего сообщества. В осадках горячих источников доля Aquificae меньше, но тоже значительна – от 15 до 50%. Донором электронов для столь обильного развития Aquificae на Чукотке, где отсутствуют растворимые восстановленные соединения серы, может служить либо пирит, либо восстановленное железо, обнаруженное в большом количестве в воде и осадках термальных источников (рис. 4в). Помимо факультативно автотрофных Aquificae в осадках были обнаружены представители различных филумов бактерий, таких как Deinococcus-Thermus, Dictyoglomi, Thermotogae, Armatimonadetes и Proteo-bacteria.
Помимо филумов и классов, для которых известны культивируемые представители, в источниках Чукотки было выявлено много бактерий глубоких некультивируемых линий. Представителя одной из них, группы OLB14, уровня нового класса внутри Chloroflexi, удалось выделить в чистую культуру и описать ее свойства (табл. 4). Tepidiforma bonchosmolovskayae является умеренным термофилом, аэробом, способным расти на разнообразных органических субстратах (от ацетата до лигнина), а также автотрофно на сидерите (FeCO3), окисляя его до магнетита (Kochetkova et al., 2020c). Последнее свойство укрепило гипотезу о том, что обильно развивающиеся литоавтотрофные бактерии в горячих источниках Чукотки могут использовать для роста энергию окислительно-восстановительных реакций с участием железа, входящего в состав минералов (Kochetkova et al., 2020b). Также из источника на Чукотке был выделен первый термофильный представитель рода Arenimonas (A. fontis, филум Proteobacteria), ранее обнаруживаемый исключительно в мезофильных экосистемах (Zayulina et al., 2020а).
Таким образом, в горячих источниках Чукотки, несмотря на невулканическое происхождение, доминирующими таксонами, так же как и в вулканических гидротермах по всему миру (см. раздел “Горячие источники Курило-Камчатского региона”), являются представители факультативных литоавтотрофных бактерий филума Aquificae. Вместе с факультативными фотоавтотрофными бактериями рода Chloroflexus они практически полностью вытесняют других фототрофов, в первую очередь цианобактерий, из этих арктических гидротерм. Самое заметное отличие микробного разнообразия этих источников от регионов с активной вулканической деятельностью – это полное отсутствие архей филумов Crenarchaeota и Euryarchaeota.
Горячие источники о. Сахалин
Термальные источники острова Сахалин, в основном, относятся к типу минерализованных (до 8 г/л), слабощелочных (рН 7.4–8.5) с хлоридно-натриевыми водами и невысокими температурами, в редких случаях достигающих 53–55°С (Жарков, 2018). Это объясняется тем, что Сахалин, несмотря на близость к Курильским островам, не является частью вулканического пояса Тихоокеанского Огненного Кольца, а входит в состав Сахалино-Японской островной дуги. Основной компонент выделяющихся газов сахалинских гидротерм – метан (до 93%), преимущественно глубинного происхождения. Гидротермальные проявления о. Сахалин сосредоточены в нефтегазоносной зоне, где обнаружены все нефтегазовые месторождения острова (Сырбу, Шакиров, 2012).
Микробное разнообразие Сахалинских гидротерм крайне слабо изучено. На сегодняшний момент из этих мест выделено несколько термофильных гетеротрофных бактерий, относящихся к филуму Firmicutes (табл. 4).
Горячие источники Северного Кавказа
Кавказ расположен в пределах Альпийско-Гималайского подвижного пояса с активными новейшими тектоническими движениями и характеризуется разнообразием гидротермальных проявлений. На территории Северного Кавказа, куда входит Большой Кавказский хребет и Предкавказье, находится огромное количество термоминеральных источников различного химического состава (хлоридно-натриевые, хлоридно-кальциевые, гидрокарбонатно-сульфатно-натриевые, сульфидные и др.), степени минерализации (от 0.5 до 100 г/л), рН (от 6 до 9) и температуры (Курбанов, 2001). Большая часть источников относится либо к умеренно теплым, в которых температура воды не превышает 45°С, либо имеет вид скважин, где на выходе вода может достигать уровня точки кипения (например, в Кизляре, Краснодарском крае и др.). Однако есть и истинно горячие природные источники с температурами вод выше 50–60°С, например, на территории Адыгеи, Северной Осетии, Дагестана, Чечни и Ставропольского края (рис. 1а). Северо-Кавказские гидротермы используются в бальнеологических целях еще с XVIII века, а источники района Кавказских Минеральных Вод и Краснодарского края уже более ста лет являются известными курортами страны. Однако, несмотря на многолетнюю историю использования и разнообразие физико-химических параметров, микробный состав гидротермальных источников этого региона практически не изучен. Большинство проведенных исследований было сосредоточено на умеренно-теплых источниках и обитающих там сообществах фототрофных или сероокисляющих мезофильных или термотолерантных бактерий (Черноусова и соавт., 2008; Горленко и соавт., 2019). В немногочисленных работах, посвященных микробному разнообразию истинно горячих источников Северного Кавказа, применяемые методы не позволили провести оценку термофильных микробных сообществ, населяющих эти источники (Халилова и соавт., 2017; Богомаз и соавт., 2019).
Единственным описанным термофильным микроорганизмом, выделенным из Северо-Кавказского региона, является уникальный представитель рода Nitrospira – ‘Ca. Nitrospira inopinata’ (Daims et al., 2015). Это первая работа, в которой была доказана возможность процесса полной нитрификации одним микроорганизмом, т.н. “comammox” (complete ammonia oxidizer), что перевернуло представления о функционировании цикла азота и роли в нем представителей широко распространенного рода Nitrospira.
Несмотря на слабую изученность микробного разнообразия кавказских источников, есть основания надеяться, что в ближайшем будущем эта ситуация изменится к лучшему. Так, в 2020 году НИЦ Курчатовский институт, ФИЦ Биотехнологии РАН и Северо-Осетинский государственный университет им. К.Л. Хетагурова провели совместную экспедицию в район североосетинских горячих источников (Урсдон, Кармадон, Бирагзанг и др.) (рис. 4г), по результатам которой было выделено более 30 штаммов термофильных и термотолерантных бактерий (аэробных и анаэробных, гетеро- и автотрофных), часть из которых оказалась представителями новых таксонов внутри филумов Bacteroidetes, Proteobacteria, Planctomycetes, Ignavibacteriae, Acidobacteria и Verrucomicrobia (наши неопубликованные данные).
ЗАКЛЮЧЕНИЕ
В данном обзоре мы подробно рассмотрели микробные сообщества природных горячих источников, расположенных на территории Российской Федерации, как наземных, так и находящихся в прибрежной зоне. Однако есть еще одна природная термальная экосистема глобального масштаба, о которой нельзя не упомянуть. Подземная биосфера, составляющая значительную часть от общей биомассы Земли (по некоторым оценкам, десятки процентов), также населена многочисленными термофильными и гипертермофильными прокариотами (Stetter et al., 1993; Magnabosco et al., 2018). Скважины, пробуренные на большие глубины, можно рассматривать как “окна”, позволяющие заглянуть в подземный мир. Помимо скважин исследовать микробные сообщества подземной биосферы позволяют нефтяные месторождения, подземные газохранилища, шахты глубокого залегания и др. К настоящему времени в подземных местообитаниях детектированы почти все известные филумы бактерий и архей. Подземная биосфера на территории России достаточно активно исследуется, однако в задачи данного обзора не входило рассмотрение микробных сообществ этой экосистемы. Ознакомиться с результатами этих работ можно в публикациях (Назина и соавт., 2013; Podosokorskaya et al., 2013; Слободкин, Слободкина, 2014; Karnachuk et al., 2019 и др.).
Разнообразие физико-химических условий горячих источников обусловливает вариативность окислительно-восстановительных реакций, которые используются термофильными прокариотами для получения энергии. Это, в свою очередь, определяет высокое разнообразие микроорганизмов, обитающих в горячих источниках. Особую роль среди них занимают хемолитотрофные прокариоты, окисляющие компоненты глубинных эманаций, поступающих на поверхность за счет геотермальной активности. Именно поэтому микробные сообщества таких систем называют “тропическими дождевыми лесами” микробного мира (Des Marais, Walter, 2019). В ходе многолетних исследований термофильных микробных сообществ горячих источников Российской Федерации знания о разнообразии микробного мира пополнились более чем на полусотню новых таксонов, представляющих более десятка филумов (рис. 5, табл. 1–4). Среди них были представители как хорошо изученных, таких как Firmicutes, Proteobacteria и Crenarchaeota, так и малоисследованных и малочисленных филумов, например Synergistetes, Planctomycetes, Dictyoglomi, Verrucomicrobia, Calditrichota, Thaumarchaeota. Некоторые из выделенных штаммов оказались первыми культивируемыми представителями глубоких линий (например, Tepidiforma bonchosmolovskayae, Tepidisphaera mucosa, Tenuifilum thalassicum, Acidilobus aceticus, Fervidicoccus fontis). Среди выделенных штаммов можно обнаружить представителей всех основных метаболических групп, от фото/хемоавтотрофов, ассимилирующих углекислоту, до гетеротрофов, использующих как простые органические молекулы, так и сложно разлагаемые полимерные соединения. У выделенных из горячих источников России термофильных прокариот были показаны уникальные метаболические возможности, как например: новые пути ассимиляции СО2 (Mall et al., 2018; Frolov et al., 2019), термофильная железоредукция (Слободкин и соавт., 1995), полная нитрификация одним микроорганизмом (Daims et al., 2015), архейная сульфатредукция (Chernyh et al., 2020) и др. Тем не менее, чем больше мы получаем информации о разнообразии термофильных прокариот, населяющих горячие источники РФ, тем больше мы видим масштаб неизвестного, от микроорганизмов до их ферментов и метаболических путей. Это позволяет с оптимизмом смотреть в будущее: микробов и скрываемых ими тайн хватит еще не на одно поколение исследователей.
Список литературы
Бабасанова О.Б., Будагаева В.Г., Бархутова Д.Д., Намсараев Б.Б. Органотрофные бактерии гидротерм Байкальской рифтовой зоны и их функциональная роль в микробном сообществе // Вестн. Бурятского гос. ун‑та. 2013. Т. 4. С. 150–153.
Балашова В.В., Заварзин Г.А. Анаэробное восстановление окисного железа водородной бактерией // Микробиология. 1979. Т. 48. С. 773–778.
Басков Е., Суриков С. Гидротермы Земли. Л.: Недра, 1989.
Богомаз О.Д., Владимиров И.А., Павлова О.А., Богомаз Д.И. Изучение разнообразия термофильных бактерий из Псекупского месторождения термальных вод // Международный журн. прикладных и фундаментальных исследований. 2019. Т. 5. С. 1–6.
Бонч-Осмоловская Е.А., Слесарев А.И., Мирошниченко М.Л., Светличная Т.П., Алексеев В.А. Характеристика Desulfurococcus amylolyticus sp. nov. – новой экстремально-термофильной архебактерии, выделенной из гидротерм Камчатки и острова Кунашир // Микробиология. 1988. Т. 57. С. 94–102.
Бонч-Осмоловская Е.А., Мирошниченко М.Л., Пикута Е.В., Сорокин Д.Ю., Намсараев Б.Б. Бактериальная сероредукция в мелководных гидротермах Юго-Западной части Тихого океана // Микробиология. 1993. Т. 62. С. 564–573.
Бонч-Осмоловская Е.А., Мирошниченко М.Л., Черных Н.А., Кострикина Н.А., Пикута Е.В., Рэйни Ф.А. Восстановление элементной серы термофильной органотрофной бактерией и описание Thermoanaerobacter sulfurophilus sp. nov. // Микробиология. 1997. Т. 66. С. 581–587.
Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Chernykh N.A., Kostrikina N.A., Pikuta E.V., Rainey F.A. Reduction of elemental sulfur by moderately thermophilic organotrophic bacteria and the description of Thermoanaerobacter sulfurophilus sp. nov. // Microbiology (Moscow). 1997. V. 66. P. 483–489.
Бонч-Осмоловская Е.А., Мирошниченко М.Л., Слободкин А.И., Соколова Т.Г., Карпов Г.А., Кострикина Н.А., Заварзина Д.Г., Прокофьева М.И., Русанов И.И., Пименов Н.В. Биоразнообразие анаэробных литотрофных прокариот в наземных горячих источниках Камчатки // Микробиология. 1999. Т. 68. С. 398–406.
Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Slobodkin A.I., Sokolova T.G., Kostrikina N.A., Prokofeva M.I., Rusanov I.I., Pimenov N.V., Karpov G.A., Zavarzina D.G. Biodiversity of anaerobic lithotrophic prokaryotes in terrestrial hot springs of Kamchatka // Microbiology (Moscow). 1999. V. 68. P. 343–351.
Борисенко И.М., Замана Л.В. Минеральные воды Бурятской АССР. Улан-Удэ: Бурятское книгоиздательство, 1978.
Брянская А.В., Намсараев З.Б., Калашников О.М., Бархутова Д.Д., Намсараев Б.Б., Горленко В.М. Биогеохимические процессы в альгобактериальных матах щелочного термального Уринского источника // Микробиология. 2006. Т. 75. С. 702–712.
Bryanskaya A.V., Barkhutova D.D., Namsaraev B.B., Namsaraev Z.B., Gorlenko V.M., Kalashnikova O.M. Biogeochemical processes in the algal-bacterial mats of the Urinskii alkaline hot spring // Microbiology (Moscow). 2006. V. 75. P. 611–620.
Будагаева В.Г., Раднагуруева А.А., Малыгин А.В., Бархутова Д.Д. Таксономический состав микробного сообщества горячего источника Алла (Байкальская Рифтовая Зона) // Вестн. Бурятского гос. ун-та. 2021. Т. 110. С. 3–11.
Головачева Р.С. Термофильные нитрифицирующие бактерии горячих источников // Микробиология. 1976. Т. 45. С. 298–301.
Головачева Р.С., Каравайко Г.И. Sulfobacillus, новый род термофильных спорообразующих бактерий // Микробиология. 1978. Т. 47. С. 815–822.
Головачева Р.С., Вальехо-Роман К.М., Троицкий А.В. Sulfurococcus mirabilis gen. nov., sp. nov., новая термофильная архебактерия, способная окислять серу // Микробиология. 1987. Т. 56. С. 100–107.
Головачева Р.С., Голышина О.В., Каравайко Г.И., Дорофеев А.Г., Пивоварова Т.А., Черных Н.А. Новая железо-окисляющая бактерия Leptospirillum thermoferrooxidans sp. nov. // Микробиология. 1992. Т. 61. С. 1056–1065.
Горленко В.М., Бонч-Осмоловская Е.А., Компанцева Е.И., Старынин Д.А. Дифференциация сообществ микроорганизмов в связи с изменением физико-химических условий в источнике Термофильном // Микробиология. 1987. Т. 56. С. 314–322.
Горленко В.М., Бурганская Е.И., Брянцева И.А. Фототрофные сообщества высокоминерализованных мезотермальных сульфидных Берикейских источников (Дагестан) // Микробиология. 2019. Т. 88. С. 154–164.
Gorlenko V.M., Burganskaya E.I., Bryantseva I.A. Phototrophic communities of the Berikei highly mineralized mesothermal sulfide springs (Dagestan, Russia) // Microbiology (Moscow). 2019. V. 88. P. 146–155.
Дворянчикова Е.Н., Кизилова А.К., Кравченко И.К., Гальченко В.Ф. Анализ микробных сообществ термальных источников района озера Фумарольное кальдеры вулкана Узон, Камчатка // Известия Самарского научного центра РАН. 2011. Т. 13. С. 1418–1424.
Добрецов Н.Л., Лазарева Е.В., Жмодик С.М., Брянская А.В., Морозова В.В., Тикунова Н.В., Пельтек С.Е., Карпов Г.А., Таран О.П., Огородникова О.Л., Кириченко И.С., Розанов А.С., Бабкин И.В., Шуваева О.В, Чебыкин Е.П. Геологические, гидрогеохимические и микробиологические особенности нефтяной площадки кальдеры Узон (Камчатка) // Геология и геофизика. 2015. Т. 56. С. 56–88.
Dobretsov N.L., Lazareva E.V., Zhmodik S.M., Kirichenko I.S., Bryanskaya A.V., Peltek S.E., Rozanov A.S., Morozova V.V., Tikunova N.V., Babkin I.V., Karpov G.A., Taran O.P., Ogorodnikova O.L., Shuvaeva O.V., Chebykin E.P. Geological, hydrogeochemical, and microbiological characteristics of the oil site of the Uzon caldera (Kamchatka) // Russian Geol. Geophys. 2015. V. 56. P. 39–63.
Жарков Р.В. Современные физико-химические особенности термоминеральных вод Дагинского месторождения (о. Сахалин) // Науки о Земле. 2018. Т. 4. С. 35–40.
Заварзин Г.А., Карпов Г.А., Горленко В.М., Головачева Р.С., Герасименко Л.М., Бонч-Осмоловская Е.А. Кальдерные микроорганизмы. М.: Наука, 1989. 119 с.
Зеленкина Т.С., Ешинимаев Б.Ц., Дагурова О.П., Сузина Н.Е., Намсараев Б.Б., Троценко Ю.А. Аэробные метанотрофы прибрежных гидротерм озера Байкал // Микробиология. 2009. Т. 78. С. 545–551.
Zelenkina T.S., Dagurova O.P., Namsarayev B.B., Eshinimayev B.T., Suzina N.E., Trotsenko Y.A. Aerobic methanotrophs from the coastal thermal springs of Lake Baikal // Microbiology (Moscow). 2009. V. 78. P. 492–497.
Зотов А.В., Сорокин В.И., Никитина И.Б. Некоторые особенности современной гидротермальной деятельности в кальдере вулк. Головнина (о-в Кунашир) // Современные гидротермы и минералообразование. М.: Наука, 1988. С. 54–69.
Калашников А.М., Гайсин В.А., Сухачева М.В., Намсараев Б.Б., Пантелеева А.Н., Нуянзина-Болдарева Е.Н., Кузнецов Б.Б., Горленко В.М. Аноксигенные фототрофные бактерии микробных сообществ термального источника Горячинск (Прибайкалье) // Микробиология. 2014. Т. 83. С. 484–499.
Kalashnikov A.M., Nuyanzina-Boldareva E.N., Gorlenko V.M., Gaisin V.A., Sukhacheva M.V., Panteleeva A.N., Kuznetsov B.B., Namsaraev B.B. Anoxygenic phototrophic bacteria from microbial communities of Goryachinsk thermal spring (Baikal area, Russia) // Microbiology (Moscow). 2014. V. 83. P. 407–421.
Карасева А.И., Ельченинов А.Г., Перевалова А.А., Заюлина К.С., Кочеткова Т.В., Кубланов И.В. Fervidicoccus fontis 3639Fd – первая кренархеота, способная расти на липидах // Микробиология. 2021. Т. 90. С. 421–429.
Karaseva A.I., Elcheninov A.G., Perevalova A.A., Zayulina K.S., Kochetkova T.V., Kublanov I.V. Fervidicoccus fontis strain 3639FD, the first crenarchaeon capable of growth on lipids // Microbiology (Moscow). 2021. V. 90. P. 435−442.
Кейльгак К. Подземные воды. М.: ОНТИ, 1935.
Корженков А.А., Теплюк А.В., Лебединский А.В., Хващевская А.А., Копылова Ю.Г., Аракчаа К.Д., Голышин П.Н., Лунев Е.А., Голышина О.В., Кубланов И.В, Тощаков С.В., Гаврилов С.Н. Представители некультивируемого таксона ОР1 (“Acetothermia”) доминируют в микробном сообществе щелочного горячего источника Восточно-Тувинского нагорья // Микробиология. 2018. Т. 87. С. 679–694.
Korzhenkov A.A., Teplyuk A.V., Lunev E.A., Lebedinsky A.V., Kublanov I.V., Toshchakov S.V., Gavrilov S.N., Khvashchevskaya A.A., Kopylova Y.G., Arakchaa K.D., Golyshin P.N., Golyshina O.V. Members of the uncultured taxon OP1 (“Acetothermia”) predominate in the microbial community of an alkaline hot spring at East-Tuvinian upland // Microbiology (Moscow). 2018. V. 87. P. 783–795.
Крюков В., Савельева Н., Пушева М. Calderobacterium hydrogenophilum nov. gen., nov. sp., экстремально термофильная водородная бактерия и ее гидрогеназная активность // Микробиология. 1983. Т. 52. С. 781–788.
Кузнецов Б.Б. Труды Института микробиологии им. С.Н. Виноградского. 1955. С. 130.
Курбанов М.К. Геотермальные и гидроминеральные ресурсы Восточного Кавказа и Предкавказья. М.: Наука, 2001. 260 с.
Логачев Н.А. История и геодинамика Байкальского рифта // Геология и геофизика. 2003. Т. 44. С. 391–406.
Logachev N.A. History and geodynamics of the Baikal rift // Russian Geol. Geophys. 2003. V. 44. P. 353−370.
Логинова Л.Г., Храпцова Г.И., Егорова Л.А., Богданова Т.И. Ацидофильные облигатно-термофильные бактерии Bacillus acidocaldarius, выделенные из горячих источников и почвы острова Кунашир // Микробиология. 1978. Т. 47. С. 939–946.
Меркель А.Ю., Подосокорская О.А., Черных Н.А., Бонч-Осмоловская Е.А. Распространение, разнообразие и численность метаногенных архей в наземных горячих источниках Камчатки и острова Сан-Мигель // Микробиология. 2015. Т. 84. С. 485–492.
Merkel A.Y., Podosokorskaya O.A., Chernyh N.A., Bonch-Osmolovskaya E.A. Occurrence, diversity, and abundance of methanogenic archaea in terrestrial hot springs of Kamchatka and Saõ Miguel island // Microbiology (Moscow). 2015. V. 84. P. 577–583.
Меркель А.Ю., Подосокорская О.А., Соколова Т.Г., Бонч-Осмоловская Е.А. Разнообразие метаногенных архей в наземном горячем источнике 2012 (Долина Гейзеров, Камчатка) // Микробиология. 2016. Т. 85. С. 327–336.
Merkel A.Y., Podosokorskaya O.A., Sokolova T.G., Bonch-Osmolovskaya E.A. Diversity of methanogenic archaea from the 2012 terrestrial hot spring (Valley of Geysers, Kamchatka) // Microbiology (Moscow). 2016. V. 85. P. 342–349.
Назина Т.Н., Павлова Н.К., Татаркин Ю.В., Шестакова Н.М., Бабич Т.Л., Соколова Д.Ш., Ивойлов В.С., Хисаметдинов М.Р., Ибатуллин Р.Р., Турова Т.П., Беляев С.С., Иванов М.В. Микроорганизмы карбонатной нефтяной залежи 302 Ромашкинского месторождения и их биотехнологический потенциал // Микробиология. 2013. Т. 82. С. 191–202.
Nazina T.N., Pavlova N.K., Tatarkin Y.V., Shestakova N.M., Babich T.L., Sokolova D.S., Ivoilov V.S., Tourova T.P., Belyaev S.S., Ivanov M.V., Khisametdinov M.R., Ibatullin R.R. Microorganisms of the carbonate petroleum reservoir 302 of the Romashkinskoe oilfield and their biotechnological potential // Microbiology (Moscow). 2013. V. 82. P. 190–200.
Намсараев Б.Б., Бонч-Осмоловская Е.А., Мирошниченко М.Л., Пикута Е.В., Качалкин В.И., Миллер Ю.М., Пропп Л.А., Тарасов В.Г. Микробиологические процессы круговорота углерода в мелководных гидротермах Юго-Западной окраины Тихого океана // Микробиология. 1994. Т. 63. С. 100–111.
Намсараев З.Б., Горленко В.М., Намсараев Б.Б., Бурюхаев С.П., Юрков В.В. Структура и биогеохимическая активность фототрофных сообществ щелочного термального Большереченского источника // Микробиология. 2003. Т. 72. С. 228–238.
Namsaraev Z.B., Gorlenko V.M., Namsaraev B.B., Buryukhaev S.P., Yurkov V.V. The structure and biogeochemical activity of the phototrophic communities from the Bol’sherechenskii alkaline hot spring // Microbiology (Moscow). 2003. V. 72. P. 193–202.
Намсараев Б.Б., Абидуева Е.Ю., Лаврентьева Е.В. и др. Экология микроорганизмов экстремальных водных систем. Улан-Удэ: Изд-во Бурятского гос. ун-та, 2008. С. 94.
Ножевникова А.Н., Чудина В.И. Морфология термофильной ацетокластической бактерии Methanothrix thermoacetophila sp. nov. // Микробиология. 1984. Т. 33. С. 756–760.
Nozhevnikova A.N., Chudina V.I. The morphology of the thermophilic acetate methanogenic bacterium Metha-nothrix thermoacetophila n. sp. // Microbiology (Moscow). 1984. V. 33. P. 756–760.
Перевалова А.А., Лебединский А.В., Бонч-Осмоловская Е.А., Черных Н.А. Детекция гипертермофильных архей рода Desulfurococcus при помощи гибридизации с олигонеклеотидными зондами // Микробиология. 2003. Т. 72. С. 383–389.
Perevalova A.A., Lebedinsky A.V., Bonch-Osmolovskaya E.A., Chernyh N.A. Detection of hyperthermophilic archaea of the genus Desulfurococcus by hybridization with oligonucleotide probes // Microbiology (Moscow). 2003. V. 72. P. 340–346.
Пиннекер Е.В. Минеральные воды Тувы. Кызыл: Тувинское книжное издательство, 1968. 105 с.
Светличный В.А., Слесарев А.И., Светличная Т.П., Заварзин Г.А. “Caldococcus litoralis” gen. nov., sp. nov. – новая морская экстремально термофильная архебактерия, восстанавливающая элементарную серу // Микробиология. 1987. Т. 56. С. 831–838.
Светличный В.А., Светличная Т.П. Dictyoglomus turgidus sp. nov. – новая экстремально термофильная бактерия, выделенная из горячего источника кальдеры вулкана Узон // Микробиология. 1988. Т. 57. С. 435–441.
Светличный В.А., Светличная Т.П., Черных Н.А., Заварзин Г.А. Anaerocellum thermophilum gen. nov., sp. nov., экстремально термофильная целлюлозолитическая бактерия, выделенная из горячего источника Долины гейзеров // Микробиология. 1990. Т. 59. С. 871–879.
Svetlichny V.A., Svetlichnaya T.P., Chernykh N.A., Zavarzin G.A. Anaerocellum thermophilum gen. nov. sp. nov., an extreme thermophilic celluloselytic eubacterium isolated from hot springs in the Valley of Geysers // Microbiology (Moscow). 1990. V. 59. P. 871–879.
Слободкин А.И., Ерощев-Шак А.А., Кострикина Н.А., Лаврушин В.Ю., Дайняк Л.Г., Заварзин Г.А. Образование магнетита термофильными анаэробными микроорганизмами // Доклады Академии наук. 1995. Т. 345. С. 694–697.
Слободкин А.И. Термофильная микробная металлоредукция // Микробиология. 2005. Т. 74. С. 581–595.
Slobodkin A.I. Thermophilic microbial metal reduction // Microbiology (Moscow). 2005. V. 74. P. 501–514.
Слободкин А.И., Гаврилов С.Н., Слободкина Г.Б. Термофильные железовосстанавливающие прокариоты // Труды Института микробиологии имени С.Н. Виноградского. Выпуск XVI. Термофильные микроорганизмы / Ред. Гальченко В.Ф. М.: Макс Пресс, 2011. С. 36–63.
Слободкин А.И., Слободкина Г.Б. Термофильные прокариоты из глубинных подземных местообитаний // Микробиология. 2014. Т. 83. С. 255–270.
Slobodkin A.I., Slobodkina G.B. Thermophilic prokaryotes from deep subterranean habitats // Microbiology (Moscow). 2014. V. 83. P. 169–183.
Сырбу Н.С., Шакиров Р.Б. Источники природных углеводородных газов и распределение газоопасных районов на острове Сахалине // Нефтегазовое и горное дело. 2012. С. 194–197.
Троценко Ю.А., Медведкова К.А., Хмеленина В.Н. Термофильные и термотолерантные аэробные метанотрофы // Микробиология. 2009. Т. 78. С. 435–450.
Trotsenko Y.A., Medvedkova K.A., Khmelenina V.N., Eshinimayev B.T. Thermophilic and thermotolerant aerobic methanotrophs // Microbiology (Moscow). 2009. V. 78. P. 387–401.
Федотов С.А. О механизме вулканической деятельности на Камчатке, Курило-Камчатской дуге и в сходных структурах // Действующие вулканы Камчатки. М.: Наука, 1991. P. 18–35.
Фролова А.А., Слободкина Г.Б., Баслеров Р.В., Новиков А.А., Бонч-Осмоловская Е.А., Слободкин А.И. Thermosulfurimonas marina sp. nov. – автотрофная серодиспропорционирующая и нитратвосстанавливающая бактерия, выделенная из мелководной морской гидротермы // Микробиология. 2018. Т. 87. С. 366–372.
Frolova A.A., Slobodkina G.B., Bonch-Osmolovskaya E.A., Slobodkin A.I., Baslerov R.V., Novikov A.A. Thermosulfurimonas marina sp. nov., an autotrophic sulfur-disproportionating and nitrate-reducing bacterium isolated from a shallow-sea hydrothermal vent // Microbiology (Moscow). 2018. V. 87. P. 502–507.
Халилова Э.А., Аливердиева Д.А., Котенко С.Ц., Исламмагомедова Э.А., Абакарова А.А. Биоразнообразие микробных сообществ геотермальных вод и засоленных почв в регионах Прикаспийской низменности (республика Дагестан) // Известия Самарского научного центра Российской академии наук. 2017. Т. 19. С. 99–105.
Храпцова Г.И., Цаплина И.А., Серегина Л.М. Термофильные бактерии горячих источников Бурятии // Микробиология. 1984. Т. 53. С. 137–141.
Цыренжапова И.С., Ешинимаев Б.Ц., Хмеленина В.Н., Осипов Г.А., Троценко Ю.А. Новый термотолерантный аэробный метанотроф из термального источника Бурятии // Микробиология. 2007. Т. 76. С. 132–135.
Tsyrenzhapova I.S., Eshinimaev B.Ts., Khmelenina V.N., Trotsenko Yu.A., Osipov G.A. A new thermotolerant aerobic methanotroph from a thermal spring in Buryatia // Microbiology (Moscow). 2007. V. 76. P. 118–121.
Черноусова Е.Ю., Акимов В.Н., Гриднева Е.В., Дубинина Г.А., Грабович М.Ю. Филогенетический in situ/ex situ анализ микробного сообщества серного мата из термального сульфидного источника Северного Кавказа // Микробиология. 2008. Т. 77. С. 255–260.
Chernousova E.Yu., Gridneva E.V., Grabovich M.Yu., Akimov V.N., Dubinina G.A. Phylogenetic in situ/ex situ analysis of a sulfur mat microbial community from a thermal sulfide spring in the North Caucasus // Microbiology (Moscow). 2008. V. 77. P. 219–223.
Черных Н.А., Кубланов И.В., Прокофьева М.И., Пименов Н.В., Фролов Е.Н., Марданов А.В., Хващевская А.А., Гусева Н.В., Лебединский А.В., Бонч-Осмоловская Е.А. Продукция органического вещества и разнообразие генов рибулозо-бисфосфат карбоксилазы в осадках источника Солнечный, кальдера Узон, Камчатка // Микробиология. 2017. Т. 86. С. 651–654.
Chernyh N.A., Kublanov I.V., Prokof’eva M.I., Pimenov N.V., Frolov E.N., Lebedinskii A.V., Bonch-Osmolovskaya E.A., Mardanov A.V., Khvashchevskaya A.A., Guseva N.V. Production of organic matter and diversity of the ribulose bisphosphate carboxylase genes in sediments of the Solnechny spring, Uzon caldera, Kamchatka // Microbiology (Moscow). 2017. V. 86. P. 666–669.
Adam P.S., Borrel G., Brochier-Armanet C., Gribaldo S. The growing tree of Archaea: new perspectives on their diversity, evolution and ecology // ISME J. 2017. V. 11. P. 2407–2425.
Albuquerque L., Rainey F.A., da Costa M.S. Thermus // Bergey’s Manual of Systematics of Archaea and Bacteria. Wiley, 2018. P. 1–39.
Bazhenova O.K., Arefiev O.A., Frolov E.B. Oil of the volcano Uzon caldera, Kamchatka // Org. Geochem. 1998. V. 29. P. 421–428.
Bonch-Osmolovskaya E.A., Sokolova T.G., Kostrikina N.A., Zavarzin G.A. Desulfurella acetivorans gen. nov. and sp. nov. – a new thermophilic sulfur-reducing eubacterium // Arch. Microbiol. 1990a. V. 153. P. 151–155.
Bonch-Osmolovskaya E.A., Miroshnichenko M.L., Kostrikina N.A., Chernyh N.A., Zavarzin G.A. Thermoproteus uzoniensis sp. nov., a new extremely thermophilic archaebacterium from Kamchatka continental hot springs // Arch. Microbiol. 1990б. V. 154. P. 556–559.
Boyd E.S., Fecteau K.M., Havig J.R., Shock E.L., Peters J.W. Modeling the habitat range of phototrophs in Yellowstone National Park: toward the development of a comprehensive fitness landscape // Front. Microbiol. 2012. V. 3. P. 221.
Brock T.D., Freeze H. Thermus aquaticus gen. n. and sp. n., a nonsporulating extreme thermophile // J. Bacteriol. 1969. V. 98. P. 289–297.
Brock T.D. Thermophilic Microorganisms and Life at High Temperatures. Berlin: Springer, 1978.
Bryanskaya A.V., Rozanov A.S., Slynko N.M., Shekhovtsov S.V., Peltek S.E. Geobacillus icigianus sp. nov., a thermophilic bacterium isolated from a hot spring // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 864–869.
Burgess E.A., Unrine J.M., Mills G.L., Romanek C.S., Wiegel J. Comparative geochemical and microbiological characterization of two thermal pools in the Uzon Caldera, Kamchatka, Russia // Microb. Ecol. 2012. V. 63. P. 471–489.
Chernyh N.A., Mardanov A.V., Gumerov V.M., Miroshnichenko M.L., Lebedinsky A.V., Merkel A.Y., Crowe D., Pimenov N.V., Rusanov I.I., Ravin N.V., Moran M.A., Bonch-Osmolovskaya E.A. Microbial life in Bourlyashchy, the hottest thermal pool of Uzon Caldera, Kamchatka // Extremophiles. 2015. V. 19. P. 1157–1171.
Chernyh N.A., Neukirchen S., Frolov E.N., Sousa F.L., Miroshnichenko M.L., Merkel A.Y., Pimenov N.V., Sorokin D.Y., Ciordia S., Mena M.C., Ferre M., Golyshin P.N., Lebedinsky A.V., Pereira I.A.C., Bonch-Osmolovskaya E.A. Dissimilatory sulfate reduction in the archaeon ‘Candidatus Vulcanisaeta moutnovskia’ sheds light on the evolution of sulfur metabolism // Nature Microbiol. 2020. V. 5. P. 1428–1438.
Corliss J.B., Dymond J., Gordon L.I., Edmond J.M., von Herzen R.P., Ballard R.D., Green K., Williams D., Bainbridge A., Crane K., van Andel T.H. Submarine thermal springs on the Galápagos Rift // Science. 1979. V. 203. P. 1073–1083.
Daims H., Lebedeva E.V., Pjevac P., Han P., Herbold C., Albertsen M., Jehmlich N., Palatinszky M., Vierheilig J., Bulaev A., Kirkegaard R.H., von Bergen M., Rattei T., Bendinger B., Nielsen P.H., Wagner M. Complete nitrification by Nitrospira bacteria // Nature. 2015. V. 528. P. 504–509.
DeCastro M.-E., Rodríguez-Belmonte E., González-Siso M.-I. Metagenomics of thermophiles with a focus on discovery of novel thermozymes // Front. Microbiol. 2016. V. 7. Art. 1521.
Des Marais D.J., Walter M.R. Terrestrial hot spring systems: introduction // Astrobiology. 2019. V. 19. P. 1419–1432.
Eder W., Huber R. New isolates and physiological properties of the Aquificales and description of Thermocrinis albus sp. nov. // Extremophiles. 2002. V. 6. P. 309–318.
Elcheninov A.G., Podosokorskaya O.A., Kovaleva O.L., Novikov A.A., Toshchakov S.V., Bonch-Osmolovskaya E.A., Kublanov I.V. Thermogemmata fonticola gen. nov., sp. nov., the first thermophilic planctomycete of the order Gemmatales from a Kamchatka hot spring // Syst. Appl. Microbiol. 2021. V. 44. Art. 126157.
Eme L., Reigstad L.J., Spang A., Lanzén A., Weinmaier T., Rattei T., Schleper C., Brochier-Armanet C. Metagenomics of kamchatkan hot spring filaments reveal two new major (hyper) thermophilic lineages related to Thaumarchaeota // Res. Microbiol. 2013. V. 164. P. 425–438.
Frolov E.N., Kublanov I.V., Toshchakov S.V., Samarov N.I., Novikov A.A., Lebedinsky A.V., Bonch-Osmolovskaya E.A., Chernyh N.A. Thermodesulfobium acidiphilum sp. nov., a thermoacidophilic, sulfate-reducing, chemoautotrophic bacterium from a thermal site // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1482–1485.
Frolov E.N., Zayulina K.S., Kopitsyn D.S., Kublanov I.V., Bonch-Osmolovskaya E.A., Chernyh N.A. Desulfothermobacter acidiphilus gen. nov., sp. nov., a thermoacidophilic sulfate-reducing bacterium isolated from a terrestrial hot spring // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 871–875.
Frolov E.N., Kublanov I.V., Toshchakov S.V., Lunev E.A., Pimenov N.V., Bonch-Osmolovskaya E.A., Lebedinsky A.V., Chernyh N.A. Form III RubisCO-mediated transaldolase variant of the Calvin cycle in a chemolithoautotrophic bacterium // Proc. Natl. Acad. Sci. USA. 2019. V. 116. P. 18638–18646.
Frolov E.N., Gololobova A.V., Klyukina A.A., Bonch-Osmolovskaya E.A., Pimenov N.V., Chernyh N.A., Merkel A.Y. Diversity and activity of sulfate-reducing prokaryotes in Kamchatka hot springs // Microorganisms. 2021. V. 9. Art. 2072.
Fry J.C., Parkes R.J., Cragg B.A., Weightman A.J., Webster G. Prokaryotic biodiversity and activity in the deep subseafloor biosphere // FEMS Microbiol. Ecol. 2008. V. 66. P. 181–196.
Gaisin V.A., Kalashnikov A.M., Sukhacheva M.V., Namsaraev Z.B., Barhutova D.D., Gorlenko V.M., Kuznetsov B.B. Filamentous anoxygenic phototrophic bacteria from cyanobacterial mats of Alla hot springs (Barguzin Valley, Russia) // Extremophiles. 2015. V. 19. P. 1067–1076.
Gaisin V.A., Grouzdev D.S., Namsaraev Z.B., Sukhacheva M.V., Gorlenko V.M., Kuznetsov B.B. Biogeography of thermophilic phototrophic bacteria belonging to Roseiflexus genus // FEMS Microbiol. Ecol. 2016. V. 92. P. 1–7.
Gavrilov S.N., Stracke C., Jensen K., Menzel P., Kallnik V., Slesarev A., Sokolova T., Zayulina K., Bräsen C., Bonch-Osmolovskaya E.A., Peng X., Kublanov I.V., Siebers B. Isolation and characterization of the first xylanolytic hyperthermophilic euryarchaeon Thermococcus sp. strain 2319x1 and its unusual multidomain glycosidase // Front. Microbiol. 2016. V. 7. Art. 552.
Golyshina O.V., Bargiela R., Toshchakov S.V., Chernyh N.A., Ramayah S., Korzhenkov A.A., Kublanov I.V., Golyshin P.N. Diversity of “Ca. Micrarchaeota” in two distinct types of acidic environments and their associations with Thermoplasmatales // Genes. 2019. V. 10. Art. 461.
Hao L., McIlroy S.J., Kirkegaard R.H., Karst S.M., Fernando W.E.Y., Aslan H., Meyer R.L., Albertsen M., Nielsen P.H., Dueholm M.S. Novel prosthecate bacteria from the candidate phylum Acetothermia // ISME J. 2018. V. 12. P. 2225–2237.
Hatzenpichler R., Lebedeva E.V., Spieck E., Stoecker K., Richter A., Daims H., Wagner M. A moderately thermophilic ammonia-oxidizing crenarchaeote from a hot spring // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 2134–2139.
Hedlund B.P., Reysenbach A.-L., Huang L., Ong J.C., Liu Z., Dodsworth J.A., Ahmed R., Williams A.J., Briggs B.R., Liu Y., Hou W., Dong H. Isolation of diverse members of the Aquificales from geothermal springs in Tengchong, China // Front. Microbiol. 2015. V. 6. Art. 157.
Hellebrand H.J., Schade G.W. Carbon monoxide from composting due to thermal oxidation of biomass // J. Environ. Qual. 2008. V. 37. P. 592–598.
Hou W., Wang S., Dong H., Jiang H., Briggs B.R., Peacock J.P., Huang Q., Huang L., Wu G., Zhi X., Li W., Dodswoth J.A., Hedlund B.P., Zhang C., Hartnett H.E., Dijkstra P., Hungate B.A. A comprehensive census of microbial diversity in hot springs of Tengchong, Yunnan Province China using 16S rRNA gene pyrosequencing // PLoS One. 2013. V. 8. e53350.
Hu P., Tom L., Singh A., Thomas B.C., Baker B.J., Piceno Y.M., Andersen G.L., Banfield J.F. Genome-resolved metagenomic analysis reveals roles for candidate phyla and other microbial community members in biogeochemical transformations in oil reservoirs // mBio. 2016. V. 7. Art. 1669-15.
Huang Q., Jiang H., Briggs B.R., Wang S., Hou W., Li G., Wu G., Solis R., Arcilla C.A., Abrajano T., Dong H. Archaeal and bacterial diversity in acidic to circumneutral hot springs in the Philippines // FEMS Microbiol. Ecol. 2013. V. 85. P. 452–464.
Inskeep W.P., Jay Z.J., Tringe S.G., Herrgård M.J., Rusch D.B. The YNP metagenome project: Environmental parameters responsible for microbial distribution in the Yellowstone geothermal ecosystem // Front. Microbiol. 2013. V. 4. P. 1–15.
Islam T., Jensen S., Reigstad L.J., Larsen Ø., Birkeland N.K. Methane oxidation at 55°C and pH 2 by a thermoacidophilic bacterium belonging to the Verrucomicrobia phylum // Proc. Natl. Acad. Sci. USA. 2008. V. 105. P. 300–304.
Jung D., Seo E.-Y., Owen J.S., Aoi Y., Young S., Lavrentyeva E.V., Ahn T.S. Application of the filret plate microbial trap (FPTMT), for cultivating thermophilic bacteria from thermal springs in Barguzin area, eastern Baikal, Russia // Biosci. Biotechnol. Biochem. 2018. V. 82. P. 1624–1632.
Karnachuk O.V., Frank Y.A., Lukina A.P., Kadnikov V.V., Beletsky A.V., Mardanov A.V., Ravin N.V. Domestication of previously uncultivated Candidatus Desulforudis audaxviator from a deep aquifer in Siberia sheds light on its physiology and evolution // ISME J. 2019. V. 13. P. 1947–1959.
Karner M.B., DeLong E.F., Karl D.M. Archaeal dominance in the mesopelagic zone of the Pacific Ocean // Nature. 2001. V. 409. P. 507–510.
Karpov G.A., Naboko S.I. Metal contents of recent thermal waters, mineral precipitates and hydrothermal alteration in active geothermal fields, Kamchatka // J. Geochem. Explor. 1990. V. 36. P. 57–71.
Kevbrin V.V., Zengler K., Lysenko A.M., Wiegel J. Anoxybacillus kamchatkensis sp. nov., a novel thermophilic facultative aerobic bacterium with a broad pH optimum from the Geyser valley, Kamchatka // Extremophiles. 2005. V. 9. P. 391–398.
Kevbrin V., Boltyanskaya Y., Garnova E., Wiegel J. Anaerobranca zavarzinii sp. nov., an anaerobic, alkalithermophilic bacterium isolated from Kamchatka thermal fields // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1486–1491.
Khomyakova M.A., Merkel A.Y., Kopitsyn D.S., Bonch-Osmolovskaya E.A., Slobodkin A.I. Calorimonas adulescens gen. nov., sp. nov., an anaerobic thermophilic bacterium utilizing methoxylated benzoates // Int. J. Syst. Evol. Microbiol. 2020. V. 70. P. 2066–2071.
Kizilova A.K., Sukhacheva M.V., Pimenov N.V., Yurkov A.M., Kravchenko I.K. Methane oxidation activity and diversity of aerobic methanotrophs in pH-neutral and semi-neutral thermal springs of the Kunashir Island, Russian Far East // Extremophiles. 2014. V. 18. P. 207–218.
Kochetkova T.V., Rusanov I.I., Pimenov N.V., Kolganova T.V., Lebedinsky A.V., Bonch-Osmolovskaya E.A., Sokolova T.G. Anaerobic transformation of carbon monoxide by microbial communities of Kamchatka hot springs // Extremophiles. 2011. V. 15. P. 319–325.
Kochetkova T.V., Kublanov I.V., Toshchakov S.V., Osburn M.R., Novikov A.A., Bonch-Osmolovskaya E.A., Perevalova A.A. Thermogladius calderae gen. nov., sp. nov., an anaerobic, hyperthermophilic crenarchaeote from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 1407–1412.
Kochetkova T.V., Mardanov A.V., Sokolova T.G., Bonch-Osmolovskaya E.A., Kublanov I.V., Kevbrin V.V., Beletsky A.V., Ravin N.V., Lebedinsky A.V. The first crenarchaeon capable of growth by anaerobic carbon monoxide oxidation coupled with H2 production // Syst. Appl. Microbiol. 2020a. V. 43. Art. 126064.
Kochetkova T.V., Toshchakov S.V., Zayulina K.S., Elcheninov A.G., Zavarzina D.G., Lavrushin V.Y., Bonch-Osmolovskaya E.A., Kublanov I.V. Hot in cold: Microbial life in the hottest springs in permafrost // Microorganisms. 2020b. V. 8. Art. 1308.
Kochetkova T.V., Zayulina K.S., Zhigarkov V.S., Minaev N.V., Chichkov B.N., Novikov A.A., Toshchakov S.V., Elcheninov A.G., Kublanov I.V. Tepidiforma bonchosmolovskayae gen. nov., sp. nov., a moderately thermophilic Chloroflexi bacterium from a Chukotka hot spring (Arctic, Russia), representing a novel class, Tepidiformia, which includes the previously uncultivated lineage OLB14 // Int. J. Syst. Evol. Microbiol. 2020c. V. 70. P. 1192–1202.
Kompantseva E.I., Kublanov I.V., Perevalova A.A., Chernyh N.A., Toshchakov S.V., Litti Y.V., Antipov A.N., Bonch-Osmolovskaya E.A., Miroshnichenko M.L. Calorithrix insularis gen. nov., sp. nov., a novel representative of the phylum Calditrichaeota // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 1486–1490.
Kovaleva O.L., Merkel A.Y., Novikov A.A., Baslerov R.V., Toshchakov S.V., Bonch-Osmolovskaya E.A. Tepidisphaera mucosa gen. nov., sp. nov., a moderately thermophilic member of the class Phycisphaerae in the phylum Planctomycetes, and proposal of a new family, Tepidisphaeraceae fam. nov., and a new order, Tepidisphaerales ord. nov. // Int. J. Syst. Evol. Microbiol. 2015. V. 65. P. 549–555.
Kozina I.V., Kublanov I.V., Kolganova T.V., Chernyh N.A., Bonch-Osmolovskaya E.A. Caldanaerobacter uzonensis sp. nov., an anaerobic, thermophilic, heterotrophic bacterium isolated from a hot spring // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 1372–1375.
Kublanov I.V., Prokofeva M.I., Kostrikina N.A., Kolganova T.V., Tourova T.P., Wiegel J., Bonch-Osmolovskaya E.A. Thermoanaerobacterium aciditolerans sp. nov., a moderate thermoacidophile from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 260–264.
Kublanov I.V., Perevalova A.A., Slobodkina G.B., Lebedinsky A.V., Bidzhieva S.K., Kolganova T.V., Kaliberda E.N., Rumsh L.D., Haertlé T., Bonch-Osmolovskaya E.A. Biodiversity of thermophilic prokaryotes with hydrolytic activities in hot springs of Uzon Caldera, Kamchatka (Russia) // Appl. Environ. Microbiol. 2009. V. 75. P. 286–291.
Lau M.C.Y., Aitchison J.C., Pointing S.B. Bacterial community composition in thermophilic microbial mats from five hot springs in central Tibet // Extremophiles. 2009. V. 13. P. 139–149.
Lebedeva E.V., Alawi M., Fiencke C., Namsaraev B., Bock E., Spieck E. Moderately thermophilic nitrifying bacteria from a hot spring of the Baikal rift zone // FEMS Microb. Ecol. 2005. V. 54. P. 297–306.
Lebedeva E.V., Off S., Zumbrägel S., Kruse M., Shagzhina A., Lücker S., Maixner F., Lipski A.M., Daims H., Spieck E. Isolation and characterization of a moderately thermophilic nitrite-oxidizing bacterium from a geothermal spring // FEMS Microbiol. Ecol. 2011. V. 75. P. 195–204.
Lebedeva E.V., Hatzenpichler R., Pelletier E., Schuster N., Hauzmayer S., Bulaev A., Grigor’eva N.V., Galushko A., Schmid M., Palatinszky M., Le Paslier D., Daims H., Wagner M. Enrichment and genome sequence of the group I.1a ammonia-oxidizing archaeon “Ca. Nitrosotenuis uzonensis” representing a clade globally distributed in thermal habitats // PLoS One. 2013. V. 8. P. 1–12.
Loginova L.G., Egorova L.A., Golovacheva R.S., Seregina L.M. Thermus ruber sp. nov., nom. rev. // Int. J. Syst. Evol. Bacteriol. 1984. V. 34. P. 498–499.
Magnabosco C., Lin L.H., Dong H., Bomberg M., Ghiorse W., Stan-Lotter H., Pedersen K., Kieft T.L., van Heerden E., Onstott T.C. The biomass and biodiversity of the continental subsurface // Nature Geosci. 2018. V. 11. P. 707–717.
Mall A., Sobotta J., Huber C., Tschirner C., Kowarschik S., Bačnik K., Mergelsberg M., Boll M., Hügler M., Eisenreich W., Berg I.A. Reversibility of citrate synthase allows autotrophic growth of a thermophilic bacterium // Science. 2018. V. 359. P. 563–567.
Mardanov A.V., Gumerov V.M., Beletsky A.V., Perevalova A.A., Karpov G.A., Bonch-Osmolovskaya E.A., Ravin N.V. Uncultured archaea dominate in the thermal groundwater of Uzon Caldera, Kamchatka // Extremophiles. 2011. V. 15. P. 365–372.
Mardanov A.V., Gumerov V.M., Beletsky A.V., Ravin N.V. Microbial diversity in acidic thermal pools in the Uzon Caldera, Kamchatka // Antonie van Leeuwenhoek. 2018. V. 111. P. 35–43.
Martin W., Russell M.J. On the origins of cells: A hypothesis for the evolutionary transitions from abiotic geochemistry to chemoautotrophic prokaryotes, and from prokaryotes to nucleated cells // Philos. Trans. R. Soc. Lond. B. Biol. Sci. 2003. V. 358. P. 59–85.
Menzel P., Gudbergsdóttir S.R., Rike A.G., Lin L., Zhang Q., Contursi P., Moracci M., Kristjansson J.K., Bolduc B., Gavrilov S., Ravin N., Mardanov A., Bonch-Osmolovskaya E., Young M., Krogh A., Peng X. Comparative metagenomics of eight geographically remote terrestrial hot springs // Microb. Ecol. 2015. V. 70. P. 411–424.
Merkel A.Y., Pimenov N.V., Rusanov I.I., Slobodkin A.I., Slobodkina G.B., Tarnovetckii I.Y., Frolov E.N., Dubin A.V., Perevalova A.A., Bonch-Osmolovskaya E.A. Microbial diversity and autotrophic activity in Kamchatka hot springs // Extremophiles. 2017. V. 21. P. 307–317.
Miroshnichenko M.L., Bonch-Osmolovskaya E.A., Neuner A., Kostrikina N.A., Chernych N.A., Alekseev V.A. Thermococcus stetteri sp. nov., a new extremely thermophilic marine sulfur-metabolizing archaebacterium // Syst. Appl. Microbiol. 1989. V. 12. P. 257–262.
Miroshnichenko M.L., Rainey F.A., Hippe H., Chernyh N.A., Kostrikina N.A., Bonch-Osmolovskaya E.A. Desulfurella kamchatkensis sp. nov. and Desulfurella propionica sp. nov., new sulfur-respiring thermophilic bacteria from Kamchatka thermal environments // Int. J. Syst. Bacteriol. 1998. V. 48. P. 475–479.
Miroshnichenko M.L., Tourova T.P., Kolganova T.V., Kostrikina N.A., Chernych N., Bonch-Osmolovskaya E.A. Ammonifex thiophilus sp. nov., a hyperthermophilic anaerobic bacterium from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2008a. V. 58. P. 2935–2938.
Miroshnichenko M.L., Kublanov I.V., Kostrikina N.A., Tourova T.P., Kolganova T.V., Birkeland N.-K., Bonch-Osmolovskaya E.A. Caldicellulosiruptor kronotskyensis sp. nov. and Caldicellulosiruptor hydrothermalis sp. nov., two extremely thermophilic, cellulolytic, anaerobic bacteria from Kamchatka thermal springs // Int. J. Syst. Evol. Microbiol. 2008б. V. 58. P. 1492–1496.
Miroshnichenko M.L., Lebedinsky A.V., Chernyh N.A., Tourova T.P., Kolganova T.V., Spring S., Bonch-Osmolovskaya E.A. Caldimicrobium rimae gen. nov., sp. nov., an extremely thermophilic, facultatively lithoautotrophic, anaerobic bacterium from the Uzon Caldera, Kamchatka // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 1040–1044.
Nazina T.N., Lebedeva E.V., Poltaraus A.B., Tourova T.P., Grigoryan A.A., Sokolova D.S., Lysenko A.M., Osipov G.A. Geobacillus gargensis sp. nov., a novel thermophile from a hot spring, and the reclassification of Bacillus vulcani as Geobacillus vulcani comb. nov. // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 2019–2024.
Nepomnyashchaya Y.N., Slobodkina G.B., Baslerov R.V., Chernyh N.A., Bonch-Osmolovskaya E.A., Netrusov A.I., Slobodkin A.I. Moorella humiferrea sp. nov., a thermophilic, anaerobic bacterium capable of growth via electron shuttling between humic acid and Fe(III) // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 613–617.
O’Neill A.H., Liu Y., Ferrera I., Beveridge T.J., Reysenbach A.-L. Sulfurihydrogenibium rodmanii sp. nov., a sulfur-oxidizing chemolithoautotroph from the Uzon Caldera, Kamchatka Peninsula, Russia, and emended description of the genus Sulfurihydrogenibium // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1147–1152.
Op den Camp H.J.M., Islam T., Stott M.B., Harhangi H.R., Hynes A., Schouten S., Jetten M.S.M., Birkeland N.-K., Pol A., Dunfield P.F. Environmental, genomic and taxonomic perspectives on methanotrophic Verrucomicrobia // Environ. Microbiol. Rep. 2009. V. 1. P. 293–306.
Panda A.K., Bisht S.S., De Mandal S., Kumar N.S. Bacterial and archeal community composition in hot springs from Indo-Burma region, North-east India // AMB Express. 2016. V. 6. 111.
Perevalova A.A., Kolganova T.V., Birkeland N.-K., Schleper C., Bonch-Osmolovskaya E.A., Lebedinsky A.V. Distribution of Crenarchaeota representatives in terrestrial hot springs of Russia and Iceland // Appl. Environ. Microbiol. 2008. V. 74. P. 7620–7628.
Perevalova A.A., Bidzhieva S.K., Kublanov I.V., Hinrichs K.U., Liu X.L., Mardanov A.V., Lebedinsky A.V., Bonch-Osmolovskaya E.A. Fervidicoccus fontis gen. nov., sp. nov., an anaerobic, thermophilic crenarchaeote from terrestrial hot springs, and proposal of Fervidicoccaceae fam. nov. and Fervidicoccales ord. nov. // Int. J. Syst. Evol. Microbiol. 2010. V. 60. P. 2082–2088.
Perevalova A.A., Kublanov I.V., Baslerov R.V., Zhang G., Bonch-Osmolovskaya E.A. Brockia lithotrophica gen. nov., sp. nov., an anaerobic thermophilic bacterium from a terrestrial hot spring // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 479–483.
Perevalova A.A., Kublanov I.V., Bidzhieva S.K., Mukhopadhyay B., Bonch-Osmolovskaya E.A., Lebedinsky A.V. Reclassification of Desulfurococcus mobilis as a synonym of Desulfurococcus mucosus, Desulfurococcus fermentans and Desulfurococcus kamchatkensis as synonyms of Desulfurococcus amylolyticus, and emendation of the D. mucosus and D. amylolyticus species descriptions // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 514–517.
Podosokorskaya O.A., Merkel A.Y., Kolganova T.V., Chernyh N.A., Miroshnichenko M.L., Bonch-Osmolovskaya E.A., Kublanov I.V. Fervidobacterium riparium sp. nov., a thermophilic anaerobic cellulolytic bacterium isolated from a hot spring // Int. J. Syst. Evol. Microbiol. 2011. V. 61. P. 2697–2701.
Podosokorskaya O.A., Kadnikov V.V., Gavrilov S.N., Mardanov A.V., Merkel A.Y., Karnachuk O.V., Ravin N.V., Bonch-Osmolovskaya E.A., Kublanov I.V. Characterization of Melioribacter roseus gen. nov., sp. nov., a novel facultatively anaerobic thermophilic cellulolytic bacterium from the class Ignavibacteria, and a proposal of a novel bacterial phylum Ignavibacteriae // Environ. Microbiol. 2013. V. 15. P. 1759–1771.
Podosokorskaya O.A., Kochetkova T.V., Novikov A.A., Toshchakov S.V., Elcheninov A.G., Kublanov I.V. Tenuifilum thalassicum gen. nov., sp. nov., a novel moderate thermophilic anaerobic bacterium from a Kunashir Island shallow hot spring representing a new family Tenuifilaceae fam. nov. in the class Bacteroidia // Syst. Appl. Microbiol. 2020. V. 43. Art. 126126.
Polyak B.G., Prasolov E.M., Lavrushin V.Y., Cheshko A.L., Kamenskii I.L. He, Ar, C and N isotopes in thermal springs of the Chukotka Peninsula: Geochemical evidence of the recent rifting in the north-eastern Asia // Chemical Geology. 2013. V. 339. P. 127–140.
Prokofeva M.I., Miroshnichenko M.L., Kostrikina N.A., Chernyh N.A., Kuznetsov B.B., Tourova T.P., Bonch-Osmolovskaya E.A. Acidilobus aceticus gen. nov., sp. nov., a novel anaerobic thermoacidophilic archaeon from continental hot vents in Kamchatka // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 2001–2008.
Prokofeva M.I., Kublanov I.V., Nercessian O., Tourova T.P., Kolganova T.V., Lebedinsky A.V., Bonch-Osmolovskaya E.A., Spring S., Jeanthon C. Cultivated anaerobic acidophilic/acidotolerant thermophiles from terrestrial and deep-sea hydrothermal habitats // Extremophiles. 2005. V. 9. P. 437–448.
Prokofeva M.I., Kostrikina N.A., Kolganova T.V., Tourova T.P., Lysenko A.M., Lebedinsky A.V., Bonch-Osmolovskaya E.A. Isolation of the anaerobic thermoacidophilic crenarchaeote Acidilobus saccharovorans sp. nov. and proposal of Acidilobales ord. nov., including Acidilobaceae fam. nov. and Caldisphaeraceae fam. nov. // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 3116–3122.
Rasmussen B. Filamentous microfossils in a 3,235-million-year-old volcanogenic massive sulphide deposit // Nature. 2000. V. 405. P. 676–679.
Reigstad L.J., Richter A., Daims H., Urich T., Schwark L., Schleper C. Nitrification in terrestrial hot springs of Iceland and Kamchatka // FEMS Microbiol. Ecol. 2008. V. 64. P. 167–174.
Reigstad L.J., Jorgensen S.L., Schleper C. Diversity and abundance of Korarchaeota in terrestrial hot springs of Iceland and Kamchatka // ISME J. 2010. V. 4. P. 346–356.
Reysenbach A.-L., Banta A., Civello S., Daly J., Mitchel K., Lalonde S., Konhauser K., Rodman A., Rusterholtz K., Takacs-Vesbach C. Aquificales in Yellowstone National Park // Geothermal Biology and Geochemistry in YNP. 2005. P. 129–142.
Rozanov A.S., Bryanskaya A.V., Malup T.K., Meshcheryakova I.A., Lazareva E.V., Taran O.P., Ivanisenko T.V., Ivanisenko V.A., Zhmodik S.M., Kolchanov N.A., Peltek S.E. Molecular analysis of the benthos microbial community in Zavarzin thermal spring (Uzon Caldera, Kamchatka, Russia) // BMC Genomics. 2014a. V. 15. P. 1–15.
Rozanov A.S., Bryanskaya A.V., Ivanisenko T.V., Malup T.K., Peltek S.E. Biodiversity of the microbial mat of the Garga hot spring // BMC Evol. Biol. 2017a. V. 17. 254.
Rozanov A.S., Bryanskaya A.V., Kotenko A.V., Peltek S.E. Draft genome sequence of Thermoactinomyces sp. Gus2-1 isolated from the hot-spring Gusikha in Bargusin Valley (Baikal Rift Zone, Russia) // Genomics Data. 2017b. V. 11. P. 1–2.
Saiki R., Gelfand D., Stoffel S., Scharf S., Higuchi R., Horn G., Mullis K., Erlich H. Primer-directed enzymatic amplification of DNA with a thermostable DNA polymerase // Science. 1988. V. 239. P. 487–491.
Skirnisdottir S., Hreggvidsson G.O., Hjörleifsdottir S., Marteinsson V.T., Petursdottir S.K., Holst O., Kristjansson J.K. Influence of sulfide and temperature on species composition and community structure of hot spring microbial mats // Ap-pl. Environ. Microbiol. 2000. V. 66. P. 2835–2841.
Slepova T.V., Sokolova T.G., Lysenko A.M., Tourova T.P., Kolganova T.V., Kamzolkina O.V., Karpov G.A., Bonch-Osmolovskaya E.A. Carboxydocella sporoproducens sp. nov., a novel anaerobic CO-utilizing/H2-producing thermophilic bacterium from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 797–800.
Slepova T.V., Sokolova T.G., Kolganova T.V., Tourova T.P., Bonch-Osmolovskaya E.A. Carboxydothermus siderophilus sp. nov., a thermophilic, hydrogenogenic, carboxydotrophic, dissimilatory Fe(III)-reducing bacterium from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2009. V. 59. P. 213–217.
Slobodkin A.I., Tourova T.P., Kuznetsov B.B., Kostrikina N.A., Chernyh N.A., Bonch-Osmolovskaya E.A. Thermoanaerobacter siderophilus sp. nov., a novel dissimilatory Fe(III)-reducing, anaerobic, thermophilic bacterium // Int. J. Syst. Evol. Microbiol. 1999. V. 49. P. 1471–1478.
Slobodkin A.I., Tourova T.P., Kostrikina N.A., Lysenko A.M., German K.E., Bonch-Osmolovskaya E.A., Birkeland N.K. Tepidimicrobium ferriphilum gen. nov., sp. nov., a novel moderately thermophilic, Fe(III)-reducing bacterium of the order Clostridiales // Int. J. Syst. Evol. Microbiol. 2006. V. 56. P. 369–372.
Slobodkin A.I., Slobodkina G.B., Panteleeva A.N., Chernyh N.A., Novikov A.A., Bonch-Osmolovskaya E.A. Dissulfurimicrobium hydrothermale gen. nov., sp. nov., a thermophilic, autotrophic, sulfur-disproportionating deltaproteobacterium isolated from a hydrothermal pond // Int. J. Syst. Evol. Microbiol. 2016. V. 66. P. 1022–1026.
Slobodkina G.B., Panteleeva A.N., Sokolova T.G., Bonch-Osmolovskaya E.A., Slobodkin A.I. Carboxydocella manganica sp. nov., a thermophilic, dissimilatory Mn(IV)- and Fe(III)-reducing bacterium from a Kamchatka hot spring // Int. J. Syst. Evol. Microbiol. 2012. V. 62. P. 890–894.
Slobodkina G.B., Lebedinsky A.V., Chernyh N.A., Bonch-Osmolovskaya E.A., Slobodkin A.I. Pyrobaculum ferrireducens sp. nov., a hyperthermophilic Fe(III)-, selenate- and arsenate-reducing crenarchaeon isolated from a hot spring // Int. J. Syst. Evol. Microbiol. 2015a. V. 65. P. 851–856.
Slobodkina G.B., Kovaleva O.L., Miroshnichenko M.L., Slobodkin A.I., Kolganova T.V., Novikov A.A., van Heerden E., Bonch-Osmolovskaya E.A. Thermogutta terrifontis gen. nov., sp. nov. and Thermogutta hypogea sp. nov., thermophilic anaerobic representatives of the phylum Planctomycetes // Int. J. Syst. Evol. Microbiol. 2015b. V. 65. P. 760–765.
Slobodkina G.B., Baslerov R.V., Novikov A.A., Viryasov M.B., Bonch-Osmolovskaya E.A., Slobodkin A.I. Inmirania thermothiophila gen. nov., sp. nov., a thermophilic, facultatively autotrophic, sulfur-oxidizing gammaproteobacterium isolated from a shallow-sea hydrothermal vent // Int. J. Syst. Evol. Microbiol. 2016a. V. 66. P. 701–706.
Slobodkina G.B., Kolganova T.V., Kopitsyn D.S., Viryasov M.B., Bonch-Osmolovskaya E.A., Slobodkin A.I. Dissulfurirhabdus thermomarina gen. nov., sp. nov., a thermophilic, autotrophic, sulfite-reducing and disproportionating deltaproteobacterium isolated from a shallow-sea hydrothermal vent // Int. J. Syst. Evol. Microbiol. 2016b. V. 66. P. 2515–2519.
Slobodkina G.B., Baslerov R.V., Novikov A.A., Bonch-Osmolovskaya E.A., Slobodkin A.I. Thermodesulfitimonas autotrophica gen. nov., sp. nov., a thermophilic, obligate sulfite-reducing bacterium isolated from a terrestrial hot spring // Int. J. Syst. Evol. Microbiol. 2017. V. 67. P. 301–305.
Slobodkina G.B., Baslerov R.V., Kostryukova N.K., Bonch-Osmolovskaya E.A., Slobodkin A.I. Tepidibaculum saccharolyticum gen. nov., sp. nov. a moderately thermophilic, anaerobic, spore-forming bacterium isolated from a terrestrial hot spring // Extremophiles. 2018. V. 22. P. 761–768.
Sokolova T.G., Kostrikina N.A., Chernyh N.A., Tourova T.P., Kolganova T.V., Bonch-Osmolovskaya E.A. Carboxydocella thermautotrophica gen. nov., sp. nov., a novel anaerobic, CO-utilizing thermophile from a kamchatkan hot spring // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1961–1967.
Sokolova T.G., Kostrikina N.A., Chernyh N.A., Kolganova T.V., Tourova T.P., Bonch-Osmolovskaya E.A. Thermincola carboxydiphila gen. nov., sp. nov., a novel anaerobic, carboxydotrophic, hydrogenogenic bacterium from a hot spring of the Lake Baikal area // Int. J. Syst. Evol. Microbiol. 2005. V. 55. P. 2069–2073.
Stetter K.O., Huber R., Blöchl E., Kurr M., Eden R.D., Fielder M., Cash H., Vance I. Hyperthermophilic archaea are thriving in deep North Sea and Alaskan oil reservoirs // Nature. 1993. V. 365. P. 743–745.
Svetlichny V.A., Sokolova T.G., Gerhardt M., Kostrikina N.A., Zavarzin G.A. Anaerobic extremely thermophilic carboxydotrophic bacteria in hydrotherms of Kuril Islands // Microb. Ecol. 1991a. V. 21. P. 1–10.
Svetlichny V.A., Sokolova T.G., Gerhardt M., Ringpfeil M., Kostrikina N.A., Zavarzin G.A. Carboxydothermus hydrogenoformans gen. nov., sp. nov., a CO-utilizing thermophilic anaerobic bacterium from hydrothermal environments of Kunashir Island // Syst. Appl. Microbiol. 1991b. V. 14. P. 254–260.
Symonds R.B., Rose W.I., Bluth G.J.S., Gerlach T.M. Volvanic-gas studies: methods, results, and applications // Vol-atiles in Magmas. Chapter 1 / Eds. Carroll M.R., Holloway J.R. Berlin, Boston: De Gruyter, 1994. P. 1–66.
Takami H., Noguchi H., Takaki Y., Uchiyama I., Toyoda A., Nishi S., Chee G.-J., Arai W., Nunoura T., Itoh T., Hattori M., Takai K. A deeply branching thermophilic bacterium with an ancient Acetyl-CoA pathway dominates a subsurface ecosystem // PLoS One. 2012. V. 7. e0030559.
Toshchakov S.V., Korzhenkov A.A., Samarov N.I., Mazunin I.O., Mozhey O.I., Shmyr I.S., Derbikova K.S., Taranov E.A., Dominova I.N., Bonch-Osmolovskaya E.A., Patrushev M.V., Podosokorskaya O.A., Kublanov I.V. Complete genome sequence of and proposal of Thermofilum uzonense sp. nov. a novel hyperthermophilic crenarchaeon and emended description of the genus Thermofilum // Stand. Genomic Sci. 2015. V. 10. Art. 122.
Toshchakov S.V., Lebedinsky A.V., Sokolova T.G., Zavarzina D.G., Korzhenkov A.A., Teplyuk A.V., Chistyakova N.I., Rusakov V.S., Bonch-Osmolovskaya E.A., Kublanov I.V., Gavrilov S.N. Genomic insights into energy metabolism of Carboxydocella thermautotrophica coupling hydrogenogenic CO oxidation with the reduction of Fe(III) minerals // Front. Microbiol. 2018. V. 9. Art. 1759.
Urschel M.R., Kubo M.D., Hoehler T.M., Peters J.W., Boyd E.S. Carbon source preference in chemosynthetic hot spring communities // Appl. Environ. Microbiol. 2015. V. 81. P. 3834–3847.
Wagner I.D., Zhao W., Zhang C.L., Romanek C.S., Rohde M., Wiegel J. Thermoanaerobacter uzonensis sp. nov., an anaerobic thermophilic bacterium isolated from a hot spring within the Uzon Caldera, Kamchatka, Far East Russia // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 2565–2573.
Walker J.C.G. Was the Archaean biosphere upside down? // Nature. 1987. V. 329. P. 710–712.
Weiss M.C., Sousa F.L., Mrnjavac N., Neukirchen S., Roettger M., Nelson-Sathi S., Martin W.F. The physiology and habitat of the last universal common ancestor // Nat. Microbiol. 2016. V. 1. Art. 16116.
Wemheuer B., Taube R., Akyol P., Wemheuer F., Daniel R. Microbial diversity and biochemical potential encoded by thermal spring metagenomes derived from the Kamchatka peninsula // Archaea. 2013. Art. 136714.
Whitaker R.J., Grogan D.W., Taylor J.W. Geographic barriers isolate endemic populations of hyperthermophilic archaea // Science. 2003. V. 301. P. 976–978.
Wilkins L.G.E., Ettinger C.L., Jospin G., Eisen J.A. Metagenome-assembled genomes provide new insight into the microbial diversity of two thermal pools in Kamchatka, Russia // Sci. Rep. 2019. V. 9. P. 1–15.
Woese C.R., Kandler O., Wheelis M.L. Towards a natural system of organisms: proposal for the domains Archaea, Bacteria, and Eucarya // Proc. Natl. Acad. Sci. USA. 1990. V. 87. P. 4576–4579.
Yumoto I., Hirota K., Kawahara T., Nodasaka Y., Okuyama H., Matsuyama H., Yokota Y., Nakajima K., Hoshino T. Anoxybacillus voinovskiensis sp. nov., a moderately thermophilic bacterium from a hot spring in Kamchatka // Int. J. Syst. Evol. Microbiol. 2004. V. 54. P. 1239–1242.
Zavarzina D.G., Zhilina T.N., Tourova T.P., Kuznetsov B.B., Kostrikina N.A., Bonch-Osmolovskaya E.A. Thermanaerovibrio velox sp. nov., a new anaerobic, thermophilic, organotrophic bacterium that reduces elemental sulfur, and emended description of the genus Thermanaerovibrio // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1287–1295.
Zavarzina D.G., Tourova T.P., Kuznetsov B.B., Bonch-Osmolovskaya E.A., Slobodkin A.I. Thermovenabulum ferriorganovorum gen. nov., sp. nov., a novel thermophilic, anaerobic, endospore-forming bacterium // Int. J. Syst. Evol. Microbiol. 2002. V. 52. P. 1737–1743.
Zavarzina D.G., Sokolova T.G., Tourova T.P., Chernyh N.A., Kostrikina N.A., Bonch-Osmolovskaya E.A. Thermincola ferriacetica sp. nov., a new anaerobic, thermophilic, facultatively chemolithoautotrophic bacterium capable of dissimilatory Fe(III) reduction // Extremophiles. 2007. V. 11. P. 1–7.
Zavarzina D.G., Kochetkova T.V., Chistyakova N.I., Gracheva M.A., Antonova A.V., Merkel A.Y., Perevalova A.A., Chernov M.S., Koksharov Y.A., Bonch-Osmolovskaya E.A., Gavrilov S.N., Bychkov A.Y. Siderite-based anaerobic iron cycle driven by autotrophic thermophilic microbial consortium // Sci. Rep. 2020. V. 10. P. 1–11.
Zayulina K.S., Prokofeva M.I., Elcheninov A.G., Voytova M.P., Novikov A.A., Kochetkova T.V., Kublanov I.V. Arenimonas fontis sp. nov., a bacterium isolated from Chukotka hot spring, Arctic region, Russia // Int. J. Syst. Evol. Microbiol. 2020a. V. 70. P. 2726–2731.
Zayulina K.S., Kochetkova T.V., Piunova U.E., Ziganshin R.H., Podosokorskaya O.A., Kublanov I.V. Novel hyperthermophilic crenarchaeon Thermofilum adornatum sp. nov. uses GH1, GH3, and two novel glycosidases for cellulose hydrolysis // Front. Microbiol. 2020b. V. 10. Art. 2972.
Zhao W., Zhang C.L., Romanek C.S., Wiegel J. Description of Caldalkalibacillus uzonensis sp. nov. and emended description of the genus Caldalkalibacillus // Int. J. Syst. Evol. Microbiol. 2008. V. 58. P. 1106–1108.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология