Микробиология, 2022, T. 91, № 6, стр. 742-748
Эндофитные грибы Pezicula radicicola в клубеньках актиноризных растений
Г. А. Кочкина a, *, Н. Е. Иванушкина a, И. П. Пинчук a, С. М. Озерская a
a Институт биохимии и физиологии микроорганизмов им. Г.К. Скрябина, ФИЦ Пущинский научный центр биологических исследований РАН
142290 Пущино, Россия
* E-mail: gak@dol.ru
Поступила в редакцию 13.05.2022
После доработки 16.06.2022
Принята к публикации 17.06.2022
- EDN: RMKMAG
- DOI: 10.31857/S0026365622600419
Аннотация
На основе анализа нуклеотидных последовательностей регионов ITS, фрагментов генов LSU рДНК и культурально-морфологических признаков определена видовая принадлежность 6 штаммов мицелиальных грибов, выделенных из клубеньков актиноризных растений субтропической зоны – кориарии миртолистной (Coriaria myrtifolia), восковницы восконосной (Myrica cerifera) и лоха колючего (Elaeagnus pungens). Изученные микромицеты идентифицированы как Pezicula radicicola. Представители этого вида впервые найдены в клубеньках актиноризных растений. Обсуждаются возможные функции и экологическая роль микромицетов вида Pezicula radicicola – микросимбионтов актиноризных растений.
Актиноризные растения представляют собой группу покрытосеменных растений, образующих корневые клубеньки, индуцируемые и населенные азотфиксирующими актиномицетами рода Frankia. Это преимущественно кустарниковые и древесные растения, которые входят в состав 24 родов, 8 семейств, 3 порядков и встречаются повсеместно. К ним, например, относятся широко распространенные в средней полосе ольха и облепиха, а также более редкие растения субтропический зоны. Способность образовывать азотфиксирующие клубеньки дает им конкурентное преимущество при освоении бедных и неплодородных почв за счет обогащения их азотом, что создает условия для дальнейшей колонизации этих почв другими видами растений (Ngom et al., 2016).
В последнее время произошли значительные изменения в представлениях о симбиозе между растениями и микроорганизмами. Сейчас уже ясно, что симбиотические ассоциации – многокомпонентные системы, в которых могут сосуществовать микроорганизмы, играющие существенную роль в функционировании симбиоза в целом (Khare et al., 2018; Tsiknia et al., 2021). Микромицеты и бактерии в этих ассоциациях составляют огромный по разнообразию и численности пул микроорганизмов. Как показывает молекулярно-генетический анализ микробных сообществ in situ, несоизмеримо большая часть эу- и прокариотных организмов, развивающихся в ассоциации с растениями, остается неисследованной или исследованной крайне слабо. Согласно предварительным оценкам, только около 1–2% всего спектра известных растений исследованы на предмет состава их эндофитов (Strobel, 2018). Среди наиболее изученных ассоциантов растений – микроорганизмы, привлекавшие внимание исследователей в связи с решением практических задач фитопатологии и сельского хозяйства.
Изучение грибов и бактерий, ассоциированных с актиноризными растениями, позволяет предположить, что одна из функций таких микроорганизмов в актиноризном симбиозе – деструкция многолетних симбиотических структур клубеньков и высвобождение пропагул актиномицетов рода Frankia для поддержания их инфекционного пула в почве (Ivanushkina et al., 1994). Однако возможно, что взаимовлияние микросимбионтов и, в частности, грибов в клубеньках значительно сложнее, чем кажется на первый взгляд.
В ходе эксперимента по изучению ассоциативных эндосимбионтов в клубеньках ольхи, развивающихся в растениях, искусственно инфицированных актиномицетами рода Frankia, нами было показано, что грибы отсутствовали в молодых клубеньках и появлялись лишь по мере развития последних. При этом состав грибов в клубеньках и в среде произрастания растения различался (Kochkina et al., 1994).
Изучение субтропических актиноризных растений, растущих на желтоземах, также подтвердило наличие специфического, по сравнению с почвенным, сообщества микромицетов внутри клубеньков. Для большинства выделенных микромицетов удалось определить видовую принадлежность (Ivanushkina et al., 1994).
Вместе с тем, была обнаружена большая группа грибов, которые не удалось идентифицировать по фенотипическим (культурально-морфологическим) признакам. Представители этой группы (штаммы ВКМ F-3184, ВКМ F-4853, ВКМ F-4854, ВКМ F-4855, ВКМ F-4856 и ВКМ F-4857) были помещены во Всероссийскую коллекцию микроорганизмов (ВКМ) и поддерживались как грибы с невыясненным таксономическим положением.
Целью настоящей работы было таксономическое изучение вышеупомянутых микромицетов с использованием классических фенотипических и молекулярных методов, а также оценка возможной роли микромицетов-эндофитов в микробном сообществе актиноризных клубеньков.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эндофитные грибы были выделены из клубеньков трех актиноризных растений, произрастающих в Сухумском Ботаническом саду (Грузия, СССР) на желтоземных почвах, ‒ лоха колючего (Elaeagnus pungens), восковницы восконосной (Myrica cerifera) и кориарии миртолистной (Coriaria myrtifolia) (Kochkina et al., 1994) (табл. 1).
Таблица 1.
Эндофитные грибы, изолированные из корневых клубеньков актиноризных растений (отбор проб произведен в августе 1990 г.)
| Штамм | Растение-хозяин | Номер GenBank |
|---|---|---|
| ВКМ F-4853 | Лох колючий (Elaeagnus pungens) | MT774097 |
| ВКМ F-4854 | MT774098 | |
| ВКМ F-4855 | Восковница восконосная (Myrica cerifera) | MT774099 |
| ВКМ F-4856 | MT774100 | |
| ВКМ F-3184 | Кориария миртолистная (Coriaria myrtifolia) | MT774096 |
| ВКМ F-4857 | MT774101 |
Изучение культурально-морфологических признаков грибов проводили на мальт-экстракт агаре (MEA), картофельно-глюкозном агаре (PDA), овсяном агаре (OA) при различных температурах (5, 15, 20, 25, 30, 37°С) в течение 6 нед. Оценивались макроскопические (морфология колоний, цвет, диаметр) и микроскопические (репродуктивные структуры, форма и размер конидий) признаки на 14‒30 сут роста. Цвет колоний определяли по специальным цветовым картам (Kornerup, Wanscher, 1978).
Для молекулярно-генетического изучения выделенных культур биомассу получали на среде PDA с целлофаном при 25°C. ДНК грибов выделяли с помощью набора Фитосорб (“Синтол”, Москва, Россия). Концентрацию ДНК измеряли с использованием флуориметра Qubit 3.0 (“Life Technologies”, Карлсбад, Калифорния, США).
Участок ДНК с увеличением длины секвенирования до 1500 п.н. (Vasilenko et al., 2018), включающий фрагмент гена малой субъединицы рРНК (SSU), регион ITS (ITS1, 5.8S рРНК, ITS2) и D1‒D3 домены большой субъединицы рРНК (LSU) всех изолятов амплифицировали с помощью полимеразной цепной реакции (ПЦР) с праймерами ITS1F (Gardes, Bruns, 1993) и LR5 (Tedersoo et al., 2008).
Реакции ПЦР проводили в 25 мкл конечного объема с 5 мкл шаблонной ДНК (концентрация 20‒70 мкг/мл), 0.5 мкл каждого праймера (10 пмоль/мкл), 1.5 мкл MgCl2 (25 мМ), 10 мкл мастер-микса (Реакционная смесь для ПЦР-РВ, “Синтол”, Москва, Россия) и 7.5 мкл ddH2O. Параметры термоциклера (“Bio-Rad”, Hercules, CA, США) были следующими: первый период денатурации при 95°C в течение 5 мин, затем 34 цикла денатурации при 95°C в течение 30 с, отжига при 53°C в течение 30 с и удлинения при 72°C в течение 1 мин 30 с. Окончательное удлинение при 72°C в течение 5 мин завершало реакцию. Ампликоны очищали с помощью набора Cleanup Standard (“Евроген”, Москва, Россия). Автоматизированное секвенирование ДНК проводилось компанией “Синтол’ (Москва, Россия) с использованием праймеров ITS1F, LR5, ITS3, ITS4, NL-3AOV.
Сборку последовательностей осуществляли с помощью программ BioEdit версии 7.1.11 (Hall, 1999), DNASTAR (SaqMan Pro v. 11.1.0). Все последовательности были депонированы в Генбанк (табл. 1).
Сходство последовательностей исследуемых культур и типовых/референтных штаммов (Chen et al., 2016) ближайших видов оценивали с использованием программы BLAST (NCBI). Филогенетическое древо строили по методу максимального правдоподобия (Maximum Likelihood, ML) на основе модели замен семейства GTR (General Time Reversible Model) (Nei, Kumar, 2000) c использованием программного обеспечения MEGA X (Kumar et al., 2018). Для филогенетических построений использовали последовательности ITS и LSU, доступные из GenBank для всех референтных штаммов (табл. 2), и полученные нами нуклеотидные последовательности для грибов из актиноризных клубеньков (табл. 1).
Таблица 2.
Штаммы видов Pezicula и последовательности ДНК, использованные для филогенетического анализа
| Вид | Номер штамма | Растение-хозяин | Номера в GenBank | |
|---|---|---|---|---|
| ITS | LSU | |||
| Neofabraea inaequalis | CBS 326.75, Тип | Chamaecyparis sp. | KR859081 | NG_069280 |
| Neofabraea malicorticis | CBS 122030, Тип | Malus sp. | KR859086 | NG_068983 |
| Pezicula acericola | CBS 239.38, Тип | Acer spicatum | KR859092 | KR858883 |
| Pezicula brunnea | CBS 120291, Тип | Gaultheria shallon | KR859103 | NG_067449 |
| Pezicula carpinea | CBS 923.96, Тип | Carpinus betulus | KR859108 | NG_067295 |
| Pezicula cinnamomea | CBS 184.50, Тип | Abies balsamea | KR859115 | KR858906 |
| Pezicula diversispora | CBS 185.50, Тип | Picea abies | KR859170 | KR858962 |
| Pezicula ericae | CBS 120290, Тип | Vaccinium membranaceum | KR859173 | NG_069888 |
| Pezicula heterochroma | CBS 199.46, Тип | Alnus crispa var. mollis | KR859210 | NG_067297 |
| Pezicula melanigena | CBS 898.97, Тип | Quercus petraea | KR859211 | NG_069281 |
| Pezicula microspora | CBS 124641, Тип | Berberis vulgaris | KR859212 | NG_067298 |
| Pezicula radicicola | CBS 640.94, Тип | Quercus robur | KR859236 | NG_069837 |
| Pezicula radicicola | CBS 681.83 | Quercus robur | KR859237 | KR859029 |
| Pezicula rhizophila | CBS 109839, Тип | Erica tetralix | KR859238 | NG_067301 |
| Pezicula sporulosa | CBS 224.96, Тип | Larix decidua | KR859261 | NG_069840 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Сравнение полученных последовательностей шести эндофитных штаммов грибов (табл. 1) показало, что они идентичны или практически идентичны (100 и 99.9%). По последовательностям ITS и LSU рДНК эндофиты были наиболее близки к организмам рода Pezicula (максимальный уровень сходства выявлен с Pezicula radicicola). Величины сходства между P. radicicola CBS 640.94 (типовой штамм вида) и штаммами из клубеньков по ITS (552 п.н.) достигали 99.82‒100% (отличия по одному нуклеотиду или полная идентичность) и по LSU (877 п.н.) – 99.88‒99.89%.
Сходство ITS исследуемых штаммов и другого наиболее близкого вида, P. melanigena, было 99.07‒99.28%, что ниже предложенной границы разделения видов ‒ 99.6% (Vu et al., 2019). Показатели сходства с другими видами были еще ниже.
На филогенетическом древе, построенном на основе комбинированных последовательностей ITS региона рДНК и фрагментов генов LSU рДНК, все изученные штаммы формировали монофилетическую группу в составе рода Pezicula, включающую также типовой штамм P. radicicola CBS 640.94, и обособлялись от организмов других видов (рис. 1).
Рис. 1.
Филогенетическое дерево изученных и типовых/референтных штаммов видов рода Pezicula на основе комбинированных последовательностей ITS и LSU ядерной рДНК, построенное по методу максимального правдоподобия (Maximum Likelihood). Шкала соответствует 0.005 замены нуклеотидов на позицию.

Результаты филогенетического анализа согласуются с данными фенотипического изучения культур. Известно (Kowalski, Bartnik, 1995; Verkley et al., 2003; Sigler et al., 2005), что для получения конидиогенных структур in vitro у изолятов Pezicula используется набор разнообразных условий культивирования (сред и температур). Установлено, что все шесть изученных штаммов росли в интервале температур от 5 до 30°С, при температуре 37°С рост отсутствовал.
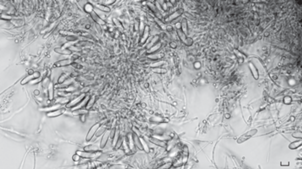
При оценке роста штаммов во всех изученных вариантах культивирования было отмечено, что культуральные признаки наиболее выражены на среде PDA при оптимальной для роста температуре культивирования 25°С. Диаметр колоний на PDA через 14 сут роста достигал: 76‒84 мм (ВКМ F-4854, ВКМ F-4855, ВКМ F-4857) и 60‒67 мм (ВКМ F-3184, ВКМ F-4853, ВКМ F-4856). Колонии плотные, войлочные, края ровные или лопастные, цвет варьировал от белого (3A1) до красноватого светло-коричневато-оранжевого (5C3), центры колоний были наиболее пигментированы. Цвет реверса варьировал от белого (3A1) до сернистого (4C5), оранжево-серого (5A2) и табачно-коричневого (5F6). Наиболее интенсивный цвет колоний был обнаружен у штаммов ВКМ F‑3184, ВКМ F-4853 и ВКМ F-4857. Ни один штамм не образовал плодовые тела в чистой культуре. Штамм ВКМ F-4857 остался стерильным независимо от условий культивирования. Пять штаммов сформировали макроконидии (19‒35 × 5.0‒ 7.5 мкм), типичные по форме и размерам для P. radicicola, как на одиночных конидиеносцах, так и в спородохиях разной формы ‒ от полукруглой до сферической (рис. 2). Микроконидии (3.5‒7.5 × × 1.5‒2.5 мкм), отмеченные при описании вида P. radicicola, образовались только у штаммов ВКМ F-4853 и ВКМ F-4854. Сетаподобные гифы, описанные у P. radicicola, удалось обнаружить только у штамма ВКМ F-3184, строму ‒ у штамма ВКМ F-4853.
Фенотипические характеристики изученных штаммов достаточно сильно различаются по отдельным признакам, таким как интенсивность окраски колоний, наличие/отсутствие конидий, сетозных (жестких, толстостенных, темноокрашенных) гиф и стромы, однако в целом соответствуют описанию P. radicicola (Kowalski, Bartnik, 1995). Ранее при описании видов рода Pezicula также отмечалась значительная фенотипическая вариабельность штаммов (Sigler et al., 2005).
Таким образом, на основании результатов сравнительного анализа последовательностей ITS, фрагментов LSU рДНК и фенотипических признаков изученные штаммы могут быть отнесены к виду Pezicula radicicola (T. Kowalski et C. Bartnik 1995) P.R. Johnston 2014, типовой штамм которого был выделен с корней дуба Quercus robur. В настоящее время грибы этого вида найдены на корнях осины (Wang et al., 2007), ясеня, ели (Stroheker et al., 2021) и других растений. Из клубеньков актиноризных растений субтропической зоны, где они являются одними из основных микосимбионтов, эти грибы были выделены впервые.
Для понимания экологической роли эндофитов P. radicicola в клубеньках была оценена встречаемость и доля представителей этого вида среди всех ассоциативных симбионтов, изученных нами ранее (Ivanushkina et al., 1994). Микобиота корневых клубеньков этих растений представлена анаморфами аскомицетов и базидиомицетов, а также большим количеством стерильного мицелия, как темного, так и светлоокрашенного. Большая часть всех идентифицированных штаммов принадлежала к видам рода Cylindrocarpon: C. didymum, C. effusum, C. obtusisporum и C. theobromicola. Хорошо известно, что представители этого рода являются патогенами растений (Capote et al., 2022), однако в нашем случае никаких видимых признаков заболевания обнаружено не было. Эндофиты вида P. radicicola оказались вторыми по обилию (отношению числа штаммов данного рода к общему числу выделенных штаммов) и первыми по частоте встречаемости (отношение числа образцов, в которых встретился таксон к общему числу образцов) среди всех выделенных из клубеньков грибов. Частота встречаемости P. radicicola оказалась выше 80%, что больше, чем у других ассоциативных микосимбионтов. Очень небольшое количество изолятов принадлежало родам Fusarium, Acremonium, Zalerion и некоторым другим (Ivanushkina et al., 1994).
Виды рода Pezicula обычно встречаются в умеренных регионах мира. Они могут быть сапротрофами на гниющей древесине и опаде, а также способны выступать как эндофитные грибы, локализуясь в разных частях растений.
Подробно спектр растений, из которых выделяются грибы этого рода, представлен в масштабном таксономическом труде, посвященном грибам рода Pezicula и близким родам (Chen et al., 2016), где было изучено 211 штаммов из крупнейшей коллекции грибов CBS (Collection of yeasts and filamentous fungi, The Westerdijk Fungal Biodiversity Institute). Показано, что около трети всех штаммов было изолировано из растений порядка Pinales (сосновые) – это сосна, ель, лиственница и пихта. В отделе Magnoliophyta (цветковые) наибольшее число штаммов было выделено из порядков Fagales (буковые) и Rosales (розоцветные) ‒ 16 и 14% соответственно. Штаммы выделяли с разных частей растений, но более всего ‒ из корневой системы. Авторы отметили, что некоторые виды Pezicula могут быть слабыми патогенами растений, вызывающими заболевания исключительно у ослабленных хозяев.
Выделенные нами штаммы связаны с растениями лох колючий (Rosales, розоцветные), восковница восконосная (Fagales, буковые) и кориария миртолистная (Cucurbitales, тыквоцветные). С растений последнего порядка штаммы этого рода были выделены впервые.
Роль этих грибов в клубеньках актиноризных растений до конца не изучена. Однако известно, что эндофиты растений продуцируют целый пул метаболитов с разнообразной структурой, которые активно участвуют в жизни растений и могут служить важнейшими ресурсами для разработки новых эффективных фунгицидов (Xu et al., 2019).
Грибы рода Pezicula ‒ неисчерпаемые источники разнообразных вторичных метаболитов, полезных для растений. Они образуют различные биологически-активные вещества (Schulz et al., 1995), например, эхинокандины, представляющие собой противогрибные липопептиды, элиминирующие фитопатогенные грибы и позволяющие осуществлять защиту растений, и при этом сами не испытывают влияния микоцида вследствие уникального генетического механизма саморезистентности (Yue et al., 2018). Кроме того, эти грибы продуцируют и другие антибиотики, такие как меллеин, микоризин, криптоспориопсин, криптокандин (Chen et al., 2016). Они синтезируют летучие соединения, активные в отношении фитопатогенных грибов Sclerotinia sclerotiorum и Setosphaeria turcica, ингибирующие их развитие (Zhang et al., 2018). Недавно был выделен штамм Pezicula sp., образующий целый спектр метаболитов, активных в отношении различных фитопатогенных грибов, особенно против Botrytis cinerea и Fulvia fulva, что переводит эти грибы в разряд перспективных для биотехнологии (Wang et al., 2014). В США получен патент на способ производства средств для профилактики и борьбы с грибными заболеваниями растений на основе сложных эфиров грибов Pezicula sp. (Xu et al., 2019).
Изучение грибов, ассоциированных с микоризами, показало, что грибы рода Pezicula встречаются в корневой системе микоризных растений наряду с Glomus и другими эндомикоризными грибами. Предполагается, что это также связано с продукцией вторичных метаболитов, активных в отношении фитопатогенов. Но это только одна из функций. Все большее число исследований показывает, что немикоризные эндофитные грибы могут снабжать растение-хозяина фосфором, потенциально играя ту физиологическую роль, которая свойственна грибам микоризы (Almario et al., 2017; Toju, Sato, 2018).
Было сделано предположение, что грибы-эндофиты, связанные с различными таксономическими группами растений в широком географическом диапазоне, могут опосредовать косвенные взаимодействия между арбускулярными микоризными и эктомикоризными видами растений через подземные мицелиальные связи, создавая целые “метасообщества” (Toju et al., 2018). В Японии с помощью метагеномного секвенирования были получены данные о корневых ассоциациях грибов с растениями на территории восьми хвойных лесов Японского архипелага, включающие информацию о 150 видах деревьев и более 8000 ОТЕ грибов. Детальный сетевой анализ полученных сведений позволил выявить среди тысяч видов “метакоммуникативные” узловые виды грибов (“hub” species), которые играют ключевую роль в синхронизации процессов масштаба “метасообщества” в растительно-микробных ассоциациях, способствуя росту растений-хозяев и устойчивости их к патогенам. Список “метакоммуникативных” эндофитных грибов не слишком велик, но включает грибы рода Pezicula (Toju et al., 2018).
Данный вывод согласуется с нашими исследованиями, которые показывают, что роль этих грибов в клубеньках актиноризных растений может не исчерпываться какой-то одной функцией и быть гораздо сложнее, чем взаимодействие растение‒гриб. Проведенное нами изучение взаимоотношений между грибами рода Pezicula и основным симбионтом актиноризных клубеньков актиномицетами рода Frankia указывает на мутуалистические отношения между этими микроорганизмами. Известно, что актиномицеты рода Frankia образуют розовые или красно-коричневые пигменты, идентифицированные как бензонафтан-хиноны, которые, как было показано, ингибируют рост некоторых грамположительных бактерий, дрожжей и грибов. Более детальное изучение состава антимикробных соединений, выделенных из штаммов Frankia (изоляты из Alnus incana и Pinus sylvestris), показало, что это антибиотические вещества кальцимицинового класса и пироэфирные ионофоры (Sarma et al., 2003). Нами показано, что пигмент, образованный актиномицетами Frankia, выделенными из тех же клубеньков, что и штаммы Pezicula radicicola, положительно повлиял на развитие последних, увеличивая скорость роста в среднем на 40%. В то же время рост грибов Fusarium oxysporum, которые не встречались в клубеньках, но были обнаружены в желтоземах вокруг них, значительно замедлялся (Kochkina et al., 1995). Очевидно, что можно говорить о селективном воздействии пигмента на грибы из разных мест обитания.
Этот факт может быть подтверждением избирательности клубеньков по отношению к микромицетам, что выражается в наличии в клубеньке специфического комплекса микроорганизмов, в котором впервые найденные грибы рода Pezicula могут играть значительную роль.
Список литературы
Almario J., Jeena G., Wunder J., Langen G., Zuccaro A., Coupland G., Buche M. Root-associated fungal microbiota of nonmycorrhizal Arabis alpine and its contribution to plant phosphorus nutrition // Proc. Natl. Acad. Sci. USA. 2017. V. 114. P. E9403–E9412. https://doi.org/10.1073/pnas.1710455114
Capote N., Del Rio M.A., Herencia J.F., Arroyo F.T. Molecular and pathogenic characterization of Cylindrocarpon-like anamorphs causing root and basal rot of almonds // Plants. 2022. V. 11. P. 984. https://doi.org/10.3390/plants11070984
Chen C., Verkley G.J.M., Sun G., Groenewald J.Z., Crous P.W. Redefining common endophytes and plant pathogens in Neofabraea, Pezicula and related genera // Fungal Biol. 2016. V. 120. P. 1291‒1322. https://doi.org/10.1016/j.funbio.2015.09.013
Gardes M., Bruns T.D. ITS primers with enhanced specificity for basidiomycetes – application to the identification of mycorrhizae and rusts // Mol. Ecol. 1993. V. 2. P. 113‒118. https://doi.org/10.1111/j.1365-294X.1993.tb00005.x
Hall T.A. BioEdit: a user-friendly biological sequence alignment editor and analysis program for Windows 95/98/NT // Nucl. Acid. S. 1999. V. 41. P. 95‒98.
Иванушкина Н.Е., Кочкина Г.А., Ступарь О.С., Павлова О.С., Полянская Л.М. Специфика микромицетных комплексов прикорневой зоны и клубеньков актиноризных растений // Микробиология. 1994. Т. 63. С. 909‒916.
Ivanushkina N.E., Kochkina G.A., Stupar O.S., Pavlova O.S., Polyanskaya L.M. Specific features of micromycete complexes of the rhizosphere and nodules of actinorhizal plants // Microbiology (Moscow). 1994. V. 63. P. 511‒515.
Khare E., Mishra J., Arora N.K. Multifaceted interactions between endophytes and plant: developments and prospects // Front. Microbiol. 2018. V. 9. P. 2732. https://doi.org/10.3389/fmicb.2018.02732
Kochkina G.A., Ivanushkina N.E. Effect of Frankia sp. pigment on growth of fungi from actinorhizal nodules // XII Congress of European Mycologists. Netherland, Wageningen. 1995. Abstracts. P. 31.
Кочкина Г.А., Иванушкина Н.Е., Павлова О.С., Полянская Л.М. Видовой состав микромицетов актиноризных клубеньков ольхи // Микробиология. 1994. Т. 63. С. 699‒705.
Kochkina G.A., Ivanushkina N.E., Pavlova O.S., Polyans-kaya L.M. Species composition of micromycetes of Alder actinorhizal nodules // Microbiology (Moscow). 1994. V. 63. P. 397‒400.
Kornerup A., Wanscher J.H. Methuen Handbook of Colour, 3rd edn. London: Eyre Methuen, 1978. 252 p.
Kowalski T., Bartnik C. Cryptosporiopsis radicicola sp. nov. from roots of Quercus robur // Mycol. Res. 1995. V. 99. P. 663‒666. https://doi.org/10.1016/S0953-7562(09)80524-8
Kumar S., Stecher G., Li M., Knyaz C., Tamura K. MEGA X: Molecular evolutionary genetics analysis across computing platforms // Mol. Biol. Evol. 2018. V. 35. P. 1547‒1549. https://doi.org/10.1093/molbev/msy096
Nei M., Kumar S. Molecular Evolution and Phylogenetics. Oxford University Press, N.Y., 2000. 352 p.
Ngom M., Oshone R., Diagne N., Cissoko M., Svistoonoff S., Tisa L.S., Laplaze L., Sy M.O., Champion A. Tolerance to environmental stress by the nitrogen-fixing actinobacterium Frankia and its role in actinorhizal plants adaptation // Symbiosis. 2016. V. 70. № 1‒3. P. 17–29. https://doi.org/10.1007/s13199-016-0396-9
Sarma K.H., Sarma B.K., Tiwari S.C. A novel calcimycin antibiotic from Gram-positive actinomycete Frankia microsymbiont // Curr. Sci. 2003. V. 85. P. 1401‒1403. www.researchgate.net/publication/255621183
Schulz B., Sucker J., Aust H.J., Krohn K., Ludewig K., Jones P.G., Döring D. Biologically active secondary metabolites of endophytic Pezicula species // Mycol. Res. 1995. V. 99. P. 1007–1015. https://doi.org/10.1016/S0953-7562(09)80766-1
Sigler L., Allan T., Lim S.R., Berch S., Berbee M. Two new Cryptosporiopsis species from roots of ericaceous hosts in western North America // Stud. Mycol. 2005. V. 53. P. 53‒62. https://doi.org/10.3114/sim.53.1.53
Strobel G. The emergence of endophytic microbes and their biological promise // J. Fungi. 2018. V. 4. P. 57. https://doi.org/10.3390/jof4020057
Stroheker S., Dubach V., Vogtli I., Sieber T.N. Investigating host preference of root endophytes of three European tree species, with a focus on members of the Phialocephala fortinii‒Acephala applanata species complex (PAC) // J. Fungi. 2021. V. 7. P. 317. https://doi.org/10.3390/jof7040317
Tedersoo L., Jairus T., Horton B.M., Abarenkov K., Suvi T., Saa I., Kõljalg U. Strong host preference of ectomycorrhizal fungi in a Tasmanian wet sclerophyll forest as revealed by DNA barcoding and taxon-specific primers // New Phytol. 2008. V. 180. P. 479‒490. https://doi.org/10.1111/j.1469-8137.2008.02561.x
Toju H., Sato H. Root-associated fungi shared between arbuscular mycorrhizal and ectomycorrhizal conifers in a temperate forest // Front. Microbiol. 2018. V. 9. P. 433. https://doi.org/10.3389/fmicb.2018.00433
Toju H., Tanabe A.S., Sato H. Network hubs in root-associated fungal metacommunities // Microbiome. 2018. V. 6. P. 116. https://doi.org/10.1186/s40168-018-0497-1
Tsiknia M., Tsikou D., Papadopoulou K., Ehaliotis C. Multi-species relationships in legume roots: From pairwise legume-symbiont interactions to the plant–microbiome–soil continuum // FEMS Microbiol. Ecol. 2021. V. 97. fiaa222. https://doi.org/10.1093/femsec/fiaa222
Vasilenko O., Ivanushkina N., Starodumova I., Kochkina G., Danilogorskaya A., Pinchuk I., Telkov M., Ozerskaya S. The advantage of the usage of the long “boosted” fungal barcode that includes ITS1/2 region and D1/D3 domain of the 26s large subunit ribosomal DNA // XXXVII Annual Meeting of the European Culture Collections’ Organisation. Conference Proceedings. Russia, Moscow. 2018. P. 126‒127.
Verkley G.J.M., Zijlstra J.D., Summerbell R.C., Berendse F. Phylogeny and taxonomy of root-inhabiting Cryptosporiopsis species, and C. rhizophila sp. nov., a fungus inhabiting roots of several Ericaceae // Mycol. Res. 2003. V. 107. P. 689‒698. https://doi.org/10.1017/S0953756203007883
Vu D., Groenewald M., De Vries M., Gehrmann T., Stielow B., Eberhardt U., Al-Hatmi A., Groenewald J.Z., Cardinali G., Houbraken J., Boekhout T., Crous P.W., Robert V., Verkley G.J.M. Large-scale generation and analysis of filamentous fungal DNA barcodes boosts coverage for kingdom fungi and reveals thresholds for fungal species and higher taxon delimitation // Stud. Mycol. 2019. V. 92. P. 135‒154. https://doi.org/10.1016/j.simyco.2018.05.001
Wang J., Wang G., Zhang Y., Zhen B., Zhang C., Wang L. Isolation and identification of an endophytic fungus Pezicula sp. in Forsythia viridissima and its secondary metabolites // World J. Microb. Biot. 2014. V. 30. P. 2639–2644. https://doi.org/10.1007/s11274-014-1686-0
Wang W., Tsuneda A., Gibas C., Currah R.S. Cryptosporiopsis species isolated from the roots of aspen in central Alberta: identification, morphology and interactions with the host, in vitro // Can. J. Bot. 2007. V. 85. P. 1214–1226. https://doi.org/10.1139/B07-086
Xu L., Duan X., Wei X., Xue J., Feng L., Wu P. Fungal trisaccharide ester compounds and use thereof in preparing agents for preventing and controlling plant fungal diseases. US Patent. № 0166835 A1. 2019.
Yue Q., Li Y., Chen L., Zhang X., Liu X., An Z., Bill G.F. Genomics driven discovery of a novel self-resistance mechanism in the echinocandin producing fungus Pezicula radicicola // Environ. Microbiol. 2018. V. 20. P. 3154–3167. https://doi.org/10.1111/1462-2920.14089
Zhang X.H., Zhang D.J., Liu J.L., Pan H.Y., Qin J.C., Zhang Y.H. Antifungal effects of volatile organic compounds from the endophytic fungus Cryptosporiopsis ericae Cc-HG-7 isolated from Coptis chinensis Franch. // Biocontrol. Sci. Techn. 2018. V. 28. P. 496‒508. https://doi.org/10.1080/09583157.2018.1460744
Дополнительные материалы отсутствуют.