Микробиология, 2023, T. 92, № 2, стр. 111-134
Трансформация метоксилированных ароматических соединений анаэробными микроорганизмами
М. А. Хомякова a, *, А. И. Слободкин a
a Институт микробиологии им. С.Н. Виноградского, Федеральный исследовательский центр
“Фундаментальные основы биотехнологии” Российской академии наук
119071 Москва, Россия
* E-mail: mary_klimova@mail.ru
Поступила в редакцию 26.09.2022
После доработки 11.10.2022
Принята к публикации 12.10.2022
- EDN: ATHNPM
- DOI: 10.31857/S0026365622600651
Аннотация
Метоксилированные ароматические соединения (МАС) широко распространены в разнообразных местообитаниях и являются компонентами лигнина – второго по распространению биополимера на Земле. В обзоре мы обобщаем исследования в области микробиологии, экологии и биохимии анаэробного катаболизма МАС у представителей Bacteria и Archaea. Нами проанализированы геномы 46 прокариот, анаэробно разлагающих МАС, на наличие генов О-деметилаз, СО-дегидрогеназы/ацетил-КоА синтазы, а также бензоил-КоА редуктаз, обусловливающих возможность метоксидотрофного роста. Обнаружено, что факультативные анаэробы, принадлежащие к филуму Pseudomonadota, не имеют известных генетических детерминант анаэробной О-деметилазной реакции и восстановления ароматического кольца. Таким образом, трансформация МАС анаэробными микроорганизмами осуществляется различными биохимическими механизмами и, вероятно, играет более значимую роль в глобальном цикле углерода, чем предполагалось ранее.
ПРИРОДНЫЕ ИСТОЧНИКИ МЕТОКСИЛИРОВАННЫХ АРОМАТИЧЕСКИХ СОЕДИНЕНИЙ
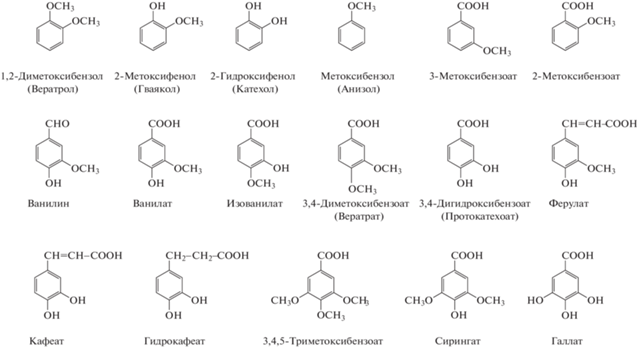
Метоксилированные ароматические соединения (МАС), представляющие собой ароматические эфиры, содержащие одну или несколько метоксильных групп (‒ОСН3), широко распространены в природе и являются компонентами лигнина, угля и нефти (рис. 1) (Hatcher, Clifford, 1997; Libes, 2009; Brunow, Lundquist, 2010).
Лигнин – один из основных компонентов фотосинтетической биомассы, составляет примерно 25% сухой массы сосудистых растений и считается вторым после целлюлозы биополимером по степени распространенности в природе (Zeikus, 1981). Характерной особенностью данного гетерополимера является наличие в нем метоксильных групп, содержание которых колеблется от 1.24 до 24.1% в зависимости от того, из какого растения или какой его части выделен лигнин (Vanholme et al., 2010). Так, в хвойной древесине и лиственных породах этот показатель самый высокий и составляет 14–24% (Venkatesagowda, Dekker, 2021). Ежегодно образуется большое количество лигнина ‒ в пределах 5‒36 × 108 тонн (Abdelaziz et al., 2016). Уголь представляет собой сложную смесь, состоящую из монолигнолов лигнина, которые часто замещены гидроксильными, метоксильными и карбоксильными группами. Особенно много метоксильных групп содержится в незрелом угле. Ароматические соединения являются также и компонентами неочищенной нефти, составляя 20‒43% (Libes, 2009).
АНАЭРОБНЫЕ МИКРООРГАНИЗМЫ, РАСТУЩИЕ ЗА СЧЕТ ИСПОЛЬЗОВАНИЯ МАС
Первые анаэробные микроорганизмы, растущие на МАС (метоксидотрофы) были описаны в 1981 г. в лаборатории под руководством Пфеннига. Эти изоляты, отнесенные к Acetobacterium woodii, были выделены из пресноводных илов и осадков сточных вод на ванилате, сирингате и триметоксициннамате в качестве субстратов (Bache, Pfennig, 1981). К настоящему времени известно более 40 видов культивируемых микроорганизмов, способных расти на МАС анаэробно. Большинство видов относятся к домену Bacteria (филумы Acidobacteriota, Bacillota, Chloroflexota, а также Pseudomonadota), и лишь в последние несколько лет была показана способность двух термофильных видов из домена Archaea к метоксидотрофному росту (Mayumi et al., 2016; Kurth et al., 2021) (табл. 1). Подавляющее же количество видов, метаболизирующих МАС в анаэробных условиях, относится к филуму Bacillota, они являются облигатными анаэробами и осуществляют ацетогенез.
Таблица 1.
Микроорганизмы, способные к анаэробному росту на МАС
| Микроорганизм, штамм | Источник выделения | Физиологические характеристики | Используемые МАС | Акцепторы электронов | Физиологическая группа | Ссылка |
|---|---|---|---|---|---|---|
| Acidobacteriota: Holophagae | ||||||
| Holophaga foetida TMBS4 | Анаэробный пресноводный ил | ОА, М, Н | ТМБ, СР, 5-гидроксиВА, ФР | * | Ацетоген | Liesack et. al., 1994 |
| Bacillota: Clostridia | ||||||
| Acetitomaculum ruminis 139B | Рубец жвачных животных | ОА, М, Н | СР, ФР, ВА | CO2 | Ацетоген | Greening, Leedle 1989 |
| Acetobacterium carbinolicum SyrA5 | Анаэробный осадок соленого фьорда | ОА, ПТ, Н | СР, ТМБ, ВА, 2-МФ, 3,4-ДМБ | СО2 | Ацетоген | Paarup et al., 2006 |
| “Acetobacterium dehalogenans” MC | Осадок сточных вод | ОА, М, Н | 3,4-ДМБ, 3-МФ, СР, 1,2-диметоксибензол (вератрол) | Фумарат (при росте на формиате), без акцептора | Ацетоген | Kaufmann et al., 1998а, Traunecker et al., 1991 |
| Acetobacterium malicum MuMEI | Пресноводный осадок канала | ОА, М, Н | 2-Метоксиэтанол, ТМБ, ТМЦ | СО2 | Ацетоген | Tanaka, Pfennig, 1988 |
| Acetobacterium woodii DSM 1030 | Пресноводный осадок и осадок сточных вод | ОА, М, Н | Более 10 МАС | СО2 | Ацетоген | Bache, Pfennig 1981 |
| Alkalibacter mobilis M17 DMB | Ил со дна озера | ОА, М, умеренный алкалофил | ВА, 3,4-ДМБ | СО2 | Ацетоген | Khomyakova et al., 2021 |
| Alkalibaculum bacchi CP11 | Почва с животноводческой фермы | ОА, М, умеренный алкалофил | 4-МБ, 3-МФ, 3-МЦ, 4-МС, 5-МС, СР | СО2 | Ацетоген | Allen et al., 2010 |
| Alkalibaculum sporogenes M08 DMB | Наземный грязевой вулкан | ОА, М, умеренный алкалофил | 3,4-ДМБ, 2-МФ | СО2 | Ацетоген | Khomyakova et al., 2020b |
| Blautia producta U-1 (Peptostreptococcus productus) | Осадок сточных вод | ОА, М, Н | ВА, СР, ФР | CO2 | Ацетоген | Lorowitz et al., 1984; Parekh et al., 1992 |
| “Butyribacterium methylotrophicum” DSM 3468 | Сточные воды | ОА, М, Н | ТМБ, СР, ВА | CO2 | Ацетоген | Zeikus et al., 1980 |
| Calorimonas adulescens A05MB | Горячий источник | ОА, Т, Н | 2-МБ, 3,4-ДМБ | СО2 | Ацетоген, бродильщик | Khomyakova et al., 2020a |
| Catenibacillus scindens CG19-1 | Пищеварительный тракт человека | ОА, М, Н | ФР (ингибирует рост) | Без акцептора | Бродильщик | Braune, Blaut, 2018 |
| Clostridium aceticum DSM 1496 | Грязь | ОА, М, Н | 10 МАС | СО2 | Ацетоген | Lux, Drake, 1992 |
| Cl. formicaceticum DSM 92 | Очистные сооружения | ОА, М, Н | Более 10 МАС | СО2 | Ацетоген | Lux, Drake, 1992 |
| Cl. methoxybenzovorans SR3 | Метаногенный биореактор | ОА, М, Н | Более 30 МАС | СО2 | Ацетоген | Mechichi et al., 1999b |
| Cl. scatologenes SL1 | Осадок из кислотного пруда угольной шахты | ОА, М, ацидофил | ВА, ФР | СО2 | Ацетоген | Küsel et al., 2000 |
| Desulfitobacterium hafniense* DCB-2 | Осадок сточных вод | ОА, М, Н | ВА, СР, изоВА | Тиосульфат, сульфит, нитрат, Fe(III), фумарат | Восстановительное дехлорирование | Christiansen, Ahring, 1996; Studenik et al., 2012 |
| D. chlororespirans DSM 11544 | Компостная почва | ОА, М, Н | ВА, СР, изоВА | Тиосульфат, сульфит, S0, нитрат, Fe(III), фумарат | Восстановительное дехлорирование | Sanford et al., 1996; Mingo et al., 2014 |
| D. dehalogenans DSM 9161 | Пресноводный озерный осадок | ОА, М, Н | ВА, СР, изоВА | Тиосульфат, нитрат, Fe(III), фумарат | Восстановительное дехлорирование | Utkin et al., 1994; Mingo et al., 2014 |
| Desulfofundulus thermobenzoicus TSB (Desulfotomaculum thermobenzoicum) | Осадок термофильного метантенка | ОА, Т, умеренный галофил | 3- МБ, 4-МБ, ВА, СР, ТМБ | Сульфат, сульфит, тиосульфат, нитрат | Сульфатредуктор | Tasaki et al., 1992 |
| Desulfoscipio (Desulfotomaculum) gibsoniae Groll | Черный ил из пресноводной канавы | ОА, М, Н | Ванилиновый спирт, ВА, ВН, ФР, анизол | Сульфат, сульфит, тиосульфат, без акцептора | Сульфатредуктор | Kuever et al., 1999 |
| Desulfosporosinus (Desulfotomaculum) orientis DSM 765 | Почва | ОА, М, Н | ТМБ | Сульфат, тиосульфат, без акцептора | Сульфатредуктор, ацетоген | Stackebrandt et al., 1997 |
| Eubacterium limosum ATCC 8486 | Пищеварительный тракт человека | ОА, М, Н | 3-МБ, ФР, ВА | CO2 | Ацетоген | DeWeerd et al., 1988; Chen et al., 2016 |
| Eubacterium callanderi FD | Анаэробный ферментер | ОА, М, Н | ФР, синапат, СР, ВА, ВН, ТМЦ | CO2 | Ацетоген | Mountfort et al., 1988 |
| Koleobacter methoxysyntrophicus NRmbB1 | Подземное нефтяное месторождение | ОА, Т, Н | ТМБ | ** | Бродильщик, синтроф | Sakamoto et al., 2021 |
| Moorella thermoacetica DSM 2955 (Cl. thermoaceticum = Cl. thermoautotrophicum) | Конский навоз | ОА, Т, Н | Более 20 МАС | Нитрат, нитрит, тиосульфат, ДМСО, без акцептора | Ацетоген | Daniel et al., 1991; Pierce et al., 2008 |
| Oxobacter (Clostridium) pfennigii V5-2 | Жидкость из рубца быка | ОА, М, Н | ВН, ФР, СР, ТМБ | СО2 | Ацетоген | Krumholz, Bryant, 1985 |
| Papillibacter cinnamivorans CIN1 | Анаэробный ферментер | ОА, М, Н | 3-МЦ, 4-МЦ | Без акцептора | Бродильщик | Defnoun et al., 2000 |
| Parasporobacterium paucivorans SYR1 | Эвтрофный пресноводный пруд | ОА, М, Н | СР, ТМБ | * | Ацетоген/ бродильщик | Lomans et al., 2001 |
| Sporobacter termitidis DSM 10068 | Пищеварительный тракт термитов | ОА, М, Н | ТМЦ, синапат, 3,4-диМЦ, ТМБ, ФР, СР, ВА | * | Ацетоген | Grech-Mora et al., 1996 |
| Sporobacterium olearium SR1 | Анаэробный метаногенный ферментер | ОА, М, Н | 10 МАС | СО2 | Ацетоген/ бродильщик | Mechichi et al., 1999a |
| Syntrophococcus sucromutans DSM 3224 | Содержимое рубца быка | ОА, М, Н | ТМБ, СР, ВА, ВН, ФР | ** | Синтроф | Krumholz, Bryant, 1986 |
| Thermacetogenium phaeum DSM 12270 | Термофильный анаэробный метаногенный реактор | ОА, Т, Н | ТМБ, СР, ВА | ** | Ацетоген, синтроф | Hattori et al., 2000 |
| Bacillota: Negativicutes | ||||||
| Acetonema longum DSM 6540 | Содержимое кишечника термита | ОА, М, Н | ТМБ | CO2 | Ацетоген | Kane, Breznak, 1991 |
| Sporomusa malonica DSM 5090 | Пресноводный анаэробный седимент | ОА, М, Н | ТМЦ | CO2 | Ацетоген | Dehning et al., 1989 |
| Sporomusa ovata DSM 2662 | Силос из листьев сахарной свеклы | ОА, М, Н | 10 МАС | CO2 | Ацетоген | Stupperich et al., 1993; Möller et al., 1984 |
| Sporomusa silvacetica DSM 10669 | Лесная почва | ОА, М, Н | ФР, ВА | CO2 | Ацетоген | Kuhner et al., 1997 |
| Sporomusa termitida DSM 4440 | Содержимое кишечника термита | ОА, М, Н | ТМБ | СО2 | Ацетоген | Brezhak et al., 1988 |
| Chloroflexota: Dehalococcoidia | ||||||
| Dehalococcoides mccartyi 195 | Анаэробный ферментер | ОА, М, Н | 4-Бромо-3,5-ДМБ | Галогенированные органические соединения | Органогалогенидное дыхание | Löffler et al., 2013 |
| Pseudomonadota: Alphaproteobacteria | ||||||
| Rhodomicrobium vannielii ATCC 17100 | Грязь | ФА, T, Н | ВА, СР | Кислород, без акцептора | Фототроф | Wright, Madigan, 1991 |
| Rhodopseudomonas palustris CGA001 | Грязь | ФА, М, Н | ФР | Тиосульфат, кислород, без акцептора | Фототроф | Harwood, Gibson, 1988 |
| Pseudomonadota: Betaproteobacteria | ||||||
| Achromobacter denitrificans (Alcaligenes xylosoxidans subsp. Denitrificans) LMG1231 | Почва | ФА, М, Н | ВА, 3,4-ДМБ, 2-МФ, 3-МБ, ФР, ТМЦ, ТМБ | Нитрат, кислород | Нитрат-редуктор/ Аэроб | Taylor, 1983 |
| Pseudomonadota: Gammaproteobacteria | ||||||
| Acinetobacter johnsonii FZ-5 | Морской осадок | ФА, М, Н | ВА | Кислород, без акцептора | Аэроб | Lu et al., 2022 |
| Enterobacter cloacae ATCC 35929 | Метаногенная культура, разлагающая ферулат | ФА, М , Н | ФР | Кислород, селенит, без акцептора | Аэроб | Grbić-Galić, 1985 |
| Klebsiella oxytoca FZ-8 | Морской осадок | ФА, М, Н умеренный галотолерантный | ВА | Кислород, без акцептора | Аэроб | Lu et al., 2022 |
| Pseudomonadota: Deltaproteobacteria | ||||||
| Desulfomonile tiedjei DCB-1 | Осадок сточных вод | ОА, М, Н | Метил 3-МБ, метил 4-МБ, ВА, изоВА, 3-МС | Сульфат, сульфит, тиосульфат, без акцептора | Дегалогенирующий сульфат-редуктор | DeWeerd et al., 1990 |
| “Euryarchaeota”: Archaeoglobi | ||||||
| Archaeoglobus fulgidus VC-16 | Мелководная морская гидротерма | ОА, Т, Н | 2,6-диМФ, метоксигидрохинон, 2-МБ | Сульфат | Сульфат-редуктор | Welte et al., 2021 |
| “Euryarchaeota”: “Methanomicrobia” | ||||||
| Methermicoccus shengliensis ZC-1 | Нефтяное месторождение | ОА, Т, Н | 35 MAC | ‒ | Метаноген | Mayumi et al., 2016; Kurth et al., 2021 |
Сокращения: ТМБ ‒ 3,4,5-триметоксибензоат, МБ ‒ метоксибензоат, ДМБ ‒ диметоксибензоат, ТМЦ ‒ 3,4,5-триметоксициннамат, МЦ ‒ метоксициннамат, МС ‒ метоксисалицилат, ФР ‒ ферулат, ВА ‒ ванилат, ВН ‒ ванилин, СР ‒ сирингат, МФ ‒ метоксифенол, ДМСО ‒ диметилсульфоксид, ОА ‒ облигатный анаэроб, ФА ‒ факультативный анаэроб, М ‒ мезофил, Н ‒ нейтрофил, Т ‒ термофил, ПТ ‒ психротолерантный. * Сульфид выступает в качестве акцептора метильной группы, в данном случае в качестве продуктов помимо ацетата образуются диметилсульфид и метантиол. ** Трансформация МАС возможна в условиях синтрофного роста с метаногеном.
Как правило, ацетогены не способны разрушать ароматическое кольцо и лишь отщепляют от МАС метильную группу, что приводит к образованию ацетата и соответствующих гидроксилированных продуктов, выделяемых в среду культивирования. Примерами являются Sporomusa termitida, Moorella thermoacetica, Acetobacterium woodii и многие другие представители, для которых показано образование гидроксилированных продуктов наряду с ацетатом (Bache, Pfennig, 1981; Breznak et al., 1988).
Однако несколько ацетогенов из класса Clostridia, таких как Sporobacter termitidis, Sporobacterium olearium, Parasporobacterium paucivorans, а также единственный метоксидотрофный представитель филума Acidobacteriota ‒ Holophagа foetida, способны в присутствии сульфида в качестве акцептора метильной группы разрывать ароматическое кольцо и превращать МАС в ацетат, метантиол или диметилсульфид во флороглюциновом пути (Liesack et al., 1994; Grech-Mora et al., 1996; Mechichi et al., 1999a; Lomans et al., 2001).
Показана способность к росту на МАС у нескольких представителей филума Pseudomonadota в классах Alpha-, Beta-, Gamma- и Deltaproteobacteria. Все эти виды, за исключением Desulfomonile tiedjei, принадлежащего к классу Deltaproteobacteria, являются факультативными анаэробами, и могут использовать помимо кислорода другие акцепторы электронов (нитрат, соединения серы) или же расти без акцептора электронов, сбраживая метоксилированные соединения. Более того, в данной группе представлены весьма разнообразные в физиологическом отношении микроорганизмы, метаболизирующие преимущественно ванилат или ферулат, и способные к аноксигенному фотосинтезу (Rhodopseudomonas и Rhodomicrobium), дегалогенированию (Desulfomonile tiedjei), а также относящиеся к условно патогенной микрофлоре (Enterobacter, Acinetobacter, Klebsiella, Achromobacter). Таким образом, хотя способность к анаэробному росту на МАС выявлена преимущественно у ацетогенов, изоляты, проявляющие аналогичные свойства, были найдены и среди других физиологических групп анаэробов, включая денитрифицирующие, фотосинтезирующие, синтрофные, сульфатредуцирующие.
МАС могут играть различную роль в энергетическом метаболизме анаэробных бактерий. Так, Desulfitobacterium hafniense способен к анаэробному росту на ванилате или сирингате, используя их в качестве доноров электронов в комбинации с фумаратом, играющим роль акцептора (Christiansen, Ahring, 1996). Syntrophococcus sucromutans при росте на углеводах использует метоксилированные бензоаты в качестве акцепторов электронов, превращая их в соответствующие гидроксибензоаты (Krumholz, Bryant, 1986). Недавно описанный Koleobacter methoxysyntrophicus способен расти на 3,4,5-триметоксибензоате только синтрофно в присутствии метаногена Methanothermobacter thermautotrophicus (Sakamoto et al., 2020). Механизм разложения 3,4,5-триметоксибензоата у данного микроорганизма неизвестен. Для Dehalococcoides mccartyi – представителя еще одного бактериального филума Chloroflexota, – показан рост на 4-бромо-3,5-диметоксибензоате, однако продуктом органогалогенидного дыхания являлся 3,5-диметоксибензоат, что свидетельствует о неспособности микроба метаболизировать МАС, а имеет место лишь отщепление брома (Löffler et al., 2013).
Единственные культивируемые представители домена Archaea, для которых экспериментально доказана способность расти на МАС, относятся к классам Archaeoglobi (Archaeoglobus fulgidus) и “Methanomicrobia” (Methermicoccus shengliensis). Сульфатредуктор Archaeoglobus fulgidus растет на ограниченном количестве МАС, превращая их в гидроксильные производные и параллельно восстанавливая сульфат до сульфида. Метаноген Methermicoccus schengliensis способен к росту на 35 различных МАС, разлагая их до CH4 и CO2 в процессе “метоксидотрофного” метаногенеза, который будет подробно рассмотрен ниже.
Безусловно, список видов, метаболизирующих МАС, нельзя назвать полным, поскольку большинство анаэробных бактерий не проверяли на способность использовать метоксилированные ароматические соединения. Многие виды рода Clostridium, Acetobacterium, а также Sporomusa ovata, Sporobacterium olearium, Methermicoccus shengliensis имеют удивительно широкий спектр используемых МАС, тогда как другие, даже в пределах одного рода (например, Cl. scatologenes, Sporomusa silvacetica), проявляют ограниченность в использовании МАС. В связи с этим при описании новых видов желательно включать несколько разных субстратов для проверки способности новых изолятов к их использованию. Концентрация субстратов также является важным параметром для выделения и проверки роста. Некоторые изоляты растут на 5‒10 мМ МАС. Однако ароматические соединения, главным образом фенольные и углеводороды, проявляют цитотоксический эффект, поскольку они способны растворяться в биологических мембранах, что увеличивает текучесть последних, а это, в свою очередь, приводит к потере ионов, АТФ и других клеточных метаболитов. Более того, диссипация протонной движущей силы и денатурация мембранных белков (дыхательных комплексов и транспортеров питательных веществ) приводит к серьезным энергетическим проблемам. В связи с их токсичностью правильнее было бы использовать в начальных экспериментах более низкие концентрации ароматических субстратов – от 2 мМ для ароматических кислот и 0.1‒0.5 мМ для производных катехола (Frazer, 1994).
Наиболее распространенными субстратами для культивирования метоксидотрофов являются ванилат, ферулат, сирингат, а также 3,4-диметоксибензоат и 3,4,5-триметоксибензоат. Ферулат (феруловая кислота) представляет собой широко распространенное в природе фенольное соединение и рассматривается как возобновляемое химическое сырье для биокаталитического превращения в другие полезные ароматические соединения в промышленном масштабе (Rosazza et al., 1995). 3,4-Диметоксибензоат и 3,4,5-триметоксибензоат являются метоксилированными предшественниками протокатехоата и галлата – центральных интермедиатов превращения ароматических соединений; разложение ванилата и сирингата также приводит к образованию данных фенольных соединений (Schink et al., 2000; Boll, 2005).
Среди известных анаэробных метоксидотрофов преобладают мезофилы, предпочитающие для роста условия c нейтральными значениями рН. Однако выявлено несколько термофильных представителей (Calorimonas adulescens, Desulfofundulus thermobenzoicus, Koleobacter methoxysyntrophicus, Moorella thermoacetica, Thermacetogenium phaeum, Rhodomicrobium vannielii и Methermicoccus shengliensis), гипертермофильный Archaeoglobus fulgidus, психротолерантный Acetobacterium carbinolicum, а также алкалофилы родов Alkalibacter и Alkalibaculum, ацидофильный ацетоген Clostridium scatologenes и несколько галотолерантных видов (Klebsiella oxytoca, Desulfofundulus thermobenzoicus).
Микроорганизмы, способные к анаэробному росту на МАС, выделены из разнообразных мест обитаний естественного и антропогенного происхождения, включая осадки сточных вод (виды Acetobacterium, D. hafniense, Blautia producta и “Butyribacterium methylotrophicum”, Desulfomonile tiedjei), пищеварительные тракты различных организмов (из крупного рогатого скота ‒ Acetitomaculum ruminis, Oxobacter pfennigii, Syntrophococcus sucromutans, из человека ‒ Catenibacillus scindens, Eubacterium limosum, из термитов ‒ Sporobacter termitidis, Acetonema longum, Sporomusa termitida), анаэробные ферментеры, морские и пресноводные осадки, почвы, гидротермальные источники (Calorimonas adulescens) и нефтяные месторождения (Koleobacter methoxysyntrophicus, Methermicoccus shengliensis) (табл. 1).
ЭНЗИМАТИЧЕСКИЕ СИСТЕМЫ ДЕМЕТИЛИРОВАНИЯ АНАЭРОБНЫХ ПРОКАРИОТ
Деметилирование, т.е. отщепление метильной группы (‒СН3), является ключевой стадией разнообразных биологических процессов, включая эпигенетическую регуляцию, репарацию ДНК, деградацию токсинов и метаболизм биоактивных метаболитов. Данный процесс катализируют ферменты деметилазы, которые могут принадлежать к нескольким различным семействам белков, включая цитохромы P450, ФАД-зависимые оксидазы, белки домена Риске и другие белки с негемовыми центрами (Hagel, Facchini, 2010). О‑деметилазы разрывают эфирную связь O‒C, в отличие от N-деметилаз, разрывающих N‒C связь.
Общая характеристика О-деметилаз
По отношению к кислороду выделяют два основных типа О-деметилаз. Аэробная ванилат-зависимая О-деметилаза (VanAВ) относится к классу IA оксигеназ и состоит из двух железосерных белков – оксигеназы и редуктазы, содержащих [2Fe‒2S] редокс кластера (Masai et al., 2007). Эта система поглощает кислород и восстановительные эквиваленты в форме НАДН, и, в результате деметилирования, помимо основного продукта – преимущественно протокатеховой кислоты, образуется также формальдегид, H2O и НАД+. Другая ферментная система относится к тетрагидрофолат-зависимым ароматическим О-деметилазам анаэробных микроорганимов, включает, как правило, четыре компонента и впервые была выявлена у ацетогенов (Bache, Pfennig, 1981; Kaufmann et al., 1997). В этом случае происходит расщепление С‒О связи МАС, скорее всего, в результате гетеролитического разрыва, который характерен для переноса метильных групп (Ragsdayle, 2008). Далее метильная группа с помощью многокомпонентной метилтрансферазной системы у ацетогенов переносится на тетрагидрофолат (ТГФ), а у архей ‒ на тетрагидрометаноптерин (ТГМП) (Stupperich, Konle, 1993; Mayumi et аl., 2016; Kurth et al., 2020) (табл. 2).
Таблица 2.
Охарактеризованные анаэробные О-деметилазы метоксидотрофных прокариот
| Микроорганизм | Донор ‒СН3 группы | Конечный
акцептор ‒СН3 группы |
Белки метилтрансферазного комплекса | Особенности О-деметилазы и ее генетических детерминант | Тип метаболизма микроорганизма | Ссылки |
|---|---|---|---|---|---|---|
| Acetobacterium dehalogenans | Ванилат | ТГФ | OdmABCD | 4-хкомпонентная белковая система; МТI содержит Zn. Генный кластер состоит из трех генов, ген АФ расположен отдельно |
Ацетогенез | Kaufmann et al., 1998; Schilhabel et al., 2009 |
| Вератрат (3,4-ДМБ), гваякол (2-МФ), m-гваякол (3-МФ) | ТГФ | VdmABCD | Engelmann et al., 2001 | |||
| Moorella thermoacetica | Ванилат, дикамба | ТГФ | MtvABC | 3-хкомпонентная белковая система, отсутствует AФ; МТI не содержит Zn. Генный кластер состоит из трех генов |
Ацетогенез | Naidu, Ragsdale, 2001 |
| Eubacterium limosum | Секоизоларициресинол | ТГФ | ELI_2003–ELI_2005 и ELI_0370 (AФ) | 4-хкомпонентная белковая система; Zn-содержащая МТI. Генный кластер состоит из трех генов, ген АФ расположен отдельно |
Ацетогенез | Chen et al., 2016 |
| Desulfitobacterium hafniense | Ванилат, изованилат, гваякол, сирингат, CH3Cl | ТГФ | Dhaf_4610–Dhaf_4612 и Dhaf_2573 (АФ) | 4-хкомпонентная белковая система; MTI не содержит Zn. Генный кластер состоит из трех генов, ген АФ расположен отдельно |
Восстановительное дегалогенирование | Studenik et al., 2012 |
| Archaeoglobus fulgidus | Гваякол (2-МФ) | ТГМП | MtoABCD | О-деметилазный кластер включает 8 генов, в т.ч. ген транспортного белка Mfs; АФ расположен в опероне | Сульфатредукция | Welte et al., 2021 |
| Methermicoccus shengliensis | О-анисовая кислота (2-МБ), 3,4,5-ТМБ | ТГМП/КоМ | MtoAB1B2CD | О-деметилазный кластер состоит из пяти генов, АФ расположен в опероне | Метаногенез | Kurth et al., 2021 |
Классическая метилтрансферазная система состоит из нескольких компонентов (рис. 2). Субстрат-специфичная метилтрансфераза I (MTI = = компонент В) расщепляет С‒О связь метилированного субстрата; кобаламин-связывающий корриноидный белок (CoP, или компонент С) обеспечивает супернуклеофильное состояние Со(I) витамина В12, который действует как промежуточный акцептор метильной группы. Далее СоР взаимодействует с метилтрансферазой II (МТII = компонент А) для переноса метильной группы к конечному акцептору.
Рис. 2.
Схема О-деметилирования у использующих МАС микроорганизмов (модифицирована по Mingo et al., 2014): MTI ‒ ванилат: корриноидный белок метилтрансфераза; МТII – метил-корриноидный белок: тетрагидрофолат метилтрансфераза; [Co I–III] корриноидный белок в соответствующей степени окисления кобаламина В12; АФ – активирующий фермент; ТГФ ‒ тетрагидрофолат; ТГМП ‒ тетрагидрометаноптерин; КоМ ‒ кофермент М. Рассмотрены компоненты О-деметилазных ферментных систем: MtvABC – из Moorella thermoacetica; MtoABCD – из термофильных архей; OdmABCD и VdmABCD – ванилат-зависимая и вератрол-зависимая О-деметилазы соответственно из Acetobacterium dehalogenans; MtaABC – метанол-КоМ метилтрансфераза из Methanosarcina barkerii, имеющая сходное с О-деметилазой строение и катализирующая перенос метильной группы с метанола на КоМ.

Поскольку корриноиды очень реакционноспособны в своем активном состоянии Co(I), они спонтанно самоокисляются до неактивного состояния Co(II). Как только происходит окислительная инактивация, B12-зависимым метилтрансферазам требуется восстановительная активация для повторного входа в каталитический цикл. Восстановление Co(II) P до активного состояния Со(I) катализируется у О-деметилазы большинства ацетогенов четвертым компонентом системы – активирующим ферментом (АФ = = компонент D) (Kaufmann et al., 1998b).
О-деметилазы анаэробных бактерий
Получение препаратов нативных О-деметилаз оказалось сложной задачей, в первую очередь, из-за их чувствительности к кислороду, а также склонности связываться с клеточными мембранами (Ander, Eriksson, 1978). Попытки измерить активность О-деметилаз или провести их фракционирование также вызывало проблемы в связи с влиянием ТГФ и АТФ (Berman, Frazer, 1992). Кауфманну и соавторам удалось выделить и охарактеризовать первую ванилат-зависимую О-деметилазу у Acetobacterium dehalogenans лишь в конце 90-х гг., почти 30 лет спустя после того, как были описаны первые аэробные О-деметилазы (Bernhardt et al., 1971; Kaufmann et al., 1997, 1998a, 1998b). К настоящему времени выделено несколько О‑деметилаз из ацетогенных бактерий Moorella thermoacetica, Acetobacterium dehalogenans и Eubacterium limosum, а также из осуществляющего органогалогенидное дыхание Desulfitobacterium hafniense, и их сравнение показывает, что в структурном плане О-деметилазы отличаются лишь незначительно (Kaufmann et al., 1997; Naidu, Ragsdale, 2001; Studenik et al., 2012; Chen et al., 2016) (табл. 2).
Метилтрансфераза I, ответственная за субстратную специфичность, является, как правило, мономером с молекулярной массой 36‒56 кДа и может содержать ион Zn2+. У проанализированных бактерий МТI значительно отличаются в отношении спектров субстратов и, как следствие, по аминокислотным последовательностям, что установлено даже для ванилат- и вератрол-зависимой О-деметилазы из одного микроорганизма (Schilhabel et al., 2009). Скорее всего, субстрат-связывающий центр находится на N-конце метилтрансферазы, тогда как каталитический центр располагается на С-конце аминокислотной цепи в составе β-бочонка (TIM barrel), что подтверждается косвенно наличием цинка в этой же части фермента (Studenik et al., 2011). Однако, в отличие от О-деметилаз, выделенных из A. dehalogenans, МТI из M. thermoacеtica и D. hafniense не содержат цинк, и добавление Zn2+ к реакционной смеси не стимулирует активность фермента (табл. 2) (Naidu, Ragsdale, 2001; Studenik et al., 2012). У E. limosum МТI является Zn-зависимой, и, помимо данного лиганда, в составе каталитического центра выявлены аминокислотные остатки Glu166, Cys222 и Cys268 (Chen et al., 2016).
Метилтрансфераза II представляет собой гомодимер с молекулярной массой одной субъединицы около 28‒30 кДа (Kaufmann et al., 1997). N‑терминальная аминокислотная последовательность МТII из M. thermoacetica обладает высокой степенью сходства с хорошо изученной у данного микроба метил-ТГФ- и В12-зависимой метилтрансферазой (AcsE), которая укладывается в β‑бочонок, содержащий связывающий центр птерина (Naidu, Ragsdale, 2001). У E. limosum выявлено три аминокислоты (Asp-76, Asn-200 и Arg-208), которые предположительно связывают ТГФ посредством водородных связей в составе MTII (Chen et al., 2016). В то же время положение ключевых остатков активного центра у MTII из D. hafniense слегка изменено (Sjuts et al., 2015).
Корриноидный белок СоР у A. dehalogenans представляет собой мономер с молекулярной массой 26 кДа (Kauffman et al., 1997), у других изученных бактерий размеры фермента колеблются в аналогичных пределах 22‒28 кДа. Данные по третичной структуре получены в результате клонирования гена СоР из D. hafniense в E. coli (Sjuts et al., 2013). Корриноидный белок содержит N‑концевой α-спиральный домен и С-концевой домен с кобаламином, в котором к центральному атому кобальта координируется гистидин (Sjuts et al., 2013).
Последний компонент О-деметилазной системы – активирующий фермент АФ, является крупным тримерным белком с идентичными субъединицами массой около 67 кДа каждая (Kauffman et al., 1997). Восстановление неактивного [CoII]-CоP в активный [CoI]-CoP в реакционной среде происходит в присутствии АТФ и искуственного донора цитрата титана(III) (Siebert et al., 2005). В составе АФ нескольких ацетогенов выявлен [2Fe‒2S] кластер, а также четыре аминокислотных остатка цистеина в близких положениях, которые могут быть связаны c данным кластером в составе активного центра (Schilhabel et al., 2009; Chen et al., 2016). Гидролиз АТФ активирующим ферментом увеличивает окислительно-восстановительный потенциал связанного с белком кобаламина, что позволяет осуществить перенос электронов от ферредоксин/флаводоксин-зависимых гидрохинонов через [2Fe‒2S] кластер активирующего фермента на неактивный Со(II) (Dürichen et al., 2019). В то же время у M. thermo-acetica АФ отсутствует, т.е. О-деметилаза является трехкомпонентной системой; в данном случае система восстановительной активации не требуется (Naidu, Ragsdale, 2001).
Гены, кодирующие МТI, CoP и МТII, у всех этих микроорганизмов организованы в оперон, тогда как АФ всегда расположен отдельно (Schilhabel et al., 2009; Studenik et al., 2012; Chen et al., 2016). В большинстве случаев в геноме находится несколько оперонов О-деметилаз; например, в геноме D. hafniense выявлено не меньше 17 оперонов, способных кодировать корриноид-зависимые метилтрансферазные системы, причем все они содержат не менее двух генов, кодирующих MTI, МТII и/или CoP, а в большинстве случаев представлены и три гена (Studenik et al., 2012). При этом только продукт единственного кодирующего АФ гена отвечает за восстановление различных О-деметилазных корриноидных белков (Schilhabel et al., 2009; Studenik et al., 2012). Установлено, что АФ группируется с металл-связывающими белками группы COG3894, гены которых представлены в многочисленных геномах анаэробных микроорганизмов. Проверка доменной структуры и генетический анализ этих ортологов показали, что они являются восстановительными активазами для корриноидных белков (RACE белки, reductive activases for corrinoid enzymes), таких как СО-дегидрогеназа/ацетил-КоА синтаза и анаэробные метилтрансферазы (Schilhabel et al., 2009).
Белковые последовательности СоР и МТII являются консервативными. MTI, напротив, имеет низкую степень сходства белковых последовательностей, демонстрируя структурные различия между ферментами, которые необходимы для распознавания различных субстратов. Поскольку отщепляющая метильную группу часть метилтрансферазной системы MTI содержит субстрат-связывающий сайт, и так как для связывания требуется специфичность, микроорганизм может иметь несколько индуцибельных MTI-кодирующих генов. Например, в геноме A. woodii содержится 23 различных MTI-гомолога, и только субстраты для нескольких из них известны в настоящее время (Lechtenfeld et al., 2018).
О-деметилазы анаэробных архей
Способность к трансформации МАС археями долгое время была неизвестна. Лишь в 2016 г. было установлено, что термофильный метаноген Methermicoccus shengliensis способен использовать значительное количество (около 35) МАС, образуя из метоксильной группы метан. В ходе этого “метоксидотрофного метаногенеза”, метильная группа, входящая в состав ‒OCH3, отщепляется в процессе О-деметилирования и используется для образования ацетил-КоА, который впоследствии диспропорционируется до CH4 и CO2 (Mayumi et al., 2016).
В состав О-деметилазы M. shengliensis входит две метилтрансферазы МТI (MtoB1 и MtoB2) аналогичного молекулярного веса (48 и 47 кДа) с невысоким сходством по аминокислотным последовательностям, что свидетельствует о различной субстратной специфичности этих белков и позволяет метаногену использовать больше разнообразных субстратов.
Содержащий кобальт корриноидный белок СоР имеет молекулярную массу 22 кДа, и связывание метильной группы происходит в каталитическом N-терминальном В12-связывающем центре. О-деметилаза из M. shengliensis является четырехкомпонентной и содержит АФ (MtoD) с рассчитанной молекулярной массой около 68 кДа. Наличие в составе активирующего фермента N-концевого [2Fe‒2S] связывающего центра – особенность, более характерная для ацетогенов, чем метаногенов, у которых в составе АФ находятся два С-терминальных [4Fe‒4S] кластера (Schilhabel et al., 2009; Kurth et al., 2021).
Главное отличие от классических О-деметилаз ацетогенов заключается в происхождении МТII, катализирующей дальнейший перенос метильной группы ‒СН3 с корриноидного белка. У M. shengliensis МТII, переносящая метильную группу с СоР в метаногенный путь, является MtrH-метилтрансферазой, ген которой не имеет гомологов среди известных МТII и связан скорее с метил-тетрагидрометаноптерин:КоМ метилтрансферазной субъединицей Н из неметаногенных архей (например, Archaeoglobus fulgidus), а также метилотрофных бактерий Desulfitobacterium hafniense и Acetobacterium woodii, т.е. организмов, которые не образуют и не используют КоМ (Wang et al., 2015). В противоположность росту на метаноле, ‒СН3 группа данной метилтрансферазой вероятнее всего переносится сначала на ТГМП, а затем уже на КоМ (табл. 2) (Kurth et al., 2021). Это, наиболее вероятно, приводит к нестандартному ходу метаногенеза, который извлекает энергию скорее за счет переноса метильной группы (Mtr, метил-ТГ-МП:КоМ метилтрансфераза), чем за счет переноса электронов (ре-окисления F420H2), характерного для метилотрофного метаногенеза (Kurth et al., 2021).
Гены, вовлеченные в метоксидотрофный рост M. shengliensis, также найдены у других культивируемых архей, таких как A. fulgidus, Methanolacinia petrolearia и Methanothermobacter tenebrarum, что свидетельствует о более широком распространении метоксидотрофного метаболизма, чем предполагалось ранее. Более того, в 2021 году показана способность гипертермофильной археи A. fulgidus к метоксидотрофному метаболизму (Welte et al., 2021). Отсутствие роста на метаноле подтверждает, что A. fulgidus не содержит гомологичные метилтрансферазные системы MtaABC для его превращения. В отличие от M. schengliensis, A. fulgidus превращает метильную группу в СО2, а не в СН4, в пути Вуда‒Льюнгдаля. А. fulgidus может расти на МАС, таких как 2-метоксифенол, 2,6-диметоксифенол, метоксигидрохинон и 2-метоксибензоат, осуществляя их неполное окисление до гидроксилированных производных. О-деметилазная ферментная система у данного организма представлена MtoABCD белками, которые обеспечивают перенос СН3-группы через корриноидный белок предположительно на ТГМП (Welte et al., 2021). С1-переносчиком в пути Вуда‒Льюнгдаля у A. fulgidus скорее является ТГМП, а не ТГФ, что отличает метоксидотрофные археи от ацетогенных бактерий, но, в то же время, подтверждает гипотезу о том, что MtoA переносит метильную группу на ТГМП. Образовавшийся метил-ТГМП может затем окисляться до CO2 через путь Вуда‒Льюнгдаля, генерируя восстановительные эквиваленты, которые предоставляют электроны для восстановления сульфата непосредственно через ферредоксин или косвенно через восстановленный менахинон.
О-деметилазная система в геномах метоксидотрофных архей кодируется генными кластерами, структурно отличающимися от оперонов ацетогенных бактерий. Так, О-деметилазу M. shengliensis кодирует кластер из пяти генов mtoAB1B2CD (Kurth et al., 2021), к тому же АФ расположен в одном опероне с остальными генами О-деметилазы, что нехарактерно для ацетогенных бактерий (Schilhabel et al., 2009). У A. fulgidus кластер генов, отвечающих за метоксидотрофный метаболизм, состоит из восьми генов и включает гены, кодирующие две МТI, два СоР, АФ, располагающийся рядом с МТII, а также несколько транспортных белков Mfs, отвечающих за импорт МАС в клетку и последующее выделение гидроксилированных продуктов во внешнюю среду (Welte et al., 2021). Несмотря на различия в структуре оперонов, их компоненты, тем не менее, проявляют высокую степень гомологии с компонентами бактериальной О-деметилазной системы MtvABC из M. thermoacetica, и их механизм действия, вероятнее всего, идентичен (Pierce et al., 2008). Более того, МТI и СоР, по-видимому, были приобретены археями в результате горизонтального переноса генов от бактерий (Kurth et al., 2021).
С помощью биоинформатического анализа было установлено, что и другие археи, такие как представители некультивируемых филумов Batharchaeota, Lokiarchaeota, Korarchaeota, Helarchaeota, Verstraetearchaeota и Nezhaarchaeota, содержат в своих геномах mtoABC аналоги (Kurth et al., 2021).
Филум Bathyarchaeota распространен повсеместно и имеет большую численность в морских осадках. Помимо предполагаемой способности батиархей к ацетогенезу и сбраживанию различных органических субстратов недавно был продемонстрирован рост Bathyarchaeota на лигнине (Yu et al., 2018). Представители подгруппы 8 батиархей способны осуществлять превращение метоксилированных групп лигнина в ацетил-КоА, используя метильную ветвь пути Вуда‒Льюнгдаля (Yu et al., 2018). Нашим коллективом также установлено значительное увеличение относительной численности представителей филума Batharchaeota при росте в накопительных культурах, субстратом для которых являются метоксилированные ароматические соединения, что подтверждает способность представителей Bathyarchaeota к метоксидотрофному росту (неопубликованные данные). Lokiarchaeota, возможно, также имеют потенциал к разложению лигнина (Yin et al., 2020). Таким образом, наличие mto-гомологов у всех вышеперечисленных групп архей позволяет выдвинуть гипотезу об их способности разлагать МАС.
БИОХИМИЧЕСКИЕ ПУТИ РАСЩЕПЛЕНИЯ БЕНЗОЛЬНОГО КОЛЬЦА В АНАЭРОБНЫХ УСЛОВИЯХ
В анаэробных условиях ароматическое кольцо подвергается восстановлению с последующим гидролитическим расщеплением образовавшейся алициклической структуры. Стратегия анаэробных бактерий заключается в превращении многочисленных низкомолекулярных ароматических ростовых субстратов в несколько ключевых интермедиатов, а именно в бензоил-КоА, флороглюцин (1,3,5-тригидроксибензол), резорцин (1,3-тригидроксибензол) и гидроксигидрохинон (1,2,4-тригидроксибензол), которые являются субстратами для соответствующих деароматических редуктаз (Harwood et al., 1999; Schink et al., 2000). Последние три соединения содержат ОН-группы в мета-положении, которое значительно ослабляет ароматические свойства интермедиата. Вследствие этого, двухэлектронное восстановление данных соединений может осуществляться в экзергонических реакциях с обычными физиологическими восстановителями. НАД(Ф)Н (в случае флороглюцина и гидроксигидрохинона) или ферредоксин (в случае резорцина) служат донорами электронов для соответствующих редуктаз (Haddock, Ferry, 1989; Kluge et al., 1990; Reichenbecher, Schink, 1997). Напротив, из-за высокой стабильности бензольного кольца, бензоил-КоА трудно восстановить физиологическими восстановителями. Единственный известный фермент, способный к такому восстановлению – бензоил-КоА редуктаза, – использует не только низкопотенциальный донор электронов ферредоксин, но, кроме того, связывает восстановление кольца со стехиометрическим гидролизом АТФ (Boll, Fuchs, 1995). Бензоил-КоА редуктаза (Bcr) является единственным чувствительным к кислороду ферментом из бензоил-КоА пути. К настоящему времени описано два класса бензоил-КоА редуктаз – АТФ-зависимая (Класс I), характерная для факультативных анаэробов, и АТФ-независимая, выявленная у облигатно анаэробных микроорганизмов (Класс II) (Boll, Fuchs, 1995; Holmes et al., 2012). Оба класса катализируют восстановление бензоил-КоА до неароматического продукта циклогекса-1,5-диен-1-карбоксил-КоА (1,5-диеноил-КоА) за счет последовательного переноса единичных электронов и протонов с крайне низким окислительно-восстановительным потенциалом. В процессе АТФ-зависимого разрушения ароматического кольца восстановление бензоил-КоА может быть сопряжено с гидролизом АТФ, катализируемым бензоил-КоА редуктазой класса I (Boll, Fuchs, 1995; Boll, 2005). Бензоил-КоА редуктаза класса I из денитрифицирующей бактерии Thauera aromatica представляет собой нативный белок весом около 170 кДа, состоящий из четырех различных субъединиц с молекулярными массами 48, 45, 38 и 32 кДа, кодируемых генами bcrABCD (Boll, Fuchs, 1995).
Субъединицы BcrAD образуют электронный активирующий модуль, содержащий [4Fe–4S] кластер, в котором электроны от восстановленного ферредоксина активируются в результате гидролиза АТФ (1 молекула АТФ на 1 е–) и переносятся на субстрат-активирующий модуль BcrBC, содержащий два [4Fe–4S] кластера, а также бензоил-КоА связывающий сайт (Boll et al., 2000). Ген другой бензоил-КоА редуктазы bzd-типа (bzdNOPQ) выявлен у нескольких представителей рода Azoarcus (López Barragán et al., 2004). Данный ген проявлял 43% сходства по аминокислотной последовательности с бензоил-КоА редуктазами из T. aromatica и Rhodopseudomonas palustris. Структура оперона, отвечающего за анаэробное разложение бензоата у T. aromatica и Azoarcus evansii, значительно различается, хотя оба вида довольно близки согласно анализу 16S рРНК сиквенсов (Harwood et al., 1999). Оба филогенетически различных подкласса бензоил-КоА редуктаз Thauera- и Azoarcus-типов являются железосерными белками и состоят из АТФ-гидролизующего модуля активации электронов и модуля восстановления бензоил-КоА. Белки BzdP и BzdQ из гипертермофильной археи Ferroglobus placidus организованы в гетеродимер с молекулярным весом 73 кДа, содержат [4Fe‒4S] кластер и образуют электронный активационный модуль, гомологичный активационному модулю 2-гидроксиацил-КоА дегидратаз, вовлеченных в сбраживание аминокислот, а не BcrAD из T. aromatica (Schmid et al., 2016).
У Geobacter metallireducens, осуществлявшего анаэробное железное дыхание на ароматических субстратах, была выделена и охарактеризована АТФ-независимая бензоил-КоА редуктаза класса II (Wischgoll et al., 2005). Фермент состоит из восьми различных субъединиц (BamBCDEFGHI), которые содержат [4Fe–4S] кластеры, вольфрам, цинк, флавин и селеноцистеин в качестве кофакторов (Wischgoll et al., 2005). Субъединица BamB содержит активный сайт с вольфрамово-птериновым кофактором и [4Fe–4S] кластером. Гены, кодирующие данные белки, были выявлены в геномах большинcтва облигатно анаэробных Fe(III)-восстанавливающих, сульфатредуцирующих и ферментирующих бактерий, способных использовать ароматические соединения для роста (Löffler et al., 2011).
Несмотря на различный субъединичный состав, бензоил-КоА редуктазы обоих классов образуют один и тот же неароматический продукт – 1,5-диеноил-КоА, последующие пути трансформации которого катализируются сходными ферментами у всех анаэробных бактерий, метаболизирующих ароматические соединения (Wischgoll et al., 2005; Löffler et al., 2011), что приводит в итоге к образованию трех молекул ацетил-КоА и CО2.
ЭКОЛОГИЧЕСКИЕ И ПРИКЛАДНЫЕ АСПЕКТЫ АНАЭРОБНОЙ МЕТОКСИДОТРОФИИ
Анаэробные метоксидотрофные микроорганизмы играют важную роль в ряде природных процессов, таких как разложение лигина, метоксидотрофный метаногенез, образование летучих серных соединений и разложение ксенобиотиков.
Разложение лигнина
Микробные процессы разложения лигнина вызывают большой интерес в самых разных областях, начиная от общеэкологических вопросов минерализации углерода до биоэнергетической инженерии и выяснения микробных путей превращения угля (Lehmann, Kleber, 2015; Welte, 2016). Переработка биомассы и целлюлозно-бумажная промышленность обеспечивают около 6.2 × 107 и 5 × 107 тонн лигнина соответственно (Zakzeski, 2010). Лигнин, как составная часть древесины, наиболее трудноутилизируемый отход, который образуется при ее химической переработке на целлюлозно-бумажных и гидролизных предприятиях и является довольно токсичным при захоронении на полигонах. В то же время лигнин выступает как перспективное сырье для производства биотоплива и биохимикатов, благодаря высокому соотношению углерода и кислорода в его составе. Считается, что в анаэробных условиях лигнин инертен, но он, по-видимому, может подвергаться незначительной деградации в некоторых анаэробных местообитаниях за счет факультативных анаэробов. Следует отметить, что разложение модифицированного лигнина происходит эффективнее по сравнению с натуральным, что может быть связано с его более высокой степенью метоксилирования (Ahring et al., 2015). Мономеры, образующиеся при деградации лигнина, могут быть легко метаболизированы и полностью разлагаются анаэробно, причем главным объектом реакции их анаэробного разложения являются метоксильные группы. Наиболее интенсивно микробиологами исследовались МАС, структурно связанные с функциональными группами лигнина, такие как ванилат, ферулат, сирингат и их гидроксильные производные ‒ протокатехоат, кафеат и галлат (рис. 1). Для связи фундаментальных знаний с развивающейся в последнее время областью биовалоризации лигнина, сотрудниками Университета г. Лунд (Швеция), создана свободно доступная база данных по микробному катаболизму лигнина eLignin Microbial Database (www.elignindatabase.com), в которой каталогизированы данные по микроорганизмам-лигнинолитикам, ароматическим субстратам, в т.ч. метоксилированным, а также метаболическим путям их превращения (Brink et al., 2019). Поскольку аэробное разложение лигнина и его составляющих выходит за рамки данного обзора, более подробную информацию по указанной тематике можно найти в следующих источниках (Abdelaziz et al., 2016; Venkatesagowda, Dekker, 2021).
Метоксидотрофный метаногенез
Метан является вторым по значимости парниковым газом на Земле, его выделение в атмосферу достигает 600 × 109 кг в год (Conrad, 2009). Около 70% метана образуется метаногенными археями, что подтверждает важность метаногенеза в глобальном цикле углерода (Conrad, 2009). Метаногены используют очень ограниченный набор субстратов для образования СН4, основными из которых являются ацетат, H2/CO2, метанол и метиламины. Недавно перечень метаногенных субстратов был расширен вследствие открытия прямого использования МАС метаногеном Methermicoccus shengliensis (Mayumi et al., 2016). Метоксидотрофный метаногенез устанавливает ранее неизвестную связь между С1-метаболизмом и анаэробным разложением инертных ароматических соединений. Факт обнаружения метоксидотрофного метаногенеза, наряду с широким распространением МАС, позволяет предположить, что роль этого процесса в глобальном цикле углерода, особенно в подземной биосфере, недооценена (Welte, 2016). Микробные сообщества глубинной биосферы участвуют в превращении растительного вещества в уголь, причем наличие МАС влияет на количество образовавшегося в угольных пластах метана (Lloyd et al., 2021). Особенно много метоксильных групп содержится в незрелом угле, что повышает возможность метоксидотрофного метаногенеза. И хотя ранее предполагали, что для превращения соединений угля в метан требуются метаболические взаимодействия между несколькими микроорганизмами, способность M. shengliensis осуществлять метоксидотрофный метаногенез в одиночку, минуя полную микробную трофическую цепь, может оказывать существенное влияние на образование метана в угольных пластах, которое составляет 7% мировой годовой продукции СН4 (Ritter et al., 2015). Метан, образующийся из угля, может стать экономической альтернативой сланцевому газу, который добывается посредством гидроразрыва пластов. Несмотря на довольно небольшие объемы образования метана из угля в настоящее время, понимание биологических механизмов метоксидотрофного метаногенеза в дальнейшем может облегчить задачу его добычи (Welte, 2016). Сейчас известно лишь два штамма метоксидотрофных метаногенов. Оба принадлежат к виду Methermicoccus shengliensis, являются термофилами и выделены из пластовых вод нефтяных месторождений в Китае и Японии. Метоксидотрофный штамм Methermicoccus shengliensis AmaM был изначально выделен на метаноле и затем протестирован на способность к использованию МАС (Mayumi et al., 2016). Этой же исследовательской группой был продемонстрирован метоксидотрофный метаногенез и для типового штамма M. shengliensis ZC-1T (Cheng et al., 2007), выделенного ранее. Кажется весьма вероятным, что должны существовать и другие метаногенные археи, использующие МАС, однако пока попытки прямого выделения представителей этой физиологической группы не привели к положительным результатам.
Образование летучих серных соединений
В отличие от гомоацетогенов, которые переносят метильную группу с метоксилированного ароматического соединения на СО2 с образованием ацетата, некоторые микроорганизмы могут осуществлять реакцию трансметилирования между МАС и неорганическим сульфидом с образованием диметилсульфида (ДМС) и метантиола (МТ) (Bak et al., 1992). Эти два продукта представляют собой летучие органические серные соединения, играющие важную роль в процессах глобального потепления, кислотных осадках, а также в глобальном цикле серы. Биогенная эмиссия метилированных серных соединений, образующихся в осадочных породах и почвах, является наиболее важным природным источником серы в атмосфере. В противоположность морским экосистемам, где МТ и ДМС образуются, главным образом, из диметилсульфониопропионата (осмолит многих морских водорослей и галофитных растений), в пресноводных экосистемах летучие органические серные соединения образуются преимущественно в результате метилирования сульфида в процессе анаэробного О-деметилирования МАС и, в гораздо меньшей степени, в процессе разложения серосодержащих аминокислот (Lomans et al., 2002). Значительная часть образованных МТ и ДМС в дальнейшем могут подвергаться анаэробному разложению метилотрофными метаногенами (Lomans et al., 1999).
Разложение ксенобиотиков
Многочисленные химикаты и ксенобиотики содержат метоксильные функциональные группы. Эти О-метиловые эфиры весьма стабильны во многих химических процессах, и основной начальной реакцией при их анаэробном разложении является отщепление защитной ‒СН3 группы, поскольку фенольные продукты легче подвергаются последующей деградации (Azzena et al., 1992). Эксперименты in vitro c О-деметилазой, выделенной из Sporomusa ovata, показали ее способность деметилировать такие субстраты, как метоксинафтол, метоксифуран и фторанизолы (Stupperich et al., 1996). Анаэробное О-деметилирование является важным этапом и в биотрансформации хлорсодержащих метоксикатехолов. Хлоровератролы и хлорогваяколы являются ксенобиотиками, которые попадают в сточные воды в результате химического отбеливания целлюлозы. Установлено, что ацетогены A. woodii и E. limosum могут осуществлять О-деметилирование ряда хлорогваяколов без последующего дехлорирования образующихся хлорокатехолов (Häggblom et al., 1993). Другое хлорсодержащее органическое соединение ‒ широко распространенный гербицид дикамба (3,6-дихлор-2-метоксибензоат) – является субстратом для Moorella thermoacetica и О-деметилируется до 3,6-дихлорсалицилата (Naidu, Ragsdale, 2001). Дикамба представляет собой синтетический аналог природного растительного гормона индол-3-уксусной кислоты и используется в качестве селективного гербицида для ряда сельскохозяйственных культур в борьбе с сорняками. В 2007 году фирма Monsanto вставила один из компонентов трехкомпонентной системы O-деметилазы из облигатного аэроба Stenotrophomonas (Pseudomonas) maltophilia, в геном сои и несколько широколиственных хлебных злаков, сделав их устойчивыми к дикамбе. Однако это не исключает дальнейший поиск новых биотехнологических подходов и делает гены О-деметилаз из ацетогенов перспективными кандидатами для решения проблемы селективности сельскохозяйственных культур в отношении гербицидов.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ГЕНОМОВ АНАЭРОБНЫХ МИКРООРГАНИЗМОВ, ИСПОЛЬЗУЮЩИХ МАС
В данной работе мы провели сравнительный анализ доступных полных геномов микроорганизмов, способных метаболизировать МАС анаэробно (46 геномов). Объектом анализа было наличие и организация генов О-деметилазы (МТI и MTII, CоP и активирующий фермент), бензоил-КоА редуктазы различных типов (BcrCBAD, BzdQ и BamB), а также СО-дегидрогеназы/ацетил-КоА синтазы, ключевого фермента пути Вуда‒Льюнгдаля (табл. 3). Исследование проводилось с использованием биоинформатических методов, предоставляемых интернет-сервисами GenBank (https://www.ncbi.nlm.nih.gov/) и IMG/M (https:// img.jgi.doe.gov).
Таблица 3.
Гены ферментов системы О-деметилазы и восстановления ароматического кольца у культивируемых анаэробных прокариот, способных к анаэробному росту на МАС
| Микроорганизм, штамм | Номер генома в GenBank | Гены О-деметилазы | Комплекс
СО-дегидрогеназа/ ацетил-КоА синтаза |
Кластер бензоил-КоА редуктазы BcrCBAD | Бензоил-КоА редуктаза BzdQ | Бензоил-КоА редуктаза BamB |
|---|---|---|---|---|---|---|
| Acetonema longum DSM 6540 | PRJNA66109 | Несколько кластеров | + | Неполный кластер из двух генов | ‒ | ‒ |
| Acetitomaculum ruminis DSM 5522 | PRJEB17106 | Кластер | + | ‒ | + | ‒ |
| “Acetobacterium dehalogenans” DSM 11527 | PRJNA165505 | Несколько кластеров | + | ‒ | Несколько генов | Несколько генов |
| Acetobacterium malicum DER-2019 | PRJNA586871 | Несколько кластеров | + | Кластер из трех генов | Несколько генов | Несколько генов |
| Acetobacterium woodii DSM 1030 | PRJNA60713 | Несколько кластеров | + | Неполный кластер из двух генов | Несколько генов | + |
| Acinetobacter johnsonii DSM 6963 | PRJDB1754 | ‒ | ‒ | ‒ | ‒ | ‒ |
| Achromobacter denitrificans LMG1231 | PRJEB37567 | ‒ | ‒ | ‒ | ‒ | ‒ |
| Alkalibacter mobilis M17 DMB | PRJNA676094 | Несколько кластеров | + | ‒ | + | Несколько генов |
| Alkalibaculum bacchi DSM 22112 | PRJNA456024 | Не в кластере | + | ‒ | Несколько генов | + |
| Alkalibaculum sporogenes M08 DMB | PRJNA578292 | Не в кластере | + | ‒ | Несколько генов | Несколько генов |
| Archaeoglobus fulgidus DSM 4304 | PRJNA104 | Кластер | + | Кластер из трех генов | + | Несколько генов |
| Blautia producta ATCC 27340 | PRJNA169801 | Кластер | + | Кластер из трех генов | Несколько генов | ‒ |
| “Butyribacterium methylotrophicum” DSM 3468 | PRJNA342396 | Не в кластере | + | ‒ | + | Несколько генов |
| Calorimonas adulescens A05MB | PRJNA560519 | Не в кластере | + | Неполный кластер из двух генов | Несколько генов | + |
| Catenibacillus scindens DSM 106146 | PRJNA632145 | МТII отсутствует, остальные гены не в кластере | ‒ | Неполный кластер из двух генов | Несколько генов | ‒ |
| Cl. aceticum DSM 1496 | PRJNA263904 | Несколько кластеров | + | Неполный кластер из двух генов | Несколько генов | Несколько генов |
| Cl. formicaceticum DSM 92 | PRJNA380994 | Кластер | + | Неполный кластер из двух генов | Несколько генов | + |
| Cl. methoxybenzovorans SR3 | PRJNA187237 | ‒ | Неполный кластер | Кластер из трех генов | Несколько генов | ‒ |
| Cl. scatologenes ATCC 25775 | PRJNA265889 | Кластер | + | Кластер из трех генов | Несколько генов | ‒ |
| Desulfitobacterium hafniense DCB-2 | PRJNA205 | Несколько кластеров | + | Кластер из трех генов | Несколько генов | + |
| D. chlororespirans DSM 11544 | PRJEB18450 | Кластер | + | Кластер из трех генов | Несколько генов | + |
| D. dehalogenans ATCC 51507 | PRJNA61181 | Кластер | + | Кластер из трех генов | Несколько генов | + |
| Desulfofundulus thermobenzoicus DSM 14055 | PRJNA579145 | Кластер | Неполный кластер | Неполный кластер из двух генов | Несколько генов | Несколько генов |
| Desulfoscipio gibsoniae DSM 7213 | PRJNA59873 | Кластер | + | Неполный кластер из двух генов | + | Несколько генов |
| Desulfosporosinus DSM 765 | PRJNA66191 | Кластер | + | Кластер из трех генов | Несколько генов | Несколько генов |
| Desulfomonile tiedjei DSM 6799 | PRJNA43133 | Несколько кластеров | + | Неполный кластер из двух генов | + | Несколько генов |
| Dehalococcoides mccartyi 195 | PRJNA214 | ‒ | ‒ | ‒ | + | ‒ |
| Enterobacter cloacae ATCC 13047 | PRJNA45793 | ‒ | ‒ | ‒ | ‒ | ‒ |
| Eubacterium limosum ATCC 8486 | PRJNA270275 | Кластер | + | ‒ | + | Несколько генов |
| Eubacterium callanderi FD | PRJEB18374 | Не в кластере | + | ‒ | + | Несколько генов |
| Holophaga foetida DSM 6591 | PRJNA53485 | Не в кластере | + | ‒ | + | ‒ |
| Klebsiella oxytoca DSM 5175 | PRJNA543274 | ‒ | ‒ | Неполный кластер из двух генов | + | ‒ |
| Koleobacter methoxysyntrophicus NRmbB1 | PRJNA645406 | Отсутствует МТI, остальные гены в кластере | ‒ | Неполный кластер из двух генов | Несколько генов | Несколько генов |
| Methermicoccus shengliensis DSM 18856 | PRJNA235052 | Кластер | + | ‒ | ‒ | ‒ |
| Moorella thermoacetica DSM 2955 | PRJNA292083 | Несколько кластеров | + | Кластер из трех генов | Несколько генов | Несколько генов |
| Oxobacter pfennigii DSM 3222 | PRJNA297260 | Несколько кластеров | + | Неполный кластер из двух генов | Несколько генов | Несколько генов |
| Papillibacter cinnamivorans DSM 12816 | PRJEB20323 | ‒ | ‒ | Полный кластер из четырех генов | Несколько генов | ‒ |
| Parasporobacterium paucivorans DSM 15970 | PRJEB18299 | Кластер | + | ‒ | + | ‒ |
| Rhodomicrobium vannielii ATCC 17100 | PRJNA38253 | ‒ | ‒ | Полный кластер из четырех генов | + | ‒ |
| Rhodopseudomonas palustris RCB100 | PRJNA683609 | ‒ | ‒ | Полный кластер из четырех генов | ‒ | ‒ |
| Sporobacter termitidis DSM 10068 | PRJEB18258 | Не в кластере | + | ‒ | Несколько генов | + |
| Sporomusa malonica DSM 5090 | PRJEB20330 | Не в кластере | + | Неполный кластер из двух генов | Несколько генов | ‒ |
| Sporomusa ovata DSM 2662 | PRJNA205246 | Не в кластере | + | Неполный кластер из двух генов | Несколько генов | ‒ |
| Sporomusa silvacetica DSM 10669 | PRJNA310713 | Не в кластере | + | Кластер из трех генов | + | + |
| Sporomusa termitida DSM 4440 | PRJNA523110 | Не в кластере | + | ‒ | Несколько генов | ‒ |
| Thermacetogenium phaeum DSM 12270 | PRJNA168373 | Не в кластере | + | Кластер из трех генов | Несколько генов | Несколько генов |
Обозначения. Кластер: рядом расположены три и более гена. В качестве референсных использовались гены из базы данных GenBank с доказанной биохимической активностью генного продукта. Гены О-деметилазы из Acetobacterium dehalogenans: odmA (AAC83695.2), odmB (AAC83696.2), odmC (ACJ01666.1), odmD (AAR11880.2); гены бензоил-КоА редуктазы из Thauera aromatica: bcrA (O87876.1), bcrB (O87875.1), bcrC (O87874.1), bcrD (O87877.1); ген бензоил-КоА редуктазы из Geobacter metallireducens bamB (ABB32316.1); ген бензоил-КоА редуктазы из Azoarcus штамм CIP bzdQ (AAQ08809.1); гены СО-дегидрогеназы/ацетил-КоА синтазы из Moorella thermoacetica α-субъединица (P27988.1) и β-субъединица (P27989.1).
Как видно из табл. 3, организация всех генов системы О-деметилирования в один кластер не является обязательным требованием для проявления ее активности. Однако все биохимически охарактеризованные к настоящему моменту О‑деметилазы кодируются кластером, состоящим не менее чем из трех генов (табл. 2). Более того, даже полное отсутствие О-деметилазных генов не исключает для организма возможности роста на МАС, поскольку у большинства проанализированных микроорганизмов в геномах выявлены как гены О-деметилирования, так и гены расщепления ароматического кольца. В связи с этим, в каждом конкретном случае, для выяснения возможных путей разложения МАС, требуется более подробный геномный анализ в совокупности с физиологическими и биохимическими экспериментами. Особенно это относится к микроорганизмам, растущим на таких ароматических субстратах, как ванилин, ванилат, ферулат, сирингат (рис. 1, табл. 1), содержащим в своем составе как метоксильные, так и гидроксильные группы. В филуме Bacillota гены О-деметилазы отсутствуют у Papillibacter cinnamivorans, Catenibacillus scindens, Cl. methoxybenzovorans, тогда как подавляющее большинство ацетогенов содержит полный набор этих генов (во многих случаях и несколько копий), также как и ген СО-дегидрогеназы/ацетил-КоА синтазы. Koleobacter methoxysyntrophicus, способеный расти на триметоксибензоате только в присутствии метаногена, не содержит генов, СО-ДГ/ацетил-КоА синтазы и МТI, хотя остальные гены О-деметилазы локализованы в кластере. Подобная способность разлагать МАС исключительно путем синтрофного взаимодействия контрастирует со всеми выделенными к данному моменту чистыми культурами, метаболизирующими МАС, и требует более детального изучения.
Все проанализированные представители Pseudomonadota, кроме Desulfomonile tiedjei, являются факультативными анаэробами, и в их геномах не выявлено генов анаэробной О-деметилазной системы, а также СО-ДГ/ацетил-КоА синтазного комплекса и генов бензоил-КоА редуктаз. У Desulfomonile tiedjei из класса Deltaproteobacteria обнаружено несколько классических оперонов О-деметилаз, однако этот микроорганизм является облигатным анаэробом и способен расти на широком спектре метоксилированных ароматических субстратов (DeWeerd et al., 1990). Геном Rhodopseudomonas palustris содержит полный оперон генов бензоил-КоА редуктазы bcr-типа, что свидетельствует об отщеплении функциональной гидроксильной группы ферулата, а не метильной. С другой стороны, мутант R. palustris с “выключенным” опероном bcrCABD все равно оказался способен расти на сирингате за счет вовлечения белков, кодируемых опероном vanARB, который отвечает за О-деметилирование ароматического кольца у аэробных бактерий (Oshlag et al., 2020). Мы проанализировали присутствие в геномах va-nARB оперона у всех микроорганизмов из табл. 3 с отсутствующими генами анаэробной О-деметилазы (данные не представлены). Оказалось, что только Klebsiella oxytoca, Enterobacter cloacae и Achromobacter denitrificans содержат кластер vanAB, тогда как ген регулятора транскрипции vanR располагается не в опероне. С учетом вышесказанного вопрос о том, каким образом группа факультативных анаэробов осуществляет деградацию МАС, остается открытым.
ЗАКЛЮЧЕНИЕ
Трансформация МАС микроорганизмами изучается на протяжении нескольких десятилетий. Наиболее многочисленной группой анаэробов, способных к росту на МАС, являются ацетогенные бактерии класса Clostridia. Факультативно анаэробные метоксидотрофы гораздо менее многочисленны и относятся к филуму Pseudomonadota. Недавно установлено, что и археи способны метаболизировать МАС в анаэробных условиях. Открытие метоксидотрофного метаногенеза существенно меняет взгляд на пути образования метана в природе.
Энергию для роста при использовании МАС микроорганизм может получать либо за счет деметилирования, либо за счет разрыва ароматического кольца, а иногда за счет обеих реакций. В большинстве случаев, метоксидотрофный рост обусловлен наличием О-деметилазной энзиматической системы, состоящей из четырех компонентов и сходной у бактерий и архей. Проведенный нами анализ геномов 46 прокариот, анаэробно разлагающих МАС, на наличие генов О-деметилаз, СО-дегидрогеназы/ацетил-КоА синтазы, а также бензоил-КоА редуктаз показал, что факультативные анаэробы, принадлежащие к филуму Pseudomonadota, не имеют известных генетических детерминант анаэробной О-деметилазной реакции и восстановления ароматического кольца. Таким образом, трансформация МАС анаэробными микроорганизмами осуществляется различными биохимическими механизмами.
Практически отсутствует информация о вкладе анаэробного метаболизма МАС в глобальный цикл углерода, однако можно предположить, что он может быть довольно существенным, принимая во внимание значительные концентрации МАС в природных органических веществах, таких как лигнин и уголь. Потенциальная способность к анаэробному О-деметилированию у некультивируемых представителей филумов Bathyarchaerota, Korarchaeota и ряда других свидетельствует о более широких экологических функциях, выполняемой анаэробными метоксидотрофными микроорганизмами.
Список литературы
Abdelaziz O.Y., Brink D.P., Prothmann J., Ravi K., Sun M., García-Hidalgo J., Sandahl M., Hulteberg C.P., Turner C., Lidén G., Gorwa-Grauslund M.F. Biological valorization of low molecular weight lignin // Biotechnol. Adv. 2016. V. 34. P. 1318–1346.
Ahring B.K., Biswas R., Ahamed A., Teller P.J., Uellendahl H. Making lignin accessible for anaerobic digestion by wet-explosion pretreatment // Bioresour. Technol. 2015 V. 175. P. 182–188.
Allen T.D., Caldwell M.E., Lawson P.A., Huhnke R.L., Tanner R.S. Alkalibaculum bacchi gen. nov., sp. nov., a CO-oxidizing, ethanol-producing acetogen isolated from livestock-impacted soil // Int. J. Syst. Evol. Microbiol. 2010 V. 60. P. 2483–2489.
Ander P., Eriksson K.B. Lignin degradation and utilization by micro-organisms // Prog. Ind. Microbiol. 1978. V. 14. P. 1–58.
Azzena U., Denurra T., Melloni G., Fenude E., Rassu G. Electron-transfer-induced reductive demethoxylation of anisole: evidence for cleavage of a radical anion // J. Org. Chem. 1992. V. 57. P. 1444–1448.
Bache R., Pfennig N. Selective isolation of Acetobacterium woodii on methoxylated aromatic acids and determination of growth yields // Arch. Microbiol. 1981. V. 130. P. 255–261.
Bak F., Finster K., Rothfuss F. Formation of dimethyl sulfide and methanethiol from methoxylated aromatic compounds and inorganic sulfide by newly isolated anaerobic bacteria // Arch. Microbiol. 1992. V. 159. P. 529–534.
Berman M.H., Frazer A.C. Importance of tetrahydrofolate and ATP in the anaerobic O-demethylation reaction for phenylmethylethers // Appl. Environ. Microbiol. 1992. V. 58. P. 925–931.
Bernhardt F.H., Ruf H.H., Staudinger H. Purification of a 4‑methoxybenzoate O-demethylase from Pseudomonas putida // Biol. Chem. 1971. V. 352. P. 1091–1099.
Boll M. Dearomatizing benzene ring reductases // J. Mol. Microbiol. Biotechnol. 2005. V. 10. P. 132–142.
Boll M., Fuchs G. Benzoyl-coenzyme A reductase (dearomatizing), a key enzyme of anaerobic aromatic metabolism. ATP dependence of the reaction, purification and some properties of the enzyme from Thauera aromatica strain K172 // Eur. J. Biochem. 1995. V. 234. P. 921–933.
Boll M., Fuchs G., Meier C., Trautwein A., Lowe D.J. EPR and Mössbauer studies of benzoyl-CoA reductase // J. Biol. Chem. 2000. V. 275. P. 31857–31868.
Braune A., Blaut M. Catenibacillus scindens gen. nov., sp. nov., a C-deglycosylating human intestinal representative of the Lachnospiraceae // Int. J. Syst. Evol. Microbiol. 2018. V. 68. P. 3356–3361.
Breznak J.A., Switzer J.M., Seitz H.J. Sporomusa termitida sp. nov., an H2/CO2-utilizing acetogen isolated from termites // Arch. Microbiol. 1988. V. 150. P. 282–288.
Brink D.P., Ravi K., Lidén G., Gorwa-Grauslund M.F. Mapping the diversity of microbial lignin catabolism: experiences from the eLignin database // Appl. Microbiol. Biotechnol. 2019. V. 103. P. 3979–4002.
Brunow G., Lundquist K. Functional groups and bonding patterns in lignin (including the lignin-carbohydrate com-plexes) // Lignin and Lignans / Eds. Heitner C., Dimmel D., Schmidt J. CRC Press, 2010. P. 267–299.
Chen J.X., Deng C.Y., Zhang Y.T., Liu Z.M., Wang P.Z., Liu S.L., Qian W., Yang D.H. Cloning, expression, and characterization of a four-component O-demethylase from human intestinal bacterium Eubacterium limosum ZL-II // Appl. Microbiol. Biotechnol. 2016. V. 100. P. 9111–9124.
Cheng L., Qiu T.L., Yin X.B., Wu X.L., Hu G.Q., Deng Y., Zhang H. Methermicoccus shengliensis gen. nov., sp. nov., a thermophilic, methylotrophic methanogen isolated from oil-production water, and proposal of Methermicoccaceae fam. nov. // Int. J. Syst. Evol. Microbiol. 2007. V. 57. P. 2964‒2969.
Christiansen N., Ahring B.K. Desulfitobacterium hafniense sp. nov., an anaerobic, reductively dechlorinating bacterium // Int. J. Syst. Evol. Microbiol. 1996. V. 46. P. 442‒448.
Conrad R. The global methane cycle: recent advances in understanding the microbial processes involved // Environ. Microbiol. Rep. 2009. V. 1. P. 285–292.
Daniel S.L., Keith E.S., Yang H., Lin Y.S., Drake H.L. Utilization of methoxylated aromatic compounds by the acetogen Clostridium thermoaceticum: expression and specificity of the co-dependent O-demethylating activity // Biochem. Biophys. Res. Commun. 1991. V. 180. P. 416–422.
Defnoun S., Labat M., Ambrosio M., Garcia J.L., Patel B.K. Papillibacter cinnamivorans gen. nov., sp. nov., a cinnamate-transforming bacterium from a shea cake digester // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1221–1228.
Dehning I., Stieb M., Schink B. Sporomusa malonica sp. nov., a homoacetogenic bacterium growing by decarboxylation of malonate and succinate // Arch. Microbiol. 1989. V. 151. P. 421–426.
DeWeerd K.A., Mandelco L., Tanner R.S., Woese C.R., Suflita J.M. Desulfomonile tiedjei gen. nov. and sp. nov., a novel anaerobic, dehalogenating, sulfate-reducing bacterium // Arch. Microbiol. 1990. V. 154. P. 23–30.
DeWeerd K.A., Saxena A., Nagle D.P., Jr., Suflita J.M. Metabolism of the 18O-methoxy substituent of 3-methoxybenzoic acid and other unlabeled methoxybenzoic acids by anaerobic bacteria // Appl. Environ. Microbiol. 1988. V. 54. P. 1237–1242.
Dürichen H., Diekert G., Studenik S. Redox potential changes during ATP-dependent corrinoid reduction determined by redox titrations with europium(II)-DTPA // Protein Sci. 2019. V. 28. P. 1902–1908.
Engelmann T., Kaufmann F., Diekert G. Isolation and characterization of a veratrol:corrinoid protein methyl transferase from Acetobacterium dehalogenans // Arch. Microbiol. 2001. V. 175. P. 376–383.
Frazer A.C. O-Demethylation and other transformations of aromatic compounds by acetogenic bacteria // Acetogenesis / Eds. Drake H.L. Chapman & Hall Microbiology Series. Boston: Springer, 1994. P. 445–483.
Grbić-Galić D. Fermentative and oxidative transformation of ferulate by a facultatively anaerobic bacterium isolated from sewage sludge // Appl. Environ. Microbiol. 1985. V. 50. P. 1052–1057.
Grech-Mora M.L., Fardeau M.L., Patel B.K.C., Ollivier B., Rimbault A., Prensier G., Garcia J.L., Garnier-Sillam E. Isolation and characterization of Sporobacter termitidis gen.nov., sp. nov., from the digestive tract of the wood-feeding termite // Int. J. Syst. Evol. Microbiol. 1996. V. 46. P. 512–518.
Greening R.C., Leedle J.A. Enrichment and isolation of Acetitomaculum ruminis, gen. nov., sp. nov.: acetogenic bacteria from the bovine rumen // Arch. Microbiol. 1989. V. 151. P. 399–406.
Haddock J.D., Ferry J.G. Purification and properties of phloroglucinol reductase from Eubacterium oxidoreducens G-41 // J. Biol. Chem. 1989. V. 264. P. 4423– 4427.
Hagel J., Facchini P. Biochemistry and occurrence of O-demethylation in plant metabolism // Front. Physiol. 2010. V. 1. P. 14.
Häggblom M.M., Berman M.H., Frazer A.C., Young L.Y. Anaerobic O-demethylation of chlorinated guaiacols by Acetobacterium woodii and Eubacterium limosum // Biodegradation. 1993. V. 4. P. 107–114.
Hatcher P.G., Clifford D.J. The organic geochemistry of coal: from plant materials to coal // Org. Geochem. 1997. V. 27. P. 251–274.
Harwood C.S., Burchhardt G., Herrmann H., Fuchs G. Anaerobic metabolism of aromatic compounds via the benzoyl-CoA pathway // FEMS Microbiol. Rev. 1999. V. 22. P. 4439–4458.
Harwood C.S., Gibson J. Anaerobic and aerobic metabolism of diverse aromatic compounds by the photosynthetic bacterium Rhodopseudomonas palustris //Appl. Environ. Microbiol. 1988. V. 54. P. 712–717.
Hattori S., Kamagata Y., Hanada S., Shoun H. Thermacetogenium phaeum gen. nov., sp. nov., a strictly anaerobic, thermophilic, syntrophic acetate-oxidizing bacterium // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 1601–1609.
Healy J.B., Young L.Y. Anaerobic biodegradation of eleven aromatic compounds to methane // Appl. Environ. Microbiol. 1979. V. 38. P. 84–89.
Holmes D.E., Risso C., Smith J.A., Lovley D.R. Genome-scale analysis of anaerobic benzoate and phenol metabolism in the hyperthermophilic archaeon Ferroglobus placidus // ISME J. 2012. V. 6. P. 146–157.
Kane M.D., Breznak J.A. Acetonema longum gen. nov. sp. nov., an H2/CO2 acetogenic bacterium from the termite, Pterotermes occidentis // Arch. Microbiol. 1991. V. 156. P. 91–98.
Kaufmann F., Wohlfarth G., Diekert G. Isolation of O-demethylase, an ether-cleaving enzyme system of the homoacetogenic strain MC // Arch. Microbiol. 1997. V. 166. P. 136–142.
Kaufmann F., Wohlfarth G., Diekert G. O-demethylase from Acetobacterium dehalogenans ‒ cloning, sequencing, and active expression of the gene encoding the corrinoid protein // Eur. J. Biochem. 1998a. V. 257. P. 515–521.
Kaufmann F., Wohlfarth G., Diekert G. O-demethylase from Acetobacterium dehalogenans ‒ substrate specificity and function of the participating proteins // Eur. J. Biochem. 1998b. V. 253. P. 706–711.
Khomyakova M.A., Merkel A.Y., Kopitsyn D.S., Bonch-Osmolovskaya E.A., Slobodkin A.I. Calorimonas adulescens gen. nov., sp. nov., an anaerobic thermophilic bacterium utilizing methoxylated benzoates // Int. J. Syst. Evol. Microbiol. 2020a. V. 70. P. 2066–2071.
Khomyakova M., Merkel A., Novikov A., Klyukina A., Slobodkin A. Alkalibacter mobilis sp. nov., an anaerobic bacterium isolated from a coastal lake // Int. J. Syst. Evol. Microbiol. 2021. V. 71. Art. 5174.
Khomyakova M.A., Merkel A.Y., Petrova D.A., Bonch-Osmolovskaya E.A., Slobodkin A.I. Alkalibaculum sporogenes sp. nov., isolated from a terrestrial mud volcano and emended description of the genus Alkalibaculum // Int. J. Syst. Evol. Microbiol. 2020b. V. 70. P. 4914–4919.
Kluge C., Tschech A., Fuchs G. Anaerobic metabolism of resorcyclic acids (m-dihydroxybenzoic acids) and resorcinol (1,3-benzenediol) in a fermenting and in a denitrifying bacterium // Arch. Microbiol. 1990. V. 155. P. 68–74.
Krumholz L.R., Bryant M.P. Clostridium pfennigii sp. nov. uses methoxyl groups of monobenzenoids and produces butyrate // Int. J. Syst. Bacteriol. 1985. V. 35. P. 454–456.
Krumholz L.R., Bryant M.P. Syntrophococcus sucromutans sp. nov., gen. nov. uses carbohydrates as electron donors and formate, methoxybenzenoids or Methanobrevibacter as electron acceptor systems // Arch. Microbiol. 1986. V. 143. P. 313–318.
Kuever J., Rainey F.A., Hippe H. Description of Desulfotomaculum sp. Groll as Desulfotomaculum gibsoniae sp. nov. // Int. J. Syst. Bacteriol. 1999. V. 49. P. 1801–1808.
Kuhner C.H., Frank C., Griesshammer A., Schmittroth M., Acker G., Gössner A., Drake H.L. Sporomusa silvacetica sp, nov., an acetogenic bacterium isolated from aggregated forest soil // Int. J. Syst. Bacteriol. 1997. V. 47. P. 352–358.
Kurth J.M., Nobu M.K., Tamaki H., de Jonge N., Berger S., Jetten M.S.M., Yamamoto K., Mayumi D., Sakata S., Bai L., Cheng L., Nielsen J.L., Kamagata Y., Wagner T., Welte C.U. Methanogenic archaea use a bacteria-like methyltransferase system to demethoxylate aromatic compounds // ISME J. 2021. V. 15. P. 3549–3565.
Kurth J.M., Op den Camp H.J.M., Welte C.U. Several ways one goal-methanogenesis from unconventional substrates // Appl. Microbiol. Biotechnol. 2020. V. 104. P. 6839–6854.
Küsel K., Dorsch T., Acker G., Stackebrandt E., Drake H.L. Clostridium scatologenes strain SL1 isolated as an acetogenic bacterium from acidic sediments // Int. J. Syst. Evol. Microbiol. 2000. V. 50. P. 537–546.
Lechtenfeld M., Heine J., Sameith J., Kremp F., Müller V. Glycine betaine metabolism in the acetogenic bacterium Acetobacterium woodii // Environ. Microbiol. 2018. V. 20. P. 4512–4525.
Lehmann J., Kleber M. The contentious nature of soil organic matter // Nature. 2015. V. 528. P. 60–68.
Libes S.M. The origin of petroleum in the marine environment // Introduction to Marine Biogeochemistry. Amsterdam: Elsevier Science, 2009. P. 1–33.
Liesack W., Back F., Kreft J.U., Stackebrandt E. Holophaga foetida gen. nov., sp. nov., a new homoacetogenic bacterium degrading methoxylated aromatic compounds // Arch. Microbiol. 1994. V. 162. P. 85–90.
Lloyd M.K., Trembath-Reichert E., Dawson K.S., Feakins S.J., Mastalerz M., Orphan V.J., Sessions A.L., Eiler J.M. Methoxyl stable isotopic constraints on the origins and limits of coal-bed methane // Science. 2021. V. 374. P. 894–897.
Löffler C., Kuntze K., Vazquez J.R., Rugor A., Kung J.W., Böttcher A., Boll M. Occurrence, genes and expression of the W/Se-containing class II benzoyl-coenzyme A reductases in anaerobic bacteria // Environ. Microbiol. 2011. V. 13. P. 696–709.
Löffler F.E., Yan J., Ritalahti K.M., Adrian L., Edwards E.A., Konstantinidis K.T., Müller J.A., Fullerton H., Zinder S.H., Spormann A.M. Dehalococcoides mccartyi gen. nov., sp. nov., obligately organohalide-respiring anaerobic bacteria relevant to halogen cycling and bioremediation, belong to a novel bacterial class, Dehalococcoidia classis nov., order Dehalococcoidales ord. nov. and family Dehalococcoidaceae fam. nov., within the phylum Chloroflexi // Int. J. Syst. Evol. Microbiol. 2013. V. 63. P. 625–635.
Lomans B.P., Leijdekkers P., Wesselink J.-J., Bakkes P., Pol A., van der Drift C., Op den Camp H.J.M. Obligate sulfide-dependent degradation of methoxylated aromatic compounds and formation of methanethiol and dimethyl sulfide by a freshwater sediment isolate, Parasporobacterium paucivorans gen. nov., sp. nov. // Appl. Environ. Microbiol. 2001. V. 67. P. 4017–4023.
Lomans B.P., Op den Camp H.J., Pol A., van der Drift C., Vogels G.D. Role of methanogens and other bacteria in degradation of dimethyl sulfide and methanethiol in anoxic freshwater sediments // Appl. Environ. Microbiol. 1999. V. 65. P. 2116–2121.
Lomans B.P., van der Drift C., Pol A., Op den Camp H.J. Microbial cycling of volatile organic sulfur compounds // Cell. Mol. Life Sci. 2002. V. 59. P. 575–588.
López Barragán M.J., Carmona M., Zamarro M.T., Thiele B., Boll M., Fuchs G., García J.L., Díaz E. The bzd gene cluster, coding for anaerobic benzoate catabolism, in Azoarcus sp. strain CIB // J. Bacteriol. 2004. V. 186. P. 5762–5774.
Lorowitz W.H., Bryant M.P. Peptostreptococcus productus strain that grows rapidly with CO as the energy source // Appl. Environ. Microbiol. 1984. V. 47. P. 961–964.
Lu P., Huang H., Sun Y., Qiang M., Zhu Y., Cao M., Peng X., Yuan B., Feng Z. Biodegradation of 4-hydroxybenzoic acid by Acinetobacter johnsonii FZ-5 and Klebsiella oxytoca FZ-8 under anaerobic conditions // Biodegradation. 2022. V. 33. P. 17–31.
Lux M.F., Drake H.L. Re-examination of the metabolic potentials of the acetogens Clostridium aceticum and Clostridium formicoaceticum: chemolithoautotrophic and aromatic-dependent growth // FEMS Microbiol. Lett. 1992. V. 95. P. 49–56.
Masai E., Katayama Y., Fukuda M. Genetic and biochemical investigations on bacterial catabolic pathways for lignin derived aromatic compounds // Biosci. Biotechnol. Biochem. 2007. V. 71. 1e15.
Mayumi D., Mochimaru H., Tamaki H., Yamamoto K., Yoshioka H., Suzuki Y., Kamagata Y., Sakata S. Methane production from coal by a single methanogen // Science. 2016. V. 354. P. 222–225.
Mechichi T., Labat M., Garcia J.-L., Thomas P., Pate B.K.C. Sporobacterium olearium gen. nov., sp. nov., a new methanethiol-producing bacterium that degrades aromatic compounds, isolated from an olive mill wastewater treatment digester // Int. J. Syst. Bacteriol. 1999a. V. 49. P. 1741–1748.
Mechichi T., Labat M., Patel B.K., Woo T.H., Thomas P., Garcia J.L. Clostridium methoxybenzovorans sp. nov., a new aromatic o-demethylating homoacetogen from an olive mill wastewater treatment digester // Int. J. Syst. Bacteriol. 1999b. V. 49. P. 1201–1209.
Mingo F.S., Studenik S., Diekert G. Conversion of phenyl methyl ethers by Desulfitobacterium spp. and screening for the genes involved // FEMS Microbiol. Ecol. 2014. V. 90. P. 783–790.
Möller B., Oßmer R., Howard B.H., Gottschalk G., Hippe H. Sporomusa, a new genus of gram-negative anaerobic bacteria including Sporomusa sphaeroides spec. nov. and Sporomusa ovata spec. nov. // Arch. Microbiol. 1984. V. 139. P. 388–396.
Mountfort D.O., Grant W.D., Clarke R., Asher R. Eubacterium callanderi sp. nov. that demethoxylates O-methoxylated aromatic acids to volatile fatty acids // Int. J. Syst. Evol. Microbiol. 1988. V. 38. P. 254‒258.
Naidu D., Ragsdale S.W. Characterization of a three-component vanillate O-demethylase from Moorella thermoacetica // J. Bacteriol. 2001. V. 183. P. 3276–3281.
Oshlag J.Z., Ma Y., Morse K., Burger B.T., Lemke R.A., Karlen S.D., Myers K.S., Donohue T.J., Noguera D.R. Anaerobic degradation of syringic acid by an adapted strain of Rhodopseudomonas palustris // Appl. Environ. Microbiol. 2020. V. 86. e01888-19.
Paarup M., Friedrich M.W., Tindall B.J., Finster K. Characterization of the psychrotolerant acetogen strain SyrA5 and the emended description of the species Acetobacterium carbinolicum // Antonie Van Leeuwenhoek. Int. J. 2006. V. 89. P. 55–69.
Parekh M., Keith E.S., Daniel S.L., Drake H.L. Comparative evaluation of the metabolic potentials of different strains of Peptostreptococcus productus: utilization and transformation of aromatic compounds // FEMS Microbiol. Lett. 1992. V. 73. P. 69–74.
Pierce E., Xie G., Barabote R.D., Saunders E., Han C.S., Detter J.C., Richardson P., Brettin T.S., Das A., Ljungdahl L.G., Ragsdale S.W. The complete genome sequence of Moorella thermoacetica (f. Clostridium thermoaceticum) // Environ. Microbiol. 2008. V. 10. P. 2550–2573.
Ragsdale S.W. Catalysis of methyl group transfers involving tetrahydrofolate and B12 // Vitam. Horm. 2008. V. 79. P. 293–324.
Reichenbecher W., Schink B. Desulfovibrio inopinatus, sp. nov., a new sulfate-reducing bacterium that degrades hydroxyhydroquinone // Arch. Microbiol. 1997. V. 168. P. 338–344.
Ritter D., Vinson D., Barnhart E., Akob D.M., Fields M.W., Cunningham A.B., Orem W., McIntosh J.C. Enhanced microbial coalbed methane generation: a review of research, commercial activity, and remaining challenges // Int. J. Coal. Geol. 2015. V. 146. P. 28–41.
Rosazza J.P., Huang Z., Dostal L., Volm T., Rousseau B. Review: biocatalytic transformations of ferulic acid: an abundant aromatic natural product // J. Ind. Microbiol. 1995. V. 15. P. 457–471.
Sakamoto S., Nobu M.K., Mayumi D., Tamazawa S., Kusada H., Yonebayashi H., Iwama H., Ikarashi M., Wakayaääma T., Maeda H., Sakata S., Tamura T., Nomura N., Kamagata Y., Tamaki H. Koleobacter methoxysyntrophicus gen. nov., sp. nov., a novel anaerobic bacterium isolated from deep subsurface oil field and proposal of Koleobacteraceae fam. nov. and Koleobacterales ord. nov. within the class Clostridia of the phylum Firmicutes // Syst. Appl. Microbiol. 2021. V. 44. Art. 126154.
Sanford R.A., Cole J.R., Löffler F.E., Tiedje J.M. Characterization of Desulfitobacterium chlororespirans sp. nov., which grows by coupling the oxidation of lactate to the reductive dechlorination of 3-chloro-4-hydroxybenzoate // Appl. Environ. Microbiol. 1996. V. 62. P. 3800–3808.
Schilhabel A., Studenik S., Vödisch M., Kreher S., Schlott B., Pierik A.J., Diekert G. The ether-cleaving methyltransferase system of the strict anaerobe Acetobacterium dehalogenans: analysis and expression of the encoding genes // J. Bacteriol. 2009. V. 191. P. 588–599.
Schink B., Philipp B., Müller J. Anaerobic degradation of phenolic compounds // Naturwissenschaften. 2000. V. 87. P. 12–23.
Schmid G., Auerbach H., Pierik A.J., Schünemann V., Boll M. ATP-dependent electron activation module of benzoyl-coenzyme A reductase from the hyperthermophilic archaeon Ferroglobus placidus // Biochemistry. 2016. V. 55. P. 5578–5586.
Siebert A., Schubert T., Engelmann T., Studenik S., Diekert G. Veratrol-O-demethylase of Acetobacterium dehalogenans: ATP-dependent reduction of the corrinoid protein // Arch. Microbiol. 2005. V. 183. P. 378–384.
Sjuts H., Dunstan M.S., Fisher K., Leys D. Structure of the cobalamin-binding protein of a putative O-demethylase from Desulfitobacterium hafniense DCB-2 // Acta Crystallogr. D. Biol. Crystallogr. 2013. V. 69. P. 1609–1616.
Sjuts H., Dunstan M.S., Fisher K., Leys D. Structures of the methyltransferase component of Desulfitobacterium hafniense DCB-2 O-demethylase shed light on methyltetrahydrofolate formation // Acta Crystallogr. D. Biol. Crystallogr. 2015. V. 71. P. 1900–1908.
Stackebrandt E., Sproer C., Rainey F.A., Burghardt J., Päuker O., Hippe H. Phylogenetic analysis of the genus Desulfotomaculum: evidence for the misclassification of Desulfotomaculum guttoideum and description of Desulfotomaculum orientis as Desulfosporosinus orientis gen. nov., comb. nov. // Int. J. Syst. Bacteriol. 1997. V. 47. P. 1134–1139.
Studenik S., Kreher S., Diekert G. The ether-cleaving methyltransferase of the strict anaerobe Acetobacterium dehalogenans: analysis of the zinc-binding site // FEMS Microbiol Lett. 2011. V. 318. P. 131–136.
Studenik S., Vogel M., Diekert G. Characterization of an O‑demethylase of Desulfitobacterium hafniense DCB-2 // J. Bacteriol. 2012. V. 194. P. 3317–3326.
Stupperich E., Konle R. Corrinoid-dependent methyl transfer reactions are involved in methanol and 3,4-dimethoxybenzoate metabolism by Sporomusa ovata // Appl. Environ. Microbiol. 1993. V. 59. P. 3110–3116.
Stupperich E., Konle R., Eckerskorn C. Anaerobic O-demethylations of methoxynaphthols, methoxyfuran, and fluoroanisols by Sporomusa ovata // Biochem. Biophys. Res. Commun. 1996. V. 223. P. 770–777.
Subramanian M., Tuckey J., Patel B., Jensen P.J. Engineering dicamba selectivity in crops: a search for appropriate degradative enzyme(s) // J. Ind. Microbiol. Biotech. 1997. V. 19. P. 344–349.
Tanaka K., Pfennig N. Fermentation of 2-methoxyethanol by Acetobacterium malicum sp. nov. and Pelobacter venetianus // Arch. Microbiol. 1988. V. 149. P. 181–187.
Taylor B.F. Aerobic and anaerobic catabolism of vanillic acid and some other methoxy-aromatic compounds by Pseudomonas sp. strain PN-1 // Appl. Environ. Microbiol. 1983. V. 46. P. 1286–1292.
Tasaki M., Kamagata Y., Nakamura K., Mikami E. Utilization of methoxylated benzoates and formation of intermediates by Desulfotomaculum thermobenzoicum in the presence or absence of sulfate // Arch. Microbiol. 1992. V. 157. P. 209–212.
Traunecker J., Preuß A., Diekert G. Isolation and characterization of a methyl chloride utilizing, strictly anaerobic bacterium // Arch. Microbiol. 1991. V. 156. Art. 4162421.
Utkin I., Woese C., Wiegel J. Isolation and characterization of Desulfitobacterium dehalogenans gen. nov., sp. nov., an anaerobic bacterium which reductively dechlorinates chlorophenolic compounds // Int. J. Syst. Bacteriol. 1994. V. 44. P. 612–619.
Vanholme R., Demedts B., Morreel K., Ralph J., Boerjan W. Lignin biosynthesis and structure // Plant Physiol. 2010. V. 153. P. 895–905.
Venkatesagowda B., Dekker R.F.H. Microbial demethylation of lignin: Evidence of enzymes participating in the removal of methyl/methoxyl groups // Enzyme Microb. Technol. 2021. V. 147. Art. 109780.
Wang S., Chen Y., Cao Q., Lou H. Long-lasting gene conversion shapes the convergent evolution of the critical methanogenesis genes // G3. 2015. V. 5. P. 2475–2486.
Welte C.U. A microbial route from coal to gas // Science. 2016. V. 354. P. 184.
Welte C.U., de Graaf R., Dalcin Martins P., Jansen R.S., Jetten M.S.M., Kurth J.M. A novel methoxydotrophic metabolism discovered in the hyperthermophilic archaeon Archaeoglobus fulgidus // Environ. Microbiol. 2021. V. 23. P. 4017–4033.
Wischgoll S., Heintz D., Peters F., Erxleben A., Sarnighausen E., Reski R., Van Dorsselaer A., Boll M. Gene clusters involved in anaerobic benzoate degradation of Geobacter metallireducens // Mol. Microbiol. 2005. V. 58. P. 1238–1252.
Wright G.E., Madigan M.T. Photocatabolism of aromatic compounds by the phototrophic purple bacterium Rhodomicrobium vannielii // Appl. Environ. Microbiol. 1991. V. 57. P. 2069–2073.
Yin X., Cai M., Liu Y., Zhou G., Aromokeye D.A., Kulkarni A.C., Nimzyk R., Cullhed H., Zhou Z., Pan J., Yang Y., Gu J.D., Elvert M., Li M., Friedrich M.W. Subgroup level differences of physiological activities in marine Lokiarchaeota // ISME J. 2020. V. 15. P. 848–861.
Yu T., Wu W., Liang W., Alexander M., Hinrichs K.U. Growth of sedimentary Bathyarchaeota on lignin as an energy source // Proc. Natl. Acad. Sci. USA. 2018. V. 115. P. 6022–6027.
Zakzeski J. The catalytic valorization of lignin for the production of renewable chemicals // Chem. Rev. 2010. V. 110. P. 3552–3599.
Zeikus J.G. Lignin metabolism and the carbon cycle // Advances in Microbial Ecology / Eds. Alexander M. Boston (MA): Springer, 1981. P. 211–243.
Zeikus J.G., Lynd L.H., Thompson T.E., Krzycki JA., Weimer P.J., Hegge P.W. Isolation and characterization of a new, methylotrophic, acidogenic anaerobe, the marburg strain // Curr. Microbiol. 1980. V. 3. P. 381–386.
Дополнительные материалы отсутствуют.
Инструменты
Микробиология