Микология и фитопатология, 2019, T. 53, № 1, стр. 17-25
Инсектицидная, акарицидная и цитотоксическая активность экстрактов некоторых грибов филлосферы и почвенных гипокрейных микромицетов
А. О. Берестецкий 1, *, В. В. Инюшева 1, М. О. Петрова 1, С. В. Сокорнова 1, Е. А. Степанычева 1
1 Всероссийский НИИ защиты растений
196608 Санкт-Петербург, Россия
* E-mail: aberestetskiy@vizr.spb.ru
Поступила в редакцию 24.04.2017
После доработки 15.05.2018
Принята к публикации 29.05.2018
Аннотация
В работе были использованы 10 изолятов аскомицетов, 7 из которых выделены из листьев дикорастущих растений и продемонстрировали афицидную активность в отношении виковой тли (Megoura viciae), остальные три изолята – почвенные гипокрейные микромицеты. Экстракты из культурального фильтрата и мицелия этих грибов были испытаны в отношении злаковой тли (Schizaphis graminum), гусениц пчелиной огневки (Galleria mellonella), самок паутинного клеща (Tetranychus urticae), оценена их цитотоксическая активность в отношении культуры клеток яичника китайского хомячка (СHО-К1) и инфузории-туфельки (Paramecium caudatum). Все испытанные экстракты проявили достоверную токсичность в отношении злаковой тли, причем экстракты из мицелия грибов были более активны, чем экстракты из культурального фильтрата. Гусеницы пчелиной огневки были чувствительны лишь к экстрактам из культурального фильтрата четырех видов грибов (Acremonium sp. 16.5, Alternaria penicillatum, Colletotrichum gloeosporioides, Metapochonia suchlasporia). Акарицидная активность изученных экстрактов была незначительной (гибель не более 30% клещей), однако некоторые из них вызывали существенное снижение репродуктивной функции паутинных клещей. Экстракты из культур грибов филлосферы проявили в среднем более высокую цитотоксичность, чем почвенные микромицеты. Таким образом, фитопатогенные и эндофитные грибы, наряду с почвенными гипокрейными микромицетами, способны к продукции инсектицидных веществ. Их экологическая роль нуждается в дальнейшем изучении.
Периодическое появление резистентных к различным инсектицидам популяций насекомых-вредителей сельскохозяйственных культур заставляет искать новые источники оригинальных инсектицидных молекул. К традиционным ресурсам этих веществ относят растения и бактерии, на основе которых уже создан целый ряд широко используемых биорациональных пестицидов (пиретроидов, неоникотиноидов, авермектинов и некоторых других) (Rosell et al., 2008). Большое внимание уделяется изучению инсектицидных токсинов, образуемых энтомопатогенными грибами. Несмотря на то, что практические успехи в этом направлении намного скромнее, многие выявленные природные соединения (например, боверицин, бассианолид, деструксины) изучаются как прообразы различных лекарственных препаратов (Molnár et al., 2010). Инсектицидные свойства метаболитов, образуемых почвенными клавицепитальными грибами – филогенетически близкими к энтомопатогенам, изучены еще недостаточно.
Данные последних лет демонстрируют способность некоторых грибов филлосферы (эндофитов и фитопатогенов) образовывать метаболиты, регулирующие поведение насекомых. Изучены репелленты (Daisy et al., 2002; Nakajima et al., 2010) и инсектицидные метаболиты ряда эндофитных грибов, населяющих злаковые травы (Breen, 1994), некоторые травянистые растения (Findlay et al., 1997), а также древесные породы (Findlay et al., 1995). Обнаружена высокая корреляция между образованием ряда алкалоидов грибами рода Neotyphodium и устойчивостью заселенных ими злаковых трав к вредителям, в частности, к долгоносику Listronotus bonariensis (Popay et al., 2009).
Исследования, посвященные инсектицидным метаболитам фитопатогенных грибов, начались сравнительно недавно. Обнаружено, что некоторые фитопатогенные микромицеты (Rhizoctonia solani и Sclerotinia sclerotiorum) способны образовывать лектины с инсектицидным действием (Hamshou et al., 2010 a, b). Низкомолекулярные инсектицидные метаболиты – выявлены у Alternaria brassicae (Buchwaldt, Jensen, 1991) и Pyrenophora teres (Bachmann et al., 1996). Значительное количество штаммов возбудителей фузариоза колоса злаков (Fusarium cerealis, F. culmorum, F. graminearum и F. sporotrichioides) оказывало репеллентное действие в отношении жуков рисового долгоносика (Selitskaya et al., 2014). Известно, что многие виды этого рода образуют вещества и с инсектицидной активностью (Cole, Rolinson, 1972; Claydon et al., 1977; Anke, Sterner, 2002; Guesmi et al., 2010; Ameen 2012).
В данной работе представлены результаты оценки инсектицидной и акарицидной активности экстрактов ряда отобранных нами грибов филлосферы и почвенных микромицетов в отношении злаковой тли (Schizaphis graminum Rond.), пчелиной огневки (Galleria mellonella L.) и паутинного клеща (Tetranychus urticae Koch). Учитывая, что в качестве потенциальных биорациональных инсектицидов можно считать вещества не только с высокой инсектицидной активностью, но и минимальными побочными эффектами, в задачи работы входила также и оценка цитотоксической активности экстрактов. Обсуждается экологическое значение полученных результатов.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали 10 изолятов аскомицетов из рабочей коллекции чистых культур лаборатории микологии и фитопатологии Всероссийского научно-исследовательского института защиты растений (ВИЗР). Семь из них представлены грибами, выделенными из листьев травянистых растений. По данным ранее проведенных экспериментов с использованием виковой тли в качестве тест-организма они продемонстрировали афицидную активность (Berestetskiy et al., 2014, 2015). Остальные три изолята – почвенные грибы из семейства Clavicepitaceae (порядок Hypocreales), являющиеся факультативными патогенами насекомых и нематод (Stadler et al., 2003; Yokoyama et al., 2006). Происхождение изолятов приведено в табл. 1. Они представлены и идентифицированы Б.А. Борисовым (Институт проблем экологии и эволюции им. А.Н. Северцова РАН), Ф.Б. Ганнибалом и Е.Л. Гасич (ВНИИ защиты растений). Недавно было показано, что изолят S-MRZ-13-Ma, идентифицированный как Metarhizium anisopliae s.l. по биоэкологическим особенностям и молекулярным данным близок к M. pemphigi (Driver et Milner) Kepler S.A. Rehner et Humber – типичному обитателю почв умеренного климата (Sokornova et al., 2016).
Таблица 1.
Список изолятов грибов, использованных в работе
| Видовое название | Коллекционный номер | Происхождение |
|---|---|---|
| Acremonium sp. | 16.5 | Ленинградская обл., листья Convolvulus arvensis |
| Alternaria japonica Yoshii | 181-011 | Московская обл., листья растения из семейства Brassiacaceae |
| A. penicillatum (Corda) Woudenb. et Crous | 463-011 | Краснодарский край, листья Papaver rhoeas |
| A. saponariae (Peck) Neerg. | 201-011 | Иркутская обл., листья неидентифицированного растения из семейства Cariophyllaceae |
| Botrytis cinerea Pers. | 47.1 | Украина, Сумская обл. листья Galinsoga parviflora |
| Colletotrichum gloeosporioides (Penz.) Penz. et Sacc. | 13.3 | “ “ |
| Lecanicillium flavidum (W. Gams et Zaayen) W. Gams et Zare | S-MRZ-13-Lf (на рисунках – Lf) | Московская обл., лесная почва |
| Metapochonia suchlasporia (W. Gams et Dackman) Kepler | S-MRZ-13-Ps (на рисунках – Ps) | “ “ |
| Metarhizium anisopliae (Metschin.) Sorokin | S-MRZ13-Ma (на рисунках – Ma) | “ “ |
| Phoma sp. | 22.2 | Орловская обл., листья Chenopodiumurbicum |
Лабораторные исследования инсектицидной и акарицидной активности экстрактов, полученных из культур грибов, проводили на обыкновенной злаковой тле (Schizaphis graminum), пчелиной огневке (Galleria mellonella) и обыкновенном паутинном клеще (Tetranychus urticae), культуры которых поддерживаются во ВНИИ защиты растений. Цитотоксчность экстрактов исследовали на культуре инфузорий Paramecium caudatum Ehr., представленной О.Д. Виноходовым (Санкт-Петербургский государственный технологический институт) и на культуре клеток яичника китайского хомячка CHO-K1 (из коллекции Института цитологии РАН).
Злаковую тлю разводили на проростках пшеницы, выращиваемых в кюветах на влажной фильтровальной бумаге в термостатированном помещении с температурой 22 ± 2°С и продолжительностью светового дня 16 ч.
Паутинного клеща содержали на растениях фасоли при тех же условиях, что и тлю. Для получения выровненного материала растения фасоли в фазе 1–2 настоящих листа помещали на сутки в садки со взрослыми особями вредителей для заселения.
Гусениц пчелиной огневки поддерживали в термостате без освещения при 28°С в чашках Петри, добавляя при этом один раз в сутки 2 г корма, приготовленного по рецепту Н.А. Тамариной (Tamarina, 1987).
Культуру инфузорий выращивали в среде Лозина-Лозинского (1 г NaCl, 1 г KCl, 0.1 г MgSO4, 0.1 г CaCl2 · 2H2O, 0.2 г NaHCO3, 1 л дистиллированной воды), разбавленной в 10 раз стерильной водой, при комнатной температуре. В качестве корма использовали хлебопекарные дрожжи.
Культуру клеток CHO-K1 поддерживали на среде DMEM с добавлением 10%-й бычьей сыворотки в CO2-инкубаторе при температуре 25°C и 5% CO2. Пересев осуществляли по стандартной методике каждые 3 суток в 200 мл сосуды (по 20 мл среды на сосуд).
Изоляты грибов культивировали на жидкой питательной среде ДМГ (4 г дрожжевого экстракта, 10 г мальтозного экстракта, 10 г глюкозы, 1 л дистиллированной воды, pH 6) в матрацах объемом 2 л (по 300 мл среды) 3 недели в горизонтальном положении при комнатной температуре. Инокуляцию питательных сред осуществляли двумя агаровыми блоками из края растущих колоний изучаемых изолятов на агаризованной среде ДМГ.
Перед экстракцией грибных метаболитов культуральную жидкость отделяли от мицелия фильтрованием. Биомассу высушивали двое суток при комнатной температуре током воздуха в ламинарном боксе. Экстракцию экзометаболитов из культурального фильтрата (300 мл) проводили двумя порциями этилацетата по 150 мл. Экстракцию эндометаболитов из высушенного, измельченного мицелия проводили 50 мл ацетона в ультразвуковой ванне в течение 20 мин. Растворители выпаривали при помощи ротационного испарителя при температуре воды в бане 40°С. Сухой остаток взвешивали.
Перед началом тестирования биологической активности экстрактов сухой остаток метаболитных комплексов изучаемых грибов растворяли в небольшом количестве этанола, который затем разбавляли дистиллированной водой до необходимой концентрации экстрактивных веществ (типично – 0.2%). Конечное содержание этанола во всех препаратах экстрактов составляло 5%. В контроле использован 5%-й этанол.
Инсектицидная активность. В чашки Петри (диаметр 4 см) помещали диски фильтровальной бумаги (на дно и крышку чашки) и пропитывали их 1%-м экстрактом (по 250 мкл на диск). Затем лист пшеницы обмакивали в экстракте и добавляли в чашку Петри вместе с 15–20 самками злаковой тли. Через 24 ч проводили учет живых и погибших взрослых особей. Об эффективности судили по среднему проценту гибели вредителя по сравнению с контролем. Каждый вариант эксперимента включал 5 повторностей. Экстракт в концентрации 0.2% (объем 4 мкл) при помощи гамильтоновского шприца вводили в полость тела гусениц пчелиной огневки III–IV классов возраста. Инъецированных гусениц (по 6–7 особей) переносили в чашки Петри с суточной нормой корма и инкубировали в термостате без освещения при температуре 25°С. Учет погибших гусениц проводили через 24 ч. Опыт повторяли не менее двух раз.
Акарицидная активность. Молодые настоящие листья фасоли погружали в 0.2%-й препарат экстрактов на 2 с. После испарения жидкости с поверхности обработанных листьев их помещали в чашки Петри на влажную фильтровальную бумагу и заселяли молодыми самками паутинного клеща по 20 особей на каждую из 5 повторностей. Через 1, 3, 7 суток после обработки учитывали гибель самок клеща и на 7-е сутки вели подсчет количества отродившихся личинок дочернего поколения.
Цитотоксическая активность. В лунки 96-луночных планшет вносили по 100 мкл суспензии клеток CHO-K1 в концентрации 5 × 106 клеток/мл, затем туда добавляли 20 мкл экстракта до конечной концентрации 0.002%. Титр клеток определяли через 24 ч. Опыт повторяли дважды в трех повторностях.
В лунках 24-луночного планшета смешивали 800 мкл культуры инфузорий и 200 мкл 1%-го экстракта. Планшет с растворами инкубировали при постоянном искусственном освещении и температуре 24°C. Уровень гибели инфузорий оценивали через 3, 30 и 180 мин после обработки. Критерием для определения чувствительности инфузории-туфельки к токсическим веществам служило время от начала воздействия испытуемого вещества до полной гибели простейших, которую констатируют на основании прекращения их движения.
Уровень различий между средними значениями определяли по критерию наименьшей существенной разницы (НСР) на 95%-м уровне значимости. Если число повторностей в эксперименте было неодинаковым, существенность различий определяли при помощи критерия Фишера. Расчеты проводили при помощи программы Statistica 8 (StatSoft, США).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
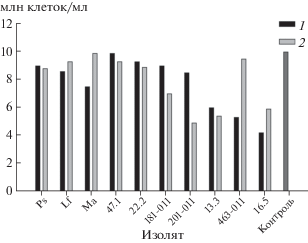
Продуктивность. Выход экстрактивных веществ из мицелия и культурального фильтрата значительно варьировал в зависимости от его происхождения (изолята гриба). Максимальный выход экстрактивных веществ получен из культурального фильтрата (около 240 мг/л) Metapochonia suchlasporia S-MRZ-13-Ps. Высокой продуктивностью экзометаболитов (с выходом более 100 мг/л) характеризовались также Phoma sp. 22.2, Alternaria saponariae 201-011 и A. japonica 181-011. Низкий выход экстрактивных веществ (менее 50 мг/л) отмечен для культурального фильтрата Metarhizium pemphigi S-MRZ-13-Ma, а также Alternaria penicillatum 463-011, Botrytis cinerea 47.1 и Acremonium sp. 16.5 (рис. 1).
Рис. 1.
Выход экстрактивных веществ из культурального фильтрата (1) и мицелия (2) 10 изолятов грибов. Указаны средние значения и стандартное отклонение.
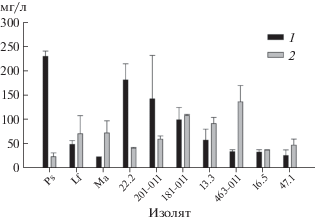
Выход экстрактивных веществ из мицелия изучаемых грибов был в целом ниже, чем выход экзометаболитов. Максимальный выход эндометаболитов получен из мицелия Alternaria penicillatum 463-011 (около 150 мг/л). Высокий выход экстрактивных веществ из мицелия отмечен также для экстрактов Alternaria japonica 181-011 и Colletotrichum gloeosporioides 13.3. Экстракты Metapochonia suchlasporia S-MRZ-13-Ps и Phoma sp. 22.2 отличались низким уровнем накопления эндометаболитов (рис. 1).
БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ ЭКСТРАКТОВ
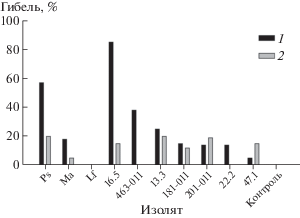
Инсектицидная активность. Активность экстрактов в отношении злаковой тли существенно зависела от их происхождения (изолят гриба) и источника для их извлечения (культуральный фильтрат, мицелий), причем во всех вариантах она была существенно выше контрольной обработки. В целом экстракты из мицелия проявили более высокую и менее вариабельную инсектицидную активность, чем экстракты из культурального фильтрата (рис. 2). Максимальное токсичное действие (смертность тли более 80%) выявлено у экстрактов из мицелия почвенных грибов Metapochonia suchlasporia S-MRZ-13-Ps и M. anisopliae S-MRZ-13-Ma. Практически наравне с ними высокими афицидными свойствами обладали экстракты Phoma sp. 22.2, Botrytis cinerea 47.1 и Alternaria penicillatum 463-011. Следует отметить, что экстракты из культурального фильтрата, содержащие экзометаболиты этих же грибов, также вызывали высокую смертность самок злаковой тли (на уровне 70%). Минимальное влияние на жизнеспособность злаковой тли оказывал экстракт из культурального фильтрата Colletotrichum gloeosporioides 13.3, однако экстракт из мицелия этого гриба был высокотоксичен для данного объекта (рис. 2). Гусеницы Galleria mellonella, напротив, были слабо чувствительны к экстрактам из мицелия изученных грибов (рис. 3). Достоверной инсектицидной активностью по сравнению с контролем обладал лишь ряд экстрактов, выделенных из культурального фильтрата Acremonium sp. 16.5 (смертность гусениц пчелиной огневки достигла 85% от общего числа обработанных особей), Metapochonia suchla-sporia S-MRZ-13-Ps (57%), Alternaria penicillatum 463-011 (38%) и Colletotrichum gloeosporioides 13.3 (26%) (рис. 3). Погибшие гусеницы переставали двигаться и меланизировались.
Рис. 2.
Инсектицидная активность экстрактов из культурального фильтрата (1) и мицелия (2) на злаковой тле. HCP0.05 = 13.0.
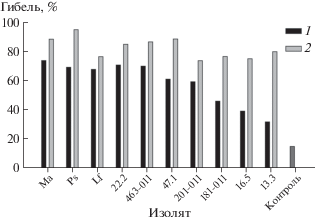
Рис. 3.
Инсектицидная активность экстрактов из культурального фильтрата (1) и мицелия (2) против гусениц пчелиной огневки. НСР0.05 = 25.0.
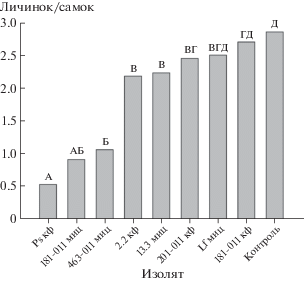
Акарицидная активность. Из-за ограниченного количества полученного материала оценили экстракты только у изолятов грибов с высоким выходом экстрактивных веществ. Выявлено, что тестируемые образцы не обладали достоверным токсическим действием на самок паутинного клеща (смертность не превышала 30% за весь период наблюдения). Однако некоторые экстракты вызывали существенное снижение их плодовитости (рис. 4). Так экстракт из культурального фильтрата Metapochonia suchlasporia S-MRZ-13-Ps снижал численность личинок дочернего поколения в 6 раз, экстракты из мицелия Alternaria japonica 181-011 и A. penicillatum 463-011 – примерно в 3 раза. Менее заметное, но достоверное снижение плодовитости клещей отметили при обработке листьев фасоли экстрактами из культурального фильтрата Phoma sp. 22.2 и Alternaria saponariae 201-011, а также из мицелия Colletotrichum gloeosporioides 13.3 (рис. 4). Из всех изученных образцов фитотоксичность проявил лишь экстракт из культурального фильтрата Metapochonia suchlasporia S-MRZ-13-Ps: на 3-и сутки после обработки наблюдали усыхание листьев фасоли.
Рис. 4.
Влияние экстрактов из культурального фильтрата и мицелия на плодовитость самок паутинного клеща: кф – культуральный фильтрат, миц – мицелий. Средние значения, обозначенные одной и той же буквой, не различаются при р = 0.05.
Цитотоксическая активность. Существенная цитотоксическая активность в отношении клеточной линии CHO-K1 выявлена у экстрактов 5 изолятов грибов, включая одного энтомопатогена (Metarhizium anisopliae S-MRZ-13-Ma). При этом, количество жизнеспособных клеток CHO-K1 снижалось в 1.7–2.3 раза. Максимальное ингибирующее влияние (около 50%) на деление клеток CHO-K1 оказывали экстракты из культурального фильтрата и мицелия Acremonium sp. 16.5 и Colletotrichum gloeosporioides 13.3, а также экстракты из мицелия Alternaria saponariae 201-011 и из культурального фильтрата A. penicillatum 463-011 (рис. 5). Достоверной цитотоксической активностью обладали также экстракты из мицелия A. japonica 181-011 и культурального фильтрата Metarhizium anisopliae S-MRZ-13-Ma (рис. 5).
Рис. 5.
Цитотоксическая активность экстрактов из культурального фильтрата (1) и мицелия (2) на культуру клеток CHO-K1. НСР0.05 = 2.3.
За исключением экстрактов, выделенных из мицелия и культурального фильтрата гриба Alternaria saponariae 201-011, экстракты изученных грибов в концентрации 0.2% были нетоксичными в отношении инфузории.
Энтомопатогенные, почвенные и эндофитные аскомицеты из семейства Clavicipitaceae давно привлекают исследователей как продуценты инсектицидных соединений. Грибы из других семейств, особенно фитопатогенные, крайне редко становились объектами изучения их инсектицидных свойств. Недавно нами было показано, что культуральный фильтрат и экстракты некоторых отобранных нами грибов филлосферы были токсичны для виковой тли (Berestetskiy et al., 2014, 2015). В данной работе нами продемонстрирована высокая чувствительность другого вида тли – злаковой тли к экстрактам из культур этих же изолятов грибов наряду с экстрактами из культур почвенных гипокрейных микромицетов, являющихся факультативными патогенами насекомых и нематод (рис. 2).
Следует отметить, что экстракты из мицелия всех 10 изученных грибов проявили более высокую афицидную активность по сравнению с экстрактами из культурального фильтрата. Активность 0.2%-х экстрактов из мицелия варьировала от 75% (A. saponariae 201-011) до 95% (Metapochonia suchlasporia S-MRZ-13-Ps); в контроле погибло в среднем 15% особей тли. Несмотря на то, что некоторые энтомопатогены накапливают токсины именно в мицелии (Mitina et al., 2012; Safavi, 2013), высокая инсектицидная активность экстрактов из грибного мицелия изученных нами грибов, возможно, связана также с наличием в них жирных кислот и стероидов, многие из которых могут обладать неспецифичными афицидными свойствами (Siegler, 1928; Puritch, 1975; Bouvaine et al., 2012, 2014).
Тест с использованием пчелиной огневки – стандартный для изучения биологически активных соединений и эффективности биоинсектицидов (Kučera, 1980; Fallon et al., 2012). Достоверную токсичность в отношении этого насекомого продемонстрировали лишь экстракты из культурального фильтрата четырех видов грибов без какой-либо связи с их афицидными свойствами. Гусеницы пчелиной огневки были высокочувствительны к комплексам экзометаболитов эндофита Acremonium sp. 16.5 (гибель 85% гусениц) и M. suchlasporia S-MRZ-13-Ps (57%). Экстракты из культурального фильтрата фитопатогенов Alternaria penicillatum 463-011 (38%) и Colletotrichum gloeosporioides 13.3 (25%) проявили более низкую, но статистически существенную инсектицидную активность (рис. 2, 3). Известно, что грибы рода Acremonium способны к синтезу инсектицидных алкалоидов (Siegel et al., 1990). В доступной нам литературе данные по инсектицидной активности остальных трех видов грибов не обнаружены. Известно лишь, что Metapochonia suchlasporia образует алкалоид, ингибирующий бета-N-ацетилглюкозаминидазу у насекомых и некоторых других организмов (Usuki et al., 2009).
Экстракты высокопродуктивных изолятов грибов были изучены на акарицидную активность в отношении серьезного вредителя тепличных культур – паутинного клеща. Все изученные экстракты были нетоксичными для самок клеща, однако некоторые из них существенно снижали их плодовитость. Максимальный ингибирующий эффект на репродуктивную функцию клеща показали экстракты из мицелия Alternaria japonica 181-011, A. penicillatum 463-011 и экстракт из культурального фильтрата Metapochonia suchlasporia S-MRZ-13-Ps. Последний, однако, был фитотоксичен для листьев фасоли, на которых поддерживали популяцию клеща; возможно, что в данном случае низкая численность потомства связана с ухудшением качества субстрата. Фитотоксические свойства Pochonia suchlasporia еще не описаны. Что касается Alternaria japonica, известно, что штаммы этого вида являются продуцентами тенуазоновой кислоты (Kinoshita et al., 1972), которая, в свою очередь индуцирует у растений образование метаболитов с инсектицидными свойствами (Yang et al., 2015). Чем может быть обусловлено действие A. penicillatum на репродуктивную функцию клеща неизвестно, поскольку метаболиты этого гриба еще не изучены.
Степень цитотоксичной активности может быть важным индикатором потенциальной опасности химических соединений в отношении человека и теплокровных. Ингибирующая активность в отношении клеточной линии CHO-К1 выявлена у экстрактов, выделенных из культур шести изолятов грибов. Максимальную цитотоксичность продемонстрировали экстракты из культурального фильтрата и мицелия Acremonium sp. 16.5 и Colletotrichum gloeosporioides 13.3. Если цитотоксические свойства Acremonium sp. известны (Jang et al., 2006; Chen et al., 2012; Meléndez-González et al., 2015), то у представителей рода Colletotrichum они практически не изучены (Yang et al., 2014). Любопытно, что цитотоксичность изученных почвенных микромицетов была в целом ниже, чем активность экстрактов из культур отобранных грибов филлосферы.
Токсичное действие в отношении инфузорий проявили только экстракты из культуры гриба Alternaria saponariae 201-011. Недавно из культуры этого гриба было выделено вещество сапонароксин А, которое является токсичным для инфузорий (Cimmino et al., 2016). Инсектицидная активность сапонароксина А на сегодняшний день остается неизученой.
Полученные результаты продемонстрировали разнообразные и не коррелирующие между собой эффекты комплексов эндо- и экзометаболитов, образуемых изученными микромицетами, на насекомых и клещей-фитофагов, а также на клеточные культуры. Из-за широкого спектра биологической активности перспективы применения грубых экстрактов из культур грибов для борьбы с вредными членистоногими сомнительны. Впрочем, дальнейшее фракционирование экстрактов может привести к обнаружению более специфичных инсектицидных и акарицидных метаболитов. При этом совершенно очевидно, что для успешного их выявления требуется использование широкой линейки биотестов, включающей различные виды насекомых.
На основании приведенных данных можно сделать ряд предположений об экологической роли грибов филлосферы и их метаболитов. С одной стороны, токсинообразующие фитопатогенные грибы, обитающие на листьях, выделяя инсектицидные метаболиты или антифиданты, защищают их от поедания конкурентами – насекомыми и клещами. С другой стороны, выделяя фитотоксины и убивая клетки растений, они также могут снижать качество субстрата и вытеснять конкурентов с заболевших растений. Это, возможно, объясняет тот факт, что на растениях чаще доминируют грибы как стационарные паразиты, тогда как чувствительные к их метаболитам фитофаги вынуждены постоянно мигрировать в поисках незараженного субстрата.
Работа выполнена при поддержке РФФИ (проект № 12-04-00853 “Изучение роли вторичных метаболитов грибов в формировании биоценозов филлосферы”) и № 17-04-01445 “Изучение экологической роли инсектицидных метаболитов фитопатогенных грибов”).
Список литературы
Anke H., Sterner O. Insecticidal and nematicidal metabolites from fungi. In: The Mycota, vol. 10, Springer-Verlag, Berlin, Heidelberg, 2002. P. 109–127.
Bachmann T.L., Heide M., Manker D.C., Nielsen R.I., Rosendahl C.N. Fungicidal and insecticidal compounds and compositions derived from fungal strains of Pyrenophora teres. US Patent. 1996. № 5491122.
Berestetskiy A.O., Gasich E.L., Poluektova E.V., Nikolaeva E.V., Sokornova S.V., Khlopunova L.B. Biological activity of fungi inhabiting the phyllosphere of weeds and wild herbaceous plants. Microbiol. 2014. V. 83 (5). P. 523–530.
Berestetskiy A.O., Apollonova L.S., Sokornova S.V., Chermenskaya T.D. Insecticidal properties of phytopathogenic ascomycetes. Plant Prot. News. 2015. V. 85 (3). P. 56–58 (in Russ.).
Bouvaine S., Behmer S., Lin G.G., Faure M.L., Grebenok R.J., Douglas A.E. The physiology of sterol nutrition in the pea aphid Acyrthosiphon pisum. J. Insect. Physiol. 2012. V. 58 (11). P. 1383–1389.
Bouvaine S., Faure M.-L., Grebenok R.J., Behmer S.T., Douglas A.E. A dietary test of putative deleterious sterols for the aphid Myzus persicae. PLoS One. 2014. V. 9. P. e86256.
Breen J.P. Acremonium endophyte interactions with enhanced plant resistance to insects. Ann. Rev. Entomol. 1994. V. 39. P. 401–423.
Buchwaldt L., Jensen J.S. HPLC purification of destruxins produced by Alternaria brassicae in culture and leaves of Brassica napus. Phytochem. 1991. V. 30 (7). P. 2311–2316.
Chen Z., Song Y., Chen Y., Huang H., Zhang W., Ju J. Cyclic heptapeptides, cordyheptapeptides C-E, from the marine-derived fungus Acremonium persicinum SCSIO 115 and their cytotoxic activities. J. Nat. Prod. 2012. V. 75 (6). P. 1215–1219.
Cimmino A., Masi M., Minkovich E., Evidente M., Gannibal P., Krivorotov D., Chisty L., Berestetskiy A., Evidente A. Saponaroxins A-C, a new 19-oxa-tricyclohenicosatetraenone and, a new dioxacyclopropacycloundecene-10-carboaldehyde and its 6,7-dihydro derivative, produced by Alternaria saponariae, a pathogen of a medicinal plant Saponaria officinalis. Tetrahedron Let. 2016. V. 57 (15). P. 1702–1705.
Claydon N., Grove J.F., Pople M. Insecticidal secondary metabolic products from the entomogenous fungus Fusarium solani. J. Invertebrate Pathol. 1977. V. 30 (2). P. 216–223.
Cole M., Rolinson G.N. Microbial metabolites with insecticidal properties. Appl. Microbiol. 1972. V. 24 (4). P. 660–662.
Daisy B.H., Strobel G.A., Castillo U., Ezra D., Sears J., Weaver D.K., Runyon J.B. Naphthalene, an insect repellent, is produced by Muscodor vitigenus, a novel endophytic fungus. Microbiol. 2002. V. 148 (11). P. 3737–3741.
Fallon J., Kelly J., Kavanagh K. Galleria mellonella as a model for fungal pathogenicity testing // Methods Mol. Biol. 2012. V. 845. P. 469–485.
Findlay J.A., Buthelezi S., Li G., Seveck M., Miller J.D. Insect toxins from an endophytic fungus from wintergreen. J. Nat. Prod. 1997. V. 60 (11). P. 1214–1215.
Findlay J.A., Li G., Penner P.E., Miller J.D. Novel diterpenoid insect toxins from a conifer endophyte. J. Nat. Prod. 1995. V. 58 (2). P. 197–200.
Hamshou M., Smagghe G., Shahidi-Noghabi S., De Geyter E., Lannoo N., Van Damme E.J.M. Insecticidal properties of Sclerotinia sclerotiorum agglutinin and its interaction with insect tissues and cells. Insect Biochem. Mol. Biol. 2010a. V. 40 (12). P. 883–890.
Hamshou M., Van Damme E.J.M., Smagghe G. Entomotoxic effects of fungal lectin from Rhizoctonia solani towards Spodoptera littoralis. Fungal Biol. 2010b. V. 114 (1). P. 34–40.
Jang J.H., Kanoh K., Adachi K., Shizuri Y. Awajanomycin, a cytotoxic gamma-lactone-delta-lactam metabolite from marine-derived Acremonium sp. AWA16-1. J. Nat. Prod. 2006. V. 69 (9). P. 1358–1360.
Kinoshita T., Renbutsu Y., Khan I.D., Kohmoto K., Nishimura S. Distribution of tenuazonic acid production in the genus Alternaria and its pathological evaluation. Jap. J. Phytopathol. 1972. V. 38 (5). P. 397–404.
Kučera M. Proteases from the fungus Metarhizium anisopliae toxic for Galleria mellonella larvae. J. Invertebrate Pathol. 1980. V. 35 (3). P. 304–310.
Meléndez-González C., Murià-González M.J., Anaya A.L., Hernández-Bautista B.E., Hernández-Ortega S., Gonzá-lez M.C., Glenn A.E., Hanlin R.T., Macías-Rubalcava M.L. Acremoxanthone E, a novel member of heterodimeric polyketides with a bicyclo[3.2.2]nonene ring, produced by Acremonium camptosporum W. Gams (Clavicipitaceae) endophytic fungus. Chem Biodivers. 2015. V. 12 (1). P. 133–147.
Mitina G.V., Yuzikhin O.S., Isangalin F.S., Yakimov A.P. Isolation and identification of toxin with insecticidal activity from fungus Lecanicillium muscarium. Nauchnoye priborostroyenie. 2012. V. 22 (2). P. 3–10 (in Russ.).
Molnár I., Gibson D.M., Krasnoff S.B. Secondary metabolites from entomopathogenic hypocrealean fungi. Nat. Prod. Rep. 2010. V. 27 (9). P. 1241–1275.
Nakajima H., Ishihara A., Sawa Y., Sakuno E. 3-(4-Methylfuran-3-yl)propan-1-ol: a white-spotted stinkbug (Eysarcoris ventralis) repellent produced by an endophyte isolated from green foxtail. J. Agric. Food Chem. 2010. V. 58 (5). P. 2882–2885.
Popay A.J., Tapper B.A., Podmore C. Endophyte-infected meadow fescue and loline alkaloids affect Argentine stem weevil larvae. New Zeal. Plant Prot. 2009. V. 62. P. 19–27.
Puritch G.S. The toxic effects of fatty acids and their salts on the balsam woolly aphid, Adelges picea (Ratz.). Can. J. Forest Res. 1975. V. 5 (4). P. 515–522.
Rosell G., Quero C., Coll J., Guerrero A. Biorational insecticides in pest management. J. Pesticide Sci. 2008. V. 33(2). P. 103–121.
Safavi S.A. In vitro and in vivo induction, and characterization of beauvericin isolated from Beauveria bassiana and its bioassay on Galleria mellonella larvae. J. Agr. Sci. Tech. 2013. V. 15 (1). P. 1–10.
Selitskaya O.G., Gavrilova O.P., Schenikova A.V., Shamshev I.V., Gagkaeva T.Yu. The effect of toxin-produced Fusarium fungi on behaviour of the rice weevil Sitophilus oryzae L. (Coleoptera, Dryophthoridae). Entomol. Rev. 2014. V. 94 (6). P. 820–825.
Sharma I., Sharma A. Use of Alternaria spp as a pest control agent: a review. World Appl. Sci. J. 2014. V. 31 (11). P. 1869–1872.
Siegel M.R., Latch G.C.M., Bush L.P., Fannin F.F., Rowan D.D., Tapper B.A., Bacon C.W., Johnson M.C. Fungal endophyte-infected grasses: alkaloid accumulation and aphid response. J. Chem. Ecol. 1990. V. 16 (12). P. 3301–3315.
Siegler E.H. Some insecticidal properties of the fatty acid series. J. Agric. Res. 1924. V. 29 (5). P. 259–261.
Sokornova S.V., Yaroslavtseva O.N., Aleksandrova A.V., Lednev G.R., Borisov B.A. Ecology-genetic characteristics of Metarhizium sp. isolate MMB. Plant Prot. News 2016. V. 89 (3). P. 155–156 (in Russ.).
Stadler M., Tichy H.-V., Katsiou E., Hellwig V. Chemo-taxonomy of Pochonia and other conidial fungi with Verticillium-like anamorphs. Mycol. Progress. 2003. V. 2 (2). P. 95–122.
Tamarina N.A. Technical entomology – new branch of applied entomology. In: Itogi naki i tekhniki. Entomologiya, vol. 7. VINITI, Moscow, 1987 (in Russ.).
Usuki H., Toyo-oka M., Kanzaki H., Okuda T., Nitoda T. Pochonicine, a polyhydroxylated pyrrolizidine alkaloid from fungus Pochonia suchlasporia var. suchlasporia TAMA 87 as a potent beta-N-acetylglucosaminidase inhibitor. Bioorg. Med. Chem. 2009. V. 17 (20). P. 7248–7253.
Yang F.Z., Yang B., Li B.B., Xiao C. Alternaria toxin-induced resistance in rose plants against rose aphid (Macrosiphum rosivorum): effect of tenuazonic acid. J. Zhejiang Univ. Sci. B. 2015. V. 16 (4). P. 264–274.
Yang Z., Bao L.X., Yin Y., Ding G., Ge M., Chen D., Qian X. Pyrenocines N–O: two novel pyrones from Colletotrichum sp. HCCB03289. J. Antibiotics. 2014. V. 67 (11). P. 791–793.
Yokoyama E., Arakawa M., Yamagishi K., Hara A. Phylogenetic and structural analyses of the mating-type loci in Clavicipitaceae. FEMS Microbiol. Letters. 2006. V. 264 (2). 182–191.
Берестецкий А.О., Гасич Е.Л., Полуэктова Е.В., Николаева Е.В., Сокорнова С.В., Хлопунова Л.Б. (Berestetskiy et al.) Биологическая активность грибов филлосферы сорных и дикорастущих травянистых растений // Микробиология. 2014. Т. 83. № 5. С. 534–542.
Берестецкий А.О., Аполлонова Л.С., Сокорнова С.В., Черменская Т.Д. (Berestetskiy et al.) Инсектицидные свойства некоторых фитопатогенных аскомицетов // Вестник защиты растений. 2015. Т. 85. № 3. С. 52–54.
Митина Г.В., Юзихин О.С., Исангалин Ф.Ш., Якимов А.П. (Mitina et al.) Выделение и изучение химической структуры токсина с инсектицидной активностью из гриба Lecanicillium muscarium // Научное приборостроение. 2012. Т. 22. № 2. С. 3–10.
Селицкая О.Г., Гаврилова О.П., Щеникова А.В., Шамшев И.В., Гагкаева Т.Ю. (Selitskaya et al.) Влияние токсинопродуцирующих грибов рода Fusarium на поведение жуков рисового долгоносика Sitophilus oryzae L. (Coleoptera, Dryophthoridae) // Энтомол. обозрение. 2014. Т. 93. № 2. С. 303–310.
Сокорнова С.В., Ярославцева О.Н., Александрова А.В., Леднев Г.Р., Борисов Б.А. (Sokornova et al.) Эколого-генетическая характеристика изолята Metarhizium sp. MMB // Вестник защиты растений. 2016. Т. 89. № 3. P. 155–156.
Тамарина Н.А. (Tamarina) Техническая энтомология – новая отрасль прикладной энтомологии // Итоги науки и техники. Энтомология. Т. 7. М.: ВИНИТИ, 1987. 144 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


