Микология и фитопатология, 2019, T. 53, № 1, стр. 36-45
Деструкционная активность углеводородокисляющих микромицетов, выделенных из почв Кольского полуострова
А. А. Чапоргина 1, М. В. Корнейкова 1, *, Н. В. Фокина 1
1 Институт проблем промышленной экологии Севера Кольского НЦ РАН
184209 Апатиты, Россия
* E-mail: korneykova@inep.ksc.ru
Поступила в редакцию 02.04.2017
После доработки 25.07.2017
Принята к публикации 20.11.2018
Аннотация
Из почв Кольского полуострова выделены виды микроскопических грибов – активные деструкторы углеводородов нефти. Выявлено 18 видов микромицетов с высокой и 20 видов со средней деструкционной активностью, снижающих содержание нефти в среде за 14 суток на 80–98% и 50–79%, соответственно. Штаммы Penicillium canescens 1, P. commune, P. ochrochloron, P. restrictum и P. simplicissimum 1 обладали наибольшей деструкционной активностью. Штамм P. commune проявлял высокую активность разложения углеводородов нефти с первых дней эксперимента и за период в 1, 3, 7, 10 суток снижал содержание нефтепродуктов в среде до 18, 49, 73 и 87% от исходного уровня, соответственно. Наиболее эффективными по разложению нефтепродуктов среди ассоциаций микроорганизмов оказались бактериально-грибная ассоциация и бактериальная ассоциация с P. commune. Степень деструкции нефти за 3 суток составила 38 и 28%, а за 10 суток – 84 и 94%, соответственно. Изученные виды микромицетов и бактериально-грибные ассоциации могут быть использованы для создания активного биопрепарата, основанного на аборигенных микроорганизмах с его дальнейшим применением для биоремедиации почв.
В настоящее время в связи с продолжающимися аварийными ситуациями, особенно в районах добычи и транспортировки нефти, проблема ликвидации нефтяного загрязнения имеет важное экологическое и экономическое значение (April et al., 2000; Vodopyanov et al., 2009; Nilanjana et al., 2010; Panov et al., 2013). Попадая в окружающую среду, углеводороды нефти (УН) оказывают угнетающее действие на живые организмы и существенно изменяют условия их обитания.
Очистка нефтезагрязненных природных объектов является частью сложной экологической проблемы восстановления окружающей среды. Разработка приемов, направленных на снижение негативного воздействия нефтяных углеводородов на природные экосистемы, является на сегодняшний день актуальной задачей.
Микроскопические грибы являются важным компонентом микробного сообщества почвы. Известно, что основную роль в разложении углеводородов играет бактериальная микробиота (Bilay, Koval, 1980; Song et al., 1986; Kireeva, 1994; Myazin, Evdokimova, 2012), однако грибы вносят большой вклад в процесс самоочищения почвы от загрязнителей углеводородной природы (Bilay, Koval, 1980; Marfenina, 1982; Lebedeva et al., 1988; Field et al., 1992; April et al., 2000; Margesin et al., 2000; Cerniglia, Sutherland, 2001; Bulavko, Koronatova, 2004; Kireeva et al., 2005; Terekhova, 2007; Kokanina et al., 2010), особенно в кислых почвах, где создаются неблагоприятные условия для развития бактерий. Грибы обладают уникальной адаптационной способностью по отношению к неблагоприятным условиям окружающей среды за счет мощной ферментативной системы и обильного спорообразования (Kireeva et al., 2005; Zhukova, Morozov, 2007). Они способны расщеплять не только нефть, но и отдельные нефтепродукты (НП), в том числе и ароматические, используя их в качестве источника углерода и энергии (Grotenhuis et al., 1998; Allen, Wagner, 1999; Zaripova et al., 2001; Drachuk, 2004; Pyrchenkova et al., 2006; Glyaznecova, Zueva, 2013; Krivushina et al., 2016).
По данным отечественных и зарубежных авторов, изучающих различные таксономические группы грибов, было установлено, что наиболее активными в разложении НП являются грибы родов Aspergillus, Cladosporium, Penicillium, Fusarium, Trichoderma (Bilay, Koval, 1980; Cerniglia, Sutherland, 2001; Kasumova, 2004; Kireeva et al., 2005; Nadykta, Negri, 2006; Kazakov et al., 2007; Pinedo-Rivilla et al., 2009; Tigini et al., 2009; Galiullin et al., 2010; Habibullina, Ibatullina, 2011; Evdokimova et al., 2013).
В климатических условиях Мурманской области процессы деградации УН в почвах микроскопическими грибами практически не изучены. Слабый потенциал самоочищения арктических экосистем при коротком вегетационном периоде и низких температурах обуславливает необходимость поиска новых эффективных технологий очистки сред от нефтезагрязнений до максимально возможного уровня для восстановления нарушенных северных экосистем. Если природа более южных районов быстрее нивелирует следы, наносимые хозяйственной деятельностью человека, то природа Крайнего Севера легко разрушается в процессе ее освоения (Kryuchkov, 1976; Evdokimova, 1995).
Биологический метод доочистки почв от нефтяного загрязнения используется после механического и физико-химического этапов рекультивации загрязненной почвы. Он заключается во внесении в почву нефтеокисляющих микроорганизмов, ранее выделенных из загрязненных почв, и в стимулировании аборигенной нефтеокисляющей микробиоты агротехническими приемами (внесение удобрений, рыхление, увлажнение) (Ratledge, 1978; Kireeva, 1996; Koronelli, 1996; Kireeva et al., 2000; Kireeva et al., 2001; Ghazali et al., 2004; Tulyankin et al., 2007; Joo et al., 2008; Timergazina, Perehodova, 2012). Эффективность процесса очистки зависит от ряда факторов, в том числе от правильного выбора микроорганизма-деструктора. Для ликвидации региональных нефтезагрязнений предпочтительнее использование адаптированных к конкретным условиям микроорганизмов-нефтедеструкторов (Evdokimova, Masloboev, 2011). При этом упор делается на создание ассоциаций микроорганизмов, которые более эффективно окисляют НП по сравнению с отдельными видами (Smirnov et al., 2002).
Проводимые нами исследования носят опережающий характер, поскольку массовых разливов НП на наземных экосистемах Кольского полуострова, к счастью, пока не наблюдается. Разработка шельфа Баренцева моря, транспортировка нефтепродуктов могут привести к загрязнению, что подтверждается отечественной и мировой практикой в освоенных нефтегазовых районах.
Цель работы – выявление активных штаммов углеводородокисляющих микромицетов выделенных из почв Кольского полуострова для их дальнейшего использования при биоремедиации нефтезагрязненных почв.
МАТЕРИАЛЫ И МЕТОДЫ
Исследована деструкционная активность 81 штамма грибов, выделенных из загрязненных НП почв модельной полевой площадки на территории филиала Всероссийского института растениеводства “Полярная опытная станция” (ПОСВИР), расположенной в 1.5 км от г. Апатиты Мурманской обл. (67°34′ с.ш., 33°22′ в.д.), и почв горы Каскама, находящейся на северо-западе Кольского полуострова (69°16′ с.ш., 29°28′ в.д., 320 м над ур. м.). На территории ПОСВИРа почва представляет собой окультуренный Al–Fe гумусовый подзол, который был искусственно загрязнен легкими и тяжелыми НП в разных концентрациях в разные годы исследований (дизельное топливо – ДТ; ДТ + бензин-76 + мазут; мазут, стабильный газовый конденсат; ДТ + мазут) (Evdokimova et al., 2007; Korneykova et al., 2011; Evdokimova et al., 2013). Почва на г. Каскама загрязнена НП в результате деятельности воинской части.
Образцы почв для микологического анализа отбирали из слоя 0–10 см в трех повторностях. Всего было проанализировано 287 образцов. Идентификацию микроскопических грибов проводили на основе культурально-морфологических признаков с использованием определителей (Raper, Thom, 1949; Egorova, 1986; Klich 2002; Domsh et al., 2007; Samson et al., 2010; Seifert et al., 2011).
На первом этапе работы изучали нефтеокисляющую способность микроскопических грибов, выделенных из загрязненных почв. Культивирование грибов проводили в колбах Эрленмейера с 50 мл жидкой питательной среды Чапека следующего состава (г/л): NaNO3 – 3.0; KH2PO4 – 1.0; MgSO4 – 0.5; KCl – 0.5; FeSO4 – 0.01. 50 мл питательной среды инокулировали 5 мл суспензии микромицетов. В качестве источника углерода в среду вносили нефть в концентрации 1% по объему. Повторность опыта 3-кратная. Контролем служила стерильная среда с нефтью без грибов. Инкубацию проводили в термостате при температуре 27°C в течение 14 сут. Определение остаточного содержания нефтепродуктов в среде проводили методом инфракрасной спектрометрии на анализаторе АН-2 (Methods, 1998). Определяли также биомассу микромицетов, высушивая ее при 105°С до абсолютно сухой массы.
На втором этапе работы изучали деструкцию нефти наиболее активными штаммами микроскопических грибов по результатам предыдущего опыта (Penicillium canescens 1, P. commune, P. ochrochloron, P. restrictum, P. simplicissimum 1) в градиенте времени через 1, 3, 7 и 10 суток.
На третьем этапе проводили изучение деструкционной активности ассоциаций грибов и бактерий по отношению к нефтепродуктам в градиенте времени через 3, 7 и 10 суток. Для опыта были взяты наиболее активные штаммы микромицетов (P. canescens 1, P. commune, P. ochrochloron, P. restrictum, P. simplicissimum 1), а также активные углеводородокисляющие бактерии, ранее выделенные из почв Кольского полуострова (Pseudomonas fluorescens, P. putida, P. baetica, Microbacterium paraoxydans) (Evdokimova et al., 2009, 2012). Варианты опыта: контроль (К), бактериальная ассоциация (А1), грибная ассоциация (А2), бактериальная ассоциация + грибная ассоциация (А3), бактериальная ассоциация + Penicillium commune (А4), бактериальная ассоциация + P. canescens 1 (A5), бактериальная ассоциация + P. simplicissimum 1 (A6). 50 мл питательной среды инокулировали 1 мл бактериальной суспензии плотностью 107–108 клеток в 1 мл.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Выявление микромицетов – активных деструкторов НП. Способность усваивать УН не является особенностью отдельных родов и видов мицелиальных грибов, а свойственна им наравне с ассимиляцией других источников углерода. Это одна из наиболее важных физиологических функций не только мицелиальных грибов, но и других микроорганизмов (Kireeva et al., 2005).
Наибольшее количество видов грибов, используемых в лабораторном опыте, относились к роду Penicillium – 31 вид. Род Trichoderma был представлен 4 видами, Fusarium и Phoma –3 видами. Грибы родов Acremonium, Alternaria, Aspergillus, Aureobasidium, Botrytis, Cephalosporium, Cephalotrichum, Chaetomium, Сladosporium, Clonostachys, Fusicolla, Gibberella, Gibellulopsis, Gongronella, Humicola, Lecanicillium, Mucor, Pseudogymnoascus, Rhizopus, Rhodotorula, Scopulariopsis, Stachybotrys, Streptothrix, Talaromyces, Torula, Ulocladium, Umbelopsis, Wallrothiella были представлены 1–2 видами.
Известно, что токсичность нефти определяется главным образом наличием в ней летучих ароматических углеводородов (толуола, бензола, ксилола), нафталина и некоторых других фракций (Heath, 1993). Эти соединения сравнительно легко и быстро улетучиваются и разрушаются. Лабораторные исследования показали, что основная часть нефти, которую составляют легкие фракции (27%), в растворе уменьшилась за счет испарения. По данным Мак Джилла (McGill, 1977), Ю.С. Другова и А.А. Родина (Drugov, Rodin, 2007) путем испарения из почвы удаляется от 20 до 40% легких фракций УВ.
Полученные экспериментальные данные свидетельствуют о том, что во всех вариантах за время проведения опыта процессы деструкции нефтяных углеводородов происходили с разной интенсивностью (табл. 1).
Таблица 1.
Нефтеокисляющая активность изученных микромицетов за 14 суток
| Виды микромицетов | 1 | 2 | 3 | Виды микромицетов | 1 | 2 | 3 |
|---|---|---|---|---|---|---|---|
| I группа | A. repens (Corda) Sacc. | 6 | 0.074 | 0.100 | |||
| Alternaria alternata (Fr.) Keissl. | 83 | 0.304 | 0.515 | A. rutilum W. Gams | 20 | 0.117 | 0.123 |
| Fusarium solani (Mart.) Sacc. | 84 | 0.310 | 0.251 | Acremonium charticola (Lindau) W. Gams | 24 | 0.213 | 0.234 |
| F. oxysporum Schltdl. штамм 1 | 80 | 0.311 | 0.268 | Amorphotheca resinae Parbery | 20 | 0.170 | 0.174 |
| Penicillium commune Thom | 98 | 0.414 | 0.596 | Aureobasidium microstictum (Bubák) W.B. Cooke | 17 | 0.110 | 0.095 |
| P. canescens Sopp штамм 1 | 98 | 0.372 | 0.867 | A. pullulans (de Bary et Löwenthal) G. Arnaud | 9 | 0.054 | 0.097 |
| “ “ штамм 2 | 95 | 0.335 | 0.758 | Botrytis cinerea Pers. | 5 | 0.065 | 0.164 |
| “ “ штамм 3 | 88 | 0.229 | 0.651 | Cladosporium cladosporioides (Fresen.) G.A. de Vries | 19 | 0.160 | 0.071 |
| P. decumbens Thom | 92 | 0.266 | 0.810 | Cephalosporium bonordenii Sacc. | 37 | 0.204 | 0.191 |
| P. implicatum Biourge | 92 | 0.327 | 0.530 | C. nanum (Ehrenb.) S. Hughes | 9 | 0.050 | 0.090 |
| P. jensenii K.M. Zalesski штамм 1 | 84 | 0.312 | 0.667 | Clonostachys rosea (Link) Schroers, Samuels, Seifert et W. Gams | 44 | 0.281 | 0.402 |
| P. miczynskii K.M. Zalesski штамм 1 | 85 | 0.294 | 0.573 | Fusarium oxysporum штамм 2 | 4 | 0.053 | 0.178 |
| P. nigricans K.M. Zalesski | 84 | 0.245 | 0.847 | Gibberella fujikuroi (Sawada) Wollenw. | 20 | 0.170 | 0.293 |
| P. ochrochloron Biourge | 94 | 0.337 | 0.615 | Gibellulopsis nigrescens (Pethybr.) Zare, W. Gams et Summerb. | 17 | 0.222 | 0.183 |
| P. restrictum J.C. Gilman et E.V. Abbott | 95 | 0.330 | 0.738 | Gongronella butleri (Lendn.) Peyronel et Dal Vesco | 13 | 0.107 | 0.109 |
| P. simplicissimum (Oudem.) Thom штамм 1 | 96 | 0.353 | 0.687 | Humicola grisea Traaen | 3 | 0.020 | 0.280 |
| “ “ штамм 2 | 87 | 0.311 | 0.519 | Lecanicillium psalliotae (Treschew) Zare et W. Gams | 46 | 0.233 | 0.369 |
| P. velutinum J.F.H. Beyma | 93 | 0.253 | 0.335 | Mucor circinelloides Tiegh. | 10 | 0.116 | 0.163 |
| Ulocladium consortiale (Thum.) E.G. Simmons | 92 | 0.343 | 0.518 | M. hiemalis Wehmer | 25 | 0.149 | 0.104 |
| II группа | Penicillium aurantiogriseum штамм 3 | 28 | 0.245 | 0.461 | |||
| Acremonium egyptiacum (J.F.H. Beyma) W. Gams | 57 | 0.215 | 0.391 | “ “штамм 4 | 17 | 0.122 | 0.327 |
| Cephalotrichum stemonitis (Pers.) Nees | 62 | 0.257 | 0.563 | P. corylophilum Dierckx | 9 | 0.091 | 0.501 |
| Chaetomium bostrychodes Zopf | 60 | 0.294 | 0.365 | P. jensenii штамм 2 | 30 | 0.241 | 0.332 |
| Fusicolla merismoides (Corda) Gräfenhan, Seifert et Schroers | 57 | 0.218 | 0.224 | P. melinii Thom | 29 | 0.274 | 0.419 |
| Lecanicillium lecanii (Zimm.) Zare et W. Gams | 72 | 0.298 | 0.352 | P. raistrickii G. Sm. | 7 | 0.084 | 0.423 |
| Penicillium adametzii K.M. Zalesski | 75 | 0.267 | 0.716 | P. spinulosum штамм 3 | 4 | 0.033 | 0.119 |
| P. aurantiogriseum Dierckx штамм 1 | 79 | 0.269 | 0.620 | P. thomii Maire | 31 | 0.196 | 0.444 |
| “ “ штамм 2 | 67 | 0.247 | 0.418 | Phoma eupyrena Sacc. | 28 | 0.236 | 0.513 |
| P. canescens штамм 4 | 70 | 0.295 | 0.466 | Ph. glomerata (Corda) Wollenw. et Hochapfel | 13 | 0.029 | 0.279 |
| P. glabrum (Wehmer) Westling | 74 | 0.248 | 0.406 | Ph. herbarum Westend. | 25 | 0.205 | 0.236 |
| P. miczynskii штамм 2 | 73 | 0.265 | 0.525 | Pseudogymnoascus pannorum (Link) Minnis et D.L. Lindner | 33 | 0.233 | 0.185 |
| P. multicolor Grig.-Man. et Porad. | 50 | 0.231 | 0.407 | Rodotorula sp. | 10 | 0.087 | 0.128 |
| P. nalgiovense Laxa | 66 | 0.266 | 0.628 | Scopulariopsis communis Bainier штамм 1 | 33 | 0.195 | 0.168 |
| P. spinulosum штамм 2 | 74 | 0.281 | 0.463 | “ “штамм 2 | 15 | 0.109 | 0.165 |
| Rhizopus stolonifer (Ehrenb.) Vuill. | 76 | 0.285 | 0.485 | Streptothrix luteola Foul. et P.C. Jones | 8 | 0.107 | 0.311 |
| Stachybotrys echinata (Rivolta) G. Sm. | 70 | 0.239 | 0.406 | Talaromyces flavus (Klocker) Stolk et Samson | 8 | 0.126 | 0.289 |
| Talaromyces stipitatus C.R. Benj. | 62 | 0.270 | 0.361 | Trichoderma allii (Harz) Sacc. | 5 | 0.083 | 0.141 |
| Trichoderma viride Pers. | 67 | 0.233 | 0.283 | T. aureoviride Rifai | 19 | 0.162 | 0.165 |
| Umbelopsis isabellina (Oudem.) W. Gams | 63 | 0.294 | 0.415 | T. koningii Oudem. | 29 | 0.162 | 0.116 |
| Wallrothiella subiculosa Höhn. | 55 | 0.241 | 0.300 | T. polysporum (Link) Rifai | 23 | 0.136 | 0.044 |
| III группа | Torula herbarum (Pers.) Link | 27 | 0.180 | 0.186 | |||
| Aspergillus fumigatus Fresen. | 30 | 0.287 | 0.438 | Ulocladium longicollis (Dixon-Stew.) Y.N. Wang, X.Y. Liu et R.Y. Zheng | 41 | 0.230 | 0.391 |
По результатам лабораторного опыта разработана шкала деструкционной активности микроскопических грибов к УН за 14 суток. Все исследуемые культуры были разделены на 3 группы:
I – виды с высокой активностью, снижающие содержание нефти в среде на 80–98%;
II – виды со средней активностью, снижающие содержание нефти в среде на 50–79%;
III – виды с низкой активностью, снижающие содержание нефти в среде на 49% и менее.
Группа видов с низкой нефтедеструкционной активностью, представленная 43 видами, является наиболее разнообразной по видовому составу. Эти грибы имеют слабую способность роста на нефтяных углеводородах и не представляют особого интереса для дальнейшего изучения. Группа видов со средней активностью представлена 20 видами грибов.
К группе активных деструкторов отнесено 18 штаммов микромицетов: Alternaria alternata, Fusarium oxysporum, F. solani, Penicillium canescens (штаммы 1, 2, 3), P. commune, P. decumbens, P. implicatum, P. jensenii (штамм 1), P. miczynskii (штамм 1), P. nigricans, P. ochrochloron, P. restrictum, P. simplicissimum (штаммы 1, 2), P. velutinum, Ulocladium consortiale. Среди них по видовому разнообразию преобладал род Penicillium, представители которого являются устойчивыми и к другим типам загрязнений (Evdokimova et al., 2005; Marfenina, 2005).
Процесс разложения УН наиболее интенсивно протекал у 5 видов грибов: Penicillium canescens 1, P. simplicissimum 1, P. commune, P. ochrochloron, P. restrictum. Мы проверили способность активных культур к деструкции УН в градиенте времени.
Изучение нефтедеструкционной активности микромицетов в градиенте времени. Процесс естественного восстановления загрязненных нефтью почв длителен по времени, поэтому необходимо создавать и внедрять современные технологии рекультивации нарушенных территорий. Главным критерием таких технологий принято считать скорость разложения компонентов нефти. Важным показателем является интенсивность поглощения УН микроорганизмами за кратчайшие сроки. Через определенный интервал времени мы проводили анализы на содержание остаточных НП для выявления динамики степени деструкции под воздействием микромицетов.
Микроскопические грибы, изучаемые в опыте, проявляли разную активность потребления компонентов нефти (рис. 1).
Рис. 1.
Степень деструкции нефти активными штаммами рода Penicillium в градиенте времени: 1 – 1-е сутки, 2 – 3-и сутки, 3 – 7-е сутки, 4 – 10-е сутки.
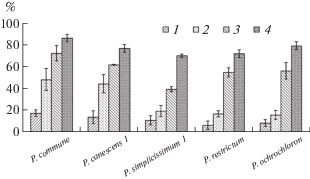
Уже за 1-е сутки грибы разлагали от 6 до 18% НП, на 3-и сутки – от 16 до 49%, на 7-е – от 40 до 73%, на 10-е – от 71 до 87% НП от исходного количества. Наибольшую деструкционную активность на протяжении всего эксперимента проявлял Penicillium commune, наименьшую – P. canescens 1. Скорость деструкции НП у изучаемых видов микромицетов изменялась в течение эксперимента (табл. 2). Так, у наиболее активного деструктора P. commune она была высокой уже на 3-и сутки эксперимента и еще немного увеличилась к 7 и 10-м суткам. У остальных видов в первые дни опыта скорость деструкции была в 1.5–3 раза меньше по сравнению с P. commune. К 7-м суткам скорость деструкции значительно возросла еще у трех видов – P. canescens 1, P. restrictum и P. ochrochloron. На 10-е сутки все исследуемые виды имели высокую скорость разложения НП – 0.123–0.152 г/сутки.
Таблица 2.
Скорость убыли нефти из жидкой среды в градиенте времени (г/сутки)
| Вариант | Сутки | |||
|---|---|---|---|---|
| 1-е | 3-и | 7-е | 10-е | |
| Penicillium canescens штамм 1 | 0.040 | 0.103 | 0.128 | 0.138 |
| P. commune | 0.049 | 0.138 | 0.163 | 0.157 |
| P. ochrochloron | 0.024 | 0.062 | 0.127 | 0.145 |
| P. restrictum | 0.013 | 0.039 | 0.107 | 0.129 |
| P. simplicissimum штамм 1 | 0.031 | 0.046 | 0.058 | 0.126 |
| А1 (бактериальная ассоциация) | – | 0.049 | 0.097 | 0.099 |
| А2 (грибная ассоциация) | – | 0.040 | 0.068 | 0.090 |
| А3 (бактериальная ассоциация + грибная ассоциация) | – | 0.071 | 0.069 | 0.114 |
| А4 (бактериальная ассоциация + P. commune) | – | 0.075 | 0.138 | 0.111 |
| А5 (бактериальная ассоциация + P. canescens штамм 1) | – | 0.032 | 0.052 | 0.071 |
| А6 (бактериальная ассоциация + P. simplicissimum штамм 1) | – | 0.044 | 0.006 | 0.074 |
Изучение нефтедеструкционной активности ассоциаций микроорганизмов в градиенте времени. Необходимость использования ассоциаций, состоящих из двух и более видов микроорганизмов-деструкторов, вызвана сложным химическим составом нефти.
В опыте с ассоциациями микроорганизмов на 3-и сутки происходило снижение НП в среде от 11 до 38%, на 7-е сутки – от 17 до 83%, на 10-е сутки – до 94% (рис. 2). Наиболее эффективными оказались варианты А3 (бактериальная + грибная ассоциация), А2 (грибная ассоциация) и А4 (бактериальная ассоциация + P. commune). Первые два варианта показали наилучший результат на 3-и сутки эксперимента, а последняя из перечисленных ассоциация была наиболее активна на 7 и 10-е сутки. Следует отметить, что ассоциация бактерий (вариант А1) в данном опыте оказалась более пассивной по отношению к УН – деструкция составила 20% за 10 суток.
Рис. 2.
Степень деструкции нефти ассоциациями микроорганизмов в градиенте времени. Варианты опыта: бактериальная ассоциация (А1), грибная ассоциация (А2), бактериальная ассоциация + грибная ассоциация (А3), бактериальная ассоциация + Penicillium commune (A4), бактериальная ассоциация + P. canescens 1 (A5), бактериальная ассоциация + P. simplicissimum 1 (A6). 1 – 3-и сутки, 2 – 7-е сутки, 3 – 10-е сутки.
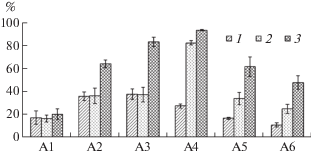
Скорость разложения НП на 3-и сутки эксперимента изменялась от 0.03 до 0.08 г/сутки в разных вариантах опыта (табл. 2). Наибольшей она была у ассоциаций А4 (бактериальная ассоциация + P. commune) и А3 (бактериальная + грибная ассоциация) на протяжении всего эксперимента. Для варианта А3 максимум отмечался на 10-е сутки, для варианта А4 – на 7-е сутки.
Таким образом, микроскопические грибы, выделенные из почв Кольского полуострова, проявляют избирательное отношение к деструкции нефтепродуктов. Выявлены группы активных и потенциальных деструкторов, а также видов микромицетов, частично устойчивых и/или чувствительных к углеводородам нефти. Из 81 исследованного штамма 18 штаммов снижали содержание нефтепродуктов в среде за 14 суток более чем на 80%. Наибольшей нефтедеструкционной способностью обладали штаммы P. commune (98%), P. canescens 1 (98%), P. simplicissimum 1 (96%), P. restrictum (95%), P. ochrochloron (94%). P. commune имел высокую скорость разложения НП уже с первых дней эксперимента и снижал содержание НП в среде за 1, 3, 7 и 10-е сутки до 18, 49, 73 и 87% соответственно от исходного уровня. Наиболее эффективными по разложению НП среди ассоциаций микроорганизмов оказались комплексная бактериально-грибная ассоциации (А3) и бактериальная ассоциация с P. commune (А4). Количество разложенной ими нефти на 3-и сутки составило 38 и 28%, а к 10-м суткам – 84 и 94%, соответственно. Изученные штаммы и ассоциации могут быть использованы для создания биопрепаратов и их дальнейшего применения при биоремедиации нефтезагрязненных почв.
Авторы выражают благодарность заведующей лаборатории экологии микроорганизмов д.б.н., профессору Г.А. Евдокимовой за ценные советы в ходе проведения работы, а также к.б.н. В.А. Мязину за помощь в освоении метода определения НП.
Список литературы
Allen C.A., Wagner S.C. Rhizospere activity of plants inhabiting an oil spill in Ray E. Larsen Sandyland Sanctuaru. In: American Society for Microbiology 99th general meeting, Chicago, 1999. P. 609.
April T.M., Foght J.M., Currah R.S. Hydrocarbon-degrading filamentous fungi isolated from flare pit soils in northern and western Canada. Can. J. Microbiol. 2000. V. 46 (1). P. 38–49.
Bilay V.I., Koval E.Z. The growth of fungi on petroleum hydrocarbons. Naukova dumka, Kiev, 1980 (in Russ.).
Bulavko G.I., Koronatova N.G. The rate of formation of the destruction unit in soils of Northern boreal forest when recovering of sand quarries. In: Materialy IV Dokuchaevskogo obshchestva pochvovedov. Vol. 2. Novosibirsk, Nauka, 2004. P. 543 (in Russ.).
Cerniglia C.E., Sutherland T.B. Bioremediation of polycyclic aromatic hydrocarbons by ligninolytic and non-ligninolytic fungi. In: Fungi in Bioremediation. London, 2001. P. 136–187.
Domsch K.H., Gams W., Anderson T.H. Compendium of soil fungi. 2nd ed. IHW-Verlag Eching, 2007.
Drachuk S.V. Photoheterotrophic purple bacteria in soils contaminated with hydrocarbons. Cand. Biol. Thesis. TGU, Tyumen, 2004 (in Russ.).
Drugov Yu.S., Rodin A.A. Environmental analyses for oil spills and oil products. Moscow, 2007 (in Russ.).
Egorova L.N. Soil fungi of Far East. Nauka, Leningrad, 1986 (in Russ.).
Evdokimova G.A. Ecological and microbiological basis for soil protection of the Far North. Apatity, 1995 (in Russ.).
Evdokimova G.A., Mozgova N.P. Tundra microorganisms and forest podzols of the Kola North. Apatity, 2001 (in Russ.).
Evdokimova G.A., Masloboev V.A. Bioremediation of soils contaminated with oil products in the conditions of the Kola North. Murmanshelf Info. 2011. V. 2 (15). P. 34–38 (in Russ.).
Evdokimova G.A., Masloboev V.A., Mozgova N.P., Myazin V.A., Fokina N.V. Bioremediation of oil-polluted cultivated soils in the Euro-Arctic Region. Environmental Science and Engineering. 2012. V. 1 (9). P. 1130–1136.
Evdokimova G.A., Korneykova M.V., Myazin V.A. Assessment of the dynamics of gas condensate removal from the Al–Fe-humus podzols and its effect on soil fungal complexes. Pochvovedenie. 2013. V. 3. P. 343–350 (in Russ.).
Evdokimova G.A., Mozgova N.P., Korneykova M.V., Akhtulova E.M., Mikhaylova I.V. The impact of soil pollution with diesel fuel at plants and rhizosphere microbiota on the Kola Peninsula. Agrokhimiya. 2007. V. 12. P. 1–7 (in Russ.).
Evdokimova G.A., Mozgova N.P., Mikhaylova I.V. Methods of bioremediation of soils at the Kola Peninsula diesel pollution. Agrokhimiya. 2009. V. 6. P. 61–66 (in Russ.).
Evdokimova G.A., Zenkova I.V., Mozgova N.P., Pereverzev V.N. Soil and soil biota in the environments of fluorine pollution. Apatity, 2005 (in Russ.).
Field J.A., Jonf E.D., Costa G.F., Bont J.A. Biodegradation of polyaromatic hydrocarbons by new isolates of white rot fungi. Environmental Microbiol. 1992. V. 58 (7). P. 2219–2226.
Galiullin R.V. Comparative assessment of the decomposition of gas condensate and oil hydrocarbons in the soil under the action of biological agents. Agrokhimiya. 2010. V. 10. P. 52–58 (in Russ.).
Ghazali F.M., Rahman R.N., Salleh A.B., Basri M. Biodegradation of hydrocarbons in soil by microbial consortium. Biodeterior. Biodeg. 2004. V. 54 (1). P. 61–67.
Glyaznetsova Yu.S., Zueva I.N. Bioremediation of contaminated soils in the North. Mezhdunarodnyy zhurnal prikladnykh i fundamentalnykh issledovaniy. 2013. V. 8 (2). P. 214–216 (in Russ.).
Grotenhuis T., Fied L., Wasseveld R., Rulkens W. Biodegradation of polyaromatic hydrocarbons (PAH) in polluted soil by the white-rot fungus Bjerkandera. Chem. Technol. Biotechnol. 1998. V. 71 (4). P. 359–360.
Habibullina F.M., Ibatullina I.Z. Transformation of micromycetes community in peat-gley soils of the Far North at oil contamination. Teoreticheskaya i prikladnaya ekologiya. 2011. V. 3. P. 76–86 (in Russ.).
Heath J.S. Review of chemical, physical and toxicological properties of components of total petroleum hydrocarbons. Soil Contamination. 1993. V. 2. P. 548–611.
Joo H.S., Ndegwa P.M., Shoda M., Phae Ch.G. Bioremediation of oil-contaminated soil using Candida catenulate and food waste. Environmental Pollution. 2008. V. 156 (3). P. 891–896.
Kasumova S.Yu. Environmental aspects of naphthalan oil assimilation by fungi. In: I Mezhdunarodnaya nauchnaya konferentsiya “Aktualnye problemy ekologii”. Lipetsk, 2004. P. 76–79 (in Russ.).
Kazakov A.V. Preparation of oil-contaminated soil to conduct a phase phytoremediation. In: II Mezhdunarodnaya nauchnaya konferentsiya “Sovremennye problemy zagryazneniya pochv”. T. 2. Moscow, 2007. P. 293–294 (in Russ.).
Kireeva N.A. Microbiological processes in oil-polluted soils. Ufa, 1994 (in Russ.).
Kireeva N.A. Biodegradation of oil in the soil hydrocarbon cultures of microorganisms. Biotekhnologiya. 1996. V. 1. P. 51–54 (in Russ.).
Kireeva N.A., Gallimzyanova N.F., Miftakhova A.M. Micromycetes which contaminate the soil with oil, and their phytotoxicity. Mikologiya i fitopatologiya. 2000. V. 34 (1). P. 36–41 (in Russ.).
Kireeva N.A., Vodopyanov V.V., Miftakhova A.M. Biological activity of oil-contaminated soil. Ufa, 2001 (in Russ.).
Kireeva N.A., Miftakhova A.M., Bakaeva M.D., Vodopya-nov V.V. Complexes of soil micromycetes in technoge-nesis. Ufa, 2005 (in Russ.).
Klich M.A. Identification of common Aspergillus species. Utrecht, 2002.
Kokanina A.V., Marchenko M.Yu., Barkov A.V., Leonteva M.I., Avtonomova A.V., Vinkurov V.A., Krasnopolskaya L.M. The use of basidiomycetes in order to increase the efficiency of remediation of oil-contaminated soils. Bashkirskiy khimicheskiy zhurnal. 2010. V. 17 (3). P. 123–129 (in Russ.).
Korneykova M.V., Evdokimova G.A., Lebedeva E.V. The complexes of microscopic fungi in oil products polluted cultivated soil on Kola North. Mikologiya i fitopatologiya. 2011. V. 45 (3). P. 249–256 (in Russ.).
Koronelli T.V. Principles and methods for intensification biodegradation of hydrocarbons in the environment (a review). Prikladnaya biokhimiya i mikrobiologiya. 1996. V. 32 (6). P. 579–585 (in Russ.).
Krivushina A.A., Chekunova L.N., Mokeeva V.L., Polyakova A.V. Micromycetes in fuel tanks of exploiting planes. Mikologiya i fitopatologiya. 2016. V. 50 (2). P. 108–114 (in Russ.).
Kryuchkov V.V. A vulnerable Subarctics. Nauka, Moscow, 1976 (in Russ.).
Lebedeva E.V., Kanevskaya I.G., Trilesnik G.I. Impact of petrochemical contaminants in soil micromycetes. Vestnik Leningradskogo gosudarstevennogo universiteta. 1988. V. 4 (3). P. 31–35 (in Russ.).
Marfenina O.E. Influence of some anthropogenic impacts on a variety complex of soil micromycetes and biomass mycelium. In: Struktura i funktsii mikrobnykh soobshchestv s razlichnoy antropogennoy nagruzkoy. Naukova dumka, Kiev, 1982 (in Russ.).
Marfenina O.E. Anthropogenic ecology of soil fungi. Moscow, 2005 (in Russ.).
McGill W.W. Soil restoration following oil spills – a review. Petroleum Technology. 1977. V. 16 (2). P. 60–67.
Methods of measurement of the mass fraction of petroleum products in soils and sediments by IR spectrometry. PND F 16.1 : 2.2.22-98. Moscow, 1998 (in Russ.).
Myazin V.A., Evdokimova G.A. The biological activity of the soil of the northern polar regions when oil pollution. Inzhenernaya ekologiya. 2012. V. 1. P. 17–23 (in Russ.).
Nadykta V.D., Negri K. Remediation of soil contaminated with petroleum hydrocarbons. In: III Mezhdunarodnaya konferentsiya. Tezisy dokladov. Pushchino, 2006. P. 103 (in Russ.).
Nilanjana D., Preethy Ch. Microbial degradation of petroleum hydrocarbon contaminants: an overview. Biotechnology Research International 2011. P. 1–13.
Panov A.V., Esikova T.Z., Sokolov S.L., Kosheleva I.A., Boronin A.M. The impact of soil contamination on the composition of the microbial community. Mikrobiologiya. 2013. V. 82 (2). P. 239–246 (in Russ.).
Pinedo-Rivilla C., Aleu J., Collado I.G. Pollutants biodegradation by fungi. Current Organic Chemistry. 2009. V. 13 (12). P. 1194–1214.
Pyrchenkova I.A., Gafarov A.B., Puntus I.F. Selection and characterization of active psychrophilic microorga-nisms – destructors of oil. Prikladnaya biokhimiya i mikrobiologiya. 2006. V. 42 (3). P. 298–305 (in Russ.).
Raper K.B., Thom C.A. Manual of the Penicillia. Heffner publishing company, N.Y., London, 1949.
Ratledge G. Degradation of aliphatic hydrocarbons. Applied Science Publishers, London, 1978.
Samson R.A., Houbraken J., Thrane U., Frisvard J.C., Andersen B. Food and indoor fungi. Utrecht, 2010.
Seifert K., Morgan-Jones G., Gams W., Kendrick B. The genera of Hyphomycetes. Utrecht, 2011.
Smirnov V.N., Ryabkin M.V., Vinarov A.Yu. Selection of industrial strains of microorganisms for the biodegradation of the phenolic compounds in a number of air-gas and water flows. Biotekhnologiya. 2002. V. 3. P. 67–69 (in Russ.).
Song H.G., Bartha R. Bacteria and fungi contributions to hydrocarbon mineralization in soil. Abstracts of the annual meeting of the American society for microbiology, Washington, 1986. P. 302.
Terekhova V.A. Micromycetes in the environmental assessment of aquatic and terrestrial ecosystems. Nauka, Moscow, 2007 (in Russ.).
Tigini V., Prigione V., Di Toro S., Fava F., Varese G.C. Isolation and characterization of polychlorinated biphenyl (PCB) degrading fungi from a historically contaminated soil. Microbial Cell Factories. 2009. V. 8 (5). P. 1–14.
Timergazina A.F., Perehodova L.S. On the problem of biological oxidation of petroleum and petroleum hydrocarbon-oxidizing microorganisms. Neftegazovaya geologiya. Teoriya i praktika. 2012. V. 7 (1). P. 1–28 (in Russ.).
Tulyankin G.M., Archegova I.B., Habibullina F.M., Gridin O.M., Shubakov A.A., Taskaev A.I., Terexova V.A., Zhuchikhin Yu.S., Kozminykh A.N. Ecological bases of the optimized technology of restoration of oil-contaminated natural sites in the North. Syktyvkar, 2007 (in Russ.).
Vodopyanov V.V., Kireeva N.A., Grigoriadi A.S., Yakupova A.B. The impact of oil pollution of soil on the rhizosphere microbiota and modeling of processes of biodegradation. Vestnik Orenburgskogo gosudarstvennogo universiteta. 2009. V. 6. P. 545–547 (in Russ.).
Zaripova S.K., Rakhimova E.R., Garusov A.V., Sabirova Yu.S., Egorova K.V., Naumova R.P. Remediation of contaminated soils in the conditions of the accompanying oil pollution. In: Ekobiotekhnologiya: borba s neftyanym zagryazneniem okruzhayushchey sredy. Pushchino, 2001. P. 45–46 (in Russ.).
Zhukova O.V., Morozov N.V. Research of relations between hydrocarbon-oxidizing microorganisms in associations that are used for controlled natural and waste waters from oil pollution. Vestnik Tatarskogo gosudarstvennogo gumanitarno-pedagogicheskogo universiteta. 2007. V. 2–3 (9–10). P. 100–107 (in Russ.).
Билай В.И., Коваль Э.З. (Bilay, Koval) Рост грибов на углеводородах нефти. Киев: Наукова Думка, 1980. 254 с.
Булавко Г.И., Коронатова Н.Г. (Bulavko, Koronatova) Скорость формирования деструкционного звена в почвах Северной тайги при восстановлении песчаных карьеров // Почвы – национальное достояние России. Материалы IV Докучаевского общества почвоведов. Кн. 2. Новосибирск: Наука – Центр, 2004. С. 543.
Водопьянов В.В., Киреева Н.А., Григориади А.С., Якупова А.Б. (Vodopyanov et al.) Влияние нефтяного загрязнения почвы на ризосферную микробиоту и моделирование процессов биодеградации // Вестник ОГУ. 2009. № 6. С. 545–547.
Галиулин Р.В., Галиулина Р.А., Башкин В.Н., Акопова Г.С., Листов Е.Л., Балакирев И.В. (Galiullin et al.) Сравнительная оценка разложения углеводородов газового конденсата и нефти в почве под действием биологических средств // Агрохимия. 2010. № 10. С. 52–58.
Глязнецова Ю.С., Зуева И.Н. (Glyaznetsova, Zueva) Биоремедиация нефтезагрязненных почв в условиях Севера // Международный журнал прикладных и фундаментальных исследований. 2013. № 8. С. 214–216.
Драчук С.В. (Drachuk) Фотогетеротрофные пурпурные бактерии в почвах, загрязненных углеводородами. Автореф. дис… канд. биол. наук. Тюмень: ТГУ, 2004. 23 с.
Другов Ю.С., Родин А.А. (Drugov, Rodin) Экологические анализы при разливах нефти и нефтепродуктов. Практическое руководство. М.: Лаборатория знаний, 2007. 270 с.
Евдокимова Г.А., Корнейкова М.В., Мязин В.А. (Evdokimova et al.) Оценка динамики выноса газового конденсата из Al–Fe-гумусового подзола и его воздействия на комплексы почвенных грибов // Почвоведение. 2013. № 3. С. 343–350.
Евдокимова Г.А. (Evdokimova) Эколого-микробиологические основы охраны почв Крайнего Севера. Апатиты: КНЦ РАН, 1995. 272 с.
Евдокимова Г.А., Мозгова Н.П. (Evdokimova, Mozgova) Микроорганизмы тундровых и лесных подзолов Кольского Севера. Апатиты: КНЦ РАН, 2001. 184 с.
Евдокимова Г.А., Зенкова И.В., Мозгова Н.П., Переверзев В.Н. (Evdokimova et al.) Почва и почвенная биота в условиях загрязнения фтором. Апатиты: КНЦ РАН, 2005. 155 с.
Евдокимова Г.А., Мозгова Н.П., Корнейкова М.В., Ахтулова Е.М., Михайлова И.В. (Evdokimova et al.) Воздействие загрязнения почв дизельным топливом на растения и ризосферную микробиоту на Кольском Севере // Агрохимия. 2007. № 12. С. 1–7.
Евдокимова Г.А., Мозгова Н.П., Михайлова И.В. (Evdokimova et al.) Способы биоремедиации почв Кольского Севера при загрязнении дизельным топливом // Агрохимия. 2009. № 6. С. 61–66.
Евдокимова Г.А., Маслобоев В.А. (Evdokimova, Masloboev) Биоремедиация загрязненных нефтепродуктами почв в условиях Кольского Севера // МурманшельфИнфо. 2011. № 2 (15). С. 34–38.
Егорова Л.Н. (Egorova) Почвенные грибы Дальнего Востока. Л.: Наука, 1986. 192 с.
Жукова О.В., Морозов Н.В. (Zhukova, Morozov) Исследование взаимоотношений углеводородокисляющих микроорганизмов в ассоциациях, используемых для управляемой очистки природных и сточных вод от нефтяных загрязнений // Вестник Татарского государственного гуманитарно-педагогического университета. 2007. № 2–3 (9–10). С. 100–107.
Зарипова С.К., Рахимова Э.Р., Гарусов А.В., Сабирова Ю.С., Егорова К.В., Наумова Р.П. (Zaripova et al.) Ремедиация нефтезагрязненных почв в условиях сопутствующего нефтяного загрязнения // Экобиотехнология: борьба с нефтяным загрязнением окружающей среды. Тезисы докл. конф. Пущино, 2001. С. 45–46.
Казаков А.В., Злотников К.М., Злотников А.К. (Kazakov et al.) Подготовка нефтезагрязненных почв к проведению этапа фиторемедиации // II Международная научная конференция “Современные проблемы загрязнения почв”: сборник материалов. Том 2. М.: Изд-во МГУ, 2007. С. 293–294.
Касумова С.Ю. (Kasumova) Экологические аспекты ассимиляции нафталановой нефти грибами // I Международная научная конференция “Актуальные проблемы экологии”: материалы конференции. Липецк, 2004. С. 76–79.
Киреева Н.А. (Kireeva) Биодеструкция нефти в почве культурами углеводородокисляющих микроорганизмов // Биотехнология. 1996. № 1. С. 51–54.
Киреева Н.А. (Kireeva) Микробиологические процессы в нефтезагрязненных почвах. Уфа: Изд-во БашГУ, 1994. С. 172.
Киреева Н.А., Галлимзянова Н.Ф., Мифтахова А.М. (Kireeva et al.) Микромицеты почв, загрязненных нефтью, и их фитотоксичность // Микология и фитопатология, 2000. Т. 34. Вып. 1. С. 36–41.
Киреева Н.А., Водопьянов В.В., Мифтахова А.М. (Kireeva et al.) Биологическая активность нефтезагрязненных почв. Уфа: Гилем, 2001. 376 с.
Киреева Н.А., Мифтахова А.М., Бакаева М.Д., Водопьянов В.В. (Kireeva et al.) Комплексы почвенных микромицетов в условиях техногенеза. Уфа: Гилем, 2005. 358 с.
Коканина А.В., Марченко М.Ю., Барков А.В., Леонтьева М.И., Автономова А.В., Винкуров В.А., Краснопольская Л.М. (Kokanina et al.) Использование базидиальных грибов с целью повышения эффективности рекультивации нефтезагрязненных почв // Башкирский химический журнал. 2010. Т. 17. № 3. С. 123–129.
Корнейкова М.В., Евдокимова Г.А., Лебедева Е.В. (Korneykova et al.) Комплексы микроскопических грибов в загрязненных нефтепродуктами агроземах в условиях Кольского Севера // Микология и фитопатология. 2011. Т. 45. Вып. 3. С. 249–256.
Коронелли Т.В. (Koronelli) Принципы и методы интенсификации биологического разрушения углеводородов в окружающей среде (обзор) // Прикладная биохимия и микробиология. 1996. Т. 32. № 6. С. 579–585.
Кривушина А.А., Чекунова Л.Н., Мокеева В.Л., Полякова А.В. (Krivushina et al.) Изучение микромицетов, обнаруженных в топливных баках эксплуатирующихся самолетов // Микология и фитопатология. 2016. Т. 50. Вып. 2. С. 108–114.
Крючков В.В. (Kryuchkov) Чуткая Субарктика. М.: Наука, 1976. 136 с.
Лебедева Е.В., Каневская И.Г., Трилесник Г.И. (Lebedeva et al.) Влияние нефтехимических загрязнений на микромицеты почвы // Вестник ЛГУ. Серия 3. 1988. № 4. С. 31–35.
Марфенина О.Е. (Marfenina) Антропогенная экология почвенных грибов. М.: Медицина для всех, 2005. 196 с.
Марфенина О.Е. (Marfenina) Влияние некоторых антропогенных воздействий на разнообразие комплексов почвенных микромицетов и биомассу мицелия // Структура и функции микробных сообществ с различной антропогенной нагрузкой. Киев: Наукова думка, 1982. 174 с.
Методика выполнения измерений массовой доли нефтепродуктов в почвах и донных отложениях методом ИК-спектрометрии: ПНД Ф 16.1:2.2.22-98 (Methods…). М., 1998. 15 с.
Мязин В.А., Евдокимова Г.А. (Myazin, Evdokimova) Биологическая активность почв северных приполярных областей при загрязнении нефтепродуктами // Инженерная экология. 2012. № 1. С. 17–23.
Надыкта В.Д., Негри К. (Nadykta, Negri) Ремедиация почв, загрязненных углеводородами нефти // III Международная конференция “Международное сотрудничество в биотехнологии: Ожидания и реальность”. Тезисы докладов. Пущино, 2006. С. 103.
Панов А.В., Есикова Т.З., Соколов С.Л., Кошелева И.А., Боронин А.М. (Panov et al.) Влияние загрязнения почвы на состав микробного сообщества // Микробиология. 2013. Т. 82. № 2. С. 239–246.
Пырченкова И.А., Гафаров А.Б., Пунтус И.Ф. (Pyrchenkova et al.) Выбор и характеристика активных психотрофных микроорганизмов-деструкторов нефти // Прикладная биохимия и микробиология. 2006. Т. 42. № 3. С. 298–305.
Смирнов В.Н., Рябкин М.В., Винаров А.Ю. (Smirnov et al.) Селекция промышленных штаммов микроорганизмов для биодеградации соединений фенольного ряда в газовоздушных и водных потоках // Биотехнология. 2002. № 3. С. 67–69.
Терехова В.А. (Terekhova) Микромицеты в экологической оценке водных и наземных экосистем. М.: Наука, 2007. 215 с.
Тимергазина А.Ф., Переходова Л.С. (Timergazina, Perekhodova) К проблеме биологического окисления нефти и нефтепродуктов углеводородокисляющими микроорганизмами // Нефтегазовая геология. Теория и практика, 2012. Т. 7. № 1. С. 1–28.
Тулянкин Г.М., Арчегова И.Б., Хабибуллина Ф.М., Гридин О.М., Шубаков А.А., Таскаев А.И., Терехова В.А., Жучихин Ю.С., Козьминых А.Н. (Tulyankin et al.) Монография: Экологические основы оптимизированной технологии восстановления нефтезагрязненных природных объектов на Севере. Сыктывкар, КНЦ УрО РАН, 2007. 140 с.
Хабибуллина Ф.М., Ибатуллина И.З. (Habibullina, Ibatullina) Трансформация сообщества микромицетов в торфяно-глеевых почвах Крайнего Севера при нефтяном загрязнении // Теоретическая и прикладная экология. 2011. № 3. С. 76–86.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


