Микология и фитопатология, 2019, T. 53, № 2, стр. 115-123
РОЛЬ ПОЛОВОГО ПРОЦЕССА В СОХРАНЕНИИ ЧУЖЕРОДНОЙ ТРАНСЛОКАЦИИ ГЕНА TOXA В ГЕНОМЕ PYRENOPHORA TRITICI-REPENTIS
Н. В. Мироненко *, О. А. Баранова, Н. М. Коваленко
Всероссийский НИИ защиты растений
196608 Санкт-Петербург, Россия
* E-mail: nina2601mir@mail.ru
Поступила в редакцию 18.05.2018
После доработки 02.10.2018
Принята к публикации 21.12.2018
Аннотация
Одним из основных факторов патогенности возбудителя желтой пятнистости пшеницы гомоталличного аскомицета Pyrenophora tritici-repentis является токсин Ptr ToxA, индуцирующий некроз у восприимчивых сортов. Продукция данного эффектора детерминирована геном ToxA, который привнесен в геном гриба в результате горизонтального переноса. Считают, что чужеродная транслокация вызвала резкое возрастание патогенных свойств гриба и обусловила его широкое распространение по всему миру. Мы показали, что частота изолятов, имеющих ToxA (ToxA+) существенно ниже в популяциях северных регионов, чем в южных. Для объяснения данного явления мы предположили, что механизмом, ограничивающим распространение изолятов ToxA+ на север может быть мейотический дрейф гена ToxA в результате скрещиваний спонтанных мутантов по локусу типа спаривания или аномалии мейоза у гомоталличных изолятов. Материалом исследования служили 4 популяции P. tritici-repentis 2017 года. Популяция P. tritici-repentis из регионов Северного Кавказа на 100% состояла из изолятов ToxA+, тогда как в популяциях северо-запада РФ, северного Казахстана и Южного Уральского округа таких изолятов было в 2–4 раза меньше. Проанализирована структура МАТ-локуса у 57 изолятов P. tritici-repentis из северо-западной и северо-казахстанской популяций. Показано, что все проанализированные изоляты имеют две идиоморфы MAT1-1 и MAT1-2 и являются гомоталличными. Все 57 изолятов были самофертильны. 74 аскоспоровых потомка трех ToxA+ изолятов сохранили ген ToxA и были однородны по двум SSR локусам (SSR12, SSR15). По локусу SSR06 был выявлен полиморфизм у аскоспоровых потомков одного изолята В6: 37% аскоспоровых изолятов оказались гибридными и имели 2 аллеля. Для объяснения гибридной природы мейотического потомства гомоталличного изолята B6 необходимы дополнительные исследования. Сделан вывод, что чужеродный ген ToxA сохраняется у аскоспоровых потомков гомоталличных изолятов P. tritici-repentis. Механизм, препятствующий распространению гена в северных популяциях, очевидно, связан с ограниченной ролью полового процесса в жизненном цикле патогена в условиях более низких температур и высокой конкурентоспособности местных изолятов.
Возбудитель желтой пятнистости листьев пшеницы гомоталличный аскомицет Pyrenophora tritici-repentis (Died.) Drechsler [анаморфа – Drechslera tritici-repentis (Died.) Shoemaker] является хорошей моделью для исследований микроэволюционных процессов в природных популяциях патогена. Основными факторами патогенности Pyrenophora tritici-repentis яляются токсины некроза и хлороза. Два из них – Ptr ToxA и Ptr ToxB – белковой природы и кодируются генами ToxA и ToxB (Ciuffetti et al., 2010; Lamari, Strelkov, 2010; один – частично охарактеризованный токсин небелковой природы Ptr ToxC (Effertz et al., 2002). На микроэволюционные процессы фитопатогенных грибов влияют их взаимоотношения с растением-хозяином. Патосистема P. tritici-repentis – пшеница работает по принципу инверсной системы “ген-на-ген”: каждый индивидуальный токсин узнается продуктом одного локуса восприимчивого хозяина, что выражается в восприимчивости растения и проявлении болезни (Strelkov, Lamari, 2003). Уникальность данной патосистемы в том, что ген ToxA, детерминирующий основной фактор патогенности – токсин Ptr ToxA, привнесен в геном патогена путем горизонтального переноса из другого патогена пшеницы – гриба Stagonospora nodorum (Friesen et al., 2006) и не является, таким образом, “собственным” геном гриба. На примере гриба Pyrenophora tritici-repentis можно понять, каким образом чужеродная транслокация сохраняется в геноме-реципиенте, а несущие ее изоляты успешно размножаются как бесполым, так и половым путем.
Патоген преимущественно распространен в южных регионах. При расширении ареала популяций P. tritici-repentis на север наблюдается значительное уменьшение частоты изолятов с геном ToxA (ToxA+) (Mironenko et al., 2015, 2016). Мы связали это наблюдение с наличием в “северных” популяциях патогена факторов, препятствующих сохранению чужеродного генетического детерминанта – ToxA.
По нашим сведениям, в научной литературе отсутствуют работы по изучению влияния половой стадии гриба P. tritici-repentis на сохранение в популяции изолятов, несущих ToxA (ToxA+). Хотя условия получения зрелых псевдотециев P. tritici-repentis хорошо известны (Friesen et al., 2003; Benslimane, 2014), генетические исследования гриба очень ограничены (Hunger, Brown, 1987; McCallum et al., 1994). Очевидно, это связано с гомоталличной природой гриба. Существует гипотеза, что вид P. tritici-repentis эволюционировал от гетеро- к гомоталлизму (Lepoint et al., 2010). Косвенно об этом также свидетельствуют эксперименты по инактивации генов MAT1-1 и MAT1-2 у гомоталличных изолятов P. tritici-repentis методом нокаута генов (gene knockout), в результате чего были получены мутанты разного типа спаривания, способные скрещиваться и давать фертильное аскоспоровое потомство (Ameen et al., 2017). Мы предположили, что в природных популяциях P. tritici-repentis могут встречаться подобные мутанты. Обнаружение изолятов с одной функциональной идиоморфой: MAT1-1 или MAT1-2, позволило бы проверить гипотезу мейотического дрейфа гена ToxA как механизма, ограничивающего распространение этого гена в популяциях патогена.
Цель работы – оценить роль полового процесса в сохранении изолятов с интрогрессированным геном ToxA в популяциях P. tritici-repentis путем тестирования гипотезы мейотического дрейфа гена ToxA в результате возможных скрещиваний между изолятами P. tritici-repentis или аномалий мейоза при самооплодотворении гомоталличных изолятов.
МАТЕРИАЛЫ И МЕТОДЫ
Коллекция моноконидиальных изолятов была выделена из листьев пшеницы с симптомами желтой пятнистости, собранных в четырех регионах РФ в 2017 г. (табл. 1). Вид гриба идентифицировали по морфологическим признакам конидий (т.н. “змеиной головке”, и методом ПЦР с видоспецифичными праймерами (Antoni et al., 2010). Выделение и выращивание гриба проводили по известной методике (Mikhailova et al., 2002). Потенциальную способность изолятов гриба продуцировать экзотоксины определяли фитопатологическим методом инокуляции сорта пшеницы Glenlea (Ptr ToxA), и линий пшеницы 6B365 и 6B662 (Ptr ToxC и Ptr ToxB, соответственно) (Lamari et al., 2005).
Таблица 1.
Происхождение изолятов Pyrenophora tritici-repentis
| Регион | Географическое происхождение | Всего изолятов | Количество ToxA+ изолятов |
|---|---|---|---|
| Северный Казахстан | Северо-Казахстанская область: п. Кириловка, п. Подгорное, п. Корнеевка | 25 | 11 |
| Уральский федеральный округ | Челябинская область: Чебаркульский район, Челябинский НИИСХ | 17 | 4 |
| Северо-запад России | Новгородская обл.: Батецкий ГСУ | 32 | 11 |
| Северный Кавказ | Краснодарский край: Новопокровский, Каневский, Егорлыкский, Ейский и Тимошевский р-ны | 38 | 38 |
Для получения псевдотециев с аскоспорами использовали известный метод, основанный на инокуляции автоклавированных отрезков листьев кукурузы агаровыми блоками 5–7-дневной культуры моноконидиальных изолятов P. tritici-repentis (Friesen et al., 2003). Аскоспоры “выстреливали” на агаровую поверхность крышки чашки Петри после кратковременного нагревания псевдотециев. После прорастания аскоспор их переносили на свежую питательную среду.
ДНК изолятов грибов выделяли известным методом (Murray, Thompson, 1980). Анализ структуры MAT-локуса P. tritici-repentis проводили с помощью ПЦР с праймерами на обе идиоморфы MAT1-1 и MAT1-2 (табл. 2). В качестве “гена домашнего хозяйства” использовали ген хитинсинтазы (CHS1). Для верификации отрицательных результатов амплификации больших диагностических фрагментов (размером 900–12 000 п.н.) проводили дополнительные ПЦР на короткие фрагменты, включающие один из двух сайтов праймирования для большого фрагмента.
Таблица 2.
Праймеры, использованные в работе
| Название праймера | Нуклеотидная последовательность (5' → 3') | Источник |
|---|---|---|
| PLP1 | CACTGCCCACTCACCTTGTGC | Lepoint et al. (2010) |
| PLP2 | CAGAACAAAGGCAGGACTGTGAGC | |
| PLP3 | CAGACAAGGCGCTCTCGGTTGAAG | |
| PLP4 | ATGCGCTCAGCAAGGAAGGTCG | |
| PLP5 | AACTCGGAACGCTGAGCCTAATGG | |
| PLP6 | TTGACGCCACAGACGGAACAGG | |
| PLP7 | GCTTTACTACAACTTTCCTCTACC | |
| PLP8 | CTGGAAGTGCTGGACGAGAAGATC | |
| PLP10 | GTACGGGCCAGCATGACGTGC | |
| PtrUniqueF2 | GGACTTTGGCTTTCTATTGTGC | Antoni et al. (2010) |
| PtrUniqueR2 | CTTGGTGAATGGTGAAGATGG | |
| PtrSSR-06 | F: TGCATTTGTGGTGCAAGATC | Gurung et al. (2013) |
| R: AGAAGCCTTGGCCATTTTCA | ||
| PtrSSR-12 | F: AAGAGGTGTCGACTAGCGTTT | |
| R: GGCTTAATTTTAAGCGCGTG | ||
| PtrSSR-15 | F: CGCCAACATAGTTGCGAATT | |
| R: TCCGCCTCTGTAGGTGTTAAA | ||
| TA51 | F: GCGTTCTATCCTCGTACTTC | Andrie et al. (2007) |
| TA52 | R: GCATTCTCCAATTTTCACG | |
| CHS-79F | F: TGGGCAAGGATGCTTGGAAGAAG | |
| CHS-354R | R: TGGAAGAACCATCTGTGAG AGTTG |
Идентификацию гена ToxA в конидиальных и аскоспоровых изолятах проводили методом ПЦР с известными праймерами на сам ген (Andrie et al., 2007). Праймеры на микросателлитные последовательности и условия ПЦР приведены в оригинальной работе (Gurung et al., 2013) (тaбл. 2). Авторы праймеров (Gurung et al., 2013) анализировали продукты амплификации SSR локусов в агарозном и полиакриламидном гелях. В нашей работе мы также использовали этот подход.
Для амплификации использовали термоциклер С1000TM Thermal Cycler (BIO-RAD). Разделение продуктов амплификации проводили методом электрофореза в 1.7%-х агарозных гелях и в 6%-м ПААГ, окрашенных бромистым этидием, при напряжении 100 V в течение 3 ч в 0.5× ТБЕ-буфере. Приблизительный размер продукта амплификации определяли путем сравнения со стандартом молекулярной массы – GeneRulerTM 50 п.н. DNA Ladder фирмы Fermentas.
РЕЗУЛЬТАТЫ
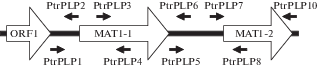
Анализ структуры MAT-локуса. Для поиска природных мутантов по MAT-локусу изоляты P. tritici-repentis были проанализированы на целостность обеих идиоморф с помощью 9 сайтов праймирования MAT локуса, представленных на рис. 1.
Рис. 1.
Структура MAT-локуса Pyrenophora tritici-repentis (рисунок модифицирован по Lepoint et al., 2010).
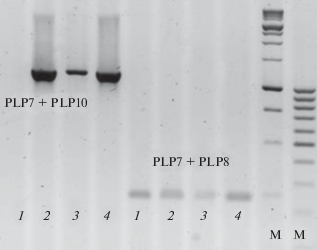
По результатам амплификации идиоморф MAT1-1 и MAT1-2 мы предполагали судить о гомо- или гетероталличной природе изолята. Два продукта амплификации – с праймерами PLP1 + + PLP4 (размер примерно 1200 п.н.) и PLP3 + + PLP6 (размер примерно 900 п.н.) свидетельствовали о наличии идиоморфы MAT1-1, один продукт с праймерами PLP7 + PLP10 (размер примерно 1200 п.н.) – о наличии идиоморфы MAT1-2. На наличие обеих идиоморф методом ПЦР были тестированы изоляты казахстанской и батецкой популяций патогена (всего 57 изолятов). В ряде случаев наблюдали отсутствие продукта амплификации той или другой идиоморфы при наличии продукта амплификации “гена домашнего хозяйства”. Для проверки данного факта, т.е. доказательства отсутствия всей идиоморфы или ее части проводили дополнительные амплификации коротких участков MAT-локуса с праймерами, используемыми для амплификации больших фрагментов идиоморф (табл. 3). Например, на рис. 2 приведен пример амплификации с праймерами PLP3 + PLP6 и PLP1 + PLP4 на идиоморфу MAT1-1 для четырех изолятов гриба. У изолята № 1 отсутствует продукт амплификации с праймерами PLP1 + PLP4. Контрольные амплификации коротких участков идиоморф (PLP1 + PLP2, PLP3 + + PLP4 и PLP5 + PLP6) подтвердили целостность MAT-локуса и отсутствие мутаций в виде делеций или вставок в идиоморфе MAT1-1 первого изолята. На рис. 2 представлены только результаты амплификации с праймерами PLP1 + PLP2. Для идиоморфы МАТ1-2 возможность контрольной амплификации имеется только для сайта PLP7 (рис. 3).
Таблица 3.
Диагностические ПЦР на идиоморфы Pyrenophora tritici-repentis
| Идиоморфы | Комбинация праймеров | Размер продукта амплификации (п.н.) |
|---|---|---|
| МАТ1-1 | PLP1 + PLP4 | 1200 |
| PLP3 + PLP6 | 900 | |
| PLP1 + PLP2 | 250 | |
| PLP3 + PLP4 | 100 | |
| PLP5 + PLP6 | 280 | |
| МАТ1-2 | PLP7 + PLP10 | 1200 |
| PLP7 + PLP8 | 280 |
Рис. 2.
ПЦР-анализ целостности идиоморфы MAT1-1 Pyrenophora tritici-repentis. Изоляты 1–4. М – маркеры молекулярных весов 1 кб и 100 п.н.
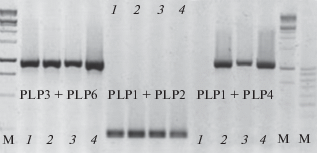
Рис. 3.
ПЦР-анализ целостности идиоморфы MAT1-2 Pyrenophora tritici-repentis. Изоляты 1–4. М – маркеры молекулярных весов 1 кб и 100 п.н.
В результате амплификации идиоморф MAT1-1 и MAT1-2 и контрольных амплификаций у 57 тестируемых изолятов не было найдено ни одного случая нарушения структуры MAT-локуса.
Идентификация гена ToxA в популяциях P. tritici-repentis 2017 г. Все 112 изолятов из 4 популяций 2017 г. сбора были тестированы на наличие ToxA методом ПЦР (табл. 1). В южной популяции (Краснодарский край) 100% изолятов содержали ген. В “северных” популяциях – из Северного Казахстана, Уральского федерального округа и северо-запада РФ встречаемость ToxA+ изолятов была значительно ниже и составляла от 24 до 44%.
Половая стадия P. tritici-repentis в лабораторных условиях. Мы индуцировали половую стадию у изолятов P. tritici-repentis из северо-западной популяции. Все изоляты оказались самофертильными. Псевдотеции гриба были полностью зрелыми на 30–40-й день с момента постановки скрещивания (рис. 4) и содержали большое количество асков с аскоспорами (рис. 5). Аски содержали в основном по 8 аскоспор. Для анализа аскоспорового потомства были выбраны 3 ToxA+-изолята – В6, В8 и В11. Из псевдотециев, образованных каждым изолятом, были выделены случайные аскоспоры: для изолята В6 – 19 аскоспоровых потомков, В8 – 25 и В11 – 30. Всего выделено 74 аскоспоровых изолята. Отмечалась морфологическая гетерогенность моноаскоспоровых изолятов – потомков одного самофертильного изолята (рис. 6).
Рис. 6.
Морфологическая гетерогенность аскоспоровых изолятов (а и б) – потомков изолята Pyrenophora tritici-repentis В11. На каждой половинке чашки Петри представлены три субклона от одного аскоспорового изолята.

Генотипирование аскоспорового потомства изолятов P. tritici-repentis. Аскоспоровое потомство трех изолятов P. tritici-repentis (В6, В8 и В11) было проверено на наличие гена ToxA. Все 74 аскоспоровых изолята содержали ген ToxA (рис. 7). Для генотипирования аскоспоровых изолятов использовали метод ПЦР с праймерами на микросателлитные локусы, расположенные на разных хромосомах гриба (Gurung et al., 2013). Сперва родительские моноконидиальные изоляты В6, В8 и В11 были оценены по 9 SSR-локусам (результаты по 5 SSR-локусам представлены на рис. 8). Изоляты В8 и В11 оказались идентичными по всем 9 локусам, тогда как изолят В6 отличался полиморфизмом по всем изученным локусам.
Рис. 7.
Молекулярная диагностика гена ToxA в аско-споровых изолятах – потомках изолята B11. Размер продукта амплификации – 573 п.н. Последняя дорожка – негативный контроль без ДНК. Боковые дорожки – маркеры молекулярных весов 100 п.н.

Рис. 8.
Полиморфизм трех изолятов Pyrenophora tritici-repentis по 5 микросателлитным локусам. Сверху даны обозначения SSR-локусов, снизу – изоляты гриба: 1 – В6, 2 – В8, 3 – В11. Боковые дорожки – маркеры молекулярных весов 100 п.н.
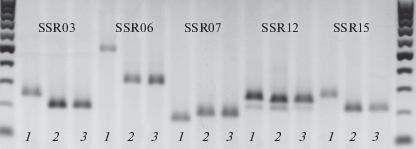
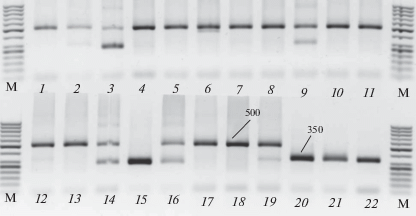
Генетическая однородность аскоспорового потомства была проанализирована по трем локусам: SSR6, SSR12 и SSR15. Аскоспоровое потомство каждого изолята оказалось однородным по локусам SSR12 и SSR15 и не отличалось от родительского изолята. Амплификация SSR06-локуса выявила одну аллель размером 350 п.н. у аскоспоровых изолятов – потомков В8 и В11 и две аллели размером 500 и 350 п.н. у аскоспоровых изолятов – потомков В6. Причем, у семи (№№ 2, 3, 9, 12, 14, 16, 19 на рис. 9) из 19 аскоспоровых потомков изолята В6 обнаружены оба аллеля, один изолят (№ 14) имел аллель 350 п.н. (рис. 9).
Рис. 9.
Продукты амплификации SSR6-локуса аскоспорового потомства изолятов В6 и В11 Pyrenophora tritici-repentis: 1–19 – аскоспоровое потомство изолята P. tritici-repentis В6, 20–22 – аскоспоровое потомство изолята В11. М – маркеры молекулярных весов 50 п.н. Стрелки указывают на размер продуктов амплификации в п.н.
ОБСУЖДЕНИЕ
Разработанные в последнее время методы сравнительного анализа геномов фитопатогенных видов грибов позволили выявить большое количество случаев горизонтального переноса генов (ГПГ) (Slot, Rokas, 2011; Gardiner et al., 2012; Coelho et al., 2013; Boto et al., 2015). Предложена гипотеза о роли горизонтального переноса дополнительных хромосом, несущих генетические детерминанты патогенности и вирулентности, между грибами как механизма образования новых рас фитопатогенных грибов в природе (Akagi et al., 2009). Считается, что именно в результате ГПГ ToxA ранее малозаметный патоген пшеницы P. tri-tici-repentis в 1940-х гг. стал активно поражать сорта пшеницы и вызывать эпифитотии. Одним из факторов сохранения и распространения изолятов ToxA+ в популяции является их отбор на сортах с геном восприимчивости Tsn1 (Mironenko et al., 2017). Нами также показано, что ген Tsn1 преимущественно встречается в озимых сортах пшеницы, выращиваемых в южных районах РФ. Данное обстоятельство означает, что, возможно, особенности жизненного цикла гриба на озимых и яровых сортах пшеницы, доминирующих в производственных посевах пшеницы в северных регионах РФ, влияют на сохранение и распространение в популяциях патогена изолятов ToxA+. Жизненный цикл патогена включает половую стадию, которая завершается после перезимовки на остатках соломы в поле образованием плодовых тел – псевдотециев. Аскоспоры P. tritici-repentis являются первичным инокулюмом при весеннем заражении всходов пшеницы (Pfender, Wootke, 1987). Можно предположить, что половая стадия преимущественно наблюдается на озимых сортах и приводит к сохранению гена ToxA. Например, в Краснодарском крае, где популяция патогена на 100% состоит из ToxA+ изолятов и выращивают в основном озимые сорта пшеницы, весной легко обнаружить зрелые псевдотеции P. tritici-repentis (Кремнева О.Ю., личное сообщение).
В настоящее время показано, что две идиоморфы MAT1-1 и MAT1-2 тандемно расположены в локусе типа спаривания (MAT) каждого изолята P. tritici-repentis (Lepoint et al., 2010). В данной работе структура MAT-локуса 57 изолятов P. tritici-repentis была изучена с помощью семи ПЦР, дающих перекрывающиеся продукты амплификации. Мы не обнаружили полиморфизма MAT-локуса у изученных изолятов, что свидетельствует об отсутствии природных мутантов со вставкой/делецией в генах MAT1-1 и MAT1-2 в изученной выборке изолятов, которые могли бы стать кандидатами для направленных скрещиваний в качестве гетероталличных изолятов. Таким образом, оказалось невозможным проверить гипотезу мейотического дрейфа гена ToxA. Для изучения продуктов мейоза гомоталличных ToxA+ изолятов индуцировали половую стадию у моноконидиальных изолятов P. tritici-repentis В6, В8 и В11 и выделили 74 аскоспоровых изолята. Все аскоспоровое потомство трех ToxA+ изолятов сохранило ген ToxA. Генотипирование аскоспоровых изолятов по трем SSR-локусам показало, что все потомство изолятов В6, В8 и В11 однородно по локусам SSR12 и SSR15, как и следовало ожидать, исходя из гомоталличной природы гриба. По третьему локусу (SSR06) картина оказалась более сложной: аскоспоровое потомство изолятов В8 и В11 было однородным и имело аллель размером 350 п.н., тогда как аскоспоровые изоляты В6 имели две разные аллели. Данный результат можно объяснить наличием в мицелии моноконидиального изолята В6 P. tritici-repentis по крайней мере двух типов генетически различных гаплоидных ядер, которые в результате полового процесса продуцировали аскоспоровое потомство с аллелью 500 п.н., 350 п.н. и гибридное (или гетерокариотичное) с обеими аллелями. Очевидно, ядра с аллелью 350 п.н. в родительском изоляте присутствовали в минорном количестве, т.к. они не выявлены в исходном родительском изоляте В6. Можно предположить, что генетически различные ядра, каждое из которых имеет две тандемно расположенных идиоморфы MAT1-1 и MAT1-2, способны к переключению типа спаривания, слиянию и последующему мейозу с образованием гибридного полового потомства, которое маркировано присутствием сразу двух аллелей SSR06 локуса. Для доказательства этой гипотезы требуются дополнительные исследования. Дополнительным аргументом в пользу выдвинутой гипотезы служит выявленная морфологическая гетерогенность не только аскоспоровых изолятов, но и их митотического потомства (рис. 6).
Половая стадия важна для грибов, поскольку она продуцирует споры, способные к переживанию неблагоприятных условий. С другой стороны, очевидно, что в результате мейоза с большой долей вероятности может разрушиться благоприятная для гриба комбинация генов. Это особенно важно для фитопатогенных грибов, характеризующихся высоким уровнем нестабильности генома (Mironenko, 2019), и для которых особую роль при заражении растения-хозяина играет половое потомство. В отличие от других примеров горизонтального переноса генов между грибами, указывающих на основную роль дополнительных или несущественных (dispensable) для выживания гриба хромосом в горизонтальном переносе отдельных чужеродных генов или целых кластеров генов (Akagi et al., 2009; Richards et al., 2011; Ma et al., 2013), у P. tritici-repentis ген ToxA локализован в одной из основных хромосом гриба в единственной копии (Aboukhaddour et al., 2009). Дополнительные хромосомы как гомо-, так и гетероталличных видов грибов дуплицируются или теряются в процессе мейоза (Garmaroodi, Taga, 2015), но могут сохраниться в процессе парасексуальной рекомбинации (Schoustra et al., 2007). Что касается основных хромосом, то транслокации в них с большей вероятностью могут сохраниться у самофертильных изолятов гомоталличных видов. Гомоталличный способ размножения P. tritici-repentis, на наш взгляд, – единственно возможный путь сохранения чужеродного гена ToxA в основной хромосоме в процессе мейоза и образования аскоспорового потомства с этим геном. Механизм, препятствующий распространению гена в северных популяциях, очевидно, связан с ограниченной ролью полового процесса в жизненном цикле патогена в условиях более низких температур и высокой конкурентоспособности местных изолятов.
Работа выполнена при частичной поддержке гранта РФФИ № 18-04-00128а.
Список литературы
Aboukhaddour R., Cloutier S., Balance G.M., Lamari L. Genome characterization of Pyrenophora tritici-repentis isolates reveals high plasticity and independent chromosomal location of ToxA and ToxB. Molec. Plant Pathol. 2009. V. 10 (2). P. 201–212. https:// doi.org/doi:10.1111/J.1364-3703.2008.00520.X.
Akagi Y., Akamatsu H., Otani H., Kodama M. Horizontal chromosome transfer: a mechanism for the evolution and differentiation of a plant pathogenic fungus. Eukaryot. Cell 2009. V. 8. P. 1732–1738. https:// doi.org/doi:10.1128/EC.00135-09.
Ameen G., Kariyawasam G., Shi G., Friesen T.L., Faris J.D., Ali S., Rasmussen J.B., Liu Z. Molecular manipulation of the mating-type system and development of a new approach for characterizing pathogen virulence in Pyrenophora tritici-repentis. Fungal Genet. Biol. 2017. V. 109. P. 16–25. https://doi.org/doi:10.1016/j.fgb.2017.10.004.
Andrie R.M., Pandelova I., Ciuffetti L.M. A combination of phenotypic and genotypic characterization strengthens Pyrenophora tritici-repentis race identification. 2007. Phytopathology. V. 97. P. 694-670. https://doi.org/doi: doi 10.1094/PHYTO-97-6-0694.
Antoni E.A., Rybak K., Tucker M.P. et al. Ubiquity of ToxA and absence of ToxB in Australian populations of Pyrenophora tritici-repentis. Austral. Plant. Pathol. 2010. V. 39. P. 63–68. www.publish.csiro.au/journals/app.
Benslimane H. Simple method to produce in vitro Pyrenophora tritici-repentis teleomorph. Plant Pathol. 2014. V. 30 (4). P. 437–439. https://doi.org/doi:10.5423/PPJ.NT.06.2014.0049.
Boto L. Horizontal gene transfer in evolution. In: John Wiley and Sons, Ltd.: Chichester, 2015. https://doi.org/doi: . doi 10.1002/9780470015902.a0022835.pub2
Ciuffetti L.M., Manning V.A., Pandelova I., Betts M.F., Martinez J.P. Host-selective toxins, Ptr ToxA and Ptr ToxB, as necrotrophic effectors in the Pyrenophora tritici-repentis – wheat interaction. New Phytol. 2010. V. 187. P. 911–919. https://doi.org/doi:10.1111/j.1469-8137.2010.03362.x
Coelho M.A., Goncalves C., Sampaio J.P., Goncalves P. Extensive intra-kingdom horizontal gene transfer converging on a fungal fructose transporter gene. PLoS Genet. 2013. V. 9(6): e1003587. doi: 10.1371/journal.pgen. 1003587
Effertz R.J., Meinhardt S.W., Anderson J.A., Jordahl J.G., Francl L.J. Identification of a chlorosis-inducing toxin from Pyrenophora tritici-repentis and the chromosomal location of an insensitivity locus in wheat. Phytopathology. 2002. V. 92. P. 527–533. doi: 10.1094/PHYTO.2002.92.5.527
Friesen T.L., Ali S., Stack R.W., Francl L.J., Rasmussen J.B. Rapid and efficient production of the Pyrenophora tritici-repentis teleomorph. Can. J. Bot. 2003. V. 81 (8). P. 890–895. https://doi.org/10.1139/b03-082
Friesen T.L., Stukenbrock E.H., Liu Z., Meinhardt S., Ling H., Faris J.D., Rasmussen J.B., Solomon P.S., McDonald B.A., Oliver R.P. Emergence of a new disease as a result of interspecific virulence gene transfer. Nature Genetics. 2006. V. 38 (8). P. 953–956. https:// doi.org/10.1038/ng1839
Gardiner D.M., McDonald M.C., Covarelli L. et al. Comparative pathogenomics reveals horizontally acquired novel virulence genes in fungi infecting cereal hosts. PLoS Pathogens. 2012. V. 8(9): e1002952. https:// doi.org/doi:10.1371/journal.ppat.1002952.
Garmaroodi Y.S., Taha M. Meiotic inheritance of a fungal supernumerary chromosome and its effect on sexual fertility in Nectria haematococca. Fungal Biol. 2015. V. 119 (10). P. 929–939. https://doi.org/doi:10.1016/j.funbio.2015.07.004
Gurung S., Short D.P.G., Adhikari T.B. Global population structure and migration patterns suggest significant population differentiation among isolates of Pyrenophora tritici-repentis. Fungal Genet. Biol. 2013. V. 52. P. 32–41. https://doi.org/doi: 10.1016/j.fgb.2013.01.003
Hunger R.M., Brown D.A. Colony color, growth, sporulation, fungicide sensitivity, and pathogenicity of Pyrenophora tritici-repentis. Plant Dis. 1987. V. 71. P. 907–910. https://doi.org/doi:10.1094/PD-71-0907
Lamari L., Strelkov S.E. The wheat/Pyrenophora tritici-repentis interaction: progress towards an understanding of tan spot disease. Can. J. Plant Pathol. 2010. V. 32. P. 4–10. https://doi.org/doi:10.1080/07060661003594117.
Lamari L., Strelkov S.E., Yahyaoui A., Amedov M., Saidov M., Djunusova M., Koichibayev M. Virulence of Pyrenophora tritici-repentis in the countries of the Silk Road. Can. J. Plant Pathol. 2005. V. 27. P. 383–388. https:// doi.org/10.1080/07060660509507236
Lepoint P., Renard M.E., Legreve A. et al. Genetic diversity of the mating type and toxin production genes in Pyrenophora tritici-repentis. Phytopathology. 2010. V. 100 (5). P. 474–483. https://doi.org/doi: 10.1094/PHYTO-100-5-0474
Ma L.-J., Geiser D.M., Proctor R.H., Rooney A.P., O’Donnell K., Trail F., Gardiner D.M., Manners J.M., Kazan K. Fusarium pathogenomics. Annu. Rev. Microbiol. 2013. V. 67. P. 399–416. https://doi.org/doi:10.1146/annurev-micro-092412-155650
McCallum B.D., Bernier C.C., Lamari L. Generation and utilization of chemical-resistant mutants in Pyrenophora tritici-repentis, the causal agent of tan spot of wheat. Can. J. Bot. 1994. V. 72. P. 100–105. https://doi.org/doi:10.1139/b94-014.
Mikhailova L.A., Gultyaeva E.I., Kokorina N.M. Laboratory methods of cultivation of wheat tan spot causal agent Pyrenophora tritici-repentis. Mikologiya i fitopatologiya. 2002. V. 36 (1). P. 63–67 (in Russ.).
Mironenko N.V. Genome plasticity of phytopathogenic fungi. Mikologiya i fitopatologiya. 2019. (in press, in Russ.).
Mironenko N.V., Baranova O.A., Kovalenko N.M., Afanasenko O.S., Mikhailova L.A. Selective influence of wheat cultivars with Tsn1 gene on the formation of tan spot causative agent Pyrenophora tritici-repentis population. Plant Prot. News. 2017. V. 3 (93). P. 23–27 (in Russ.).
Mironenko N.V., Baranova O.A., Kovalenko N.M., Mikhailova L.A. Frequency of ToxA gene in North Caucasian and North-West Russian populations of Pyrenophora tritici-repentis. Mikologiya i fitopatologiya. 2015. V. 49 (5). P. 25–329 (in Russ.).
Mironenko N.V., Baranova O.A., Kovalenko N.M., Mikhailova L.A., Rosseva L.P. Genetic structure of the Russian populations of Pyrenophora tritici-repentis, determined by using microsatellite markers. Russian Journal of Genetics. 2016. V. 52 (8). P. 771–779. https:// doi.org/doi:10.1134/S1022795416080093.
Murray H.G., Thompson W.F. Rapid isolation of high mole-cular weight DNA. Nucl. Acids Res. 1980. V. 8. P. 4321–4325.
Pfender W.F., Wootke S.L. Production of pseudothecia and ascospores by Pyrenophora tritici-repentis in response to macronutrient concentrations. Phytopathology. 1987. V. 77. P. 1213–1216.
Richards T.A., Leonard G., Soanes D.M., Talbot N.J. Gene transfer into the fungi. Fungal Biol. Rev. 2011. V. 25 (2). P. 98–110. https://doi.org/10.1016/j.fbr.2011.04.003
Schoustra S.E., Debets A.J.M., Slakhorst M., Hoekstra R.F. Mitotic recombination accelerates adaptation in the fungus Aspergillus nidulans. PLoS Genet. 2007. V. 3(4): e68. https://doi.org/10.1371/journal.pgen.0030068
Slot J.C., Rokas A. Horizontal transfer of a large and highly toxic secondary metabolic gene cluster between fungi. Current Biol. 2011. V. 21 (2). P. 134–139. https:// doi.org/doi: 10.1016/j.cub.2010.12.020
Strelkov S.E., Lamari L. Host-parasite interactions in tan spot Pyrenophora tritici-repentis of wheat. Can. J. Plant Pathol. 2003. V. 25 (4). P. 339–349. https:// doi.org/10.1080/07060660309507089
Мироненко Н.В. (Mironenko) Пластичность генома фитопатогенных грибов // Микология и фитопатология. 2019 (в печати).
Мироненко Н.В., Баранова О.А., Коваленко Н.М., Афанасенко О.С., Михайлова Л.А. (Mironenko et al.) Селективное влияние сортов пшеницы с геном Тsn1 на формирование популяции возбудителя желтой пятнистости Pyrenophora tritici-repentis // Вестник защиты растений. 2017. № 3 (93). С. 23–27.
Мироненко Н.В., Баранова О.А., Коваленко Н.М. Михайлова Л.А. (Mironenko et al.) Частота гена ToxA в популяциях Pyrenophora tritici-repentis на Северном Кавказе и северо-западе России // Микология и фитопатология. 2015. Т. 49. Вып. 5. С. 325–329.
Михайлова Л.А., Гультяева Е.И., Кокорина Н.М. (Mikhailova et al.) Лабораторные методы культивирования возбудителя желтой пятнистости пшеницы Pyrenophora tritici-repentis // Микология и фитопатология. 2002. Т. 36. Вып. 1. С. 63–67.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология