Микология и фитопатология, 2019, T. 53, № 2, стр. 95-100
Исследование ионного состава биомассы Aspergillus oryzae – продуцента гидролитических ферментов
Е. М. Серба *, П. Ю. Мочалина, Л. В. Римарева, М. Б. Оверченко, Н. В. Шелехова, Н. И. Игнатова, А. Г. Калинина
Всероссийский научно-исследовательский институт пищевой биотехнологии
111033 Москва, Россия
* E-mail: serbae@mail.ru
Поступила в редакцию 10.04.2018
После доработки 10.05.2018
Принята к публикации 29.05.2018
Аннотация
Проблема рациональной переработки биомассы мицелиальных грибов – отходов многих биотехнологических производств, является важной задачей. С целью выявления перспективности их использования исследован биохимический состав биомассы штаммов гриба Aspergillus oryzae. Биомасса штамма A. oryzae RCAM 01133 содержала 32% полисахаридов и 28% белка, для штамма RCAM 01134 эти показатели составили 36 и 19%, соответственно. Общая сумма идентифицированных ионов в биомассе А. oryzae RCAM 01134 была на 35% больше, чем у штамма RCAM 01133 за счет повышенных концентраций в ней фосфатов, хлоридов, малатов, цитратов, сукцинатов и лактатов. Доля фосфатов и калия в биомассе гриба А. oryzae RCAM 01133 составила 65 и 25%, для А. oryzae RCAM 01134 – 65 и 19%, соответственно. Результаты испытаний биологического действия препарата грибной биомассы подтвердили, что введение его в рацион мышей не вызывало негативных побочных эффектов, при этом обеспечивался быстрый прирост массы тела при стабильном физиологическом и динамическом состоянии подопытных животных. Полученные экспериментальные данные о содержании полисахаридов и белковых веществ, составе и массовой концентрации катионов, анионов неорганических и органических кислот в отходах ферментного производства – биомассе A. оryzae позволяют рассматривать ее как перспективный субстрат для получения биодобавки для коррекции минерального состава и повышения биологической ценности продуктов питания и кормов.
В современных технологиях перерабатывающих отраслей АПК, основанных на глубокой биокаталитической конверсии полимеров сельскохозяйственного сырья, широко используются ферментные препараты (ФП) микробного происхождения (Polizeli et al., 2005; Tananayka et al., 2009; Lukin et al., 2013; Aksenova, Rimareva, 2017). Основными промышленными продуцентами ФП являются мицелиальные грибы, обладающие способностью к синтезу и секреции гидролаз в культуральную жидкость (Rozhkova et al., 2011; Serba et al., 2016; Kurbatova et al., 2017). Высокая скорость роста микромицетов способствует образованию большого количества мицелиальной биомассы, рациональное использование которой является актуальной задачей. Важно отметить, что в настоящее время проблема утилизации грибного мицелия – отхода многих биотехнологических производств, остается практически нерешенной (Serba et al., 2015a).
Одним из перспективных объектов биоресурсов является биомасса гриба Aspergillus oryzae – продуцента основных промышленно значимых ферментов амилолитического и протеолитического действия (Serba et al., 2017). Этот вид не является патогенным и широко применяется в пищевой промышленности. Работами последних лет показано, что селекционированные штаммы наряду с ферментами синтезируют биомассу, содержащую ценные полисахариды и белки с высоким скором незаменимых аминокислот (Feofilova, 2010; Skorik, 2010). Представленные данные подтверждают перспективность применения биомассы гриба в качестве субстрата для получения белково-аминокислотных и углеводных ингредиентов пищи и кормов (Rimareva et al., 2012; Serba et al., 2017). Однако исследований ионного состава мицелиальной биомассы не проводилось. В то же время известно, что химические элементы, такие как калий, магний, фосфор и др., необходимые организму для построения и жизнедеятельности клеток и органов, являются биогенными веществами и обладают определенным физиологическим действием (Ershov et al., 2003; Nechaev et al., 2015). В этой связи представляется актуальным оценить возможность использования биомассы гриба A. oryzae в качестве их источника.
Цель работы – исследование катионного и анионного состава биомассы гриба A. oryzae для выявления перспективности ее использования в качестве биодобавки для коррекции минерального состава и повышения биологической ценности продуктов питания и кормов.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом исследования являлась биомасса штаммов RCAM 01133 и RCAM 01134 гриба A. oryzae, которые были получены в результате селекции во ВНИИ пищевой биотехнологии (Serba et al., 2016). Продуценты культивировали глубинным способом на обычно применяемых для данного вида грибов натуральных средах, в состав которых входили мука и минеральные соли (Patent. 2008). Культивирование проводили в лабораторном ферментере RALF Plus (Bioengineering, Швейцария) при коэффициенте заполнения питательной средой, равном 0.6, и скорости вращения мешалки 200–220 об/мин. Выращивание штаммов грибов осуществляли при температуре 30°С, расходе воздуха 0.5–1.0 м3/м3/мин. Длительность культивирования составляла 48 ч.
Содержание полисахаридов в биомассе определяли колориметрическим методом по уровню образования общих редуцирующих веществ (ОРВ) после кислотного гидролиза (Serba et al., 2015b). Содержание общего белка определяли по методу Кьельдаля (Polyakov et al., 2007) на автоматической установке определения азота Vadopest 10 (Gerhardt, Германия) с использованием автоматического титратора DL 15 (Mettler Toledo, Швейцария).
Для изучения ионного состава биомассы грибов A. oryzae мицелий после глубинного культивирования отделяли от культуральной среды при помощи центрифугирования (5000 об/мин в течение 10 мин), промывали дистиллированной водой и полученный фугат декантировали. Механическую деструкцию биомассы проводили путем ее растирания с кварцевым песком в соотношении 2 : 1. Экстракцию осуществляли деионизованной водой, добавленной в соотношении 1 : 3, тщательно перемешивая, после чего центрифугировали. Фугаты деструктированной биомассы изучаемых штаммов A. oryzae анализировали методом капиллярного электрофореза (Litvinova et al., 2009; Shelechova et al., 2017) с использованием системы PrinCЕ 560 (PrinCЕ technologies, Нидерланды), оснащенной кондуктометрическим детектором. Для обработки результатов измерений использовали систему обработки данных UniChrom (ООО “Новые аналитические системы”, Республика Беларусь). Процентное содержание ионов калия и фосфора от суммы идентифицированных ионов рассчитывали, исходя из их массовой концентрации в фугате деструктированной биомассы.
Исследования токсичности и физиологического влияния грибной биомассы проводили в соответствии с “Руководством по экспериментальному (доклиническому) изучению новых фармакологических веществ” (Gabriev, 2005). В эксперименте использовали беспородных белых мышей с исходной массой тела 32.6 ± 6.2 г. Животные содержались в стандартных условиях вивария. Испытуемые животные были разделены на 2 группы: одна группа на протяжении 14 дней потребляла биопрепарат грибной биомассы, вторая – контрольная, которая вместо исследуемого биопрепарата потребляла питьевую воду. Доза потребления составила 1100 мг/кг массы тела. Период адаптации животных составил 5 суток. После этого исследуемый биопрепарат предоставлялся животным в режиме полудобровольного метода в составе “мягкой диеты”: хлеб (20–30 г), пропитанный фугатом деструктированной грибной биомассы или водой. Каждому животному “диета” предоставлялась в индивидуальном порядке. До полного потребления животные не получали другой пищи (время потребления было ориентировочно 2–2.5 ч). В процессе эксперимента определяли прирост массы мышей за время потребления препаратов и общее состояние животных.
Статистическую обработку данных, полученных не менее, чем в 3-х повторностях, осуществляли с помощью программы Microsoft Excel с использованием коэффициента Стьюдента (доверительный интервал 0.95).
РЕЗУЛЬТАТЫ
Исследуемые штаммы A. oryzae RCAM 01133 и RCAM 01134 различались по своим культуральным свойствам и морфологическим признакам. Штамм A. oryzae RCAM 01134 характеризовался способностью к синтезу преимущественно протеолитических ферментов и обильным спорообразованием, а A. oryzae RCAM 01133 – преимущественно амилолитических ферментов и слабым спорообразованием (Serba et al., 2017). Биомасса гриба штамма RCAM 01133 содержала 32% полисахаридов и 28% белка, для штамма RCAM 01134 эти показатели составили 36 и 19%, соответственно (рис. 1).
Рис. 1.
Содержание полисахаридов (1), идентифицированных ионов (2) и белка (3) в биомассе Аspergillus oryzae RCAM 01133 и RCAM 01134.
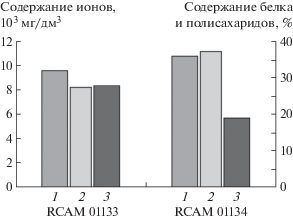
Результаты электрофоретических исследований грибной биомассы выявили различия в их ионном составе. Отмечено более высокое содержание ионов в биомассе гриба А. oryzae RCAM 01134 (на 35%). Согласно полученным данным, массовая концентрация идентифицированных ионов в фугате деструктированной биомассы для А. oryzae RCAM 01133 составила 8261 мг/дм3, для А. oryzae RCAM 01134–11193 мг/дм3 (рис. 1), что в пересчете на биомассу составляет 247.8 мг/г асв и 335.8 мг/г асв соответственно.
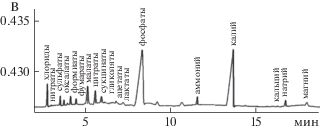
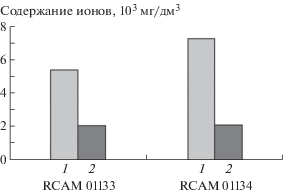
На примере электрофореграммы деструктурированной мицелиальной биомассы гриба A. oryzae RCAM 01134 показаны идентифицированные пики катионов и анионов (рис. 2). Результаты исследования показали, что ионный состав биомассы исследуемых штаммов микромицета A. oryzae представлен анионами органических и неорганических кислот и катионами (рис. 2). Как видно из полученных результатов, в анализируемых образцах фугата деструктированной биомассы гриба А. oryzae RCAM 01133 и RCAM 01134 в наибольшем количестве содержались фосфаты (5387 мг/дм3 и 7251 мг/дм3) и ионы калия (2091 мг/дм3 и 2109 мг/дм3) соответственно (рис. 3). При этом доля фосфатов и калия от общего количества идентифицированных ионов для гриба А. oryzae RCAM 01133 составила 65 и 25%, для А. oryzae RCAM 01134 – 65 и 19%.
Рис. 3.
Содержание фосфатов (1) и ионов калия (2) в биомассе Аspergillus oryzae RCAM 01133 и RCAM 01134.
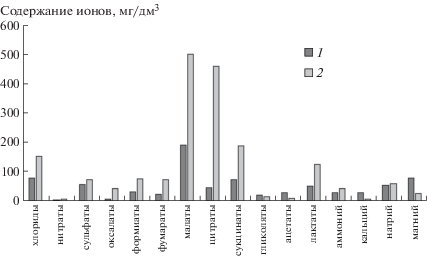
Кроме того, установлено, что биомасса микромицетов содержит ионы органических (оксалаты, формиаты, фумараты, цитраты, сукцинаты, гликоляты, ацетаты, лактаты) и неорганических (хлориды, нитраты, сульфаты) кислот, концентрации которых варьируют в зависимости от штамма гриба (рис. 4).
Сравнительная оценка ионного состава фугатов деструктированной биомассы микромицетов показала (рис. 4), что в биомассе А. oryzae RCAM 01134 в наибольшем количестве присутствуют ионы малатов – 501.0 мг/дм3, цитратов – 461.1 мг/дм3 и сукцинатов – 187.9 мг/дм3.
Исследовали токсичность и физиологическое влияние препарата грибной биомассы A. oryzae RCAM 01134 на физическое состояние и активность белых мышей при введении его в рацион подопытных животных. Проведенные испытания подтвердили его биологическую эффективность, проявившуюся в повышении аппетита и увеличении выносливости животных. Потребление исследуемой добавки способствовало более интенсивному (на 40%) увеличению массы животных и повышению в 1.3–1.4 раза их двигательной активности по сравнению с контрольной группой в аналогичных условиях.
ОБСУЖДЕНИЕ
Таким образом, получены новые экспериментальные данные о составе и массовой концентрации катионов, анионов неорганических и органических кислот в отходах ферментного производства – биомассе A. оryzae, что позволяет рассматривать ее как перспективный субстрат для получения пищевых ингредиентов и биологически активных кормовых добавок.
Известно, что среди биогенных элементов особая роль принадлежит фосфору, который является органогенным элементом, входящим в состав всех живых организмов. Калий не менее важен для организма, т.к. он участвует во многих биохимических процессах и входит в состав каталитических центров важнейших ферментов (Mattey, 1992; Nechaev et al., 2015). Поэтому грибная биомасса, содержащая в общем количестве идентифицированных ионов порядка 65% фосфатов и 19–25% калия, является перспективным субстратом.
Органические кислоты оказывают благоприятное влияние на процесс пищеварения, способствуя созданию определенного состава микрофлоры, стимулируют деятельность поджелудочной железы, возбуждают аппетит, способствуют усвоению пищи, активно участвуют в энергетическом обмене (Mattey, 1992; Zeikus et al.; 1999). Установленное наличие в грибной биомассе A. oryzae штаммов RCAM 01133 и RCAM 01134 анионов органических кислот, играющих важную роль в обменных процессах организма, порядка 3–10% от общего количества идентифицированных ионов подтверждает ее биологическую ценность и перспективность использования в производстве функциональных продуктов.
Комплекс микроэлементов и органических кислот, белка и полисахаридов, содержащихся в грибной биомассе, может существенно повысить пищевую ценность продуктов, изготовленных с ее включением, способствовать разработке новых видов продукции функционального назначения. Создавая различные композиции можно регулировать не только белково-углеводный, но и минеральный состав пищевых и кормовых добавок.
Результаты испытаний биологического действия препарата грибной биомассы подтвердили, что введение его в рацион опытных животных не вызывало негативных побочных эффектов, при этом обеспечивался быстрый прирост массы тела при стабильном физиологическом и динамичном состоянии мышей.
Исследования проведены за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований государственных академий наук на 2013–2020 гг. (тема № 0529-2019-0066).
Список литературы
Aksenova L.M., Rimareva L.V. Directional conversion of protein modules of food products of animal and vegetable origin. Vestnik Rossiiskoi Akademii Nauk. 2017. V. 4. P. 355–357 (in Russ.).
Ershov Yu.A., Popkov V.A., Knizhnik A.Z. General chemistry. Biophysical chemistry. Chemistry of biogenic elements. Moscow, 2003 (in Russ.).
Feofilova E.P. The cell wall of fungi: modern views on the structure and biological function. Mikrobiologiya. 2010. V. 6 (6). P. 723–733 (in Russ.).
Gabriev R.U. Manual on experimental (preclinical) study of new pharmacological substances. Moscow, Meditsina, 2005 (in Russ.).
Kurbatova E.I., Sokolova E.N., Borshcheva Yu.A., Davydkina V.E., Rimareva L.V., Polyakov V.A. Micromycete Aspergillus foetidus – producer complex of hydrolytic enzymes. Mikologiya i fitopatologiya. 2017. V. 51 (1). P. 34–40 (in Russ.).
Litvinova T.N., Vyskubova N.K., Nenasheva L.V. Nutrients. Complex Connections. Rostov-on-Don, 2009 (in Russ.).
Lukin N.D., Borodina Z.M., Papakhin A.A., Shatalova O.V., Krivandin A.V. Investigation of the action of amylolytic enzymes on native starch of various species in a heterogeneous medium. Achievements of science and technology of agroindustrial complex. 2013. V. 10. P. 62–64 (in Russ.).
Mattey M. The production of organic acids. Crit. Rev. Biotechnol. 1992. V. 12. P. 87–132.
Nechaev A.P., Traubenberg S.E., Kochetkova A.A., Kolpakova V.V., Vitol I.S., Kobeleva I.B. Food chemistry. St. Petersburg, 2015 (in Russ.).
Patent RF N 2315096. The strain of the fungus Aspergillus oryzae – producer of complex of protease, peptidases, β-glucanase, α-amylase end xylanase. 2008 (in Russ.).
Polizeli M.L., Rizzatti A.C.S., Monti R., Terenzy H.F., Jorge J.A., Amorim D.S. Xylanases from fungi: properties and industrial applications. Microbiol. Biotechnol. 2005. V. 67. P. 577–591.
Polyakov V.A., Abramova I.M., Polygalina G.V., Rimareva L.V., Korchagina G.T., Piskareva E.N. Instructions for techno-chemical and microbiological control of alcohol production. Moscow (in Russ.).
Rimareva L.V., Serba E.M., Overchenko M.B., Rachakov K.V., Orlova E.V., Abramova I.M. Use of the fungus Aspergillus oryzae as a source of biologically active substances. Khranenie i pererabotka selkhozsyrya. 2012. V. 9. P. 46–49 (in Russ.).
Rozhkova A.M., Semenova M.V., Rubtsova E.A., Sereda A.S., Tsurikova N.V., Rimareva L.V., Nurtaeva A.K., Zorov I.N., Sinitsyna O.A., Sinitsyn A.P. Creation of a heterologous gene expression system on the basis of Aspergillus awamori recombinant strain. Appl. Biochem. Microbiol. 2011. V. 47 (3). P. 279–287.
Serba E.M., Overchenko M.B., Davydkina V.E., Shelekhova N.V., Rimareva L.V., Polyakov V.A. Theoretical and practical aspects of obtaining dietary supplements based on the conversion of secondary biological resources. Khranenie i pererabotka selkhozsyrya. 2015a. V. 2. P. 44–50 (in Russ.).
Serba E.M., Overchenko M.B., Krivova A.Y., Ignatova N.I., Rimareva L.V. Development of method for content determination of polysaccharides in the biomass of microorganisms. Khranenie i pererabotka selkhozsyrya. 2015b. V. 7. P. 32–35 (in Russ.).
Serba E.M., Overchenko M.B., Rimareva L.V., Pogorzhelskaya N.S., Sokolova E.N., Ignatova N.I., Borshcheva Yu.A. Mycelial fungi – promising source of hydrolasas and valuable polymers. Vestnik Rossiyakoy selskokhozyastvennoy akademii. 2016. V. 4. P. 41–43 (in Russ.)
Serba E.M., Overchenko M.B., Rimareva L.V., Pogorzhelskaya N.S., Davydkina V.E., Polyakov V.A. Screening active population in fungus Aspergillus oryzae ability to synthesize industrially significant metabolites. Mikologiya i fitopatologiya. 2017. V. 57 (1). P. 47–53 (in Russ.).
Shelekhova N.V., Polyakov V.A., Rimareva L.V. Capillary electrophoresis as effective analytical method of research the composition of complex biological media. Pivo i napitki. 2017. V. 2. P. 34–38 (in Russ.).
Skorik Y.A., Pestov A.V., Yatluk Y.G. Evaluation of various chitinglucan derivatives from Aspergillus niger as transition metal adsorbents. Bioresource technology. 2010. T. 101.
Tananaiko T.M., Pushkar A.A. The results of experimental studies on the intensification of alcohol production through the directed use of endogenous acidic proteases. Food industry: science and technology. 2009. V. 3 (5). P. 66–71 (in Russ.).
Zeikus J.G., Jain M.K., Elankovan P. Biotechnology of succinic acid production and markets for derived industrial products. Appl. Microbiol. Biotechnol. 1999. V. 51 (5). P. 545–552.
Аксенова Л.М., Римарева Л.В. (Aksenova, Rimareva) Направленная конверсия белковых модулей пищевых продуктов животного и растительного происхождения // Вестник российской академии наук. 2017. Т. 87. № 4. С. 355–357.
Ершов Ю.А. Попков В.А., Берлянд А.С., Книжник А.З. (Ershov et al.) Общая химия. Биофизическая химия. Химия биогенных элементов. 4-е изд. М.: Высшая школа, 2003. 560 с.
Курбатова Е.И., Соколова Е.Н., Борщева Ю.А., Давыдкина В.Е., Римарева Л.В., Поляков В.А., Погоржельская Н.С. (Kurbatova et al). Микромицет Aspergillus foetidus – продуцент комплекса гидролитических ферментов // Микология и фитопатология. 2017. № 1. С. 34–40.
Литвинова Т.Н., Выскубова Н.К., Ненашева Л.В. (Litvinova et al.) Биогенные элементы. Комплексные соединения. Ростов-на-Дону: Феникс, 2009. 283 с.
Лукин Н.Д., Бородина З.М., Папахин А.А., Шаталова О.В., Кривандин А.В. (Lukin et al.) Исследование действия амилолитических ферментов на нативный крахмал различных видов в гетерогенной среде // Достижения науки и техники АПК. 2013. № 10. С. 62–64.
Нечаев А.П., Траубенберг С.Е., Кочеткова А.А., Колпакова В.В., Витол И.С., Кобелева И.Б. (Nechaev et al.) Пищевая химия. 6-е изд. СПб., 2015. 672 с.
Патент РФ № 2315096 (Patent). Штамм гриба Aspergillus oryzae – продуцент комплекса протеиназ, пептидаз, β-глюаназы, α-амилазы и ксиланазы. 2008.
Поляков В.А., Абрамова И.М., Полыгалина Г.В., Римарева Л.В., Корчагина Г.Т., Пискарева Е.Н. (Polayakov et al.) Инструкция по технохимическому и микробиологическому контролю спиртового производства. М.: ДеЛи принт, 2007. 480 с.
Римарева Л.В., Серба Е.М., Оверченко М.Б., Рачков К.В., Абрамова И.М. (Rimareva et al.) Использование биомассы гриба Аspergillus oryzae в качестве источника биологически активных веществ // Хранение и переработка сельхозсырья. 2012. № 9. С. 46–49.
Рожкова А.М., Семенова М.В., Рубцова Е.А., Середа А.С., Цурикова Н.В., Римарева Л.В., Нуртаева А.К., Зоров И.Н., Синицина О.А., Синицын А.П. (Rozhkova et al.) Создание системы экспрессии гетерологичных генов на основе рекомбинантного штамма гриба Aspergillus awamori // Прикладная биохимия и микробиология. 2011. Т. 47. № 3. С. 279–287.
Серба Е.М., Оверченко М.Б., Давыдкина В.Е., Шелехова Н.В., Римарева Л.В., Поляков В.А. (Serba et al.) Научно-практические аспекты получения БАД на основе конверсии вторичных биоресурсов // Хранение и переработка сельхозсырья. 2015a. № 2. С. 44–50.
Серба Е.М., Оверченко М.Б., Кривова А.Ю., Игнатова Н.И., Римарева Л.В. (Serba et al.) Разработка метода определения содержания полисахаридов в биомассах микроорганизмов // Хранение и переработка сельхозсырья. 2015b. № 7. С. 32–35.
Серба Е.М., Оверченко М.Б., Римарева Л.В., Погоржельская Н.С., Давыдкина В.Е., Поляков В.А. (Serba et al.) Скрининг активных популяций гриба Аspergillus oryzae по способности к синтезу промышленно значимых метаболитов // Микология и фитопатология. 2017. Т. 57 № 1. С. 47–53.
Серба Е.М., Римарева Л.В., Оверченко М.Б., Погоржельская, Соколова Е.Н., Игнатова Н.И., Борщева Ю.А. (Serba et al.) Мицелиальные грибы – перспективный источник гидролаз и ценных биополимеров // Вестник российской сельскохозяйственной науки. 2016. № 4. С. 41–43.
Тананайко Т.М., Пушкарь А.А. (Tananaiko et al.) Результаты экспериментальных исследований по интенсификации производства спирта путем направленного использования эндогенных кислых протеаз // Пищевая промышленность: наука и технологии. 2009. № 3 (5). С. 66–71.
Феофилова Е.П. (Feofilova) Клеточная стенка грибов: современные представления о составе и биологической функции // Микробиология. 2010. Т. 79. № 6. С. 723–733.
Хабриев Р.У. (Gabriev) Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ. М.: Медицина, 2005. 832 с.
Шелехова Н.В., Поляков В.А., Римарева Л.В. (Shelehova et al.) Капиллярный электрофорез как высокоэффективный аналитический метод исследования состава сложных биологических сред // Пиво и напитки. 2017. № 2. С. 34–38.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология