Микология и фитопатология, 2019, T. 53, № 3, стр. 146-155
Морфология и ориентация первичных инфекционных структур некоторых специализированных форм возбудителя мучнистой росы злаков
А. В. Бабоша 1, *, Г. И. Комарова 1
1 Главный ботанический сад им. Н.В. Цицина РАН
127276 Москва, Россия
* E-mail: phimmunitet@yandex.ru
Поступила в редакцию 13.06.2017
После доработки 12.07.2017
Принята к публикации 21.12.2017
Аннотация
Изучали морфологию и ориентацию на листьях злаков первичных инфекционных структур специализированных форм возбудителя мучнистой росы Blumeria graminis (B. graminis f. sp. tritici, B. graminis f. sp. agropyri и B. graminis f. sp. poae) в совместимой и несовместимой комбинациях. Конидии всех 3-х форм прорастали на поверхности листьев пшеницы, пырея и мятлика с образованием первичной и вторичной (аппрессориальной) ростковых трубок нормальной морфологии. От 3 до 14% вторичных ростковых трубок имели аномальную удлиненную форму, примерно в 2 раза длиннее трубок нормальной морфологии. Частота аномалий в случае B. graminis agropyri была заметно выше как на листьях пшеницы, так и пырея. Все формы B. graminis смогли образовать зрелые колонии с конидиеносцами только на своих растениях-хозяевах. Особенностью развития B. graminis tritici в начальный период в несовместимой комбинации с пыреем было частое образование микроколоний, близкое с ростом гриба на восприимчивых растениях. Это свидетельствует о частичном преодолении несовместимости. Аппрессории всех 3-х форм были способны к индукции гало на поверхности листьев растения. При этом на листьях пшеницы гало наблюдали с наибольшей частотой. В совместимом сочетании B. graminis tritici средний диаметр гало был наибольшим на листьях пшеницы. Длина ростковой трубки у инфекционных единиц нормальной морфологии достоверно различалась у изученных форм мучнистой росы. Вид растения-хозяина и ориентация аппрессория к апексу листа или его базальной части также оказывали достоверное влияние на ее длину. От времени с момента инфицирования и ориентации вдоль или поперек оси листа длина ростковой трубки не зависела. При расположении листовой пластинки непосредственно после инфицирования вертикально апикальным концом вверх инфекционные структуры с более длинной ростковой трубкой принимали по большей части продольное относительно оси листа положение дистальным концом вниз. Средняя длина трубок без гало при ориентации вниз была, как правило, больше, чем у таких структур, направленных вверх, что, вероятно, обусловлено вращающим моментом у длинных трубок и их меньшей адгезией к поверхности. Наличие гало у аппрессория соответствовало большей длине ростковой трубки, причем в этой группе трубки, направленные вверх и вниз, имели примерно одинаковую длину. Варьирование морфологических параметров было обусловлено по большей части локальными различиями условий патогенеза и биологическими свойствами растения и патогена и в меньшей степени их совместимостью или несовместимостью. Вероятно, это связано с тем, что в состав выборки входили по большей части абортивные структуры, которые, несмотря на визуально нормальную морфологию, не имели перспектив развития с образованием спороносящей колонии.
Поражение мучнистой росой культивируемых злаков приводит к потере урожая вследствие уменьшения ассимиляционной поверхности листьев. Возбудителем ее является Blumeria graminis, для которого известно 8 специализированных форм, паразитирующих на разных видах злаков (Wyand, Brown, 2003).
Конидия B. graminis прорастает с образованием первичной инфекционной трубки, апекс которой взаимодействует с клеточной стенкой эпидермиса растения-хозяина, обеспечивая первичное закрепление инфекционной единицы. Проникновение внутрь клетки растения обеспечивает вторичная (аппрессориальная) ростковая трубка. Прорастание двумя ростковыми трубками – характерная черта возбудителя мучнистой росы злаков (Homma, 1937; Kunoh, 1982). В местах контакта с растением первичной трубки, лопастей аппрессория и позднее мицелия иногда заметно гало, округлая зона измененной клеточной стенки (Mishina et al., 2001). При взаимодействии с эпидермисом аппрессория образуется большое гало, первичной трубки – малое. В случае успешного проникновения и образования гаустория на 2–3-и сутки после инокуляции начинается рост гиф мицелия (микроколония). Через 5–7 суток образуется зрелая колония с конидиеносцами, заметная невооруженным глазом. Только небольшая часть первоначального инокулюма достигает стадии зрелой колонии, остальные инфекционные единицы останавливаются на разных этапах или проявляют аномалии. Одной из типичных аномалий является образование сильно удлиненной вторичной ростковой трубки вместо короткого и слегка утолщенного аппрессория нормальной морфологии. Аномальные структуры редко контактируют с поверхностью и практически никогда не дают колоний. Различные проявления аномального роста связывают с уменьшением адгезии (Mishina et al., 1988; Serezhkina et al., 1990), что сопровождается отслоение инфекционных структур от поверхности эпидермы хозяина. Как правило, с большей частотой это происходит при прорастании на гидрофильной поверхности, на устойчивых растениях или при иных неблагоприятных для патогена обстоятельствах (Serezhkina et al., 1996; Serezhkina et al., 1999; Wright et al., 2000).
Топография поверхности листа и вариации ее химической структуры, по-видимому, должны играть важную роль в детерминации морфологии первичных инфекционных структур. Эпидермальные клетки листьев злаков, которые атакует патоген, вытянуты вдоль длинной оси листа. Они образуют продольные гряды, которые чередуются с продольными бороздами над местами соединения продольных клеточных стенок. Это приводит к анизотропии поверхности листа, т.е. неравноценности возможных направлений роста инфекционных структур вдоль или поперек оси листа. Ранее нами было показано, что у мучнисторосяных грибов злаков аппрессориальные трубки нормальной морфологии ориентированы преимущественно вдоль оси листа (Ryabchenko et al., 2009). Однако при обработке пшеницы некоторыми физиологически-активными веществами, в частности, цитокининами (Ryabchenko et al., 2009) и перекисью водорода (Avetisyan et al., 2014) доля поперечного роста заметно увеличивалась. Эти же воздействия оказывали влияние на соотношение нормального и аномального развития аппрессориальных структур. Нами была высказана гипотеза о том, что также как и морфология инфекционных единиц, ориентация ростковых трубок связана со степенью адгезии гриба к поверхности растения (Babosha, Komarova, 2017). Известно, что эффективность проникновения в клетку растения-хозяина у B. graminis выше в том случае, если и первичная ростковая трубка, и аппрессорий имеют контакт с одной и той же клеткой растения (Yamaoka et al., 2007). Однако иногда в случае неудачи аппрессорий образует вторую лопасть для проникновения в соседнюю клетку (Sugai et al., 2010). Было предположено, что при неблагоприятном первом контакте может происходить уменьшение адгезии аппрессориальной трубки к поверхности и увеличение ее вращательной подвижности как механизма для проникновения в соседнюю клетку (Ryabchenko et al., 2009; Babosha, Komarova, 2017). В этом случае ориентация аппресориальной ростковой трубки и ее длина имеют существенное значение.
Целью работы было изучение морфологии и ориентации на листьях злаков первичных инфекционных структур специализированных форм возбудителя мучнистой росы B. graminis (syn. Erysiphe graminis) в совместимой и несовместимой комбинациях.
МАТЕРИАЛЫ И МЕТОДЫ
Для заражения злаков использовали популяции возбудителей мучнистой росы злаков Blumeria graminis f. sp. tritici, B. graminis f. sp. agropyri и B. gra-minis f. sp. poae, собранные в Московской области и поддерживаемые на восприимчивых растениях. Инфицировали грибом листья 2-недельных проростков мягкой пшеницы Triticum aestivum сорта Заря, пырея ползучего (Elytrigia repens) и мятлика лугового (Poa pratensis), перенесенные из природных местообитаний (Московская обл.) и выращиваемые при 20–22°С с 16-часовым фотопериодом. Отделенные первые настоящие листья проростков пшеницы и вторые листья молодых (до появления соцветий) боковых побегов пырея и мятлика после инокуляции инкубировали во влажной камере вертикально с погружением базальной части листа в дистиллированную воду. Фрагменты средней части листа исследовали методом криоСЭМ при –30°С с помощью сканирующего электронного микроскопа LEO-1430 VP (Carl Zeiss, Германия), оборудованного элементом Пелтье (Deben Cool Stage). Полученную базу цифровых фотографий анализировали в программе Image J. У проросших конидий с вторичной (аппрессориальной) ростковой трубкой определяли: длину ростковой трубки, наличие большого и малого гало и аномалий (с нормальными аппрессориями или аномальными удлиненными ростковыми трубками), диаметр большого гало в направлении вдоль оси листа, углы между направлением вторичной ростковой трубки (аппрессорием) и осью листа, положение ростковой трубки в одном из квадратов, пронумерованных от 1 до 4. Аналогичные измерения проводили также у молодых колоний (микроколоний), у которых имеются немногочисленные гифы (рис. 1–3), но конидия и аппрессориальная ростковая трубка еще доступны для наблюдения. Сравнение средних значений длины трубки и диаметра гало проводили с использованием t-критерия для данных с неравными отклонениями, сравнение долей – критерия Фишера с преобразованием через арксинус и поправкой Йетса, для проверки соответствия соотношению 1 : 1 использовали формулу χ2. Статистическую обработку полученных результатов проводили с использованием программы Excel. Дисперсионный анализ проводили в программе SPlus, основные параметры приведены в табл. 2. Достоверными считали различия с p < 0.05.
Рис. 1.
Развитие Blumeria graminis tritici на листьях пшеницы (а, в, е) и пырея (б, г, д): а, б – прорастание конидий с образованием апрессориальной ростковой трубки нормальной морфологии; в, г – конидии с аномальными удлиненными вторичными ростковыми трубками; д – начальный этап роста колонии (микроколония) через 2-е суток после инфицирования; е – зрелая спороносящая колония (6-е сутки после инфицирования). Масштаб – 20 мкм (а–д), 200 мкм (е).

Рис. 2.
Развитие Blumeria graminis agropyri на листьях пырея (а, г, д) и пшеницы (б, в): а, б – прорастание конидий с образованием апрессориальной ростковой трубки нормальной морфологии; в – конидии с аномальными удлиненными вторичными ростковыми трубками; г – начальный этап роста колонии (микроколония) через 2-е суток после инфицирования; д – зрелая спороносящая колония (5-е сутки после инфицирования). Масштаб –10 мкм (а, г), 20 мкм (б, в) и 100 мкм (д).

Рис. 3.
Развитие Blumeria graminis poae на листьях мятлика (а, г, д), и пшеницы (б, в): а, в – прорастание конидий с образованием апрессориальной ростковой трубки нормальной морфологии; б – конидии с аномальными удлиненными вторичными ростковыми трубками; г – начальный этап роста колонии (микроколония) через 2-е суток после инфицирования; д – фрагмент зрелой спороносящей колонии с конидиеносцем (5-е сутки после инфицирования). Масштаб –10 мкм (а, б, в), 20 мкм (г, д).
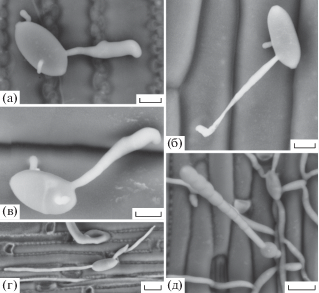
Таблица 1.
Средняя длина аппрессориальной ростковой трубки у некоторых специализированных форм возбудителя мучнистой росы Blumeria graminis (2-е сутки после инфицирования)
| Формы | Растение | Нормальные ростковые трубки | Аномальные ростковые трубки | Микроколонии | |||||
|---|---|---|---|---|---|---|---|---|---|
| среднее ± ошибка, мкм | N | среднее ± ошибка, мкм | N | доля,% | среднее ± ошибка, мкм | N | доля,% | ||
| agropyri | пшеница | 39.0 ± 0.5 | 339 | 62.7 ± 1.6 | 55 | 14.0 | – | – | – |
| пырей | 34.5 ± 0.5 | 274 | 63.3 ± 2.2 | 34 | 9.6 | 37.2 ± 1.4 | 47 | 13.2 | |
| tritici | пшеница | 33.6 ± 0.8 | 115 | 64.5 ± 3.0 | 4 | 3.3 | 32.1 ± 2.4 | 2 | 1.7 |
| пырей | 31.6 ± 0.6 | 228 | 62.0 ± 2.5 | 15 | 5.5 | 29.6 ± 1.2 | 31 | 11.3 | |
| poae | пшеница | 26.8 ± 1.2 | 68 | 60.2 ± 4.3 | 5 | 6.8 | – | – | – |
| пырей | 24.0 ± 1.5 | 36 | – | – | – | 40.4 ± 3.1 | 4 | 10.0 | |
| мятлик* | 28.4 ± 1.6 | 29 | – | – | – | 21.8 ± 1.9 | 5 | 11.6 | |
Примечание. *Данные по длине трубки у микроколоний мятликовой формы на мятлике – сумма данных по 2-м и 5-м суткам после инфицирования. Доли аномальных структур и микроколоний рассчитаны в % от общего числа проросших конидий. N – число учтенных инфекционных единиц, прочерк – данная структура малочисленна или отсутствует.
Таблица 2.
Дисперсионный анализ влияния некоторых факторов на длину аппрессориальной ростковой трубки нормальной морфологии
| Категория изменчивости и градации факторов | Степени свободы | Средний квадрат | P (F) |
|---|---|---|---|
| DPI – время после инфицирования (2 и 5-е сутки) | 1 | 129.6 | 0.201 |
| Plant – вид растения-хозяина (пшеница, пырей) | 1 | 4597.4 | <0.0000001 |
| Form – formae speciales (B. graminis tritici, B. graminis agropyri ) | 1 | 2323.7 | <0.0000001 |
| UpDn – направление аппрессория относительно апекса и базальной части листа (вверх, вниз) | 1 | 4747.9 | <0.0000001 |
| Orient – направление аппрессория относительно оси листа (вдоль, поперек) | 1 | 93.9 | 0.277 |
| DPI: Form | 1 | 446.7 | 0.018 |
| Plant: Form | 1 | 755.5 | 0.002 |
| UpDn: Orient | 1 | 730.3 | 0.002 |
| Остаток | 1344 | 79.3 |
Примечание. Использованы только данные по инфекционным структурам нормальной морфологии без гало на листьях пшеницы и пырея, инфицированных B. graminis tritici и B. graminis agropyri на 2-е и 5-е сутки после инфицирования. Взаимодействия факторов со значениями p(F) < 0.05 исключены с соответствующей корректировкой степеней свободы и дисперсии остатка.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рис. 1–3 представлены фазы развития специализированных форм возбудителя мучнистой росы злаков на изучаемых растениях. Все 3 формы возбудителя в пределах 48 ч после инокуляции были способны прорастать на поверхности листьев пшеницы, пырея и мятлика с образованием первичной и вторичной (аппрессориальной) ростковых трубок нормальной морфологии. При этом от 3 до 14% вторичных ростковых трубок в зависимости от специализированной формы и растения-хозяина имели аномальную удлиненную форму (длинные ростковые трубки, табл. 1). Часто такие структуры начинали свой рост из верхней (обращенной от субстрата) части конидии. Иногда они вступали в контакт с поверхностью эпидермиса, однако даже в этом случае аппрессориеподобная структура в дистальной части была существенно тоньше аппрессория нормальной морфологии. При инфицировании пшеницы и пырея B. graminis tritici и B. graminis agropyri в совместимой и несовместимой комбинациях получены достаточно представительные выборки для сравнения величин долей аномальных структур. Частота аномалий в случае B. graminis agropyri согласно критерию Фишера существенно выше на листьях пшеницы (p < 0.0002). Тенденция увеличения доли аномальных структур в несовместимых комбинациях также проявилась достаточно отчетливо (табл. 1).
Нормальные и аномальные прорастающие инфекционные единицы были сходны по своей морфологии независимо от формы патогена и растения-хозяина. Через 48 ч после инокуляции при нормальном прорастании и в совместимой комбинации растение–патоген у чуть более 10% инфекционных единиц начинали расти первые гифы с образованием микроколонии (табл. 1), а на 5–6-е сут наблюдали зрелые колонии с конидиеносцами. При инфицировании B. graminis tritici листьев совместимой пшеницы на 2-е сутки после инфицирования зарегистрировано только очень небольшое количество микроколоний, но на 5-е сутки они были многочисленны и образовали конидиеносцы.
Частота появления микроколоний при инфицировании листьев пырея инокулюмом B. graminis tritici и B. graminis poae (несовместимая комбинация растение – патоген) также была довольно высокой (11.3 и 10.0%, соответственно). Частота и степень развития микроколоний (2 сут после инфицирования) соответствовала росту на восприимчивых растениях, однако зрелые колонии не формировались. Очевидно, что причина несовместимости в сочетаниях B. graminis agropyri–пшеница и B. graminis tritici–пырей различна.
В табл. 1 представлена средняя длина аппрессориальной ростковой трубки у изученных форм мучнистой росы. Несмотря на визуальное сходство аппрессориальных ростковых трубок (рис. 1–3) их длина у разных специализированных форм мучнистой росы имеет достоверные различия. Относительно более длинные ростковые трубки наблюдали при прорастании конидий B. graminis agropyri. Для одной и той же формы патогена длина трубки существенно различалась при развитии на разных злаках.
Аномальные ростковые трубки примерно в 2 раза длиннее трубок нормальной морфологии (табл. 1), однако различия между специализированными формами патогена и влияние растения-хозяина для них несущественны. Это может быть обусловлено как высокой дисперсией и относительно низкой повторностью, не позволяющих эти различия выявить, так и, возможно, тем обстоятельством, что аномальная ростковая трубка дорастает до своей предельной длины при использовании всех питательных веществ конидии. Их количество не зависит от растения-хозяина и примерно одинаково у всех специализированных форм патогена.
Дисперсионный анализ общей базы данных, полученных через 2 и 5 суток после инфицирования, показал отсутствие достоверного влияния на длину трубки фактора времени (табл. 2). Ориентация вдоль или поперек оси листа (Orient) также существенного влияния не имела в отличие от ориентации вверх или вниз (UpDn). Длину ростковой трубки определяли специализированная форма мучнистой росы (Form) и вид растения-хозяина (Plant).
В месте контакта лопасти аппрессория некоторых фитопатогенных грибов с эпидермисом растения-хозяина можно заметить округлое образование – гало. На изображениях, полученных методом криоСЭМ, область гало заметна как более светлое поле (рис. 1–3). Известно, что материал клеточной стенки в зоне гало содержит флуорогены (Mellersh, Heath, 2001) и избирательно окрашивается некоторыми красителями (Edwards, 1970; Serezhkina et al., 1996). Размеры гало способны изменяться при обработке растения фитогормонами (Babosha et al., 2009) или перекисью водорода (Avetisyan, Babosha, 2011) и, поэтому, представляют интерес в качестве физиологического индикатора характера взаимодействия растения и патогена.
Средние размеры и частота появления гало в изучаемых патосистемах представлены в табл. 3. Аппрессории прорастающих конидий всех 3 специализированных форм мучнистой росы были способны взаимодействовать с клетками растения с образованием гало. Однако в приведенной серии экспериментов эти объекты наблюдали почти исключительно на листьях пшеницы. Полученные данные свидетельствуют о том, что гало в качестве феномена, наблюдаемого при использовании криоСЭМ, в большей мере обусловлены свойствами растения, но не патогена.
Таблица 3.
Частота появления и размеры большого гало у некоторых специализированных форм возбудителя мучнистой росы Blumeria graminis (2-е сутки после инфицирования)
| Формы | Растение | Нормальные ростковые трубки | Аномальные ростковые трубки | ||||
|---|---|---|---|---|---|---|---|
| среднее ± ошибка | N | доля гало, % | среднее ± ошибка | N | доля гало, % | ||
| agropyri | пшеница | 17.5 ± 0.7 | 80 | 23.6 | 17.3 ± 1.1 | 11 | 20.0 |
| пырей | 31.6 | 2 | 0.7 | – | 0 | – | |
| tritici | пшеница | 19.8 ± 1.1 | 17 | 14.8 | – | 0 | – |
| пырей | 10.1 ± 1.9 | 5 | 2.2 | – | 0 | – | |
| poae | мятлик | 9.5 | 1 | 3.4 | – | 0 | – |
| пшеница | 14.3 ± 0.8 | 26 | 38.2 | 11.6 | 2 | – | |
| пырей | – | 0 | – | – | 0 | – | |
Гало у микроколоний довольно редки. В нашем эксперименте наблюдали только 2 таких случая (у B. graminis poae на мятлике с диаметром большого гало 10.7 мкм и у B. graminis tritici на пырее – 14.7 мкм). Поскольку в данном эксперименте были обнаружены только единичные случаи появления малого гало (в месте контакта первичной ростковой трубки), размеры и частота приведены только для большого гало (в месте контакта аппрессориальной ростковой трубки). При инокуляции листьев пшеницы с наименьшей частотой большое гало проявлялось в совместимой комбинации, а именно при контакте с эпидермисом пшеницы аппрессориев B. graminis tritici нормальной морфологии. Интересной особенностью B. graminis agropyri и B. graminis poae явилась высокая частота образования большого гало у аномальных аппрессориеподобных структур. Ранее у аномальных структур B. graminis tritici появление гало наблюдали относительно редко, а в представленных вариантах с участием B. graminis tritici таких случаев не отмечено вовсе. Причиной, скорее всего, является то, что аномальные структуры B. graminis tritici вообще более слабо контактируют с поверхностью растения, включая и контакт своим дистальным аппрессориеподобным концом.
Ввиду того, что на листьях пырея и мятлика были отмечены только единичные случаи появления гало, надежные сравнения размеров гало также могут быть получены только для вариантов с инфицированием листьев пшеницы. Как следует из табл. 3, размеры гало на листьях пшеницы сильно различаются у всех 3-х форм. Совместимое взаимодействие пшеничной формы B. graminis tritici и растений пшеницы показало наибольший средний диаметр гало. Это согласуется с результатами экспериментов других авторов (Serezhkina et al., 1999), которые наблюдали аппрессориальное гало наибольшего размера у наиболее восприимчивой гибридной формы пшеницы. Сходство размеров гало B. graminis agropyri у апрессориальных трубок нормальной и аномальной морфологии свидетельствует о том, что максимальные средние размеры гало у B. graminis tritici обусловлены не столько совместимым характером взаимодействия, сколько специфическими особенностями данной специализированной формы.
Наличие гало у аппрессория соответствовало большей длине ростковой трубки, причем в этой группе трубки направленные вверх и вниз имели примерно одинаковую длину (табл. 4). Следует отметить, что соотношение длины аппрессориальной трубки B. graminis tritici на листьях пшеницы (т.е. в совместимой комбинации) у инфекционных единиц с гало и без него примерно такое же, как у инфекционных единиц B. graminis agropyri в несовместимой и совместимой комбинации. Можно предположить, что увеличение длины трубки нормальной морфологии и появление гало в какой-то мере свидетельствуют о неблагоприятных для патогена условиях. Это согласуется с ранее полученными данными о связи гало с оксидативным стрессом и увеличении в неблагоприятных условиях для развития мучнистой росы доли аномально длинных ростковых трубок (Serezhkina et al., 1996; Serezhkina et al., 1999; Wright et al., 2000).
Таблица 4.
Влияние большого гало на среднюю длину аппрессориальной ростковой трубки у некоторых специализированных форм возбудителя мучнистой росы Blumeria graminis на листьях пшеницы (2-е сутки после инфицирования)
| Формы | Аппрессории без гало | Большое гало имеется | p1 | p2 | ||
|---|---|---|---|---|---|---|
| направление аппрессория | ||||||
| вверх | вниз | вверх | вниз | |||
| agropyri | 35.3 ± 1.3(56) | 39.0 ± 0.7(203) | 41.7 ± 1.6(20) | 41.4 ± 1.2(60) | 0.011 | 0.003 |
| poae | 24.5 ± 2.2(18) | 27.8 ± 1.8(24) | 25.2 ± 3.2(9) | 28.7 ± 2.5(17) | 0.260 | 0.871 |
| tritici | 27.6 ± 2.9(13) | 33.8 ± 0.9(85) | 37.3 ± 1.7(2) | 36.8 ± 1.7(15) | 0.062 | 0.018 |
Примечание. Данные в формате: среднее ± ошибка (повторность): p1 – вероятность, соответствующая t-тесту при сравнении длины трубок, направленных вверх и вниз, у инфекционных единиц без гало; p2 – вероятность, соответствующая t-тесту при сравнении длины трубок, направленных вверх, у инфекционных единиц, имеющих или не имеющих гало.
Данные по ориентации вторичной ростковой трубки инфекционных единиц различного типа в патосистемах с участием 3-х специализированных форм возбудителя мучнистой росы представлены в табл. 5. Все отношения в колонке “вдоль/поперек” превышают значение 1. Во всех вариантах с достаточно высокой повторностью это превышение достоверно, что указывает о преимущественно продольном (вдоль оси листа) расположении вторичной инфекционной трубки. Как было показано ранее, продольная ориентация характерна для инфекционных структур нормальной морфологии и аппрессориев в составе микроколоний и нарушается в особых случаях при обработке некоторыми физиологически активными веществами.
Таблица 5.
Ориентация вторичной ростковой трубки у инфекционных единиц у некоторых специализированных форм возбудителя мучнистой росы Blumeria graminis (2-е сутки после инфицирования)
| Категория инфекционных единиц | Формы | Растение | Всего инфекционных единиц | Отношения | |
|---|---|---|---|---|---|
| вдоль/поперек | вверх/вниз | ||||
| Нормальные | agropyri | пшеница | 339 | 1.32 | 0.29 |
| пырей | 274 | 2.08 | 0.23 | ||
| tritici | пшеница | 115 | 2.71 | 0.15 | |
| пырей | 228 | 1.96 | 0.20 | ||
| poae | мятлик | 29 | 2.22 | 0.32 | |
| пшеница | 68 | 2.58 | 0.66* | ||
| пырей | 36 | 2.60 | 0.80* | ||
| Аномальные | agropyri | пшеница | 55 | 2.67 | 0.06 |
| пырей | 34 | 2.09 | 0.03 | ||
| tritici | пшеница | 4 | – | – | |
| пырей | 15 | 2.75* | 0.07 | ||
| poae | пшеница | 5 | – | – | |
| Микроколонии | agropyri | пырей | 52 | 4.88 | 0.21 |
| tritici | пшеница | 3 | – | – | |
| пырей | 35 | 6.75 | 0.46 | ||
| poae | мятлик | 5 | – | – | |
| пырей | 4 | – | – | ||
Примечание. В таблице представлены отношение численности продольных (направленных под углом к оси листа менее 45°) и поперечных структур в колонке “вдоль/поперек” и отношение численности направленных вверх к направленным вниз в колонке “вверх/вниз”. Ориентация вверх соответствует нахождению ростковой трубки в 2-х верхних квадрантах, вниз – в 2-х нижних. *Все отношения, кроме отмеченных звездочкой, достоверно отличаются от 1 согласно χ2-тесту при p < 0.05.
Напротив, продольная ориентация аномальных структур, повторяющаяся во всех 3-х вариантах, где такие структуры были обнаружены, вызывает удивление, поскольку ранее (Ryabchenko et al., 2009; Avetisyan, Babosha, 2011; Babosha, Komarova, 2017) наблюдали преимущественно случайную направленность аномальных ростковых трубок, что должно давать отношения “вдоль/поперек”, близкие или меньшие 1. О неслучайном характере подобной ориентации свидетельствуют также величина отношения “вверх/вниз”, которая в большинстве вариантов также существенно отличается от 1 (табл. 5). Обращает на себя внимание то обстоятельство, что, судя по величине этого отношения для аномальных структур, только единичные трубки данной категории направлены вверх. Данное несоответствие ранее полученным данным можно объяснить тем, что в большей части прошлых экспериментов инфицированные листья пшеницы размещали горизонтально. Однако данные табл. 5 получены с использованием инокулированных листьев, которые инкубировали в пробирках с дистиллированной водой вертикально базальной частью листа вниз. В этих условиях большая часть аномальных структур, которые имеют меньшую адгезию к поверхности листа и соответственно высокую вращательную подвижность, под действием силы тяжести приняла положение дистальным концом ростковой трубки вертикально вниз и продольно относительно оси листа. Аналогичный процесс имел место и для нормальных ростковых трубок, однако их более высокая адгезия, по-видимому, препятствовала как перемещению из верхнего положения в нижнее, так и из поперечного положения продольно вниз.
Следует отметить достоверные различия соответствующих отношений “вверх/вниз” у нормальных и аномальных структур [p(χ2) < 0.0001 для суммарных данных], что, вероятно, также является проявлением различной адгезии этих инфекционных единиц к поверхности растения. При этом отношение “вверх/вниз” мало отличается среди аппрессориев у структур, образовавших и не образовавших микроколонии. Различие отношений “вдоль/поперек” у этих категорий существенное [p(χ2) < 0.0004], что, вероятно, связано с более прочным прикреплением тех аппрессориев, которые в дальнейшем способны к дальнейшему развитию с образованием колоний. Таким образом, при вертикальном расположении листьев различия величины адгезии у разных категорий инфекционных структур B. graminis в большей степени проявляются в изменении соотношения структур, направленных вверх или вниз вдоль оси листа. Это хорошо заметно при сопоставлении нормальных и аномальных структур. Закономерность преобладания продольной ориентации над поперечной у нормальных инфекционных структур в определенной мере сохраняется в условиях, когда силы тяжести направлена вдоль оси листа. Это определяет различие структур нормальной морфологии, образующих и не образующих микроколонии.
Выявлено достоверное влияние на длину аппрессориальной трубки фактора (UpDn), отражающего ее ориентацию вверх или вниз (табл. 2). Более того, достоверно также взаимодействие UpDn:Orient, т.е. обоих факторов, связанных с ориентацией апрессория. Почти во всех вариантах опыта у продольных структур средняя длина трубок при ориентации вниз была больше, чем у структур, направленных вверх, а поперечно направленные ростковые трубки имели промежуточную длину. У более многочисленных инфекционных единиц B. graminis agropyri на листьях пшеницы, трубки, направленные вверх и не ассоциированные с гало, имели существенно большую длину (табл. 4). Аналогичные существенные различия имели инфекционные единицы B. graminis agropyri и B. graminis tritici на листьях пырея (данные не представлены). Полагаем, что большая длина у трубок, направленных вниз, может быть обусловлена, во-первых, большим вращающим моментом у длинных трубок, и, во-вторых, меньшей адгезией более длинных трубок, часть из которых более близка по своим свойствам к аномальным и попали в категорию нормальных по ошибке.
ЗАКЛЮЧЕНИЕ
Несмотря на высокое визуальное сходство морфологии инфекционных структур мучнистой росы 3-х специализированных форм они имеют отчетливые различия в длине нормальной апрессориальной инфекционной трубки, частоте аномалий и размерах гало. Вариабельность длины инфекционной трубки и частота формирования гало в значительной степени определяется и растением-хозяином.
При вертикальном расположении листовой пластинки ориентация трубки зависела от степени адгезии и приводила к тому, что структуры с более длинной ростковой трубкой и низкой адгезией принимали по большей части продольное положение дистальным концом вниз.
Варьирование изученных морфометрических параметров было обусловлено в большей степени локальными различиями условий патогенеза, в частности, локальной адгезией инфекционных трубок к поверхности и в меньшей степени совместимостью или несовместимостью растения и патогена. Это связано с тем, что в состав выборки входили преимущественно абортивные структуры, которые несмотря на визуально нормальную морфологию не имели перспектив развития с образованием спороносящей колонии.
Работа выполнена в рамках ГЗ ГБС РАН (№ 118021490111-5) на базе УНУ “Фондовая оранжерея”.
Список литературы
Avetisyan G.A., Avetisyan T.V., Babosha A.V. Influence of oxidative stress on the direction of infectious structures of the wheat powdery mildew pathogen. In: Y.W. Dehn, H.B. Deising, B. Fraaije, U. Gisi, D. Hermann, A. Mehl, E.C. Oerke, P.E. Russell, G. Stammler, K.H. Kuck, H. Lyr (eds). Modern fungicides and antifungal compounds, Vol. 7. Braunschweig, Germany: Deutsche Phytomediziische Gesellschaft, 2014. P. 87–88.
Avetisyan G.A., Babosha A.V. Role of oxidative stress in pathogenesis of wheat powdery mildew. Byulleten Glavnogo botanicheskogo sada. 2011. V. 196. P. 157–164 (in Russ.).
Babosha A.V., Komarova G.I. Orientation of the primary infectious structures of powdery mildew fungi (Blumeria graminis) and their adhesion to the surface of infected wheat (Triticum aestivum) leaves. Physiol. Mol. Plant Pathol. 2017. V. 99. P. 65–74. https:// doi.org/.https://doi.org/10.1016/j.pmpp.2016.09.004
Babosha A.V., Ryabchenko A.S., Avetisyan T.V. Effect of exogenous cytokinins on dynamics of development and differentiation of infectious structures of the pathogen of wheat powdery mildew. Cell and Tissue Biology. 2009. V. 3(4). P. 387–396. https:// doi.org/.https://doi.org/10.1134/S1990519X09040117
Edwards H.H. A basic staining material associated with the penetration process in resistant and susceptible powdery mildewed barley. New Phytol. 1970. V. 69. P. 299–301.
Homma Y. Erysiphaceae of Japan. J. Facul. Agr. Hokkaido Imp. Univ., Sapporo. 1937. V. 38 (3). P. 186–461.
Kunoh H. Primary germ tubes of Erysiphe graminis conidia. In: Y. Asada, W.R. Bushnell, S. Ouchi, C.P. Vance (eds). Plant infection: the physiological and biochemical basis. Springer-Verlag, 1982. P. 45–59.
Mellersh D.G., Heath M.C. Plasma membrane – cell wall adhesion is required for expression of plant defense responses during fungal penetration. Plant Cell. 2001. V. 13. P. 413–424. https://doi.org/.https://doi.org/10.1105/tpc.13.2.413
Mishina G.N., Serezhkina G.V., Avetisyan T.V., Ryabchenko A.S., Andreev L.N. Peculiarities of halo formation in pathogenesis as a response of epidermal cereal cells to penetration of powdery mildew pathogens. Izvestia RAS. Ser. Biol. 2001. V. 4. P. 424–430 (in Russ.).
Mishina G.N., Serezhkina G.V., Rashal I.D., Andreev L.N. Features of the development of Erysiphe graminis f. sp. hordei Marchal on the leaves of various barley genotypes of resistance. Mikologiya i fitopatologiya. 1988. V. 22 (4). P. 292–295 (in Russ.).
Ryabchenko A.S., Avetisyan T.V., Babosha A.V. Special traits of growth of the agent of powdery mildew of wheat along and across the longitudinal axis of a leaf under the action of exogenous zeatin. Biology Bulletin. 2009. V. 36. P. 437–448. https://doi.org/https://doi.org/10.1134/S1062359009050033
Serezhkina G.V., Andreev L.N., Avetisyan T.V., Batova S.N., Poleva L.V. Role of primary reactions in interactions between the parasite and host plant with special reference to resistance of the wheat-wheatgrass hybrids to Erysiphe graminis tritici at the stage of penetration. Biology Bulletin. 1996. V. 23. P. 346–352.
Serezhkina G.V., Andreev L.N., Mishina G.N. The importance of adhesion in the relationship of the parasite and the host plant with mandatory parasitism. Izvestia AN. Ser. Biol. 1990. V. 1. P. 149–153 (in Russ.).
Serezhkina G.V., Mishina G.N., Andreev L.N., Avetisyan T.V., Lapochkina I.F. Cytophysiological characteristics of resistance of Aegilops speltoides Tausch, and disomic addition wheat – Aegilops lines (2N = 44) at the stage of seedlings against powdery mildew. Biology Bulletin. 1999. V. 26. P. 344–350.
Sugai K., Masaoka H., Penjore K., Hanboonsong Y., Nishiguchi M., Yamaoka N. The time and spatial strategy of Blumeria graminis f. sp. hordei for surviving after failure of first infection. Physiol. Mol. Plant Pathol. 2010. V. 74 (5). P. 346–350. https://doi.org/.https://doi.org/10.1016/j.pmpp.2010.05.005
Wright A.J., Carver T.L., Thomas B.J., Fenwick N.I., Kunoh H., Nicholson R.L. The rapid and accurate determination of germ tube emergence site by Blumeria graminis conidia. Physiol. Mol. Plant Pathol. 2000. V. 57. P. 281–301. https://doi.org/.https://doi.org/10.1006/pmpp.2000.0304
Wyand R.A., Brown J.K. Genetic and forma specialis diversity in Blumeria graminis of cereals and its implications for host-pathogen co-evolution. Mol. Plant Pathol. 2003. V. 4(3). P. 187–198. https:// doi.org/.https://doi.org/10.1046/j.1364-3703.2003.00167.x
Yamaoka N., Ohta T., Danno N., Taniguchi T., Matsumoto I., Nishiguchi M. The role of primary germ tubes in the life cycle of Blumeria graminis: the primary germ tube is responsible for the suppression of resistance induction of a host plant cell. Physiol. Mol. Plant Pathol. 2007. V. 71. P. 184–191. https://doi.org/.https://doi.org/10.1016/j.pmpp.2008.02.001
Аветисян Г.А., Бабоша А.В. (Avetisyan, Babosha) Роль окислительного стресса в патогенезе возбудителя мучнистой росы пшеницы // Бюллетель ГБС. 2011. Т. 196. С. 157–164.
Бабоша А.В., Рябченко А.С., Аветисян Т.В. (Babosha et al.) Влияние экзогенных цитокининов на динамику развития и дифференциацию инфекционных структур возбудителя мучнистой росы пшеницы // Цитология. 2009. Т. 51. № 7. С. 602–611.
Мишина Г.Н., Сережкина Г.В., Аветисян Т.В., Рябченко А.С., Андреев Л.Н. (Mishina et al.) Особенности формирования гало в процессе патогенеза как ответная реакция эпидермальных клеток злаков на проникновение возбудителей мучнистой росы // Известия РАН. Сер. биол. 2001. № 4. С. 424–430.
Мишина Г.Н., Сережкина Г.В., Рашаль И.Д., Андреев Л.Н. (Mishina et al.) Особенности развития Erysiphe graminis f. sp. hordei Marchal на листьях различных по устойчивости генотипов ячменя // Микология и фитопатология. 1988. Т. 22. Вып. 4. С. 292–295.
Рябченко А.С., Аветисян Т.В., Бабоша А.В. (Ryabchenko et al.) Особенности роста возбудителя мучнистой росы пшеницы вдоль и поперек длинной оси листа под действием экзогенного зеатина // Известия РАН. Сер. биол. 2009. № 5. С. 1–13.
Сережкина Г.В., Андреев Л.Н., Аветисян Т.В., Батова С.Н., Полева Л.В. (Serezhkina et al.) О роли первичных реакций во взаимоотношениях паразита и растения-хозяина при определении устойчивости пшенично-пырейных гибридов к Erysiphe graminis tritici на стадии проникновения // Известия РАН. Сер. биол. 1996. № 4. С. 422–429.
Сережкина Г.В., Андреев Л.Н., Мишина Г.Н. (Serezhkina et al.) Значение адгезии во взаимоотношениях паразита и растения-хозяина при облигатном паразитизме // Известия АН. Сер. биол. 1990. № 1. С. 149–153.
Сережкина Г.В., Мишина Г.Н., Андреев Л.Н., Аветисян Т.В., Лапочкина И.Ф. (Serezhkina et al.) Цитофизиологическая характеристика устойчивости к мучнистой росе Aegilops speltoides Tausch. и дисомнодополненных пшенично-эгилопсных линий (2n = 44) в стадии проростков // Известия РАН. Сер. биол. 1999. № 4. С. 417–424.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


