Микология и фитопатология, 2019, T. 53, № 3, стр. 177-182
Устойчивость сортов ржи к спорынье и содержание эргоалкалоидов в склероциях Claviceps purpurea в условиях Кировской области
Т. К. Шешегова 1, 2, *, Л. М. Щеклеина 1, В. П. Желифонова 3, Т. В. Антипова 3, Б. П. Баскунов 3, А. Г. Козловский 3
1 Федеральный аграрный научный центр Северо-Востока им. Н.В. Рудницкого
610007 Киров, Россия
2 Вятская государственная сельхозакадемия
610017 Киров, Россия
3 Институт биохимии и физиологии микроорганизмов имени Г.К. Скрябина РАН
142290 Пущино, Россия
* E-mail: immunitet@fanc-sv.ru
Поступила в редакцию 25.05.2018
После доработки 19.07.2018
Принята к публикации 24.12.2018
Аннотация
Исследованы спектр и содержание эргоалкалоидов (ЭА) в склероциях гриба Claviceps purpurea, собранных на зерновых культурах (озимая рожь, озимая и яровая тритикале, озимая и яровая пшеница, яровой ячмень) в разных агроэкологических точках Кировской обл. Во всех образцах выявлен одинаковый состав ЭА, что может свидетельствовать о распространении на данной территории только одной расы гриба C. purpurea, для которой характерен биосинтез эргокристина и его стереизомера эргокристинина. Содержание ЭА в образцах различалось в 3 раза – от 0.3 до 0.9% от массы склероциев. Наибольшее количество ЭА было в склероциях, сформированных на ржи (0.8 и 0.9%) и яровой тритикале (0.9%), а наименьшее (0.3%) – на растениях яровой пшеницы. Место сбора склероциев не оказывало значительного влияния на содержание ЭА: у сорта ржи Кировская 89 в разных географических местах, удаленных друг от друга на 150 км, содержание их было примерно на одном уровне. Изучение 60 сортов озимой ржи при искусственной инокуляции цветков суспензией конидий C. purpurea показало, что все сорта сильно восприимчивы к спорынье. За 5 лет изучения (2013–2017 гг.) лишь 12 сортов, среди которых возделываемые в РФ Рада, Графиня, Татьяна, Московская 12, Саратовская 7, Антарес и Памяти Кунакбаева, поражались в среднем на уровне 13.0–25.0%. Это ниже в 2.4–4.5 раза, по сравнению с сортом-индикатором (наиболее восприимчивым). При отсутствии инокуляции данные сорта характеризовались как среднеустойчивые – поражение составляло до 3%. Установлено, что в растительно-микробных взаимоотношениях Secale sereale – Claviceps purpurea велика роль климатических и случайных (неучтенных) факторов: доля фактора “год” в поражении растений составляет 36.6%, “сорт” – 17.1%, неучтенных факторов – 40.9%. Как и в отношении других болезней, возбудителями которых являются неспециализированные патогены, селекция должна быть ориентирована на выносливость.
Фитопатогенный гриб Claviceps purpurea (Fr.) Tul., вызывающий заболевание спорынью у зерновых культур и злаковых трав в РФ и за рубежом (Pazoutova, 2001; Shchekleina, Sheshegova, 2013; Miedaner, Geiger, 2015), относится к отделу Ascomycota (Sordariomycetes, Hypocreales, Clavicipitaceae). Цикл развития его складывается из трех обособленных стадий: склероциальной, сумчатой (половая стадия) и конидиальной (бесполая). Таким образом, у гриба имеется несколько инфекционных структур (склероции, аскоспоры и конидии), что значительно осложняет систему защиты от спорыньи. Склероциальная (зимующая) стадия и конидии на поверхности склероциев являются единственной формой сохранения патогена в природе – в почве и семенном материале (Buga, Nemkovich, 1997).
Вредоносность спорыньи заключается в значительном снижении продуктивности растений из-за обеспложивания цветков в которых образуются склероции. В других, незараженных цветках, происходит задержка развития завязи, в результате зерно формируется более мелкое и щуплое, что влечет за собой общее снижение урожайности зерновых культур. Нашими исследованиями (Sheshegova, Shchekleina, 2017) установлена достоверная (при Р ≥ 0.95) зависимость между количеством склероциев в колосе и его продуктивностью (r = –0.55), массой 1000 зерен (r = –0.43) и урожайностью озимой ржи (r = –0.65).
Биологическая опасность спорыньи заключается также в возможности отравления людей и животных зерном и различными кормами, содержащими склероции патогена, токсические свойства которых обусловлены содержанием в них эргоалкалоидов (ЭА) разного строения (Scott et al.,1992; Khochenko et al., 2000; Dusemund et al., 2006). В результате у человека, животных и птицы проявляется эрготизм – общее название комплекса заболеваний, связанных с попаданием с пищей и кормами ЭА склероциев спорыньи. Надо сказать, что химико-фармацевтическая промышленность широко использует склероции в качестве сырья для производства лечебных препаратов, применяемых в акушерстве, гинекологии, хирургии, неврологии, психиатрии и пр. Для медицинских целей склероции получают либо на растениях, либо в лабораторных условиях в сапрофитной культуре (Fonin et al., 2003). Во Всероссийском институте лекарственных и ароматических растений (ВИЛАР), в настоящее время, отобраны в процессе селекции и запатентованы новые высокопродуктивные промышленные штаммы спорыньи – продуценты различных эргоалкалоидов. Разработана уникальная для России интенсивная технология возделывания спорыньи на ржи, позволяющая обеспечить сырьем производство лекарственных препаратов. Методом индуцированного мутагенеза получены генетически измененные линии сапрофитной культуры спорыньи эрготаминового и эргокриптинового штаммов (Bykov et al., 2012).
Надо сказать, что способность гриба C. purpurea продуцировать эргоалкалоиды определенного состава является наследственно закрепленным признаком. Тем не менее, количественное и качественное содержание алкалоидов непостоянно и зависит в какой-то мере от географического фактора, климатических условий и растения-хозяина (Zvonkova et al., 2005; Miedaner, Geiger, 2015). Спорынья проявляется в регионах с высокой влажностью воздуха (70% и выше) и умеренно теплой погодой (около 20°С) в период цветения растений (Sheshegova, Shchekleina, 2014). В Кировской обл. с 1998 по 2016 гг. поражение озимой ржи было в пределах от 0.2 до 1.7% (Sheshegova, Shchekleina, 2017). Аномальные по тепло- и влагообеспеченности условия вегетации 2017 г. (гидротермический коэффициент 2.13) спровоцировали сильнейшее развитие спорыньи, когда на отдельных производственных посевах ржи поражение было на уровне 3–5%. Фитопатологическая проблема спорыньи обостряется еще и в связи с ужесточением отечественного ГОСТа 16990-88 на рожь, который не допускает наличия склероциев в оригинальных и семенах высших репродукций.
Целью наших исследований стало изучение содержания и спектра эргоалкалоидов в разных образцах склероциев C. purpurea и поиск наиболее устойчивых сортов озимой ржи.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование было проведено на 60 отечественных сортах озимой ржи, в том числе 25 – селекции ФГБНУ ФАНЦ Северо-Востока. Растения ежегодно высевали на фитопатологическом участке на делянках площадью 1 м2 в 3-кратной повторности. В начале колошения их инокулировали в цветок суспензией конидий C. purpurea в концентрации 105 спор/мл (Shchekleina, Sheshegova, 2012). Для этого использовали патогенные штаммы местной популяции возбудителя, имеющиеся в рабочей коллекции лаборатории иммунитета и защиты растений ФАНЦ Северо-Востока. При полной спелости зерна оценивали поражение сортов по соотношению здоровых (без склероциев) и больных (со склероциями) растений в анализируемой выборке (не менее 20 растений в каждой повторности), весовую массу зерна и склероциев. Характеристику сортов по устойчивости давали на основании шкалы (Miedaner et al., 2010).
Для изучения содержания и спектра эргоалкалоидов местной популяции C. purpurea в 2017 г. провели фитосанитарный мониторинг и сбор инфекционного материала на селекционных и семеноводческих посевах ФАНЦ Северо-Востока (г. Киров) и двух сортоиспытательных участках (Яранский и Советский) Кировской обл. Для биохимического анализа отобрали шесть образцов склероциев, собранные на растениях озимой ржи, ярового ячменя, яровых и озимых форм пшеницы и тритикале (табл. 1). Склероции собирали на наиболее поражаемых сортах этих культур.
Таблица 1.
Характеристика образцов склероциев Claviceps purpurea
| Номер образца | Растение-хозяин, сорт | Место выделения | Поражение, % | Масса склероциев | |
|---|---|---|---|---|---|
| г/м2 | в % к массе зерна | ||||
| 1 | Озимая рожь Кировская 89 | г. Киров, ФГБНУ ФАНЦ Северо-Востока | 25.5 | 18.2 | 14.9 |
| 2 | Озимая рожь Кировская 89 | г. Яранск, сортоиспытательный участок | 8.8 | 5.3 | 4.8 |
| 3 | Озимая тритикале Зимогор | г. Советск, сортоиспытательный участок | 9.7 | 6.9 | 5.5 |
| 4 | Яровой ячмень Зазерский 85 | г. Киров, ФГБНУ ФАНЦ Северо-Востока | 1.0 | 1.8 | 0.5 |
| 5 | Яровая тритикале 09-211 ят. 10 | г. Киров, ФГБНУ ФАНЦ Северо-Востока | 5.0 | 3.8 | 3.2 |
| 6 | Яровая пшеница С-122 | г. Киров, ФГБНУ ФАНЦ Северо-Востока | 1.8 | 3.1 | 0.9 |
Выделение чистых культур C. purpurea проводили с поверхности склероциев в чашках Петри с агаризованной средой Т2 (г/л): сахароза – 100; аспарагин – 10.0; дрожжевой экстракт – 0.1; KH2PO4 – 0.25; MgSO4 · 7H2O – 0.25; KCl – 0.12; Ca(NO3)2 · · 4H2O – 1.0; FeSO4 · 7H2O – 0.007; ZnSO4 · 7H2O – 0.006; NH4OH до pH 5.2; агар – 20,0; дистиллированная вода – до 1 л. При изучении продукции ЭА, выделенными изолятами было использовано две среды. Для выращивания инокулята использовали среду TG (г/л): глюкоза – 100; лимонная кислота – 10.0; дрожжевой экстракт – 0.1; KH2PO4 – 0.5; MgSO4 · 7H2O – 0.3; FeSO4 · 7H2O – 0.007; ZnSO4 · 7H2O – 0.006; NH4OH до pH 5.5; дистиллированная вода – до 1 л. Для ферментации использовали среду T25 (г/л): сахароза – 300; лимонная кислота – 15.0; дрожжевой экстракт – 0.1; KH2PO4 – 0.5; MgSO4 · 7H2O – 0.5; KCl – 0.12; FeSO4 · 7H2O – 0.007; ZnSO4 · 7H2O – 0.006; NH4OH до pH 5.2; дистиллированная вода – до 1 л. Изоляты выращивали 12 суток в колбах (750 мл) со 100 мл среды T25 на качалке (220 об./мин) при температуре 24 ± 1°С.
ЭА из измельченных склероциев экстрагировали трижды 50%-м водным раствором ацетона, содержащего Н2SО4 для создания кислой среды (рН 4.5). Объединенный экстракт концентрировали на роторном испарителе до половины первоначального объема, собирая отгон ацетона. В полученную водную фракцию добавляли 25%-й р-р аммиака до рН 9–10 и экстрагировали 3 раза хлороформом. Для анализа ЭА из культуральной жидкости фильтрат экстрагировали 3 раза хлороформом при рН 9–10. Хлороформные экстракты подсушивали безводным Na2SO4 и упаривали на роторном испарителе. Анализ экстрактов осуществляли методом ТСХ на пластинках силикагеля (Silica gel F254, “Merck”, Германия) в системах: хлороформ – метанол – 25%-й NH4OH (90 : 10 : 0.1) и (80 : 20 : 0.2). ЭА обнаруживали по поглощению и флуоресценции в УФ-свете (264 и 360 нм) и после опрыскивания пластин реактивом Эрлиха. Выделение и очистку ЭА проводили препаративной ТСХ на пластинах силикагеля. Идентификацию метаболитов осуществляли сохроматографией со стандартными образцами и с помощью данных УФ-спектроскопии и масс-спектрометрии.
УФ-спектры соединений в метаноле получали на спектрофотометре UV-160А (“Shimadzu”, Япония). Масс-спектры соединений регистрировали на квадрупольном масс-спектрометре LCQ Advantage MAX (“Thermo Finnigan”, Германия), используя одноканальный шприцевой насос для прямого ввода образца в камеру для химической ионизации при атмосферном давлении.
Количественное содержание суммарного количества ЭА в экстрактах склероциев определяли спектрофотометрически в метаноле при λ = 313 нм. Расчет вели, используя коэффициент молярной экстинкции эргокристинина (log ε = 3.96).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При искусственной инокуляции весь анализируемый генофонд озимой ржи в сильной степени восприимчив к спорынье. Можно лишь выявлять и отбирать наименее поражаемые сорта и отдельные биотипы (табл. 2). Среди сортов селекции ФАНЦ Северо-Востока, интерес для работы в данном направлении представляют: районированные сорта Рада и Графиня и популяции, проходящие конкурсное испытание: Леда, Перепел, Графиня 2D, Флора и Флора RFc. Поражение их в среднем за 5 лет изучения было на уровне 12.2–26.2%, а содержание склероциев в зерновой массе 6.5–8.8%. Без искусственной инокуляции их можно отнести к среднеустойчивым (поражение до 3%). Состояние признаков у индикаторного сорта (наиболее восприимчивого в текущем году) было в среднем 58.8% и 31.7%. Индикатором в течение 3 лет был сорт Снежана 2, 2 лет – Фаленская универсальная. Большинство сортов других НИУ РФ еще более восприимчивы к местной популяции C. рurpurea. В 2017 г. более половины изучаемого генофонда поражались на 100%, т.е. в этих популяциях отсутствовали растения без склероциев. Относительно меньше поражались сорта: Татьяна, Московская 12, Памяти Кунакбаева, Антарес и Саратовская 7.
Таблица 2.
Наиболее устойчивые к спорынье сорта озимой ржи (искусственное заражение 2013–2017 гг.)
| Сорт | Происхождение | Поражение, % | Доля склероциев в зерновой массе, % |
|---|---|---|---|
| Флора | Кировская обл. | 12.7 | 8.1 |
| Флора RFc | '' | 12.2 | 7.1 |
| Рада | '' | 13.0 | 7.7 |
| Графиня | '' | 13.7 | 6.5 |
| Графиня 2D | '' | 18.0 | 8.0 |
| Леда | '' | 19.0 | 8.8 |
| Перепел | '' | 26.2 | 6.6 |
| Татьяна | Московская обл. | 22.2 | 12.8 |
| Московская 12 | '' | 15.0 | 12.3 |
| Саратовская 7 | Саратовская обл. | 18.7 | 4.7 |
| Памяти Кунакбаева | Республика Башкортостан | 21.0 | 7.2 |
| Антарес | Самарская обл. | 25.0 | 8.3 |
| Сорт-индикатор | 58.8 | 31.7 |
При статистической обработке иммунологических признаков выявлено существенное влияние климатических факторов на развитие этой болезни даже при искусственном заражении. Доля фактора “год” в поражении растений составила 36.6%, в засоренности зерновой массы склероциями – 29.1%. Роль сорта усиливается в интенсивности поражения растений, о чем свидетельствует характер засоренности зерна склероциями: вклад генотипа увеличился с 17.1 до 27.5%. Можно полагать, что благоприятные для патогена экологические факторы провоцируют повышение инфекционной нагрузки и образование склероциев, но количество их в значительной степени определяют морфо-биологические и биохимические свойства генотипа.
В растительно-микробных взаимоотношениях Secale sereale – Claviceps purpurea велика роль случайных (неучтенных) факторов – 40.9 и 35.9%. Это, к сожалению, значительно ограничивает возможности классической селекции в данном направлении. Как и в отношении других болезней (снежная плесень, корневые гнили, фузариоз, склеротиния, оливковая плесень) возбудителями, которых являются неспециализированные патогены, селекция должна быть ориентирована на выносливость. С учетом инфекционного потенциала каждого года следует выявлять популяции (биотипы) с наименьшим ущербом для урожая, а также формы, формирующие относительно меньшее количество склероциев на растениях.
Изучение состава ЭА в шести образцах склероциев показало, что спектр их был аналогичным. Два основных метаболита, реагирующих с реактивом Эрлиха, различались по хроматографической подвижности, имели идентичный УФ-спектр и молекулярную массу 609 Да. На основании полученных данных метаболиты были идентифицированы как эргокристин и его стереоизомер эргокристинин. Для представителей вида C. purpurea известен биосинтез трех типов эргоалкалоидов: клавиновых, D-лизергиновой кислоты и ее производных, пептидных эргоалкалоидов различных структурных групп (Flieger, Wurst, Shelby, 1990). В склероциях C. purpurea, как правило, обнаруживают пептидные эргоалкалоиды – эргометрин, эрготамин, эргокорнин, эргокриптин, эргозин и эргокристин (Zvonkova et al., 2005; Miedaner, Geiger, 2015). Многими исследователями (Pazoutova et al., 2000; Miedaner, Geiger 2015) отмечены значительные отличия в спектре ЭА C. purpurea из различных географических регионов. Так, изоляты из Западной Европы синтезируют эрготамин или эрготоксин, а cевероамериканские – различные комбинации эрготамина и эрготоксина (Miedaner, Geiger, 2015). Также обнаружено влияние местоположения посевов злаков и погодных условий на концентрацию и спектр ЭА в склероциях. По данным немецких исследователей (Miedaner, Geiger 2015) в первый год обработки конидиями посевов ржи в склероциях преобладали эрготамин (25%) и эргозин (18%), а на другой год – эргозин (25%) и эргокристин (24%).
Содержание ЭА в 6-ти образцах склероциев варьировало от 0.3 до 0.9% от массы склероциев (табл. 3). Различия в количестве ЭА зависели от видов растений-хозяев (Pazoutova et al., 2011). Наиболее высокое процентное соотношение ЭА было в склероциях, сформированных на ржи (0.8 и 0.9%) и яровой тритикале (0.9%), а наименьшее (0.3%) – на растениях перспективного сорта С-122 яровой пшеницы. Место сбора склероциев не оказывало значительного влияния на количественный состав ЭА: у сорта ржи Кировская 89 в разных географических местах, удаленных на 150 км, содержание их было примерно на одном уровне.
Таблица 3.
Содержание эргоалкалоидов (эргокристин, эргокристинин) и их состав в образцах склероциев Claviceps purpurea
| Образец | Содержание эргоалкалоидов | |
|---|---|---|
| мг/г | % | |
| 1 | 8.0 | 0.8 |
| 2 | 8.6 | 0.9 |
| 3 | 6.7 | 0.7 |
| 4 | 7.4 | 0.7 |
| 5 | 9.1 | 0.9 |
| 6 | 3.4 | 0.3 |
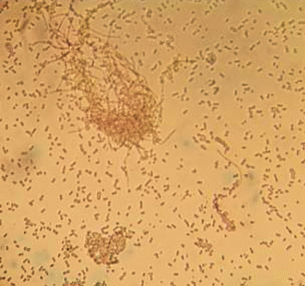
Была исследована продукция ЭА изолятами C. purpurea, выделенными в чистую культуру из склероциев, собранных в 2017 г. с ячменя, яровой и озимой пшеницы, озимой ржи, яровой и озимой тритикале при глубинном и поверхностном выращивании в средах, благоприятных для синтеза ЭА (Rehacek, Sajdl, 1990). Было установлено, что изоляты C. purpurea при культивировании на питательных средах не продуцировали ЭА. Микроскопирование глубинных культур изолятов показало наличие в препаратах неорганизованного мицелия и конидий (рис. 1). Такая морфология изолятов и отсутствие продукции ЭА характерна для паразитарных культур C. purpurea.
ЗАКЛЮЧЕНИЕ
Таким образом, одинаковый состав ЭА в склероциях разных видов злаковых культур, собранных в трех экологических точках Кировской обл., может свидетельствовать о распространении на данной территории только одной расы гриба C. purpurea, для которой характерен биосинтез эргокристина и эргокристинина. Отсутствие высокоустойчивых к спорынье сортов ржи среди изученного генофонда культур предполагает расширение их поиска путем иммунологического менеджмента коллекционных образцов, в том числе на фоне искусственных эпифитотий. В селекционном процессе следует ориентироваться на выявление и создание наименее поражаемых сортов и отдельных биотипов.
Список литературы
Buga S.F., Nemkovich A.I. Influence of disinfectants on the germination of sclerotia of ergot of the influenza of desinfectants he germination of ergote screlotia Claviceps purpurea (Fr.) Tul. Izvestiya Akademii agrarnykh nauk Respubliki Belarus. 1997. V. 4. P. 56–58 (in Russ.).
Bykov V.A., Sokolskaya T.A., Sidelnikov N.I. Unique center for medicinal plant industry. Zashchita i karantin rasteniy. 2012. V. 8. P. 3–7 (in Russ.).
Dusemund B., Altmann H., Jampen A. Mutterkornalkaloide in Lebensmitteln: Toxikologische J. Verbraucherschutz Lebensmittelsicherheit. 2006. V. 1. P. 150–152.
Flieger M., Wurst M., Shelby R. Ergot alkaloids – sources, structures and analytical methods. Folia Microbiol. 1997. V. 42 (1). P. 3–30.
Fonin V.S., Romanenko V.I., Ozerskaya S.M. Study on store conditions for strains of parasitic ergot Claviceps purpurea (Fr.) Tul. In: New and non-traditional plants and perspectives of its use: Materials of V International symposium. Moscow, 2003. P. 358–360 (in Russ.).
Khochenko A.A., Khudosovsky D.I., Solyanin V.V., Bezmen V.A. Problems of grain-fodder quality. Veterinariya. 2000. V. 1. P. 55–56 (in Russ.).
Miedaner T., Mirdita V., Geiger H.H. Strategies in breeding for ergot (Claviceps purpurea) resistance. In: International Symposium on rye breeding and genetics. Minsk, 2010. P. 83.
Miedaner T., Geiger H.H. Biology, genetics and management of ergot (Claviceps spp.) in rye, sorghum and pearl mille. Toxins. 2015. V. 7. P. 659–778.
Pazoutova S., Odvody G.N., Debra E., Frederickson D.E., Chudíčková M., Olšovská J., Kolařík M. New Claviceps species from warm-season grasses. Fungal Diversity. 2011.V. 49 (1). P. 145–165.
Pazoutova S. The phylogeny and evolution of the genus Claviceps. Mycol. Res. 2001. V. 105 (3). P. 275–283.
Pazoutova S., Olsovska J., Linka M., Kolínska R, Flieger M. Chemoraces, and habitats specialization of Claviceps purpurea populations. Appl. Environ. Microbiol. 2000. V. 66. P. 5419–5425.
Rehacek Z., Sajdl P. Ergot alkaloids. Chemistry, biological effect, biotechnology. Academia, Prague, 1990.
Scott P.M., Lombart G.A., Pellaers P., Bacler S., Lappi J. Ergot alkaloids in grain foods in Canada. J. AOAC Int. 1992. V. 75. P. 773–779.
Shchekleina L.M., Sheshegova T.K. Immunological state of winter rye perspective populations bred in North-East Agricultural Research Institute. Dostizheniya nauki i tekhniki APK. 2012. V. 6. P. 23–26 (in Russ.).
Shchekleina L.M., Sheshegova T.K. Problem of cereal ergot [Claviceps purpurea (Fr.) Tul.]: history and modern state (review). Teoreticheskaya i prikladnaya ekologiya. 2013 (1). P. 5–10 (in Russ.).
Sheshegova T.K., Shchekleina L.M. Some methods and tools for winter rye protection from ergot. Dostizheniya nauki i tekhniki APK. 2014. V. 3. P. 47–50 (in Russ.).
Sheshegova T.K., Shchekleina L.M. Influence of ergot harmful on biometric parameters of sclerotia. Zashchita i karantin rasteniy. 2017. V. 11. P. 10–12 (in Russ.).
Zvonkova E.N., Shain S.S., Sajbel E.S. Methods of obtaining of neuro-hormonal preparations of egro-peptide line. Rossiyskiy khimicheskiy zhurnal. 2005. V. 49. P. 125–134 (in Russ.).
Буга С.Ф., Немкович А.И. (Buga, Nemkovich) Влияние протравителей на прорастание склероциев спорыньи Claviceps purpurea (Fr.) Tul. // Известия Академии аграрных наук Республики Беларусь. 1997. № 4. С. 56–58.
Быков В.А., Сокольская Т.А., Сидельников Н.И. (Bykov et al.). Уникальный центр лекарственного растениеводства // Защита и карантин растений. 2012. № 8. С. 3–7.
Звонкова Е.Н., Шаин С.С., Сайбель Е.С. (Zvonkova et al.). Пути получения нейрогормональных препаратов эргопептидного ряда // Российский химический журнал. 2005. Т. 49. С. 125–134.
Фонин В.С., Романенко В.И., Озерская С.М. (Fonin et al.). Изучение условий хранения штаммов паразитарной спорыньи Claviceps purpurea (Fr.) Tul. // Новые и нетрадиционные растения и перспективы их использовании: Материалы V Международного симпозиума. Т. I. М., 2003. С. 358–360.
Хоченко А.А., Худосовский Д.И., Солянин В.В., Безмен В.А. (Khochenko et al.). Проблемы качества зернофуража // Ветеринария. 2000. № 1. С. 55–56.
Шешегова Т.К., Щеклеина Л.М. (Sheshegova, Shchekleina). Зависимость вредоносности спорыньи от биометрических показателей склероциев // Защита и карантин растений. 2017. № 11. С. 10–12.
Шешегова Т.К., Щеклеина Л.М. (Sheshegova, Shchekleina). Некоторые приемы и средства защиты озимой ржи от спорыньи // Достижения науки и техники АПК. 2014. № 3. С. 47–50.
Щеклеина Л.М., Шешегова Т.К. (Shchekleina, Sheshegova). Иммунологическое состояние перспективных популяций озимой ржи селекции НИИСХ Северо-Востока // Достижение науки и техники АПК. 2012. № 6. С. 23–26.
Щеклеина Л.М., Шешегова Т.К. (Shchekleina, Sheshegova). Проблема спорыньи злаков [Claviceps purpurea (Fr.) Tul.]: история и современность (обзор) // Теоретическая и прикладная экология. 2013. № 1. С. 5–10.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология