Микология и фитопатология, 2019, T. 53, № 4, стр. 236-245
РАМУЛЯРИОЗ ЯЧМЕНЯ В РОССИЙСКОЙ ФЕДЕРАЦИИ: ДИАГНОСТИКА И РАСПРОСТРАНЕНИЕ
О. С. Афанасенко 1, *, Н. В. Мироненко 1, **, Л. А. Беспалова 2, ***, И. Б. Аблова 2, ****, Н. М. Лашина 1, *****
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
2 Национальный центр зерна им. П.П. Лукьяненко
350012 Краснодар, Россия
* E-mail: olga.s.afan@gmail.com
** E-mail: nina2601mir@mail.ru
*** E-mail: bespalova_l_a@rambler.ru
**** E-mail: ablova@mail.ru
***** E-mail: nlashina@mail.ru
Поступила в редакцию 19.10.2018
После доработки 26.11.2018
Принята к публикации 21.12.2018
Аннотация
Рамуляриоз ячменя вызывает несовершенный гриб Ramularia collo-cygni. Болезнь относится к числу экономически значимых в Европе, Новой Зеландии и Южной Америке. Впервые в России сильное развитие рамуляриоза было выявлено в 2011 г. в Краснодарском крае. В пораженных листьях ячменя из Архангельской обл. в 2014 г. и при фитосанитарном мониторинге на производственных посевах сорта Достойный в 2016 г. в Адыгее, нами также был выявлен рамуляриоз. В 2018 г. в начале июня (фаза созревания) проведены обследования посевов озимого ячменя в Краснодаре, Новокубанском, Тбилисском, Усть-Лабинском, Красноармейском и Славянском районах Краснодарского края и в Новоалександровском районе Ставропольского края. Повсеместно выявлено эпифитотийное развитие рамуляриоза (100%-я распространенность болезни). Симптомы болезни соответствовали описанным в литературе на поздних стадиях развития растений. ПЦР-диагностику инфекционного материала провели в одном образце каждого обследованного региона. Для идентификации возбудителя проводили прямую ПЦР с видоспецифичными праймерами, используя для амплификации вместо целевой ДНК небольшой участок ткани листа ячменя с симптомами болезни, то есть без выделения патогена в чистую культуру и без выделения и очистки ДНК. В качестве контроля использовали ДНК чистой культуры гриба. Во всех образцах из Краснодарского и Ставропольского краев было подтверждено наличие диагностического фрагмента R. collo-cygni. Урожайность озимого ячменя в 2018 г. в Краснодарском крае, по данным Министерства сельского хозяйства и перерабатывающей промышленности Краснодарского края, составила 63.8 ц с 1 га. Эти показатели превысили прошлогодние на 3.7%. То есть сильное развитие рамуляриоза не привело к значительным потерям урожая, что, по-видимому, связано с ускоренным созреванием озимого ячменя в условиях острой засухи и предположительно позднему проявлению болезни. Эпифитотийное развитие болезни в Краснодарском крае в 2018 г. свидетельствует о сильной контаминации семян ячменя, которая, по-видимому, происходила в предыдущие годы при массовом распространении конидий. В Северо-Западном регионе РФ только в Ленинградской обл. с сортов коллекционного питомника Ленинградского НИИСХ методом ПЦР удалось доказать присутствие патогена на трех сортах ярового ячменя Posada, J.B. Flavour и Issota, интродуцированных из Германии и полученных из коллекции ВИР. В остальных местах сборов результаты ПЦР-диагностики были отрицательными. Отсутствие сведений о реальном распространении рамуляриоза на территории Российской Федерации связаны в основном с трудностями диагностики патогена.
ВВЕДЕНИЕ
Возбудителем рамуляриоза ячменя является несовершенный гриб Ramularia collo-cygni Sutton et Waller, 1988, в более ранней литературе известный как Ophiocladium hordei, Ovularia hordei и Ramularia hordeicola (Sachs, 2006).
Впервые симптомы рамуляриоза на ячмене были описаны более чем 100 лет назад в Италии (Cavara, 1893, цит. по: Havis et al., 2015). В обзоре N. Havis et al. (2015) приведены даты первого обнаружения патогена в странах мира, которые свидетельствуют, что на Южно-Американском континенте впервые патоген был обнаружен в 1925 г. в Чили, на Северо-Американском континенте в 1960 г. в США, в 1934 г. гриб был обнаружен в Норвегии. Только почти через 100 лет со времени первого обнаружения рамуляриоз был описан как вредоносное заболевание ячменя в Австрии (Huss et al., 1987), а позже в других странах Европы: Германии (Sachs, 2000), Шотландии (Oxley et al., 2002), Чехии (Minarikova et al., 2002), Швеции (Djurle, Rasmussen, 2006), Англии, Ирландии, Франции, Дании, Швейцарии (Walters et al., 2008), Словакии (Gubis et al., 2008), Хорватии (Koric et al., 2009), Эстонии (Soovali et al., 2014). За пределами Европы рамуляриоз ячменя распространен в Северной и Южной Америке и Новой Зеландии (Walters et al., 2008).
В настоящее время рамуляриоз ячменя относится к числу экономически значимых болезней в Европе (Pinnschmidt, Hovmoller, 2003), Новой Зеландии (Cromey et al., 2004), Южной Америке – в Аргентине (Clemente et al., 2014) и Уругвае (Pereyra, 2013). Вредоносность заболевания связана как с прямыми потерями урожая, так и с ухудшением качества зерна. В эпифитотийные годы потери урожая до 70% определены в Уругвае (Pereyra, 2013). В Европе потери урожая на восприимчивых сортах могут достигать 5–10 ц/га (Oxley et al., 2006; Reitan, Salamati, 2006). Значительное снижение массы зерна при поражении растений возбудителем R. collo-cygni, было определено также в работе S.A. Pereyra (2013).
Впервые в России в 2011 г. в Краснодарском крае при обследовании посевов ячменя в фазу молочно-восковой спелости на сортах Платон и Циндерелла было отмечено сильное развитие рамуляриоза (Afanasenko et al., 2011, 2012). Распространенность заболевания составляла 100%. Позже, в пораженных листьях ячменя, присланных нам из Архангельской обл. в 2014 г. и при фитосанитарном мониторинге на производственных посевах сорта Достойный в 2016 г. в Адыгее нами также был выявлен рамуляриоз (неопубликованные данные).
В связи с высокой вредоносностью болезни и отсутствием сведений о реальной распространенности рамуляриоза в зоне первичного обнаружения, в 2018 г. проведены обследования посевов ячменя в 6 районах Краснодарского и одном районе Ставропольского краев, а также в Северо-Западном регионе РФ и диагностика возбудителя в собранном инфекционном материале.
Результаты мониторинга и диагностики, а также обзор современной литературы по особенностям биологии нового для России патогена ячменя представлены в данной статье.
МАТЕРИАЛЫ И МЕТОДЫ
Обследование посевов ячменя было проведено в начале июня 2018 г. в ряде районов Краснодарского края (рис. 1) и в Новоалександровском р-не Ставропольского края. В 2016 г. исследования были проведены в Республике Адыгея. В Северо-Западном регионе РФ исследования проводились в Ленинградской, Новгородской и Псковской областях в середине июля 2018 г. (рис. 2).
Рис. 1.
Распространение рамуляриоза на озимом ячмене в Краснодарском крае в 2018 г.: 1 – Темрюкский р-н, 2 – Крымский р-н, 3 – Красноармейский р-н, 4 – г. Краснодар, 5 – Усть-Лабинский р-н, 6 – Белореченский р-н, 7 – Новокубанский р-н, 8 – Тбилисский р-н, 9 – Успенский р-н. В Республике Адыгея (светлая окружность) заболевание зафиксировано в 2016 г.
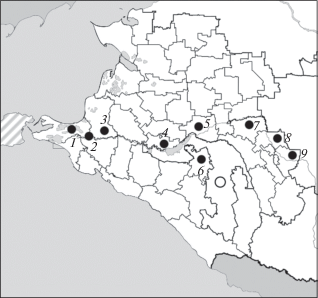
Рис. 2.
Места обследования и обнаружения Ramularia collo-cygni на яровом ячмене в Северо-Западном регионе РФ в 2014 г. (светлая окружность) и 2018 г. (темная окружность).
Необычные условия засухи мая и начала июня в Краснодарском крае привели к раннему созреванию озимого ячменя. На период обследования, в зависимости от района озимый ячмень находился в фазе созревания, на западе региона в фазе Z 80–90, на востоке – Z 75–80. На Северо-Западе РФ яровой ячмень находился в фазе молочной спелости (Z 71–75).
Образцы пораженных листьев были собраны во всех районах обследования. В лаборатории иммунитета растений к болезням ВИЗР проведена ПЦР-диагностика собранного материала. Для идентификации R. collo-cygni проводили ПЦР-тест с видоспецифичными праймерами (Frei et al., 2007; Afanasenko et al., 2011) в варианте “прямой” ПЦР. Состав праймеров: RC3-F5'-GCGACCCTGCCGCGCAA-3' и RC5-R5'-CTCTGCGAATAGTTGCCACAA CG-3' (диагностический фрагмент размером 350 п.н.), Ram-For-6: 5'-CGTCATTTCACCACTCAAG-3', Ram-Rev-6a: 5'-CCTCTGCGAATAGTTGCC-3' (диагностический фрагмент 120 п.н.).
Для проведения ПЦР использовали продукт фирмы DIALAT Ltd. (Москва, Россия): буфер 2.5X ProSMasCFMix для ПЦР ДНК растительных образцов, без выделения ДНК, который содержит смесь ПЦР реагентов, включая стабилизатор/энхансер, термостабильную химерную ProSTag полимеразу, оптимизированную концентрацию MgCl2.
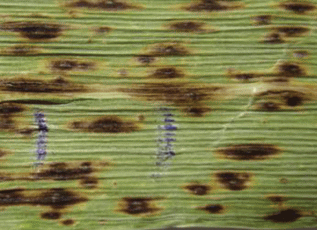
Состав реакционной смеси (на объем 20 мкл): 2.5X ProSMasCFMix – 10 мкл; праймеры по 0.4 мкМ каждого; вода – до 20 мкл. Вместо ДНК в реакционную смесь добавляли фрагмент пораженного болезнью листа ячменя размером 0.5–1.0 × × 0.5–1.0 мм (рис. 3).
Рис. 3.
Инфекционные пятна на листе ячменя. Маркером отмечено пятно, часть которого размером 1.0 × 1.0 мм использована для прямой ПЦР.
Условия ПЦР: начальная денатурация 98°С в течение 5 мин, затем 35 циклов с температурным режимом 98°С (5 сек), 61°С (10 сек), 72°С (15 сек). Финальная элонгация при 72°С (1 мин).
Продукты амплификации разделяли в 1.7%-м агарозном геле, окрашенном бромистым этидием, при напряжении 100 В в течение 3 ч и фотографировали. В качестве маркеров молекулярных масс использовали GeneRulerTM 100 и 50 п.н. DNA Ladder фирмы Fermentas.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Во всех районах обследования в Краснодарском крае было выявлено эпифитотийное развитие рамуляриоза. Симптомы болезни соответствовали описанным в литературе на поздних стадиях развития растений (Salamati, Reitan, 2006).
Симптомы рамуляриоза ячменя. Выделяют 3 стадии развития симптомов рамуляриоза на ячмене (Oxley et al., 2002). На ранней стадии развития болезни на нижних листьях ячменя в период кущения болезнь проявляется в виде мелких точечных некрозов 1–2 мм, которые чаще всего при первом обнаружении неправильно идентифицируют как физиологическую пятнистость. Эту пятнистость в англоязычной литературе описывают как “посыпанные перцем” листья (pepper spot). Отличить симптомы рамуляриоза от физиологической пятнистости можно при сравнении проявления болезни на нижней и верхней стороне листа: симптомы рамуляриоза одинаковы на обеих сторонах листовой пластинки, тогда как физиологическая пятнистость проявляется только на верхней стороне листа.
Промежуточная стадия болезни характеризуется появлением на нижних листьях прямоугольных темно-бурых пятен 2 × 0.5 мм, ограниченных жилками листа. Вследствие того, что эти пятна появляются при разрастании точечного некроза (pepper spot), он просматривается посредине пятна в виде более темной точки, поэтому пятно по форме напоминает букву Н. Пятно окружено хлорозом и, так же, как и на ранней стадии, в отличие от физиологической пятнистости, одинаково проявляется с верхней и нижней стороны листа. Покрытые пятнами нижние листья быстро усыхают, что может быть ошибочно принято за реакцию на абиотический стресс.
Симптомы пятнистости на собранных нами в Северо-Западном регионе РФ листьях отличались от описанных, характерных для промежуточной стадии (рис. 4). Мы наблюдали отдельные типичные Н-образные пятна, но также присутствовали темно-бурые пятна с параллельными краями, ограниченные жилками и проявляющиеся с обеих сторон листа. Наличие таких пятен служило критерием для сбора инфекционного материала.
Рис. 4.
Симптомы рамуляриоза на листьях сортов ячменя, собранных в Ленинградской обл. в 2018 г.: А – Issota, B – Posada, C – J.B. Flavour.

До момента выколашивания ячменя симптомы рамуляриоза отсутствуют и появляются только в фазу колошения, так как гриб развивается как эндофит, межклеточно, образуя разветвленные гифы, которые колонизируют ткани мезофилла (Sutton, Waller, 1988). Методом ПЦР было показано наличие гриба в листьях за 2–4 недели до появления первых симптомов (Havis et al., 2004).
На поздней стадии болезни на флаговом и предфлаговом листьях начинают появляться симптомы пятнистости. Листья покрываются мелкими бурыми сливающимися пятнами, желтеют и очень быстро, в течение 2–3 суток отмирают (рис. 5). Некротизация листа начинается, как правило, с вершины, при этом пятнистость остается заметной с обеих сторон отмершего листа. Кроме листьев пятнистость развивается на стеблях, колосковых чешуйках и остях. Пятна на листовой обертке более мелкие, чем на листе и также окружены сливающимся хлорозом.
Рис. 5.
Симптомы поздней стадии рамуляриоза на усыхающих листьях ячменя, собранных в Краснодарском крае в 2018 г.: А – сорт Рубеж, В – сорт Карера.

На всех обследованных полях в Краснодарском и Ставропольском краях наблюдалась 100%-я распространенность болезни (табл. 1). В связи с тем, что флаговый и предфлаговый листья на поздней стадии развития болезни были полностью покрыты некротическими пятнами и усохли, также как и обертка стебля (рис. 6), мы оценили развитие болезни в большинстве районов обследования в 100%.
Таблица 1.
Перечень сортов озимого ячменя, на которых распространенность рамуляриоза составила 100% и обследуемые посевные площади в Краснодарском и Ставропольском краях (июнь 2018 г.), а также Республике Адыгея (июнь 2016 г.)
| Район | Сорт | Площадь, га |
|---|---|---|
| Краснодарский край, 2018 г. | ||
| Новокубанский | Кондрат | 135 |
| Рубеж | 110 | |
| Каррера | 30 | |
| Гордей | 30 | |
| Платон | 30 | |
| Тбилисский | Стратег | 65 |
| Усть-Лабинский | Рубеж | 44 |
| Краснодар, опытное поле ФГБНУ “НЦЗ им. П.П. Лукьяненко” | Стратег | 15 |
| Гордей | 6 | |
| Платон | 5 | |
| Тома | 2 | |
| Вася | 10 | |
| Юрий | 1 | |
| Молот | 1 | |
| Красноармейский | Иосиф | 85 |
| Славянский | Рубеж | 94 |
| Ставропольский край, 2018 г. | ||
| Новоалександровский | Стратег | 110 |
| Иосиф | 126 | |
| Республика Адыгея, 2016 г. | ||
| Шовгеновский хутор Свободный труд | Достойный | ? |
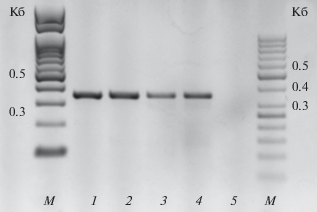
ПЦР-диагностика. ПЦР-диагностику инфекционного материала провели в одном образце каждого обследованного региона. В Краснодарском крае во всех образцах было подтверждено наличие диагностического фрагмента R. collo-cygni (RCC). В качестве контроля использовали ДНК чистой культуры гриба. Пример идентификации R. collo-cygni с использованием видоспецифичных праймеров приведен на рис. 7.
Рис. 7.
Идентификация Ramularia collo-cygni в листьях ячменя методом прямой ПЦР. М – маркеры молекулярных масс: слева GeneRulerTM 100 п.н. (Fermentas) и справа. GeneRulerTM 50 п.н. (Fermentas). 1–4 – диагностические ПЦР-продукты размером 350 п.н. Районы Краснодарского края: 1 – Новокубанский, 2 – Тбилисский, 3 – Усть Лабинский, 4 – Новоалександровский район Ставропольского края, 5 – негативный контроль (реакционная смесь без добавления растительного материала с симптомами рамуляриоза).
На листьях растений, выращенных из семян пораженных колосьев, собранных в Новоалександровском р-не Ставропольского края, в условиях климатической комнаты с высокой интенсивностью освещения (30 000 люкс) через 45 суток после посева появились симптомы пятнистости, одинаковые, как с верхней, так и нижней стороны листа (рис. 8). Проведенный ПЦР тест показал присутствие ДНК патогена.
Рис. 8.
Симптомы рамуляриоза на растениях, выращенных из пораженных семян сорта Рубеж: А – верхняя, В – нижняя сторона листа.

Из собранного инфекционного материала в Северо-Западном регионе РФ только в Ленинградской области с сортов коллекционного питомника Ленинградского НИИСХ методом ПЦР удалось доказать присутствие патогена на трех сортах ярового ячменя Posada, J.B. Flavour и Issota. Причем, ПЦР-диагностика была выполнена дважды: с праймерами, дающими диагностический фрагмент 350 п.н. (Frei et al., 2007) и другой парой праймеров (Afanasenko et al., 2011), дающими диагностический продукт размером 120 п.н. (рис. 9). В остальных местах сборов результаты ПЦР-диагностики были отрицательными.
Рис. 9.
Прямая ПЦР с реактивами ProSMasCFMix (Диалат) с отрезками листьев ячменя с симптомами рамуляриоза. Диагностический фрагмент размером 120 п.н. Обозначения: М – молекулярный маркер GeneRulerTM 50 п.н. (Fermentas). № 1 – негативный контроль; № 2–3 – сорт Posada, Белогорка 2018; № 4–5 – сорт Issota, Белогорка 2018; № 6–7 – сорт J.B. Flavour, Белогорка 2018; № 8 – ДНК Ramularia collo-cygni (:100).

После обнаружения патогена в Ленинградской обл., было проведено повторное обследование коллекции ячменя в фазу восковой спелости (Z 90). На делянках данных сортов были обнаружены типичные симптомы поздней стадии болезни.
На рис. 1 и 2 отмечены места обнаружения рамуляриоза на озимом ячмене в Краснодарском крае и на яровом в Ленинградской обл. На карте (рис. 2) также отмечена Архангельская обл., где в 2014 г. на листьях ячменя, собранных с коллекционных образцов на опытном поле ФГУП “Котласское” Архангельского НИИСХ и присланных нам О.Б. Батаковой, был выделен RСС.
Таким образом, в 2018 г. в фазу восковой спелости, практически перед уборкой ячменя, мы наблюдали эпифитотию рамуляриоза в различных районах Краснодарского края. На всех обследованных посевах наблюдалась 100% распространенность болезни. В модельных опытах потери урожая и снижение массы 1000 зерен определены в 30% и 15%, соответственно (Pinnschmidt, Jorgensen, 2009). Разработанная авторами модель прогноза предполагала, что развитие болезни 30% соответствует снижению урожая более чем на 15% (при урожае 75 ц с 1 га) и массы 1000 зерен менее чем на 10%. Имеются наблюдения, что при быстром созревании и позднем проявлении болезни урожайность снижается незначительно (личное сообщение N. Havis).
Впервые в коллекционных посевах ячменя на сортах J.B. Flavour, Posada и Issota в Ленинградской области ПЦР-тест позволил обнаружить возбудителя рамуляриоза ячменя в листьях с не ярко выраженными симптомами промежуточной стадии болезни: темно-бурые пятна различного размера с параллельными краями, с хлорозом и без него. Типичные симптомы поздней стадии были обнаружены на этих сортах при обследовании в фазу восковой спелости. Пятнистость выявлена на листьях, стеблях, колосковых чешуйках и остях.
Известна роль семенной инфекции в распространении рамуляриоза (Havis et al., 2006; Matusinsky et al., 2011; Kaczmarek et al., 2013). RCC был обнаружен в оболочках семян и лемме, а также в перикарпии и зародыше (Matusinsky et al., 2011). При искусственной инокуляции гриб аккумулируется под оболочкой семени снаружи алейронового слоя и присутствует во всех частях семени, включая эндосперм (Kaczmarek et al., 2013). По-видимому, новый обнаруженный нами очаг в Ленинградской обл. связан с завозом инфицированных семян из Европы. При этом сорт Isotta, на котором были обнаружены симптомы рамуляриоза, был рекомендован как донор средней устойчивости к болезни (Pinnschmidt et al., 2006). Интересно отметить наличие бессимптомной инфекции у растений, выращенных из инфицированных семян (Zamani-Noor, 2011). В обзоре Havis et al. (2015) приведены сведения о наличии ДНК Rcc в семенах озимого и ярового ячменя, сохраняемых с 1958 по 2007 гг. в Германии: патоген постоянно присутствовал в семенах с 1960 г. (<1 пг на 100 нг ДНК), но значительное увеличение уровня ДНК гриба в семенах озимого ячменя (>1 пг) произошло в 1968 г., а затем с 1977 по 2007 гг. При этом, первое сообщение о рамуляриозе, как о вредоносной болезни ячменя в Германии появилось в 1987 г. (Huss et al., 1987). В России подобных исследований не проводилось, однако вероятнее всего инфекция была занесена с семенами из Германии. К такому же выводу мы пришли и при первом обнаружении болезни в Краснодарском крае на интродуцированном из Германии сорте Циндерелла (Afanasenko et al., 2011). По сообщению сотрудника ЛенНИИСХ Т.Н. Радюкевич семена немецких сортов J.B. Flavour, Posada и Issota были получены из ВИРа в 2014, 2014 и 2018 гг., соответственно.
После выколашивания и появления на верхних листьях симптомов пятнистости гриб начинает продуцировать неспецифические токсины, идентифицированные как рубеллины (рубеллины A, B, C и D). Токсины вызывают оксидативное разрушение клеточных мембран растений и вызывают симптомы болезни. Основное значение в патогенезе имеет рубеллин D, который активируется только на свету и вызывает быстрое усыхание пораженных листьев. (Heiser, Liebermann, 2006). Во влажную погоду с нижней стороны листа появляется белый налет в виде подушечек конидиального спороношения, расположенных горизонтальными строчками. Конидиеносцы выходят из устьиц пучками от 3 до 15 единиц и имеют сильно выраженный изгиб на вершине, на которой образуются до 5 одноклеточных конидий. Наличие изгиба у конидиеносцев, которые по форме напоминают лебединую шею, обусловило название паразита R. collo-cygni (collum – шея, сygnus – лебедь) (Sachs, 2006). При первичном обнаружении в 2011 г. мы легко получили типичное спороношение гриба на зеленых листьях ячменя. На усохших листьях во влажной камере поверхность листа очень быстро покрывалась сапротрофными грибами, в основном таких родов как Alternaria и Bipolaris, при этом наблюдали только единичные пучки конидиеносцев RCC. В качестве иллюстрации приводим фотографию, любезно предоставленную известным экспертом по проблеме рамуляриоза из Шотландского сельскохозяйственного колледжа (Scottish Agricultural College) проф. N. Havis (рис. 10, 11).
Рис. 10.
Конидиальное спороношение Ramularia collo-cygni на нижней поверхности листа ячменя (по: Afanasenko et al., 2011). Фотография предоставлена N. Havis.

Рис. 11.
Конидиеносец и конидия Ramularia collo-cygni (по: Afanasenko et al., 2011). Фотография предоставлена N. Havis.
Известно, что при благоприятных условиях прорастание конидий и проникновение мицелия в устьица происходит в течение 24 ч (Sutton, Waller, 1988). Конидии распространяются воздушным путем и способны инфицировать все части растения. О роли вторичной инфекции в развитии эпифитотий существуют противоречивые мнения. По данным Schutzendubel et al. (2008), воздушное перемещение конидий способствовало развитию эпифитотии рамуляриоза в Германии и являлось основным способом переноса инфекции с озимого ячменя на яровой. Тогда как при использовании споровых ловушек в Англии было показано, что эпифитотия развивалась при отсутствии спорового потока, но при наличии ДНК патогена в растениях. Авторы сделали вывод, что позднее распространение конидий не влияет на развитие эпифитотии (Havis et al., 2014).
Эпифитотийное развитие болезни в Краснодарском крае в 2018 г. свидетельствует о сильной контаминации семян ячменя, которая, по-видимому, происходила в предыдущие годы при массовом распространении конидий.
Известно, что кроме ячменя патоген может поражать другие злаковые, такие как Triticum aestivum L., T. durum Dest, Avena sativa L., Poa pratensis L., Lolium perenne L., Agropyron repens L. Beauv. (Frei, Gindrat, 2000).
Кроме конидиального спороношения, в конце вегетационного сезона на соломе и в лабораторных условиях на автоклавированных стеблях ячменя гриб способен формировать плодовые тела Asteromella (Salamati, Reitan, 2006). Мы обнаружили такие структуры на усохших листьях ячменя. Предполагается, что телеоморфа RCC принадлежит к роду Mycosphaerella (Braun, 2004; Heiser et al., 2004), что было также подтверждено филогенетическим анализом (Kaczmarek et al., 2011). Однако до настоящего времени половая стадия RCC не обнаружена, хотя имеются косвенные доказательства ее существования. На основании анализа изменчивости AFLP-маркеров и микросателлитных локусов в географически отдаленных популяциях RCC был сделан вывод о существовании в жизненном цикле патогена половой стадии, на что указывает очень высокое мультилокусное генотипическое разнообразие (более 96%) в каждой популяции и значения гаметического равновесия (Leisova-Svobodova et al., 2012; Piotrowska et al., 2016).
AFLP-анализ северо- и центральноевропейских популяций показал высокую (86%) внутрипопуляционную изменчивость патогена и отсутствие дифференциации между отдельными популяциями, что свидетельствует о наличии генного потока, обусловленного, по-видимому, семенной инфекцией (Hjortshøj et al., 2013; Leisova-Svobodova et al., 2012).
Патоген легко контролировался фунгицидом Амистар (azoxystrobin). Однако с 2002 года эффективность фунгицида резко снизилась вследствие накопления в популяции патогена мутаций устойчивости в гене цитохрома b (Fountaine, Fraaije, 2009). Были разработаны праймеры, специфичные для области точковой мутации в гене цитохрома b, названной впоследствии G143A. Это дало возможность определять уровень устойчивости популяций R. collo-cygni (% устойчивых изолятов) к фунгицидам стробилуринового ряда strobilurin-based (quinone outside inhibitors – QoI) (Matusinsky et al., 2010).
Приведенные данные свидетельствуют о высоком эволюционном потенциале патогена для преодоления генов устойчивости в сортах ячменя и образования, и накопления в популяциях изолятов, устойчивых к фунгицидам.
Отсутствие сведений о реальном распространении рамуляриоза на территории Российской Федерации связаны, в основном, с трудностями диагностики патогена. Чаще всего при первичном обнаружении болезнь идентифицируют как физиологическую пятнистость. Лаборатория иммунитета растений к болезням ВИЗР при необходимости готова оказать помощь специалистам в диагностике рамуляриоза.
Приносим благодарность за организацию и проведение экспедиционных поездок по Краснодарскому и Ставропольскому краям сотрудникам НЦЗ им. П.П. Лукьяненко, А.Н. Боровику и В.Г. Цвиринько; О.Б. Батаковой за присланный инфекционный материал из Архангельской области, а также Л.М. Бондаревой и Т.Н. Радюкевич за предоставленную возможность обследования коллекционных посевов ячменя ЛенНИИСХ. Благодарим проф. N. Havis из Scottish Agricultural College за предоставленные фотографии.
Список литературы
Afanasenko O.S., Havis N.D., Bespalova L.A., Ablova I.B., Maryenko V.I. Ramularia spot blotch – new barley disease in Russia. Zashchita i karantin rasteniy. 2012. № 1. P. 11 (in Russ.).
Afanasenko O.S., Mironenko N.V., Anisimova A.V., Kovalenko N.M., Baranova O.A., Novozhilov K.V. Novel and potential harmful cereal diseases in Russia. Vestnik zashchity rasteniy. 2011. № 4. P. 3–18 (in Russ.).
Braun U. Ramularia collo-cygni (Ramularia leaf blight of barley): taxonomy and phylogeny. In: Proceedings of the Second International Workshop on Barley Leaf Blights, April 7–11, 2004. Aleppo, 2004. P. 370–375.
Clemente G., Quintana S., Aguirre N., Rosso A., Cordi N., Havis N. State of art of Ramularia collo-cygni (leaf spot of barley) in Argentina and detection and quantification of R. collo-cygni by real-time PCR in barley plantlets and seeds treated with fungicide. In: Proc. 11th Conf. Eur. Found. Plant Pathol. Krakow, 2014.
Cromey M.C., Harvey I.C., Sheridan J.E., Grbavac N. Occurrence, importance and control of Ramularia collo-cygni in New Zeland. In: Proceedings of the Second International Workshop on Barley Leaf Blights, April 7–11, 2004. Aleppo, 2004. P. 337–342.
Djurle A., Rasmussen M. Ramularia leaf spot in barley. A new disease in Sweden? In: Proceedings 1st European Ramularia Workshop. Gottingen, 2006. P. 45.
Fountaine J., Fraaije B.A. Development of QoI resistant alleles in populations of Ramularia collo-cygni. Asp. Appl. Biol. 2009. V. 92. P. 123–126.
Frei P., Gindrat D. Le champignon Ramularia collo-cygni pro-voque une forme de grillures sur les feuilles d’orge d’automne et degraminees adventices. Rev. Suisse Agric. 2000. V. 32. P. 229–233.
Gubis J., Hudcovicova M., Klcova L. First report of Ramularia collo-cygni in Slovakia. J. Plant. Pathol. 2008. V. 90. P. 149.
Havis N.D., Brown J.K.M., Clemente G., Frei P., Jedryczka M., Kaczmarek J., Kaczmarek M., Matusinsky P., McGrann G.R.D., Pereyra S., Piotrowska M., Sghyer H., Tellier A., Hess M. Ramularia collo-cygni – an emerging pathogen of barley crops. Phytopathology. 2015. V. 105. P. 895–904. https://doi.org/10.1094/PHYTO-11-14-0337-FI
Havis N.D., Gorniak K., Carmona M.A., Formento A.N., Luque A.G., Scandiani M.M. First molecular detection of Ramularia leaf spot (Ramularia collo-cygni) in seeds and leaves of barley in Argentina. Plant Dis. 2014a. V. 98. P. 277. https://doi.org/10.1094/PDIS-04-13-0416-PDN.
Havis N.D., Kaczmarek M., Fountaine J.M. Ramularia collo-cygni – a rapidly developing problem. In: Proc. Crop Prot. North. Britain. Dundee, 2014b. P. 95–100.
Havis N.D., Nyman M., Oxley S.J.P. Evidence for seedtransmission and symptomless growth of Ramularia collo-cygni in barley (Hordeum vulgare). Plant Pathol. 2014c. V. 63. P. 929–936. https://doi.org/10.1111/ppa.12162
Havis N.D., Oxley S.J.P., Piper S.R., Langrell S.R.H. Rapid nested PCR-based detection of Ramularia collo-cygni direct from barley. FEMS Microbiol. Lett. 2006. V. 256. P. 217–223. https://doi.org/10.1111/j.1574-6968.2006.00121.x
Havis N.D., Piper S.R., Oxley S.J.P., Langrell S.R.H. Development of a PCR based identification and detection assey for Ramularia collo-cygni direct from barley leaf tissue. In: Proceedings of the Second International Workshop on Barley Leaf Blights, April 7–11, 2004. Aleppo, 2004. P. 343–350.
Heiser I., Hess M., Schmidtke K.-U., Vogler U., Miethbauer S., Liebermann B. Fatty acid peroxidation by rubellin B, C and D, phytotoxins produced by Ramularia collo-cygni (Sutton et Waller). Physiol. Mol. Plant Pathol. 2004. V. 64. P. 135–143.
Heiser I., Liebermann B. Phytotoxins from Ramularia collo-cygni: Mode of action and contribution to pathogenicity. In: Proceedings 1st European Ramularia Workshop. Gottingen, 2006. P. 57–62.
Hjortshøj R.L., Ravnshøj A.R., Nyman M., Orabi J., Backes G., Pinnschmidt H., Havis N., Stougaard J., Stukenbrock E.H. High levels of genetic and genotypic diversity in field populations of the barley pathogen Ramularia collo-cygni. Eur. J. Plant. Pathol. 2013. V. 136. P. 51–60. https://doi.org/10.1007/s10658-012-0137-8.
Huss H., Mayerhofer H., Wetschnig W. Ophiocladium hordei CAV. (Fungi Imperfecti), ein fur Osterreich neuer parasitischer Pilz rer Gerste. Der Pflanzenarzt. 1987. V. 40. P. 167–169. https://www.zobodat.at/pdf/MittNatVerSt_122_0087-0095.pdf.
Kaczmarek M., Fountaine J.M., Havis N.D., Lord K.M., Read N.D. An investigation into possibility of sexual reproduction in the filamentous fungus Ramularia collo-cygni. In: 4th International Workshop on Barley Leaf Blights, June 27–29, 2011. The James Hutton Institute, 2011. B-2b.
Kaczmarek M., Fountaine J.M., Newton A.C., Read N.D., Havis N.D. The life history of Ramularia collo-cygni. In: 27th Fungal Genet. Conference, Asilomar, CA. 2013. Online publication. www.fgsc.net/27thFGC/FungalProgramBook2013.pdf.
Koric B., Tomic Z., Simala M., Milek M. Ramularia leaf spot on barley in the Republic of Croatia. Zbornik predavanj in referatov 9 slovenskega posvetovanja o varstvu rastlin z mednarodno udelezbo. Nov aGorica, Slovenia. 2009.
Leisova-Svobodova L.L. Variability of the Ramularia collo-cygni Population in Central Europe. J. Phytopathology. 2012. V. 160 (11–12). P. 701–709. https://doi.org/10.1111/jph.12017
Matusinsky P., Leisova-Svobodova L., Gubis J., Hudcovicova M., Klcova L., Gubisova M., Marik P., Tvaruzek L., Minarikova V. Impact of the seed-borne stage of Ramularia collo-cygni in barley seed. J. Plant Pathol. 2011. V. 93. P. 679–689. https://doi.org/10.4454/jpp.v93i3.3650
Matusinsky P., Leisova-Svobodova L., Marik P., Tvaruzek L., Stemberkova L., Hanusova M., Minarikova V., Vysohlidova M., Spitzer T. Frequency of a mutant allele of cytochrome b conferring resistance to QoI fungicides in the Czech population of Ramularia collo-cygni. J. Plant Dis. Prot. 2010. V. 117. P. 248–252.
Minarikova V., Marik P., Stemberkova L. Occurence of a New Fungal Pathogen on Barley, Ramularia collo-cygni, in the Czech Republic. Proceedings of the Second International Workshop on Barley Leaf Blights, ICARDA, Aleppo, Syria, April 7–11, 2004. P. 360–364.
Oxley S.J.P., Havis N., Hunter T., Hackett R. Impact of fungisides and varietal resistance on Ramularia collo-cygni in spring barley. In: Proceedings 1st European Ramularia Workshop. Gottingen, 2006. P. 103–112.
Oxley S.J.P., Havis N.D., Sutherland K.G., Nuttall M. Development of a rationale to identify the causal agent of necrotic lesions in spring barley and to identify control mechanisms. HGCA Project Report No 282. HGCA Publications, London, 2002.
Pereyra S. Herramientas disponibles para el manejo de dos enferme-dades relevantes de la pasada zafra: Fusariosis de la espiga en trigo y Ramularia en cebada. Actividades Difusion INIA. 2013. V. 720. P. 33–41.
Pinnschmidt H.O., Hovmøller M.S. Ramularia, a new disease ofbarley – a review of present knowledge. DJF Rapport. 2003. V. 89. P. 313–321.
Pinnschmidt H.O., Sindberg S.A., Willas J. Expression of Ramularia leaf spot resistance in barley cultivars and its relation to resistance against other diseases. In: Proceedings of the Third International Workshop on Barley Leaf Blights, Canada, July. 2006. Tdmonton, 2006. P. 141–145.
Piotrowska M.J., Ennos R.A., Fountaine J.M., Burnetta F.J., Kaczmarek M., Hoebe P.N. Development and use of microsatellite markers to study diversity, reproduction and population genetic structure of the cereal pathogen Ramularia collo-cygni. Fungal Genet. Biol. 2016. V. 87. P. 64–71. https://doi.org/10.1016/j.fgb.2016.01.007.
Reitan L., Salamati S. Field screening in Norway for resistance to Ramularia collo-cygni in old and new barley material. In: Proceedings 1st European Ramularia Workshop. Gottingen, 2006. P. 73–82.
Sachs E. Das Auftreten der Ramularia – Blattfleckenkrankheit an Gerste in Bayern 1999, verursacht durch Ramularia collo-cygni Sutton et Waller. Nachrichtenbl Dt Pflanzenschutzd. 2000. V. 52. P. 160–163.
Sachs E. The history of research into Ramularia leaf spot on barley. In: Proceedings 1st European Ramularia Workshop. Gottingen, 2006. P. 9–15.
Salamati S., Reitan L. Ramularia collo-cygni on spring barley, and overview of its biology and epidemiology. In: Proc. 1st European Ramularia Workshop. Gottingen, 2006. P. 19–35.
Schutzendubel A., Stadler M., Wallner D., Tiedemann A. Ahypothesis on physiological alterations during plant ontogenesis governingsusceptibility of winter barley to Ramularia leaf spot. Plant Pathol. 2008. V. 57. P. 518–526. https://doi.org/10.1111/j.1365-3059.2007.01820.x
Soovali P., Tikhonova M., Matusinsky P. First report of Ramularia leaf spot caused by Ramularia collo-cygni on leaves and seeds of barley in Estonia. Plant Dis. 2014. V. 98. P. 997. https://doi.org/10.1094/PDIS-10-13-1035-PDN.
Sutton B., Waller J. Taxonomy of Ophiocladium hordei causing leaf lesions on Triticale and other Gramineae. Trans. Brit. Micol. Soc. 1988. V. 90. P. 145–155.
Walters D.R., Havis N.D., Oxley J.P. Ramularia collo-cygni: the biology of an emerging pathogen of barley. FEMS Microbiol. Lett. 2008. V. 279. P. 1–7. https://doi.org/10.1111/j.1574-6968.2007.00986.x.
Zamani-Noor N. Studies on Ramularia leaf spots on barley – Resistance phenotyping, epidemiology and pathogenicity. PhD thesis, Georg-August-University, Gottingen, 2011.
Афанасенко О.С., Мироненко Н.В., Анисимова А.В., Коваленко Н.М., Баранова О.А., Новожилов К.В. (Afanasenko et al.) Новые и потенциально опасные болезни зерновых культур в России // Вестник защиты растений. 2011. № 4. С. 3–18.
Афанасенко О.С., Хэвис Н.Д., Беспалова Л.А., Аблова И.Б., Марьенко В.И. (Afanasenko et al.) Рамуляриоз – новая для России болезнь ячменя // Защита и карантин растений. 2012. № 1. С. 11.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология



