Микология и фитопатология, 2019, T. 53, № 4, стр. 229-235
Продукция штаммом Aspergillus ustus протеиназ, высокоактивных в отношении фибриллярных белков
Е. А. Попова 1, *, А. А. Осмоловский 1, **, В. Г. Крейер 1, ***, И. Б. Котова 1, ****, Н. С. Егоров 2, *****
1 Биологический факультет Московского государственного университета им. М.В. Ломоносова
119991 Москва, Россия
2 Международный биотехнологический центр Московского государственного университета им. М.В. Ломоносова
119234 Москва, Россия
* E-mail: veliania@gmail.com
** E-mail: aosmol@mail.ru
*** E-mail: vkreyer@yandex.ru
**** E-mail: kira1959@gmail.com
***** E-mail: nsegorov21@mail.ru
Поступила в редакцию 18.02.2018
После доработки 19.10.2018
Принята к публикации 21.12.2018
Аннотация
Изучено влияние условий культивирования и источников азота в составе среды на образование штаммом Aspergillus ustus 1 протеиназ, высокоактивных в отношении фибриллярных белков. Было показано, что по сравнению с глубинным культивированием, в условиях твердофазного культивирования на вермикулите с ферментационной средой (pH 7.0), содержащей источники как аминного, так и минерального азота, при температуре 28°С штамм A. ustus 1 продуцирует протеиназы, обладающие наибольшей общей протеолитической (1018.95 Eтир/мл), коллагенолитической (242.75 Eазк/мл × 10–3), фибринолитической (254.4 Eтир/мл) и эластинолитической (271.76 EпНА/мл × 10–3) активностью.
ВВЕДЕНИЕ
Мицелиальные грибы рода Aspergillus известны как продуценты широкого спектра протеолитических ферментов, обладающих различной субстратной специфичностью. В их числе можно обнаружить продуцентов протеиназ, высокоактивных в отношении фибриллярных белков (Rhodes et al., 1990; Barthomeuf et al., 1992; Sharkova et al., 2015; Popova et al., 2017; Ferreira et al., 2017; Wanderley et al., 2017). Способность этих грибов к расщеплению коллагена, эластина и фибрина находит широкое применение. Так, в кожевенной и пищевой промышленности активно используют коллагеназы для смягчения кожи и тендерезации мяса. В медицинской практике применяют не только коллагенолитические, но и фибринолитические и эластинолитические протеиназы: с их помощью удаляют некротизированные ткани, кровяные сгустки в открытых ранах и гнойные выделения (Zanoelo et al., 2013).
Наиболее подходящим способом для культивирования мицелиальных грибов и высокоэффективного получения продуцируемых ими ферментов считается твердофазное культивирование (ТФК). Такой способ культивирования наиболее приближен к естественным условиям роста микромицетов (Barrios-González, 2012; Osmolovskiy et al., 2014; Barrios-González, Tarragó-Castellanos, 2015). Для ТФК характерны низкие значения активности воды (0.6–0.8) и использование сыпучих частиц, которые могут быть представлены как натуральными субстратами, так и инертными, иногда синтетическими, носителями. Экспериментальные данные показывают, что при применении твердофазного культивирования выход целевого продукта в несколько раз (от 2 до 20) выше, чем в случае глубинного культивирования того же микроорганизма (Pandey, 2003; Holker et al., 2004).
Среди аспергиллов, активно изучаемых последнее время, был обнаружен штамм Aspergillus ustus 1, способный продуцировать протеиназы, обладающие высокой коллагенолитической и фибринолитической активностью (Osmolovskiy et al., 2016).
Целью данного исследования было изучение влияния условий культивирования и источников азота в составе среды на образование микромицетом A. ustus 1 протеиназ, высокоактивных в отношении фибриллярных белков.
МАТЕРИАЛЫ И МЕТОДЫ
Продуцент и условия культивирования. Объектом исследования служил штамм микромицета A. ustus 1 из коллекции микроорганизмов кафедры микробиологии Московского государственного университета имени М.В. Ломоносова, для которого ранее были показаны высокие значения активности образуемых протеиназ в отношении фибриллярных белков (Osmolovskiy et al., 2016).
Культивирование микромицета осуществляли в глубинных и твердофазных условиях. В качестве посевного материала использовали выращенные на скошенном сусло-агаре 7-суточные культуры микромицета.
Глубинное культивирование проводили в колбах объемом 750 мл со 100 мл питательной среды в шейкере-инкубаторе ЕS-20/60 (BioSan, Латвия) при 200 об./мин и 28°С. Для наращивания биомассы использовали питательную среду, содержащую сусло, глюкозу и пептон (Osmolovskiy et al., 2017). Инокулирование проводили смывом спор культуры данной средой. После 2-х суток культивирования часть биомассы переносили в ферментационную среду № 1 следующего состава (%): глюкоза – 3.0, глицерин – 7.0, гидролизат рыбной муки – 0.5, NaNO3 – 0.2, KH2PO4 – 0.05, MgSO4 – 0.05.
Твердофазное культивирование проводили в культуральных флаконах T-75 (Eppendorf, Германия) в стационарных условиях при 28°С. В качестве субстратов или носителей твердой фазы использовали пенополиуретан (ППУ, размер частиц приблизительно 5 мм2), вермикулит, кокосовые волокна, пшеничные отруби и силикагель. Во флаконах устанавливали определенное соотношение носитель/среда (подобраны ранее). Так, во флаконы с ППУ на 1 г носителя добавляли 8.3 мл ферментационной среды № 1, с вермикулитом – 4.2 мл, с кокосовыми волокнами – 2.5 мл, с пшеничными отрубями – 2.3 мл и с силикагелем – 1.4 мл, соответственно. При культивировании микромицета на пшеничных отрубях дополнительно изучали образование протеиназ без добавления дополнительных питательных веществ, заменяя ферментационную среду дистиллированной водой. Инокулирование осуществляли 1 мл суспензии спор культуры дистиллированной водой с Твин-80. По истечении времени культивирования в культуральные флаконы добавляли 0.05 М Na-ацетатный буфер (рН 5.5), после чего флаконы помещали на орбитальную качалку (200 об./мин) на 30 мин. Во флаконы, содержащие ППУ, вносили 80 мл буфера, с вермикулитом – 20 мл, с кокосовыми волокнами и пшеничными отрубями – по 60 мл буфера, с силикагелем – 15 мл. Элюат отделяли от субстрата или носителя фильтрованием через фильтровальную бумагу (ФС, Россия). В фильтрате проводили определение активности протеиназ.
Определение скорости роста микромицета A. ustus 1. Для определения скорости линейного роста микромицет культивировали на сусло-агаре (3°Б) и агаризованной питательной среде № 1 в чашках Петри при различных температурах (4, 25, 28, 32, 37°С). Скорость роста рассчитывали по формуле: Kr = ΔR/Δt (Panikov, 1991), где R – размер колонии (мм), t – время (сутки).
Засев проводили уколом в трех повторностях, диаметры колоний (мм) измеряли ежедневно в течение 7 суток.
Изучение влияния условий культивирования на образование протеолитических ферментов A. ustus 1. Изучение влияния источников азота на продукцию протеиназ микромицетом A. ustus 1 проводили с использованием 5 вариантов жидкой ферментационной среды № 1, содержащие источники азота в разных формах и концентрациях. В среде № 2 нитрат натрия был заменен на пептон (0.5%), в средах № 3 и № 4 был исключен гидролизат рыбной муки, а источники минерального азота были представлены NaNO3 (0.5%) и NH4NO3 (0.5%), соответственно. В среде № 5 в качестве единственного источника азота использовали пептон (1%).
Влияние температуры культивирования на образование протеолитических ферментов изучали при 24, 28, 30, 32°С, а влияние начального pH среды при 4.0, 5.0, 6.0, 7.0, 8.0, как было описано ранее (Osmolovskiy et al., 2012).
Определение биомассы. Биомассу определяли после фильтрования, с последующим высушиванием до постоянной массы при 86°С. Массу выражали в мг на 1 мл культуральной жидкости.
Определение протеолитической активности. В культуральной жидкости (элюате) определяли общую протеолитическую, коллагенолитическую, фибринолитическую и эластинолитическую активность.
Общую протеолитическую активность определяли модифицированным методом Ансона–Хагихары по количеству тирозина в продуктах протеолиза, не осаждаемых ТХУ, после десятиминутного гидролиза 1%-го р-ра казеина в 0.1 М Na-ацетатном буфере, рН 5.5 и 37°С, как было описано ранее (Osmolovskiy et al., 2016). Активность выражали в мкмолях тирозина/мин (Етир).
Фибринолитическую активность определяли по количеству тирозина в супернатанте после тридцатиминутного гидролиза 1%-й суспензии бычьего фибрина в 0.1 М Na-ацетатном буфере, рН 5.5 и 37°С (Osmolovskiy et al., 2016; Osmolovskiy et al., 2017). Активность выражали в Етир.
Коллагенолитическую активность определяли колориметрически по общепринятой методике с использованием азоколлагена (Chavira et al., 1984; Sharkova et al., 2015). Активность выражали в количестве мкг расщепившегося азоколла за 1 мин (ЕАзк).
Определение эластинолитической активности проводили по расщеплению хромогенного пептидного субстрата эластазы – сукцинил-L-аланил-L-аланил-L-аланил-п-нитроанилида (Suc-Ala-Ala-Ala-pNA) (Bieth, Wermuth, 1973). К 200 мкл пробы добавляли 100 мкл 0.05%-го раствора субстрата и 50 мкл 0.05 М Na-ацетатного буфера, рН 5.5. Инкубацию проводили в течение 5 мин при 37°С. Реакцию останавливали добавлением 200 мкл 50%-й уксусной кислоты. Поглощение определяли спектрофотометрически при длине волны 405 нм. Активности выражали в мкмолях п-нитроанилина в мин (EпНА).
Реакции проводили при постоянном перемешивании в термошейкере TS-100 (BioSan, Латвия). Измерение оптической плотности растворов проводили на спектрофотометре BioSpecrtrometer kinetic, Eppendorf (Германия).
Опыты проводили в трех повторностях. Приведенные результаты представляют собой средние значения, ошибка которых не превышала 5–7%.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
A. ustus Thom et Church (Eurotiales, Ascomycota) – типичный обитатель почв и мелких растительных остатков.
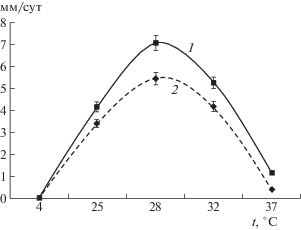
Для штамма A. ustus 1 при поверхностном росте на агаризованных средах характерно образование плоских бархатистых колоний. Они имеют серо-зеленую окраску при росте на сусло-агаре, и более светлую, желто-зеленую при росте на агаризованной ферментационной среде № 1. Обратная сторона колоний при росте на обеих средах была окрашена в желтый цвет. Максимальная линейная скорость роста A. ustus 1 была выявлена при температуре 28°С на агаризованной среде № 1, где она была на 29.1% выше, чем на сусло-агаре (рис. 1). Очевидно, что наличие в среде гидролизатов белков является предпочтительным для поверхностного роста микромицета.
Рис. 1.
Линейная скорость роста Aspergillus ustus 1 на ферментационной агаризованной среде № 1 (1) и на сусло-агаре (2).
Влияние источников азота на образование продуцентом протеолитических ферментов, высокоактивных в отношении фибриллярных белков оценивали по величине коллагенолитической активности на 5-е сутки культивирования. В соответствии с полученными результатами (табл. 1), наибольшее значение удельной коллагенолитической активности (5.38 Eазк/мг × 10–3) было показано при культивировании A. ustus 1 на ферментационной среде № 1, содержащей источники как аминного, так и минерального азота. При росте на средах № 3 и 4, содержащих только источники минерального азота, значения обоих типов активности были близки или активность отсутствовала вовсе вне зависимости от природы содержащегося в среде источника азота. В данном случае можно говорить о проявлении одного из механизмов контроля экспрессии генов ферментов – азотной катаболитной репрессии. Также интересно отметить, что на среде № 3 при небольших значениях активности отмечали максимальное количество биомассы микромицета A. ustus 1 (26.7 мг/мл). При росте на среде № 2, содержащей только аминные формы азота (гидролизат рыбной муки в сочетании с пептоном), удельная коллагенолитическая активность составила 3.65 Eазк /мг × 10–3 и была меньше, чем при росте на среде № 1 в 1.5 раза. Значение же удельной протеолитической активности, напротив, оказалось на 12% выше, чем при росте на среде № 1. Среда № 5, в состав которой в качестве источника азота входил только пептон, также оказалась неэффективной для повышения продуктивности образования протеиназ, высокоактивных в отношении фибриллярных белков (табл. 1). Таким образом, для образования искомых ферментов микромицетом A. ustus 1, наиболее подходящим является сочетание источников аминного и минерального азота в составе ферментационной среды.
Таблица 1.
Влияние источников азота в составе ферментационной среды на образование протеиназ штаммом Aspergillus ustus 1
| Среда № | Источник азота, % | Общая протеолитическая активность, Eтир/мг | Коллагенолитическая активность, Eазк/мг × 10–3 |
|---|---|---|---|
| 1 | гидролизат рыбной муки – 0.5; NaNO3 – 0.2 | 6.48 | 5.38 |
| 2 | гидролизат рыбной муки – 0.5; пептон – 0.5 | 7.35 | 3.65 |
| 3 | NaNO3 – 0.5 | 0.19 | 0 |
| 4 | NH4NO3 – 0.5 | 0.37 | 0 |
| 5 | пептон – 1.0 | 4.54 | 0 |
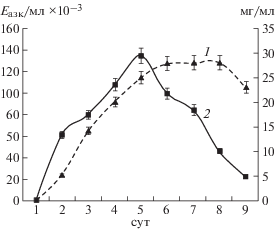
На рис. 2 представлена динамика роста A. ustus 1 и накопления протеиназ, обладающих активностью к фибриллярным белкам, на среде № 1. Максимальное значение коллагенолитической активности наблюдали на 5-е сутки культивирования в конце логарифмической фазы роста продуцента, которое составило 134.86 Eазк/мл × 10–3, а удельная активность – 5.39 Eазк/мг × 10–3.
Результаты изучения влияния температуры и начального pH среды культивирования на образование протеолитических ферментов микромицетом A. ustus 1 представлены на рис. 3 и 4. Определение общей протеолитической, коллагенолитической, фибринолитической и эластинолитической активности проводили на 5-е сутки культивирования микромицета на среде № 1. Максимальные значения коллагенолитической (121.31 Eазк/мл × 10–3), фибринолитической (25.82 Eтир/мл) и общей протеолитической (62.25 Eтир/мл) активности наблюдали при 28°С, однако наибольшая эластинолитическая активность (16.01 EпНА/мл × 10–3) была выявлена при культивировании A. ustus 1 при 24°С. Стоит отметить, что оптимальная температура роста микромицета A. ustus 1 не совпадала с оптимальной температурой для образования протеолитических ферментов.
Рис. 3.
Влияние температуры культивирования на продукцию протеиназ штаммом Aspergillus ustus 1: 1 – казеинолитическая активность, 2 – фибринолитическая активность, 3 – эластинолитическая активность, 4 – коллагенолитическая активность.
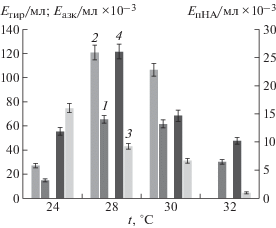
Рис. 4.
Влияние начального значения pH среды на продукцию протеиназ штаммом Aspergillus ustus 1: 1 – казеинолитическая активность, 2 – фибринолитическая активность, 3 – эластинолитическая активность, 4 – коллагенолитическая активность.
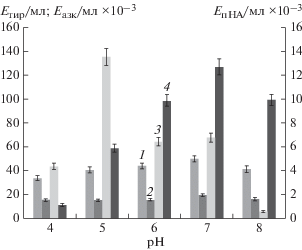
Влияние начального pH ферментационной среды № 1 на секрецию протеиназ A. ustus 1 изучали, определяя протеолитическую активность на 5-е сутки культивирования. Как видно из рис. 4, максимальные значения коллагенолитической (127.3 Eазк/мл × 10–3), общей протеолитической (49.68 Eтир/мл) и фибринолитической активности (19.37 Eтир/мл) были выявлены при росте гриба на ферментационной среде с начальным значением pH 7.0. Так же как и температурный оптимум, pH-оптимум образования эластаз микромицетом A. ustus 1 отличается от оптимума других протеиназ. Так, максимальную эластинолитическую активность наблюдали при pH 5.0 – она составила 13.51 EпНА/мл × 10–3, и оказалась более чем в 2 раза больше, чем значения, полученные при других значениях pH.
Подбор оптимального носителя (субстрата) для культивирования A. ustus 1 в условиях ТФК проводили при наиболее подходящих условиях культивирования: в качестве питательной среды была использована ферментационная среда № 1 с начальным значением pH 7.0, температура культивирования составила 28°С. Были изучены общая протеолитическая, коллагенолитическая, фибринолитическая и эластинолитическая активность A. ustus 1 на 7-е сутки культивирования.
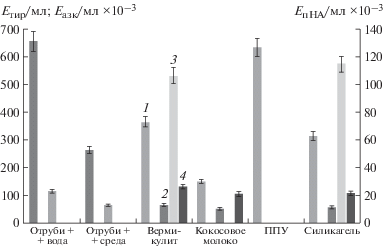
В соответствии с данными, представленными на рис. 5, при культивировании на пшеничных отрубях была выявлена высокая общая протеолитическая и фибринолитическая активность, причем при росте продуцента на отрубях с водой значения активности составили 658.56 и 114.79 Eтир/мл соответственно, что оказалось в 2.5 и в 1.8 раза выше, чем в случае культвивирования микромицета на отрубях с ферментационной средой № 1. Однако коллагенолитическая и эластинолитическая активность в данных условиях выявлены не были. Кокосовые волокна в качестве носителя в системе ТФК с A. ustus 1 оказались неэффективны: протеиназы, образуемые в таких условиях показали низкие значения искомых типов активности по сравнению с другими вариантами (коллагенолитическая активность составила 105.43 Eазк/мл × 10–3, общая протеолитическая – 150.3 Eтир/мл, фибринолитическая – 52.26 Eтир/мл), эластинолитическая активность обнаружена не была. При ТФК на пенополиуретане удалось выявить только общую протеолитическую активность (634.78 Eтир/мл). Максимальные же значения искомых типов активности были выявлены при использовании вермикулита в качестве носителя. Так, при росте на вермикулите, общая протеолитическая активность составила 365.4 Eтир/мл, коллагенолитическая – 130.36 Eазк/мл × 10–3, фибринолитическая – 67.34 Eтир/мл. Максимум эластинолитической активности был показан при росте A. ustus 1 на среде с силикагелем – 114.32 EпНА /мл × 10–3. Однако, поскольку это значение активности менее чем на 10% превышало значение, полученное при ТФК на вермикулите (106.74 EпНА/мл × 10–3) для дальнейшей работы был выбран вермикулит в качестве наиболее подходящего носителя для изучения образования протеиназ, высокоактивных в отношении фибриллярных белков, микромицетом A. ustus 1.
Рис. 5.
Влияние природы субстрата на образование протеиназ штаммом Aspergillus ustus 1 в условиях твердофазного культивирования: 1 – казеинолитическая активность, 2 – фибринолитическая активность, 3 – эластинолитическая активность, 4 – коллагенолитическая активность.
Динамика накопления протеолитических ферментов микромицетом A. ustus 1 в условиях ТФК на ферментационной среде № 1, с использованием вермикулита в качестве носителя представлена на рис. 6. Видно, что общая протеолитическая активность достигала максимума к 3-м суткам культивирования и составляла 1018.95 Eтир/мл, что оказалось в 16.3 раза выше, чем при глубинном культивировании (62.25 Eтир/мл). Максимум коллагенолитической активности (242.75 Eазк/мл × 10–3) был обнаружен на 5-е сутки и его значение превышало таковое для глубинного культивирования (121.31 Eазк/мл × 10–3) в 2 раза. Во время роста микромицета наблюдали два пика образования фибринолитических протеиназ, на 3-и (237.35 Eтир/мл) и на 5-е (254.4 Eтир/мл) сутки культивирования. В первом случае наибольшее значение совпадало по времени с максимумом общей протеолитической активности, во втором – с максимумом проявления коллагенолитической активности. Данные значения активности превышали полученные в условиях глубинного культивирования более, чем в 9 раз. Максимумы эластинолитической активности были выявлены на 4-е (109.2 EпНА/мл × 10–3) и на 9-е (271.76 EпНА/мл × 10–3) сутки культивирования и они оказались от 6.8 до 16.9 раза больше значения, полученного при глубинном культивировании продуцента (16.01 EпНА/мл × 10–3). Стоит отметить, что пик общей протеолитической активности был разделен во времени с пиками коллагенолитической и фибринолитической активности. Такую особенность можно рассматривать как потенциальное технологическое преимущество для направленного получения ферментов, высокоактивных в отношении фибриллярных белков, образуемых A. ustus 1.
Рис. 6.
Динамика накопления протеиназ шатммом Aspergillus ustus 1 в условиях твердофазного культивирования: 1 – казеинолитическая активность, 2 – фибринолитическая активность, 3 – эластинолитическая активность, 4 – коллагенолитическая активность.
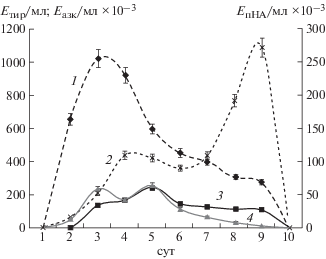
Учитывая все полученные данные, представляются интересными закономерности образования эластаз микромицетом A. ustus 1. Условия, оказавшиеся оптимальными для продукции данного фермента отличаются от таковых, необходимых для образования других протеиназ. Также, в динамике накопления протеолитических ферментов в условиях ТФК можно заметить, что на 9-е сутки, максимальные по эластинолитической активности, другие изученные активности составляют менее 30% от своих максимумов (общая протеолитическая – 26.8%, коллагенолитическая – 10.72%, фибринолитическая – 3.29%). Эти данные позволяют предположить, что A. ustus 1 способен к образованию высокоспецифичной эластазы.
Таким образом, в результате проведенной работы было изучено влияние условий культивирования и источников азота в составе среды на образование микромицетом A. ustus 1 протеиназ, высокоактивных в отношении фибриллярных белков: фибрина, коллагена, эластина. Показано, что для максимально эффективной продукции коллагенолитических протеиназ необходимо наличие источников как аминного, так и минерального азота в составе ферментационной среды. Максимальные значения общей протеолитической, коллагенолитической и фибринолитической активности были получены при начальном значении pH ферментационной среды 7.0 и 28°С. Для образования эластинолитических протеиназ наиболее подходящими условиями являлись pH 5.0 и 24°С. Также было установлено, что максимальная секреция протеиназ, образуемых A. ustus 1, происходит в конце логарифмической фазы роста. Были подобраны наиболее подходящие условия при твердофазном культивирования A. ustus 1: максимальные значения общей протеолитической, коллагенолитической и фибринолитической активности были выявлены при использовании вермикулита в качестве носителя. Была изучена динамика накопления протеолитических ферментов микромицетом A. ustus 1 в условиях ТФК на ферментационной среде № 1 (pH 7.0 и 28°С), с использованием вермикулита в качестве носителя.
Список литературы
Barrios-González J. Solid-state fermentation: physiology of solid medium, its molecular basis and applications. Process Biochem. 2012. V. 47. N2. P. 175–185. https://doi.org/10.1016/j.procbio.2011.11.016
Barrios-González J., Tarragó-Castellanos M.R. Solid-State Fermentation: Special Physiology of Fungi. In: J.M. Merillon, K. Ramawat (eds). Fungal Metabolites. Springer, Cham, 2015, pp. 319–347.
Barthomeuf C., Pourrat H., Pourrat A. Collagenolytic of a new semi-alkaline protease from Aspergillus niger. J. Ferment. Bioeng. 1992. V. 73. N 3. P. 233–236. https://doi.org/10.1016/0922-338X(92)90168-T
Bieth J., Wermuth C.G. The action of elastase on p-nitroanilide substrates. Biochem. Biophys. Res. Commun. 1973. V. 53. N 2. P. 383–390. https://doi.org/10.1016/0006-291X(73)90673-6
Chavira R.Jr., Burnett T.J., Hageman J.N. Assaying proteinases with Azocoll. Anal. Biochem. 1984. V. 136. N 2. P. 446–450. https://doi.org/10.1016/0003-2697(84)90242-2
Ferreira C.M.O., Correia P.C., Brandão-Costa R.M.P., Albuquerque W.W.C., Lin Liu T.P., Campos-Takaki G.M., Porto A.L. Collagenase produced from Aspergillus sp. (UCP 1276) using chicken feather industrial residue. Biomed. Chromatography. 2017. V. 31. N 5. e3882. https://doi.org/10.1002/bmc.3882
Holker U., Hofer M., Lenz J. Biotechnological advantages of laboratory-scale solid-state fermentation with fungi. Appl. Microbiol. Biotechnol. 2004. V. 64. N 2. P. 175–186. https://doi.org/10.1007/s00253-003-1504-3
Osmolovskiy A.A., Baranova N.A., Kreier V.G., Kurakov A.V., Egorov N.S. Solid-state and membrane-surface liquid cultures of micromycetes: specific features of their development and enzyme production. Appl. Biochem. Microbiol. 2014. V. 50. N 3. P. 219–227. https://doi.org/10.1134/S0003683814030107
Osmolovskiy A.A., Kreier V.G., Kurakov A.V., Baranova N.A., Egorov N.S. Aspergillus ochraceus micromycetes – producers of extracellular proteinases – protein C activators of blood plasma. Appl. Biochem. Microbiol. 2012. V. 48. N 5. P. 488–492. https://doi.org/10.1134/S0003683812050109
Osmolovskiy A.A., Popova E.A., Kreyer V.G., Baranova N.A., Egorov N.S. Fibrinolytic and collagenolytic activity of extracellular proteinases of the strains of micromycetes Aspergillus ochraceus L-1 and Aspergillus ustus 1. Mosc. Univ. Biol. Sci. Bull. 2016. V. 71. N 1. P. 62–66. https://doi.org/10.3103/S0096392516010053
Osmolovskiy A.A., Rukavitsyna E.D., Kreier V.G., Baranova N.A., Egorov N.S. Production of proteinases with fibrinolytic and fibrinogenolytic activity by a micromycete Aspergillus ochraceus. Microbiology. 2017. V. 86. N 4. P. 512–516. https://doi.org/10.1134/S0026261717040105
Pandey A. Solid-state fermentation. Biochem. Eng. J. 2003. V. 13. N 2–3. P. 81–84. https://doi.org/10.1016/S1369-703X(02)00121-3
Panikov N.S. Microbial growth kinetics. Moskva, 1991 (in Russ.).
Popova E.A., Bednenko D.M., Osmolovskiy A.A., Kreyer V.G., Kotova I.B., Egorov N.S. Secretion of extracellular proteinases active against fibrillar proteins by micromycetes. Mosc. Univ. Biol. Sci. Bull. 2017. V. 72. N 4. P. 206–210. https://doi.org/10.3103/S0096392517040101
Rhodes J.C., Amlung T.W., Miller M.S. Isolation and characterization of an elastinolytic proteinase from Aspergillus flavus. Infection and Immunity. 1990. V. 58. N 8. P. 2529–2534.
Sharkova T.S., Kurakov A.V., Osmolovskiy A.A., Matveeva E.O., Kreyer V.G., Baranova N.A., Egorov N.S. Screening of producers of proteinases with fibrinolytic and collagenolytic activities among micromycetes. Microbiology. 2015. V. 84. N 3. P. 359‒364. https://doi.org/10.1134/S0026261715030182
Wanderley M.C., Neto J.M., Filho J.L., Lima C.A., Teixeira J.A., Porto A.L. Collagenolytic enzymes produced by fungi: a systematic review. Braz. J. Microbiol. 2017. V. 48. N 1. P. 13–24. https://doi.org/10.1016/j.bjm.2016.08.001
Zanoelo F.F., Giannesi G.C., Cabral H. Proteolytic enzymes: biochemical properties, production and biotecnological application. In: M.L.T.M. Polizeli, M. Rai (eds). Fungal enzymes. Boca Raton: CRC Press, 2013, pp. 94–112.
Паников Н.С. (Panikov) Кинетика роста микроорганизмов. M.: Наука, 1991. 309 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология