Микология и фитопатология, 2020, T. 54, № 1, стр. 23-32
ПОЛУЧЕНИЕ ПЕПТИДНО-АМИНОКИСЛОТНЫХ ИНГРЕДИЕНТОВ НА ОСНОВЕ ГРИБНОЙ БИОМАССЫ ASPERGILLUS ORYZAE
Е. М. Серба 1, *, П. Ю. Таджибов 1, **, Л. В. Римарева 1, ***, М. Б. Оверченко 1, ****, Н. И. Игнатова 1, *****
1 Всероссийский научно-исследовательский институт пищевой биотехнологии –
филиал ФИЦ питания и биотехнологий
111033 Москва, Россия
* E-mail: serbae@mail.ru
** E-mail: polia-nk@yandex.ru
*** E-mail: lrimareva@mail.ru
**** E-mail: mb_over@mail.ru
***** E-mail: ignatova59@list.ru
Поступила в редакцию 30.04.2019
После доработки 11.06.2019
Принята к публикации 25.10.2019
Аннотация
В настоящее время особое внимание уделяется исследованиям в области использования остаточной биомассы грибов рода Aspergillus – продуцентов ферментов, в качестве субстрата для производства пищевых и кормовых ингредиентов. Наиболее перспективным является метод биокаталитической конверсии полимеров мицелиальной биомассы, способствующий повышению доступности биологически ценных компонентов клетки. Цель исследований: разработка условий ферментативной деструкции полисахаридов клеточных стенок и белковых веществ грибной биомассы – вторичного ресурса ферментного производства для получения пептидно-аминокислотных ингредиентов. Установлено, что использование ферментативной системы, включающей внутриклеточные протеиназы и пептидазы и комплекс экзогенных β-глюканаз, а также регуляция длительности их воздействия обеспечивают получение ферментолизатов с заданным структурно-фракционным составом. Исследования молекулярно-массового распределения пептидных фракций в ферментолизатах грибной биомассы показали, что за 6 ч гидролиза доля пептидов с молекулярной массой (ММ) свыше 29.0 кДа снизилась в 2.8 раза, а за 12 ч – в 4.7 раза. При этом содержание низкомолекулярных пептидов с ММ менее 1.6 кДа увеличилось в 1.4 раза, что составило 47.9% от общего количества. Сравнительный анализ спектров пептидов с ММ менее 1000 Да в ферментолизатах грибной биомассы после 6 ч и 12 ч гидролиза показал существенные различия в их составе. С увеличением длительности гидролиза содержание пептидов с ММ менее 500 Да и аминокислот в свободной форме повысилось в 1.6 раза. Результаты исследований подтверждают перспективность создания функциональных ингредиентов и биологически активных добавок, обогащенных пептидно-аминокислотной составляющей с преобладающим содержанием свободных аминокислот и коротких биоактивных пептидов, на основе ферментолизатов грибной биомассы.
ВВЕДЕНИЕ
В последнее время отмечается тенденция повышения пищевой и биологической ценности продуктов питания и кормов путем введения в их состав биологически активных добавок (БАД) – натуральных источников макро- и микронутриентов (Tutelyan, 2008; Ryazanova, Pirogova, 2011; Gammel et al., 2017). Перспективным субстратом для получения биологически значимых ингредиентов можно рассматривать микробную биомассу, содержащую белок, аминокислотный скор которого приближается к животному белку, а также ценные полисахариды (Feofilova, 2010; Serba et al., 2017). Для эффективного ее использования применяют биокаталитические технологии, обеспечивающие повышение степени биодоступности внутриклеточных компонентов, особенно белковых веществ, для действия пищеварительных ферментов (Rimareva et al., 2017; Sereda et al., 2018).
Известно, что ферментативный гидролиз пептидных связей является одним из важнейших регуляторных факторов во многих биохимических процессах жизнедеятельности живых организмов. Высокая биологическая значимость протеолиза – причина эволюционного происхождения множественных видов протеолитических ферментов с различной специфичностью и механизмом действия (Lysenko et al., 2011). Протеазы являются важным инструментом как в осуществлении биологических процессов в живых организмах, так и в биотехнологических процессах направленного получения пептидно-аминокислотных добавок для коррекции продуктов питания и кормов (Rawlings et al., 2010; Lysenko et al., 2011; Rimareva et al., 2017). В процессе глубокой биокаталитической деструкции белковой молекулы образуются свободные аминокислоты и низкомолекулярные пептиды, которые, высвобождаясь из полимерной структуры, приобретают биологическую активность и становятся самостоятельными регуляторными факторами с определенными функциональными свойствами (Orlova et al., 2012).
В настоящее время исследовано много биологически активных пептидов, которые были выделены из белков, содержащихся в пищевом сырье. Спектр их биологических функций весьма широк и разнообразен: одни воздействуют на иммунные процессы организма, некоторые связаны с деятельностью центральной нервной системы, обладают антигипертонической активностью, другие оказывают регуляторное влияние на функции пищеварительной системы, проявляют пребиотическое действие и т.д. (Jeong et al., 2003; Razumnikova et al., 2011; Skat, 2017). Известно, что регуляторные пептиды в основном являются низкомолекулярными и содержат от 2 до 20 аминокислотных остатков. Биоактивные пептиды с молекулярной массой менее 5 кДа обнаружены в ферментолизатах из животного, растительного и микробного сырья (Jeong et al., 2003; Prosekov, 2010; Kulikova, 2015; Serba et al., 2017).
Рядом исследователей показано, что в результате ферментативного гидролиза белков, содержащихся в дрожжах Saccharomyces cerevisiae, образуются биоактивные пептиды, проявляющие антиоксидантные и антиканцерогенные свойства (Orlova, Rimareva, 2007; Orlova et al., 2012). В отличие от сырья животного и растительного происхождения, биокаталитическая деструкция полимеров микробной биомассы существенно затруднена в связи с наличием в ней клеточной оболочки, основной структурной составляющей которой являются β-глюканы (Feofilova et al., 2006; New et al., 2008; Klishanets et al., 2016). Поэтому для повышения доступности внутриклеточных структур в состав ферментного комплекса должны входить ферменты, катализирующие гидролиз полисахаридов клеточных стенок микроорганизмов (Sereda et al., 2018).
В последнее время все больше внимания уделяется работам по изучению возможности использования остаточной биомассы грибов рода Aspergillus – продуцентов ферментов и органических кислот не как отхода производства, а как перспективного источника белка, аминополисахаридов и биологически активных веществ (Brar et al., 2014; Novinyuk et al., 2016; Abdel-Gawad et al., 2017). Ранее было показано, что при глубинном культивировании гриба Aspergillus oryzae количество синтезируемой биомассы составляет 30–40% от общего объема культуральной жидкости (Rimareva et al., 2018а, 2018b). При этом было установлено, что на долю адсорбируемых на биомассе и клеточно-связанных гидролаз к концу ферментации приходится до 30% от общего показателя синтезируемых ферментов, секретирующих продуцентом в культуральную жидкость. В то же время биомасса мицелиальных грибов по сравнению с дрожжевой содержит в 1.5 раза больше полисахаридов и сложный хитино-глюкановый комплекс, который необходимо разрушить и получить доступ к белковой составляющей клетки.
Цель настоящей работы состояла в разработке условий ферментативной деструкции полисахаридов клеточных стенок и белковых веществ мицелиальной биомассы гриба Aspergillus oryzae – вторичного ресурса ферментного производства, для получения пептидно-аминокислотных ингредиентов.
МАТЕРИАЛЫ И МЕТОДЫ
Работа выполнялась на базе ВНИИПБТ – филиала ФГБУН “ФИЦ питания и биотехнологии” в отделе биотехнологии ферментных препаратов, дрожжей, органических кислот и БАД.
Объектом исследований служила биомасса мицелиального гриба A. oryzae RCAM 11034 – продуцента протеолитических ферментов. В работе использовали ферментный препарат (ФП) Глюканофоетидин – источник экзо- и эндо- β-глюканазы, хитиназы, маннаназы и протеазы (Kurbatova et al., 2017). Уровень активности гидролитических ферментов в биомассе гриба и в ФП Глюканофоетидин анализировали по стандартным методикам (Serba et al., 2013).
Биомасса получена в результате глубинного культивирования A. oryzae на питательной среде, в состав которой входила ячменная мука – 4.0%, отруби пшеничные – 1.0% и КН2РО4 – 1.5%. Культивирование проводили в лабораторном ферментере RALF Plus (Bioengineering, Швейцария) при коэффициенте заполнения, равном 0.6; скорости вращения мешалки 200–220 об./мин. Условия культивирования гриба: температура – 30°С, расход воздуха – 0.5–1.0 м3/м3/мин; длительность – 48 ч. По окончании ферментации биомассу отделяли на центрифуге ОС-6М при 5000 об./мин в течение 10 мин.
Процесс биокаталитической конверсии внутриклеточных полимеров A. oryzae осуществляли в стационарных условиях в конической колбе объемом 0.5 дм3, в которую помещали 100.0 г полученной мицелиальной биомассы (содержание сухих веществ 10%, рН 5.5) и вводили дополнительный источник β-глюканазы – ФП Глюканофоетидин, при периодическом перемешивании. Ферментолиз проводили в термостате ТС 180 СПУ при температуре 50°С, при необходимости температуру снижали до 30°С. Процесс гидролиза белковых веществ и полисахаридов тестировали по степени накопления аминного азота и редуцирующих веществ в ферментолизатах биомассы (GPA; Polyakov et al., 2007).
Спектральный анализ состава низкомолекулярных пептидов определяли методом ВЭЖХ на квадрупольной масс-спектрометрической системе Agilent 6120 (Artemenko et al., 2006). Содержание аминокислот в микробной биомассе и ферментолизатах определяли на хроматографе Knauer Eurochrom 2000 с последующим детектированием компонентов спектрофотометрическим детектором Smartline UV Detector 2500 (Германия) при λ = 570 нм. Просчет аминограмм осуществляли методом сравнения площадей стандарта и образца (Roslyakov et al., 1984).
Молекулярно-массовое распределение пептидов в ферментолизатах оценивали методом эксклюзионной жидкостной хроматографии высокого давления (Zorin, Bayarzhargal, 2009) на колонке Супероза 12, 1.0 × 30 см (производства Serva, Германия), предварительно откалиброванной по стандартным глобулярным водорастворимым белкам. В качестве элюента использовали 0.2 М хлористый натрий при скорости элюирования 0.4 см3/мин и длине световой волны 280 нм. Аналитический сигнал регистрировали проточным УФ-детектором УФ132, соединенным с рабочей станцией специализированным интерфейсом. Для обработки результатов измерений использовали программу “Мультихром 3.1”. Хроматограммы интегрировались весовым методом в диапазоне молекулярных масс от свободного до полного объема хроматографической колонки.
Статистическую обработку данных, полученных не менее, чем в 3-х повторностях, осуществляли с помощью программы Microsoft Excel с использованием коэффициента Стьюдента (доверительный интервал 0.95).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты исследования биомассы A. oryzae показали, что в ней содержались внутриклеточные ферменты различного спектра действия. В пересчете на сухие вещества (СВ) грибной биомассы уровень активности ферментов протеолитического действия составил 37.0 ед. протеазной способности (ПС)/г, β-глюканолитического – 12.0 ед. β-глюканазной способности (β-ГкС)/г, хитинолитического – 0.2 ед. хитиназной способности (ХС)/г, маннанолитического – 1.0 ед. маннаназной способности (МС)/г (табл. 1). Остаточная протеолитическая активность в грибной биомассе была достаточно высокая и составляла около 25% от общего уровня активности протеаз в культуральной жидкости. Однако для эффективной конверсии полисахаридов клеточных стенок уровня β-глюканазной активности недостаточно, поэтому требовалось внесение дополнительного количества экзогенных гидролаз.
Таблица 1.
Ферментативная активность биомассы гриба Aspergillus oryzae и ФП Глюканофоетидина
| Ферментативная активность | Объект | |
|---|---|---|
| Биомасса A. oryzae, ед./г сухого вещества биомассы | Глюкано-фоетидин, ед./г | |
| протеолитическая, ед. ПС/г | 37.0 | 10.2 |
| β-глюканазная, ед. β-ГкС/г | 12.0 | 161.1 |
| хитиназная, ед. ХС/г | 0.2 | 3.6 |
| маннаназная, ед. МС/г | 1.0 | 7.3 |
На первом этапе для гидролиза полисахаридов клеточных стенок гриба в биомассу добавляли ФП Глюканофоетидин – как дополнительный источник β-глюканазы из расчета от 20 до 100 ед. β-ГкС/ 1 г биомассы (табл. 1). Совместно с β-глюканазой дозировались ферменты, присутствующие в глюканофоетидине: протеазы (1.2–6.1 ед. ПС/г СВ биомассы), хитиназа (0.4–2.2 ед. ХС/г) и маннаназа (0.9–4.4 ед. МС/г). Процесс деструкции полимеров грибной биомассы продолжали в течение 18 ч при температуре 50°С.
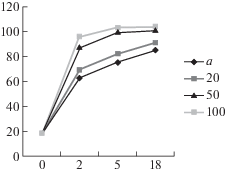
Как видно из приведенных на рис. 1 и 2 данных, дозировка β-глюканазы, равная 50 ед. β-ГкС/г СВ биомассы, обеспечивала основную деструкцию полимеров клеточных стенок гриба за 5 ч с образованием в ферментолизате 0.77% редуцирующих веществ (РВ) и 103 мг% аминного азота (${\text{NH}}_{2}^{ + }$). При этом концентрация РВ увеличилась в 2.6 раза, а ${\text{NH}}_{2}^{ + }$ – в 5.7 раза по сравнению с исходным уровнем. Дальнейшее увеличение дозировки β-глюканазы не приводило к значительному повышению глубины гидролиза белково-полисахаридных полимеров (рис. 1, 2).
Рис. 1.
Влияние дозировки β-глюканазы (а – автолиз, 20 единиц, 50 единиц, 100 единиц) на образование редуцирующих веществ (%) в зависимости от длительности ферментолиза (ч) грибной биомассы.
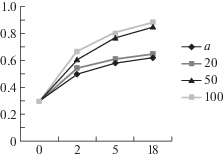
Рис. 2.
Влияние дозировки β-глюканазы (а – автолиз, 20 единиц, 50 единиц, 100 единиц) на содержание аминного азота (%) в зависимости от длительности ферментолиза (ч) грибной биомассы.
Таким образом, для разрушения полимеров клеточной оболочки гриба и обеспечения доступа протеаз к белковым веществам выбрана дозировка 50 ед. β-ГкС/г биомассы, которую использовали в дальнейшем.
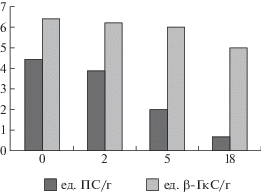
Результаты исследований уровня остаточной активности ферментов в процессе ферментолиза грибной биомассы показали, что за первые 2 ч гидролиза при 50°С существенных изменений не наблюдалось. Через 5 ч уровень протеолитической активности снизился более, чем в 2 раза, а уровень β-глюканазной активности остался практически без изменений (рис. 3). Поэтому в дальнейшем температуру гидролиза понижали.
Рис. 3.
Уровень остаточной активности протеаз (ед. ПС/г) и β-глюканаз (ед. β-ГкС/г) в ферментолизатах биомассы гриба Aspergillus oryzae в зависимости от длительности гидролиза (ч).
С использованием установленной дозировки экзогенной β-глюканазы (50 ед. β-ГкС/г) и внутриклеточных протеаз (37 ед. ПС/г) осуществлена биокаталитическая конверсия полимеров грибной биомассы (табл. 1). Процесс гидролиза проводили в два этапа: первые 2 ч при температуре 50°С происходило автолитическое расщепление полимеров (автолиз), затем температуру снижали до 30°С и добавляли ФП Глюканофоетидин. Наиболее интенсивное образование продуктов гидролиза белков и полисахаридов отмечено через 6 ч: концентрация растворимых РВ увеличилась в 2.6 раза, ${\text{NH}}_{2}^{ + }$ – в 7.3 раза (рис. 4).
Рис. 4.
Содержание редуцирующих веществ (РВ, %) и аминного азота (NH, %) в ферментолизатах биомассы гриба Aspergillus oryzae в зависимости от длительности гидролиза в ч.
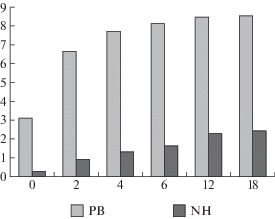
Практически к 12 ч процесс деструкции полимеров заканчивался. При этом концентрация РВ к 12 ч увеличилась незначительно (в 2.7 раза). Более существенно повысилась степень гидролиза белковых веществ: содержание ${\text{NH}}_{2}^{ + }$ увеличивалось в 10.5 раза (с 0.22 до 2.3%). К 18 ч показатели ферментолизата биомассы гриба изменились несущественно (рис. 4).
В результате действия собственной ферментной системы гриба A. oryzae и экзогенных ферментов получены ферментолизаты грибной биомассы с различной степенью деструкции внутриклеточных полимеров: ферментолизат-1 (автолиз – 2 ч, 50°С), ферментолизат-2 (2 ч, 50°С и 4 ч, 30°С) и ферментолизат-3 (2 ч, 50°С и 10 ч, 30°С).
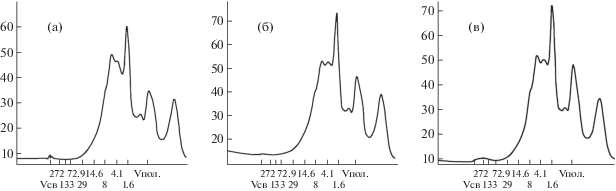
Исследовали изменение молекулярно-массового распределения пептидных фракций в ферментолизатах после 2 ч гидролиза при температуре 50°С (а); 6 ч (б) и 12 ч (в) при 30°С (рис. 5). Молекулярная масса (ММ) пептидов, содержащихся в ферментолизатах, представлена в широком диапазоне от 272 кДа до 1.6 кДа и ниже. Результаты исследований подтвердили эффективность деструктивных процессов, приводящих к образованию пептидов с более низкой молекулярной массой. В ферментолизате-3 после 12 ч гидролиза отмечено наиболее высокое содержание пептидов с ММ менее 1.6 кДа (рис. 5).
Рис. 5.
Молекулярно-массовое распределение (кД) продуктов конверсии белковых полимеров биомассы гриба Aspergillus oryzae в ферментолизатах после 2 ч при 50°С (а); 6 ч (б) и 12 ч (в) при 30°С.
Результаты расчета показали, что в ферментолизате-1, полученном после 2 ч гидролиза, содержание высокомолекулярных белков с ММ от 272.0 до 14.6 кДа составило 6.3% от общего количества белковых веществ; на долю пептидов с ММ от 14.6 до 4.1 кДа приходилось 32.5%; пептидов с ММ от 4.1 до 1.6 кДа – 28.0%. 33.2% составили пептиды с ММ менее 1.6 кДа (рис. 6).
Рис. 6.
Изменение молекулярной массы пептидов в процессе ферментативной деструкции (время гидролиза 2, 6, 12 ч) белков грибной биомассы (%).
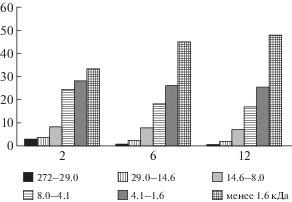
В процессе гидролиза белковых полимеров содержание высокомолекулярных пептидов существенно снижалось. Так, за 6 ч гидролиза доля пептидов с ММ свыше 29.0 кДа снизилась в 2.8 раза, а за 12 ч – в 4.7 раза. При этом содержание низкомолекулярных пептидов с ММ менее 1.6 кДа в процессе деструкции белковых полимеров грибной клетки возрастало и к концу ферментолиза увеличилось в 1.4 раза, что составило 47.9% от общего количества (рис. 6). Таким образом, в составе пептидных фракций ферментолизата-3 после 12 ч гидролиза на долю низкомолекулярных пептидов (НМП) с ММ менее 4.1 кДа приходилось 73.4%, а в ферментолизате-2 – 71.0%.
Как показали результаты анализа молекулярно-массового распределения продуктов конверсии белковых полимеров, ферментолизаты, полученные под действием внутриклеточных и экзогенных ферментов в течение 6 и 12 ч гидролиза, несущественно различались по составу пептидов, особенно с ММ от 29.0 до 1.6 кДа. Однако, проведенные сравнительные исследования спектрального состава НМП и содержания аминокислот (АК) в свободной форме позволили выявить существенные различия этих ферментолизатов.
Анализ спектров пептидов с ММ менее 1000 Да в ферментолизатах грибной биомассы после 6 ч (а) и 12 ч (б) гидролиза и результаты расчета показали, что с увеличением длительности воздействия ферментов повышалась глубина гидролиза белковых веществ (рис. 7). В 12-часовом ферментолизате количество пептидов с ММ менее 500 Да составило 89% от общего количества НМП, а количество пептидов с ММ от 500 до 1000 Да было в 3.9 раза ниже, чем в 6-часовом ферментолизате (рис. 7, табл. 2).
Рис. 7.
Спектральный анализ низкомолекулярных пептидов с молекулярной массой менее 1000 Да в ферментолизатах грибной биомассы после 5 (а) и 12 (б) ч гидролиза.
Таблица 2.
Фракционный состав низкомолекулярных пептидов и содержание свободных аминокислот в ферментолизатах грибной биомассы
| Время гидролиза, ч | Содержание пептидов, % от общего количества НМП | Свободные аминокислоты, % от общего количества АК | |
|---|---|---|---|
| 500–1000 Да | менее 500 Да | ||
| 6 | 43 | 57 | 23.5 |
| 12 | 11 | 89 | 39.5 |
Полученные экспериментальные данные по составу и количеству аминокислот в свободной форме, образовавшихся в процессе ферментативного гидролиза, подтвердили результаты спектрального анализа НМП (табл. 2, 3).
Таблица 3.
Содержание аминокислот (АК) в ферментолизатах биомассы гриба Aspergillus oryzae
| Аминокислота (АК) | Содержание АК в ферментолизатах, мг/см3 | ||
|---|---|---|---|
| Общих АК | Свободных АК | ||
| 6 ч | 12 ч | ||
| триптофан | 30.51 | 6.83 | 11.54 |
| глутаминовая кислота | 25.40 | 6.54 | 11.04 |
| лейцин | 22.85 | 5.13 | 8.67 |
| аспарагиновая кислота | 20.02 | 3.31 | 5.61 |
| лизин | 12.91 | 3.14 | 5.30 |
| серин | 10.90 | 3.05 | 5.15 |
| аланин | 10.95 | 2.91 | 4.79 |
| валин | 12.02 | 2.67 | 4.11 |
| фенилаланин | 8.40 | 2.20 | 3.69 |
| глицин | 10.01 | 2.17 | 3.66 |
| треонин | 8.45 | 2.16 | 3.64 |
| изолейцин | 6.49 | 1.82 | 3.08 |
| аргинин | 5.03 | 1.45 | 2.44 |
| тирозин | 6.00 | 1.40 | 2.37 |
| гистидин | 5.39 | 1.32 | 2.22 |
| метионин | 6.31 | 1.34 | 2.17 |
| Общее количество АК, мг/г | 201.64 | 47.44 | 79.48 |
| % от общего количества АК | 100.0 | 23.5 | 39.4 |
| Незаменимые АК, мг/г | 112.97 | 24.33 | 42.2 |
| % от общего количества АК | 56.0 | 51.3 | 53.1 |
Содержание свободных АК в ферментолизате после 12 ч гидролиза в 1.7 раза превысило показатели после 6-ти ч гидролиза и составило 39.4% от общего количества идентифицированных АК в биомассе, из них порядка 53% составили незаменимые аминокислоты.
ЗАКЛЮЧЕНИЕ
Проведенные исследования позволили разработать условия регулируемого процесса ферментативной деструкции полимеров остаточной биомассы гриба A. oryzae – вторичного сырья ферментного производства. Установлено, что использование ферментативной системы, включающей внутриклеточные протеиназы и пептидазы, катализирующие глубокое разрушение белковых веществ, и комплекс экзогенных ферментов для гидролиза полисахаридов, а также регуляция длительности их воздействия обеспечивают получение ферментолизатов с заданным структурно-фракционным составом.
В результате направленной биокаталитической конверсии белковых веществ микромицета получены пептидно-аминокислотные ингредиенты с превалирующим содержанием низкомолекулярных пептидов и свободных аминокислот. Установлено, что в составе пептидных фракций ферментолизата после 12 ч инкубации 73.4% приходилось на долю НМП с ММ менее 4.1 кДа, из них около 40% составляли свободные аминокислоты. Сравнительный анализ спектров пептидов с ММ менее 1000 Да в ферментолизатах грибной биомассы после 6 и 12 ч гидролиза показал существенные различия в их составе. С увеличением длительности гидролиза содержание пептидов с ММ менее 500 Да и аминокислот в свободной форме повысилось в 1.6 раза, а количество пептидов от 500 до 1000 Да сократилось в 3.9 раза.
Результаты теоретических и экспериментальных исследований подтверждают перспективность создания функциональных ингредиентов и биологически активных добавок, обогащенных пептидно-аминокислотной составляющей с преобладающим содержанием свободных аминокислот и коротких биоактивных пептидов на основе ферментолизатов микробной биомассы.
Исследования проведены за счет средств субсидии на выполнение государственного задания в рамках Программы фундаментальных научных исследований государственных академий наук (тема № 0529-2019-0066).
Список литературы
Abdel-Gawad K.M., Hifney A.F., Fawzy M.A., Gomaa M. Technology optimization of chitosan production from Aspergillus niger biomass and its functional activities. Food Hydrocolloids. 2017. V. 63. P. 593–601. https://doi.org/10.1016/j.foodhyd.2016.10.001
Artemenko K.A., Samgina T.Yu., Lebedev A.T. Mass spectrometry de novo sequencing of peptides. Mass-spektrometriya. 2006. V. 3. P. 225–255 (in Russ.).
Brar S.K., Dhillon G.S., Sjccjl C.R. Biotransformation of waste biomass into high value Biochemicals. Springer, 2014. P. 504. https://elibrary.ru/item.asp?id=24457108.
Feofilova E.P. The cell wall of fungi: modern understanding of the composition and biological function. Mikrobiologiya. 2010. V. 79. (6). P. 723–733 (in Russ.).
Feofilova E.P., Nemtsev D.V., Tershina V.M., Memorskaya A.S. Composition and content of chitin-glucan complex in ontogenesis of the fungus Aspergillus niger. Prikladnaya biokhimiya i mikrobiologiya. 2006. V. 42. (6). P. 624–629 (in Russ.).
Gammel I.V., Suvorova O.V., Zaporozhskaya L.I. Analysis of trends in the Russian market of dietary supplements. Meditsinskiy almanakh. 2017. V. 6 (51). P. 156–157 (in Russ.).
GPA.1.2.3.0022.15 (General pharmacopoeia article). Determination of amino nitrogen by the formol and iodometric titration methods (in Russ.).
Jeong H.J., Park J.H., Lam Y., Lumen B.O. Characterization of lunasin isolated from soybean. J. Agric. Food Chem. 2003. V. 51. P. 7901–7906 https://doi.org/10.1021/jf034460y
Klishanets E., Lugin V., Litvyak V., Trotskaya T. The Chitin-glucan complex: preparation and properties. Nauka i innovatsii. 2016. V. 9 (163). P. 62–67 (in Russ.).
Kulikova O.G., Maltsev D.I., Ilyina A.P., Burdina A.V., Yamskova V.P., Yamskov I.A. Biologically active peptides isolated from dill Anethum graveolens L. Applied Biochemistry and Microbiology. 2015. V. 51. N 3. P. 348–366. https://doi.org/10.1134/S0003683815030114
Kurbatova E.I., Sokolova E.N., Borshcheva Yu.A., Davydkina V.E., Rimareva L.V., Polyakov V.A., Pogorzhelskaya N.S. Micromycete Aspergillus foetidus-producing complex of hydrolytic enzymes. Mikologiya i fitopatologiya. 2017. V. 51 (1). P. 34–40 (in Russ.).
Lysenko L.A., Nemova N.N., Kantserova N.P. Proteolytic regulation of biological processes. Petrozavodsk, 2011 (in Russ.).
New N., Stevens W.F., Tokura S., Tamura H. Characterization of chitosan-glucan complex extracted from the cell wall of fungus Gongronella butleri USDB 0201 by an enzymatic method. Enzyme and Microbial Technology. 2008. V. 42. P. 242–251. https://doi.org/10.1016/j.enzmictec.2007.10.001
Novinyuk L.V., Kulev D.X., Velinzon P.Z., Sharova N.Yu. Isolation of chitin- and chitosanglucan biopolymers from mycelial wastes of citric acid production. Pishchevaya promyshlennost. 2016. V. 11. P. 30–31 (in Russ.).
Orlova E.V., Rimareva L.V. The study of the antioxidant properties of the drug, obtained on the basis of controlled enzymatic hydrolysis of the biomass of the yeast Saccharomyces cerevisiae. Khranenie i pererabotka selkhozsyrya. 2007. V. 11. P. 63–64 (in Russ.).
Orlova E.V., Rimareva L.V., Overchenko M.B., Orlova V.S., Serba E.M. Influence of Saccharomyces cerevisiae yeast enzymes on the cell cycle and apoptosis of transplantable tumor cells. Biozashchita i biobezopasnost. 2012. V. 4. V. 3 (12). P. 48–51 (in Russ.).
Polyakov V.A., Abramova I.M., Polygalin G.V., Rimareva L.V., Korchagina G.T., Piskareva E.N. Instructions for techno-chemical and microbiological control of alcohol production. DeLiprint, Moscow, 2007 (in Russ.).
Prosekov A.Yu. Features of obtaining biologically active peptides from whey proteins. Pererabotka moloka. 2010. V. 5 (127). P. 12–13 (in Russ.).
Rawlings N.D., Barrett A.J., Bateman A. MEROPS: the peptidase database. Nucleic Acids Res. 2010. V. 38. P. 227–233. https://doi.org/10.1093/nar/gkp971
Razumnikova I.S., Babich O.O., Prosekov A.Yu., Kurbanova M.G. Biologically active peptide derived from milk protein. RF Patent. 2011. N 2415943.
Rimareva L.V., Serba E.M., Sokolova E.N., Borscheva Yu.A., Ignatova N.I. Enzyme preparations and biocatalytic processes in the food industry. Voprosy pitaniya. 2017. V. 86 (5). P. 63–74 (in Russ.).
Rimareva L.V., Serba E.M., Overchenko M.B., Ignatova N.I., Krivova A.Yu., Kurbatova E.I., Sokolova E.N. Multipurpose use of the fungus Aspergillus oryzae – producer of the complex of hydrolases for the food industry. Vestnik rossiyskoy selskokhozyaystvennoy nauki. 2018. V. 5. P. 29–33 (in Russ.).https://doi.org/10.30850/vrsn/2018/5/29-33
Rimareva L.V., Krivova A.Yu., Serba E.M., Overchenko M.B., Ignatova N.I., Pogorzhelskaya N.S., Borshcheva Yu.A., Mochalina P.Yu. Biological preparations based on microbial biomass enriched with valuable polysaccharides and essential amino acids. Izvestiya Ufimskogo nauchnogo tsentra RAN. 2018. V. 3 (3). P. 28–33 (in Russ.).
Roslyakov V.Ya., Tarasenko I.S., Balabanov N.P., Vasilyev P.S. Determining the number of amino acids and peptides in parenteral nutrition preparations based on protein hydrolysis. Gematologiya i transfuziologiya. 1984. V. 3. P. 50–52 (in Russ.).
Ryazanova O.A., Pirogova O.O. The use of biologically active food additives in the correction of nutrition of the population. Pishchevaya promyshlennost. 2011. V. 2. P. 8–10 (in Russ.).
Serba E.M., Overchenko M.B., Ignatova N.I., Sokolova E.N., Kurbatova E.I. Development of national standards for methods for determining the activity of enzyme preparations for the food industry. Pishchevaya promyshlennost. 2013. V. 7. P. 40–44 (in Russ.).
Serba E.M., Rimareva L.V., Kurbatova E.I., Volkova G.S., Polyakov V.A., Varlamov V.P. The study of the process of enzymatic hydrolysis of yeast biomass to create food ingredients with fractional composition of proteins. Voprosy pitaniya. 2017. V. 86 (2). P. 76–83 (in Russ.).
Sereda A.S., Velikoretskaya I.A., Osipov D.O., Matys V.Yu., Bubnova T.V., Nemashkalov V.A., Sinitsyna O.A., Rozhkova A.M., Tsurikova N.V., Sinitsyn A.P. Enzyme complexes for the destruction of the cell wall of filamentous fungi – producers of industrial enzymes. Izvestiya Ufimskogo nauchnogo tsentra RAN. 2018. V. 3 (2). P. 31–35 (in Russ.).
Skat R. Bioactive peptides and probiotics for functional meat products. Myasnye tekhnologii. 2017. V. 2. P. 42–45 (in Russ.).
Tutelyan V.A. Biologically active food supplements: modern approaches to ensuring quality and safety. Voprosy pitaniya. 2008. V. 3. P. 4–15 (in Russ.).
Zorin S.N., Bayarzhargal M. Obtaining enzymatic hydrolysates of food proteins using some commercial enzyme preparations and various schemes for hydrolysis. Biomeditsinskaya khimiya. 2009. V. 55 (1). P. 73–80 (in Russ.).
Артеменко К.А., Самгина Т.Ю., Лебедев А.Т. (Artemenko et al.) Масс-спектрометрическое de novo секвенирование пептидов // Масс-спектрометрия. 2006. № 3. С. 225–255.
Гаммель И.В., Суворова О.В., Запорожская Л.И. (Gammel et al.) Анализ тенденций российского рынка биологически активных добавок // Медицинский альманах. 2017. № 6 (51). С. 156–157.
Зорин С.Н., Баяржаргал М. (Zorin, Bayarzhargal) Получение ферментативных гидролизатов пищевых белков с использованием некоторых коммерческих ферментных препаратов и различных схем проведения гидролиза // Биомедицинская химия. 2009. Т. 55. № 1. С. 73–80.
Клишанец Е., Лугин В., Литвяк В., Троцкая Т. (Klishanets et al.) Хитин-глюкановый комплекс: получение и свойства // Наука и инновации. 2016. № 9 (163). С. 62–67.
Курбатова Е.И., Соколова Е.Н., Борщева Ю.А., Давыдкина В.Е., Римарева Л.В., Поляков В.А., Погоржельская Н.С. (Kurbatova et al.) Микромицет Aspergillus foetidus-продуцент комплекса гидролитических ферментов // Микология и фитопатология. 2017. Т. 51. № 1. С. 34–40.
Лысенко Л.А., Немова Н.Н., Канцерова Н.П. (Lysenko et al.) Протеолитическая регуляция биологических процессов. Петрозаводск: Карельский научный центр РАН, 2011. 482 с.
Новинюк Л.В., Кулев Д.Х., Велинзон П.З., Шарова Н.Ю. (Novinyuk et al.) Выделение хитин- и хитозанглюкановых биополимеров из мицелиальных отходов производства лимонной кислоты // Пищевая промышленность. 2016. № 11. С. 30–31.
Орлова Е.В., Римарева Л.В. (Orlova, Rimareva) Исследование антиоксидантных свойств препарата, полученного на основе регулируемого ферментативного гидролиза биомассы дрожжей Saccharomyces cerevisiae // Хранение и переработка сельхозсырья. 2007. № 11. С. 63–64.
Орлова Е.В., Римарева Л.В., Оверченко М.Б., Орлова В.С., Серба Е.М. (Orlova et al.) Влияние ферментолизатов дрожжей Saccharomyces cerevisiae на клеточный цикл и апоптоз клеток перевиваемых опухолей // Биозащита и биобезопасность. 2012. Т. 4. № 3 (12). С. 48–51.
ОФС.1.2.3.0022.15. Общая фармакопейная статья (GPA). Определение аминного азота методами формольного и йодометрического титрования.
Поляков В.А., Абрамова И.М., Полыгалина Г.В., Римарева Л.В., Корчагина Г.Т., Пискарева Е.Н. (Polyakov et al.) Инструкция по технохимическому и микробиологическому контролю спиртового производства. М.: ДеЛипринт, 2007. 480 с.
Просеков А.Ю. (Prosekov) Особенности получения биологически активных пептидов из белков молочной сыворотки // Переработка молока. 2010. № 5 (127). С. 12–13.
Разумникова И.С., Бабич О.О., Просеков А.Ю., Курбанова М.Г. (Razumnikova et al.) Биологически активный пептид, полученный из молочного белка // Патент РФ № 2415943 10.04.2011.
Римарева Л.В., Кривова А.Ю., Серба Е.М., Оверченко М.Б., Игнатова Н.И., Погоржельская Н.С., Борщева Ю.А., Мочалина П.Ю. (Rimareva et al.) Биопрепараты на основе микробной биомассы, обогащенные ценными полисахаридами и незаменимыми аминокислотами // Известия Уфимского научного центра РАН, 2018a. № 3 (3). С. 28–33.
Римарева Л.В., Серба Е.М., Оверченко М.Б., Игнатова Н.И., Кривова А.Ю., Курбатова Е.И., Соколова Е.Н. (Rimareva et al.) Многоцелевое использование гриба Aspergillus oryzae – продуцента комплекса гидролаз для пищевой промышленности // Вестник российской сельскохозяйственной науки. 2018b. № 5. С. 29–33.
Римарева Л.В., Серба Е.М., Соколова Е.Н., Борщева Ю.А., Игнатова Н.И. (Rimareva et al.) Ферментные препараты и биокаталитические процессы в пищевой промышленности // Вопросы питания. 2017. Т. 86 (5). С. 63–74.
Росляков В.Я., Тарасенко И.С., Балабанов Н.П., Васильев П.С. (Roslyakov et al.) Определение количества аминокислот и пептидов в препаратах парентерального питания на основе гидролиза белка // Гематология и трансфузиология. 1984. № 3. С. 50–52.
Рязанова О.А., Пирогова О.О. (Ryazanova, Pirogova) Применение биологически активных добавок к пище в коррекции питания населения // Пищевая промышленность. 2011. № 2. С. 8–10.
Серба Е.М., Оверченко М.Б., Игнатова Н.И., Соколова Е.Н., Курбатова Е.И. (Serba et al.) Разработка национальных стандартов по методам определения активности ферментных препаратов для пищевой промышленности // Пищевая промышленность. 2013. № 7. С. 40–44.
Серба Е.М., Римарева Л.В., Курбатова Е.И., Волкова Г.С., Поляков В.А., Варламов В.П. (Serba et al.) Исследование процесса ферментативного гидролиза биомассы дрожжей для создания пищевых ингредиентов с заданным фракционным составом белковых веществ // Вопросы питания. 2017. Т. 86. № 2. С. 76–83.
Середа А.С., Великорецкая И.А., Осипов Д.О., Матыс В.Ю., Бубнова Т.В., Немашкалов В.А., Синицына О.А., Рожкова А.М., Цурикова Н.В., Синицын А.П. (Sereda et al.) Ферментные комплексы для разрушения клеточной стенки мицелиальных грибов – продуцентов промышленных ферментов // Известия Уфимского научного центра РАН. 2018. № 3 (2). С. 31–35.
Скат Р. (Skat) Биоактивные пептиды и пробиотики для функциональных мясных продуктов // Мясные технологии. 2017. № 2. С. 42–45.
Тутельян В.А. (Tutelyan) Биологически активные добавки к пище: современные подходы к обеспечению качества и безопасности // Вопросы питания. 2008. № 3. С. 4–15.
Феофилова Е.П. (Feofilova) Клеточная стенка грибов: современные представления о составе и биологической функции // Микробиология. 2010. Т. 79. № 6. С. 723–733.
Феофилова Е.П., Немцев Д.В., Тершина В.М., Меморская А.С. (Feofilova et al.) Состав и содержание хитин-глюканового комплекса в онтогенезе гриба Aspergillus niger // Прикл. биохимия и микробиология. 2006. Т. 42. № 6. С. 624–629.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


