Микология и фитопатология, 2020, T. 54, № 1, стр. 59-66
ВЛИЯНИЕ STREPTOMYCES CASTELARENSIS A4 НА ЗАБОЛЕВАЕМОСТЬ И УРОЖАЙНОСТЬ ЗЕРНОВЫХ КУЛЬТУР ПОЛЕВОГО СЕВООБОРОТА
И. Г. Широких 1, *, А. В. Бакулина 1, **, Я. И. Назарова 1, ***, А. А. Широких 1, ****, Л. М. Козлова 1, *****
1 Федеральный аграрный научный центр Северо-Востока им. Н.В. Рудницкого
610007 Киров, Россия
* E-mail: irgenal@mail.ru
** E-mail: drugaeann1@rambler.ru
*** E-mail: yan1997183@yandex.ru
**** E-mail: aleshirokikh@yandex.ru
***** E-mail: zemledel_niish@mail.ru
Поступила в редакцию 20.03.2019
После доработки 10.04.2019
Принята к публикации 16.05.2019
Аннотация
Штамм Streptomyces sp. А4, выделенный с корней овса и продемонстрировавший сильные антифунгальные свойства, по морфолого-культуральным признакам был предварительно отнесен нами к виду Streptomyces hygroscopicus. В задачи данного исследования входило уточнение филогенетического положения изолята А4 и оценка его биоконтрольного действия на зерновых культурах полевого севооборота. На основе анализа фрагментов гена 16S рРНК установлено тесное (99%) сходство штамма А4 с депонированным в NCBI штаммом S. castelarensis BJ-608 NR_029114.1. Биопрепаратом, изготовленным на основе живых клеток S. castelarensis A4, а также препаратом сравнения Псевдобактерин 2 (на основе Pseudomonas aureofaciens BS 1393) проведена обработка вегетирующих растений в посевах пшеницы, ячменя и овса на двух фонах основной обработки почвы. Обработка посевов биопрепаратами в фазу кущения привела, по сравнению с контролем без обработки, к достоверному (р < 0.05) снижению степени поражения пшеницы листовой (на 15.2%) и стеблевой (на 1.8%) ржавчинами, септориозом (на 1.7%), ячменя – листовой ржавчиной (на 19.1%) и септориозом (на 1.3%), овса – корневыми гнилями (на 17.4%), листовой (на 4.7%) и корончатой (на 17.4%) ржавчинами и красно-бурой пятнистостью (на 17.5%). По эффективности действия штамм Streptomyces castelarensis А4 сопоставим с коммерческим препаратом Псевдобактерин 2. Максимальные прибавки урожая от применения S. castelarensis А4 получены при выращивании овса и составили 0.44 и 0.47 т/га по сравнению с контрольным вариантом без обработки и обработкой посевов Псевдобактерином 2.
ВВЕДЕНИЕ
Актиномицеты рода Streptomyces являются одной из перспективных групп микроорганизмов, представители которой способны не только сдерживать развитие и распространение фитопатогенов, но и стимулировать рост растений, и их устойчивость к болезням. Современная информационная база данных по метаболитам стрептомицетов насчитывает более 10 000 биологически активных соединений (Dewi et al., 2017; Martinez et al., 2017). Стрептомицеты могут воздействовать на фитопатогены непосредственно, продуцируя антибиотики (Tarkka, Hampp, 2008), сидерофоры (Wang et al., 2014), гидролитические (Hoster et al., 2005; Chater et al., 2010) или детоксицирующие ферменты (Horlacher et al., 2013). При этом механизм антифунгальной активности актиномицетов часто обусловлен одновременным синтезом сразу нескольких метаболитов, что препятствует формированию устойчивости в популяциях фитопатогенов (Schrey, Tarkka, 2008). Повышению сопротивляемости растений к болезням может также способствовать обусловленная стрептомицетами индуцированная (ISR) и/или приобретенная (SAR) системная устойчивость (Kurth et al., 2014). Кроме того, стрептомицеты могут противодействовать фитопатогенам косвенно, улучшая рост растений-хозяев посредством синтеза фитогормонов (Nimnoi et al., 2010; Merzaeva, Shirokikh, 2010) или конкурируя с фитопатогенами за доступные элементы питания и сайты колонизации (Law et al., 2017; Rey, Dumas, 2017). В качестве агентов биоконтроля актиномицеты отличает высокая колонизирующая способность, устойчивость спор к УФ-излучению и высушиванию, временному отсутствию питательных веществ (Hamedi, Mohammadipanah, 2015; Shrivastava, Kumar, 2018). Большое значение для разработки новых биопрепаратов имеет правильная идентификация штаммов стрептомицетов, только фенотипических признаков для этой цели явно недостаточно (Alam et al., 2010; Chaves et al., 2018).
Ранее авторами из ризосферы овса Аргамак была выделена культура стрептомицета А4, проявившая антифунгальное действие в лабораторных (Shirokikh, Merzaeva, 2008) и полевых (Shirokikh et al., 2013, 2017) экспериментах. На основании изучения культуральных и морфологических признаков штамм А4 с высокой антифунгальной активностью был предварительно отнесен к виду Streptomyces hygroscopicus.
В задачи данного исследования входило уточнение филогенетического положения штамма А4 и оценка эффективности его биоконтрольного действия при обработке посевов зерновых культур в полевом севообороте.
МАТЕРИАЛЫ И МЕТОДЫ
Морфолого-культуральные признаки штамма А4 изучали на минеральном агаре 1, органическом агаре 11, глицерин-нитратной, овсяной и пептон-дрожжевой средах в соответствии с ключом Gause et al. (1983). Морфологические признаки исследовали при помощи светового микроскопа Leica DM 2500 (Carl Zeiss, Германия).
Филогенетическое положение штамма А4 определяли на основе анализа фрагментов 16S рРНК в научно-производственной компании “Синтол” (г. Москва). Первичный сравнительный анализ полученных нуклеотидных последовательностей с последовательностями из базы данных GenBank проводили с помощью программы NCBI BLAST (http://www.ncbi.nlm.nih.gov/blast). Парное выравнивание последовательностей осуществляли с помощью программы LALIGN (https://embnet.vital-it.ch/software/LALIGN_form.html). Множественное выравнивание осуществляли с помощью программы MAFFT (https://mafft.cbrc.jp/alignment/server/). Полученные данные обрабатывали методом ближайших соседей (Neighbor-Joining). Статистическая достоверность кластеризации определялась с поддержкой бутстреп-теста для интерпретации филогенетических отношений между предположительно родственными последовательностями.
Бактериальную суспензию для обработки растений получали посевом чистой культуры штамма А4 в 50 мл жидкой овсяной среды, с последующим культивированием на качалке (120 об./мин) при температуре 20 ± 2°С в течение 5–7 суток до получения суспензии с титром 106–107 КОЕ/мл. В качестве препарата сравнения использовали Псевдобактерин 2, изготовленный на основе штамма Pseudomonas aureofaciens BS 1393.
Оценку влияния бактериальных штаммов на заболеваемость растений проводили в полевом стационарном опыте, заложенном в семипольном севообороте на дерново-подзолистой среднесуглинистой почве. Культуры выращивали на двух фонах основной обработки: вспашка на 20–22 см и комбинированная плоскорезная обработка на 14–16 см. В годы проведения исследований (2014–2017 гг.) в севообороте выращивали яровую мягкую пшеницу (Triticum aestivum L.) сорта Свеча, ячмень (Hordeum vulgare L.) сорта Лель и овес (Avena sativa L.) сорта Сельма. Схема опыта: 1 – без обработки препаратами (контроль); 2 – обработка суспензией клеток штамма Streptomyces sp. А4; 3 – обработка суспензией клеток продуцента препарата Псевдобактерин 2. Площадь делянки 32 м2. Между участками с обработкой разными препаратами имелись защитные полосы шириной 1 м. Повторность в опыте 4-кратная. Размещение вариантов рандомизированное. Обработку растений суспензиями клеток двух штаммов проводили в фазу кущения из расчета 1.0 л/га, расход рабочей жидкости 300 л/га (1 л суспензии с титром 106–107 КОЕ/мл доводили водой до объема 300 л).
Ответную реакцию на обработку препаратами оценивали по урожайности растений и степени поражения грибными болезнями. Для анализа отбирали по 50 растений (130–150 стеблей) с делянки в фазу молочно-восковой спелости зерна. Степень развития болезни устанавливали как итоговый (средний) показатель пораженности растений, в котором учтены число (%) больных растений и степень (балл) поражения (Experience.., 1982).
Статистическую обработку данных проводили стандартными методами с использованием программы Excel 7.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследуемая культура А4 на диагностических средах формировала спиральные спороносцы с 2–6 оборотами. Меланоидные пигменты на пептон-дрожжевом агаре не образовывались. Субстратный мицелий на овсяном, глицерин-нитратном и минеральном агаре 1 бесцветный до серовато-желтого, растворимые пигменты отсутствовали. Воздушный мицелий серый, на 13–18-е сутки роста лизировался и покрывал колонию актиномицета черным влажным слоем. Согласно ключу Gause et al. (1983), автолиз воздушного мицелия характерен для восьми представителей серии Cinereus Achromogenes, в том числе вида Streptomyces hygroscopicus, с которым исследуемый штамм А4 имел хорошее совпадение по культуральным и морфологическим признакам.
Таксономическая идентификация, основанная на анализе фрагментов гена 16S рРНК подтвердила, что штамм А4 является представителем рода Streptomyces (Streptomycetaceae, Streptomycetales, Actinobacteria). Поисковым сервисом Blast в качестве наиболее близких (99% сходства) по последовательности 16S рРНК к исследуемому штамму А4 было предложено 13 штаммов стрептомицетов, но представителей вида S. hygroscopicus среди них не было.
Генетические данные были сопоставлены с ранее полученной информацией о фенотипических признаках. Как наиболее соответствующая фенотипически, среди предложенных для стрептомицета А4, была выбрана последовательность, принадлежащая штамму S. castelarensis BJ-608 NR_029114.1. Достоверность кластеризации стрептомицета А4 с S. castelarensis BJ-608 NR_029114.1 составила 97% (рис. 1).
Рис. 1.
Филогенетическое древо, полученное на основании анализа последовательностей фрагмента гена 16S рРНК штамма А4 и его ближайших родственников, найденных сервисом Blast. Дендрограмма построена на основании метода NJ с помощью программы MAFFT. Масштаб соответствует восьми нуклеотидным заменам на 100 нуклеотидов. Цифрами показана статистическая достоверность кластеризации, определенная с помощью бутстреп-анализа 1000 альтернативных деревьев. Штамм Rhodococcus rhodochrous DSM 43274T приведен как референсный организм, не принадлежащий к роду Streptomyces.
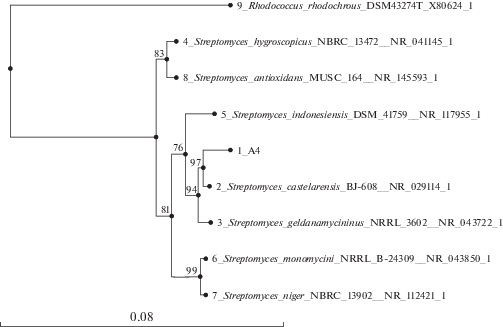
Следует отметить, что первоначально вид S. castelarensis (Cercos) Kumar et Goodfellow носил название S. rutgersensis subsp. сastelarense Cercos, под которым и был упомянут в определителе Гаузе как близкий по культурально-морфологическим признакам к виду S. antimycoticus, но отличающийся от него темно-серым воздушным мицелием на минеральном агаре 1 и образованием камфомицина (Gause et al., 1983). Сам же вид S. rutgersensis (Waksman et Curtis) Waksman et Henrici отнесен авторами определителя к видам с неясным систематическим положением серии Cinereus Achromogenes. Согласно видовому диагнозу, приведенному в работах (Cercos, 1954; Kumar, Goodfellow, 2008), воздушный мицелий S. castelarensis становится при созревании спор черным и влажным, что совпадает с нашими наблюдениями автолиза в культуре стрептомицета А4 на овсяном и минеральном агаре 1.
Таким образом, идентификация штамма А4, основанная на анализе фрагментов 16S рРНК в сочетании с фенотипическими признаками, свидетельствует о его принадлежности к виду S. castelarensis, а не к виду S. hygroscopicus, к которому штамм А4 был предварительно отнесен по своим культурально-морфологическим признакам.
Обработка посевов зерновых культур полевого севооборота суспензией клеток штамма S. castelarensis A4 привела, по сравнению с контролем без обработки, к снижению поражения растений листостебельными заболеваниями, а овса, кроме того, и корневыми гнилями, как на фоне традиционной вспашки (табл. 1), так и на фоне минимизированной плоскорезной обработки почвы (табл. 2). В 2014 г. обработка посевов пшеницы привела к достоверному снижению заболеваемости растений листовой и стеблевой ржавчинами, в 2015 г. в посевах ячменя – листовой ржавчиной и септориозом, в посевах овса – корневыми гнилями (2016 и 2017 гг.), листовой ржавчиной (2016 г.), корончатой ржавчиной и красно-бурой пятнистостью (2017 г.). Биоконтрольный эффект исследуемого штамма был сопоставим с эффектом от обработки посевов препаратом сравнения Псевдобактерин 2, а при поражении пшеницы листовой ржавчиной, существенно превосходил его.
Таблица 1.
Поражение грибными заболеваниями зерновых культур на фоне вспашки в зависимости от обработки посевов биопрепаратами
| Показатель | Варианты опыта | ||
|---|---|---|---|
| К | А4 | ПБ2 | |
| 2014 | |||
| Пшеница | |||
| Корневые гнили: поражение/развитие, % (НСР05 = Fф < Fт) | 25.0/12.3 | 17.5/8.1 | 24.5/10 |
| Поражение листовой ржавчиной, % (НСР05 = 2.6) | 25.6 | 6.9 | 16.2 |
| Поражение стеблевой ржавчиной, % (НСР05 = 0.6) | 3.2 | 0.4 | 1.2 |
| Поражение септориозом, % (НСР05 = 1.0) | 3.2 | 0.1 | 0.7 |
| 2015 | |||
| Ячмень | |||
| Корневые гнили: поражение/развитие, % (НСР05 = FФ < F0.5/НСР05 = FФ < F0.5) | 25.0/14.0 | 22.0/15.0 | 24.0/14.3 |
| Поражение листовой ржавчиной, % (НСР05 = 7.1) | 49.0 | 24.5 | 35.0 |
| Поражение стеблевой ржавчиной, % (НСР05 = FФ < F0.5) | 2.0 | 2.0 | 2.0 |
| Поражение септориозом, % (НСР05 = 1.2) | 2.0 | 0.5 | 0.0 |
| 2016 | |||
| Ячмень | |||
| Корневые гнили: поражение/развитие, % (НСР05 = FФ < F0.5/НСР05 = FФ < F0.5) | 26.5/12.0 | 16.0/9.5 | 20.5/10.5 |
| Овес | |||
| Корневые гнили: поражение/развитие, % (НСР05 = 3.9/НСР05 = 3.3) | 28.0/15.0 | 4.0/3.0 | 5.0/4.0 |
| Поражение листовой ржавчиной, % (НСР05 = 1.7) | 10.5 | 3.5 | 2.0 |
| 2017 | |||
| Овес | |||
| Корневые гнили: поражение/развитие, % (НСР05 = 9.1/НСР05 = 6.6) | 25.0/16.0 | 20.0/13.1 | 17.0/10.9 |
| Поражение корончатой ржавчиной, % (НСР05 = 6.4) | 25.6 | 5.0 | 6.5 |
| Поражение красно-бурой пятнистостью, % (НСР05 = 6.7) | 51.6 | 41.9 | 49.2 |
Таблица 2.
Поражение грибными заболеваниями зерновых культур на фоне плоскорезной обработки почвы в зависимости от обработки посевов биопрепаратами
| Показатель | Варианты опыта | ||
|---|---|---|---|
| К | А4 | ПБ2 | |
| 2014 | |||
| Пшеница | |||
| Корневые гнили: поражение/развитие, % (НСР05 = Fф < Fт) | 22.5/9.6 | 25/11.3 | 14/6.4 |
| Поражение листовой ржавчиной, % (НСР05 = 6.82) | 32.0 | 9.6 | 17.8 |
| Поражение стеблевой ржавчиной, % (НСР05 = 1.40) | 2.5 | 0.3 | 0.1 |
| Поражение септориозом, % (НСР05 = Fф < Fт) | 4.2 | 0.8 | 1.0 |
| 2015 | |||
| Ячмень | |||
| Корневые гнили: поражение/развитие, % (НСР05 = FФ < F0.5 / НСР05 = FФ < F0.5) | 26.4/14.6 | 25.0/13.8 | 18.5/9.8 |
| Поражение листовой ржавчиной, % (НСР05 = 7.1) | 50.0 | 28.0 | 34.0 |
| Поражение стеблевой ржавчиной, % (НСР05 = FФ < F0.5) | 1.0 | 3.5 | 1.0 |
| Поражение септориозом, % (НСР05 = 1.2) | 1.5 | 2.0 | 0.5 |
| 2016 | |||
| Ячмень | |||
| Корневые гнили: поражение/развитие, % (НСР05 = FФ < F0.5/НСР05 = FФ < F0.5) | 15.5/8.5 | 13.5/9.0 | 16.0/10.0 |
| 2016 | |||
| Овес | |||
| Корневые гнили: поражение/развитие, % (НСР05 = 3.9/НСР05 = 3.3) | 32.0/18.0 | 17.0/11.5 | 12.0/8.5 |
| Поражение листовой ржавчиной, % (НСР05 = 1.7) | 11.5 | 3.0 | 4.0 |
| 2017 | |||
| Овес | |||
| Корневые гнили: поражение/развитие, % (НСР05 = 9.1/НСР05 = 6.6) | 42.0/26.7 | 20.5/12.65 | 17.0/11.2 |
| Поражение корончатой ржавчиной, % (НСР05 = 6.4) | 18.8 | 4.7 | 9.4 |
| Поражение красно-бурой пятнистостью, % (НСР05 = 6.7) | 59.4 | 34.2 | 39.4 |
В литературе сообщалось о способности различных штаммов S. castelarensis синтезировать сильные антифунгальные антибиотики. Так, штаммы S. castelarensis FIM 95-F1 и ATCC 15191 продуцируют соответственно скопафунгин (Fei et al., 2011) и камфомицин (Kumar, Goodfellow, 2008), используемые в медицине и фармакологии. Обнаружить в литературе сведения о подавлении фитопатогенных грибов представителями вида S. castelarensis нам не удалось. Соответственно, есть основание полагать, что данная работа является первым сообщением о биоконтрольном действии актиномицета S. castelarensis в отношении фитопатогенных грибов, вызывающих заболевания зерновых культур в полевых условиях. Сведения о противодействии стрептомицетов грибным заболеваниям зерновых злаков в литературе фрагментарны. Так, Streptomyces sp., продуцент летучих цианидов, подавлял развитие Fusarium oxysporum и Rhizoctonia bataticola, вызывающих болезни сорго (Gopalakrishnan et al., 2011). Для защиты риса от грибов Pyricularia oryzae и Rhizoctonia solani использовали соответственно касугомицин (Law et al., 2017) и коммерческий препарат Endorse® (Dernoeden, 2001) на основе стрептомицетов.
Антифунгальная активность стрептомицетов обусловлена как синтезом соответствующих метаболитов, так и широкой продукцией хитиназ и глюканаз. Такие препараты, как Actinovate® (S. lydicus WYEC 108) и Mycostop® (S. griseoviridis K61) предназначены для внесения в почву, Micro108® (S. lydicus WYEC108) – для обработки семян (Owen et all., 2015). Ряд синтезируемых Streptomyces spp. метаболитов, включая полиоксин Д, стрептомицин и касугамицин, применяются для обработки вегетирующих растений (Hamedi, Mohammadipanah, 2015). Известно, что оздоравливающее действие на растения может оказывать развивающийся на их поверхности субстратный мицелий актиномицетов. Проникая через отверстия устьиц и механические повреждения в ткани, мицелий снабжает растения метаболитами, которые повышают их устойчивость к инфекциям (Mahadevan, Crawford, 1997; Gromovykh et al., 2007; Shimizu, 2011).
Для создания биопрепаратов, представляющих собой живую культуру, необходимо, чтобы она выдерживала конкуренцию со стороны аборигенных микроорганизмов. Как уже отмечалось, для штамма S. castelarensis А4, на поздних стадиях роста характерно увлажнение воздушного мицелия, благодаря чему поверхность колоний становится черной. Феномен гибели части воздушных гиф в процессе спорообразования, так же как и гиф субстратного мицелия перед формированием воздушного мицелия, описан в литературе первоначально как процесс автолиза (Wildermuth, 1970), а затем – программируемой клеточной гибели (ПКГ) (Manteca et al., 2006а). В дальнейшем сложилось представление о ПКГ, как ключевом событии в онтогенезе стрептомицетов, кардинально изменяющем ход метаболических процессов и знаменующем переход от субстратного характера роста к синтезу продуктов вторичного метаболизма (Manteca et al., 2006б). Неоднократно высказывалось мнение, что у стрептомицетов ПКГ имеет важное экологическое значение, поскольку за счет гибели части гиф создается пул питательных веществ, чем обеспечивается существование популяции в условиях ограниченности ресурсов (Prokofyeva-Belgovskaya, 1963; Miguélez et al., 2000), например, в почве (Zvyagintsev, Zenova, 2001), и которое периодически возникает в филосфере растений (Kalakutskiy, Sharaya, 1990).
Биоконтрольное действие S. castelarensis A4 среди испытанных зерновых культур в полевом севообороте отчетливей всего проявилось в посевах овса – культуры, с корней которой данный штамм был изолирован. Соответственно, при оценке влияния S. castelarensis A4 на урожайность зерновых культур, достоверные прибавки от обработки биопрепаратом также отмечены в посевах овса. Опрыскивание посевов в фазу кущения на фоне вспашки увеличило урожайность овса на 0.44 и 0.47 т/га (НСР05 = 0.32) по сравнению с контрольным вариантом без обработки и опрыскиванием посевов препаратом на основе Pseudomonas aureofaciens BS 1393 (рис. 2а). На фоне плоскорезной обработки почвы урожай зерна был незначительно ниже, чем на фоне вспашки (рис. 2б).
Рис. 2.
Урожайность зерновых культур полевого севооборота на фоне вспашки (а) и обработки почвы плоскорезом (б) в зависимости от обработки биопрепаратами: К – контроль; А4 – биопрепарат на основе Streptomyces castelarensis А4; ПБ – Псевдобактерин 2.
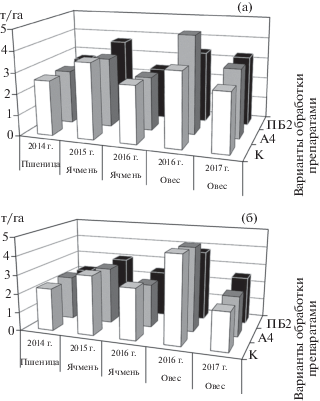
Способы основной обработки почвы не оказали достоверного влияния на распространение грибных фитопатогенов в посевах зерновых культур. Положительный эффект от обработки посевов яровой пшеницы, ячменя и овса суспензией клеток штамма S. castelarensis А4 проявился вне зависимости от способа обработки почвы.
Список литературы
Alam M.T., Merlo M.E., Takano E., Breitling R. Genome-based phylogenetic analysis of Streptomyces and its relatives. Molecular phylogenetics and evolution. 2010. V. 54 (3). P. 763–772. https://doi.org/10.1016/j.ympev.2009.11.019
Cercos A.P. Streptomyces rutgersensis var. castelarensen var. nuevas propiedades de la canfomicina. Rev. Invest. Agric. 1954. V. 8. P. 263–283.
Chater K.F., Biro S., Lee K.J., Palner T., Schrempf H. The complex extracellular biology of streptomycetes. FEMS Microbiol. Rev. 2010. V. 34. P. 171–198. https://doi.org/10.1111/j.1574-6976.2009.00206.x
Chaves J.V., Ojeda C.P.O., da Silva I.R., de Lima Procopio R.E. Identification and phylogeny of Streptomyces based on gene sequences. Res. J. Microbiol. 2018. V. 13. P. 13–20. https://doi.org/10.3923/jm.2018.13.20
Dernoeden P.H. Polyoxin D (Endorse®) – a new fungicide for brown patch and large patch control, Turfax. The international newsletter about current developments in turfgrass. 2001. V. 9. P. 6–7.
Dewi T.K., Agustiani D., Antonius S. Secondary metabolites production by Actinomycetes and their antifungal activity. KnE Life Sciences. 2017. V. 3 (4). P. 256–264. https://doi.org/10.18502/kls.v3i4.713
Experience in field farming. Moscow, 1982 (in Russ.).
Fei P., Yang X., Lu-jie C., Hong J., Yun-Yang L. Antifungal antibiotic S1 produced by Streptomyces castelarensis FIM95-F1. Natural Product Research and Development. 2011. V. 23 (5). P. 809–814.
Gauze G.F., Preobrazhenskaya T.P., Sveshnikova M.A., Terekhova L.P., Maksimova T.S. Key to actinomycetes. Genera Sreptomyces, Streptoverticillium, Chainia. Nauka, Moscow, 1983 (in Russ.).
Gopalakrishnan S., Pande S., Sharma M., Humayun P., Kiran B.K., Sandeep D., Rupela O. Evaluation of actinomycete isolates obtained from herbal vermicompost for the biological control of Fusarium wilt of chickpea. Crop. Prot. 2011. V. 30 (8). P. 1070–1078. https://doi.org/10.1016/j.cropro.2011.03.006
Gromovykh T.I., Ushanova V.A., Sizykh G.A., Litovka Yu.A., Sadykova V.S., Gaydashev I.I. Prospects for obtaining a biological product for the protection of seedlings of conifers by solid-phase cultivation of the strain 19/97M Streptomyces lateritius Sveschnikova. Khvoynye borealnoy zony. 2007. V. 4–5. P. 482–486 (in Russ.).
Hamedi J., Mohammadipanah F. Biotechnological application and taxonomical distribution of plant growth promoting actinobacteria. J. Industrial Microbiol. Biotechnol. 2015. V. 42 (2). P. 157–171. https://doi.org/10.1007/s10295-014-1537-x
Horlacher N., Nachtigall J., Schulz D., Süssmuth R.D., Hampp R., Fiedler H.P., Schrey S.D. Biotransformation of the fungal phytotoxin fomannoxin by soil Streptomycetes. J. Chem. Ecol. 2013. V. 39. P. 931–941. https://doi.org/10.1007/s10886-013-0290-3
Hoster F., Schmitz J.E., Daniel R. Enrichment of chitinolytic microorganisms: isolation and characterization of a chitinase exhibiting antifungal activity against phytopathogenic fungi from a novel Streptomyces strain. Appl. Microbiol. Biotechnol. 2005. V. 66. P. 434–442. https://doi.org/10.1007/s00253-004-1664-9
Kalakutsky L.V., Sharaya L.S. Actinomycetes and higher plants. Uspekhi mikrobiologii. 1990. V. 2. P. 26–65 (in Russ.).
Kumar Y., Goodfellow M. Five new members of the Streptomyces violaceusniger 16S rRNA gene clade: Streptomyces castelarensis sp. nov., comb. nov., Streptomyces himastatinicus sp. nov., Streptomyces mordarskii sp. nov., Streptomyces rapamycinicus sp. nov. and Streptomyces ruanii sp. nov. Int. J. Systematic Evol. Microbiol. 2008. V. 58 (6). P. 1369–1378. https://doi.org/10.1099/ijs.0.65408-0
Kurth F., Mailänder S., Bönn M., Feldhahn L., Herrmann S., Große I., Tarkka M.T. Streptomyces – induced resistance against oak powdery mildew involves host plant responses in defense, photosynthesis, and secondary metabolism pathways. Mol. Plant Microbe Interact. 2014. V. 27. P. 891–900. https://doi.org/10.1094/MPMI-10- 13-0296-R
Law J.W.F., Ser H.L., Khan T.M., Chuah L.H., Pusparajah P., Chan K.G., Lee L.H. The potential of Streptomyces as biocontrol agents against the rice blast fungus, Magnaporthe oryzae (Pyricularia oryzae). Front. Microbiol. 2017. V. 8. P. 3. https://doi.org/10.3389/fmicb.2017.00003
Mahadevan B., Crawford D.L. Properties of the chitinase of the antifungal biocontrol agent Streptomyces lydicus WYEC108. Enzyme Microbial Technol. 1997. V. 20 (7). P. 489–493. https://doi.org/10.1016/S0141-0229(96)00175-5
Manteca A., Fernandez M., Sanchez J. Cytological and biochemical evidence for an early cell dismanting events in surface cultures of Streptomyces antibioticus. Res. Microbiol. 2006a. V. 157. P. 143–152. https://doi.org/10.1016/j.resmic.2005.07.003
Manteca A., Mader U., Connolly B.A., Sanchez J. A proteomic analysis of Streptomyces coelicolor programmed cell death. Proteomics. 2006b. V. 6. P. 6008–6022. https://doi.org/10.1002/pmic.200600147
Martinez K.B., Leone V.A., Chang E.B. Microbial metabolites in health and disease: Navigating the unknown in search of function. J. Biol. Chemistry. 2017. P. R116. https://doi.org/10.1074/jbc.R116.752899
Merzaeva O.V., Shirokikh I.G. The Production of auxins by the endophytic bacteria of winter rye. Appl. Biochem. Microbiol. 2010. V. 46. P. 44–50. https://doi.org/10.1134/S0003683810010072
Miguelez E.M., Yardisson C., Manzanal M.B. Streptomycetes: a new model to study cell death. Int. Microbiol. 2000. V. 3. P. 153–158.
Nimnoi P., Pongsilp N., Lumyong S. Endophytic actinomycetes isolated from Aquilaria crassa Pierre ex Lec and screening of plant growth promoters production. World J. Microbiol. Biotechnol. 2010. V. 26. P. 193–203. https://doi.org/10.1007/s11274-009-0159-3
Owen D., Williams A.P., Griffith G. W., Withers P.J. Use of commercial bio-inoculants to increase agricultural production through improved phosphrous acquisition. Appl. Soil Ecol. 2015. V. 86. P. 41–54. https://doi.org/10.1016/j.apsoil.2014.09.012
Prokofyeva-Belgovskaya A.A. The structure and development of actinomycetes. Moscow, 1963. P. 68–123 (in Russ.).
Rey T., Dumas B. Plenty is no plague: Streptomyces symbiosis with crops. Trends in Plant Science. 2017. V. 22 (1). P. 30–37. https://doi.org/10.1016/j.tplants.2016.10.008
Schrey S.D., Tarkka M.T. Friends and foes: streptomycetes as modulators of plant disease and symbiosis. Antonie Van Leeuwenhoek. 2008. V. 94. P. 11–19. https://doi.org/10.1007/s10482-008-9241-3
Shimizu M. Endophytic Actinomycetes: biocontrolagents and growth promoters. In: D. K. Maheshwari (ed.) Bacteria in agrobiology: disease management. Springer, Berlin. 2011. https://doi.org/10.1007/978-3-642-20332-9_10.
Shirokikh I.G., Kozlova L.M., Shirokikh A.A., Popov F.A., Tovstik E.V. Effects of tillage technologies and application of biopreparations on micromycetes in the rhizosphere and rhizoplane of spring wheat. Eurasian Soil Science. 2017. V. 50 (7). P. 826–831. https://doi.org/10.1134/S1064229317070110
Shirokikh I.G., Merzaeva O.V. Biological activity of Streptomyces hygroscopicus against the phytopathogenic fungus Fusarium avenaceum in the rhizosphere. Mikologiya i fitopatologiya. 2008. V. 42 (6). P. 586–591 (in Russ.).
Shirokikh I.G., Ryabova O.V., Kharina A.V., Korjakovtseva L.A., Shirokikh A.A. Impact of Streptomyces hygroscopicus A-4 strain on microfungal complexes in the wheat rhizosphere. Mikologiya i fitopatologiya. 2013. V. 47 (6). P. 410–416 (in Russ.).
Shrivastava P., Kumar R. Actinobacteria: Eco-friendly candidates for control of plant diseases in a sustainable manner. In: New and future developments in microbial biotechnology and bioengineering, 2018. P. 79–91.
Tarkka M., Hampp R. Secondary metabolites of soil Streptomycetes in biotic interactions. In: P. Karlovsky (ed.). Secondary metabolites in soil ecology. Soil Biology 14. Springer-Verlag, Berlin, Heidelberg, 2008. P. 107–126. https://doi.org/10.1007/978-3-540-74543-3_6.
Wang W., Qiu Z., Tan H., Cao L. Siderophore production by actinobacteria. Biometals. 2014. V. 27. P. 623–631. https://doi.org/10.1007/s10534-014-9739-2
Wildermuth H. Development and organization of the aerial mycelium in Streptomyces coelicolor. J. Gen. Microbiol. 1970. V. 60. P. 43–50. https://doi.org/10.1099/00221287-60-1-43
Zvyagintsev D.G., Zenova G.M. Ecology of actinomycetes. Geos, Moscow, 2001 (in Russ.).
Гаузе Г.Ф., Преображенская Т.П., Свешникова М.А., Терехова Л.П., Максимова Т.С. (Gauze et al.) Определитель актиномицетов. Роды Sreptomyces, Streptoverticillium, Chainia. М.: Наука, 1983. 248 с.
Громовых Т.И., Ушанова В.А., Сизых Г.А., Литовка Ю.А., Садыкова В.С., Гайдашева И.И. (Gromovykh et al.) Перспективы получения биопрепарата для защиты сеянцев хвойных путем твердофазного культивирования штамма 19/97М Streptomyces lateritius Sveschnikova // Хвойные бореальной зоны. 2007. № 4–5. С. 482–486.
Звягинцев Д.Г., Зенова Г.М. (Zvyagintsev, Zenova) Экология актиномицетов. М.: Геос, 2001. 253 с.
Калакуцкий Л.В., Шарая Л.С. (Kalakutsky, Sharaya) Актиномицеты и высшие растения // Успехи микробиологии. Вып. 2. М.: Наука, 1990. С. 26–65.
Опытное дело в полеводстве (Experience). М.: Россельхозиздат, 1982. 190 с.
Прокофьева-Бельговская А.А. (Prokofyeva-Belgovskaya) Строение и развитие актиномицетов. М.: Изд-во АН СССР, 1963. С. 68–123.
Широких И.Г., Мерзаева О.В. (Shirokikh, Mеrzаeva) Биологическая активность Streptomyces hygroscopicus против фитопатогенного гриба Fusarium avenaceum в ризосфере // Микология и фитопатология. 2008. Т. 42. № 6. С. 586–591.
Широких И.Г., Рябова О.В., Харина А.В., Коряковцева Л.А., Широких А.А. (Shirokikh et al.) Влияние штамма Streptomyces hygroscopicus А4 на комплекс микромицетов-патогенов яровой мягкой пшеницы // Микология и фитопатология. 2013. Т. 47. № 6. С. 410–416.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


