Микология и фитопатология, 2020, T. 54, № 1, стр. 49-58
РАСОВЫЙ СОСТАВ НОВОСИБИРСКОЙ ПОПУЛЯЦИИ
Е. С. Сколотнева 1, *, В. Н. Кельбин 1, **, А. И. Моргунов 2, ***, Н. И. Бойко 1, ****, В. П. Шаманин 3, *****, Е. А. Салина 1, ******
1 Федеральный исследовательский центр Институт цитологии и генетики СО РАН
630090 Новосибирск, Россия
2 Международный центр улучшения кукурузы и пшеницы
313593315 Анкара, Турция
3 Омский государственный аграрный университет им. П.А. Столыпина
644008 Омск, Россия
* E-mail: sk-ska@yandex.ru
** E-mail: kelbin@bionet.nsc.ru
*** E-mail: a.morgounov@cgiar.org
**** E-mail: bojkoni@bionet.nsc.ru
***** E-mail: vp.shamanin@omgau.org
****** E-mail: sunday01@mail.ru
Поступила в редакцию 19.07.2019
После доработки 17.09.2019
Принята к публикации 25.10.2019
Аннотация
Западная Сибирь представлена областями с различными агроклиматическими показателями, где создаются условия для существования независимых патогенных популяций возбудителя стеблевой ржавчины пшеницы со специфическими путями миграции и источниками возобновления инфекции. Для выяснения фитосанитарной обстановки на обширной территории региона, а также для интеграции данных по мировой миграции вирулентных рас, исследование и мониторинг расового состава патогенных популяций ржавчинных грибов должны осуществляться с помощью универсального набора линий пшеницы и сортов дифференциаторов с известными генами устойчивости. Всемирный справочный центр ржавчины (Global Rust Reference Center, GRRC) в настоящее время реализует требования стандартных методических протоколов при работе с ржавчинными грибами и типированию рас. Расовый состав популяции и степень вирулентности патогена Новосибирской обл. изучены в условиях Всемирного справочного центра ржавчины, GRRC (Дания), а также в лаборатории молекулярной фитопатологии ФИЦ ИЦиГ СО РАН (Россия), организованной в соответствии со стандартами GRRC. Из образцов инфекции всего выделено 40 монопустульных изолятов Puccinia graminis f. sp. tritici, для которых проведено типирование с выяснением расовой принадлежности. Выявлен сложный расовый состав локальной популяции Новосибирской обл. с доминирующими патотипами TKRPF, QCRSF, QCHSF. Важно отметить отсутствие заноса в регион агрессивной расы Ug99: в составе локальной популяции Новосибирской обл. не выявлено ни одного патотипа из семейства агрессивной расы. Результаты сравнения расового состава позволяют говорить об омской и алтайской субпопуляциях с независимыми источниками генетического разнообразия и зоной соприкосновения и перемешивания на пшеничных посевах Новосибирской обл. Вероятно, наибольшее значение на формирование структуры новосибирской популяции имеет инокулюм омского происхождения, что можно заключить из сходства доминантных рас в образцах P. graminis f. sp. tritici, собранных в этих областях.
ВВЕДЕНИЕ
Расовый состав популяций возбудителя стеблевой ржавчины пшеницы Puccinia graminis f. sp. tritici нестабилен и может изменяться со временем. Причинами появления новых рас могут быть не только половая рекомбинация на промежуточном хозяине барбарисе. Бесполые популяции со временем обнаруживают новые комбинации вирулентности за счет соматической гибридизации (Johnson, Newton, 1946; Watson, Luig, 1958; Cotter, Roberts, 1963; Luig, Watson, 1972). Генетика устойчивости районированных сортов пшеницы играет непосредственную роль в отборе рас P. graminis f. sp. tritici и формировании локальных популяций. Практическая селекция многих стран показала, что введение и распространение новых устойчивых сортов приводит к изменению состава рас популяций стеблевой ржавчины (Johnson, 1953; Stakman, Harrar, 1959). Например, при сравнении популяций Австралии и Новой Зеландии, где до 1945 г. высевались одинаковые сорта пшеницы, была показана взаимосвязь появления в Австралии новых рас стеблевой ржавчины с высеванием новых, не используемых ранее устойчивых сортов. Данные расы не получили распространения в Новой Зеландии, где эти сорта не высевались (Watson, Luig, 1968). Было также показано влияние дикорастущих злаков на качественное и количественное соотношение рас в популяциях. Обладая неспецифической устойчивостью, они являются резерваторами инфекции в неблагоприятные для развития болезни годы (Leonard, Szabo, 2005; Skolotneva et al., 2013). Кроме того, система “растение-хозяин – паразит” зависит от экологических факторов. Это приводит к тому, что в одном и том же регионе, при отсутствии изменений в составе районированных сортов, в разные сезоны в популяции P. graminis f. sp. tritici доминируют разные расы. Так, в 1950–60-х гг. в Канаде наблюдалось смещение численного соотношения рас 15 и 56 в сторону доминирования одной из них при изменении температурных условий. Показано, что при повышении температур в регионе распространения раса 56 вытесняет расу 15 (Katsuya, Green, 1967). При анализе динамики основных рас популяции P. graminis f. sp. tritici центрального региона России 2001–2005 гг. была отмечена смена доминантных рас: M-расы MKBT, MKLT и MKBP были замещены Т-расами TKNT, TTNT, TKST, TKNTF, что коррелировало с повышением относительных температур сезона вегетации пшеницы (Skolotneva et al., 2013).
Изучение расового состава популяций P. gra-minis f. sp. tritici в СССР активно проводилось с середины до конца прошлого века. Первое определение физиологических рас P. graminis f. sp. tritici было проведено Барменковым (Barmenkov, 1939). За два года исследований им было выделено 9 физиологических рас P. graminis f.sp. tritici. Наиболее распространены в то время были расы 40 и 116 (авирулентные/вирулентные к линиям и сортам с генами Sr21, Sr7a/Sr6, Sr10, Sr11, Sr9a, Sr9b, Sr9e). В течение последующих 20 лет работы по определению расового состава популяций в стране не возобновлялись. Позднее, в период с 1961 по 1963 года в СССР было выявлено 16 физиологических рас P. graminis f. sp. tritici (Rassadina, 1965). Наибольшее распространение имела раса 21, зарегистрированная практически во всех эколого-географических районах и составлявшая около 50% популяции P. graminis f. sp. tritici в СССР. Обращает внимание меньшая степень вирулентности, доминирующей в этот период расы: авирулентность/вирулентность к линиям и сортам с генами Sr5, Sr21, Sr7a, Sr9e/Sr6, Sr10, Sr11, Sr9a, Sr9b. Высокой агрессивностью к ряду районированных сортов пшеницы имели мало распространенные расы 15, 40, 11 и 116, что дало основание предполагать, что вскоре они могут получить широкое распространение на производственных посевах. Последующие исследования подтвердили данное предположение: к концу 70-х годов расы 15, 40, 11 (авирулентные/вирулентные к линиям и сортам с генами Sr7a/Sr5, Sr6, Sr10, Sr11, Sr9a, Sr9b, Sr9e, Sr21) являлись доминирующими в ряде регионов страны (Volkova, 1978). Анализируя расовый состав популяций СССР в период 1930–70-е гг., можно сделать вывод об относительно стабильном расовом составе географических популяций P. graminis f. sp. tritici, что связано с культивированием в основных районах восприимчивых к стеблевой ржавчине сортов пшеницы, не способных оказать существенного селективного воздействия на популяцию (Konovalova, 1975). При этом гены устойчивости Sr5 и Sr21 постепенно теряли свою эффективность, а для линий с геном Sr7a не было выявлено вирулентных клонов P. graminis f. sp. tritici.
В последние десятилетия прошлого века эпифитотии стеблевой ржавчины отмечались редко как за рубежом, так и у нас в стране. Однако ближе к 2010 г. значительное поражение пшеничных посевов стало отмечаться в различных регионах Российской Федерации, преимущественно в Северо-Кавказском и Поволжском (Koishybaev, 2018), а к настоящему моменту наблюдается уже повсеместное развитие стеблевой ржавчины во время вегетативного сезона пшеницы (Sinyak, Volkova, 2015; Shamanin et al., 2015; Kiseleva et al., 2017). Кроме того, изменилось и мировое эпидемиологическое состояние, что некоторые исследователи связывают с изменением климатических показателей, определяющих развитие инфекции. История появления и распространения по континентам агрессивной расы стеблевой ржавчины Ug99, а также обширные вспышки желтой ржавчины в большинстве районов выращивания пшеницы за последнее десятилетие, очевидно продемонстрировали необходимость объединения международных усилий в направлении мировой продовольственной безопасности.
Для выяснения фитосанитарной обстановки на обширной территории страны, а также для интеграции данных по мировой миграции вирулентных рас, исследование и мониторинг расового состава патогенных популяций ржавчинных грибов должны осуществляться с помощью стандартного набора линий пшеницы и сортов дифференциаторов с известными генами устойчивости. Возникает также требование к ревизии Sr генов устойчивости в тестерных линиях в связи с неоднородностью дифференциальных наборов в лабораториях, изучающих ржавчинные заболевания пшеницы: линии с одним и тем же геном устойчивости, но из разных репродукций и разного происхождения не всегда показывают идентичную реакцию на заражение. Кроме того, важное значение имеет разработка и использование при популяционных исследованиях возбудителя ржавчины единых стандартов, воспринимаемых мировым научным сообществом. Всемирный справочный центр ржавчины (Global Rust Reference Center, GRRC) в настоящее время реализует требования стандартных методических протоколов при работе с ржавчинными грибами и типировании рас. GRRC был основан в 2008 г. по запросу международных организаций по защите и улучшению зерновых культур (CIMMYT и ICARDA). Мониторинг и диагностика рас ржавчины пшеницы на глобальном уровне представляют собой основные задачи функционирования Центра.
Целенаправленная работа по анализу вирулентности патогена в Западной Сибири, где широко возделывается культура пшеницы, практически только началась. Текущий расовый состав популяций P. graminis f. sp. tritici Омской обл. и Алтайского края выяснен с помощью анализа в GRRC (Shamanin et al., 2019) представлен большим разнообразием высоковирулентных рас. Исследования расового состава популяции возбудителя стеблевой ржавчины на территории севера лесостепи Приобья, принадлежащей Новосибирской области, к настоящему моменту не проводились. Тем не менее, стеблевая ржавчина в фитопатогенном комплексе пшеницы, занимающей более 1 млн га Новосибирской обл., отмечается регулярно последнее время, а в 2010, 2011 и 2016 гг. ее развитие достигало эпифитотийного уровня (Sochalova, Lihenko, 2015; Skolotneva et al., 2016).
Целью данной работы было выяснить расовый состав локальной популяции возбудителя стеблевой ржавчины пшеницы Новосибирской обл. и оценить степень вирулентности патогена с помощью стандартных протоколов, разработанных для дифференциации образцов популяций стеблевой ржавчины, при использовании международного набора тестерных линий пшеницы (Pgt-differential set, Северная Америка, Миннесота, Cereal Rust Disease Laboratory) в условиях Всемирного справочного центра ржавчины, GRRC (Дания), ресурсы которого представлены тепличным корпусом и лабораторными помещениями, оборудованными для работы с карантинными объектами, а также в лаборатории молекулярной фитопатологии ФИЦ ИЦ и Г СО РАН (Россия), организованной в соответствии со стандартами GRRC.
МАТЕРИАЛЫ И МЕТОДЫ
В июле – августе 2017 г. было проведено два обширных сбора образцов P. graminis f. sp. tritici на производственных посевах и опытных полях Новосибирска. Образцы инфицированных стеблевой ржавчиной растений были подготовлены и оформлены в соответствии с порядком, утвержденным решением Комиссии таможенного союза РФ от 20.05.2010 № 263 для безопасной транспортировки в Данию для анализа в условиях GRRC. После стандартной процедуры оживления спорового материала на восприимчивом сорте Morocco образцы послужили базой для выделения 23 монопустульных изолятов P. graminis f. sp. tritici (протоколы GRRC, Rsaliyev et al., 2018): 15 изолятов из образцов раннего сбора (июль) и 8 изолятов из образцов поздней инфекции (август).
Дополнительно в Омской (июль) и Новосибирской (август) областях образцы популяции P. gramini f. sp. tritici были собраны на одном и том же сорте яровой мягкой пшеницы Чернява 13, считающимся универсально восприимчивым к листостебельным патогенам пшеницы. В условиях лаборатории молекулярной фитопатологии ФИЦ ИЦиГ СО РАН из образцов инфекции Омской и Новосибирской областей, выделено 8 и 9 монопустульных изолятов P. graminis f. sp. tritici, соответственно.
Типирование рас проводили на проростках пшеницы при использовании международного северо-американского набора тестерных линий для дифференцирования рас стеблевой ржавчины пшеницы, Pgt differential set, переданного в лабораторию GRRC доктором Yue Jin (Cereal Rust Disease Laboratory, Minnesota, USA). Набор состоит из пяти групп линий и сортов-дифференциаторов: ISr5-Ra, CnS_T_mono_deriv, Vernstine, ISr7b-Ra, содержащих гены Sr5, Sr21, Sr9e, Sr7b, соответственно (группа 1); ISr11-Ra, ISr6-Ra, ISr8a-Ra, CnSr9g, содержащих гены Sr11, Sr6, Sr8a, Sr9g, соответственно (группа 2); W2691SrTt-1, W2691Sr9b, BtSr30Wst, Combination VII, содержащих гены Sr36, Sr9b, Sr30, Sr17+13 (группа 3); ISr9a-Ra, ISr9d-Ra, W2691Sr10, CnsSrTmp, содержащих гены Sr9a, Sr9d, Sr10, SrTmp (группа 4); LcSr24Ag, Sr31/6*LMPG, VPM-1, McNair 701, содержащих гены Sr24, Sr31, Sr38, SrMcN (группа 5). Инокулированные растения инкубировали в течение 24 ч во влажной камере при соблюдении полной темноты и при температуре 15–20°С, что обеспечивало максимальный процент проросших спор и эффективное развитие ростковой гифы гриба. После растения помещали в ростовые камеры для работы с карантинным объектом, где поддерживалось освещение (10 000 люкс) и смена светового режима (день/ночь). Во время первой фазы заражения критичной для возбудителя стеблевой ржавчины является высокая температура (26–28°С), необходимая для формирования полноценной структуры аппрессория, проникновения патогена через устьичную щель и развития инфекционных гиф в межклетниках растения-хозяина (Roelfs et al., 1992). В течение первых трех дней после инокуляции в ростовых камерах поддерживалась соответствующая температура. Следующая фаза патогенеза связана с установлением контакта патогена с клетками растения-хозяина через формирование гаусториев, исход которой определяет “ген-на-ген“ взаимодействие участников системы патоген-хозяин. Часть генов устойчивости, входящих в состав сортов-дифференциаторов стеблевой ржавчины обычно демонстрирует большую эффективность при температуре ниже 20°С. Это гены Sr6, Sr17 и Sr38 с температурозависимой экспрессией (McIntosh et al., 1995). В этой связи на четвертые-пятые сутки после инокуляции температуру в ростовой камере снижают (Jin, 2008). Однако опыт исследователей лаборатории GRRC предостерегает от чрезмерного снижения температуры: так как для споруляции P. graminis наиболее подходящим является диапазон 25–35°С. Авторы данного исследования согласны с температурой 22–25°С, рекомендованной в протоколе GRRC, которая использовалась при анализе выделенных из образцов новосибирской популяции изолятов P. graminis f. sp. tritici. Чтение инфекционных типов (ITs, infection types) проводили через 12–14 дней после инокуляции при использовании модифицированной шкалы Стэкмана (Roelfs, Martens, 1988). В общем случае, реакцией восприимчивости (high, H) считались инфекционные типы 3, 3+ и 4, за исключением реакций на следующих линиях: для Sr30 только при IT 3+ и 4; для Sr17 и Sr21 – значения IT 3– и более; для Sr36 – при всех значениях IT, превышающих 0 и “;”. Приведенные рекомендации GRRC составлены по результатам международных семинаров, посвященных методам типирования мировой коллекцией изолятов P. graminis f. sp. tritici (Pretorius, 2015).
Для сравнения расового состава образцов новосибирской популяции P. graminis f. sp. tritici, с образцами омской и алтайской популяций патогена, данные по которым получены ранее в лаборатории GRRC и опубликованны группой исследователей под руководством проф. В.П. Шаманина (Shamanin et al., 2019), был использован кластерный анализ, выполненный с помощью пакета статистических программ PAST3 (Multivariate Software). Программа позволяет создавать сложную матрицу признаков, что удобно при работе с 20-членными патотипами рас, используя данные состава генов вирулентности. Для построения кладограммы использовался метод UPGMA.
РЕЗУЛЬТАТЫ
В течение вегетационного сезона 2017 г. на пшеничных посевах Новосибирской обл. наблюдались две вспышки развития стеблевой ржавчины, разделенных друг от друга значительным промежутком времени: ранняя и поздняя инфекция. Очаг ранней инфекции был зарегистрирован во вторую декаду июля на гибридных растениях мягкой яровой пшеницы опытного поля СибНИИРС (рис. 1). Поражение было сильным и оценивалось как 70MS – 40S по международной шкале CIMMYT (Koishybaev et al., 2014). Однако дальнейшего распространения стеблевой ржавчины на посевах пшеницы не наблюдалось, что, вероятно, связано с установившейся в регионе низкой среднесуточной температурой (20–22°С), не соответствующей оптимальным показателям для инфицирования хозяина (22–25°С) и споруляции гриба (25–35°С) (Roelfs et al., 1992). Благоприятные условия для развития стеблевой ржавчины в 2017 сложились только во вторую декаду августа. Так называемая поздняя инфекция была зарегистрирована на яровой мягкой пшенице в специально высаженном питомнике с восприимчивыми генотипами (п. Элитный, поле генетики ВАСХНИЛ, Новосибирская обл.). Растения в то время находились уже на стадии молочно-восковой спелости зерна, поэтому болезнь не имела экономического значения в регионе.
Рис. 1.
Ранняя инфекция стеблевой ржавчины на гибридных растениях мягкой пшеницы, вторая декада июля 2017 г., опытное поле селекционного центра СибНИИРС, Новосибирская обл.

Списки рас P. graminis f. sp. tritici, идентифицированных в условиях GRRC и ФИЦ ИЦиГ СО РАН в образцах ранней и поздней инфекции, приведены в табл. 1. Важно отметить, что расовый состав образцов не пересекается. Доминирующими в образцах ранней инфекции были патотипы QCRSF и QCHSF с частотой встречаемости 40 и 20%, соответственно. В образцах поздней инфекции преобладала раса TKRPF (53%). Большинство изолятов P. graminis f. sp. tritici было вирулентно к линиям с генами Sr5, Sr9a, Sr9b, Sr9d, Sr9g, Sr10, Sr17, Sr38, SrMcN, но авирулентно к линиям с генами Sr11, Sr24, Sr30, Sr 31 (табл. 2). Генами, дифференцировавшими локальную популяцию патогена, были Sr6, Sr7b, Sr8a, Sr9e, Sr21, Sr36 и SrTmp.
Таблица 1.
Расы новосибирской популяции Puccinia graminis f. sp. tritici, идентифицированные в условиях GRRC в образцах ранней и поздней инфекции
| Частота рас в образцах | Ранняя инфекция | Поздняя инфекция |
|---|---|---|
| Доминантные расы | QCRSF (40%), QCHSF (20%) | TKRPF (53%), |
| Редкие и единичные расы | LCRSF (13%), LHRSF (13%), LCCSF (7%), LCHSF (7%) | LKCSF (12%), NFMSF (12%), RFPTF (12%), MCMSF (6%), QHHSF (6%) |
| Всего изолятов | 15 | 17 |
Таблица 2.
Формула вирулентности рас, идентифицированных в образцах популяций Puccinia graminis f. sp. tritici в 2017 г.
| Расы | Вирулентность к генам Sr | Авирулентность к генам Sr |
|---|---|---|
| LCCSF | 5, 9a, 9d, 9g, 10, 17, 38, McN | 6, 7b, 8a, 9b, 9e, 11, 21, 24, 30, 31, 36, Tmp |
| LCHSF | 5, 9a, 9b, 9d, 9g, 10, 17, 38, McN | 6, 7b, 8a, 9e, 11, 21, 24, 30, 31, 36, Tmp |
| LCRSF | 5, 9a, 9b, 9d, 9g, 10, 17, 36, 38, McN | 6, 7b, 8a, 9e, 11, 21, 24, 30, 31, Tmp |
| LHRSF | 5, 6, 9a, 9b, 9d, 9g, 10, 17, 36, 38, McN | 7b, 8a, 9e, 11, 21, 24, 30, 31, Tmp |
| LKCSF | 5, 6, 8a, 9a, 9d, 9g, 10, 17, 38, McN | 7b, 9b, 9e, 11, 21, 24, 30, 31, 36, Tmp |
| MCMSF | 5, 7b, 9a, 9d, 9g, 10, 17, 36, 38, McN | 6, 8a, 9b, 9e, 11, 21, 24, 30, 31, Tmp |
| NFMSF | 5, 8a, 9a, 9d, 9e, 9g, 10, 17, 36, 38, McN | 6, 7b, 9b, 11, 21, 24, 30, 31, Tmp |
| QCHSF | 5, 9a, 9b, 9d, 9g, 10, 17, 21, 38, McN | 6, 7b, 8a, 9e, 11, 24, 30, 31, 36, Tmp |
| QCRSF | 5, 9a, 9b, 9d, 9g, 10, 17, 21, 36, 38, McN | 6, 7b, 8a, 9e, 11, 24, 30, 31, Tmp |
| QHHSF | 5, 6, 9a, 9b, 9d, 9g, 10, 17, 21, 38, McN | 7b, 8a, 9e, 11, 24, 30, 31, 36, Tmp |
| RFPTF | 5, 7b, 8a, 9a, 9d, 9g, 10, 17, 21, 30, 36, 38, McN, Tmp | 6, 9b, 9e, 11, 24, 31 |
| TKMNC* | 5, 7b, 8a, 9a, 9g, 10, 17, 21, 36, McN | 9b, 9d, 11, 24, 30, 31, 38, Tmp |
| TKRPF* | 5, 7b, 8a, 9a, 9d, 9g, 10, 17, 21, 36, 38, McN, Tmp | 9b, 11, 24, 30, 31 |
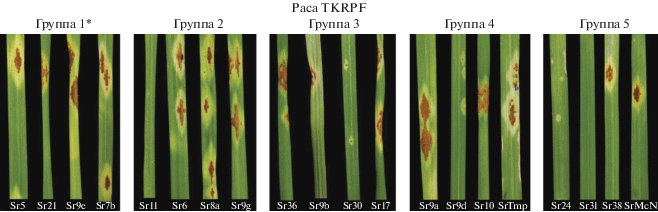
Сорт Чернява 13, на котором был дополнительно собран материал в Омской и в Новосибирской областях, является высоко восприимчивым к стеблевой ржавчине и используется в инфекционных питомниках в качестве накопителя инокулюма. Несмотря на это, нельзя исключить влияние генотипа хозяина на расовый состав образцов инфекции, разнообразие которых оказалось низким: 9 монопустульных изолятов Омской области принадлежали двум расам TKRPF (7 изолятов) и TKMNC (2 изолята), и все 8 проанализированных монопустульных изолятов Новосибирской обл. оказались расой TKRPF (рис. 2).
Рис. 2.
Патотип расы TKRPF, наиболее распространенной в образцах инфекции стеблевой ржавчины, собранных на сорте Чернява 13 в Омской и Новосибирской областях. *Инфекционные типы на растениях из соответствующей группы линий и сортов пшеницы с генами Sr, входящих в международный набор для дифференцирования рас стеблевой ржавчины пшеницы (Pgt differential set, Dr. Yue Jin, Cereal Rust Disease Laboratory, Minnesota, USA).
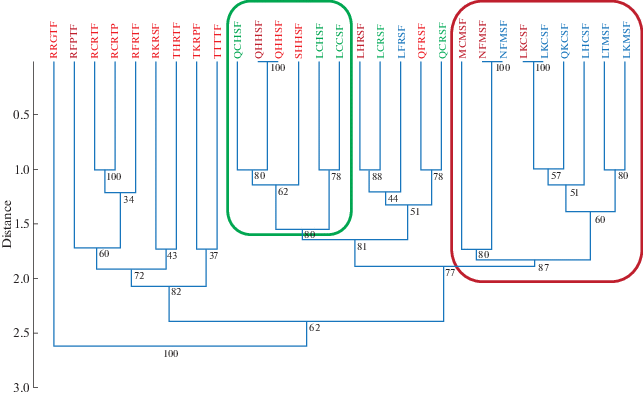
Образцы популяции P. graminis f. sp. tritici Новосибирской обл. были сопоставлены с данными, полученными ранее для образцов омской и алтайской популяций (Shamanin et al., 2019). Идентификация патотипов в одних и тех же условиях, определяемым стандартами протоколов лаборатории GRRC, позволила провести сравнение рас с помощью кластерного анализа (рис. 3).
Рис. 3.
Кладограмма, построенная методом UPGMA (PAST3 software), по данным состава генов вирулентности у сравниваемых патотипов Puccinia graminis f. sp. tritici. Условные обозначения: красным и синим шрифтом написаны расы, выделенные из образцов Омской области и Алтайского края, соответственно (Shamanin et al., 2019); зеленым и коричневым шрифтом написаны названия рас, выделенных из образцов ранней и поздней инфекции в Новосибирской обл., соответственно; с помощью цветных рамок выделены кластеры, обсуждаемые в исследовании.
ОБСУЖДЕНИЕ
В связи с тем, что между первой и второй вспышкой стеблевой ржавчины в Новосибирской обл. в 2017 г. был зарегистрирован период отсутствия развития болезни, проведен сравнительный анализ образцов ранней и поздней инфекции. Большинство рас, выявленных из образцов ранней инфекции, представлены близкородственными расами, полиморфными по признаку вирулентности только к 1–3 генам устойчивости: Sr9g, Sr21, Sr36. При кластерном анализе большинство из них, включая доминантный патотип QCHSF, объединяются с расами, зарегистрированными в том же году в Омской обл. (рис. 3). Расы поздней инфекции кластеризуются преимущественно вместе с расами, идентифицированными в образцах популяции Алтайского края, собранных также в 2017 г., вплоть до совпадения некоторых патотипов: NFMSF, LKCSF (рис. 3). В то же время один из редких патотипов поздних образцов QHHSF присутствует в списке рас омской популяции (Shamanin et al., 2019). Таким образом, можно заключить, что на территории Новосибирской обл. создаются условия для поддержания спор P. graminis f. sp. tritici, мигрирующих как в восточном направлении из Омской области, так и с южными ветрами из Алтайского края. Местный источник инфекции в настоящее время не подтвержден: половое спороношение стеблевой ржавчины на барбарисе предварительно идентифицировано как ржаная специальная форма гриба P. graminis f. sp. secalis, не способная поразить культурную пшеницу (Kelbin et al., 2019). Во время вегетационного периода 2017 г. причиной ранней инфекции, вероятнее всего, стал занос инокулюма из Омской обл. Вторичная инфекция была смешанного происхождения с преобладанием рас алтайской популяции. Кроме того, сходство доминантных рас в образцах P. graminis f. sp. tritici c восприимчивого сорта Чернява 13 также указало на преимущество восточного вектора перемещения инокулюма: раса TKRPF была зарегистрирована в Омской обл. в июле, а в Новосибирской обл. она была обнаружена только в августе.
Если использовать признак вирулентности для определения границ популяций возбудителя стеблевой ржавчины, что принято по отношению к бурой ржавчине (Mikhaylova, 1983), обращает на себя внимание значительная степень миграции патогена на территории Российской Федерации. Так, в образцах инфекции из Московской, Омской и Новосибирской областей, Алтайского края, а также в северокавказской популяции с высокой частотой представлены клоны, вирулентные к линям с генами Sr9g, Sr10, Sr38, не выявлено вирулентности к Sr31 и обнаруживается низкая частота вирулентности к Sr30 и Sr24 (табл. 3). Важно отметить, что ген Sr24 в условиях Китая уже не эффективен (Li et al., 2018). Напротив, неэффективный к образцам популяций европейской и азиатской части РФ ген Sr38 все еще обеспечивает в Казахстане и Китае надежную защиту сортов пшеницы от стеблевой ржавчины (Koishybaev, 2018; Li et al., 2018).
Таблица 3.
Вирулентность образцов популяций Puccinia graminis f. sp. tritici из различных регионов РФ, а также соседних стран
| Регион | Высокая частота вирулентности к генам (свыше 25%) | Низкая частота вирулентности (10–25%) | Авирулентность | Ссылка |
|---|---|---|---|---|
| Новосибирская обл. | Sr5, Sr9a, Sr9b, Sr9d, Sr9g, Sr10, Sr17, Sr38, SrMcN | Sr6, Sr7b, Sr8a, Sr9e, Sr21, Sr36, SrTmp | Sr11, Sr24, Sr30, Sr31 | Данное исследование |
| Омская обл. | Sr5, Sr6, Sr7b, Sr8a, Sr9a, Sr9b, Sr9d, Sr9e, Sr9g, Sr10, Sr17, Sr21, Sr36, Sr38, SrMcN, SrTmp | Sr11, Sr30 | Sr24, Sr31 | Shamanin et al. (2019) |
| Алтайский край | Sr5, Sr8a, Sr9a, Sr9d, Sr9e, Sr9g, Sr10, Sr17, Sr21, Sr36, Sr38, SrMcN | Sr7b, Sr9b, Sr11, SrTmp | Sr24, Sr30, Sr31 | Shamanin et al. (2019) |
| Московская обл. | Sr9b, Sr9g, Sr10, Sr11, Sr38 | Sr5, Sr6 Sr7b, Sr8а, Sr9a, Sr9d, Sr21, Sr24, Sr30, Sr36, SrTmp | Sr17, Sr31 | Kiseleva et al. (2017) |
| Северный Кавказ | Sr9d, Sr9g, Sr10, Sr17, Sr36 | Sr6, Sr8а, Sr24, Sr8a, Sr9b, Sr24, Sr30 | Sr5, Sr9a, 9e, Sr11, Sr31 | Sinyak, Volkova (2015) |
| Казахстан | Sr5, Sr6, Sr7b, Sr8а, Sr9b, Sr9g, Sr11, | Sr24, Sr30, Sr31, Sr38 | Koishybaev (2018) | |
| Китай | Sr5, Sr6, Sr7b, Sr8a, Sr9a, Sr9b, Sr9d, Sr9g, Sr10, Sr11, Sr24, SrMcN | Sr17, Sr30, Sr36, | Sr9e, Sr21, Sr31, Sr38 | Li et al. (2018) |
Нами уже отмечалось, что анализ вирулентности образцов P. graminis f. sp. tritici, проводимый в советское время (1940–80-е гг.), выявил относительное генетическое сходство географических популяций, что обнаруживается в целом и сейчас. Тем не менее, при сопоставлении рас (рис. 2) и анализе вирулентного состава образцов инфекции (табл. 3) можно сделать предварительный вывод о существовании обособленной азиатской популяции P. graminis f. sp. tritici на территории Западной Сибири и Алтайского края, которая отличается высокой вирулентностью к генам Sr5, Sr8a, Sr9a. Гены Sr6, Sr7b, Sr8a, Sr9b, Sr9e, Sr11, Sr21, Sr30 и Sr36 являются дифференцирующими для географических популяций из Северного Кавказа, центральноевропейского региона страны и Западной Сибири, что позволяет и дальше использовать северо-американский набор тестерных линий пшеницы (Pgt differential set) для характеристики отечественных образцов инфекции.
ЗАКЛЮЧЕНИЕ
Таким образом, анализ образцов возбудителя стеблевой ржавчины пшеницы, проведенный в условиях GRRC и в лаборатории молекулярной фитопатологии ФИЦ ИЦиГ СО РАН, позволил выявить сложный расовый состав локальной популяции Новосибирской обл. с доминирующими патотипами TKRPF, QCRSF, QCHSF. Важно отметить отсутствие заноса в регион агрессивной расы Ug99: в составе локальной популяции Новосибирской обл. не выявлено ни одного патотипа из семейства агрессивной расы.
Результаты сравнения расового состава позволяют говорить об омской и алтайской субпопуляциях с независимыми источниками генетического разнообразия и зоной соприкосновения и перемешивания на пшеничных посевах Новосибирской обл. Вероятно, наибольшее значение на формирование структуры новосибирской популяции имеет инокулюм омского происхождения, что можно заключить из сходства доминантных рас в образцах P. graminis f. sp. tritici, собранных в этих областях. Однако, нельзя исключать эффект случайной выборки при сборе материала. Поэтому, для составления более точного суждения о географическом распределении популяций P. graminis f. sp. tritici, необходимо проведение широкомасштабного анализа вирулентности образцов популяций в унифицированных условиях, соответствующих международным стандартном GRRC с привлечением данных генотипирования с помощью нейтральных ДНК маркеров: микросателлитных маркеров SSR (simple sequence repeats) и однонуклеотидных полиморфизмов SNP (single nucleotide polymorphisms). Подобный анализ выполнен Е.И. Гультяевой с целью охарактеризовать российские популяции возбудителя бурой ржавчины P. triticina: показана их дифференциация на европейскую, азиатскую и кавказскую группу со слабым генным потоком между азиатской и европейской (Gultyaeva et al., 2017). Кроме того, необходимо привлечение молекулярных маркеров для изучения местного источника инфекции стеблевой ржавчины в Новосибирской обл., который, по предварительным данным, в регионе исключается.
Стратегия селекции сортов должна решать задачу опережения развития болезни в регионе. На обширной территории Западной Сибири, представленной областями с различными агроклиматическими показателями, создаются условия для существования независимых патогенных популяций возбудителя стеблевой ржавчины со специфическими путями миграции (в восточном и северном направлениях) и все еще не выясненными источниками возобновления инфекции. Так, обозначенная вероятность смешанного происхождения популяции P. graminis f. sp. tritici, формирующейся на производственных посевах пшеницы в Новосибирской обл., определяет необходимость ориентироваться на фитопатологические сводки по расовому составу популяций Омской обл. и Алтайского края. Соответственно, гены Sr11, Sr24, Sr30 и Sr31 могут быть рекомендованы как эффективные против возбудителя стеблевой ржавчины в условиях северной лесостепи Приобья. Для создания сортов с длительной устойчивостью используется стратегия объединения в одном генотипе генов, отвечающих за разный тип устойчивости. Пирамидирование генов ювенильной устойчивости (Sr11, Sr24, Sr30 и Sr31) с геном возрастной устойчивости Sr2, обусловливающим замедленное развитие болезни “slow rusting”, будет обеспечивать более продолжительную защиту посевов пшеницы от стеблевой ржавчины в Новосибирской обл. в условиях сложившейся фитосанитарной ситуации.
Авторы выражают благодарность руководителю Всемирного справочного центра ржавчины доктору М. Ховмёллеру (Dr. Mogens Hovmøller) за возможность анализа материала в условиях центра, а также сотруднику лаборатории изучения стеблевой ржавчины доктору М. Патпоуру (Dr. Mehran Patpour) за непосредственное руководство работами с патогеном. Работа поддержана РФФИ № 17-29-08018 и бюджетным проектом № 0259-2019-0001.
Список литературы
Barmenkov A.S. Identification of Puccinia graminis f. sp. tritici physiological races. Doklady Vsesoyuznoy Akademii selskokhozyaystvennykh nauk imeni Lenina. 1939. V. 10. P. 20–22 (in Russ.).
Cotter R.V., Roberts B.J. Synthetic hybrids of two varieties of Puccinia graminis. Phytopathology. 1963. V. 53. P. 344–346.
Gultyaeva E.I., Aristova M.K., Shaydyuk E.L., Mironenko N.V., Kazartsev I.A., Akhmetova A., Kosman E. Genetic differentiation Puccinia triticina Erikss. at Russian territory. Genetika. 2017. V. 53 (9). P. 1057–1060. https://doi.org/10.7868 / S0016675817070037 (in Russ.).
Jin Y., Szabo L.J., Pretorius Z.A., Singh R.P., Ward R., Fetch T. Detection of virulence to resistance gene Sr24 within race TTKS of Puccinia graminis f. sp. tritici. Plant Diseases. 2008. V. 92 (6). P. 923–926. https://doi.org/10.1094/PDIS-92-6-0923
Johnson T. Variation in the rusts of cereals. Biol. Rev. 1953. V. 28 (2). P. 105–157.
Johnson T., Newton M. Specialization, hybridization and mutation in the cereal rusts. The Botanical Review. 1946. V.12 (6). P. 337–392.
Katsuya K., Green G.J. Reproductive potentials of races 15B and 56 of wheat stem rust. Can. J. Bot. 1967. V. 45 (7). P. 1077–1091.
Kelbin V., Skolotneva E., Vidich S., Salia E. Stem rust infection in Novosibirsk Region: life cycle and origin. In: Proceedings of the international XVIII Congress of European Mycologists, Warsaw and Białowieża, Poland. Warsaw, 2019, p. 128.
Kiseleva M.I., Kolomiets T.M., Skolotneva E.S., Vetrova M.A. The structure of stem rust populations on winter and spring wheat in the Moscow region in 2014–2017. In: Epidemics of plant diseases: monitoring, prognosis, control. Bolshiye Vyazemy, 2017, pp. 65–73 (in Russ.).
Koishybaev M. Wheat diseases. Ankara, 2018 (in Russ.).
Konovalova N.Ye. Distribution of wheat stalk races on the territory of the USSR. In: The results of the work of the IV All-Union conference on the immunity of agricultural plants. Kishenev, 1975, pp. 25–33 (in Russ.).
Leonard K.J., Szabo L.J. Stem rust of small grains and grasses caused by Puccinia graminis. Mol. Plant Pathol. 2005. V. 6 (2). P. 99–111. https://doi.org/10.1111/J.1364-3703.2004.00273.X
Li T.Y., Ma Y.C., Wu X.X., Chen S., Xu X.F., Wang H., Cao Y.Y., Xuan Y.X. Race and virulence characterization of Puccinia graminis f. sp. tritici in China. PLoS one. 2018. https://doi.org/10.1371/journal.pone.0197579
Luig N.H., Watson I.A. The role of wild and cultivated grasses in the hybridization of formae speciales of Puccinia graminis. Aust. J. Biol. Sci. 1972. V. 25 (2). P. 335–342.
Mikhaylova L.A. Genetics of phytopathogenic fungi populations. In: Variability of phytopathogenic micro-organisms. Moscow, 1983. P. 39–51 (in Russ.).
Park R., Fetch T., Hodson D., Jin Y., Nazari K., Prashar M., Pretorius Z. International surveillance of wheat rust pathogens: progress and challenges. Euphytica. 2011. V. 179 (1). P. 109–117. https://doi.org/10.1007/s10681-011-0375-4
Pretorius Z. Practical exercise in infection type scoring and pathotype identification. In: The Science Media Production Center at Cornell. https://www.youtube.com/watch?v=JPas0agufGM#action=share. Accessed 25.04.2017.
Rassadina E.G. The race composition of wheat stem rust and its significance for practical selection. PhD. Thesis. Leningrad, 1965 (in Russ.).
Roelfs A.P., Martens J.W. An international system of nomenclature for Puccinia graminis f. sp. tritici. Phytopathology. 1988. V. 78 (5). P. 526–533.
Roelfs A.P., Singh R.P., Saari E.E. Rust diseases of wheat: concepts and methods of disease management. Mexico, 1992. P. 81.
Rsaliyev A.S., Rsaliyev S.S. Principal approaches and achievements in studying race composition of wheat stem rust. Vavilovskiy zhurnal genetiki i selektsii. 2018. V. 22 (8). P. 967–977 (in Russ.).https://doi.org/10.18699/VJ18.439
Shamanin V.P., Gultyaeva E.I., Shaydyuk E.L., Petukhovsky S.L., Pototskaya I.V., Levina S.I. Monitoring the virulence of the P. triticina fungus populations on the OMGAU experimental field. Bulleten Altayskogo gosudarstvennogo agrarnogo universiteta. 2015. N 5. P. 70–75 (in Russ.).
Shamanin V.P., Zelenskiy Y., Kokhmetova A., Patpour M., Hovmøller M., Olivera P., Szabo L., Jin Y., Meyer M., Gilligan C., Hort M., Hodson D., Morgunov A. Large scale wheat stem rust outbreaks in Western Siberia/Northern Kazakhstan in 2015–2017. In: Bourlaug Global Rust Initiative 2018. Morocco, 2018.
Sinyak E.V., Volkova G.V. Distribution and virulence of the population of pathogen Puccinia graminis Pers. f. sp. tritici Erikss. et Henn. in the south of Russia. Molodoy uchenyy. 2015. N 9. P. 70–71 (in Russ.).
Skolotneva E.S., Lekomtseva S.N., Kosman E. The wheat stem rust pathogen in the central region of the Russian Federation. Plant Pathol. 2013. V. 62. P. 1003–1010. https://doi.org/10.1111/ppa.12019
Skolotneva E.S., Salina E.A. Features of the causative agent of wheat stem rust in the conditions of Western Siberia. In: Protection of grain crops from diseases, pests, weeds: achievements and problems. Bolshiye Vyazemy, 2016, pp. 67–71 (in Russ.).
Sochalova L.P., Lihenko I.E. Genetic diversity of spring wheat for resistance to migratory diseases. Novosibirsk, 2015 (in Russ.).
Stakman E., Harrar J. Basics of plant pathology. Moscow, 1959 (in Russ.).
Volkova V.T. The composition of populations of the causative agent of stem rust of cereals Puccinia graminis Pers. in the middle and lower Volga. Cand. thesis. Moscow, 1978 (in Russ.).
Watson I.A., Luig N.H. Progressive increase in virulence in Puccinia graminis f. sp. tritici. Phytopathology. 1968. V. 58 (1). P. 70–73.
Watson I.A., Luig N.H. Somatic hybridization in Puccinia graminis var. tritici. Proc. Linn. Soc. N.S.W. 1958. V. 83. P. 190–195.
Барменков А.С. (Barmenkov) Выявление физиологических рас Puccinia graminis f. sp. tritici physiological races // Докл. ВАСХНИЛ. 1939. Т. 10. С. 20–22.
Волкова В.Т. (Volkova) Состав популяции возбудителя стеблевой ржавчины зерновых культур Puccinia graminis Pers. в Среднем и Нижнем Поволжье. Дисс. … канд. биол. наук. М., 1978. 188 с.
Гультяева Е.И., Аристова М.К., Шайдаюк Е.Л. и др. (Gultiaeva et al.) Генетическая дифференциация Puccinia triticina Erikss. по микросателлитным локусам на территории России // Генетика. 2017. № 9. С. 1053–1060.
Киселева М.И., Коломиец Т.М., Сколотнева Е.С. и др. (Kiseleva et al.) Структура популяции стеблевой ржавчины пшеницы на посевах озимой и яровой пшеницы в Московской области в 2014–2017 гг. // Материалы международной конференции “Эпидемии болезней растений: мониторинг, прогноз, контроль”. Большие Вяземы, 2017. С. 65–73.
Койшыбаев М. (Koishybaev) Болезни пшеницы. Анкара, 2018. 365 с.
Коновалова Н.Е. (Konovalova) Распространение рас стеблевой ржавчины пшеницы на территории СССР // Итоги работы IV Всесоюзного совещания по иммунитету с.-х. растений. Т. 2. Кишинев, 1966. С. 25–33.
Михайлова Л.А. (Mikhailova) Генетика популяций фитопатогенных грибов // Изменчивость фитопатогенных микроорганизмов. Л., 1983. С. 39–51.
Рсалиев А.С., Рсалиев Ш.С. (Rsaliev et al.) Основные подходы и достижения в изучении расового состава стеблевой ржавчины пшеницы // Вавиловский журнал генетики и селекции. 2018. Т. 22. № 8. С. 967–977.
Синяк Е.В., Волкова Г.В. (Sinyak, Volkova) Распространение и вирулентность популяции возбудителя Puccinia graminis Pers. f. sp. tritici Erikss. et Henn. на юге России // Молодой ученый. 2015. Т. 9. С. 70–71.
Сколотнева Е.С., Салина Е.А. (Skolotneva, Salina) Особенности возбудителя стеблевой ржавчины пшеницы в условиях Западной Сибири // Материалы международной конференции “Защита зерновых культур от болезней, вредителей, сорняков: достижения и проблемы”. Большие Вяземы, 2017. С. 67–71.
Сочалова Л.П., Лихенко И.Е. (Sochalova, Lihenko) Генетическое разнообразие яровой пшеницы по устойчивости к мигрирующим заболеваниям. Новосибирск, 2015. 196 с.
Стэкмэн Э., Харрар Дж. (Stakman, Harrar) Основы патологии и растений. М., 1959. 540 с.
Шаманин В.П., Гультяева Е.И., Шайдаюк Е.Л. и др. (Shamanin et al.) Мониторинг вирулентности популяций гриба P. triticina на опытном поле ОмГАУ // Вестник Алтайского государственного аграрного университета. 2015. Т. 5. С. 70–75.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


