Микология и фитопатология, 2020, T. 54, № 4, стр. 254-263
Накопление хрома плодовыми телами агарикомицетов в условиях Пензенской области
А. И. Иванов 1, *, К. А. Дурягина 2, **
1 Пензенский государственный аграрный университет
440011 Пенза, Россия
2 Федеральное управление по безопасному хранению и уничтожению химического оружия Министерства обороны РФ
427711 Кизнер, Россия
* E-mail: rcgkim@mail.ru
** E-mail: k.duryagina@mail.ru
Поступила в редакцию 05.02.2020
После доработки 12.03.2020
Принята к публикации 11.05.2020
Аннотация
Изучено содержание хрома в пробах плодовых тел 80 видов дикорастущих агарикомицетов и 5 видов культивируемых грибов, отобранных на территории Пензенской обл. с 2015 по 2019 гг. В результате проведенных измерений было установлено, что грибы различных трофических групп накапливают хром неодинаково. Наиболее активными концентраторами этого элемента являются ксилотрофы. За ними следуют напочвенные сапротрофы и симбиотрофы. Они накапливают его в несколько меньших количествах. По содержанию хрома плодовые тела отдельных видов агарикомицетов отличаются друг от друга. Наибольшие различия между минимальными и максимальными значениями были отмечены для ксилотрофов. В наибольших количествах хром накапливали виды с мясистыми плодовыми телами агарикоидного типа, в наименьших – трутовые грибы с многолетними плодовыми телами. Среди напочвенных сапротрофов подстилочные сапротрофы накапливают хром активней, чем гумусовые. Средняя величина КН для первых составила 0.93, а для последних всего 0.29. Съедобные грибы представляют собой богатый хромом пищевой продукт, существенно превосходящий по этому показателю продукты растительного происхождения. Как показали результаты измерений, хром распределяется в плодовых телах агарикомицетов неравномерно. Максимальное его количество концентрируется в гименофоре, минимальное – в траме ножки. Трама шляпки по этому показателю занимает промежуточное положение.
ВВЕДЕНИЕ
Хром (Cr) – жизненно важный микроэлемент. Его соединения являются постоянной составной частью живых клеток (Ermakov, Tyutikov, 2008; Reutina, 2009; Lukin, 2011). Однако наряду с полезными свойствами рассматриваемый элемент в количествах, превышающих потребность живых организмов, проявляет острую токсичность (Chernyh et al., 1999).
Накопление Cr в плодовых телах агарикомицетов изучено значительно слабее, чем других тяжелых металлов (Cd, Cu, Zn, Hg, Pb). Проблема его биологической аккумуляции грибами рассматриваемой группы затрагивается в ограниченном круге работ российских и зарубежных ученых (Isidak et al., 2004; Malinowska et al., 2004; Ivanov, Kostychev, 2007; Ivanov et al., 2008; Kostychev, 2009; Stihi et al., 2011; Şen et al., 2012; Sibirkina, 2012; Širić et al., 2014; Koroleva, Ohrimenko, 2015).
Цель настоящей работы – изучение закономерностей биологической аккумуляции Cr агарикомицетами. В ходе ее выполнения ставились задачи: 1) изучить закономерности накопления Cr грибами различных трофических групп; 2) определить характер накопления Cr в плодовых телах важнейших видов дикорастущих и культивируемых съедобных грибов; 3) исследовать распределение содержания Cr в плодовых телах агарикомицетов.
МАТЕРИАЛЫ И МЕТОДЫ
Материалом для данной работы послужили плодовые тела агарикомицетов и питающие субстраты этих грибов, отбиравшиеся на территории Пензенской обл. РФ с 2015 по 2019 гг. Схема расположения мест отбора проб планировалась таким образом, чтобы в нее вошли основные экотопы и лесные сообщества, свойственные рассматриваемой части Приволжской возвышенности (рис. 1). Для выяснения закономерностей накопления Cr агарикомицетами различных трофических групп было исследовано по 20 наиболее распространенных видов симбиотрофов, ксилотрофов и напочвенных сапротрофов. Для изучения содержания рассматриваемого элемента в съедобных грибах были проанализированы плодовые тела 20 видов, наиболее широко заготавливаемых населением и пяти основных видов, выращиваемых в культуре. Плодовые тела Agaricus bisporus и Pleurotus ostreatus, а также их субстраты отбирались на грибоводческих предприятиях Пензенской обл. Такие грибы, как Cyclocybe aegerita, Hericium erinaceus, Lentinula edodes выращивались в лаборатории микологии Пензенского государственного аграрного университета на стерильных субстратах, состоящих из измельченной древесины с добавлением зерна пшеницы, мела и гипса.
Пензенская обл. располагается в 600 км к юго-западу от Москвы в пределах лесостепной зоны правобережного Поволжья. Климат района исследований – умеренно-континентальный. Средняя температура июля составляет 19–19.5°С, января – –12.5–13°С. Количество осадков в разных районах области составляет от 300 до 650 мм в год. Рельеф территории равнинный с сильным эрозионным расчленением. В почвенном покрове преобладают серые лесные почвы и выщелоченные черноземы. Материнские породы, подстилающие их, представлены песками, опоками, бескарбонатными и карбонатными глинами. Растительность имеет типичный лесостепной облик. Леса представлены отдельными массивами различных размеров, которые окружены сельскохозяйственными угодьями. На светло-серых лесных почвах, подстилаемых опоками и песками, формируются различные типы сосновых лесов: сложные сосняки с липой и дубом, сосняки зеленомошные, лишайниковые и черничные. На темно-серых лесных почвах, подстилаемых бескарбонатными и карбонатными глинами, а также в долинах рек распространены широколиственные леса. Значительные площади занимают также вторичные типы леса – березняки и осинники (Ivanov et al., 2017).
Серые лесные супесчаные и песчаные почвы под лесными массивами, где производился отбор проб грибов для анализа, в районе исследований бедны Cr. Его среднее содержание в них составляет всего 3.36 мг/кг, что в 59 раз ниже кларка валового содержания хрома в почвах мира (Vinogradov, 1957) и в 48 раз ниже, чем в темно-серых лесных суглинистых почвах Центрального Черноземья (Protasova, Shcherbakova, 2003).
Лабораторные исследования осуществлялись на базе научно-исследовательской лаборатории филиала ФБУ “Федеральное управление по безопасному хранению и уничтожению химического оружия” (№ РОСС СОБ 00029, 2017).
Плодовые тела грибов для анализов очищали от пыли и частиц почвы, нарезали широкими пластинами и сушили в электрической сушилке в потоке воздуха при температуре 50–70°С. Высушенные и измельченные образцы грибов хранили в банках с притертыми пробками. Перед проведением химического анализа определяли влажность образца, для последующего пересчета результатов на абсолютно сухое вещество. Тигель с навеской помещали в сушильный шкаф, доводя его температуру до 150°С, либо на электрическую плитку и удаляли влагу. Затем осторожно обугливали содержимое тигля на электрической плитке до прекращения выделения дыма, не допуская сильного дымления, воспламенения и выбросов. Тигель помещали в электропечь, отрегулированную ранее на температуру около 250°С. После окончания обугливания минерализацию проб проводили в электропечи, постепенно повышая температуру до 450°С до получения серой золы.
Охлажденную до комнатной температуры золу смачивали азотной кислотой, выпаривали на водяной бане и досушивали на электроплитке со слабым нагревом. Затем помещали ее в электропечь, доводили температуру до 300°С и выдерживали 30 мин. Минерализацию считали законченной, когда зола приобретала белый цвет и не содержала обугленных частиц.
Измерения проводили на атомно-адсорбционном спектрометре МГА-915 МД и “Квант-2АТ”, согласно методике определения токсичных элементов в пищевых продуктах и пищевом сырье (MU № 01-19/47-11, 1992). При статистической обработке данных проводился расчет стандартной ошибки средней арифметической в программе Microsoft Excel.
Определение собранных образцов грибов проводилось общепринятыми методами (Мoser, 1978; Funga Nordica, 2012). Актуальность названий грибов выверялась в соответствии с базой данных Index Fungorum (2019).
Способность накапливать в плодовых телах тот или иной химический элемент у разных видов агарикомицетов выражена неодинаково. Для ее количественной оценки нами использовался такой показатель, как коэффициент накопления (КН) – отношение содержания элемента в плодовом теле к его содержанию в питающем субстрате. Если КН оказывается выше 1, то есть концентрация химического элемента в плодовом теле превышает таковую в субстрате, на котором развивался гриб, значит он является концентратором рассматриваемого элемента (Ivanov et al., 2008).
РЕЗУЛЬТАТЫ
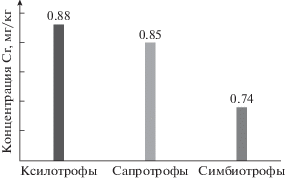
Как показали результаты измерений, представители различных трофических групп агарикомицетов накапливают Cr неодинаково. Самые высокие концентрации рассматриваемого элемента были определены в плодовых телах ксилотрофов, самые низкие – симбиотрофов. Напочвенные сапротрофы по данному показателю заняли промежуточное положение (рис. 2).
В накоплении Cr отдельными видами агарикомицетов были зафиксированы определенные различия. Минимальная концентрация была зафиксирована для Fomes fomentarius, максимальная для Schizophyllum commune (табл. 1). Максимальное значение содержания рассматриваемого элемента в плодовых телах превысило минимальное в 24 раза. Коэффициент вариации составил 66.51%.
Таблица 1.
Содержание Cr в плодовых телах и субстратах ксилотрофов, мг/кг
| Объект исследования | Содержание Cr | КН | |
|---|---|---|---|
| в плодовых телах | в субстратах | ||
| Bjerkandera adusta (Willd.) P. Karst. | 0.35 ± 0.012 | 0.83 ± 0.012 | 0.422 |
| Daedaleopsis confragosa (Bolton) J. Schröt. | 0.16 ± 0.012 | 0.83 ± 0.012 | 0.193 |
| Datronia mollis (Sommerf.) Donk | 0.68 ± 0.023 | 0.30 ± 0.012 | 2.266 |
| Flammulina velutipes (Curtis) Singer | 0.48 ± 0.006 | 0.30 ± 0.015 | 1.600 |
| Fomes fomentarius (L.) Fr. | 0.09 ± 0.017 | 0.83 ± 0.017 | 0.108 |
| Fomitopsis betulina (Bull.) B.K. Cui, M.L. Han et Y.C. Dai | 1.09 ± 0.015 | 0.83 ± 0.012 | 1.313 |
| F. pinicola (Sw.) P. Karst. | 0.49 ± 0.023 | 0.83 ± 0.012 | 0.590 |
| Ganoderma applanatum (Pers.) Pat. | 0.84 ± 0.012 | 0.57 ± 0.012 | 1.474 |
| Hypholoma lateritium (Schaeff.) P. Kumm. | 0.06 ± 0.012 | 0.45 ± 0.012 | 0.133 |
| Inonotus obliquus (Fr.) Pilát f. sterilis (Vanin) Baland. et Zmitr. | 0.76 ± 0.017 | 0.83 ± 0.012 | 0.916 |
| Kuehneromyces mutabilis (Schaeff.) Singer et A.H. Sm. | 1.14 ± 0.012 | 0.57 ± 0.012 | 2.000 |
| Laetiporus sulphureus (Bull.) Murrill | 0.95 ± 0.017 | 0.45 ± 0.006 | 2.111 |
| Mycena inclinata (Fr.) Quél. | 1.66 ± 0.006 | 0.45 ± 0.006 | 3.689 |
| Panellus stipticus (Bull.) P. Karst. | 0.82 ± 0.012 | 0.45 ± 0.006 | 1.822 |
| Pleurotus cornucopiae (Paulet) Rolland | 1.27 ± 0.006 | 0.59 ± 0.017 | 2.152 |
| P. ostreatus (Jacq.) P. Kumm. | 1.21 ± 0.009 | 0.59 ± 0.017 | 2.051 |
| P. pulmonarius (Fr.) Quél. | 1.02 ± 0.006 | 0.59 ± 0.017 | 1.729 |
| Pluteus cervinus (Schaeff.) P. Kumm. | 1.84 ± 0.017 | 0.83 ± 0.012 | 2.217 |
| Schizophyllum commune Fr. | 2.23 ± 0.015 | 0.57 ± 0.012 | 3.912 |
| Trametes versicolor (L.) Lloyd | 0.39 ± 0.023 | 0.83 ± 0.012 | 0.469 |
Агарикомицеты, относящиеся к трофической группе ксилотрофов, являются активными накопителями Cr. Из 20 изученных видов шесть имели КН более 1, пять – более 2 и один – более 3. Наиболее активно накапливали рассматриваемый элемент ксилотрофы с сочными короткоживущими плодовыми телами агарикоидного типа. КН накопления менее 1 имел только один вид – Hypholoma lateritium. У остальных видов содержание Cr в плодовых телах было более высоким, чем в питающих субстратах. Максимальный КН – 3.689 – был зафиксирован для Mycena inclinata. Среднее содержание Cr в плодовых телах этой жизненной формы ксилотрофов составляло 1.055 мг/кг.
Виды с однолетними плодовыми телами кожистой или пробковой консистенции накапливали Cr менее активно. Из шести изученных видов этой жизненной формы только три имели КН больше единицы. Среднее содержание Cr в их плодовых телах составляло 0.835 мг/кг. Минимальные значения были определены для Daedaleopsis confragosa, максимальные – для Schizophyllum commune.
Наименьшее количество Cr содержали виды с многолетними плодовыми телами. Из пяти изученных видов КН превышал 1 только у Ganoderma applanatum. Среднее содержание Cr в плодовых телах этих грибов составляло 0.545 мг/кг.
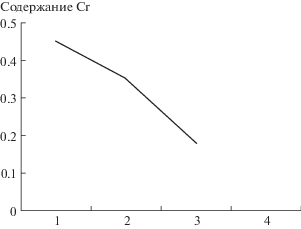
Дереворазрушающие грибы активно извлекают Cr из питающего субстрата. В ходе исследований нами было определено содержание рассматриваемого элемента в свежей древесине дуба и древесине этой породы, находящейся на разных стадиях разложения. К древесным субстратам первой фазы разложения нами был отнесен валежник, частично утративший механическую прочность, но сохранивший структуру древесины. Ко второй фазе разложения был отнесен отпад, который утратил механическую прочность и потерял структуру. В процессе микогенного разложения древесины содержание Cr уменьшается (рис. 3). Этим можно объяснить причины отмеченных выше различий в характере накопления рассматриваемого элемента ксилотрофами, имеющими различные типы плодовых тел. Так виды с многолетними плодовыми телами питаются главным образом древесиной живых деревьев и свежего отпада, содержащей максимальное количество микроэлементов, т.е. их развитие происходит на фоне достаточной обеспеченности Cr. Большинство видов с однолетними плодовыми телами осуществляют первую фазу микогенного разложения древесины и на фоне обеднения субстрата в плане содержания рассматриваемого элемента начинают запасать его, в связи с чем КН у них становятся более высокими. Ксилотрофы с сочными короткоживущими плодовыми телами агарикоидного типа завершают процесс микогенного разложения древесины. Они продолжают свое развитие на субстратах с минимальным содержанием Cr, в то время как большинство видов трутовиков с многолетними и однолетними плодовыми телами на этой стадии сукцессии уже выпадают. Вероятно, в связи с этим ксилотрофы с сочными короткоживущими плодовыми телами агарикоидного типа имеют наибольшие КН, благодаря чему они запасают в мицелии этот важный для их жизнедеятельности элемент в необходимом количестве.
Рис. 3.
Содержание Cr в древесине дуба, находящейся на разных стадиях разложения: 1 – свежая древесина; 2 – древесина, частично утратившая механическую прочность, но сохранившая структуру; 3 – древесина, утратившая механическую прочность и потерявшая структуру.
Как показали результаты измерений, различные виды напочвенных сапроторофов испытывают неодинаковую потребность в Cr и потому накапливают его в разных количествах (табл. 2). Наименьшие значения были определены для Chlorophyllum rhacodes и Macrolepiota procera, максимальные – для Agrocybe praecox и Infundibulicybe gigas. Максимальный показатель превысил минимальный в 7.6 раза. Коэффициент вариации составил 54.90%.
Таблица 2.
Содержание Cr в плодовых телах и субстратах напочвенных сапротрофов, мг/кг
| Виды грибов | Содержание Cr | КН | |
|---|---|---|---|
| в плодовых телах | в субстратах | ||
| Agaricus abruptibulbus Peck | 1.41 ± 0.017 | 4.30 ± 0.006 | 0.328 |
| A. arvensis Schaeff. | 0.44 ± 0.017 | 4.50 ± 0.017 | 0.098 |
| A. bitorquis (Quél.) Sacc. | 0.73 ± 0.012 | 8.50 ± 0.012 | 0.086 |
| Agrocybe praecox (Pers.) Fayod | 1.60 ± 0.017 | 4.30 ± 0.018 | 0.372 |
| Bovista plumbea Pers. | 0.52 ± 0.006 | 2.80 ± 0.017 | 0.186 |
| Bovistella utriformis (Bull.) Demoulin et Rebriev | 0.76 ± 0.017 | 8.50 ± 0.012 | 0.089 |
| Chlorophyllum rhacodes (Vittad.) Vellinga | 0.21 ± 0.006 | 8.50 ± 0.012 | 0.025 |
| Clitocybe nebularis (Batsch) P. Kumm. | 0.66 ± 0.017 | 0.89 ± 0.029 | 0.741 |
| C. odora (Bull.) P. Kumm. | 1.21 ± 0.017 | 0.89 ± 0.029 | 1.359 |
| Gymnopus peronatus (Bolton) Gray | 0.38 ± 0.023 | 0.89 ± 0.029 | 0.427 |
| Infundibulicybe gibba (Pers.) Harmaja | 1.11 ± 0.006 | 0.89 ± 0.029 | 1.247 |
| I. gigas (Harmaja) Harmaja | 1.46 ± 0.029 | 0.89 ± 0.029 | 1.640 |
| Lepista nuda (Bull.) Cooke | 0.43 ± 0.006 | 0.89 ± 0.029 | 0.483 |
| L. personata (Fr.) Cooke | 1.38 ± 0.012 | 5.60 ± 0.006 | 0.246 |
| Lycoperdon perlatum Pers. | 0.79 ± 0.012 | 0.58 ± 0.023 | 1.362 |
| Macrolepiota procera (Scop.) Singer | 0.28 ± 0.012 | 0.89 ± 0.029 | 0.315 |
| Marasmius oreades (Bolton) Fr. | 0.38 ± 0.029 | 5.60 ± 0.006 | 0.070 |
| Mycetinis scorodonius (Fr.) A.W. Wilson et Desjardin | 0.36 ± 0.012 | 0.35 ± 0.014 | 1.029 |
| Paralepista flaccida (Sowerby) Vizzini | 0.80 ± 0.029 | 0.89 ± 0.029 | 0.899 |
| Rhodocollybia butyracea (Bull.) Lennox | 1.05 ± 0.006 | 0.89 ± 0.029 | 1.180 |
Большинство изученных видов, относящихся к трофической группе напочвенных сапротрофов, не являются активными накопителями Cr. Из 20 изученных видов только шесть имели КН более 1. Для остальных определенные нами значения содержания Cr в плодовых телах было значительно меньше, чем в питающих субстратах.
Напочвенные сапротрофы осуществляют поэтапное разложение листового опада в лесных экосистемах, в связи с чем их обычно подразделяют на подстилочных и гумусовых сапротрофов. Первые осуществляют разложение лесной подстилки, составляющей почвенный горизонт А0, мицелий вторых развивается в гумусовом горизонте А1. Как показали результаты измерений, среднее содержание Cr в плодовых телах подстилочных и гумусовых сапротрофов выражается близкими значениями. Однако КН у подстилочных сапротрофов КН оказываются более высокими. Это связано с тем, что лесная подстилка содержит значительно меньше Cr, чем гумусовый горизонт, и, чтобы обеспечить потребность в нем, подстилочные сапротрофы концентрируют рассматриваемый элемент более активно.
Как показали результаты измерений, различные виды симбиотрофов испытывают не одинаковую потребность в Cr и потому накапливают его в разных количествах (табл. 3). Минимальные значения были определены для Lactarius rufus и Cortinarius triumphans максимальные – для Amanita pantherina и A. phalloides. Максимальный показатель превысил минимальный в 5.27 раза. Коэффициент вариации составил 49.21%.
Таблица 3.
Содержание Cr в плодовых телах симбиотрофов и почве, мг/кг
| Виды грибов | Содержание Cr | КН | |
|---|---|---|---|
| в плодовых телах | в почве | ||
| Amanita citrina Pers. | 0.46 ± 0.017 | 2.40 ± 0.061 | 0.192 |
| А. muscaria (L.) Lam. | 0.90 ± 0.017 | 3.30 ± 0.012 | 0.273 |
| А. pantherina (DC.) Krombh. | 1.38 ± 0.012 | 2.40 ± 0.012 | 0.575 |
| А. phalloides (Vaill. ex Fr.) Link | 1.74 ± 0.017 | 4.20 ± 0.006 | 0.414 |
| А. rubescens Pers. | 0.75 ± 0.006 | 3.30 ± 0.006 | 0.227 |
| Cortinarius triumphans Fr. | 0.39 ± 0.009 | 4.20 ± 0.017 | 0.093 |
| Imleria badia (Fr.) Vizzini | 0.66 ± 0.012 | 2.50 ± 0.012 | 0.264 |
| Lactarius piperatus (L.) Pers. | 0.60 ± 0.035 | 4.50 ± 0.023 | 0.133 |
| L. quietus (Fr.) Fr. | 0.71 ± 0.015 | 4.81 ± 0.006 | 0.148 |
| L. rufus (Scop.) Fr. | 0.33 ± 0.012 | 2.40 ± 0.023 | 0.137 |
| L. vellereus (Fr.) Fr. | 0.63 ± 0.006 | 4.50 ± 0.006 | 0.140 |
| Leccinum duriusculum (Schulzer ex Kalchbr.) Singer | 0.39 ± 0.023 | 4.20 ± 0.012 | 0.093 |
| Paxillus involutus (Batsch) Fr. | 0.46 ± 0.012 | 4.50 ± 0.023 | 0.102 |
| Russula adusta (Pers.) Fr. | 1.35 ± 0.012 | 2.90 ± 0.017 | 0.465 |
| Suillellus luridus (Schaeff.) Murrill | 0.76 ± 0.012 | 4.20 ± 0.006 | 0.181 |
| Suillus bovinus (L.) Roussel | 0.57 ± 0.012 | 2.40 ± 0.012 | 0.237 |
| Tricholoma populinum J.E. Lange | 0.62 ± 0.006 | 4.50 ± 0.029 | 0.138 |
| T. terreum (Schaeff.) P. Kumm. | 0.60 ± 0.012 | 2.50 ± 0.012 | 0.240 |
| Tylopilus felleus (Bull.) P. Karst. | 0.66 ± 0.017 | 3.30 ± 0.017 | 0.200 |
| Xerocomellus porosporus (Imler ex Watling) Šutara | 0.74 ± 0.012 | 2.90 ± 0.006 | 0.255 |
Среди изученных видов симбиотрофов не было выявлено видов концетраторов Cr, т.к. определенные для них КН были меньше 1.
В связи с тем, что Cr является важнейшим для здоровья человека микроэлементом, нами были проведены специальные исследования по изучению его содержания в основных видах дикорастущих и культивируемых съедобных грибов (табл. 4).
Таблица 4.
Содержание Cr в плодовых телах и субстратах дикорастущих съедобных грибов, мг/кг
| Виды грибов | Содержание Сr | КН | |
|---|---|---|---|
| в плодовых телах | в субстратах | ||
| Armillaria ostoyae (Romagn.) Herink | 0.37 ± 0.012 | 0.60 ± 0.017 | 0.617 |
| Boletus edulis Bull. | 0.97 ± 0.017 | 2.50 ± 0.012 | 0.388 |
| B. pinophilus Pilát et Dermek | 0.59 ± 0.007 | 2.50 ± 0.012 | 0.236 |
| B. reticulatus Schaeff. | 0.51 ± 0.007 | 4.20 ± 0.012 | 0.121 |
| Leccinum albostipitatum den Bakker et Noordel. | 0.62 ± 0.012 | 2.90 ± 0.006 | 0.214 |
| L. aurantiacum (Bull.) Gray | 0.54 ± 0.054 | 4.20 ± 0.012 | 0.128 |
| L. scabrum (Bull.) Gray | 0.59 ± 0.035 | 4.20 ± 0.012 | 0.140 |
| L. versipelle (Fr. et Hök) Snell | 0.35 ± 0.008 | 4.20 ± 0.012 | 0.083 |
| Suillus granulatus (L.) Roussel | 1.09 ± 0.005 | 2.90 ± 0.006 | 0.376 |
| S. luteus (L.) Roussel | 0.93 ± 0.017 | 2.90 ± 0.006 | 0.321 |
| Lactarius citriolens Pouzar | 1.01 ± 0.006 | 4.20 ± 0.012 | 0.240 |
| L. deliciosus (L.) Gray | 0.65 ± 0.023 | 4.50 ± 0.023 | 0.144 |
| L. necator (Bull.) Pers. | 0.65 ± 0.023 | 4.50 ± 0.023 | 0.144 |
| L. torminosus (Schaeff.) Gray | 0.73 ± 0.025 | 2.40 ± 0.023 | 0.304 |
| Russula chloroides (Krombh.) Bres. | 1.34 ± 0.008 | 2.50 ± 0.012 | 0.536 |
| R. foetens Pers. | 0.49 ± 0.006 | 3.80 ± 0.007 | 0.129 |
| R. pseudointegra Arnould et Goris | 0.48 ± 0.006 | 3.80 ± 0.007 | 0.126 |
| R. virescens (Schaeff.) Fr. | 0.61 ± 0.022 | 3.80 ± 0.007 | 0.160 |
| R. xerampelina (Schaeff.) Fr. | 0.81 ± 0.021 | 3.30 ± 0.006 | 0.245 |
| Tricholoma flavovirens (Bres.) Dennis | 0.75 ± 0.017 | 3.30 ± 0.006 | 0.227 |
Среднее содержание Cr в плодовых телах основных видов съедобных грибов района исследований составило 0.70 мг/кг. Наиболее богатыми изучаемым элементом оказались Lactarius citriolens, Suillus granulatus, Russula chloroides, для которых определенные в результате измерений концентрации превышали средний показатель в 1.4–1.9 раза. Минимальные значения, которые были ниже среднего показателя в 1.9–2 раза, были определены для Armillaria ostoyae и Leccinum versipelle. Содержание Cr в плодовых телах остальных изученных видов было близко к среднему показателю. Коэффициент вариации составил всего 36.11%.
Как показали результаты измерений, среднее содержание Cr в культивируемых грибах составляет 0.934 мг/кг, т.е. оно оказывается в 1.3 раза выше, чем в дикорастущих съедобных грибах (табл. 5). Это связано с тем, что большинство культивируемых грибов являются представителями трофической группы ксилотрофов, которые, как было показано выше, активней накапливают рассматриваемый элемент, по сравнению с симбиотрофами, к которым относится большинство наиболее распространенных дикорастущих съедобных грибов, кроме Armillaria ostoyae.
Таблица 5.
Содержание Cr в плодовых телах и субстратах культивируемых грибов, мг/кг
| Виды грибов | Содержание Сr | КН | |
|---|---|---|---|
| в плодовых телах | в субстратах | ||
| Agaricus bisporus (J.E. Lange) Imbach | 0.86 ± 0.012 | 2.02 ± 0.022 | 0.426 |
| Cyclocybe aegerita (V. Brig.) Vizzini | 0.99 ± 0.018 | 0.89 ± 0.013 | 1.112 |
| Hericium erinaceus (Bull.) Pers. | 0.98 ± 0.017 | 1.75 ± 0.006 | 0.560 |
| Lentinula edodes (Berk.) Pegler | 1.04 ± 0.006 | 0.93 ± 0.017 | 1.118 |
| Pleurotus ostreatus | 0.95 ± 0.016 | 1.13 ± 0.013 | 0.841 |
| Средний показатель | 0.96 | 1.34 | 0.811 |
Среди культивируемых грибов наиболее высоким содержанием Cr выделяется Lentinula edodes, наименьшая концентрация этого элемента определена для Agaricus bisporus.
Как показали результаты измерений, Cr распределяется в траме плодовых тел неравномерно. Максимальное его количество концентрируется в гименофоре, минимальное – в траме ножки. Трама шляпки по этому показателю занимает промежуточное положение. Эта закономерность проявилась у пяти изученных видов, относящихся к различным таксономическим и трофическим группам, и подтверждается результатами других исследователей (Kostychev, 2009). Вероятно, повышенное содержание Cr в гименофоре связано с тем, что он необходим для физиологических процессов, связанных с образованием спор. У молодых плодовых тел с незрелым гименофором такой разницы не наблюдается, содержание Cr оказывается на уровне средних показателей, т.е. перераспределение его концентраций происходит в процессе созревания плодовых тел. Табл. 6
Таблица 6.
Содержание Cr тяжелых в различных частях плодовых тел агарикомицетов, мг/кг
| Вид гриба | Часть плодового тела | Содержание Cr |
|---|---|---|
| Agaricus bitorquis | трама шляпки | 0.63 ± 0.018 |
| трама ножки | 0.47 ± 0.025 | |
| гименофор | 1.09 ± 0.015 | |
| Amanita muscaria | трама шляпки | 0.75 ± 0.062 |
| трама ножки | 0.59 ± 0.023 | |
| гименофор | 1.34 ± 0.014 | |
| Flammulina velutipes | трама шляпки | 0.38 ± 0.016 |
| трама ножки | 0.29 ± 0.011 | |
| гименофор | 0.78 ± 0.076 | |
| Lactarius deliciosus | трама шляпки | 0.55 ± 0.022 |
| трама ножки | 0.48 ± 0.024 | |
| гименофор | 0.92 ± 0.015 | |
| Leccinum aurantiacum | трама шляпки | 0.42 ± 0.023 |
| трама ножки | 0.39 ± 0.028 | |
| гименофор | 0.81 ± 0.012 |
ОБСУЖДЕНИЕ
В ходе проведенных исследований было установлено, что средняя концентрация рассматриваемого элемента в плодовых телах дикорастущих агарикомицетов в районе исследований составляет 0.78 мг/кг сухого вещества. Как показывает сравнение, полученная величина сопоставима с данными других исследователей. Так для причерноморских районов Турции она составляет 0.38 мг/кг (Isidak et al., 2004), для Калиниградской обл. – 1.7 мг/кг (Koroleva, Ohrimenko, 2015), для Семипалатинского Прииртышья – 4.34 (Sibirkina, 2012). Наибольший средний показатель – 6.13 мг/кг – приводится для центральных горных районов Турции (Şen et al., 2012). Максимальное же содержание Cr в плодовых телах агарикомицетов редко превышает 10 мг/кг (Sazanova et al., 2017). Таким образом, средние показатели содержания рассматриваемого элемента в плодовых телах грибов в различных исследованных районах могут отличаться в 10–20 раз.
Эти различия, с одной стороны, связаны с неодинаковым составом видов грибов в выборках, использованных для определения Cr, с другой – с сильной вариабельностью его концентраций в почвах различных геохимических провинций (Protasova, Shchcerbakova, 2003).
Как показал сравнительный анализ полученных данных, в характере накопления Cr агарикомицетами различных трофических групп имеются некоторые особенности. Так, ксилотрофы выделяются не только самым высоким содержанием рассматриваемого элемента в плодовых телах, но и являются наиболее активными его накопителями. Для них характерны более высокие КН по сравнению с таковыми для напочвенных сапротрофов и симбиотрофов. Кроме того, у дереворазрушающих грибов в наибольшей степени выражена видовая специфичность в плане накопления Cr, на что указывает самый высокий для изученных агарикомицетов коэффициент его вариации.
Важной особенностью биологической аккумуляции Cr, по сравнению с As, Cd, Hg, Pb и Zs137, является отсутствие среди грибов изучаемой группы суперконцетраторов этого элемента. Виды, у которых КН рассматриваемого металла более 5 среди изученных нами представителей класса агарикомицетов отсутствуют.
Среднее содержание Cr в плодовых телах основных видов съедобных грибов составило 0.70 мг/кг, что на 11% ниже среднего значения для агарикомицетов района исследований. В связи с тем, что содержание Cr в грибах не нормируется, было проведено сравнение определенных нами значений для съедобных грибов с таковыми для пищевых продуктов растительного происхождения (Kabata-Pendias, Pendias, 1987). Полученный в результате измерений средний показатель содержания Cr в съедобных грибах превышает в 3.5 раза содержание этого элемента в зерне пшеницы, в 3.3 – в картофеле, в 9.5 – в томатах, в 53 раза – в яблоках. Таким образом, съедобные грибы значительно богаче Cr, чем продукты растительного происхождения.
ЗАКЛЮЧЕНИЕ
Представители различных трофических групп агарикомицетов накапливают Cr неодинаково. Самые высокие концентрации рассматриваемого элемента были определены в плодовых телах ксилотрофов, самые низкие – симбиотрофов. Напочвенные сапротрофы по данному показателю заняли среднее положение.
Характер биологической аккумуляции Cr представителями различных жизненных форм дереворазрушающих грибов неодинаков. Наиболее активно накапливали рассматриваемый элемент ксилотрофы с сочными короткоживущими плодовыми телами агарикоидного типа. Виды с однолетними плодовыми телами кожистой или пробковой консистенции накапливали Cr менее активно. Наименьшее количество Cr содержали базидиомы видов с многолетними плодовыми телами.
Напочвенные сапротрофы являются менее активными накопителями Cr по сравнению с ксилотрофами. Из 20 изученных видов только шесть имели КН более 1. Для остальных показатели содержания Cr в плодовых телах были значительно меньше, чем в питающих субстратах.
Симбиотрофы не являются биоконцентраторами Cr. Среди изученных видов представителей данной трофической группы не было выявлено видов-концентраторов рассматриваемого элемента, т.к. определенные для них КН были меньше 1.
Содержания Cr в различных частях плодовых тел не одинаково. В гименофоре оно на 44–57% выше, чем в траме ножки, и на 43–49%, чем в траме шляпки. В связи с этим, во избежание ошибок, при подготовке проб для химического анализа следует использовать плодовые тела высушенные целиком.
Съедобные грибы относятся к категории богатых Cr пищевых продуктов. Содержание рассматриваемого элемента в них оказывается значительно выше, чем в продукции растениеводства.
Список литературы
Chernykh N.A., Milashchenko N.Z., Ladonin V.F. Eco-toxicological aspects of heavy metal pollution. Agropromizdat, Moscow, 1999 (in Russ.).
Ermakov V.V., Tyutikov S.F. Geochemical ecology of animals. Nauka, Moscow, 2008 (in Russ.).
Funga Nordica. Agaricoid, boletoid, cyphelloid and gasteroid genera. Nordsvamp, Copenhagen, 2012.
Index Fungorum. A nomenclatural database. http://www.indexfungorum.org/names/names.asp. Accessed 01.09.2019.
Isidak O., Turkekul I., Elmastas M., Tuzen M. Analysis of heavy metals in some wild-grown edible mushrooms from the middle black sea region. Turkey. Food Chemistry. 2004. V. 86. P. 547–555.
Ivanov A.I., Chernyshov N.V., Kuzin E.N. Natural conditions of the Penza Region. Current state. Vol. 1. Geological environment, topography, climate, surface waters, soils, vegetation cover. Penza, 2017 (in Russ.).
Ivanov A.I., Kostychev A.A. Nature of some heavy metals and arsenic accumulation in Boletales mushrooms. Mikologiya i fitopatologiya. 2007. V. 41 (6). P. 500–505 (in Russ).
Ivanov A.I., Kostychev A.A., Skobanev A.V. Accumulation of heavy metals and arsenic by basidioms of macromycetes of various ecological-trophic and taxonomic groups. Povolzhskiy ekologicheskiy zhurnal. 2008. N 3. P. 190–199 (in Russ.).
Kabata-Pendias A., Pendias X. Trace Elements in soils and plants. Mir, Moscow, 1989 (in Russ.).
Koroleva Yu.V., Ohrimenko M.A. Special accumulation of heavy metals by forest mushrooms in the Kaliningrad Region. Vestnik Baltiyskogo universiteta imeni I. Kanta. 2015. V. 1. P. 106–117 (in Russ.).
Kostychev A.A. Bio-absorption of heavy metals and arsenic by agaricoid and gasteroid basidiomycetes. Cand. Sci. Thesis. Moscow, 2009 (in Russ.).
Lukin S.V. Monitoring of chromium content in crops and soils. Dostizheniya nauki i tekhniki APK. 2011. N 6. P. 54–55 (in Russ.).
Malinowska E., Szefer P., Falandysz J. Metals bioaccumulation by bay bolete, Xerocomus badius, from selected sites in Poland. Food Chemistry. 2004. V. 84 (3). P. 405–416.
Moser M. Die Rohrlinge und Blatterpilze. Kleine Kryptogamenflora, 2. Gustav Fischer Verlag, N.Y. etc., 1978.
MU N 01-19/47-11. Atomic absorption methods for determining toxic elements in food products and food raw materials. 1992 (in Russ.).
Protasova N.A., Schcerbakova A.P. Trace elements (Cr, V, Ni, Mg, Zn, Cu, Co, Zr, Ga, Be, Ba, Be, I, Mo) in gray forest soils of the Central black earth region. Voronezh. Izd-vo Voronezhskogo gosudarstvennogo universiteta, 2003. (in Russ.).
Reutina S.V. The role of chromium in the human body. Vestnik RUDN, seriya Ekologiya i bezopasnost' zhiznedeyatel’nosti, 2009. N 4. P. 50–55 (in Russ.).
Sazanova K.V., Velikanova V.D., Stolyarova N.V. Accumulation of heavy metals by fungi. Environmental and species specificity, and mechanisms of accumulation, a potential danger to human. Toksikologiya. 2017. V. 18. P. 336–361 (in Russ.).
Şen I., Alli H., Çol B., Çelikkollu M., Balci A. Trace metal contents of some wild-growing mushrooms in Bigadiç (Balıkesir), Turkey. Turk. J. Bot. 2012. N 36. P. 519–528.
Sibirkina A.R. Acumulation of chromium by mushrooms of pine forest of the Semipalatinsk Priirtyshyye of the Republic of Kazakhstan. 2012. N 2 (in Russ.).
Siric I., Ivica K., Bedekovic D., Kaic A., Kasap A. Heavy metals in edible mushroom Boletus reticulatus Schaeff. collected from Zrin mountain. Croatia Period. Biol. 2014. V. 116 (3). P. 319–322.
Stihi C., Radulescu C., Busuioc G., Popescu I.V., Gheboianu A., Ene A. Studies on accumulation of heavy metals from substrate to edible wild mushrooms. Rom. J. Phys. 2011. V. 56 (1–2). P. 257–264.
Vinogradov A.P. Geochemistry of rare and scattered elements in soils of the USSR. Moscow, 1957 (in Russ.). Виноградов А.П. (Vinogradov) Геохимия редких и рассеянных элементов в почвах СССР. Москва: Изд-во АН СССР, 1957. 279 c.
Ермаков В.В., Тютиков С.Ф. (Ermakov, Tyutikov) Геохимическая экология животных. Москва: Наука, 2008. 312 с.
Иванов А.И., Костычев, А.А. (Ivanov, Kostychev) Характер накопления некоторых металлов и мышьяка в базидиомах грибов порядка Boletales // Микология и фитопатология. 2007. Т. 41, № 6. С. 500–505.
Иванов А.И., Костычев, А.А., Скобанев А.В. (Ivanov et al.) Аккумуляция тяжелых металлов и мышьяка базидиомами макромицетов различных эколого-трофических и таксономических групп // Поволжский экологический журнал. 2008. № 3. С. 190–199.
Иванов А.И., Чернышов Н.В., Кузин Е.Н. (Ivanov et al.) Природные условия Пензенской области. Современное состояние. Т. 1. Геологическая среда, рельеф, климат, поверхностные воды, почвы, растительный покров. Пенза: РИО ПГСХА, 2017. 235 с.
Кабата-Пендиас А., Пендиас Х. (Kabata-Pendias, Pendias) Микроэлементы в почвах и растениях. Москва: Мир, 1989. 440 с.
Королева Ю.В., Охрименко М.А. (Koroleva, Okhrimenko) Особенности накопления тяжелых металлов лесными грибами Калининградской области // Вестник Балтийского университета им. И. Канта. 2015. Вып. 1. С. 106–117.
Костычев А.А. (Kostychev) Биоабсорбция тяжелых металлов и мышьяка агарикоидными и гастероидными базидиомицетами: автореф. дисс. … канд. биол. наук. Москва, 2009. 20 с.
Лукин С.В. (Lukin) Мониторинг содержания хрома в сельскохозяйственных культурах и почвах // Достижения науки и техники АПК. 2011. № 6. С. 54–55.
МУ № 01-19/47-11 (MU) Атомно-абсорбционные методы определения токсичных элементов в пищевых продуктах и пищевом сырье, 1992.
Протасова Н.А., Щербакова А.П. (Protasova, Shcherbakova) Микроэлементы (Cr, V, Ni, Mg, Zn, Cu, Co, Zr, Ga, Be, Ba, Be, I, Mo) в серых лесных почвах центрального Черноземья. Воронеж: Изд-во Воронежского государственного университета, 2003. 355 с.
Реутина С.В. (Reutina) Роль хрома в организме человека. Весник РУДН, серия Экология и безопасность жизнедеятельности. 2009. № 4. С. 50–55.
Сазанова К.В., Великанова В.Д., Столярова Н.В. (Sazanova) Накопление тяжелых металлов грибами. Экологическая и видовая специфичность, механизмы аккумуляции, потенциальная опасность для человека // Токсикология. 2017. Т. 18. С. 336–361.
Сибиркина А.Р. (Sibirkina) Аккумуляция хрома грибами соснового бора семипалатинского Прииртышья республики Казахстан. 2012. № 2.
Черных Н.А., Милащенко Н.З., Ладонин В.Ф. (Chernykh et al.) Экотоксикологические аспекты загрязнения тяжелыми металлами. М.: Агропромиздат, 1999. 200 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология