Микология и фитопатология, 2020, T. 54, № 4, стр. 264-277
Микобиота почв города Апатиты (Мурманская область)
М. В. Корнейкова 1, 2, *, Д. А. Никитин 3, **, А. В. Долгих 4, ***, А. С. Сошина 1, ****
1 Институт проблем промышленной экологии Севера КНЦ РАН
184209 Апатиты, Россия
2 Российский университет дружбы народов
117198 Москва, Россия
3 Почвенный институт им. В.В. Докучаева
119017 Москва, Россия
4 Институт географии РАН
119017 Москва, Россия
* E-mail: korneykova.maria@mail.ru
** E-mail: dimnik90@mail.ru
*** E-mail: dolgikh@igras.ru
**** E-mail: anastasiya.soshina97@yandex.ru
Поступила в редакцию 27.12.2019
После доработки 12.03.2020
Принята к публикации 11.05.2020
Аннотация
Впервые охарактеризована микобиота почв основных функциональных зон города Апатиты. Показано, что биомасса грибов в почве селитебной зоны [дерновоподзол иллювиально-железистый урбостратифицированный – Umbric leptic entic podzol (arenic, neocambic)] составляет 0.18–0.20 мг/г, в фоновой лесной почве [подзол иллювиально-железистый грубогумусированный – Folic leptic albic podzol (arenic)] – 0.31 мг/г. Наименьшие значения (0.04–0.08 мг/г) характерны для участков с отсутствием растительности с сильно уплотненной поверхностью – пешеходная дорога без твердого покрытия [внутренний двор, селитебная зона – дерновоподзол иллювиально-гумусовый урбостратифицированный – Umbric leptic entic podzol (arenic, neocambiс)], и на детской площадке [внутренний двор, селитебная зона – подзол иллювиально-гумусовый урбостратифицированный – Leptic entic podzol (arenic, neocambic, technic)], где происходит активное перемешивание верхнего привнесенного минерального горизонта. Численность копий рибосомальных генов грибов в почвах разных функциональных зон изменяется от 4.0 × 109 до 1.14 × 1010 копий/г почвы, при этом наибольших значений достигает в фоновом подзоле (лесная зона) и подзоле урбостратифицированном детской площадки (селитебная зона). Количество зачатков микромицетов в верхнем почвенном горизонте колеблется от 1 × 103 до 9 × 104 КОЕ/г почвы, достигая максимальных значений в почве общественно-рекреационной зоны [дерновоподзол иллювиально-железистый урбостратифицированный – Umbric leptic entic podzol (arenic, neocambic, technic)]. В культивируемом сообществе сахаролитических грибов максимальным видовым разнообразием (9 видов) характеризуется род Penicillium. В почве селитебной зоны доминируют Trichocladium griseum и Penicillium dierckxii, в общественно-рекреационной зоне и на территории детской площадки – P. melinii, в почве сельскохозяйственной зоны [агродерновоподзол иллювиально-железистый глееватый – Stagnic plaggic entic podzol (arenic)] – микромицеты рода Fusarium, а в фоновой лесной почве – P. decumbens.
ВВЕДЕНИЕ
В связи с возрастающей антропогенной нагрузкой и увеличением уровня заболеваемости населения, изучению экологии городских агломераций в последнее время уделяется повышенное внимание (Morel et al., 2015; Schmidt, 2016; Huot et al., 2017; Hui et al., 2017; Vasenev, Kyzyakov, 2018, Steffan et al., 2018). Урбанизация оказывает значительное влияние на окружающую среду и приводит к необратимым изменениям рельефа, гидрологических условий, растительного покрова и почв. Биологические свойства городских почв могут служить индикаторами их экосистемной функции (Piotrowska-Dlugosz, Charzyńsky, 2015), при этом микробное разнообразие и активность являются одной из наиболее значимых биологических характеристик городских почв (Schindelbeck et al., 2008; Rosanova et al., 2016). По изменению в структуре почвенного микробиома можно сделать выводы о степени антропогенной нагрузки на биогеоценоз (Gupta et al., 2017). Важно оценить долю различных эколого-трофических групп эукариот в почве для понимания функционального потенциала почвенных микроорганизмов и, как следствие, уровня запаса прочности городских экосистем (Schmidt, 2016). Отметим, что увеличение плотности населения и формирование эффекта “острова тепла” городов (Varentsov et al., 2018) способствует накоплению в окружающей среде патогенных и условно-патогенных микроорганизмов, основным резервуаром которых является почва (Berg et al., 2013; Korneykova, 2018). Микроорганизмы – наиболее отзывчивая на изменения в экосистемах часть почвенной биоты. Городские ценозы существенно отличаются от нативных (фоновых), что проявляется в изменении не только химических параметров воздуха и воды, но и почвы – основы существования всех наземных экосистем. Большая часть микробиологических исследований почв населенных пунктов проведена в городах умеренного и теплого климата, в то время как полярные регионы изучены значительно слабее (Stepanov et al., 2005; Guilland et al., 2018). Для Кольского полуострова, где расположены наиболее северные города как России, так и мира, почвенные микроорганизмы изучались лишь в Мурманске (Turchanovskaya, Bogdanova, 2011; Peretrukhina, 2011) и Кандалакше (Marfenina, 2002). Ранее получены первые данные по агрохимическим показателям и содержанию тяжелых металлов в почвах городов Мурманской обл. (Мончегорск, Апатиты, Кировск и Мурманск) (Evdokimova, 1995; Vikhman et al., 2008, 2009, 2013). Целью настоящей работы стало изучение запасов и структуры биомассы микобиоты, численности и таксономического разнообразия культивируемых микроскопических грибов в почвах основных функциональных зон города Апатиты.
МАТЕРИАЛЫ И МЕТОДЫ
Город Апатиты является пятым по величине городом за Полярным кругом, имеет координаты 67.567° с.ш., 33.393° в.д. и находится на Кольском п-ове в пределах Мурманской обл. Климат города континентальный, холодный и влажный (Kottek et al., 2006), с самой низкой среднемесячной температурой (январь) –13.5°C и рекордной минимальной температурой –47°C. Среднегодовое количество осадков составляет 853 мм (https://www.weatheronline.co.uk/; https://ru.climate-data.org/).
В связи с относительно коротким историческим освоением современной территории города и отсутствием масштабных перепланировок городской застройки для почвенного покрова г. Апатиты, за исключением горнопромышленных комплексов, нехарактерно распространение основных типов сильно трансформированных городских почв и почводобных тел (урбаноземы, урбостратоземы, ТПО и др.), подробно описанных и исследованных на территории крупных городов европейской России (Prokofyeva et al., 2014). Профили городских почв соответствуют природным (естественным), за исключением отсутствия верхнего горизонта, заменяемого новообразованным антропогенным синлитогенным горизонтом мощностью 5–30 см, состоящим из перемешанного материала верхних горизонтов исходных почв с включениями артефактов (строительный и бытовой мусор). В зависимости от времени экспонирования в условиях отсутствия/привноса нового материала и перемешивания под злаково-разнотравной (нетипичной для фоновых северотаежных ландшафтов) растительностью формируются серогумусовые горизонты AY с хорошо выраженной комковатой структурой мощностью до 15 см. Данные серогумусовые горизонты нетипичны для фоновых альфегумусовых почв (подзолов и подбуров, в них верхний – подстилочно-торфяный – горизонт O), часто с обилием артефактов (кирпич, известь, резина, пластик, металл, и др.), что позволяет диагностировать их как серогумусовые урбистратифицированные горизонты (AYur). В парках распространены естественные почвы (подзолы и подбуры), менее трансформированные антропогенной деятельностью. В них верхний горизонт местами перемешан и фрагментарно присутствуют артефакты, отмечается формирование переходного поверхностного горизонта O-AY, более близкого к серогумусовому AY.
Образцы почв отбирали по горизонтам на пяти характерных участках (семь точек отбора), расположенных в разных функциональных зонах города и за его пределами в период с 14 по 16 июня 2019 года в 3-кратной повторности. Описание участков приведено в табл. 1. Названия почв даны по классификации почв России с дополнениями для городских почв и Мировой реферативной базе почвенных ресурсов (World reference base – WRB) (Classification, 2004; Prokofyeva et al., 2014; IUSS, 2015; Prokofyeva, Gerasimova, 2018).
Таблица 1.
Характеристика объектов исследования
| Участок (сайт) | Функциональная зона | Местоположение | Координаты | Почва КПР/WRB* | Растительность |
|---|---|---|---|---|---|
| APA01-19 | общественно-рекреационная | территория Академгородка | 67.56978 с.ш., 33.40082 в.д. | 1 | Betula pubescens, Salix caprea, Populus sp., Poa pratensis, Festuca rubra, F. pratensis, Lolium perenne |
| APA02-19 | селитебная, (внешний двор) | ул. Фестивальная д. 5 | 67.56506 с.ш., 33.41000 в.д. | 1 | Larix sibirica, Betula pubescens, Sorbus gorodkovii, Poa pratensis, Festuca rubra, Lolium perenne, Taraxacum officinale |
| APA03-19 | селитебная, (внутренний двор) | ул. Бредова, двор между д. 21 и д. 23 | 67.56139 с.ш., 33.41057 в.д. | 2 | Betula pubescens, Salix caprea, Poa pratensis, Festuca rubra, F. pratensis, Lolium perenne |
| APA04-19 | с/x | эксп. участок ПАБСИ КНЦ РАН | 67.57959 с.ш., 33.30014 в.д. | 3 | – |
| APA03-19-TR | селитебная, внутренний двор, пешеходная дорога (без твердого покрытия) | ул. Бредова, двор между д. 21 и д. 23 | 67.56139 с.ш., 33.41057 в.д. | 1 | – |
| APA03-19-PG | селитебная, внутренний двор, детская площадка с песчаным покрытием | ул. Бредова, двор между д. 21 и д. 23 | 67.56139 с.ш., 33.41057 в.д. | 4 | – |
| APA05-19 (разрез 259; Pereverzev, 2004) | лесная (естественная), фон | сосновый лес в окрестностях г. Апатиты | 67.57885 с.ш., 33.29762 с.ш. | 5 | Pinus friesiana, Picea obovata, Betula pubescens, Juniperus sp., Vaccinium vitis-idaea, V. myrtillus, Equisetum arvense |
Примечание. 1 – дерновоподзол иллювиально-железистый урбостратифицированный [Umbric leptic entic podzol (arenic, neocambic, technic)]; 2 – дерновоподзол иллювиально-гумусовый глееватый урбостратифицированный [Umbric leptic entic podzol (arenic, neocambic)]; 3 – агродерновоподзол иллювиально-железистый глееватый [Plaggic entic podzol (arenic)]; 4 – подзол иллювиально-гумусовый урбостратифицированный [Leptic entic podzol (arenic, neocambic, technic)]; 5 – подзол иллювиально-железистый грубогумусированный [Folic leptic albic podzol (arenic)]; КПР – классификация почв России; WRB – мировая реферативная база почвенных ресурсов.
Запасы и структуру биомассы грибов определяли методом люминесцентной микроскопии с применением флуоресцентного красителя калькофлуора белого (Zvyagintsev, 1991). Учет спор и длины мицелия осуществляли на люминесцентном микроскопе Zeiss Axioskop 2 plus (Германия) при увеличении 400×. Расчет грибной биомассы (мг/г почвы) проводили, полагая, что плотность спор равна 0.837 г/см3, а плотность мицелия – 0.628 г/см3 (Polyanskaya, Zvyagintsev, 2005). Содержание грибной биомассы на грамм сухой почвы рассчитывали с учетом ее влажности.
Количественную оценку содержания рибосомальных генов грибов осуществляли методом полимеразной цепной реакции (ПЦР) в реальном времени. Для учета использовали праймеры на регион ITS. Реакцию проводили в амплификаторе Real-Time CFX96 Touch (“Bio-Rad”). Реакционную смесь готовили из препарата SuperMix Eva Green (“Bio-Rad”). В качестве контроля использовали растворы клонированных фрагментов рибосомального оперона штамма дрожжей Saccharomyces cerevisae Meyen 1B-D1606. Для каждого образца реакцию проводили в трех повторностях. Концентрацию генов рассчитывали с помощью программного обеспечения CFX Manager. Концентрацию генов в препаратах ДНК пересчитывали в количество генов на 1 г почвы с учетом разведений и массы навески.
Численность колониеобразующих единиц (КОЕ) и разнообразие культивируемых микромицетов сахаролитической группы определяли методом микробиологического посева на среду Чапека с добавлением молочной кислоты (4 мл/л) для ингибирования роста бактерий (Zvyagintsev, 1991). Повторность каждого варианта пятикратная. Инкубацию проводили в термостатах при температуре 27°С в течение 7–10 дней и при 5°С в течение 5–6 недель, чтобы дополнительно выделить психротолерантные штаммы. Анализ биологического разнообразия микроскопических грибов выполнен на основе культурально-морфологических признаков (микроскоп Olympus CX41) с использованием современных определителей (Klich, 2002; Domsh et al., 2007; Seifert et al., 2011). Наименование видов и систематическое положение дано по базе данных: CABI Bioscience Databases (Index Fungorum, 2019). Для ряда видов, выделенных в форме стерильного мицелия, идентификацию осуществляли на основании анализа участка ITS1–5.8S–ITS2 рДНК. Выделение ДНК осуществляли по методике, описанной ранее (Glushakova et al., 2011), но культуры подвергали трем циклам обработки, поскольку мицелиальные грибы более устойчивы к внешним воздействиям, нежели дрожжи. Секвенирование участков ДНК делали с помощью набора реактивов BigDye Terminator V. 3.1 Cycle Sequencing Kit (Applied Biosystems, USA) с последующим анализом продуктов реакции на секвенаторе Applied Biosystems 3130l Genetic Analyzer в научно-производственном центре “Синтол” (Москва).
Для характеристики разнообразия структуры комплекса грибов использовали индексы Шеннона, Симпсона и Пиелу. Статистическую обработку данных проводили с использованием программ Microsoft Оffice Excel и Statistica.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Запасы и структура биомассы грибов. Наибольшая биомасса микобиоты (0.31 мг/г почвы) отмечена в верхнем горизонте фонового подзола иллювиально-железистого грубогумусированного (табл. 2). Сходные данные получены ранее для почв северной тайги Кольского полуострова (Evdokimova, Mozgova, 2001; Korneykova, 2018). Несколько меньше грибов (0.20 и 0.18 мг/г почвы соответственно) выявлено в дерновоподзоле иллювиально-железистом урбостратифицированном общественно-рекреационной зоны и агродерновоподзоле иллювиально-железистом глееватом. Еще ниже значения грибной биомассы в урбистратифицированных дерновоподзолах селитебной зоны (0.13 мг/г почвы для APA02-19 и 0.12 мг/г почвы для профиля APA03-19). Минимальная грибная биомасса отмечена в поверхностных почвенных горизонтах подзола урбистратифицированного детской площадки и дерново-подзола урбистратифицированного пешеходной дороги (0.08 и 0.04 мг/г почвы соответственно), где почва максимально уплотнена и нет растительного покрова, а на детской площадке происходит активное механическое перемешивание верхних первых сантиметров насыпного песчаного материала (до 15 см). Микробиологические исследования почв других городов выявляли сходные закономерности (Marfenina et al., 2017; Vinogradova et al., 2017).
Таблица 2.
Запасы и структура биомассы грибов в поверхностных горизонтах почвенных профилей
| Точки отбора | Мицелий (d ~ 3 мкм) | Споры (диаметр, мкм) | Общая биомасса спор, мг/г почвы | Суммарная биомасса грибов, мг/г почвы | |||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| биомасса, мг/г | длина, м | доля мицелия в общей биомассе, % | до 2 | от 2 до 3 | от 3 до 5 | ||||||
| числ-ть, шт/г × 105 | масса, мг/г | числ-ть, шт/г × 104 | масса, мг/г | числ-ть, шт/г × 103 | масса, мг/г | ||||||
| APA-01-19 | 0.132 ± 0.029 | 104.16 ± 22.92 | 66.14 ± 14.55 | 1.11 ± 0.24 | 0.037 ± 0.008 | 2.58 ± 0.57 | 0.030 ± 0.007 | – | 0.067 ± 0.015 | 0.199 ± 0.044 | |
| APA-02-19 | 0.035 ± 0.008 | 27.95 ± 6.15 | 26.50 ± 5.83 | 0.77 ± 0.17 | 0.036 ± 0.008 | 2.91 ± 0.64 | 0.034 ± 0.007 | 5.20 ± 1.14 | 0.028 ± 0.006 | 0.098 ± 0.022 | 0.133 ± 0.030 |
| APA-03-19 | 0.088 ± 0.019 | 69.58 ± 15.31 | 27.55 ± 6.06 | 0.49 ± 0.11 | 0.017 ± 0.004 | 0.97 ± 0.21 | 0.011 ± 0.002 | 1.04 ± 0.23 | 0.006 ± 0.001 | 0.033 ± 0.007 | 0.121 ± 0.027 |
| APA-04-19 | 0.038 ± 0.008 | 30.43 ± 6.70 | 21.64 ± 4.76 | 1.05 ± 0.23 | 0.036 ± 0.008 | 8.38 ± 1.84 | 0.098 ± 0.021 | 1.04 ± 0.23 | 0.006 ± 0.001 | 0.139 ± 0.031 | 0.177 ± 0.039 |
| APA-05-19 | 0.214 ± 0.047 | 169.58 ± 37.11 | 69.27 ± 15.25 | 1.26 ± 0.28 | 0.043 ± 0.009 | 3.07 ± 0.68 | 0.036 ± 0.008 | 3.12 ± 0.69 | 0.017 ± 0.004 | 0.095 ± 0.021 | 0.309 ± 0.066 |
| APA-03-19 TR | 0.013 ± 0.0002 | 10.26 ± 2.26 | 30.98 ± 6.82 | 0.30 ± 0.06 | 0.010 ± 0.002 | 0.65 ± 0.14 | 0.008 ± 0.002 | 2.08 ± 0.46 | 0.011 ± 0.003 | 0.029 ± 0.006 | 0.042 ± 0.009 |
| APA-03-19 PG | – | – | 0.52 ± 0.11 | 0.018 ± 0.004 | 5.94 ± 1.31 | 0.064 ± 0.001 | – | 0.081 ± 0.018 | 0.081 ± 0.018 | ||
Грибы в почве представлены как покоящимися одно- и олигоклеточными спорами, так и активной (растущей) частью – мицелием, поэтому для характеристики микобиты важно определить ее биомассу и процент содержания тех или иных пропагул (Nikitin et al., 2017). Численность грибных спор в изученных образцах изменялась от нескольких тысяч до нескольких сотен тысяч на грамм почвы, что соответствует данным для некоторых зональных почв северных регионов (Polyanskaya, Zvyagintsev, 2005). Более 95% спор представлено мелкими формами до 3 мкм (табл. 2), обилие которых характерно для экстремально холодных экосистем (Nikitin et al., 2019). Вклад крупных спор, диаметром 5 мкм, в общую численность пропагул незначителен и составляет 0.5–5.5% для каждого из участков. Наиболее существенный вклад крупных спор в общую биомассу пропагул отмечен в почвах внутренних дворов селитебной зоны (APA03-19) – до 4.5%, в почве пешеходной дороги (АPA03-19-TR) их доля близка к таковой в лесной почве (APA05-19) – 1.3–1.9%, в почве пашни (APA04-19) доля крупных спор составила лишь 0.5%, а в почве общественно-рекреационной зоны (AРA01-19) и на детской площадке (APA-03-19-PG) они не обнаружены. По результатам корреляционного анализа выявлена достоверно значимая взаимосвязь между количеством крупных спор и содержанием общего углерода (r = 0.7). Такая зависимость отмечалась ранее в ряде других работ (Polyanskaya, Zvyagintsev, 2005; Nikitin et al., 2017). Специфические морфологические особенности у спор выявлены для почв общественно-рекреационной (AРA01-19), сельскохозяйственной (APA04-19) и лесной зон (APA05-19), где характерно наличие диктио- и дидимоспор, в том числе макроспор Fusarium, a также Alternaria, Phoma и Ulocladium.
Длина грибного мицелия в исследованных почвах составляла от 10.26 до 169.17 м/г почвы. Минимальные значения определены для детской площадки (APA03-19-PG), а максимальные – в лесной почве (APA05-19). Такой существенный разброс значений может быть связан с разной степенью антропогенного воздействия на изучаемые участки (Charzyński, et al., 2017). Диаметр грибных гифов составлял от 2.5 до 4 мкм, причем мицелий большего диаметра встречался только в фоновом подзоле (APA05-19). Пряжковый базидиомицетный мицелий обнаружен лишь в профилях почв общественно-рекреационной (APA01-19) и лесной зон (APA05-19) под деревьями, где его доля составляла 21 и 38% соответственно. Это закономерный результат, поскольку высокое обилие базидиомицетов свойственно зрелым лесным экосистемам (Domsch et al., 2007). Более половины грибной биомассы (66–70%) приходилось на мицелий только в почве общественно-рекреационной (APA01-19) и лесной зоны (APA05-19), где длина и биомасса мицелия максимальны. Это наименее затронутые деятельностью человека ценозы, для которых высокую долю мицелия отмечают по всей таежной зоне с севера на юг (Khabibullina et al., 2014; Korneykova, 2018). В остальных почвенных образцах грибы, в основном, находились в виде спор, а доля грибного мицелия (где его обнаруживали) составляла от 22 до 31%. Это свидетельствует о снижении активности микобиоты в результате угнетения растительности и повышении плотности почвы при вытаптывании (Charzyński et al., 2017).
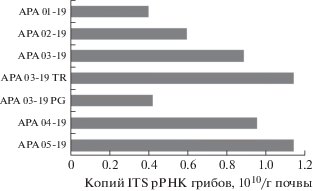
Количественная оценка содержания рибосомальных генов. Численность копий рибосомальных генов, оцениваемая по спейсерам ITS рРНК грибов, изменялась от 4.0 × 109 до 1.14 × 1010 копий/г почвы для разных функциональных зон (рис. 1), что лишь на порядок ниже, чем для красно-желтых тропических почв и на два порядка меньше по сравнению с черноземами (Сhernov et al., 2018). Такая вариабельность, вероятно, обусловлена неравномерностью распределения генетической информации в клетках микобиоты, которые могут содержать как по одному, так и по нескольку ядер c различной концентрацией ДНК (Glöckner et al., 2017).
Наименьшая численность копий генов грибов (4.0 × 109 копий/г почвы) отмечена в почве общественно-рекреационной зоны (АРА01-19) и на детской площадке (APA03-19-PG), наибольшая – в лесной почве (АРА05-19) и на пешеходной дороге (APA03-19-TR). Полагаем, что такое распределение связано с повышенной антропогенной нагрузкой на почву в городских агломерациях, где развитие мицелия у грибов ограничено (Marfenina et al., 2002). Безусловно, на содержание грибной биомассы исследованных почв оказывает большое влияние и состав растительного покрова, определяющий обилие микоризной микобиоты (Dobrovolskaya et al., 2015). Так, обилие деревьев в зоне леса и тропинки может определять широкое распространение эктомикоризных грибов, мицелий которых зачастую дает существенный вклад в биомассу почвенной микобиоты (Polyanskaya, Zvyagintsev, 2005).
Численность КОЕ и разнообразие культивируемой части почвенной микобиоты. Количество микромицетов в верхних горизонтах исследуемых городских почв составляло от 1 × 103 до 9 × 104 КОЕ/г почвы (табл. 3). Минимальная численность отмечена в почве внутреннего двора (APA03-19) и на пешеходной дороге в том же дворе (APA03-19-TR), где почва максимально уплотнена. Максимальные значения выявлены для почв общественно-рекреационной зоны на территории Академгородка (APA01-19). Численность культивируемых микроскопических грибов в фоновом подзоле (APA 05-19) составляет 2.3 × 104 КОЕ/г – ниже, чем в общественно-рекреационной зоне. По-видимому, это связано с отсутствием антропогенных субстратов, специфичных для развития нехарактерных микромицетов в данной природной зоне (Marfenina et al., 2002). В целом для фоновых почв северотаежной зоны Кольского п-ова характерна большая численность микромицетов, об этом свидетельствуют многолетние исследования (Evdokimova, Mozgova, 2001; Korneykova, 2018; Korneykova et al., 2018).
Таблица 3.
Численность культивируемых микромицетов в почвах г. Апатиты
| Почвенный горизонт | Глубина, см | Численность, тыс. КОЕ/г |
|---|---|---|
| APA01-19. Дерново-подзол иллювиально-железистый урбостратифицированный | ||
| AYur | 0–12 (16) | 89.2 ± 21.9 |
| B1ur | 12(16)–29(31) | – |
| E | 29(31)–31(34) | 19.4 ± 2.9 |
| BF | 31(34)–45 | 0.7 ± 0.3 |
| BC | 45–(55) | 0.08 ± 0.04 |
| APA02-19. Дерново-подзол иллювиально-железистый урбостратифицированный | ||
| AYur | 0–15 | 3.13 ± 0.59 |
| B1ur | 15–27 | 2.07 ± 0.18 |
| BH | 27–35 | 8.73 ± 1.16 |
| BC | 35 (55) | 0.15 ± 0.02 |
| APA03-19 Дерново-подзол иллювиально-гумусовый глееватый урбостратифицированный | ||
| AYur | 0–5 | 1.64 ± 0.84 |
| E | 5–10 | 3.68 ± 0.08 |
| BHF1 | 10–15 | 0.47 ± 0.09 |
| BF2 | 20–25 | 0 |
| BCg | 30–35 | 0.2 ± 0.00 |
| APA04-10 Агродерново-подзол иллювиально-железистый глееватый | ||
| P | 0–5 | 4.88 ± 0.88 |
| BF | 20–25 | 0.49 ± 0.09 |
| BCg | 30–35 | 0.35 ± 0.05 |
| D | 45–50 | 0 |
| APA05-19 Подзол иллювиально-железистый грубогумусированный | ||
| Oao | 0–5 | 22.7 ± 4.3 |
| E | 7–10 | 1.46 ± 0.43 |
| BF | 15–20 | 6.82 ± 0.62 |
| BC | 40–45 | 0.01 ± 0 |
| APA03-19 TR. Дерново-подзол иллювиально-гумусовый урбостратифицированный | ||
| AYur, d | 0–5 | 1.11 ± 0.9 |
| APA03-19. Подзол иллювиально-гумусовый урбостратифицированный | ||
| TCH | 0–5 | 3.9 ± 0.2 |
Известно, что городские почвы отличаются по своим свойствам от естественных аналогов, и это, в свою очередь, сказывается на биологической составляющей (Marfenina et al., 2002; Ivanova et al., 2015; Marfenina, Danilogorskaya, 2017). Выявлены некоторые закономерности в распределении численности культивируемых микромицетов по горизонтам исследуемых городских почв. В фоновой лесной почве (APA05-19) отмечали уменьшение КОЕ более чем в 10 раз от органогенного горизонта к подзолистому, а затем незначительное увеличение к иллювиальному. Такая закономерность в распределении микромицетов по почвенному профилю ранее отмечена нами для фонового подзола (Evdokimova, Mozgova, 2001; Korneykova, 2018), а также характерна для ряда других физико-химических почвенных свойств, что обусловлено их промывным режимом (Zajdelman, 2016). В почвах селитебной зоны максимум численности микромицетов отмечен в более глубоких горизонтах, что может быть связано с недостаточным количеством кислорода для развития микромицетов из-за уплотнения верхнего слоя при вытаптывании (Sherman et al., 2019). Кроме того, в минеральных слоях городских почв могут находиться органогенные артефакты (Vasenev, Kuzyakov, 2018), являющиеся дополнительным субстратом для микроорганизмов.
В пахотной почве наибольшая численность микромицетов (4.88 × 109 КОЕ/г) отмечалась в верхнем горизонте и затем существенно (более чем в 10 раз) снижалась по профилю. Вероятно, это связано с наиболее активным вовлечением верхнего пахотного горизонта почвы в сельскохозяйственную практику: внесение удобрений, рыхление, перепахивание и, как следствие, многочисленные разрывы грибного мицелия орудиями обработки почвы, которые дают начало колониям на питательных средах (Trzciński et al., 2018).
В почве общественно-рекреационной зоны отмечали постепенное снижение численности микромицетов по почвенному профилю в ряду горизонтов: органогенный > подзолистый > иллювиальный. Такое распределение отмечено и в других работах (Polyanskaya, Zvyagintsev, 2005; Vermeire et al., 2019).
Видовое разнообразие культивируемой части сахаролитического грибного сообщества исследуемых почв представлено 22 видами, относящимися к 11 родам, 10 семействам, 7 порядкам, 5 классам и 2 отделам (табл. 4). Отдел Mucoromycota представлен родами Mortierella и Umbelopsis. Отдел Ascomycota – восьмью анаморфными родами (Acremonium, Aspergillus, Fusarium, Penicillium, Stachybotrys, Thielaviopsis, Torula, Trichocladium). Также выделен один тип изолята стерильного мицелия неопределенного систематического положения ввиду сложного культивирования.
Таблица 4.
Таксономический состав микромицетов почв г. Апатиты
| Вид | Почвенный разрез | ||||||
|---|---|---|---|---|---|---|---|
| APA 01-19 | АРА 02-19 | АРА 03-19 | АРА 04-19 | АРА 05-19 | АРА 03-19TR | АРА 03-19PG | |
| Ascomycota | |||||||
| Dothideomycetes | |||||||
| Pleosporales | |||||||
| Torulaceae | |||||||
| Torula sp. | + | + | |||||
| Eurotiomycetes | |||||||
| Eurotiales | |||||||
| Aspergillaceae | |||||||
| Aspergillus fumigatus Fresen. | + | ||||||
| Penicillium aurantiogriseum Dierckx | + | ||||||
| P. canescens Sopp | + | ||||||
| P. decumbens Thom | + | ||||||
| *P. dierckxii Biourge | + | ||||||
| *P. melinii Thom | + | + | + | ||||
| *P. miczynskii K.W. Zaleski | + | + | |||||
| P. nalgiovense Laxa | + | ||||||
| *P. simplicissimum (Oudem.) Thom | + | + | + | ||||
| P. spinulosum Thom | + | + | + | ||||
| Sordariomycetes | |||||||
| Hypocreales | |||||||
| Ceratocystidaceae | |||||||
| Thielaviopsis basicola (Berk. et Broome) Ferraris | + | ||||||
| Incertae sedis | |||||||
| Acremonium felinum (Marchal) Kiyuna, K.D. An, R. Kigawa ey Sugiy. | + | ||||||
| Acremonium sp. | + | ||||||
| Hypocreaceae | |||||||
| *Trichoderma koningii Oudem. | + | ||||||
| Stachybotryaceae | |||||||
| *Stachybotrys echinatus (Rivolta) G. Sm. | + | ||||||
| Microascales | |||||||
| Nectriaceae | |||||||
| Fusarium sp. | + | + | |||||
| Sordariales | |||||||
| Chaetomiaceae | |||||||
| *Trichocladium griseum (Traaen) X. Wei Wang et Houbraken | + | + | + | + | + | ||
| Mucoromycota | |||||||
| Incertae sedis | |||||||
| Mortierellales | |||||||
| Mortierellaceae | |||||||
| Mortierella alpina Peyronel | + | + | |||||
| Incertae sedis | |||||||
| Umbelopsidales | |||||||
| Umbelopsidaceae | |||||||
| Umbelopsis isabellina (Oudem.) W. Gams | + | + | |||||
| U. longicollis (Dixon-Stew.) Y.N. Wang, X.Y. Liu et R.Y. Zheng | + | + | |||||
| Incertae sedis | |||||||
| Mycelia sterilia штамм 1 | + | + | + | + | + | ||
| Mycelia sterilia штамм 2 | + | + | + | ||||
Наибольшим видовым разнообразием характеризовался род Penicillium (9 видов), представители которого являются типичными сапротрофами (Domsch et al., 2007; Seifert, Gams, 2011), часто встречающимися в фоновых почвах Кольского п-ова (Korneykova, 2018; Korneykova et al., 2018).
Максимальное количество видов грибов выделено из почв лесной и общественно-рекреационной зон, что может быть связано с их максимальной схожестью к фоновым биотопам (Ivanova et al., 2015). Отмечены как сходства, так и различия в видовом составе комплексов микроскопических грибов для изучаемых почв. Так, Trichocladium griseum – типичный фитопатоген и целлюлозолитик (Domsch et al., 2007) – выделен из почв почти всех изучаемых функциональных зон за исключением почвы селитебной зоны. Penicillium spinulosum и стерильный мицелий также обнаружены в большинстве исследуемых почв, тогда как Acremonium felinum, Aspergillus fumigatus, Penicillium aurantiogriseum, P. canescens, P. decumbens, P. dierckxii, P. nalgiovense, Thielaviopsis basicola, Trichoderma koningii и Stachybotrys echinatus выделены только из какого-то одного исследуемого образца. Микроскопические грибы рода Penicillium являются типичными представителями северных лесных почв (Evdokimova, Mozgova, 2001; Marfenina et al., 2002; Domsch et al., 2007; Seifert, Gams, 2011). В изучаемых городских почвах они также доминировали по разнообразию и составляли 40–70% от общего количества выделенных видов. Исключение составил агродерновоподзол, где доля Penicillium составляла всего 16%. На видовой состав комплексов микромицетов почвы этой зоны, вероятно, большое влияние оказывают выращиваемые растения и сопутствующие им комплексы, включающие также патогенные виды.
В целом обследованные городские почвы характеризовались малым видовым разнообразием сообществ сахаролитических микромицетов, о чем свидетельствуют низкие значения индекса разнообразия Шеннона (табл. 5). Он изменялся от 0.68 до 1.86 на разных участках, что соответствует данным по другим районам Кольского п-ова (Korneykova, 2018). Наименьшие значения индекса отмечали для образцов APA03-19 и APA03-19-TR. На остальных участках разнообразие сообществ микромицетов характеризовалось примерно одинаковыми значениями индекса – 1.37–1.86.
Таблица 5.
Значение индексов Шеннона (Н), Симпсона (С) и Пиелу (е) для сообществ почвенных микромицетов г. Апатиты
| Почвенный разрез | H | C | e |
|---|---|---|---|
| APA-01-19 | 1.48 | 0.57 | 0.44 |
| APA-02-19 | 1.79 | 0.46 | 0.56 |
| APA-03-19 | 0.88 | 0.69 | 0.44 |
| APA-04-19 | 1.86 | 0.32 | 0.72 |
| APA-05-19 | 1.81 | 0.44 | 0.52 |
| APA-03-19 TR | 1.37 | 0.44 | 0.86 |
| APA-03-19 PG | 0.68 | 0.75 | 0.43 |
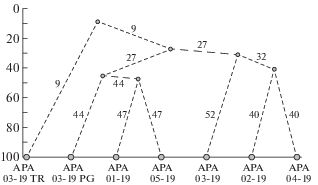
Видовой состав комплексов микромицетов городских почв разного функционального назначения существенно различался, о чем свидетельствуют низкие значения коэффициента Сёренсена (0–47%) и дендрограмма, построенная на его основе (рис. 2). Наибольшее значение коэффициента (47%) выявлено для почв общественно-рекреационной и лесной зон, что свидетельствует о большом сходстве видового состава комплексов микромицетов этих территорий. Остальные участки имели очень низкую степень сходства видового состава сообществ микромицетов с фоновым подзолом, т.е. характеризовались специфическим видовым составом.
Рис. 2.
Дендрограмма сходства видового состава микромицетов городских почв различных функциональных зон. По оси абсцисс – функциональные зоны; по оси ординат – процент сходства видового состава по коэффициенту Сёренсена–Чекановского.
Комплексы микромицетов-сахаролитиков исследуемых городских почв различных назначений существенно отличались друг от друга не только по видовому составу, но и по структуре. Во всех почвах выявлены свои характерные виды-доминанты. Причиной этого может быть неоднородность городских почв и наличие специфических субстратов для развития микромицетов (Marfenina et al., 2017). Практически во всех почвах присутствовал один преобладающий вид, обилие которого составляло более 60%. Наиболее ярко монодоминирование прослеживалось в образцах APA03-19 и APA03-19-PG, где чрезвычайно высока доля Penicillium dierckxii (82%) и P. melinii (85%) для APA03-19 и APA03-19-PG, соответственно. В этих вариантах максимальны значения индекса Симпсона и минимальны значения индекса выровненности Пиелу (табл. 5). Представители рода Penicillium часто доминируют по обилию в почвах северных областей (Domsch et al., 2007).
Сходной структурой комплексов микромицетов обладали почвы общественно-рекреационной, лесной зон и одного из участков селитебной зоны. В этих почвах выделялся один доминирующий вид с индексом обилия 63–75%, а также 7–10 видов с низким значением индекса обилия. Однако сами виды-доминанты отличались: Penicillium melinii – в почве общественно-рекреационной зоне, P. decumbens – в лесной почве и Trichocladium griseum – в почве селитебной зоны. Мы связываем активное развитие целлюлолитика T. griseum c обилием растительных остатков в данном биотопе (Domsh et al., 2007; Seifert et al., 2011) и смягчением климатических условий в последние годы в районе г. Апатиты (Demin et al., 2016).
Наиболее выровненная структура комплексов микромицетов характерна для агродерновоподзола почвы и подзола пешеходной дороги. Обилие преобладающих видов здесь составило 43 (Fusarium sp.), 29 (Trichocladium griseum), 21% (Penicillium miczynskii) для пахотной почвы и 60 (Torula sp.), 20 (P. dierckxii) и 20 (P. simplicissimum) для тропинки. Об этом также свидетельствуют наибольшие значения индекса выровненности Пиелу и наименьшие значения индекса Симпсона в этих вариантах (табл. 5).
Сравнивая видовой состав доминирующих видов зональных лесных почв с таковым городских почв можно отметить появление нетипичных видов в последних. Так, например, вид Trichocladium griseum ранее встречался в почвах региона, но относился к группе случайных и редких видов. Микромицеты рода Fusarium, доминирующие в пахотной почве, также нехарактерны для почв Кольского п-ова. Как известно, виды этого рода часто являются паразитами культурных и кормовых растений (Domsch et al., 2007) и, вероятно, этим можно объяснить большую их численность в пахотной почве. Также привлекает внимание доминирование темнопигментированных микромицетов в городских почвах. Известно, что пигментация организмов представляет защиту от негативного воздействия факторов среды (Nosanchuk et al., 2015, Marfenina et al., 2017), причем большинство меланизированных микромицетов относится к группе условно-патогенных для человека (Marfenina, Danilogorskaya, 2017).
ЗАКЛЮЧЕНИЕ
Выявлены существенные отличия количественных и качественных параметров микокомплексов городских почв субарктической зоны Кольского п-ова от таковых фоновых лесных почв. Отмечено снижение биомассы микромицетов в почвах селитебной зоны, в особенности на участках, где нет растительного покрова, почва сильно уплотнена (пешеходная дорога без твердого покрытия) или активно перемешивается (детская площадка).
В почвах общественно-рекреационной и лесной (естественной) зон грибы находятся преимущественно в виде мицелия (66–70% от общей биомассы), тогда как в почвах селитебной и сельскохозяйственной зон – в форме мелких спор до 3 мкм в диам. Вклад крупных спор (диаметром более 5 мкм) незначителен, они характерны лишь для почв селитебной зоны.
Численность копий рибосомальных генов грибов наибольшая в фоновом подзоле и дерновоподзоле пешеходной дороги, наименьшая – в дерновоподзоле урбистратифицированном общественно-рекреационной зоны и подзоле урбистратифицированном детской площадки внутреннего двора селитебной зоны.
Выявлены закономерности в распределении культивируемых форм микромицетов-сахаролитиков по почвенному профилю в разных функциональных зонах: в почве селитебной зоны максимум накопления грибов отмечен для срединных горизонтов, тогда как в почвах общественно-рекреационной, сельскохозяйственной и лесной зон – в верхних горизонтах. Первые две, в свою очередь, отличались от фоновой лесной почвы отсутствием второго максимума накопления микромицетов в иллювиальном горизонте. Таким образом, городские почвы характеризовались низким видовым разнообразием комплексов микромицетов сахаролитической группы и специфической структурой, существенно отличающейся от фоновых почв.
Наибольшее количество видов микромицетов выделено из почв лесной и общественно-рекреационной зон. Для каждой функциональной зоны характерны свои доминирующие виды, причем в почвах селитебной и сельскохозяйственной зон преобладали микромицеты, потенциально патогенные для растений и человека. Выявлено изменение структуры доминирования комплексов микромицетов в почвах селитебных территорий с полидоминантной структурой сообществ, которая характерна для фоновых лесных почв, на монодоминантную.
Авторы выражают благодарность к.б.н., с.н.с. лаборатории экологии микроорганизмов ИППЭС КНЦ РАН В.А. Мязину за помощь в организации и проведении полевых работ. Проведение полевых работ выполнялось в рамках темы НИР по госзаданию АААА-А18-118021490070-5. Выделение, учет и идентификацию видов микроскопических грибов осуществляли при поддержке гранта РФФИ № 19-29-05187. Запасы и структура биомассы грибов определены при поддержке гранта РФФИ № 18-05-60279. Морфолого-субстантивное описание и классификация почв при поддержке ГЗ № 0148-2019-0006 (Институт географии РАН). Обобщение полученных результатов и подготовка рукописи статьи выполнены при поддержке гранта РНФ № 19-77-300-12.
Список литературы
Berg G., Alavi M., Schmid M., Hartmann A. The rhizosphere as a reservoir for opportunistic human pathogenic bacteria. In: de Bruijn F. J. (ed.). Molecular microbial ecology of the rhizosphere, 1-st ed., 2013. V. 7 (11). P. 1209–1216. https://doi.org/10.1111/j.1462-2920.2005.00891.x
Charzyński P., Hulisz P., Piotrowska-Długosz A., Kamiński D., Plak A. Sealing effects on properties of urban soils. In: Urban soils. CRC Press, 2017, pp. 155–174. https://doi.org/10.1201/9781315154251
Chernov T.I., Tkhakakhova A.K., Zhelezova A.D., Bgazhba N.A. Abundance of microorganisms in the primary soils of the tropical forests of southern Vietnam. In: Syso A.I. (ed.). Soils in biosphere. Novosibirsk, 2018, pp. 439–442 (in Russ.).
Demin V.I., Kozelov B.V., Elizarova N.I., Men’shov Yu.V. Geomorphological factors of the formation of the “heat island” in Apatity. Physics of Auroral Phenomena. 2016. V. 39 (1). P. 154–157 (in Russ.).
Dobrovolskaya T.G., Zvyagintsev D.G., Chernov I.Y., Golovchenko A.V., Zenova G.M., Lysak L.V., Manucharova N.A., Marfenina O.E., Polyanskaya L.M., Stepanov A.L., Umarov M.M. The role of microorganisms in the ecological functions of soils. Eurasian Soil Science. 2015. V. 48 (9). P. 959–967. https://doi.org/10.1134/S1064229315090033
Domsch K.H., Gams W., Anderson T.H. Compendium of Soil Fungi, 2nd ed. IHW–Verlag, Eching, 2007.
Evdokimova G.A. Ecological-microbiological foundations of soil protection in the Far North. The Kola Science Centre of the Russian Academy of Sciences, Apatity, 1995 (in Russ.).
Evdokimova G.A., Mozgova N.P. Comparative characterization of microbial biomass in Al–Fe-humus podzols of the Kola Peninsula. Eurasian Soil Science. 2001. V. 34 (12). P. 1305–1312.
Evdokimova G.A., Mozgova N.P. Microorganisms of tundra and forest podzols of the Kola north. Apatity, The Kola Science Centre of the Russian Academy of Sciences, 2001 (in Russ.).
Glöckner F.O., Yilmaz P., Quast C., Gerken J., Beccati A., Ciuprina A., Bruns G., Yarza P., Peplies J., Westram R., Ludwig W. 25 years of serving the community with ribosomal RNA gene reference databases and tools. J. Biotechnol. 2017. V. 261. P. 169–176. https://doi.org/10.1016/j.jbiotec.2017.06.1198
Glushakova A.M., Kachalkin A.V., Chernov I.Yu. Specific features of the dynamics of epiphytic and soil yeast communities in the thickets of Indian balsam on mucky gley soil. Eurasian Soil Science. 2011. V. 44 (8). P. 886–892. https://doi.org/10.1134/S1064229311080059
Guilland C., Maron P.A., Damas O., Ranjard L. Biodiversity of urban soils for sustainable cities. Environmental chemistry letters. 2018. V. 16 (4). P. 1267–1282. https://doi.org/10.1007/s10311-018-0751-6
Gupta S., Kumar M., Kumar J., Ahmad V., Pandey R., Chauhan N.S. Systemic analysis of soil microbiome deciphers anthropogenic influence on soil ecology and ecosystem functioning. International Journal of Environmental Science and Technology. 2017. V. 14 (10). P. 2229–2238. https://doi.org/10.1007/s13762-017-1301-7
Hui N., Jumpponen A., Francini G., Kotze D.J., Liu X., Romantschul M., Srömmer R., Setal H. Soil microbial communities are shaped by vegetation type and park age in cities under cold climate. Environmental microbiology. 2017. V. 19 (3). P. 1281–1295. https://doi.org/10.1111/1462-2920.13660
Huot H., Joyner J., Córdoba A., Shaw R.K., Wilson M.A., Walker R., Muth T.R., Cheng Z. Characterizing urban soils in New York City: profile properties and bacterial communities. Journal of Soils and Sediments. 2017. V. 17 (2). P. 393–407. https://doi.org/10.1007/s11368-016-1552-9
Index Fungorum. A nomenclatural database. http://www.indexfungorum.org. 2019. Accessed 18.12.2019.
IUSS Working Group WRB. World Reference Base for Soil Resources 2014, update 2015 International soil classification system for naming soils and creating legends for soil maps. World Soil Resources Reports No. 106. 2015. FAO, Rome.
Ivanova A.E., Nikolaeva V.V., Marfenina O.E. Changes in the cellulolytic activity of urban soils induced by the remo-val of plant litter (using Moscow as an example). Eurasian Soil Science. 2015. V. 48 (5). P. 501–508. https://doi.org/10.1134/S1064229315030059
Khabibullina F.M., Kuznetsova E.G., Vaseneva I.Z. Micromycetes in podzolic and bog-podzolic soils in the middle taiga subzone of northeastern European Russia. Eurasian Soil Science. 2014. V. 47 (10). P. 1027–1032. https://doi.org/10.1134/S1064229314100044
Klich M.A. Identification of common Aspergillus species. CBS Fungal Biodiversity Centre, Utrecht, 2002.
Korneykova M.V. Comparative analysis of the number and structure of the complexes of microscopic fungi in tundra and taiga soils in the north of the Kola Peninsula. Eurasian Soil Science. 2018. V. 51 (1). P. 89–95. https://doi.org/10.1134/S1064229318010106
Korneykova M.V., Redkina V.V., Shalygina R.R. Algological and mycological characterization of soils under pine and birch forests in the Pasvik Reserve. Eurasian Soil Science. 2018. V. 51 (2). P. 211–220. https://doi.org/10.1134/S1064229318020047
Kottek M., Grieser J., Beck C., Rudolf B., Rubel F. World Map of the Köppen-Geiger climate classification updated. Meteorologische Zeitschrift. 2006. V. 15 (3). P. 259–265. https://doi.org/10.1127/0941-2948/2006/0130
Marfenina O.E., Danilogorskaya A.A. Effect of elevated temperatures on composition and diversity of microfungal communities in natural and urban boreal soils, with emphasis on potentially pathogenic species. Pedobiologia. 2017. V. 60. P. 11–19. https://doi.org/10.1016/j.pedobi.2016.11.002
Marfenina O.E., Kulko A.B., Ivanova A.E., Sogonov M.V. The microfungal communities in the urban outdoor environment. Mikologiya i fitopatologiya. 2002. V. 36 (4). P. 22–32 (in Russ.).
Marfenina O.E., Lysak L.V., Ivanova A.E., Glushakova A.M., Kachalkin A.V., Nikolaeva V.V., Karlsen A.A., Tepeeva A.N. Biodiversity in urban soils: threats and opportunities (on the example of cultivated microorganisms). Abstract book of 9th international congress Soils of Urban Industrial Traffic Mining and Military Areas. “Urbanization: a challenge and an opportunity for soil functions and ecosystem services” Russia Moscow 22–26 May 2017. Mosccow, 2017. P. 337–339.
Morel J.L., Chenu C., Lorenz K. Ecosystems services provided by soil of urban, industrial, traffic, mining, and military areas (SUITMAs). Journal of Soils and Sediments. 2015. V. 15. P. 1659–1666. https://doi.org/10.1007/s11368-014-0926-0
Nikitin D.A., Marfenina O.E., Kudinova A.G., Lysak L.V., Mergelov N.S., Dolgikh A.V., Lupachev A.V. Microbial biomass and biological activity of soils and soil-like bodies in coastal oases of Antarctica. Eurasian Soil Science. 2017. V. 50 (9). P. 1086–1097. https://doi.org/10.1134/S1064229317070079
Nikitin D.A., Semenov M.V., Semikolennykh A.A., Maksimova I.A., Kachalkin A.V., Ivanova A.E. Biomass of fungi and species diversity of the cultivated mycobiota of soils and substrates in Northbrook Island (Franz Josef Land). Mikologiya i fitopatologiya. 2019. V. 53 (4). P. 210–222 (in Russ.).
Nosanchuk J.D., Stark R.E., Casadevall A. Fungal melanin: what do we know about structure? Frontiers in microbiology. 2015. V. 6. P. 1463. https://doi.org/10.3389/fmicb.2015.01463
Peretrukhina A.T. Sanitary and microbiological studies of soils in Murmansk city and the Murmansk region. Mezhdunarodnyy zhurnal eksperimentalnogo obrazovaniya. 2011. N 6. P. 14–16 (in Russ.).
Pereverzev V.N. Forest soils of the Kola Peninsula. Nauka, Moscow, 2004 (in Russ.).
Piotrowska-Długosz A., Charzyński P. The impact of the soil sealing degree on microbial biomass, enzymatic activity, and physicochemical properties in the Ekranic Technosols of Toruń (Poland). Journal of Soils and Sediments. 2015. V.15 (1). P. 47–59. https://doi.org/10.1007/s11368-014-0963-8
Polyanskaya L.M., Zvyagintsev D.G. The content and composition of microbial biomass as an index of the ecolo-gical status of soil. Eurasian Soil Science. 2005. V. 38 (6). P. 625–633.
Prokofyeva T.V., Gerasimova M.I. Urban soils: diagnostics and taxonomic position according to materials of scientific excursion in Moscow at the Suitma-9 workshop. Eurasian Soil Science. 2018. V. 51 (9). P. 995–1007. https://doi.org/10.1134/S1064229318090090
Prokofyeva T.V., Gerasimova M.I., Bezuglova O.S., Gorbov S.N., Bakhmatova K.A., Matinyan N.N., Golyeva A.A., Zharikova E.A., Nakvasina E.N., Sivtseva N.E. Inclusion of soils and soil-like bodies of urban territories into the Russian soil classification system. Eurasian Soil Science. 2014. V. 47 (10). P. 959–967. https://doi.org/10.1134/S1064229314100093
Rozanova M.S., Prokofyeva T.V., Lysak L.V., Rakhleeva A.A. Soil organic matter in the Moscow State University botanical garden on the Vorobyovy Hills. 2016. Eurasian Soil Science. V. 49 (9). P. 1013–1025. https://doi.org/10.1134/S106422931609012X
Schindelbeck R.R., van Es H.M., Abawi G.S., Wolfe D.W., Whitlow T.L., Gugino B.K., Idowu O.J., Moebius-Clune B.N. Comprehensive assessment of soil quality for landscape and urban management. Landscape and Urban Planning. 2008. V. 88 (2–4). P. 73–80. https://doi.org/10.1016/j.landurbplan.2008.08.006
Schmidt D.J.E. The ecology of urbanization: A study of soil microbial community response. PhD Dissertation. Maryland, College Park, University of Maryland, 2016.
Seifert K., Morgan-Jones G., Gams W., Kendrick B. The ge-nera of Hyphomycetes. CBS, Reus, Utrecht, 2011.
Seifert K.A., Gams W. The genera of Hyphomycetes–2011 update. Persoonia. 2011. V. 27. P. 119–129. https://doi.org/10.3767/003158511X617435
Sherman C., Unc A., Doniger T., Ehrlich R., Steinberger Y. The effect of human trampling activity on a soil microbial community at the Oulanka Natural Reserve, Finland. Appl. Soil Ecol. 2019. V. 135 (14). P. 104–112. https://doi.org/10.1016/j.apsoil.2018.11.013
Steffan J.J., Brevik E.C., Burgess L.C., Cerdà A. The effect of soil on human health: an overview. European journal of soil science. 2018. V. 69 (1). P. 159–171. https://doi.org/10.1111/ejss.12451
Stepanov A.L., Manucharova N.A., Smagin A.V., Kurbatova A.S., Myagkova A.D., Bashkin V.N. Characterization of the biological activity of the microbial complex in urban soils. Eurasian Soil Science. 2005. V. 38 (8). P. 864–869.
Trzciński P., Sas-Paszt L.M., Głuszek S., Przybył M., Derkowska E. Effect of organic cultivation on the occurrence of beneficial groups of microorganisms in the rhizosphere soil of vegetable crops. Journal of Horticultural Research. 2018. V. 26 (2). P. 15–24. https://doi.org/10.2478/johr-2018-0012
Turchanovskaya N.S., Bogdanova O.Yu. Microbiological study of the soil of Murmansk city. Uspekhi sovremennogo estestvoznaniya. 2011. N 8. P. 72 (in Russ.).
Varentsov M., Konstantinov P., Baklanov A., Esau I., Miles V., Davy R. Anthropogenic and natural drivers of a strong winter urban heat island in a typical arctic city. Atmospheric Chemistry and Physics. 2018. 18 (23). P. 17573–17587. https://doi.org/10.5194/acp-18-17573-2018
Vasenev V., Kyzyakov Ya. Urban soils as hotspots of anthropogenic carbon accumulation: Review of stocks, mechanisms and driving factors. Land Degradation and Development. 2018. V. 29 (6). P. 1607–1622. https://doi.org/10.1002/lbr.2944
Vermeire M.L., Bonneville S., Stenuit B., Delvaux B., Cornélis J.T. Is microbial reduction of Fe (III) in podzolic soils influencing C release? Geoderma. 2019. V. 340 (1). P. 1–10. https://doi.org/10.1016/j.geoderma.2018.12.045
Vikhman M.I., Ingiri A.A., Kislykh E.E., Liseenko L.A. Agroecological characteristic of urbanozem soils in Murmansk city. Agrokhimicheskiy vestnik. 2009. N 5. P. 31–33 (in Russ.).
Vikhman M.I., Kislykh E.E., Liseenko L.A. Appraisal of landfill influence on soil in condition of North Lands. Agrokhimicheskiy vestnik. 2013. N 1. P. 23–24 (in Russ.).
Vikhman M.I., Kislykh E.E., Moiseeva M.M., Nefedova E.S. Agrochemical valuation of urbanozem soils in some towns of the Murmansk region. Agrokhimicheskiy vestnik. 2008. N 4. P. 17–18 (in Russ.).
Vinogradova Yu.A., Kovaleva V.A., Lapteva E.M. Micromycetes as a component of the urban environment in the European North-East. Current Mycology in Russia. 2017. V. 6 (4). P. 286–287 (in Russ.). https://doi.org/10.14427/cmr.2017.vi.07
Zajdelman F.R. The role of gley formation in soil formation and degradation. Vestnik Rossijskoj akademii nauk. 2016. V. 86 (4). P. 342–351 (in Russ.). https://doi.org/10.7868/S086958731604023X
Zvyagintsev D.G. Methods of soil microbiology and biochemistry. MGU, Moscow, 1991 (in Russ.).
Виноградова Ю.А., Ковалева В.А., Лаптева Е.М. (Vinogradova et al.) Микромицеты как компонент городской среды на европейском северо-востоке // Современная микология в России. 2017. Т. 6. № 4. С. 286–287. https://doi.org/10.14427/cmr.2017.vi.07
Вихман М.И., Ингири А.А., Кислых Е.Е., Лисеенко Л.А. (Vikhman et al.) Агроэкологическая характеристика урбаноземов заполярного города Мурманска // Агрохимический вестник. 2009. № 5. С. 31–33.
Вихман М.И., Кислых Е.Е., Лисеенко Л.А. (Vikhman et al.) Oценка влияния полигона твердых бытовых отходов на прилегающие почвы в условиях Крайнего Севера // Агрохимический вестник. 2013. № 1. С. 23–24.
Вихман М.И., Кислых Е.Е., Моисеева М.М., Нефедова Е.С. (Vikhman et al.) Агрохимическая оценка урбаноземов некоторых городов Мурманской области // Агрохимический вестник. 2008. № 4. С. 17–18.
Демин В.И., Козелов Б.В., Елизарова Н.И., Меньшов Ю.В. (Demin et al.) Геоморфологические факторы формирования “острова тепла” в г. Апатиты // Physics of Auroral Phenomena. 2016. Т. 39. № 1. С. 154–157.
Евдокимова Г.А. (Evdokimova) Эколого-микробиологические основы охраны почв Крайнего Севера. Апатиты: Кол. научн. центр РАН, 1995. 272 с.
Евдокимова Г.А., Мозгова Н.П. (Evdokimova et al.) Микроорганизмы тундровых и лесных подзолов Кольского Севера. Апатиты: КНЦ РАН, 2001. 184 с.
Зайдельман Ф.Р. (Zajdelman) Роль глееобразования в формировании и деградации почв // Вестник Российской академии наук. 2016. Т. 86. № 4. С. 342–351. https://doi.org/10.7868/S086958731604023X
Звягинцев Д.Г. (Zvyagintsev) Методы почвенной микробиологии и биохимии. М.: Изд-во МГУ, 1991. 304 с.
Марфенина О.Е., Кулько А.Б., Иванова А.Е., Согонов М.В. (Marfenina et al.) Микроскопические грибы во внешней среде города // Микология и фитопатология. 2002. Т. 36. № 4. С. 22–32.
Никитин Д.А., Семeнов М.В., Семиколенных А.А., Максимова И.А., Качалкин А.В., Иванова А.Е. (Nikitin et al.) Биомасса грибов и видовое разнообразие культивируемой микобиоты почв и субстратов о. Нортбрук (Земля Франца-Иосифа) // Микология и фитопатология. 2019. Т. 53. № 4. С. 210–222.
Переверзев В.Н. (Pereverzev) Лесные почвы Кольского полуострова. М.: Наука, 2004. 232 с.
Перетрухина А.Т. (Peretrukhina) Санитарно-микробиологические исследования почв в г. Мурманске и Мурманской области // Международный журнал экспериментального образования. 2011. № 6. С. 14–16.
Турчановская Н.С., Богданова О.Ю. (Turchanovskaya et al.). Микробиологическое исследование почвы города Мурманска // Успехи современного естествознания. 2011. № 8. С. 72.
Чернов Т.И., Тхакахова А.К., Железова А.К., Бгажба Н.А. (Chernov et al.) Численность микроорганизмов в целинных почвах тропических лесов южного Вьетнама. Почвы в биосфере: материалы Всероссийской научной конференции с международным участием, посвященной 50-летию Института почвоведения и агрохимии СО РАН. Новосибирск, 2018. С. 439–442.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология