Микология и фитопатология, 2020, T. 54, № 6, стр. 452-459
Фомоидные грибы на растениях семейства Asteraceae в микологическом гербарии ВИЗР (LEP)
М. М. Гомжина 1, *, Ф. Б. Ганнибал 1, **
1 Всероссийский научно-исследовательский институт защиты растений
196608 Санкт-Петербург, Россия
* E-mail: gomzhina91@mail.ru
** E-mail: fgannibal@vizr.spb.ru
Поступила в редакцию 22.03.2020
После доработки 03.05.2020
Принята к публикации 11.05.2020
Аннотация
Незаменимыми биоресурсными коллекциями, используемыми для изучения биоразнообразия грибов, являются микологические гербарии. Гербарий Всероссийского научно-исследовательского института защиты растений (ФГБНУ ВИЗР) – LEP является крупнейшей в России коллекцией микроскопических фитопатогенных грибов. После многолетнего хранения некоторые из ценнейших образцов уже не могут быть использованы для морфологических исследований, но, чаще всего, сохраняют какое-то количество ДНК грибов. Поэтому наряду с морфолого-анатомическими методами, гербарные коллекции начинают изучать с применением молекулярно-генетических подходов. Фомоидные грибы (Phoma sensu lato) – крупная таксономически неоднородная широко распространенная группа анаморфных аскомицетов, представители которой могут занимать разные экологические ниши. Значительная их часть – фитопатогены, вызывающие заболевания важных сельскохозяйственных культур. Всего в Микологическом гербарии LEP хранится 1328 образцов растений, пораженных грибами, которые при депонировании в коллекцию были определены как виды рода Phoma. Нами были изучены 28 образцов растений семейства Asteraceae (сложноцветные). Образцы были собраны на территории России и стран бывшего СССР с 1895 по 1960 годы. Самый старый образец (LEP 129311) на момент исследования имел возраст 124 года. Для всех отобранных образцов были изучены морфологические признаки пикнид и конидий, а из 18 – была успешно экстрагирована ДНК и определены нуклеотидные последовательности ITS-областей рДНК, для чего, была сконструирована пара праймеров Did2F/Did2R, специфично амплифицирующая ITS-области ДНК фомоидных грибов – представителей семейства Didymellaceae. Нуклеотидные последовательности только четырех образцов удалось получить в результате использования стандартных праймеров ITS1F/ITS4. Еще 14 образов были секвенированы благодаря новым праймерам. Было показано, что в результате длительного хранения морфологические структуры в большинстве случаев разрушаются и не позволяют получить достаточно информации для корректной идентификации. С помощью молекулярно-генетических методов до уровня рода было определено 9 образцов и столько же – до уровня вида. Было определено, что в Микологическом гербарии LEP представлено 5 родов фомоидных грибов, ассоциированных со сложноцветными: Ascochyta, Boeremia, Didymella, Epicoccum, Stagonosporopsis и 4 вида: Ascochyta rabiei, Boeremia exigua, Didymella pomorum, Epicoccum nigrum. Видовая идентификация по молекулярным маркерам и морфологическим признакам совпала только для 124-летнего образца Boeremia exigua, который является на настоящий момент самым старым в мире образцом фомоидного гриба, ДНК которого была успешно выделена и амплифицирована.
ВВЕДЕНИЕ
Незаменимыми биоресурсными коллекциями, используемыми для изучения биоразнообразия грибов, являются микологические гербарии. В России поддерживается несколько микологических гербариев, насчитывающих в общей сложности несколько сот тысяч образцов.
Микологический гербарий Всероссийского научно-исследовательского института защиты растений (ФГБНУ ВИЗР), имеющий международный акроним LEP, является крупнейшей в России коллекцией микроскопических фитопатогенных грибов. Гербарий начинался с коллекции из 177 видов грибов, собранных в Смоленской губернии в 1890-х гг. основоположником отечественной фитопатологии Артуром Артуровичем Ячевским. Впоследствии им в 1907 г. была основана лаборатория микологии и фитопатологии, где по настоящий момент и хранится ценнейшая и уникальнейшая коллекция фитопатогенных грибов. В гербарии насчитывается порядка 150 000 единиц хранения и ежегодно он пополняется десятками новых образцов. География образцов поистине широка – в нем представлены все части России, сопредельные территории и регионы мира.
В результате длительного хранения неизбежно гербарные образцы постепенно утрачивают свои первоначальные свойства. По прошествии десятилетий с момента сбора, некоторые из ценнейших образцов уже не могут быть полноценно использованы для морфологических исследований, но, чаще всего, сохраняют какое-то количество ДНК грибов. Поэтому наряду с традиционными морфолого-анатомическими методами, гербарные коллекции в настоящий момент начинают изучать и с применением молекулярно-генетических подходов.
Существует потенциальная возможность выделения ДНК микроорганизма из типового или иного репрезентативного образца, который был тем или иным способом “законсервирован” для длительного хранения, и последующего секвенирования таксономически значимого участка генома для пополнения баз данных, в том числе в рамках концепции ДНК-штрихкодирования жизни. Помимо уточнения видовой принадлежности хранимых гербарных образцов их секвенирование должно привести в ближайшем будущем к значительному повышению репрезентативности баз данных, расширению знаний о видовом разнообразии грибов, существовавшем в прошедшее столетие.
Фомоидные грибы (грибы рода Phoma в его широком понимании) – крупная сложная и таксономически неоднородная группа микроскопических аскомицетов. Эти грибы широко распространены и могут быть встречены в самых разнообразных условиях (Aveskamp et al., 2008). Их обнаруживают на травянистых и древесных растениях, в почве, воде, воздухе, молоке, масле, краске, на бумаге (Boerema et al., 2004), известны изоляты с неорганических материалов (Aveskamp et al., 2008). Среди них есть патогены насекомых и позвоночных животных (Sutton 1980), а также человека (Rai et al., 2014). Значительная часть фомоидных грибов является фитопатогенами, которые поражают важные сельскохозяйственные культуры и могут при этом вызывать большие потери урожая. Фомоидные грибы являются возбудителями корневых гнилей, листовых пятнистостей и других заболеваний, известных, как фомозы. Практической значимостью обладают и те виды, которые поражают наиболее трудноискоренимые сорные растения: вьюнок полевой, борщевик Сосновского, амброзию полыннолистную, полынь, осот, бодяк и т.д. На основе фомоидных грибов ведутся разработки микогербицидов – экологически безопасных средств контроля сорных растений.
Несмотря на то, что грибы рода Phoma известны науке уже более 130 лет, очень широко распространены, их систематика до сих пор остается дискуссионной (Aveskamp et al., 2009). Род Phoma в широком понимании по количеству входящих в него видов является одним из самых обширных (4960 видов; http://www.mycobank.org). В то же время, несмотря на большой интерес микологов и фитопатологов к представителям этого рода, он остается недостаточно изученным. До сих пор нет стабильного четкого мнения о границах родов фомоидных грибов, о положении в системе сумчатых грибов и филогенетических связях с морфологически сходными родами. После проведения многочисленных и обширных молекулярно-генетических исследований (Crous et al., 2009; de Gruyter et al., 2009, 2010, 2012; Quaedvlieg et al., 2013; Phookamsak et al., 2014; Ariyawansa et al., 2015а, 2015b; Chen et al., 2015, 2017) выяснилось, что представители фомоидных грибов попадают в состав почти 73 родов и 16 семейств сумчатых грибов (Gomznina, Gannibal, 2017). Также было показано, что проводить корректную идентификацию этих грибов до таксонов уровня рода или вида рекомендуется в первую очередь по молекулярно-генетическим признакам в результате секвенирования таксономически информативных локусов ДНК (рибосомальные локусы, гены β-тубулина, фактор элонгации трансляции 1-α и т.д.).
При этом фундаментальная и практическая значимость изучения биоразнообразия фитопатогенных фомоидных грибов неоспорима. Адекватная система и номенклатура этих грибов – патогенов растений – залог успешных исследований по фитопатологии, микогеографии, экологии и эволюции грибов, биотехнологии и т.д. В целях последующего усовершенствования системы защиты растений, безусловно, необходим тщательный анализ биоразнообразия экономически значимых патогенов растений – возбудителей опасных болезней сельскохозяйственных культур и потенциальных агентов биоконтроля сорных растений.
Всего в Микологическом гербарии LEP хранится 1328 образцов растений, пораженных грибами, которые при депонировании в коллекцию были определены как виды рода Phoma. Образцы были собраны в разные годы и географически охватывают весь Земной шар. В том числе среди имеющихся в гербарии, 28 образцов представляют растения семейства сложноцветных.
Из-за неизбежной деформации и разрушения в процессе хранения части морфологических структур, уточнение видовой и родовой принадлежности может быть корректно произведено лишь с использованием молекулярно-генетических методов, а именно, определения нуклеотидных последовательностей филогенетически информативных участков ДНК.
В связи с особенностями морфологии фомоидных грибов материал грибной этиологии на образцах пораженных растений виден невооруженным глазом, таким образом, для выделения ДНК есть возможность собрать непосредственно грибные структуры, минимизируя сбор растительной ткани. В процессе развития фомоидные грибы формируют на поверхности или под эпидермисом растений пикниды – визуально фиксируемые овальные или круглые структуры, связанные с бесполым размножением и хранящие споры. Именно из этих структур на наш взгляд целесообразно осуществлять процесс экстракции ДНК.
Из-за длительного хранения, пикниды неизбежно становятся хрупкими, и их аккуратный сбор становится трудноосуществимым, что повышает вероятность нахождения в пробе для экстракции растительной ткани, что в свою очередь может затруднять процесс последующей амплификации, либо приводить к ложноположительным результатам и иным артефактам.
Кроме того, при экстракции ДНК из гербарных образцов пораженных фомоидными грибами растений наряду с ДНК фомоидных грибов, неизбежно выделяется ДНК нецелевых объектов – других грибов, которые развивались на этом же растении сапротрофно, эндофитно или же заселили субстрат уже после его помещения в коллекцию. Действенным методом, способствующим амплификации целевой ДНК, могло бы служить использование специфичных для ДНК фомоидных грибов пар праймеров. На настоящий момент существуют специфичные праймеры для определенных, в первую очередь, опасных фитопатогенных видов грибов рода Phoma (в его прежнем широком понимании). Поскольку фомоидные грибы входят в состав разных семейств аскомицетов, сконструировать возможно только праймеры, специфичность которых ограничена одним семейством.
Целью нашего исследования было проведение реидентификации фомоидных грибов в образцах сложноцветных растений, хранящихся в Микологическом гербарии ФГБНУ ВИЗР в течение 124–60 лет с применением методов молекулярной филогении.
МАТЕРИАЛ И МЕТОДЫ
Материал. Материалом для выполнения работы по реидентификации фомоидных грибов из гербарных образцов пораженных растений семейства Asteraceae послужили 28 образцов. Гербарный материал хранится в Микологическом гербарии ФГБНУ ВИЗР (LEP). Растения были собраны на территории России в разные годы (1895–1960 гг.). Самый старый образец (LEP 129311) был собран 124 года назад.
Изучение морфологических признаков. Таксономически значимые признаки пикнид и конидий, сохранившихся для наблюдения, анализировали с помощью методов световой микроскопии. Микроскопирование осуществляли с использованием микроскопа Микромед 3 (Санкт-Петербург) и бинокулярной лупы (Carl Zeiss, Германия). Для идентификации видов изучаемых грибов использовали руководство по определению фомоидных грибов (Boerema et al., 2004).
Экстракция и амплификация ДНК. Выделение ДНК грибов из гербарных образцов осуществляли согласно стандартному методу с использованием цетилтриметиламмония бромида (ЦТАБ) и хлороформа с некоторыми модификациями (Doyle, Doyle, 1990).
Для последующего секвенирования и идентификации фомоидных грибов были амплифицированы участки таксономически информативного локуса – области внутреннего транскрибируемого спейсера рибосомальной ДНК (ITS-локус) с парой праймеров: ITS1F (Gardes, Bruns, 1993) и ITS4 (White et al., 1990). Реакции были проведены согласно следующему протоколу: каждая ПЦР-смесь (25 мкл) содержала: смесь дезоксинуклеозидтрифосфатов (200 мкМ), каждый праймер (25 мкМ), Taq-полимеразы (5 ед./мкл), 10-кратный буфер для полимеразы и ДНК (1 нг). ДНК амплифицировали согласно следующему циклу: преденатурация ДНК при 94°С, 2 мин.; денатурация 92°С 50 с; отжиг праймеров 55°C, 40 c; элонгация 72°С в течение 75 с; финальный синтез 3–5 мин при 72°С; количество циклов – 30.
Дизайн специфичных для семейства Didymellaceae праймеров, амплифицирующих ITS-локус рДНК. Для целевой амплификации ДНК только фомоидных грибов в тотальной ДНК, выделенной из пораженных сложноцветных растений, и последующего секвенирования и идентификации фомоидных грибов, целесообразно использование специфичных праймеров. Большая часть наиболее распространенных фомоидных грибов входит в состав семейства Didymellaceae, поэтому целесообразной представляется разработка праймеров, ограничив их специфичность этим семейством. Одним из наиболее информативных и популярных локусов ДНК для таксономических исследований среди фомоидных представителей семейства Didymellaceae является ITS область рДНК.
С помощью программы Primer3plus, была сконструирована пара олигонуклеотидных праймеров Did2F/Did2R (ATCTCTTGGTTCTGGCATCG, АCTGCGCTCCGAAATCAATAC). Состав ПЦР смеси был тот же, как описано выше. Амплификацию предложенных праймеров осуществляли в формате touchdown согласно следующему протоколу: преденатурация 94°С, 2 мин.; 92°С 50 с; 69°C, 40 с (первые 10 циклов) или 64°C, 40 с (20 циклов), 72°С, 75 с; финальный синтез 3–5 мин при 72°С, ожидаемый размер фрагмента – 250–300 п.н. Визуализацию продуктов ПЦР производили с помощью электрофореза в 1%-м агарозном геле с бромистым этидием.
Для оценки специфичности этой пары праймеров, была проведена ПЦР с ДНК 4-х представителей разных групп грибов: Microdochium sp. (порядок Xylariales), Fusarium sp. (Hypocreales), Alternaria sp. (Pleosporales), Hirsutella sp. (Hypocreales) и ДНК 4-х родов фомоидных грибов из семейства Didymellaceae: Ascochyta sp., Stagonosporopsis sp., Didymella sp., Boeremia sp.
Секвенирование ДНК и анализ нуклеотидных последовательностей. Для секвенирования производили очистку полученной после ПЦР ДНК согласно стандартному протоколу (Boyle, Lew, 1995). Очищенные фрагменты секвенировали по методу Сэнгера (Sanger et al., 1977) на секвенаторе ABIPrism 3500 (Applied Biosystems – Hitachi, Япония) в соответствии с протоколами производителя с использованием набора реактивов с флуоресцентно меченными дезоксинуклеозидтрифосфатами BigDye Terminator v3.1 Cycle Sequencing Kit (ABI, США).
Нуклеотидные последовательности выравнивали с помощью программы ClustalX 1.8 (Thompson et al., 1997), после чего при необходимости выравнивание корректировали вручную, после чего их сравнивали с последовательностями, представленными в GenBank.
РЕЗУЛЬТАТЫ
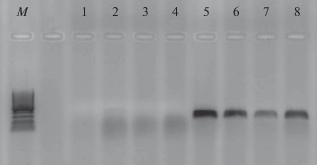
Оценка специфичности праймеров Did2F/Did2R. Была подтверждена ожидаемая специфичность разработанных нами праймеров Did2F/Did2R, избирательно амплифицирующих ITS-локусы в рДНК фомоидных грибов из семейства Didymellaceae (рис. 1). Целевой фрагмент размером 250–300 п.н. в результате ПЦР образовывался лишь у грибов из этого семейства и не формировался у представителей других групп аскомицетов.
Рис. 1.
Результаты амплификации ITS-области рДНК представителей разных родов аскомицетов с праймерами Did2F/Did2R, специфичными для родов семейства Didymellaceae: 1 – Microdochium sp.; 2 – Fusarium sp.; 3 – Alternaria sp.; 4 – Hirsutella sp.; 5 – Ascochyta sp.; 6 – Stagonosporopsis sp.; 7 – Didymella sp.; 8 – Boeremia sp.; М – маркер молекулярного веса.
Идентификация по морфологическим признакам. Из 28 гербарных образцов лишь у 6 нами была определена видовая принадлежность (табл. 1). В одном образце были обнаружены хламидоспоры, что позволило сделать предположения о таксономической принадлежности. Известно, что in vivo это характерно для двух видов: Didymella pomorum (Thüm.) Qian Chen et L. Cai и D. glomerata (Corda) Qian Chen et L. Cai. Идентификация четырех образцов нами была признана корректной. Они были определены как Phoma herbarum Westend., морфологически наблюдаемые структуры были схожи с представленными в литературе описаниями, однако, при оценке корректности проведенной реидентификации необходимо учитывать, что данный вид является типовым для рода и очень полиморфным.
Таблица 1.
Идентификация гербарных образцов сложноцветных растений, пораженных фомоидными грибами из Микологического гербария ФГБНУ ВИЗР (LEP)
| Образец LEP | Растение-хозяин | Ранее сделанная идентификация | Идентификация, выполненная в ходе данной работы | ||
|---|---|---|---|---|---|
| данные этикетки | современное название | идентификация по морфологическим признакам | идентификация по молекулярно-генетическим признакам | ||
| 129310 | Achillea millefolium | Phoma achilleae | ? | Didymella sp. | Stagonosporopsis sp. |
| 129311 | Achillea millefolium | Ph. achilleae | ? | sect. Phyllostictoides | Boeremia exigua |
| 129816 | Anthemis tinctoria | Ph. herbarum | Phoma herbarum | Phoma herbarum | Epicoccum nigrum* |
| 129642 | Arctium tomentosum | Ph. decolorans (Lév.) Sacc. | ? | sect. Phoma | Ascochyta sp. |
| 129435 | Artemisia absinthium | Ph. artemisiae | Stagonosporopsis artemisiicola | Stagonosporopsis sp. | – |
| 129801 | Artemisia absinthium | Ph. herbarum | Ph. herbarum | Stagonosporopsis sp. | – |
| 129815 | Artemisia sp. | Ph. herbarum | Ph. herbarum | sect. Phoma | B. exigua* |
| 129828 | Carduus crispus | Ph. herbarum | Ph. herbarum | Ph. herbarum | Didymella sp. |
| 129532 | Chrysanthemum leucanthemum | Ph. chrysanthemi Voglino | ? | sect. Phoma | – |
| 129537 | Cichorium sp. | Ph. cichorii Pass. | ? | sect. Phoma | Ascochyta sp. |
| 130273 | Cirsium lanceolatum | Ph. pycnocephali Pass. | ? | sect. Phoma | Ascochyta sp. |
| 129744 | Cirsium sp. | Ph. fictilis | Didymella pomorum | sect. Phoma | – |
| 129535 | Crepis tectorium | Ph. cichoriacearum Sacc. | ? | Leptosphaeria sp. | – |
| 129509 | Erigeron acer | Ph. canadensis Allesch. | ? | sect. Phoma | B. exigua |
| 129728 | Erigeron acer | Ph. erigerontis | ? | sect. Phoma | B. exigua |
| 129750 | Filago arvensis | Ph. filaginis-arvensis | ? | Didymella glomerata/D. pomorum | B. exigua |
| 129428 | Lappa tomentosum | Phomopsis arctii (Lasch) Traverso | Diaporthe arctii (Lasch) Nitschke | Didymella sp. | Ascochyta sp. |
| 130130 | Lappa sp. | Ph. oleracea Sacc. | Ph. herbarum | sect. Phoma | Didymella pomorum* |
| 129915 | Lapsana communis | Ph. lapsanae P. Karst. | ? | sect. Phoma | Didymella sp. |
| 129934 | Leonurus cardiaca | Ph. leonuri | Leptosphaeria slovacica Picb. | sect. Phoma | – |
| 129935 | Leonurus cardiaca | Ph. leonuri | L. slovacica | L. slovacica | Ascochyta sp. |
| 129848 | Matricaria indora | Ph. herbarum | Ph. herbarum | Diaporthe sp. | – |
| 130081 | Mulgedium sp. | Ph. mulgedii | ? | sect. Phoma | – |
| 130447 | Scorzonera tausaghyz | Ph. tau-saghyzi | ? | sect. Phoma | – |
| 130378 | Solidago virgaurea | Ph. solidaginis | ? | sect. Phoma | Stagonosporopsis sp. |
| 129389 | Tanacetum sp. | Ph. ambiguella P. Karst. et Har. | ? | Didymella sp. | – |
| 129822 | Trifolium pratense | Ph. herbarum | Ph. herbarum | Ph. herbarum | Ascochyta rabiei |
| 129808 | Asteraceae | Ph. herbarum | Ph. herbarum | Ph. herbarum | A. rabiei* |
У четырех образцов были обнаружены плодовые тела, характерные для представителей из рода Didymella. У двух – наличие двух разных типов конидий, что в современном понимании характерно большей частью для представителей рода Stagonosporopsis. У одного – наличие трех типов конидий α, β и γ, что характеризует их как представителей рода Diaporthe. Еще у одного – наличие многоклеточных хламидоспор, что свойственно некоторым представителям рода Didymella. Исходя из этого, была определена родовая принадлежность семи образцов. Остальные 15 были определены только до секции, из них 14 до секции Phomа, так как наблюдались лишь сходные гладкие круглые пикниды с бесцветными одноклеточными конидиями, один – до секции Phyllostictoides, так как в пикнидах содержались конидии двух разных типов.
Идентификация по молекулярно-генетическим признакам. Из 28 гербарных образцов фомоидных грибов из 18 была успешно выделена грибная ДНК. Для этих 18 образцов была осуществлена амплификация и последующее секвенирование ITS-локусов. Из них нуклеотидные последовательности четырех образцов были получены в результате секвенирования с праймерами ITS1F/ITS4, 14 – ПЦР с разработанными специфичными праймерами Did2F/Did2R (табл. 1).
По молекулярно-генетическим признакам до уровня рода были определены фомоидные грибы в 9 образцах: пять (LEP 129642, 129537, 130273, 129428, 129935) – Ascochyta sp., два (LEP 129828, 129915) – Didymella sp., два (LEP 129310, 130378) – Stagonosporopsis sp. Фомоидные грибы в других 9 образцах были определены до таксонов уровня вида: Boeremia exigua (Desm.) Aveskamp, Gruyter et Verkley (LEP 129728, 129750 129509, 129815, 129311), Ascochyta rabiei (Pass.) Labr. (LEP 129822, 129808), Didymella pomorum (LEP 130130), Epicoccum nigrum Link (LEP 129816).
ОБСУЖДЕНИЕ
Фомоидные грибы в изучаемых образцах пораженных сложноцветных растений согласно этикеточным данным при депонировании в коллекцию были отнесены к 20 видам. Двенадцать видов, очевидно, были определены исключительно на основании связи с видом питающего растения (виды Ph. achilleae Sacc., Ph. erigerontis Petrov, Ph. filaginis-arvensis Petrov, Ph. leonuri Letendre, Ph. tau-saghyzi Cherem., Ph. kok-saghyz Cherem. и др.). В связи с тем, что в современной таксономии фомоидных грибов произошли существенные преобразования, данные о видовой принадлежности, указанные на многих гербарных этикетках в большинстве случаев устарели и, очевидно, требуют уточнения. Соответствующие родовые и видовые эпитеты представлены в табл. 1.
В результате длительного хранения гербарные образцы неизбежно постепенно утрачивают свои первоначальные свойства. Нами при реидентификации по морфологическим признакам были учтены исключительно характеристики пикнид, конидий и плодовых тел, сформировавшихся непосредственно на растении (in vivo). Единственный на настоящий момент определитель фомоидных грибов (Boerema et al., 2004) построен исключительно на признаках, которые можно наблюдать в условиях чистой культуры (in vitro). При проведении идентификации фомоидных грибов из гербарных образцов использование этой монографии имеет ряд ограничений, поскольку известно, что морфологические признаки изучаемых структур могут существенно различаться in vivo и in vitro (Boerema et al., 2004). Многие таксономически значимые признаки могут быть наблюдаемы исключительно в чистой культуре. Так, например, формирование двух типов конидий или покоящихся структур – явления, которые очень редко могут быть обнаружены при микроскопировании непосредственно пораженного растительного материала. По этим причинам провести корректную реидентификацию фомоидных грибов в гербарных образцах исключительно по морфологическим признакам спороносных структур – задача практически невыполнимая. При наличии на пораженных растениях плодовых тел фомоидных грибов становится возможным определить род телеоморфы и семейство, к которому относится объект исследования. Если структур полового размножения не обнаруживается, а есть лишь органы бесполого размножения, то идентификация по определителю осуществима лишь до секции, которые в случае фомоидых грибов являются не таксономическими группами. Идентификация хотя бы до секции, однако, может быть полезной, поскольку это позволяет в первом приближении понять к кому семейству или группе видов относится изучаемый объект.
Кроме того, поскольку in vivo фомоидные грибы формируют часто очень похожие круглые, гладкие пикниды и одноклеточные, бесцветные конидии, по таким признакам возможно идентификация лишь до секции Phoma, которая, как известно, является самой крупной и объединяет разнообразные неродственные виды. Кроме описанной выше проблемы, из-за большого возраста материала некоторые признаки не поддавались наблюдению. В результате в распоряжении оказался довольно скудный набор признаков для определения видов фомоидных грибов.
Более информативными оказались молекулярно-генетические признаки. Полученные нуклеотидные последовательности ITS-локуса рДНК позволили достоверно и объективно идентифицировать грибы девяти образцов до уровня рода, а девяти – до вида. Идентификация фомоидных грибов из гербарных образцов до рода также является информативной, поскольку позволяет судить о представленном в коллекции биоразнообразии грибов. Так, секвенирование ITS-локуса фомоидных грибов из гербарных образцов позволило установить, что в коллекции представлен не один род Phoma, а пять других родов. Видовая идентификация фомоидных грибов была осуществлена не во всех образцах. Это связно с тем, что нами были определены нуклеотидные последовательности только ITS-областей ДНК. Для определения фомоидных грибов до уровня вида в отдельных случаях достаточно секвенирования одного ITS-локуса, в других случаях необходимо включать в анализ как минимум последовательности гена β-тубулина. При работе с гербарными образцами эта задача усложняется, поскольку со временем ДНК неизбежно разрушается и если есть вероятность того, что многокопийные локусы (например ITS) сохранились, то вероятность того, что белок-кодирующие последовательности не деградировали, невелика.
Молекулярные данные и морфологические признаки согласовались только для образца LEP 129311. По морфологическим признакам он был признан представителем бывшей секции Phyllostictoides. Молекулярные признаки позволили идентифицировать этот образец, как Boeremia exigua – вид, который был типовым для данной секции. Для остальных 17 образцов морфологические и молекулярно-генетические признаки не согласовывались.
Определение видов фомоидных грибов, осуществленное нашими предшественниками, и, как следствие, названия, указанные на этикетках гербарных конвертов, не согласовывалось ни для одного исследованного образца. Это может быть объяснено тем, что в предыдущие годы взгляды на систематику и номенклатуру фомоидных грибов существенно отличались от современных. Например, вид Phoma artemisiae Kalchbr. et Cooke согласно современным взглядам следует называть Stagonosporopsis artemisiicola (Hollós) Aveskamp, Gruyter et Verkley, а Phoma fictilis Delacr. – Didymella pomorum. Кроме того, ранее полагали, что идентификацию видов Phoma можно проводить по связи с растением-хозяином. Так, Phoma на Mulgedium sp. идентифицировали как Phoma mulgedii Naumov, а обнаруженные пикниды на стеблях Solidago virgaurea связывали с развитием на этом растении Phoma solidaginis Cooke.
Впервые в России фомоидные грибы из гербарных образцов пораженных растений семейства Asteraceae были изучены и достоверно идентифицированы с применением методов молекулярной филогении. Таким образом, в Микологическом гербарии ФГБНУ ВИЗР, в гербарных образцах пораженных сложноцветных растений выявлено пять родов фомоидных грибов: Ascochyta, Boeremia, Didymella, Epicoccum и Stagonosporopsis и четыре вида B. exigua, A. rabiei, D. pomorum, E. nigrum.
Образец Boeremia exigua LEP 129311, собранный А.А. Ячевским на своей родине в Смоленской губернии, хранится в Микологическом гербарии ФГБНУ ВИЗР уже 125 лет. На настоящий момент он является самым старым в мире образцом фомоидного гриба, ДНК которого была успешно выделена, амплифицирована, и для которого была определена нуклеотидная последовательность ITS-локуса. До этого времени самым старым образцом фомоидного гриба, из которого была только выделена, но не отсеквенирована ДНК, был 97-летний образец Didymella pinodes (Berk. et A. Bloxam) Petr. (Cubero et al., 1999).
Разработанные праймеры Did2F/Did2R специфичные для грибов семейства Didymellaceae целесообразно использовать для амплификации и последующего секвенирования таксономически информативных локусов ITS рДНК фомоидных грибов в тотальной ДНК, выделенной из гербарных образцов пораженных растений. Использование этих специфичных праймеров позволяет избегать амплификации рДНК других грибов и растений и получения ложноположительных результатов.
В дальнейшем для усовершенствования возможностей идентификации фомоидных грибов из гербарных образцов растений разных семейств актуальна разработка и использование праймеров для амплификации таксономически информативных локусов, специфичных для разных семейств фомоидных грибов (Didymellaceae, Phaeosphaeriaceae, Leptosphaeriaceae, Pleosporaceae и т.д.). Секвенирование гербарных образцов грибов на настоящий момент является мощным инструментом, который позволит судить не только о разнообразии, но и о географическом распространении грибов, в том числе в историческом аспекте.
Работа выполнена при финансовой поддержке Российского научного фонда (проект 19-76-30005).
Список литературы
Ariyawansa H.A., Phukhamsakda C., Thambugala K.M. et al. Revision and phylogeny of Leptosphaeriaceae. Fungal Diversity. 2015a. V. 74. P. 19–51. https://doi.org/10.1007/s13225-015-0349-2
Ariyawansa H.A., Thambugala K.M., Manamgoda D.C. et al. Towards a natural classification and backbone tree for Pleosporaceae. Fungal Diversity. 2015b. V. 71. P. 85–139. https://doi.org/10.1007/s13225-015-0323-z
Aveskamp M.M., Verkley G.J.M., de Gruyter J. et al. DNA phylogeny reveals polyphyly of Phoma section Peyronellaea and multiple taxonomic novelties. Mycologia. 2009. V. 101 (3). P. 363–382. https://doi.org/10.3852/08-199
Aveskamp M.M., de Gruyter J., Crous P.W. Biology and recent developments in the systematics of Phoma, a complex genus of major quarantine significance. Fungal Diversity. 2008. V. 31. P. 1–18.
Boerema G.H., Gruyter J., Noordeloos M.E. et al. Phoma identification Manual. CABI Publishing, 2004.
Boyle J.S., Lew A.M. An inexpensive alternative to glassmilk for DNA purification. Trends Genet. 1995. V. 11(1). P. 8. https://doi.org/10.1016/S0168-9525(00)88977-5
Brock P.M., Döring H., Bidartondo M.I. How to know unknown fungi: the role of a herbarium. New Phytologist. 2009. V. 181. P. 719–724. https://doi.org/10.1111/j.1469-8137.2008.02703.x
Chen Q., Jiang J.R., Zhang G.Z. et al. Resolving the Phoma enigma. Stud. Mycol. 2015. V. 82. P. 137–217. https://doi.org/10.1016/j.simyco.2015.10.003
Chen Q., Hou L.W., Duan W.J. et al. Didymellaceae revisited. Stud. Mycol. 2017. V. 87. P. 105–159. https://doi.org/10.1016/j.simyco.2017.06.002
Crous P.W., Schoch C.L., Hyde K.D. et al. Phylogenetic lineages in the Capnodiales. Stud. Mycol. 2009. V. 64. P. 17–47. https://doi.org/10.3114/sim.2009.64.02
Cubero O.F., Crespo A., Fatehi J. et al. DNA extraction and PCR amplification method suitable for fresh, herbarium-stored, lichenized, and other fungi. Pl. Syst. Evol. 1999. V. 216. P. 243–249. https://doi.org/10.1007/BF01084401
de Gruyter J., Woudenberg J.H.C., Aveskamp M.M. et al. Redisposition of Phoma-like anamorphs in Pleosporales. Studies in mycology. 2012. V. 75. P. 1–36. https://doi.org/10.3114/sim0004
de Gruyter J., Aveskamp M.M., Woudenberg J.H.C. et al. Molecular phylogeny of Phoma and allied anamorph genera: towards a reclassification of the Phoma complex. Mycol. Res. 2009. V. 113. P. 508–519. https://doi.org/10.1016/j.mycres.2009.01.002
de Gruyter J., Woudenberg J.H.C., Aveskamp M.M. et al. Systematic reappraisal of species in Phoma section Paraphoma, Pyrenochaeta and Pleurophoma. Mycologia. 2010. V. 102 (5). P. 1066–1081. https://doi.org/10.3852/09-240
Doyle J.J., Doyle J.L. Isolation of plant DNA from fresh tissue. Focus. 1990. V. 12. P. 13–15. https://doi.org/10.1007/978-3-642-83962-7_18
Gardes M., Bruns T.D. ITS primers with enhanced specificity for basidiomycetes – application to the identification of mycorrhizae and rusts. Molecular Ecology. 1993. V. 2. P. 113–118. https://doi.org/10.1111/j.1365-294X.1993.tb00005.x
Gomzhina M.M., Gannibal Ph.B. Modern systematics of the genus Phoma sensu lato. Mikologiya i fitopatologiya. 2017. V. 51 (5). P. 268–275 (in Russ).
Phookamsak R., Liu J.K., McKenzie E.H.C. et al. Revision of Phaeosphaeriaceae. Fungal diversity. 2014. V. 68. P. 159–238. https://doi.org/10.1007/s13225-014-0308-3
Quaedvlieg W., Verkley G.J. M., Shin H.D. et al. Sizing up Septoria. Stud. Mycol. 2013. V. 75. P. 307–390. https://doi.org/10.3114/sim0017
Rai M.K., Tiwari V.V., Irinyi L. et al. Advances in taxonomy of genus Phoma: polyphyletic nature and role of phenotypic traits and molecular systematics. Indian J. Microbiol. 2014. V. 54 (2). P. 123–128. https://doi.org/10.1007/s12088-013-0442-8
Sanger F., Nicklen S., Coulson A.R. DNA sequencing with chain-terminating inhibitors. Proc Natl Acad Sci U S A. 1977. V. 74 (12). P. 5463–5467. https://doi.org/10.1073/pnas.74.12.5463
Sutton B.C. The Coelomycetes. Fungi imperfecti with pycnidia, acervuli and stromata. 1st edn. Commonwealth Mycological Institute, U.K., 1980.
Thompson J.D., Gibson T.J., Plewniak F. et al. The ClustalX windows interface: flexible strategies for multiple sequence alignment aided by quality analysis tools. Nucl. acids res. 1997. V. 24. P. 4876–4882. https://doi.org/10.1093/nar/25.24.4876
White T.J., Bruns T., Lee S. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. PCR Protocols. In: Innis M.A. et al. (ed.) A guide to methods and Aapplications, Academic Press: San Diego, U.S.A., 1990. P. 315–322.
Гомжина М.М., Ганнибал Ф.Б. (Gomzhina, Gannibal) Современная систематика грибов рода Phoma sensu lato. Микология и фитопатология. 2017. Т. 51. № 5. С. 268–275.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология


