Микология и фитопатология, 2021, T. 55, № 1, стр. 11-35
Микориза липы (Tilia spp.) в искусственных насаждениях Санкт-Петербурга
В. А. Дудка 1, *, Е. Ф. Малышева 1, **, В. Ф. Малышева 1, ***, Е. А. Жукова 2, ****
1 Ботанический институт им. В.Л. Комарова РАН
197376 Санкт-Петербург, Россия
2 Государственный Русский музей
191186 Санкт-Петербург, Россия
* E-mail: VDudka@binran.ru
** E-mail: e_malysheva@binran.ru
*** E-mail: v_malysheva@binran.ru
**** E-mail: ealukmazova@mail.ru
Поступила в редакцию 14.05.2020
После доработки 15.08.2020
Принята к публикации 19.11.2020
Аннотация
Данное исследование посвящено изучению особенностей микоризы трех видов липы (Tilia сordata, T. platyphyllos и T. ×europaea) в условиях городской среды на территории г. Санкт-Петербурга. Исследование проводилось на трех модельных территориях: Летний сад, Ботанический сад и Дудергофские высоты. В ходе исследования были получены данные по морфологии, анатомии микоризы, молекулярной идентификации грибных симбионтов, оценено влияние некоторых показателей почвы на состав эктомикоризных грибов (ЭМГ). Методом световой микроскопии была подтверждена характерная для рода Tilia двойная микоризная колонизация: арбускулярная микориза (АМ) и эктомикориза (ЭМ). У всех исследуемых деревьев корневые окончания имели интенсивную микоризную колонизацию. Показатели ЭМ-колонизации менялись в зависимости от вида липы и лишь незначительно от сезона и места выявления, тогда как показатели колонизации корней АМ менялись от сезона, места выявления и вида липы. У некоторых исследуемых деревьев было обнаружено наличие тонких несептированных эндофитов. Для молекулярной идентификации симбионтов на корневых окончаниях липы использовали участок ITS-региона ядерной ДНК. Было выявлено 58 таксонов, относящихся к ЭМГ. Основными эктомикоризными симбионтами, выявленными для Tilia, являются базидиомицеты из родов Inocybe, Tomentella, Sebacina и Entoloma и аскомицеты из родов Tuber и Peziza. Среди выявленных таксонов ЭМГ впервые отмечены: для Tilia cordata 13 таксонов, для T. platyphyllos – 12, для T. ×europaea – 8. Таксономическое разнообразие ЭМГ изменялось в зависимости от вида липы, сезона и места произрастания деревьев. Для изучения влияния почвенных параметров на состав ЭМГ-сообществ был проведен анализ почвы на содержание нитратного азота (NO3¯) и подвижного фосфора (P2O5) и установлено значение рН. Среди исследованных параметров на состав ЭМГ влияет изменение концентрации подвижного фосфора и нитратного азота, а повышение рН почвы ведет к обеднению разнообразия ЭМГ.
ВВЕДЕНИЕ
Микоризный симбиоз широко распространен практически во всех наземных экосистемах. Около 90% всех ныне живущих растений образуют симбиоз с грибами (Brundrett, Tedersoo, 2018). Однако большинство исследований, посвященных микоризному симбиозу, проводится в горшечных культурах. Такие исследования не отражают всех аспектов микоризного симбиоза, а затрагивают лишь отдельные изолированные факторы. Исследования в естественной среде проводить значительно сложнее. Эти трудности связаны с тем, что большое количество факторов, как биотических, так и абиотических, одновременно влияет на формирование и функционирование ассоциативных связей между грибом и растением. Несмотря на эти сложности, исследования микоризного симбиоза в естественной среде обитания позволяют лучше оценить вклад микоризы в развитие отдельного растения или сообщества в целом.
Городская среда является агрессивным биомом для всех живых организмов (Kuhns, 1980). Чем крупнее город, тем сильнее сказывается это на городской среде. Не все живые организмы способны существовать в таких условиях. В первую очередь, это касается неподвижных живых организмов, таких как растения и грибы. Сильная загазованность, повышенное содержание пыли в воздухе, вытаптывание верхних горизонтов почвы, быстрая испаряемость влаги и т.д. угнетают состояние и сокращают срок жизни растения. В крупных населенных пунктах для озеленения и благоустройства стараются высаживать наиболее устойчивые к таким факторам растения. Одним из наиболее устойчивых к городским условиям растений является липа (Tilia spp.).
Изучение функционирования микоризного симбиоза в городских условиях позволяет прогнозировать состояние искусственных растительных насаждений. Манипулируя условиями среды посредством внесения специфичного инокулюма, изменения водного режима и минерального питания можно добиться здорового и устойчивого состояния зеленых насаждений на территории города (Chilvers et al., 1987).
Интерес к исследованию микоризы липы возник не так давно. И связанно это, скорее всего, с тем, что липа является деревом второго яруса и на протяжении всего своего ареала не образует крупных сообществ, а потому не вызывала долгое время интереса среди ботаников. Но уже на основе первых работ стало ясно, что липа образует микоризу с широким спектром эктомикоризных грибов (ЭМГ). А последние работы (Timonen, Kauppinen, 2008; Pigott, 2012) показали наличие у липы двойной колонизации – арбускулярной микоризой (АМ) и эктомикоризой (ЭМ).
Следует подчеркнуть, что изучение микоризного статуса липы в глобальном масштабе происходит неравномерно. В большей степени исследован вид T. cordata (Busetti, 1962; Ceruti, Busetti, 1962; Pigott, 1982; Nielsen, Rasmussen, 1999; Weissenhorn, 2002; Timonen, Kauppinen, 2008; Fini et al., 2011; Lang et al., 2011; Dudka et al., 2018а; Dudka, 2018b) и имеются некоторые единичные исследования, посвященные различным аспектам микоризы у других видов: T. platyphyllos (Lang et al., 2011), T. tomentosa (Garbaye, Churin, 1996), T. americana (Giomaro et al., 2002), T. mandschurica (Guo et al., 2008) и T. ×europaea (Timonen, Kauppinen, 2008).
Многие из этих исследований освещали лишь практические аспекты проблемы микоризы липы. Например, показано, что введение искусственного инокулюма ЭМ-симбионтов положительно влияло на рост и вегетацию T. tomentosa (Garbaye, Churin, 1996). В другой работе, связанной с выявлением роли микоризы, показана повышенная устойчивость колонизированных ЭМГ-саженцев T. cordata к засолению почвы по сравнению с немикоризованным контролем (Weissenhorn, 2002). Также в работе Fini et al. (2011) было показано влияние симбионтов Glomus mossae (АМ) и Boletus edulis (ЭМ) на устойчивость саженцев липы к засухе и повышение фотосинтетической активности растения по сравнению с неинокулированными саженцами.
Эти исследования свидетельствуют о том, что микориза играет важную роль в жизни растения. О важности внесения искусственного грибного инокулюма было известно давно. На данный момент такие биоудобрения обычно используют “универсальный” набор симбионтов широкого круга. Однако, зная круг специализированных симбионтов того или иного вида растения, можно повысить эффективность использования таких биоудобрений. Для решения подобных проблем необходимо обладать информацией и специальными знаниями о качественном составе и характеристике симбионтов той или иной древесной породы, но в настоящее время таких знаний накоплено недостаточно.
Род Tilia имеет двойную микоризную колонизацию – арбускулярной микоризой (АМ) и эктомикоризой (ЭМ). АМ формируется у саженцев липы в ранний период (20–30 дней после высаживания саженца в землю). После образования системы разветвленных боковых корней (в основном это происходит к лету, если саженец был посажен весной) наблюдается образование ЭМ (Pigott, 2012). У более взрослых особей липы наблюдается сезонное преобладание АМ весной, а ЭМ летом и осенью (Timonen, Kauppinen, 2008).
Несмотря на то, что род Tilia имеет смешанный тип микоризной колонизации, во всех исследованиях наибольшее внимание уделяется именно эктомикоризной составляющей, а вклад АМ явно недооценен. Так, например, совершенно не известны грибные симбионты, образующие АМ с Tilia, не исследовано их физиологическое значение в жизни дерева, что делает это направление исследований актуальным. Опираясь на доступные нам данные, лишь в одной работе был упомянут единственный АМ-симбионт, вступающий в контакт с липой – Glomus mossae (Fini et al., 2011).
Липа часто используется в озеленении. Древесина ее значительно ниже по ценности по сравнению с такими породами, как дуб, бук или сосна. Поэтому исследований, проведенных в естественных условиях произрастания липы, крайне мало. Одна из первых работ в этой области была посвящена изучению морфотипов ЭМ корневых окончаний липы на территории Дании (Nielsen, Rasmussen, 1999), еще одна подобная работа была проведена на территории Финляндии (Timonen, Kauppinen, 2008). В этих исследованиях было показано большое богатство ЭМГ липы в ее естественных местах обитания, как и значительное обеднение состава грибных симбионтов в городской среде.
Работы, связанные с выявлением ЭМ-партнеров молекулярными методами, которые на данный момент дают самую объективную информацию о круге симбионтов растения, пока еще малочисленны. В работе, о которой уже говорилось выше, проводимой на территории Финляндии (Timonen, Kauppinen, 2008), было выявлено в общей сложности 12 симбионтов для территории города, питомника и леса. Более масштабная работа по изучению микоризного статуса основных древесных пород проведена на территории Германии (Lang et al., 2011). В данной работе было выявлено 66 таксонов грибов для рода Tilia. К сожалению, в этих исследованиях авторы не разделяли между собой виды лип. Так, в первой работе получены обобщенные данные о T. cordata и T. ×europaea, а во второй – T. cordata и T. platyphyllos, что не дает возможности оценить видоспецифичность ЭМ- симбионтов для отдельных представителей Tilia.
Все полученные до нас данные свидетельствуют о том, что основными симбионтами Tilia являются в основном базидиомицеты из родов Russula, Xerocomus, Inocybe, Amanita, Tomentella, Piloderma, Sebacina и др., и некоторые аскомицеты из родов Tuber, Peziza, Cenococcum и др.
Данное исследование посвящено изучению некоторых аспектов микоризной колонизации различных видов рода Tilia в условиях искусственных насаждений на примере нескольких модельных территорий, расположенных в черте Санкт-Петербурга. В ходе исследования были поставлены следующие задачи: определить тип и степень микоризной колонизации видов липы в городских условиях; определить, изменяется ли микоризная стратегия растения в зависимости от сезона; на основании анализа участка ДНК корневых окончаний идентифицировать виды грибов, образующих эктомикоризу с Tilia spp.; определить, меняется ли состав сообществ ЭМГ в зависимости от вида липы и условий произрастания деревьев; определить, влияют ли почвенные условия (азот, фосфор, рН) на разнообразие ЭМ-симбионтов липы.
МАТЕРИАЛЫ И МЕТОДЫ
Территория исследования. Исследование проводилось на трех модельных территориях, расположенных в черте Санкт-Петербурга: 1) Летний сад, 2) Ботанический сад Петра Великого БИН РАН и 3) Дудергофские высоты.
Летний сад – первый в Санкт-Петербурге регулярный сад, имеющий богатую 300-летнюю историю. За это время в саду менялась растительность и ландшафт парка при содействии не только человека, но и сил природы и моды в ландшафтной архитектуре. Летний сад располагается в центре города и является важной достопримечательностью, которую посещает ежегодно большое количество туристов и жителей города. В 2009–2011 гг. была проведена крупнейшая реставрация Летнего сада. Одной из ключевых задач при реконструкции было сохранение старовозрастных деревьев, большая часть которых принадлежит к роду Tilia (Melnikov, 2014). Во время реставрации неизбежно повреждались корни и для поддержания жизнеспособности деревьев использовались органические удобрения и биофунгициды (Summer garden, 2012). Это не могло не повлиять на ризосферу.
Ботанический сад БИН РАН имеет историю, сравнимую с Летним садом. Располагается сад на территории Аптекарского острова. Дендрарий Ботанического сада более разнообразен по таксономическому составу по сравнению с Летним садом, что сближает его с естественным сообществом (Lapin, 1984).
Комплексный памятник природы “Дудергофские высоты” расположен в поселке Можайский Красносельского р-на г. Санкт-Петербурга. Высоты представляют собой две горы Ореховая и Воронья с уникальным геологическим строением. До XVI в. Дудергофские высоты были покрыты еловыми лесами. К XIX в. началось частичное осветление елового леса с последующей подсадкой лиственных пород (дуб, ясень, липа и т.д.). Постепенно из-за осветления леса и частых вырубок площадь ельников стала сокращаться. После Великой Отечественной войны сильно изменился микрорельеф и состав растительного сообщества Дудергофских высот. На данный момент времени практически весь древостой Дудергофских высот является посадками, которые не прошли столетний возрастной рубеж (Volkova et al., 2006).
Объект исследования. По данным APG IV (Angiosperm Phylogeny Group, 2016) род Tilia входит в состав порядка Malvales семейства Malvaceae подсемейства Tilioideae. Исследование микоризного статуса рода Tilia проводилось на трех модельных видах, которые чаще остальных используют в озеленении Санкт-Петербурга: липа мелколистная (T. cordata), липа крупнолистная (T. platyphyllos) и широко распространенный гибрид T. cordata × T. platyphyllos – липа европейская (T. ×europaea).
Липа – долговечная порода древесных растений, большинство особей в естественной среде достигают 150-летнего возраста, иногда 500–800 лет. В городских условиях, особенно вдоль проезжих дорог и производств, срок жизни деревьев сокращается до 80–100 лет, но в садах и парках сохраняются и вековые деревья. Липа активно используется в озеленении городов, т.к. считается одной из наиболее теневыносливых и газоустойчивых пород древесных растений, способна переживать периоды временного пересыхания и временного повышения грунтовых вод. Кроме того, T. cordata более толерантна к низким температурам по сравнению с Quercus robur. Однако у липы есть свои недостатки, например, деревья не выносят слишком сухих и засоленных почв (Vasilyev, 1958; Pigott, 1991; Pigott, 2012).
Tilia cordata, T. × europaea и T. platyphyllos широко представлены в озеленении городов России и Европы. Липы используют для создания аллей, скверов и регулярных садов в городах. Липа ценится в ландшафтной архитектуре как растение с красивым габитусом, легко поддающимся формированию, как древесная порода, сочетающая прочность и устойчивость к гниению. Стоит отметить, что липа, может играть важную роль в поддержании и улучшении плодородия почвы, и уже давно признана лесниками как порода с таким потенциалом (Pigott, 2012).
На модельных территориях были отобраны для исследования в общей сложности 24 дерева разного возраста и состояния (табл. 1). В Летнем саду: 13 деревьев (из них 5 – T. cordata, 4 – T. platyphyllos, и 4 –T. × europaea); в Ботаническом саду: 8 деревьев (из них 4 – T. cordata, 2 – T. platyphyllos, и 2 – T. × europaea); на Дудергофских высотах: 3 дерева (T. cordata). На территории Летнего сада микоризные окончания отбирались у деревьев, расположенных как в боскетах (огороженные участки сада), так и на аллеях в возрасте от 20 до 200 лет. В Ботаническом саду БИН РАН отбор проб у деревьев был как на территории самого сада, так и на прилегающей к саду территории со стороны улицы Профессора Попова.
Таблица 1.
Схема отбора проб
| Вид | Возраст | № дерева |
|---|---|---|
| Летний сад | ||
| Tilia cordata | >15 лет | Shp |
| T. cordata | >60 лет | 128 |
| T. cordata | 40–100 лет | 25 |
| T. cordata | >100 лет | 51 |
| T. cordata | 200–300 лет | 27 |
| T. ×europaea | 40–100 лет | 35 |
| T. ×europaea | 40–100 лет | 129 |
| T. ×europaea | >100 лет | 90 |
| T. ×europaea | >200 лет | 85 |
| T. platyphyllos | 40–100 лет | 118 |
| T. platyphyllos | 40–100 лет | 11 |
| T. platyphyllos | >100 лет | 78 |
| T. platyphyllos | около 200 лет | 77 |
| Ботанический сад Петра Великого | ||
| T. cordata | 40–100 лет | 2 |
| T. cordata | 40–100 лет | 1РР* |
| T. cordata | >100 лет | 32 |
| T. cordata | >100 лет | 2РР* |
| T.×europaea | 40–100 лет | 4 |
| T. ×europaea | >100 лет | 1 |
| T. platyphyllos | 40–100 лет | 3 |
| T. platyphyllos | >100 лет | 15 |
| Дудергофские высоты | ||
| T. cordata | <50 лет | 1D |
| T. cordata | <30 лет | 2D |
| T. cordata | около 80 лет | 3D |
Отбор проб микоризных окончаний. Отбор микоризных корневых окончаний исследуемых деревьев проводили в сентябре 2017 г. и в мае 2018 г. Отбор проб осуществлялся по ранее описанным методикам (Ishida et al., 2007; Timonen, Kauppinen, 2008; Smith, Smith, 2011).
Корневые окончания отбирали в проекции кроны каждого дерева, с двух противоположных сторон от ствола дерева, на расстоянии 15–30 см и на глубине 10 см. Однако, в случае с деревьями, расположенными на аллее Летнего сада, корневые окончания располагались на глубине от 15 до 30 см. Перед выкапыванием корней с места сбора удаляли верхний слой с надпочвенной растительностью и неразложившимися органическими остатками. После этого аккуратно удаляли излишки почвы, а корни помещали в пластиковый пакет и транспортировали в лабораторию, где они хранились при –20°С до проведения анализа.
Морфологический анализ микоризных окончаний. Морфологический анализ и визуальная оценка степени микоризной колонизации корневых окончаний проводили по методике Trouvelot et al. (1986) с некоторыми модификациями (Koske, Gemma, 1989; Giomaro et al., 2002).
Образцы корневых окончаний, отобранные в проекции кроны одного дерева, в дальнейшем учитывались как один образец. Корни аккуратно и тщательно отмывали от почвы. Отмытые образцы корневых окончаний нарезали на фрагменты ≈1 см дл. и помещали в емкость с водой. На следующем этапе случайным образом из емкости отбирали 30 фрагментов для анализа.
Отобранные фрагменты просматривали под бинокуляром и разделяли на две части: первая часть – корневые окончания с ЭМ, вторая часть – корневые окончания с АМ. Эктомикоризные окончания отбирали для дальнейшего молекулярного исследования ДНК. Для этого их просматривали под бинокуляром на предмет наличия плотного, живого мицелиального чехла.
Корневые окончания, которые были колонизированы арбускулярной микоризой, подвергали дополнительным этапам обработки – обесцвечивания и окрашивания для определения степени колонизации грибами. На этапе обесцвечивания образцы помещали в 10%-м KOH в термостат на 3–4 ч и нагревались до температуры 95°С. После этого их интенсивно промывали в воде и дополнительно обесцвечивались выдерживанием в аммиачном растворе H2O2 по методике (Koske, Gemma, 1989) с некоторыми модификациями, а затем окрашивались Cotton Blue (Giomaro et al., 2002) для последующего микроскопирования и определения степени АМ колонизации. Арбускулярная микориза в данной работе оценивалась только визуально, по микроморфологическим критериям. Идентификация грибных симбионтов, образующих арбускулярную микоризу, молекулярными методами не проводилась.
Для каждого дерева было проанализировано приблизительно 50–60 см микоризных окончаний. Микоризная колонизация обоих типов (ЭМ и АМ) одновременно оценивалась для каждого анализируемого образца с помощью методов световой микроскопии. Статистические параметры рассчитывали согласно методике, предложенной Trouvelot et al. (1986) с некоторыми модификациями.
Все первичные данные заносили в таблицы и затем анализировали с помощью программы Mycocalc (http://www2.dijon.inra.fr/mychintec/Mycocalc-prg/download.html).
Молекулярно-генетический анализ. Отобранные образцы эктомикоризных корневых окончаний помещали в 1.5-миллилитровые пробирки с 150 мкл лизирующего буфера (на основе 2%-го СТAB). Выделение ДНК из образцов, хранящихся в 2%-м CTAB-буфере, производили с использованием коммерческих наборов NucleoSpin Plant II Kit (Macherey-Nagel GmbH and Co. KG) и Animal and Fungi DNA Preparation Kit (Jena Bioscience) согласно прилагаемым инструкциям. Для амплификации, а также секвенирования участка ITS1–5.8S–ITS2 яДНК, использовали пару праймеров ITS1F–ITS4 (Gardes, Bruns, 1993). Амплификацию проводили с применением стандартных для использованных праймеров протоколов ПЦР (White et al., 1990). Очистку продуктов ПЦР производили с помощью наборов Fermentas Genomic DNA Purification Kit (Thermo Scientific). Секвенирование осуществляли на автоматическом анализаторе нуклеиновых кислот ABI model 3130 Genetic Analyzer (Applied Biosystems) с последующей обработкой полученных данных в программе MEGA X (Kumar et al., 2018).
Идентификацию таксонов ЭМГ, выделенных исключительно из микоризных окончаний, до видового, родового и выше уровня производили с использованием алгоритма сравнения гомологичных последовательностей BlastN с ресурсами доступных баз данных GenBank (http://www.ncbi.nlm.nih.gov/genbank/) и UNITE (http://unite.ut.ee/). В анализ вовлекались лишь последовательности, отвечающие требованиям хорошего качества и не содержащие ПЦР-химер (Nilsson et al., 2012). Для определения границ изучаемых таксонов (ОТЕ) принимали установленный для ITS грибов нижний порог (threshold или cutoff value), равный 97–98% (Smith et al., 2013; Kõljalg et al., 2013). Идентифицированным таким образом таксонам затем присваивали статус микоризообразователей, либо сапротрофов, либо эндофитов исходя из наиболее полной на данный момент классификации грибов с эктомикоризной жизненной стратегией (Tedersoo et al., 2010).
Выравнивание нуклеотидных последовательностей осуществляли с помощью программы Muscle (встроенной в MEGA X) (Kumar et al., 2018), использующей алгоритм множественного выравнивания. Филогенетические деревья были построены с помощью метода максимального правдоподобия (maximum likelihood – ML) в программе RAxML v.0.6.0 на соответствующем сервере в Интернете (http://raxml-ng.vital-it.ch/#/). Предварительно была протестирована эволюционная модель отдельно для двух независимых наборов данных ITS (для Basidiomycota и Ascomycota) с помощью Akaike Information Criterion (AIC) на FindModel веб-сервере в Интернете (http://www.hiv.lanl.gov/content/sequence/findmodel/findmodel.html). Для обоих наборов данных была выбрана одинаковая модель эволюции нуклеотидных последовательностей (GTR model).
Химический анализ почвы. Отбор образцов почвы осуществляли на всех модельных территориях в непосредственной близости от исследуемых деревьев: пять точек для Летнего сада, четыре в Ботаническом саду, две точки на Дудергофских высотах. Отбор проб почвы осуществляли на уровне, соответствующем отбору корневых окончаний, т.е. на глубине 10–15 см. После отбора пробы транспортировали в лабораторию. Пробы были проанализированы специалистами Санкт-Петербургского государственного лесотехнического университета им. С.М. Кирова. Анализ почвы проводился по следующим параметрам: азот нитратный (NO3-), фосфор подвижный (P2O5) и рН. Данные параметры были измерены фотометрическим методом с протоколами измерений ПНД Ф 16.1:2:2.2:3.67-10 для азота нитратного (NO3 ГОСТ Р 54650) и для фосфора подвижного (P2O5). Фотометрический метод с соответствующими протоколами проводился на спектрофотометре ПЭ-5300В и фотометре фотоэлектрическом КФК-3. Измерение рН почвы проводилось на Hanna Instruments pH Meter 211 в лаборатории биохимии грибов БИН РАН по соответствующей методике (McLean, 1982).
Статистическая обработка данных. Статистическая оценка данных была выполнена с помощью языка программирования R 3.3.3 (R Core Team, 2012) в программной среде RStudio 1.0.136 (RStudio Team, 2017). Для измерения общей изменчивости данных использовался метод анализа главных компонентов с помощью пакета “vegan” (Oksanen et al., 2018). Все графики визуализированы с помощью пакета “ggplot2” (Wickham, 2009).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Результаты морфологического анализа микоризных окончаний Tilia spp. В исследуемых срезах корневых окончаний T. cordata, T. platyphyllos и T. ×europaea наблюдалась двойная АМ- и ЭМ-колонизация. Ранее уже было известно о смешанном типе микоризной колонизации для рода Tilia в целом (Pigott, 2012). Однако, для T. platyphyllos и T. ×europaea до наших исследований отмечалась лишь ЭМ-колонизация (Wang, Qiu, 2006).
Корневые окончания, колонизированные АМ- симбионтом, характеризовались слабым ветвлением, светло-коричневым цветом, наличием редких корневых волосков (рис. 1, а, г). Имелся свободный несептированный мицелий (рис. 1, к), внутрикорневые структуры были представлены межклеточным мицелием и внутриклеточными структурами, а именно гифальными клубками (рис. 1, ж) и разветвленным мицелием внутри клеток. Типичные для арбускулярной микоризы структуры – арбускулы и везикулы – не были встречены.
Рис. 1.
Общий вид корневых окончаний липы, колонизированных ЭМГ и АМГ: а – корневые окончания, колонизированные АМГ; б – корневые окончания, колонизированные ЭМГ; в – плотный черный микоризный чехол и мощные черные ризоморфы Cenococcum geophilum, увеличение 500 мкм; г – микоризные окончания с АМ, увеличение 200 мкм; д – эктомикоризные окончания, увеличение 500 мкм.; е – общий вид мицелиального чехла на поверхности кончика корня, увеличение 20 мкм; ж – гифальные клубки в клетках ризодермы корня, увеличение 20 мкм.; з – плотный, светло-коричневый мицелиальный чехол с отходящим свободным мицелием, увеличение 500 мкм; и – фрагмент мицелиального чехла, увеличение 50 мкм.; й – клетки коры корня с массовым развитием внутриклеточных везикулоподобных структур, увеличение 100 мкм; к – фрагмент свободного несептированного мицелия на поверхности корня липы, увеличение 20 мкм; л – клетки коры корня с разветвленной в межклетниках мицелиальной сетью, увеличение 20 мкм.

Наряду с характерными для АМ признаками, в ряде корней нами был обнаружен интересный микоризный морфотип, очень сходный (но не идентичный) с описанным совсем недавно при исследовании взаимодействий гломусовых грибов и тропического растения Alzatea verticillata в Эквадоре (Beck et al., 2005; Beck et al., 2007). Характерными морфологическими особенностями наблюдаемого нами типа микоризы у липы явились: чрезвычайно тонкие, древовидно- и веерообразно-разветвленные гифальные структуры, расположенные в межклетниках и густо оплетающие клетки кортикального слоя корня (рис. 1, л), развитые аппрессории, внутриклеточные гифальные клубки, а также развитая внутриклеточная несептированная мицелиальная сеть с многочисленными вздутыми “узлами”, напоминающими везикулы, но значительно более мелкими по размеру (рис. 1, й).
Следует подчеркнуть, что подобные морфологические структуры ранее наблюдались у некоторых тропических растений и приписывались так называемым “тонким эндофитам” (fine endophytes) (Hall, 1977; Dodd et al., 2000). Лишь недавние молекулярные исследования показали принадлежность большинства “тонких эндофитов” к разным родам гломусовых грибов, а именно Glomus, Acaulospora и Gigaspora (Beck et al., 2007). Также из последних работ стоит отметить, что подобными морфологическими особенностями строения обладают представители недавно выделенной группы грибов из “тонких корневых эндофитов” – Planticonsortium (Greenall) C. Walker et D. Redecker, которые выполняют сходные c АМГ функции (Beck et al., 2005; Beck et al., 2007; Strullu-Derrien et al., 2016; Orchard et al., 2017; Walker et al., 2018a, 2018b).
Отличием наблюдаемого нами морфотипа от всех известных морфотипов АМ явилось полное отсутствие арбускул и типичных везикул. Таким образом, можно с уверенностью сказать, что подобная морфолого-функциональная структура микоризы у древесных растений умеренного климата отмечается нами впервые.
Корневые окончания, колонизированные ЭМ- симбионтами, характеризовались сильным ветвлением, различной окраской – от светло-желтого, красного до темно-коричневого и угольно-черного (рис. 1, б, д), наличием мицелиального чехла (рис. 1, е, и) и отходящих от него ризоморф или свободного мицелия (рис. 1, з, в).
Всего в ходе работы проанализировано 1440 корневых окончаний. У исследуемых лип в целом преобладает ЭМ-колонизация. Корневые окончания, ассоциированные с АМ, встречаются значительно реже и лишь у немногих деревьев имеют высокую встречаемость.
Показатель общей частоты встречаемости микоризы в корневой системе растения [F (%)] (общее количество колонизированных фрагментов корня на число выборки) имел достаточно высокие значения и варьировал от 20 до 100% (табл. 2). Таким образом, все исследованные деревья были в достаточной степени колонизированы микоризой. Наиболее вариабельным и информативным параметром является интенсивность микоризной колонизации [степень колонизации корня на число выборки М (%)].
Таблица 2.
Показатели микоризной колонизации Tilia spp.
| Номер дерева | Численные показатели микоризной колонизации (в %) | ||||||
|---|---|---|---|---|---|---|---|
| F | M(ЭM) | m(ЭM) | M(AM) | m(AM) | V(АМ) | $v$(АМ) | |
| Осенний период | |||||||
| 35 | 100 | 79.73 | 79.73 | – | – | – | – |
| 129 | 100 | 95.00 | 95.00 | – | – | – | – |
| 90 | 100 | 71.93 | 71.93 | – | – | – | – |
| 85 | 86.66 | 57.60 | 66.46 | – | – | – | – |
| Shp | 20 | 15.83 | 95 | 3.16 | 95.00 | 0.31 | 10.10 |
| 128 | 86.66 | 73.20 | 84.46 | – | – | – | – |
| 25 | 96.66 | 89.33 | 92.41 | – | – | – | – |
| 51 | 60 | 0.03 | 1.0 | 19.40 | 34.23 | 16.64 | 85.77 |
| 27 | 100 | 89.83 | 89.83 | – | – | – | – |
| 118 | 100 | 19.16 | 82.14 | 20.66 | 26.95 | 2.14 | 10.37 |
| 11 | 93.33 | 30.53 | 48.21 | 28.36 | 94.55 | 21.35 | 75.31 |
| 78 | 100 | – | – | 1.00 | 1.00 | 0.10 | 10.10 |
| 77 | 93.33 | 60.23 | 64.53 | – | – | – | – |
| 4 | 100 | 92.00 | 92.00 | – | – | – | – |
| 1 | 100 | 85.5 | 85.53 | – | – | – | – |
| 2 | 90 | 84.66 | 94.07 | – | – | – | – |
| 1РР | 100 | 22.16 | 95.00 | 25.16 | 32.82 | 9.70 | 38.58 |
| 32 | 100 | 95.00 | 95.00 | – | – | – | – |
| 2РР | 100 | 90.83 | 90.83 | – | – | – | – |
| 3 | 96.66 | 91.83 | 95.00 | – | – | – | – |
| 15 | 100 | 38.36 | 76.73 | 38.16 | 76.33 | 35.72 | 93.62 |
| 1D | 100 | 69.86 | 87.33 | 8.16 | 40.83 | 4.09 | 50.24 |
| 2D | 100 | 95.00 | 95.00 | – | – | – | – |
| 3D | 100 | 9.70 | 58.2 | 61.50 | 73.80 | 61.50 | 100 |
| Весенний период | |||||||
| 35 | 100 | 41.50 | 83.00 | 5.83 | 11.66 | 2.93 | 50.3 |
| 129 | 100 | 95.00 | 95.00 | – | – | – | – |
| 90 | 96.66 | 91.83 | 95.00 | – | – | – | – |
| 85 | 100 | 79.66 | 79.66 | – | – | – | – |
| Shp | 100 | 33.16 | 90.45 | 50.5 | 79.73 | 20.71 | 41.02 |
| 128 | 100 | 94.16 | 94.16 | – | – | – | – |
| 25 | 100 | 46.33 | 86.87 | 34.16 | 73.21 | 13.62 | 39.89 |
| 51 | 100 | – | – | 81.33 | 81.33 | 69.69 | 85.70 |
| 27 | 100 | 95.00 | 95.00 | – | – | – | – |
| 118 | 100 | 19.00 | 95.00 | 42.03 | 52.54 | 24.15 | 57.48 |
| 11 | 100 | 31.66 | 95.00 | 36.33 | 54.50 | 23.99 | 66.05 |
| 78 | 100 | 63.33 | 95.00 | 10.00 | 30.00 | 05.03 | 50.33 |
| 77 | 96.66 | 91.83 | 95.00 | – | – | – | – |
| 4 | 100 | 95.00 | 95.00 | – | – | – | – |
| 1 | 100 | 95.00 | 95.00 | – | – | – | – |
| 2 | 100 | 95.00 | 95.00 | – | – | – | – |
| 1РР | 100 | 19.00 | 95.00 | 48.96 | 61.20 | 20.86 | 42.61 |
| 32 | 93.33 | 88.66 | 95.00 | – | – | – | – |
| 2РР | 100 | 95.00 | 95.00 | – | – | – | – |
| 3 | 100 | 95.00 | 95.00 | – | – | – | – |
| 15 | 100 | 19.00 | 95.00 | 76.00 | 95.00 | 76.00 | 100 |
| 1D | 100 | 76.00 | 95.00 | 19.00 | 95.00 | 19.00 | 100 |
| 2D | 100 | 82.33 | 95.00 | 12.66 | 95.00 | 12.66 | 100 |
| 3D | 100 | 22.16 | 95.00 | 71.16 | 92.82 | 70.07 | 98.47 |
Среди исследуемых видов лип наибольший процент колонизации корня ЭМ [М (%)] был у Т. ×europea (рис. 2, а, б). В целом, для липы европейской в данном исследовании не наблюдалась арбускулярная микориза. Однако весной был обнаружен небольшой процент колонизации корня АМ – менее 1% (рис. 2, б). ЭМ-колонизация остальных двух видов T. cordata и T. platyphyllos была ниже, но вклад арбускулярной микоризы был значительно выше по сравнению с Т. ×europea (рис. 2, а). Такое распределение микоризной колонизации для гибрида некоторые исследователи связывают с тем, что генотип растения влияет на выбор микоризной стратегии (Timonen, Kauppinen, 2008; Bainard et al., 2011; Tyburska et al., 2013). Весной наблюдалось значительное увеличение колонизации корней арбускулярной микоризой для T. cordata и T. platyphyllos (рис. 2, б).
Рис. 2.
Распределение интенсивности микоризной колонизации (М%) в зависимости от вида липы: а – осенний период; б – весенний период.
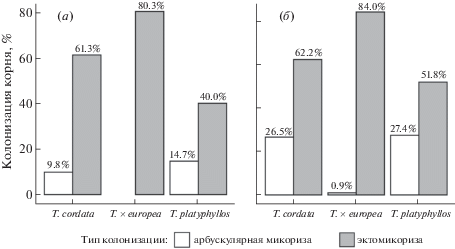
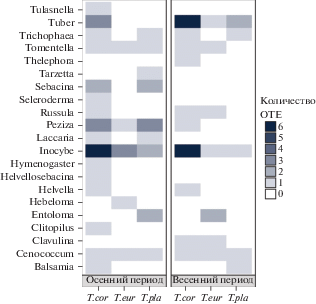
Среди исследуемых модельных территорий ЭМ- колонизация была выше в Ботаническом саду, как весной, так и осенью (рис. 3, а, б). Высокие показатели АМ-колонизации были на территории Дудергофских высот (рис. 3, а). Сезонные изменения ЭМ-колонизации среди исследуемых деревьев, в зависимости от модельных территорий, незначительны (рис. 3, а, б). А показатели АМ- колонизации лип на исследуемых территориях были выше весной по сравнению с осенним периодом (рис. 3, б). Сезонные изменения в АМ-колонизации отмечались ранее не только у липы, но и у других древесных пород, например у тополей (Bainard et al., 2011; Tyburska et al., 2013). И этот факт связывают с тем, что деревья способны менять микоризную стратегию в зависимости от условий окружающей среды. И возможно, что грибы арбускулярной микоризы менее требовательны к количеству получаемого углерода от растения, что энергетически более выгодно для растений весной (Smith, Read, 2008).
Рис. 3.
Распределение интенсивности микоризной колонизации (М%) у липы на модельных территориях: а – осенний период; б – весенний период.
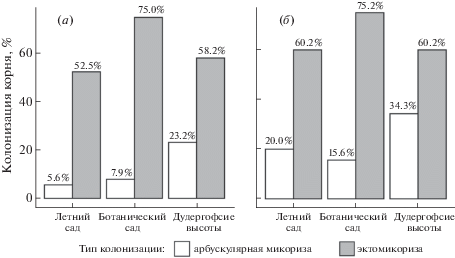
Высокая степень ЭМ-колонизации в Ботаническом саду БИН РАН, скорее всего, свидетельствует о наличии большого количества пропагул грибов для колонизации корня от деревьев других систематических групп, которые произрастают на территории сада, что отражается, в свою очередь, на более высоком разнообразии выявленных грибных таксонов.
Небольшой процент колонизации корней липы в Летнем саду, по сравнению с другими модельными территориями, может быть связан с большим влиянием городской среды. Данная территория подвергается более интенсивной антропогенной нагрузке (Летний сад находится в центре города и является часто посещаемым туристическим объектом). Также на территории Летнего сада преобладают монотипные посадки лип.
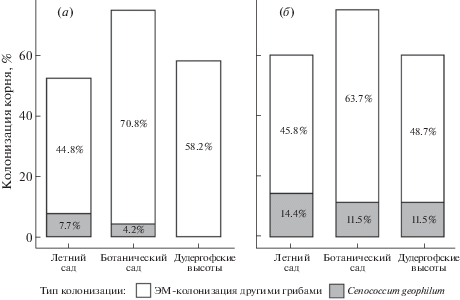
Отдельно хотелось бы выделить вклад в ЭМ-колонизацию видового комплекса из сумчатых грибов Cenococcum geophilum. Данный вид хорошо определяется морфологически и встречался практически у всех исследуемых деревьев. Достаточно высокий вклад в долю ЭМ-колонизации данного гриба наблюдался в весенний период (рис. 4, б) по сравнению с осенним (рис. 4, а). Наличие C. geophilum часто связывают с преодолением растением воздействия многих неблагоприятных факторов среды, таких как недостаток воды, нехватка почвенного пространства и загрязнение ингибирующими рост веществами (Saleh-Rastin, 1976; Pigott, 1982; Jany et al., 2003; Gonçalves et al., 2009). Возможно, что сезонные причины массового развития данного вида гриба связаны с уменьшением энергетических затрат растения на поддержание грибного симбионта сходно с АМГ, поскольку C. geophilum образует небольшой мицелий и не плодоносит (Obase et al., 2017).
Рис. 4.
Вклад Cenococcum geophilum (%) в ЭМ-колонизацию корня липы: а – осенний период; б – весенний период.
Результаты молекулярной идентификации эктомикоризных симбионтов Tilia spp. В ходе исследования для молекулярной идентификации в общей сложности было отобрано 500 (300 осенью и 200 весной) эктомикоризных корневых окончаний. Из 153 (104 отобранных осенью и 49 весной) образцов успешно выделена ДНК грибов, проведена амплификация и секвенирование ITS-региона (табл. 3).
Таблица 3.
Полный список ОТЕ ЭМГ на корневых окончаниях липы, выявленных методом молекулярной идентификации
| Номер дерева | Идентифицированные ОТЕ | Семейство | Порядок | Экологическая группа | Номер GenBank | Результат анализа BLAST | ||
|---|---|---|---|---|---|---|---|---|
| Идентичность (п.н.) | Сходство (%) | Номер GenBank или UNITE | ||||||
| Осенний период | ||||||||
| Sph | Clitopilus piperitus (G. Stev.) Noordel. et Co-David | Entolomataceae | Agaricales | ЭМ | MG844978 | 721/723 | 99% | KJ681016 |
| Peziza sp. (Pez1) | Pezizaceae | Pezizales | ЭМ | MG844981 | 322/347 | 93% | UDB032976 | |
| Laccaria sp. | Hydnangiaceae | Agaricales | ЭМ | MG844980 | 321/336 | 96% | KU685652 | |
| Scleroderma areolatum Ehrenb. | Sclerodermataceae | Boletales | ЭМ | MG844982 | 380/384 | 99% | KU878584 | |
| Helvella elastica Bull. | Helvellaceae | Pezizales | ЭМ | MG844979 | 495/501 | 99% | UDB018111 | |
| Corallomycetella repens (Berk. et Broome) Rossman et Samuels | Nectriaceae | Hypocreales | П | – | 508/519 | 98% | LT576166 | |
| Chaetomium sp. | Chaetomiaceae | Sordariales | СТ | – | 469/503 | 93% | JX984785 | |
| 11 | Trichophaea sp. | Pyronemataceae | Pezizales | ЭМ | MT554439 | 275/281 | 98% | MN653011.1 |
| Cenococcum geophilum Fr. | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 25 | Subulicystidium sp. | Hydnodontaceae | Trechisporales | СП | – | 519/573 | 91% | FJ820506 |
| Inocybe muricellata Bres. | Inocybaceae | Agaricales | ЭМ | MG844989 | 582/588 | 99% | AM882915 | |
| Phanerodontia chrysosporium (Burds.) Hjortstam et Ryvarden | Phanerochaetaceae | Polyporales | СП | – | 476/478 | 99% | KX668574 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 27 | Helvellosebacina concrescens (Schwein.) Oberw., Garnica et K. Riess | Sebacinaceae | Sebacinales | ЭМ | MG844990 | 585/590 | 99% | JQ665516 |
| Tuber rufum Pollini | Tuberaceae | Pezizales | ЭМ | MG844993 | 626/635 | 99% | UDB027553 | |
| 35 | Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 671/671 | 100% | UDB015359 |
| I. griseovelata Kühner | Inocybaceae | Agaricales | ЭМ | MT554411 | 212/216 | 98% | JF908237 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 77 | Inocybe langei R. Heim | Inocybaceae | Agaricales | ЭМ | MT554412 | 671/675 | 99% | UDB016069 |
| Peziza ostracoderma Korf | Pezizaceae | Pezizales | ЭМ | MT554421 | 613/619 | 99% | UDB025636 | |
| Sebacina sp. (Seb1) | Sebacinaceae | Sebacinales | ЭМ | MT554426 | 224/230 | 97% | HQ154352 | |
| Peziza sp. (Pez2) | Pezizaceae | Pezizales | ЭМ | MT554422 | 605/617 | 98% | MH040302 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 85 | Tomentella ellisii (Sacc.) Jülich et Stalpers | Thelephoraceae | Thelephorales | ЭМ | MT554434 | 462/465 | 99% | HQ406823 |
| Inocybe decemgibbosa (Kühner) Vauras | Inocybaceae | Agaricales | ЭМ | MT554410 | 366/369 | 99% | JF908102 | |
| 90 | I. muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 679/680 | 99% | UDB015359 |
| Peziza michelii (Boud.) Dennis | Pezizaceae | Pezizales | ЭМ | MG844983 | 584/584 | 100% | DQ200838 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 118 | Entoloma tiliae Brandrud, O.V. Morozova, Dima, Bendiksen et Noordel. | Entolomataceae | Agaricales | ЭМ | MT554404 | 263/265 | 99% | KM576403 |
| Sebacina sp. (Seb2) | Sebacinaceae | Sebacinales | ЭМ | MT554427 | 393/393 | 100% | MF352779 | |
| Peziza sp. (Pez3) | Pezizaceae | Pezizales | ЭМ | MT554441 | 210/218 | 96% | JF908562 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 128 | Tuber borchii Vittad. | Tuberaceae | Pezizales | ЭМ | MG844986 | 473/481 | 98% | UDB028214 |
| Peziza michelii | Pezizaceae | Pezizales | ЭМ | MG844983 | 626/626 | 100% | UDB032974 | |
| Mycenella trachyspora (Rea) Bon | Tricholomataceae | Agaricales | СП | – | 493/499 | 99% | UDB036599 | |
| 129 | Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | ||
| 1 | Pyronemataceae (Pyr1) | Pyronemataceae | Pezizales | – | MT554423 | 583/590 | 99% | UDB028540 |
| Grifola frondosa (Dicks.) Gray | Grifolaceae | Polyporales | П | – | 319/330 | 97% | KT693235 | |
| Hebeloma celatum Grilli, U. Eberh. et Beker | Hymenogastraceae | Agaricales | ЭМ | MT554406 | 387/390 | 99% | KX687194 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 2 | Peziza depressa Pers. | Pezizaceae | Pezizales | ЭМ | MT554420 | 565/569 | 99% | JF908539 |
| Russula pectinatoides Peck | Russulaceae | Russulales | ЭМ | MT554425 | 663/665 | 99% | UDB019332 | |
| Balsamia platyspora Berk. | Helvellaceae | Pezizales | ЭМ | MT554399 | 685/687 | 99% | KP149498 | |
| Flammulina velutipes (Curtis) Singer | Physalacriaceae | Agaricales | СП | – | 663/663 | 100% | KM668876 | |
| Thelephoraceae (The1) | Thelephoraceae | Thelephorales | – | MT554431 | 546/557 | 98% | FJ554019 | |
| Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 635/640 | 99% | AM882915 | |
| Xenopolyscytalum sp. (Xen1) | Hamatocanthoscyphaceae | Helotiales | СП | – | 437/438 | 99% | UDB013677 | |
| Tuber scruposum R. Hesse | Tuberaceae | Pezizales | ЭМ | MT554446 | 387/390 | 99% | JF261389 | |
| 3 | Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 598/602 | 99% | AM882916 |
| Tarzetta cupularis (L.) Lambotte | Pyronemataceae | Pezizales | ЭМ | MT554429 | 547/550 | 99% | UDB027406 | |
| Laccaria tortilis (Bolton) Cooke | Hydnangiaceae | Agaricales | ЭМ | MT554419 | 570/571 | 99% | MG076772 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 4 | Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 618/619 | 99% | UDB035996 |
| Heyderia abietis (Fr.) Link | Hemiphacidiaceae | Helotiales | СП | – | 272/281 | 97% | UDB031068 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 15 | Tomentella sp. (Tom1) | Thelephoraceae | Thelephorales | ЭМ | MT554436 | 571/574 | 99% | UDB013711 |
| Entoloma araneosum (Quél.) M.M. Moser | Entolomataceae | Agaricales | ЭМ | MT554405 | 260/262 | 99% | KC710056 | |
| Inocybe griseovelata | Inocybaceae | Agaricales | ЭМ | MT554411 | 208/208 | 100% | JF908237 | |
| 32 | Sebacina sp. (Seb3) | Sebacinaceae | Sebacinales | ЭМ | MT554428 | 483/483 | 100% | KM576595 |
| Pyronemataceae (Pyr2) | Pyronemataceae | Pezizales | – | MT554424 | 577/581 | 99% | UDB028540 | |
| Inocybe posterula (Britzelm.) Sacc. | Inocybaceae | Agaricales | ЭМ | MT554414 | 502/506 | 99% | KM873368 | |
| Tomentella badia (Link) Stalpers | Thelephoraceae | Thelephorales | ЭМ | MT554435 | 488/500 | 98% | JX630675 | |
| Sebacina sp. (Seb4) | Sebacinaceae | Sebacinales | ЭМ | MT554443 | 496/496 | 100% | KM576595 | |
| Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 611/611 | 100% | AM882916 | |
| Inocybe sp. (Ino1) | Inocybaceae | Agaricales | ЭМ | MT554415 | 617/617 | 100% | HF675592 | |
| Inocybe sp. (Ino2) | Inocybaceae | Agaricales | ЭМ | MT554416 | 546/551 | 99% | KT020788 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| РР1 | Sepultariella semiimmersa (P. Karst.) Van Vooren, U. Lindem. et Healy | Pyronemataceae | Pezizales | СП | – | 169/176 | 96% | KY364041 |
| Trichophaea woolhopeia (Cooke et W. Phillips) Boud. | Pyronemataceae | Pezizales | ЭМ | MT554440 | 565/584 | 97% | GU811251 | |
| РР2 | Hymenogaster arenarius Tul. et C. Tul. | Hymenogastraceae | Agaricales | ЭМ | MT554407 | 256/258 | 99% | GU479272 |
| 1D | Tulasnella sp. | Tulasnellaceae | Cantharellales | ЭМ | MT554450 | 464/518 | 90% | AF518662 |
| Phanerodontia chrysosporium | Phanerochaetaceae | Polyporales | СП | – | 468/471 | 99% | KX668574 | |
| 2D | Sarocladium kiliense (Grütz) Summerb. | Incertae sedis | Hypocreales | СП | – | 384/394 | 97% | MH790391 |
| 3D | Phanerochaete sp. | Phanerochaetaceae | Polyporales | СП | – | 324/342 | 95% | KX668574 |
| Весенний период | ||||||||
| 11 | Pseudogymnoascus pannorum (Link) Minnis et D.L. Lindner | Myxotrichaceae | Incertae sedis | СП | – | 399/401 | 99% | MF782810 |
| Tuber sp. (Tub1) | Tuberaceae | Pezizales | ЭМ | MT554447 | 523/523 | 100% | UDB033031 | |
| 118 | Tuber borchii | Tuberaceae | Pezizales | ЭМ | MG844986 | 304/308 | 99% | MF782810 |
| Trichophaea woolhopeia | Pyronemataceae | Pezizales | ЭМ | MT554440 | 507/520 | 98% | DQ200835 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 129 | Entoloma griseorugulosum Noordel. et Fern. Sas. | Entolomataceae | Agaricales | ЭМ | MT554403 | 238/245 | 97% | LN850589 |
| 25 | Tomentella sp. (Tom2) | Thelephoraceae | Thelephorales | ЭМ | MT554437 | 479/480 | 99% | UDB027150 |
| Tuber sp. (Tub2) | Tuberaceae | Pezizales | ЭМ | MT554448 | 522/524 | 99% | UDB033031 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 27 | Pseudodictyosporium wauense Matsush. | Dictyosporiaceae | Pleosporales | СП | – | 353/356 | 99% | MF948622 |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 35 | Clavulina sp. (Cla1) | Cantharellaceae | Cantharellales | ЭМ | MT554400 | 533/548 | 97% | UDB017086 |
| 77 | Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | ||
| 78 | Xenopolyscytalum sp. (Xen2) | Hama ocanthoscyphaceae | Helotiales | СП | – | 525/541 | 97% | DQ093754 |
| Balsamia platyspora | Helvellaceae | Pezizales | ЭМ | MT554399 | 338/339 | 99% | KP149498 | |
| 90 | Russula pectinatoides | Russulaceae | Russulales | ЭМ | MT554425 | 607/626 | 97% | MG679820 |
| 128 | Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | ||
| Sph | Tuber rufum | Tuberaceae | Pezizales | ЭМ | MG844993 | 299/308 | 97% | AY940646 |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 1 | Tuber scruposum | Tuberaceae | Pezizales | ЭМ | MT554447 | 197/201 | 98% | JF261405 |
| Inocybe cincinnata (Fr.) Quél. | Inocybaceae | Agaricales | ЭМ | MT554408 | 674/679 | 99% | FN550923 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 2 | Thelephoraceae (The2) | Thelephoraceae | Thelephorales | – | MT554432 | 221/230 | 96% | KM576619 |
| Tuber scruposum | Tuberaceae | Pezizales | ЭМ | MT554446 | 327/336 | 97% | JF261389 | |
| Tuber sp. (Tub3) | Tuberaceae | Pezizales | ЭМ | MT554449 | 525/526 | 99% | KU186914 | |
| Inocybe sp. (Ino3) | Inocybaceae | Agaricales | ЭМ | MT554417 | 487/492 | 99% | UDB026019 | |
| Tuber maculatum Vittad. | Tuberaceae | Pezizales | ЭМ | MT554444 | 519/519 | 100% | UDB027452 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 3 | “ “ | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | ||
| 15 | Inocybe sp. (Ino4) | Inocybaceae | Agaricales | ЭМ | MT554418 | 239/245 | 98% | HG937627 |
| 4 | Thelephoraceae (The3) | Thelephoraceae | Thelephorales | – | MT554433 | 656/656 | 100% | UDB007523 |
| Entoloma gerriae Noordel. | Entolomataceae | Agaricales | ЭМ | MT554402 | 541/543 | 99% | KC710063 | |
| Tomentella sp. (Tom3) | Thelephoraceae | Thelephorales | ЭМ | MT554438 | 505/515 | 98% | HE687150 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 32 | Russula pectinatoides | Russulaceae | Russulales | ЭМ | MT554425 | 669/673 | 99% | UDB019332 |
| Clavulina sp. (Cla2) | Cantharellaceae | Cantharellales | ЭМ | MT554401 | 614/621 | 99% | KU924302 | |
| Inocybe muricellata | Inocybaceae | Agaricales | ЭМ | MG844989 | 622/625 | 99% | AM882915 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| PP1 | Thelephora terrestris Ehrh. | Thelephoraceae | Thelephorales | ЭМ | MT554430 | 611/612 | 99% | JQ711980 |
| Peziza sp. (Pez4) | Pezizaceae | Pezizales | ЭМ | MT554442 | 564/587 | 96% | JF908553 | |
| Inocybe decemgibbosa | Inocybaceae | Agaricales | ЭМ | MT554410 | 659/670 | 98% | KY033847 | |
| I. nitidiuscula (Britzelm.) Lapl. | Inocybaceae | Agaricales | ЭМ | MT554413 | 662/672 | 99% | UDB017920 | |
| PP2 | Tuber rapaeodorum Tul. et C. Tul. | Tuberaceae | Pezizales | ЭМ | MT554445 | 391/403 | 97% | EU784430 |
| Trichophaea woolhopeia | Pyronemataceae | Pezizales | ЭМ | MT554440 | 307/311 | 99% | GU811253 | |
| Inocybe decemgibbosa | Inocybaceae | Agaricales | ЭМ | MT554410 | 642/649 | 99% | KY033847 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 1D | Helvella elastica | Helvellaceae | Pezizales | ЭМ | MG844979 | 646/651 | 99% | UDB002869 |
| Inocybe griseovelata | Inocybaceae | Agaricales | ЭМ | MT554411 | 335/342 | 98% | JF908237 | |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
| 2D | Inocybe pusio P. Karst. | Inocybaceae | Agaricales | ЭМ | MT554409 | 705/710 | 99% | UDB008811 |
| Cenococcum geophilum | Gloniaceae | Mytilinidiales | ЭМ | – | На основе морфологических признаков | |||
Результаты идентификации нуклеотидных последовательностей, полученные с помощью алгоритма Blast, выявили присутствие в микоризных окончаниях различных видов липы 77 грибных таксонов или операционных таксономических единиц (ОТЕ). Большая часть ОТЕ была идентифицирована до видового (44), родового (28) уровня и выше (5) (рис. 5, 6). Лишь C. geophilum был определен на основе морфологических признаков. Общее число выявленных ЭМ-симбионтов, таким образом, составило 78 видов.
Рис. 5.
Филогенетическое дерево, полученное с помощью ML-алгоритма на основании анализа региона ITS1–5.8S–ITS2 представителей Ascomycota. Красным цветом отмечены нуклеотидные последовательности ОТЕ, полученные в ходе проведенного исследования, черным цветом – референсные нуклеотидные последовательности из баз данных (GenBank, UNITE).
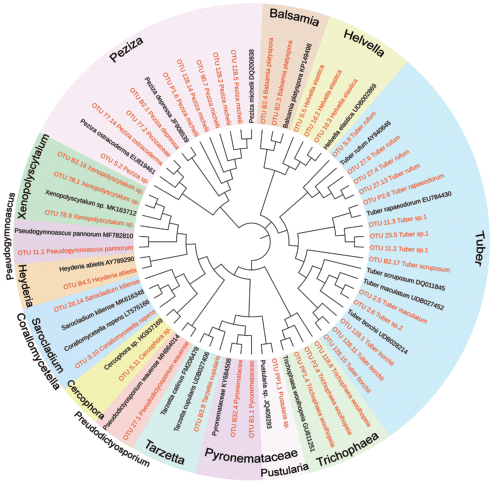
Рис. 6.
Филогенетическое дерево, полученное с помощью ML-алгоритма на основании анализа региона ITS1–5.8S–ITS2 представителей Basidiomycota. Красным цветом отмечены нуклеотидные последовательности ОТЕ, полученные в ходе проведенного исследования, черным цветом – референсные нуклеотидные последовательности из баз данных (GenBank, UNITE).
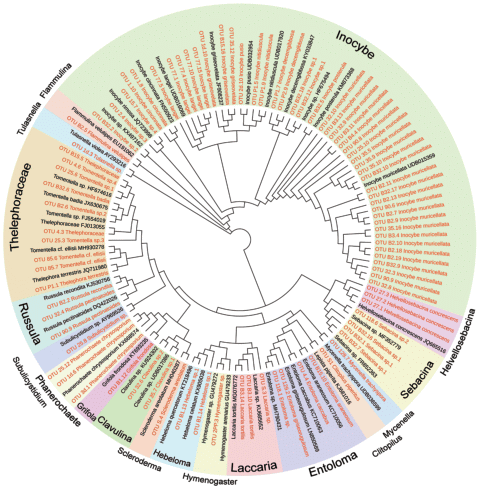
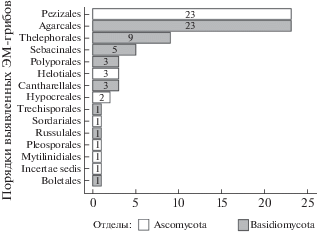
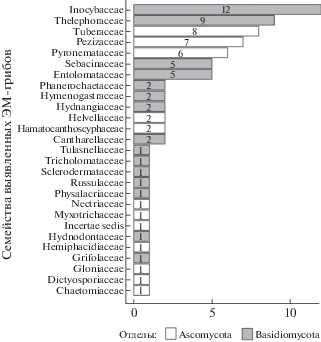
По числу таксонов преобладали базидиальные грибы (46 ОТЕ) из 8 порядков: Agaricales (23), Thelephorales (9), Sebacinales (5), Polyporales (3), Cantharellales (3), Boletales (1), Trechisporales (1), Russulales (1) (рис. 7) и 15 семейств: Inocybaceae (12), Thelephoraceae (9), Entolomataceae (5), Sebacinaceae (5), Hydnangiaceae (2), Hymenogastraceae (2), Phanerochaetaceae (2), Clavulinaceae (2), Hydnodontaceae (1), Meripilaceae (1), Physalacriaceae (1), Russulaceae (1), Sclerodermataceae (1), Tricholomataceae (1), Tulasnellaceae (1) (рис. 8).
Среди сумчатых грибов было выявлено 32 ОТЕ из 7 порядков: Pezizales (23), Helotiales (3), Hypocreales (2), Mytilinidiales (1), Pleosporales (1), Sordariales (1), incertae sedis (1) (рис. 7), распределяющихся по 12 семействам: Tuberaceae (8), Pezizaceae (7), Pyronemataceae (6), Helvellaceae (2), Hamatocanthoscyphaceae (2), Chaetomiaceae (1), Dictyosporiaceae (1), Gloniaceae (1), Hemiphacidiaceae (1), Myxotrichaceae (1), Nectriaceae (1) incertae sedis (1) (рис. 8).
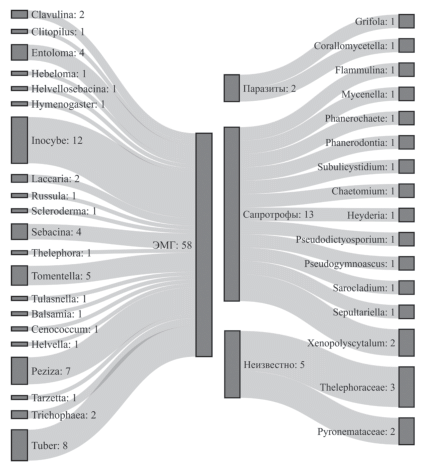
Среди выявленных 78 ОТЕ имелись представители разных экологических групп (рис. 9). Большая часть таксонов (58 ОТЕ) принадлежала к микоризообразователям, к сапротрофам было отнесено 13 таксонов: Chaetomium sp., Flammulina velutipes, Heyderia abietis, Mycenella trachyspora, Phanerodontia chrysosporium, Phanerochaete sp., Pseudodictyosporium wauense, Pseudogymnoascus pannorum, Sarocladium kiliense, Subulicystidium sp., Sepultariella semiimmersa, Xenopolyscytalum sp. (Xen1) и Xenopolyscytalum sp. (Xen2). Из патогенов обнаружены два вида: Corallomycetella repens, Grifola frondosa.
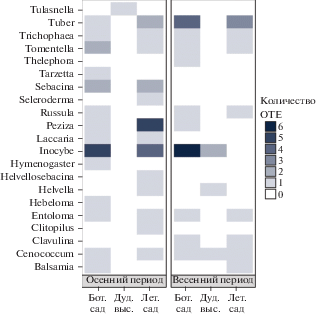
Сравнение сообществ эктомикоризных грибов у изученных видов липы, связь с возрастом деревьев, сезоном и условиями произрастания. В общей сложности для исследованных лип был выявлен 21 род эктомикоризных грибов (рис. 9). Основными эктомикоризными симбионтами, выявленными для Tilia, являются базидиомицеты из родов Inocybe (12 таксонов), Tomentella (5), Sebacina (4) Entoloma (3), а из сумчатых грибов – Tuber (8) и Peziza (7).
Среди выявленных таксонов ЭМГ на корневых окончаниях липы впервые были отмечены для T. cordata (13 таксонов): Inocybe decemgibbosa, I. griseovelata, I. nitidiuscula, I. posterula, I. pusio, Peziza depressa, Thelephora terrestris, Tomentella badia, Trichophaea woolhopeia, Tuber maculatum, T. rapaeodorum, T. scruposum, Tulasnella sp.; для Tilia platyphyllos (12 таксонов): Balsamia platyspora, Entoloma araneosum, E. tiliae, Inocybe griseovelata, I. langei, I. muricellata, Laccaria tortilis, Peziza ostracoderma, Sebacina sp., Tarzetta cupularis, Tomentella sp., Trichophaea woolhopeia; для Tilia ×europaea (8 таксонов): Entoloma gerriae, E. griseorugulosum, Hebeloma celatum, Inocybe cincinnata, I. decemgibbosa, I. griseovelata, I. muricellata, Tuber scruposum.
Стоит отметить, что в рамках нашего исследования был подтвержден микоризный статус Entoloma tiliae. Данный вид был описан О.В. Морозовой (Crous et al., 2018) на территории Ботанического сада БИН РАН под T. ×europaea. Нами E. tiliae была выявлена на территории Летнего сада у Tilia platyphyllos № 118, а также на территории Ботанического сада у T. cordata (данные, не вошедшие в статью) с помощью молекулярной идентификации.
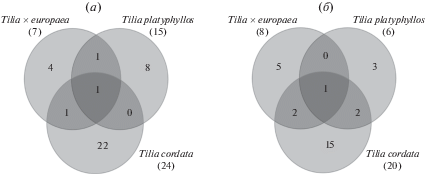
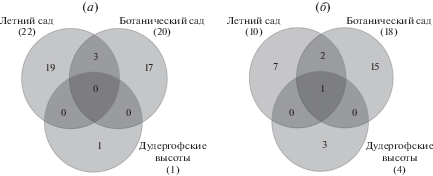
Для T. cordata было выявлено больше всего грибных таксонов (осенью 24 таксона и 20 весной), для T. platyphyllos и T. ×europaea данное разнообразие было меньше (рис. 10). На диаграмме Венна (рис. 10) можно увидеть, что количество таксонов ЭМГ меняется в зависимости от сезона у разных видов липы. На данном этапе исследования можно предположить, что для каждого вида липы характерен довольно специфический набор симбионтов. И лишь незначительная часть таксонов является общей для двух или трех видов.
Рис. 10.
Количество общих и видоспецифичных ОТЕ у разных представителей Tilia: а – осенний период; б – весенний период.
Для всех исследуемых видов рода Tilia в целом осенью наблюдалось наибольшее таксономическое разнообразие – 19 родов ЭМГ (рис. 11). Для T. cordata по видовому разнообразию преобладали роды грибов: Tuber, Peziza, Inocybe (рис. 11), а для T. platyphyllos и T. ×europaea – род Inocybe (рис. 11).
Весной наблюдалось снижение видовой представленности ЭМ родов с 19 до 12 (рис. 11). Для T. cordata отмечались такие роды как Inocybe и Tuber (рис. 11), для T. platyphyllos не наблюдалось доминирование какого-либо из родов по числу видов (рис. 11), а у T. ×europaea весной наблюдалось преобладание рода Entoloma (рис. 11).
Среди модельных территорий наибольшее число таксонов ЭМГ осенью было отмечено в Летнем саду и Ботаническом саду БИН РАН, для Дудергофских высот был выявлен только 1 таксон (рис. 12). В весенний период наибольшее количество таксонов было обнаружено на территории Ботанического сада БИН РАН. В Летнем саду количество таксонов ЭМГ сократилось по сравнению с осенью. Хотелось бы отметить, что весна 2018 г. была довольно засушливая, и, возможно, с этим фактом связано небольшое количество выявленных таксонов ЭМГ весной на территории Летнего сада. Разнообразие таксонов ЭМГ в Ботаническом саду БИН РАН может в некоторой степени определяться достаточно высоким содержанием в почве пропагул симбионтов от деревьев из других систематических групп (т.е. обмен симбионтами с широким кругом хозяев), а также более подходящими микроклиматическими условиями территории.
Рис. 12.
Количество ОТЕ ЭМГ у липы в зависимости от модельной территории: а – осенний период; б – весенний период.
На территории Летнего сада осенью по числу видов преобладали роды Inocybe, Sebacina, Tuber и Peziza (рис. 13). Для Ботанического сада БИН РАН отмечалось присутствие 14 родов с доминированием Inocybe. Для Дудергофских высот был выявлен только один род Tulasnella с одним представителем Tulasnella sp.
Весной видовая насыщенность родов выявленных ЭМГ для Летнего сада была ниже, чем осенью, и преобладал род Tuber, в Ботаническом саду БИН РАН доминировали роды Inocybe и Tuber, на Дудергофских высотах – Inocybe (рис. 13).
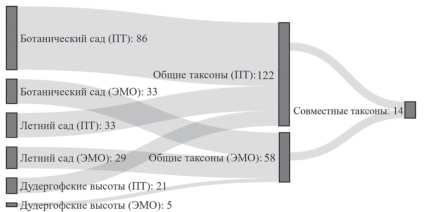
Также мы провели сравнение ЭМГ, выявленных в ходе мониторинга плодовых тел (Bondartseva et al., 2014; Morozova et al., 2014; Popov, 2014; Zhukova et al., 2017), с полученными данными молекулярной идентификации ДНК грибов из корневых окончаний лип. На основании мониторинга плодовых тел было выявлено 122 таксона эктомикоризных симбионтов для всех модельных территорий, тогда как с помощью анализа ДНК из корневых окончаний лип выделено 58 таксонов эктомикоризных грибов. При этом 14 таксонов оказались общими для “надземного” и “подземного” разнообразия (рис. 14): Entoloma araneosum, E. gerriae, E. griseorugulosum, Helvella elastica, Inocybe cincinnata, I. muricellata, I. nitidiuscula, I. posterula, Laccaria tortilis, Peziza depressa, P. michelii, Russula pectinatoides, Tarzetta cupularis и Tomentella ellisii. Метод молекулярной идентификации ЭМ симбионтов считается более достоверным для определения круга симбионтов растений, хотя нужно понимать, что и он не дает исчерпывающих результатов. При сочетании этих двух подходов можно расширить представление о круге ЭМ симбионтов липы, произрастающих в условиях городской среды.
Рис. 14.
Сравнение числа видов ЭМГ, выявленных в ходе мониторинга плодовых тел, с полученными данными молекулярной идентификации грибов из микоризных окончаний липы.
Влияние почвенных условий на состав и структуру сообществ ЭМГ. Одной из поставленных задач исследования было изучение влияния некоторых почвенных факторов на состав эктомикоризных грибных сообществ. Для этого проводился анализ почвы на содержание подвижного фосфора (P2O5, мг/кг), нитратного азота (NO$_{3}^{ - }$, мг/кг) и устанавливалось значение рН.
Выбор именно этих показателей почвы не случаен. Фосфор и азот являются важными элементами в жизни растений. Нехватка данных элементов или их наличие в труднодоступной форме замедляют рост растения (Smith, Read, 2008). Неоднократно было показано, что грибные симбионты способны улучшать минеральное питание растений (Entry et al., 2002; Courty et al., 2016), что особенно важно при небольших концентрациях N и P в почве. Микоризные грибы также участвуют в мобилизации данных элементов из труднодоступных соединений. Стоит отметить, что при высокой концентрации в почве доступного N и P будет происходить снижение колонизации корней микоризой и ее роли в минеральном питании растения (Smith, Read, 2008). Это связано с тем, что растение самостоятельно способно получать необходимое количество легкодоступного азота и фосфора для роста и развития, без затрат углерода на содержание симбионта.
Значение pH почвы влияет на состав и структуру сообществ ЭМГ. Низкое значение рН бореальных почв наиболее благоприятно для развития большинства ЭМГ в бореальной зоне. Предпочтения к кислотности могут варьировать довольно широко – от 3.5 до 6 рН, и эти предпочтения меняются в зависимости от таксона гриба. Защелачивание почвы, напротив, приводит к снижению разнообразия ЭМГ в бореальной зоне (Shubin, 1973; Smith, Read, 2008).
В нашем исследовании концентрация нитратного азота (NO$_{3}^{ - }$) и подвижного фосфора (P2O5) менялась в зависимости от места сбора. Образцы почв из Летнего сада характеризовались более низкими значениями в показателях NO$_{3}^{ - }$ и P2O5 по сравнению с другими модельными территориями (табл. 4).
Таблица 4.
Результаты анализа почвы на модельных территориях
| Место отбора | № пробы | (NO$_{3}^{ - }$), мг/кг | (P2O5), мг/кг |
|---|---|---|---|
| Летний сад | 1 | 8.1 | 44 |
| “ “ | 2 | 6 | 112 |
| “ “ | 3 | 10.6 | 98 |
| “ “ | 4 | 12.8 | 103 |
| “ “ | 5 | 9.4 | 92 |
| Ботанический сад | 6 | 22 | 190 |
| “ “ | 7 | 23 | 220 |
| “ “ | 8 | 6.9 | 170 |
| “ “ | 9 | 14 | 590 |
| Дудергофские высоты | 10 | 15 | 140 |
| “ “ | 11 | 17 | 100 |
Значения рН почвы на исследуемых территориях варьировали от 6.12 до 7.96 (табл. 5). На территории Летнего сада почвы классифицировались от слабокислых до слабощелочных, в Ботаническом саду БИН РАН – как слабокислые нейтральные, для Дудергофских высот была характерна слабощелочная почвенная среда.
Таблица 5.
Результаты измерения рН почвы для каждого исследуемого дерева
| Номер дерева | pH |
|---|---|
| 35 | 6.42 |
| 129 | 7.13 |
| 90 | 6.79 |
| 85 | 7.13 |
| Shp | 7.04 |
| 128 | 7.13 |
| 25 | 7.43 |
| 51 | 7.37 |
| 27 | 7.13 |
| 118 | 6.90 |
| 11 | 7.13 |
| 78 | 7.96 |
| 77 | 7.13 |
| 4 | 6.26 |
| 1 | 7.02 |
| 2 | 6.42 |
| 1РР | 6.73 |
| 32 | 6.12 |
| 2РР | 6.73 |
| 3 | 6.34 |
| 15 | 7.46 |
| 1D | 7.72 |
| 2D | 7.72 |
| 3D | 7.72 |
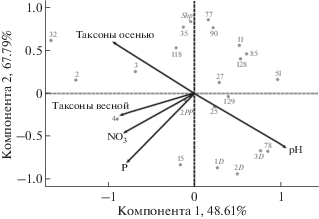
Для исследования значимости влияния почвенных факторов на разнообразие ЭМГ использовался анализ главных компонент (АГК), для проведения которого были выбраны 5 переменных: количество таксонов ЭМГ весной и осенью, показатели подвижного фосфора, нитратного азота и рН. Результаты АГК показали (рис. 15), что первая компонента описывает 48.61% изменчивости и вместе со второй компонентой они описывают 67.79% от общей изменчивости (рис. 15). Это небольшой процент объясненной дисперсии, и скорее всего не учтены какие-либо более весомые факторы. Но, несмотря на это, можно сказать, что по первой компоненте имеется положительная корреляция подвижного фосфора и нитратного азота с количеством таксонов ЭМГ весной (r = 0.87) и значимая корреляция с количеством таксонов осенью (r = 0.37). Из этого следует, что с повышением содержания в почве подвижного фосфора и нитратного азота можно будет ожидать положительную динамику в отношении увеличения разнообразия ЭМГ на наших модельных территориях. Однако, как отмечалось ранее, повышение содержания N и P в почве будет положительно влиять на разнообразие ЭМГ до тех пор, пока концентрация этих элементов не достигнет критической точки, после которой растение будет способно самостоятельно получать данные элементы без участия грибных симбионтов, что будет приводить к снижению разнообразия ЭМГ.
Из этого можно заключить, что количество азота и фосфора, которое выявлено на изученных модельных территориях, в целом благоприятствует развитию эктомикоризы. Внесение небольшого количества удобрений, содержащих N и P (при низких концентрациях этих элементов), будет способствовать поддержанию ЭМГ и улучшать состояние липы в городской среде.
По второй компоненте имеется значимая отрицательная корреляция рН почвы с количеством таксонов ЭМГ осенью (r = –0.62), и меньше весной (r = –0.18), т.е. с повышением рН будет происходить защелачивание почвы, что будет приводить к уменьшению разнообразия симбионтов и доминированию таксонов, толерантных к щелочной среде. Что и наблюдалось для территории Дудергофских высот и одного дерева из Летнего сада под номером 78, где показатели почвы были слабощелочные (от 7.72 до 7.96 рН) (табл. 5), а количество таксонов ЭМГ незначительное (от 0 до 3 таксонов на дерево). Также стоит отметить, что у этих деревьев наблюдалась высокая доля участия в колонизации корней АМ, из чего можно сделать заключение о значимой роли АМГ в микоризном симбиозе с липой в почвенной среде, склонной к защелачиванию.
Авторы выражают свою благодарность сотруднику Летнего сада инженеру СПХ, О.В. Шалакитской за помощь в проведении исследования на территории Летнего сада. Работа выполнена в рамках государственного задания БИН РАН “Биоразнообразие и пространственная структура сообществ грибов и миксомицетов в природных и антропогенных экосистемах” (регистрационный номер НИОКТР: АААА-А18-118031290108-6) на оборудовании Центра коллективного пользования научным оборудованием “Клеточные и молекулярные технологии изучения растений и грибов” Ботанического института им. В.Л. Комарова РАН (ЦКП БИН РАН) и при финансовой поддержке РФФИ в рамках научного проекта (№ 19-04-00024 A).
Список литературы
Angiosperm Phylogeny Group. An update of the angiosperm phylogeny group classification for the orders and families of flowering plants: APG IV. 2016. Bot. J. Linn. Soc. V. 181 (1). P. 1–20.
Bainard L., Klironomos J., Gordon M.A. The mycorrhizal status and colonization of 26 tree species growing in urban and rural environments. Mycorrhiza. 2011. V. 21 (2). P. 91–96. https://doi.org/10.1007/s00572-010-0314-6
Beck A., Kottke I., Oberwinkler F. Two members of the Glomeromycota form distinct ectendomycorrhizas with Alzatea verticillata, a prominent tree in the mountain rain forest of southern Ecuador. Mycol. Progress. 2005. V. 4 (1). P. 11–22.
Beck A., Haug I., Oberwinkler F., Kottke I. Structural characterization and molecular identification of arbuscular mycorrhiza morphotypes of Alzatea verticillata (Alzateaceae), a prominent tree in the tropical mountain rain forest of South Ecuador. Mycorrhiza. 2007. V. 17. P. 607–625.
Bondartseva M.A., Kotkova V.M., Zmitrovich I.V. et al. Aphyllophoroid and heterobasidioid fungi of the Peter the Great Botanical Garden of the Komarov Botanical Institute of RAS (St. Petersburg). Botany: history, theory, practice (to the 300th anniversary of the Komarov Botanical Institute): Trudy mezhdunarodnoy nauchnoy konferentsii, St Petersburg. 2014. P. 23–30 (in Russ.).
Busetti L. Sulle micorrize dei tigli (About mycorrhizas of Tilia). Allionia. 1962. V. 8. P. 45–54.
Brundrett M.C., Tedersoo L. Evolutionary history of mycorrhizal symbioses and global host plant diversity. New Phytol. 2018. P. 220.
Ceruti A., Busetti L. Sulla simbiosi micorrhizica tra tigli e Boletus subtomentosus, Russula grisea, Balsamia platysporae, Hysterangium clathroides (About mycorrhizal symbiosis of Tilia trees and Boletus subtomentosus, Russula grisea, Balsamia platyspora and Hysterangium clathroides). Allionia. 1962. V. 8. 55–66.
Courty P.E., Doidy J., Garcia K. et al. The transportome of mycorrhizal systems. 2016. https://doi.org/10.1002/9781118951446.ch14
Chilvers G., Lapeyrie F., Horan D. Ectomycorrhizal vs endomycorrhizal fungi within the same root system. New Phytol. 1987. V. 107 (2). P. 441–448. Retrieved from https://www.jstor.org/stable/2433068?seq=1.
Crous P.W., Luangsa-Ard J.J., Wingfield M.J. et al. Fungal Planet description sheets: 785–867. Persoonia. 2018. V. 41. P. 238–417. https://doi.org/10.3767/persoonia.2018.41.12
Dodd J.C., Boddington C.L., Rodriguez A. et al. Mycelium of arbuscular mycorrhizal fungi (AMF) from different genera: form, function and detection. Plant and Soil. 2000. V. 226. P. 131–151.
Dudka V.A., Malysheva E.F., Malysheva V.F. et al. Mycorrhizal status of Tilia cordata in the summer garden (Saint Petersburg): Diversity of fungal symbionts and type of mycorrhizal colonization. Mikologiya i fitopatologiya. 2018a. V. 52 (4). P. 243–251 (in Russ.).
Dudka V.A. Mycorrhizal status of Tilia cordata in the Summer Garden and Peter the Great Botanical Garden (Saint Petersburg): diversity of fungal partners and type of mycorrhizal colonization. In: International Botanical Conference of Young Scientists in Saint-Petersburg, April 22nd–28th. 2018b, pp. 208–209.
Entry J.A., Rygiewicz P.T., Watrud L.S. et al. Influence of adverse soil conditions on the formation and function of arbuscular mycorrhizas. Adv. Environ. Res. 2002. V. 7. P. 123–138.
Fini A., Piero F., Amoroso G. et al. Effect of controlled inoculation with specific mycorrhizal fungi from the urban environment on growth and physiology of containerized shade tree species growing under different water regimes. Mycorrhiza. 2011. V. 21. https://doi.org/10.1007/s00572-011-0370-6
Garbaye J., Churin J.L. Effect of ectomycorrhizal inoculation at planting on growth and foliage quality of Tilia tomentosa. J. Arboriculture. 1996. V. 22. P. 29–34.
Gardes M., Bruns T.D. ITS primers with enhanced specificity for basidiomycetes – application to the identification of mycorrhizae and rusts. Molec. Ecol. 1993. V. 2. P. 113–118.
Giomaro G., Sisti D., Zambonelli A. et al. Comparative study and molecular characterization of ectomycorrhizas in Tilia americana and Quercus pubescens with Tuber brumale. FEMS Microbiol. 2002. V. 216. P. 9–14.
Gonçalves S.C., Martins-Loução M.A., Freitas H. Evidence of adaptive tolerance to nickel in isolates of Cenococcum geophilum from serpentine soils. Mycorrhiza. 2009. V. 19 (4). P. 221–230.
Guo D., Xia M., Wei X. et al. Anatomical traits associated with absorption and mycorrhizal colonization are linked to root branch order in twenty-three Chinese temperate tree species. New Phytol. 2008. V. 180. P. 673–683.
Hall I.R. Species and mycorrhizal infections of New Zealand Endogonaceae. Trans British Mycol. Soc. 1977. V. 68. P. 341–356.
Ishida T.A., Nara K., Hogetsu T. Host effects on ectomycorrhizal fungal communities: insight from eight host species in mixed conifer–broadleaf forests. New Phytol. 2007. V. 174. P. 430–440.
Jany J.L., Martin F., Garbaye J. Respiration activity of ectomycorrhizas from Cenococcum geophilum and Lactarius sp. in relation to soil water potential in five beech forests. Plant and Soil. 2003. V. 255 (2). P. 487–494.
Koske R.E., Gemma J.N. A modified procedure for staining roots to detect VA mycorrhizas. Mycol. Res. 1989. V. 92 (4). P. 486–488.
Kõljalg U., Nilsson R.H., Abarenkov K. et al. Towards a unified paradigm for sequence-based identification of fungi. Molec. Ecol. 2013. V. 22. P. 5271–5277.
Kumar S., Stecher G., Li M. et al. MEGA X: Molecular Evolutionary Genetics Analysis across computing platforms. Mol. Biol. Evol. 2018. V. 35 P. 1547–1549. https://doi.org/10.1093/molbev/msy096
Kuhns L.J. Potential benefits of mycorrhizae in the urban environment. Metro Tree Improvement Alliance. 1980. V. 3. P. 77–82.
Lang C., Seven J., Polle A. Host preferences and differential contributions of deciduous tree species shape mycorrhizal species richness in a mixed Central European forest. Mycorrhiza. 2011. V. 21. P. 297–308.
Lapin P.I. Botanical gardens of the USSR. Moscow. Kolos. 1984. P. 216 (in Russ.).
McLean E.O. Soil pH and lime requirement. Methods of Soil Analysis. Part 2. Chemical and Microbiological Properties–Agronomy Monograph. No. 9. WI, 1982. P. 199–209.
Melnikov V.Yu. The historical range of plants for the Summer Garden. In: Abstracts of the XV conference of gardens of Saint Petersburg. St. Petersburg, 2014, pp. 106–109 (in Russ.).
Morozova O.V., Kovalenko A.E., Rebriev Yu.A. et al. Agaricoid and gasteroid fungi in the park of the Botanical Garden of the Komarov Botanical Institute. Botany: history, theory, practice (to the 300th anniversary of the Komarov Botanical Institute): Trudy mezhdunarodnoy nauchnoy konferentsii, St. Petersburg, 2014, pp. 142–149 (in Russ.).
Nielsen J., Rasmussen H. Mycorrhizal status and morphotype diversity in Tilia cordata – a pilot study of nurseries and urban habitats. Acta Horticulturae. 1999. V. 496. P. 451–459.
Nilsson R.H., Tedersoo L., Abarenkov K. et al. Five simple guidelines for establishing basic authenticity and reliability of newly generated fungal ITS sequences. MycoKeys. 2012. V. 4. P. 37–63.
Obase K., Douhan G.W., Matsuda Y. et al. Progress and challenges in understanding the biology, diversity, and biogeography of Cenococcum geophilum. In: L. Tedersoo (ed.) Biogeography of mycorrhizal symbiosis. Ecological Studies (Analysis and Synthesis). V. 230. Springer, 2017.
Oksanen J., Blanchet F.G., Friendly M. et al. Vegan: community ecology package. R package version 2.5–1. 2018. https://CRAN.R-project.org/package1/4vegan. Accessed 01.09.2018.
Orchard S., Standish R., Dickie I. et al. Fine root endophytes under scrutiny: a review of the literature on arbuscule-producing fungi recently suggested to belong to the Mucoromycotina. Mycorrhiza. 2017. V. 27 (7). P. 619–638. https://doi.org/10.1007/s00572-017-0782-z
Pigott C.D. Survival of mycorrhiza formed by Cenococcum geophilum Fr. in dry soils. New Phytol. 1982. V. 92. P. 513–517.
Pigott C.D. Tilia cordata Miller. J. Ecol. 1991. V. 79. P. 1147–1207.
Pigott C.D. Lime-trees and Basswoods: a biological monograph of the genus Tilia. Cambridge and N.Y. 2012. Cambridge University Press. https://doi.org/10.1017/CBO9781139033275.
Popov E. S. Discomycetes of Peter the Great Botanical Garden. In: Botany: history, theory, practice (to the 300th anniversary of the Komarov Botanical Institute): Trudy mezhdunarodnoy nauchnoy konferentsii, St. Petersburg, 2014, P. 166–169 (in Russ.).
R Core Team. R: A language and environment for statistical computing. R Foundation for Statistical Computing, Vienna, Austria. 2012. http://www.R-project.org/.
RStudio Team. RStudio: Integrated Development for R. RStudio, Inc., Boston, MA. 2017. URL https://rstudio.com/.
Saleh-Rastin N. Salt tolerance of the mycorrhizal fungus Cenococcum graniforme (Sow.) Ferd. Eur. J. Forest Pathol. 1976. V. 6 (3). P. 184–187.
Smith S.E., Read D.J. Mycorrhizal symbiosis. 3nd edn. London: Academic Press Ltd, 2008. P. 800.
Smith S.E., Smith F.A. Roles of arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales. Annu. Rev. Plant. Biol. 2011. V. 62. P. 227–250.
Smith M.E., Gryganskyi A., Bonito G. et al. Phylogenetic analysis of the genus Modicella reveals an independent evolutionary origin of sporocarp-forming fungi in the Mortierellales. Fungal Genetics Biol. 2013. V. 61. P. 61–68.
Strullu-Derrien C., Kenrick P., Selosse M.A. Origins of the mycorrhizal symbioses. In: F. Martin (ed.). Molecular mycorrhizal symbiosis. Wiley, 2016. P. 1–20.
Shubin V.I. Mycotrophy of tree species. Value for forest cultivation in the taiga zone. Nauka, Leningrad, 1973 (in Russ.).
Summer garden. Revival. North Slavic advertising Bureau, St. Petersburg, 2012.
Tedersoo L., May T.W., Smith M.E. Ectomycorrhizal lifestyle in fungi: global diversity, distribution, and evolution of phylogenetic lineages. Mycorrhiza. 2010. V. 20. P. 217–263.
Timonen S., Kauppinen P. Mycorrhizal colonisation patterns of Tilia trees in street, nursery and forest habitats in southern Finland. Urban Forestry and Urban Greening. 2008. V. 7. P. 265–276.
Trouvelot A., Kough J., Gianinazzi-Pearson V. Evaluation of VA infection levels in root systems. Research for estimation methods having a functional significance. In: V. Gianinazzi-Pearson, S. Gianinazzi (eds). Physiological and Genetical Aspects of Mycorrhizae. INRA Press, Paris, 1986. P. 217.
Tyburska J., Frymark-Szymkowiak A., Kulczyk-Skrzeszewska M. et al. Mycorrhizal status of forest trees grown in urban and rural environments in Poland. Ecological Questions. 2013. P. 49–57.
Vasilyev I.V. Family Tiliaceae Juss. trees and shrubs of the USSR. V. 4. Izd-vo AN SSSR, Moscow, Leningrad, 1958 (in Russ.).
Volkova E.A., Isachenko G.A., Khramtsov V.N. Duderhof Heights is a complex natural monument. St. Petersburg, 2006 (in Russ.).
Walker C., Gollotte A., Redecker D. A new genus, Planticonsortium (Mucoromycotina), and new combination (P. tenue), for the fine root endophyte, Glomus tenue (basionym Rhizophagus tenuis). Mycorrhiza. 2018a. https://doi.org/10.1007/s00572-017-0815-7
Walker C., Harper C.J., Brundrett M.C. et al. Looking for arbuscular mycorrhizal fungi in the fossil record: An Illustrated Guide. Michael Krings et al. (eds.). Transformative paleobotany. Academic Press, 2018b. P. 481–517.
Wang B., Qiu Y.L. Phylogenetic distribution and evolution of mycorrhizas in land plants. Mycorrhiza. 2006. V. 16. P. 299–363. https://doi.org/10.1007/s00572-005-0033-6
Weissenhorn I. Mycorrhiza and salt tolerance of trees. EU project Mycorem QLK3-1999-00097. Scientific Report. 2002. P. 36.
Wickham H. ggplot2: Elegant Graphics for Data Analysis. Springer-Verlag, N.Y., 2009.
White T.J., Bruns T.D., Lee S. et al. Amplification and direct sequencing of fungal ribosomal RNA genes for phylogenetics. In: PCR Protocols. A guide to methods and applications. N.Y., 1990, P. 315–322.
Zhukova E.A., Morozova O.V., Volobuev S.V. et al. Basidiomycetous macromycetes and their influence on the state of green spaces in the gardens of the Russian Museum (St. Petersburg). Mikologiya i fitopatologiya. 2017. V. 51 (6). P. 328–339 (in Russ.).
Бондарцева М.А., Коткова В.М., Змитрович И.В. и др. (Bondartseva et al.). Афиллофороидные и гетеробазидиальные грибы Ботанического сада Петра Великого Ботанического института им. В.Л. Комарова РАН Санкт-Петербург // Ботаника: история, теория, практика (к 300-летию основания Ботанического института им. В.Л. Комарова Российской академии наук): труды международной научной конференции. СПб., 2014. С. 23–30.
Васильев И.В. (Vasiliev) Сем. Липовые – Tiliaceae Juss. // Деревья и кустарники СССР. Т. 4. М., Л.: Изд-во АН СССР, 1958. С. 659–727.
Волкова Е.А., Исаченко Г.А., Храмцов В.Н. (Volkova et al.). Дудергофские Высоты – Комплексный памятник природы. СПб., 2006. 144 с.
Дудка В.А., Малышева Е.Ф., Малышева В.Ф. и др. (Dudka et al.). Микоризный статус липы (Tilia cordata) в летнем саду (Cанкт-Петербург): состав грибных симбионтов и тип микоризной колонизации // Микология и фитопатология. 2018a. Т. 52. № 4. С. 243–251.
Дудка В.А. (Dudka) Микоризный статус липы (Tilia cordata) в Летнем саду и Ботаническом саду Петра Великого (Санкт-Петербург): разнообразие грибных партнеров и тип микоризной колонизации // Материалы IV (XII) Международной ботанической конференции молодых ученых в Санкт-Петербурге 22–28 апреля 2018 г. СПб., 2018b. С. 208–209.
Жукова Е.А., Морозова О.В., Волобуев С.В. и др. (Zhukova et al.) Базидиальные макромицеты и их влияние на состояние зеленых насаждений садов Русского музея (Санкт-Петерубрг) // Микология и фитопатология. 2017. Т. 51. № 6. С. 328–339.
Лапин П.И. (Lapin). Ботанические сады СССР. М.: Колос, 1984. 216 с.
Мельников В.Ю. (Melnikov). Исторический ассортимент растений Летнего сада // Тезисы докладов XV конференции садов Санкт-Петербурга. СПб. 2014. С. 106–109.
Морозова О.В., Коваленко А.Е., Ребриев Ю.А. и др. (Morozova et al.). Агарикоидные и гастероидные грибы парка Ботанического сада Ботанического института им. В.Л. Комарова // Ботаника: история, теория, практика (к 300-летию основания Ботанического института им. В.Л. Комарова Российской академии наук): труды международной научной конференции. СПб. 2014. С. 142–149.
Попов Е.С. (Popov) Дискомицеты Ботанического сада Петра Великого // Ботаника: история, теория, практика (к 300-летию основания Ботанического института им. В.Л. Комарова Российской академии наук): труды международной научной конференции. СПб., 2014. С. 166–169.
Летний сад. Возрождение (Summer garden). СПб.: Северославянское бюро рекламы, 2012. 139 с.
Шубин В.И. (Shubin). Микотрофность древесных пород. Значение при разведении леса в таежной зоне. Л.: Наука, 1973. 264 с.
Дополнительные материалы отсутствуют.
Инструменты
Микология и фитопатология